A
A
l
l
m
m
a
a
M
M
a
a
t
t
e
e
r
r
S
S
t
t
u
u
d
d
i
i
o
o
r
r
u
u
m
m
–
–
U
U
n
n
i
i
v
v
e
e
r
r
s
s
i
i
t
t
à
à
d
d
i
i
B
B
o
o
l
l
o
o
g
g
n
n
a
a
1 2 3DOTTORATO DI RICERCA IN
4 5Ingegneria Civile, Chimica, Ambientale e dei Materiali 6 7 Ciclo XXX 8 9 Settore Concorsuale: 03/D1 10 11
Settore Scientifico Disciplinare: CHIM/11 12
13 14
PRODUZIONE DI BIOIDROGENO DA REFLUI DI CASEIFICIO
15 16 17 18
Presentata da: Ciro Vasmara
19 20 21 22
Coordinatore Dottorato Supervisore 23
24 25
Prof. Luca VITTUARI Prof. Lorenzo BERTIN 26 27 Co-supervisore 28 29 Dr. Rosa MARCHETTI 30 31 32 33 34 35 36 37 38 39 40 41 42 43
Esame finale anno 2018
44 45
INDICE
46
47
1.INTRODUZIONE 48
1.1. IDROGENO: CARATTERISTICHE CHIMICO – FISICHE
49
1.2. CAMPI D’APPLICAZIONE
50
1.3. PRODUZIONE D’IDROGENO
51
1.3.1. FONTI NON RINNOVABILI
52
IDROGENO DA GAS NATURALE
53 IDROGENO DA CARBONE 54 1.3.2. FONTI RINNOVABILI 55 IDROGENO DA ACQUA 56 IDROGENO DA BIOMASSE 57
1.4. PRODUZIONE BIOLOGICA D’IDROGENO
58
1.4.1. PROCESSI “LIGHT-DEPENDING”
59
1.4.2. PROCESSI “NON-LIGHT-DEPENDING”
60
1.5. PRINCIPI DELLA DARK FERMENTATION
61
1.5.1. BIOCHIMICA DELLA DARK FERMENTATION
62
1.6. PARAMETRI CHE INFLUENZANO LA DARK FERMENTATION
63 INOCULO 64 SUBSTRATI 65 pH 66 TEMPERATURA 67
PRESSIONE PARZIALE D’IDROGENO
68
AZOTO E FOSFORO
69
IONI METALLICI
70
CONFIGUARAZIONE DEL REATTORE
71
1.7. REFLUI DI CASEIFICIO
72
1.7.1. DISPONIBILITA’ DEI REFLUI DI CASEIFICIO
73
1.7.2. ALTERNATIVE ALLO SMALTIMENTO
74
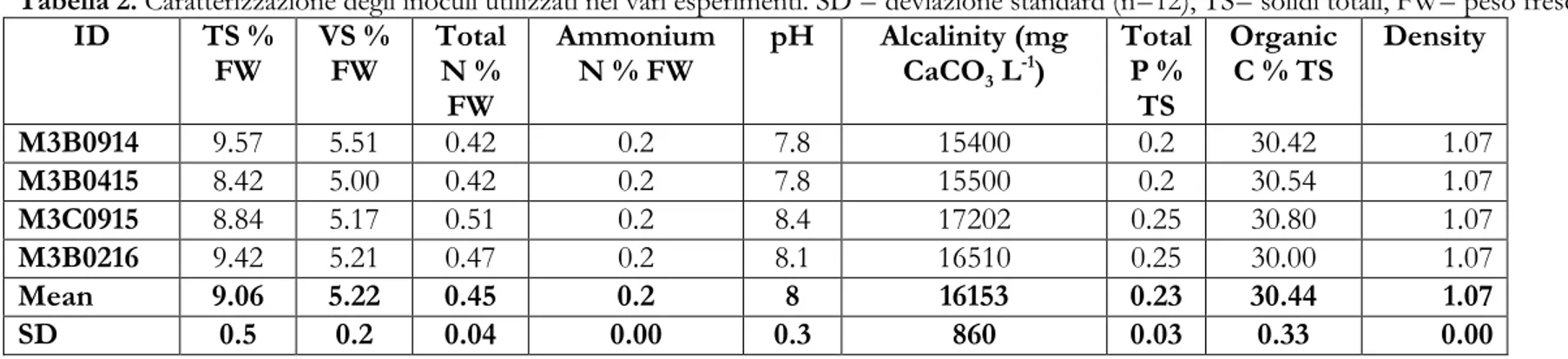
2. OBIETTIVO DEL PROGETTO 75 3. MATERIALI E METODI 76 3.1. SUBSTRATI 77 3.2. PREPARAZIONE DELL’INOCULO 78
3.3. COMPOSIZIONE DEL BIOGAS
79
3.4. METODI D’ANALISI
80
3.5. ADATTAMENTO DEL MODELLO E ANALISI STATISTICHE
81
3.6. ESTRAZIONE DEL DNA GENOMICO
82
3.7. PREPARAZIONE DELLA LIBRERIA E SEQUENZIAMENTO
83
3.8. ANALISI DEI DATI METATASSONOMICI
84
3.9. SUPPORTI PER L’ IMMOBILIZZAZIONE DELLA BIOMASSA
85 4. DISEGNI SPERIMENTALI 86 4.1. ESPERIMENTO “A” 87 4.2. ESPERIMENTO “B” 88 4.3. ESPERIMENTO “C” 89
4.4. ESPERIMENTO “D” 90 4.5. ESPERIMENTO “E” 91 4.6. ESPERIMENTO “F” 92 5. RISULTATI 93
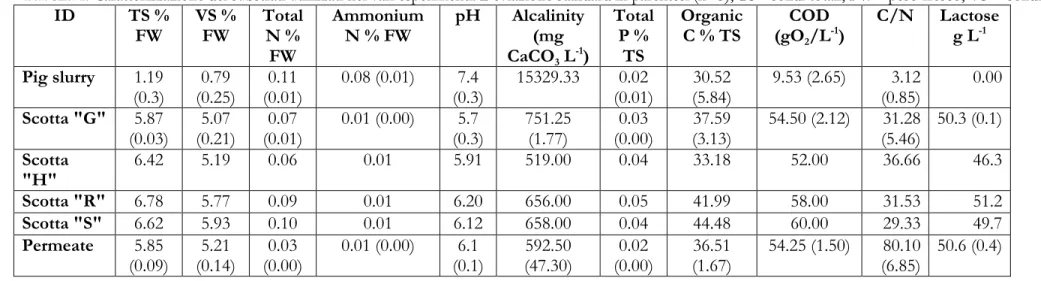
5.1. ESPERIMENTO “A” – PRODUZIONE DI H2 DA SCOTTA E PERMEATO
94
5.2. ESPERIMENTO “B” – CO-DIGESTIONE CON LIQUAME SUINO
95
5.3. ESPERIMENTO “C” – INFLUENZA DEP pH INIZIALE SULLA
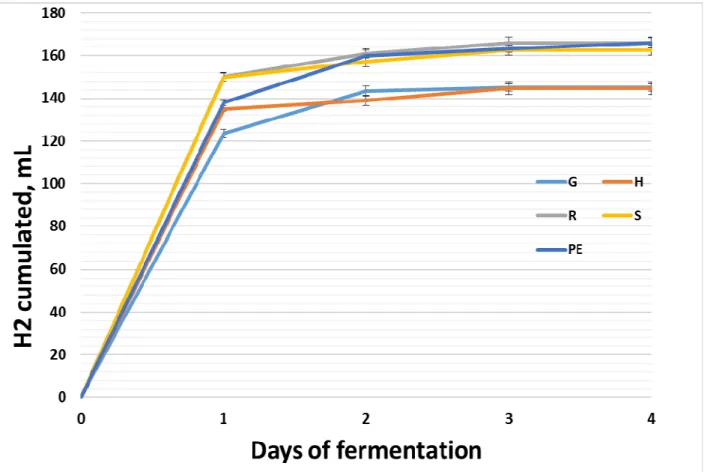
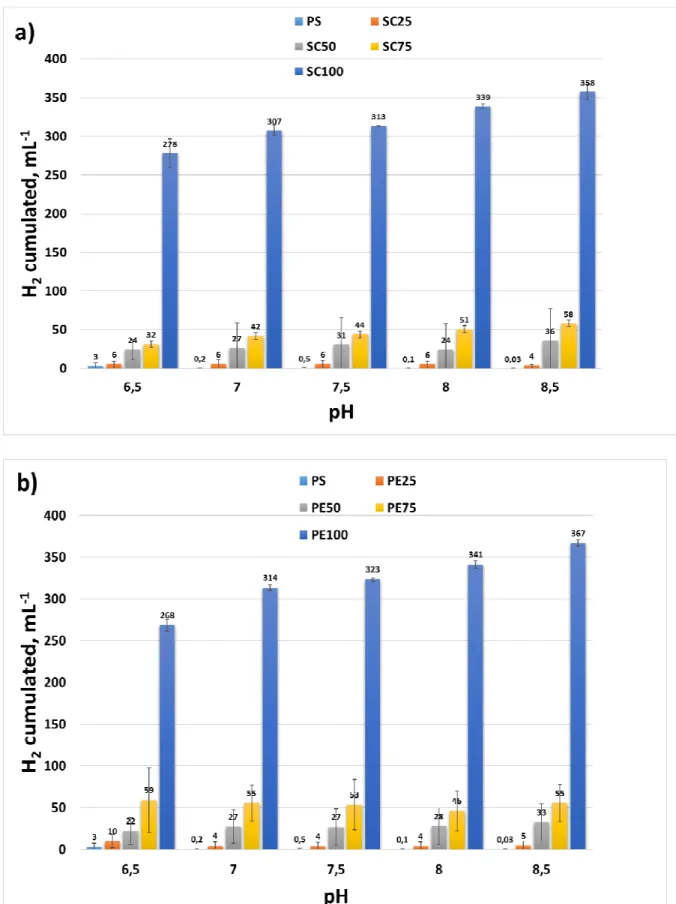
96 PRODUZIONE DI H2 IN DF 97 5.3.1. LATTOSIO RESIDUO 98 5.3.2. METABOLITI FINALI 99 ETANOLO 100
ACIDI GRASSI VOLATILI
101
ACIDO LATTICO
102
5.4. ESPERIMENTO “D” – INFLUENZA DEL pH INIZIALE SULLA
103 COMUNITA’ MICROBICA IN DF 104 5.4.1. ALFA DIVERSITY 105 5.4.2. ABBONDANZA RELATIVA 106
FASE 1, FASE “LAG”
107
FASE 2, PRODUZIONE ESPONENZIALE DI H2
108
FASE 3, FASE STAZIONARIA
109
5.4.3. . RELAZIONE TRA LA COMPOSIZIONE DELLA COMUNITA’
110
MICROBICA E LA PRODUZIONE DI METABOLITI
111
5.5. ESPERIMENTO “E” – VALUTAZIONE DEI SUPPORTI PER
112
L’IMMOBILIZZAZIONE DI BIOMASSA MICROBICA
113
5.6. ESPERIMENTO “F” – CONFRONTO DI PRODUZIONE DI H2 DA
114
BIOMASSA ADESA E SOSPESA
115
5.6.1. PRODUZIONE DI H2
116
5.6.2. pH
117
5.6.3. CONSUMO DI LATTOSIO E PRODUZIONE DI METABOLITI
118
6. DISCUSSIONE 119
6.1. EFFETTO DEL pH SULLA PRODUZIONE DI H2
120
6.2. EFFETTO DEL pH SULLA COMUNITA’ MICROBICA IN DF
121
6.3. CONSUMO DI LATTOSIO
122
6.4. RELAZIONE TRA COMPOSIZIONE DELLA COMUNITÀ MICROBICA E
123
PRODUZIONE DEI METABOLITI
124 6.5. INOCULO 125 6.6. IMMOBILIZZAZIONE 126 6.7. CO-DIGESTIONE 127 7. CONCLUSIONI 128 RICONOSCIMENTI 129 BIBLIOGRAFIA 130 131 132
ABSTRACT 133
In questo studio è stata valutata la possibilità di produrre H2 da reflui di caseificio. In
134
particolare, è stato utilizzato il permeato di scotta che è il residuo del recupero delle
135
sieroproteine, mediante ultrafiltrazione, della scotta che, a sua volta, e il residuo della
136
produzione della ricotta da siero di latte. Questo liquido è ancora ricco di lattosio (51 g
137
L-1) da cui si può ricavare H
2 mediante la fermentazione al buio (dark fermentation, DF).
138
La DF è regolata da molti parametri e presenta ancora dei punti oscuri. L’attenzione è
139
stata rivolta, in particolare, all’effetto che il pH ha sulla produzione di H2, dei metaboliti
140
prodotti (acidi grassi volatili, etanolo e acido lattico) e sulla popolazione microbica
141
coinvolta nella DF, mediante l’utilizzo della tecnica dell’high-throughput sequencing
142
(HTS), in un sistema non tamponato. La produzione di H2 è stata nettamente influenzata
143
dal pH iniziale tanto che essa è stata molto più alta (+31%) nei reattori a pH alcalino (8 -
144
10) che nei reattori a pH < 6. Lo studio della comunità microbica ha indicato che la
145
manipolazione del pH iniziale ha influenzato i rapporti interspecifici delle popolazioni
146
presenti all’interno dei reattori. Il pH alcalino ha favorito la proliferazione di un genere
147
in particolare, il Trichococcus. Sebbene questo genere non produca direttamente H2, la sua
148
proliferazione e, dunque, la sua attività metabolica nella fase immediatamente precedente
149
alla DF propriamente detta, ha creato le condizioni ideali per l’attività dei clostridi
150
(produttori di H2) che hanno iniziato a produrre H2 quando il pH era sceso a 5.4. I
151
clostridi sono stati più attivi nei reattori con pH iniziale alcalino, ovvero, dove Trichococcus
152
aveva maggiormente proliferato.
153 154
In this study, the H2 production from dairy waste was evaluated. Scotta permeate was
155
used as substrate. Scotta permeate is the residue of the recovery of the whey proteins, by
156
means of ultrafiltration, from scotta which is the residue of the production of ricotta
157
from cheese whey. This liquid is still rich in lactose (51 g L-1) and suitable for H2
158
production in dark fermentation (DF). DF is regulated by many parameters and it has
159
still dark sides. The attention was focused, in particular, on the effect of pH on H2
160
production, on metabolites production (volatile fatty acids, ethanol and lactic acid) and
161
on the microbial community involved in the DF, by means of high-throughput
162
sequencing (HTS), in an unbuffered system. The production of H2 was strongly
163
influenced by the initial pH: it was much higher (+ 31%) in the reactors at alkaline pH (8
164
- 10) in comparison with the reactors at pH <6. The study of the microbial community
165
indicated that the manipulation of the initial pH influenced the interspecific relationships
166
of the populations resident in the reactors. The alkaline pH favored the proliferation of
167
one genus in particular, Trichococcus. Although this genus is not an hydrogen-producer, its
168
proliferation and, therefore, its metabolic activity in the phase immediately preceding the
169
DF, has created the optimal conditions for the activity of the clostridia (H2 producers)
170
who have started to produce H2 when the pH had dropped to 5.4. The clostridia were
171
more active in reactors with initial alkaline pH, that is, where Trichococcus were most
172
abundant.
173 174
1.
INTRODUZIONE
175 176
1.1. IDROGENO: CARATTERISTICHE CHIMICO – FISICHE
177 178 179
L’ idrogeno è l’elemento più abbondante nell’universo. Esso, infatti, costituisce il
180
70-80% di tutta la materia: costituisce le stelle ma anche l’acqua, molti composti
181
inorganici nonché tutti i composti organici.
182
In condizioni standard l’idrogeno si presenta sottoforma di gas biatomico (H2)
183
inodore, incolore, insapore non velenoso e atossico, altamente infiammabile a
184
concentrazioni in aria che vanno dal 4 al 75% in volume. Il suo valore calorifico inferiore
185
(LHV) è di 120 MJ kg-1 K-1. Il suo basso peso specifico (0.0899 kg m3) permette ad esso
186
di sfuggire al campo gravitazionale della Terra, disperdendosi nello spazio. Ecco perché
187
l’H2 rappresenta solo l’1% dei gas atmosferici terrestri. Parte dell’idrogeno, comunque,
188
rimane occluso nelle rocce, soprattutto di origine vulcanica, come il granito.
189
Nonostante l’alta volatilità, l’H2 può ritrovarsi in diversi composti come l’acqua
190
(H2O), i combustibili fossili, il gas naturale e in tutti i composti organici.
191
192
1.2. CAMPI D’APPLICAZIONE
193
194
L’idrogeno, attualmente, è ampiamente usato nell’industria petrolchimica. Esso,
195
infatti, è adoperato per la raffinazione dei combustibili fossili: nei processi di
196
idrodealchilazione e di desolforazione del petrolio e del gas naturale [1], nel processo di
197
hydrocracking per la produzione di carburanti per aeromobili [2] è, inoltre, usato per la
198
produzione di ammoniaca nel processo Haber-Bosch [3], di acido cloridrico e
nell’industria alimentare come agente idrogenante per aumentare il grado di saturazione
200
dei grassi e degli oli insaturi [4].
201
Recentemente si sta diffondendo l’idea di utilizzare, in un futuro molto prossimo,
202
l’H2 come carrier energetico da utilizzare per la produzione di energia elettrica mediante
203
le fuel cell che permettono di ossidare l’H2 direttamente con l’ossigeno atmosferico
204
producendo elettricità [5] oppure da usare per l’autotrazione come combustibile
205
utilizzabile direttamente nei motori a combustione interna. L’H2, infatti, ha un LHV di
206
2.4 volte superiore al metano e la sua combustione produce solamente acqua e,
207
inevitabilmente, NOx. Infine, un utilizzo futuro dell’idrogeno è nella fusione nucleare in
208
cui due nuclei di idrogeno (deuterio e trizio) vengono fusi per formare He con
209
conseguente rilascio di energia e un neutrone.
210
211
1.3. PRODUZIONE D’IDROGENO
212
213
Come detto in precedenza l’H2 è in grado di sfuggire al campo gravitazionale della
214
Terra e, pertanto, è molto raro. Ciononostante esso si trova in molte sostanze molto
215
abbondanti sul nostro pianeta. L’H2, quindi, può essere estratto dalle sostanze che lo
216
contengono (Fig. 1).
218
Figura 1. Fonti da cui è possibile estrarre l’idrogeno [6].
219 220
In base alla Fig. 1, le fonti da cui estrarre H2 si possono dividere in non rinnovabili
221
(gas naturale e carbone), e rinnovabili (biomasse ed acqua).
222
Una panoramica delle tecniche attualmente utilizzate per la produzione di H2 è
223
descritta nella Fig. 2.
224
226
Figura 2. Tecnologie attualmente disponibili per la produzione di idrogeno [7].
227 228
1.3.1. FONTI NON RINNOVABILI
229
230
L’idrogeno è un costituente di diverse materie di origine organica ma non
231
rinnovabili e cioè il gas naturale e il carbone. Esistono diversi processi che permettono di
232
estrarre l’H2 da queste fonti. Processi diversi a seconda del materiale di partenza.
233
234
IDROGENO DA GAS NATURALE
235
236
Attualmente l’H2 può essere prodotto dal gas naturale attraverso tre processi
237
chimici ben consolidati: steam reforming (steam methane reforming –SMR), partial
238
oxidation (POX) Autothermal reforming (ATR) [6]. L’SMR consiste in una conversione
di CH4 e vapore acqueo in H2 e CO (1.1). Questa reazione avviene a temperature di
700-240
850 °C e tra i 3 e i 25 bar di pressione.
241 2 2 4 H O heat CO 3H CH + + → + (1.1) 242
Il monossido di carbonio può essere convertito a CO2 e H2 attraverso la scissione del
243 vapore acqueo (1.2): 244 heat H CO O H CO+ 2 → 2 + 2 + (1.2) 245
Il POX prevede la produzione di H2 attraverso la parziale combustione del CH4 con
246
l’ossigeno. In questo modo si forma CO e H2 (1.3):
247 heat H CO O CH4 + 2 → +2 2 + 2 1 (1.3) 248
Successivamente, la CO può essere convertita ad H2 secondo la reazione (1.2).
249
L’ATR è la combinazione tra l’SMR e il POX. La reazione è esotermica e la
250
produzione di H2 avviene secondo la reazione (1.2).
251
252
IDROGENO DA CARBONE
253
254
L’H2 può essere prodotto dal carbone attraverso vari sistemi di gassificazione
255
(e.g. letto fisso, fluido o trascinato). Onde evitare la formazione di prodotti sgraditi (e.g.
256
materiale carbonizzato, catrami e fenoli) sono richieste alte temperature d’esercizio. La
257
reazione tipica di gassificazione del carbone (1.4) rilascia CO + H2. Ancora una volta,
258
poi, la CO può essere utilizzata, insieme al vapore acqueo, per formare H2 tramite la
259 reazione (1.2). 260 2 2 ) (s H O heat CO H C + + → + (1.4) 261
Come descritto in precedenza, CO2 è il principale gas esausto di tutti i sistemi che
262
permettono di produrre H2 da fonti non rinnovabili. Al fine di evitare di emettere CO2
263
inquinante nell’ambiente è necessario attuare dei sistemi di sequestro di tale gas. Essi
264
sono: post-combustione, pre-combustione e ossi-combustione [6].
265
266
1.3.2. FONTI RINNOVABILI
267
268
L’H2 può essere ricavato anche da fonti rinnovabili (e.g. acqua e biomasse),
269
mediante diversi processi.
270
271
IDROGENO DA ACQUA
272
273
È possibile ricavare H2 da acqua attraverso l’idrolisi. Esistono diversi processi di
274 idrolisi dell’acqua: 275 Elettrolisi diretta 276 Elettrolisi alcalina 277
Elettrolisi su membrana polimerica elettrolitica (PEM)
278
Elettrolisi ad alta temperatura
279
Foto elettrolisi
280
Scissione termochimica dell’acqua
281
L’elettrolisi diretta dell’acqua permette la scissione dell’H2O in H2 e O mediante
282
applicazione di energia elettrica (1.5):
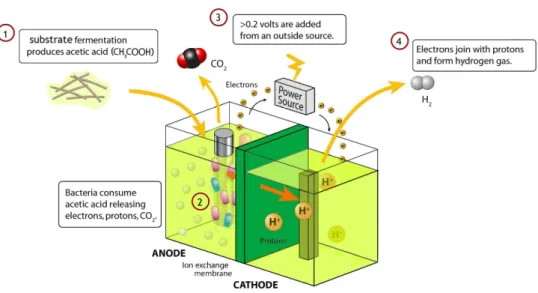
2 2
2O electricity H 1 O2
H + → + (1.5)
284
L’ elettrolisi alcalina permette l’idrolisi dell’acqua per mezzo di una soluzione
285
acquosa di KOH che circola attraverso le celle elettrolitiche. La reazione è descritta di
286
seguito ed avviene con applicazione di energia elettrica:
287 Elettrolita: 4H2O→4H+ +4OH− (1.6) 288 Catodo: 4H +4e →2H2 − + (1.7) 289 Anodo: 4OH− →O2 +2H2O+4e− (1.8) 290 Somma: 2H2O→O2 +2H2 (1.9) 291
La PEM permette l’elettrolisi dell’acqua per mezzo di una membrana polimerica
292
acida che funge da elettrolita evitando l’uso di KOH e ciò rende il sistema più sicuro.
293
L’assenza di KOH, poi, permette di avere un design più compatto dovuto all’alta densità
294
dell’elettrolita. La reazione avviene come descritto sotto [6]:
295 Anodo: H O→ O +2H+ +2e− 2 1 2 2 (1.10) 296 Catodo: 2H +2e →H2 − + (1.11) 297
L’elettrolisi ad alta temperatura è basata sulla tecnologia delle “high-temperature
298
fuel cells”. Attualmente si utilizzano celle elettrolitiche a ossidi solidi (“solid oxide
299
electrolyser cells; SOEC) che operano tra 700 e 1000 °C. A queste temperature l’energia
300
elettrica necessaria per l’elettrolisi dell’acqua è inferiore rispetto a quella necessaria per
301
l’elettrolisi a 100 °C. Il grosso nodo è rappresentato dal grande quantitativo di calore
302
necessario al processo. Attualmente si sta investigando sulla possibilità di utilizzare
303
calore generato da fonte geotermica, solare o gas naturale.
La foto elettrolisi è un processo in cui una cella fotovoltaica è accoppiata ad una
305
cella elettrolitica, ovvero, la cella fotovoltaica è avvolta dall’elettrolita e, utilizzando
306
direttamente la radiazione solare, fornisce l’energia elettrica necessaria alla reazione di
307
elettrolisi dell’acqua.
308
La scissione termo chimica dell’acqua permette di convertire l’acqua in H2 e O per
309
mezzo di reazioni termo chimiche. Un esempio di tale processo è descritto dalla reazione
310 seguente [6]: 311 2 2 2 4 2 12 : ) 850 ( °C H SO →SO +H O+ O (1.12) 312 HI SO H O H SO I C): 2 2 120 ( ° 2 + 2 + 2 → 2 4 + (1.13) 313 2 2 2 : ) 450 ( °C HI →I +H (1.14) 314 2 2 2 12 :H O H O SOMMA → + (1.15) 315 316 IDROGENO DA BIOMASSE 317 318
Le biomasse sono quei materiali di origine organica costituiti da coltivazioni
319
dedicate, residui di coltivazioni e/o di animali, provenienti dall'agricoltura, dalla
320
silvicoltura e dalle industrie connesse. Esse, pertanto, sono materie prime rinnovabili. Il
321
processo mediante il quale si estrae H2 da tali biomasse è sostanzialmente simile a quello
322
descritto precedentemente per la gassificazione del carbone (1.4). Le maggiori
323
problematiche di tale processo sono l’estrema variabilità nella composizione delle
324
biomasse e dall’umidità delle stesse che può rendere necessario uno step di essiccamento
325
prima della gassificazione.
Tutti i sistemi descritti finora hanno bisogno di una fonte primaria di energia. È
327
chiaro che tali processi potrebbero avere un minore impatto ambientale utilizzando fonti
328
energetiche rinnovabili come l’elettricità fotovoltaica, che viene prodotta per mezzo
329
dell’energia solare, oppure l’energia geotermica, l’energia idroelettrica e l’elettricità
330
prodotta dall’eolico, oppure l’energia elettrica prodotta sfruttando le onde del mare o le
331
maree.
332
Indipendentemente dalla fonte da cui viene estratto l’H2, dal processo utilizzato e
333
dalla fonte d’energia primaria utilizzata, l’efficienza di produzione di H2 viene calcolata
334 secondo l’equazione 1.17: 335 PS H H2 = LHV 2 /E η (1.17) 336
Dove ηH2è l’efficienza termica finale dell’idrogeno, LHV è il potere calorifico inferiore 337
mentre EPS è l’energia consumata per produrre 1 kg di H2. È chiaro che minore è
338
l’energia consumata per produrre 1kg di H2 maggiore sarà l’efficienza del processo.
339
340
1.4. PRODUZIONE BIOLOGICA D’IDROGENO
341
342
L’H2 può essere prodotto anche tramite processi biologici oltre che termo chimici. I
343
processi biologici sfruttano le reazioni biochimiche che regolano il metabolismo di alcuni
344
microorganismi (alghe, batteri ed archea) che sono in grado di generare H2 da materie
345
prime rinnovabili come l’acqua e i composti organici [8]. La produzione biologica di H2
346
può essere divisa in due gruppi: “light-depending” e “light-independent” (Fig. 3).
348
Figura 3. Processi attualmente disponibili per la produzione biologica di idrogeno [7].
349 350
1.4.1. PROCESSI “LIGHT-DEPENDING”
351
352
I processi “light-depending” permettono di generare H2 attraverso microorganismi
353
in grado di utilizzare la radiazione solare come fonte d’energia per le loro attività
354
metaboliche. I processi “light-depending” sono:
355 Biofotolisi diretta 356 Biofotolisi indiretta 357 Fotofermentazione 358
La biofotolisi diretta è condotta dalle alghe verdi. Il processo è stato descritto, per la
359
prima volta, da Gaffron e Rubin [9]: le alghe verdi sfruttano l’energia solare per estrarre
360
gli elettroni direttamente dall’acqua, generando O2 che si accumula sul lato ossidante del
“fotosistema II” (PSII) (Fig. 4) e l’H2 che, invece, si accumula sul lato riducente del
362
“fotosistema I” (PSI) (Fig. 4). Il processo avviene a carico dell’enzima idrogenasi alla
363
luce e in condizioni anaerobiche. Poiché l’idrogenasi è sensibile all’O2, la presenza di
364
questo gas inibisce la produzione di H2 e la biofotolisi diretta può essere mantenuta per
365
lunghi periodi solo se si rimuove costantemente l’O2 dal sistema [8]. Wykoff et al. [10]
366
hanno dimostrato che una carenza di zolfo può drasticamente limitare l’accumulo di O2
367
su PSII.
368
369
Figura 4. Meccanismo di generazione di idrogeno nelle alghe [7].
370 371
I microorganismi maggiormente coinvolti nel processo di biofotolisi diretta sono:
372
Scenedesmus obliquus [11], Chlamydomonas reinhardii e C. moewusii [12]. Il fattore limitante di
373
tale sistema è l’efficienza: in condizioni di bassa luminosità, infatti, l’efficienza
374
dell’energia solare è quasi del 10%, mentre in condizioni di luminosità elevata, essa crolla
sotto l’1%. In queste condizioni, infatti, i pigmenti fotosintetici catturano il 90% dei
376
fotoni, me essi vengono rilasciati come calore o fluorescenza poiché viene superato il
377
limite di trasferimento di elettroni tra PSII e PSI [13].
378
La biofotolisi indiretta, è condotta dai Cianobatteri. Essi posseggono 3 vie
379
metaboliche per generare H2. La prima via è specifica dei cianobatteri azoto fissatori (A.
380
variabilis, N. spongiaeforme e Westiellopsis prolifica) [14], questa via metabolica è catalizzata
381
dall’enzima nitrogenasi [MoFe] ed è energeticamente inefficiente dal momento che
382
vengono richieste 2 molecole di ATP per ogni elettrone trasferito. Inoltre, parte dell’H2
383
generato è consumato dall’enzima idrogenasi [NiFe] che partecipa al processo. La
384
seconda via metabolica è condotta utilizzando l’acqua come donatore di elettroni come
385
nelle alghe. Poiché i cianobatteri, però, non dipendono dalla ferredoxina come unico
386
donatore di elettroni, questo modo di generare H2, risulta più efficace che nelle alghe. La
387
terza via metabolica richiede una fonte esterna di carbonio (e.g. carboidrati) che vengono
388
metabolizzati in presenza di luce, cosicché l’H2 vene generato sia per mezzo
389
dell’idrogenasi che della nitrogenasi [7].
390
La biofotolisi può essere limitata solo dalla massima efficienza raggiungibile dalla
391
fotosintesi che, teoricamente, può convertire fino al 33% della luce assorbita in energia
392
chimica. Ma, poiché meno della metà dell'energia del sole si trova nella regione visibile,
393
che è foto sinteticamente attiva, e poiché ci sono perdite inevitabili, la massima efficienza
394
raggiunta dalla fotosintesi è generalmente attorno al 6%.
395
La fotofermentazione è stata descritta per la prima volta da Benemmann et al.
396
[15]. Essa è la fermentazione di composti organici in presenza di luce con conseguente
397
produzione di H2. Due gruppi di batteri sono capaci di effettuare la fotofermentazione: i
purpurei e i verdi. I batteri purpurei possono essere suddivisi in:solfobatteri purpurei
399
(Chromatium) e batteri purpurei non solfurei (Rhodobacter). I batteri Verdi possono essere
400
suddivisi in solfobatteri verdi (Chlorobium) e “gliding bacteria” (Chloroflexus). Questi
401
batteri sono in grado di convertire l’energia luminosa in energia chimica via
402
fotofosforilazione. Un esempio del meccanismo di fotofermentazione è mostrato in Fig.
403
5.
404
405
Figura 5. Meccanismo di generazione di idrogeno in fotofermentazione [7].
406 407
Il substrato organico è utilizzato come donatore di elettroni, dunque, la
408
produzione di H2 è determinata dal substrato che costituisce la riserva del un flusso di
409
elettroni. Il substrato organico può essere sostituito con del solfuro inorganico che funge
410
da donatore di elettroni, mentre i composti contenti zolfo costituiscono la riserva per il
411
flusso di elettroni, dopodiché l’NAD+ viene ridotto a NADH attraverso il flusso inverso
412
di elettroni. Gli elettroni, a questo punto, vengono trasferiti alla nitrogenasi via
413
ferredoxina con consumo di ATP e produzione di H2. Questa via, dunque, è
energeticamente sfavorevole per i microbi poiché ogni mole di H2 prodotta attraverso la
415
nitrogenasi richiede il consumo di 4 ATP [7].
416
I batteri purpurei non solfurei, invece, producono H2 per fornire gli elettroni alla
417
fotosintesi. In questa via metabolica, la CO2 viene fissata attraverso il ciclo di Calvin e
418
l’O2 si forma come accettore finale di elettroni. La nitrogenasi, però, è inibita dall’O2 e
419
quindi la formazione di H2 è soppressa in presenza di O2. In questo caso l’energia
420
luminosa è utilizzata per produrre solo ATP e gli elettroni sono ottenuti dall’ossidazione
421
del substrato organico. Tuttavia, in condizioni di carenza di azoto, la nitrogenasi catalizza
422
la formazione di idrogeno molecolare dai protoni anziché formare NH3. La reazione è
423 riassunta sotto: 424 2 2 2 3COOH 2H O 4H 2CO CH + → + (1.18) 425
I solfobatteri verdi possono fissare l’N attraverso l’enzima nitrogenasi e l’H2 è
426
generato, in condizioni limitate di N2, attraverso una via metabolica simile a quella dei
427
batteri purpurei non solfurei.
428
I “gliding bacteria” verdi possono generare H2 ma il loro metabolismo non è ancora
429
ben conosciuto [7].
430
La produzione di H2 per via fotofermentativa sembra promettente in quanto
431
permette di produrre H2 utilizzando la luce solare e i rifiuti organici. Questo processo,
432
infatti, può portare a un considerevole abbattimento della sostanza organica nelle acque
433
reflue. Il fattore limitante, però, è la bassa efficienza del processo così come il basso
434 tasso di produzione di H2 [16]. 435 436 1.4.2. PROCESSI “NON-LIGHT-DEPENDING” 437
438
L’idrogeno può essere prodotto anche per vie biologiche “non-light dependent”:
439
Elettrolisi microbica
440
Fermentazione al buio (dark fermentation)
441
L’elettrolisi microbica permette di produrre H2 da matrici organiche utilizzando
442
microorganismi “elettrogenici” per produrre corrente elettrica in abbinamento con
443
l’ossidazione dei composti ridotti. I microorganismi “elettrogenici” producono un basso
444
potenziale redox all’anodo che può essere sfruttato per ottenere la riduzione dei protoni
445
al catodo utilizzando un piccolo generatore. Questo sistema viene chiamato cella
446
elettrolitica microbica (MEC). Essa richiede un anodo, un catodo, una membrana,
447
microorganismi elettrochimicamente attivi e un generatore: la materia organica viene
448
degradata dai microorganismi “elettrogenici” che si trovano sull’anodo, rilasciando
449
elettroni e protoni, il generatore guida gli elettroni verso il catodo attraverso un cavo
450
elettrico, mentre i protoni migrano verso il catodo per mezzo di una membrana a
451
scambio protonico (PEM). A questo punto gli elettroni e i protoni si combinano sul
452
catodo formando H2 (Fig. 6) [7].
454
Figura 6. Funzionamento di una cella elettrolitica microbica.
455 456
Esistono diverse specie microbiche elettrochimicamente attive. Esse appartengono
457
a diversi generi quali: b-Protobacteria sp. (Rhodoferax), g-Protobacteria sp. (Shewanella and
458
Pseudomonas), d-Protobacteria sp. (Aeromonas, Geobacter, Geopsychrobacter, Desulfuromonas,
459
Desulfobulbus), Firmicutes sp. (Clostridium), Acidobacteria sp. (Geothrix) etc. [17]. L’efficienza
460
della produzione di H2 nelle MEC è influenzata principalmente dall’efficienza della PEM
461
(che è il fattore limitante) dalla conducibilità elettrica e dalla stabilità chimica dell’anodo e
462
del catodo.
463
La dark fermentation (DF) è la conversione dei carboidrati in H2, CO2 ed acidi
464
organici operata da alcuni batteri in anaerobiosi. Le vie metaboliche seguite durante la
465
DF sono riassunte in Fig. 7.
467
Figura 7. Vie metaboliche che permettono di generare H2 in dark fermentation [7].
468 469
La DF, attualmente, costituisce il processo produttivo più consolidato per la
470
produzione di bioidrogeno. Essa, infatti, permette di fermentare un’ampia gamma di
471
substrati da cui, teoricamente, si può generare H2 in reattori dal disegno semplice e facili
472
da controllare che permettono di avere rese di H2 più elevate se confrontate con quelle
473
ottenute nei sistemi fotosintetici [18]. Molti generi di batteri sono in grado di generare H2
474
in DF: Bacillus, Escherichia, Enterobacter, Ruminococcoi and Clostridium [19-22]. Alcuni di
475
questi microorganismi possono lavorare in condizioni di termofilia (40-60 °C) dove la
476
solubilità dell’H2 è minore così da evitare un’inibizione nella produzione. In base al
477
calcolo stechiometrico, la conversione del glucosio a H2 dovrebbe essere di 12 mol H2
478
mol-1 di esoso [16]. La resa in H2 ottenuta in DF, però, si aggira attorno a 4 mol H2 mol -1
esoso, ovvero il 33% di quella teorica. Questo è dovuto alla formazione di co-prodotti
480
(acido acetico e butirrico, etanolo, etc.) che accompagnano la produzione di H2 durante
481
la DF.
482
483
1.5. PRINCIPI DELLA DARK FERMENTATION
484
485
Come detto in precedenza la DF suscita interesse perché permette di produrre H2
486
da un’ampia gamma di substrati. In realtà, tra i vari substrati utilizzabili, la DF è stata
487
condotta con successo solo su materiali ricchi di carboidrati. Le proteine, infatti,
488
vengono idrolizzate ad aminoacidi e poi fermentati accoppiati secondo la reazione di
489
Stickland: un aminoacido funge da accettore di elettrone per l’ossidazione dell’altro
490
aminoacido [23]. Questa reazione, però, non genera H2 (Fig. 8).
491
492
493
Figura 8. Schema della reazione di Stickland.
495 496
I grassi vengono scissi in glicerolo e acidi grassi a lunga catena (LCFA). Il glicerolo
497
può essere fermentato direttamente a H2 [24, 25] gli LCFA, invece, vengono degradati ad
498
acetato e H2 da batteri sintrofici [26]. Questa reazione richiede una pressione parziale di
499
H2 molto bassa che può essere mantenuta utilizzando microorganismi metanogeni
500
oppure batteri solfo riduttori.
501
La dinamica della produzione di H2 durante la DF può essere descritta utilizzando
502
l’equazione di Gompertz modificata (1.19) [27].
503
(
)
+ − − = exp exp 1 ) ( max max max t H e R H t H λ 1.19 504Dove: H (t) è l’ammontare totale di H2 prodotto al tempo d’incubazione t, in
505
condizioni standard (STP) di temperatura (273 °K) e pressione (101.3 kPa). e è la
506
funzione esponenziale di 1. Hmax è la produzione massima di H2 cumulata (resa in H2).
507
Rmax (H2 mol -1
h-1) è il tasso orario di accumulo di H2 (produttività di H2) e λ è la durata
508
della fase lag, cioè il tempo necessario all’ adattamento della flora microbica prima della
509
fase di produzione esponenziale di H2.
510
511
1.5.1. BIOCHIMICA DELLA DARK FERMENTATION
512
513
Come mostrato in Fig. 7, la DF segue la via glicolitica che porta alla formazione di
514
piruvato. Il piruvato, in effetti, è l’intermedio chiave della DF: può essere scisso in acido
515
formico o Acetil-CoA da due differenti enzimi coinvolti nella produzione di H2. Tra i
batteri capaci di generare H2, quelli che maggiormente si ritrovano nella DF sono
517
appartenenti ai generi Enterobacter e Clostridium [7, 28-30].
518
Le specie appartenenti agli Enterobacter convertono le molecole di piruvato in Acetil
519
Co-A e formiato attraverso l’enzima formato C-acetiltransferasi (Pfl) e poi, attraverso
520
l’idrogenasi Hyd3, convertono il formiato a H2 and CO2 (Fig. 9). L’idrogenasi Hyd3 è
521
peculiare delle specie di Enterobacter.
522
Le specie appartenenti al genere Clostridium trasformano le molecole di piruvato in
523
Acetil Co-A e CO2. La ferredossinaridotta viene prodotta dall’enzima piruvato sintasi
524
(PFOR). La ferredossina ridotta può fornire gli elettroni direttamente alla idrogenasi
525
[FeFe], un enzima tipico dei clostridi, che catalizza la formazione di H2 coniugando gli
526
H+ derivanti dall’ossidazione della feredossina [30].
527
528
529
Figura 9. Vie metaboliche seguite da Enterobacter spp. (a) e Clostridium spp. (b) in DF [30].
530 531 532
Durante la DF, la produzione di H2 è accompagnata dalla produzione di
co-533
prodotti. I co-prodotti più comuni sono acido acetico e butirrico [31]. Le reazioni
534
biochimiche che portano alla produzione di questi acidi sono:
2 2 3 2 6 12 6H O 2H O 2CH COOH 2CO 4H C + → + + 1.20 536 2 2 2 2 3 6 12 6H O CH CH CH COOH 2CO 2H C → + + 1.21 537
Entrambe le vie metaboliche generano H2, però, in alcuni casi può attivarsi una
538
terza via metabolica che porta alla formazione di acetato ed etanolo con conseguente
539
abbassamento della produzione di H2:
540 2 2 3 2 3 2 6 12 6H O 2H O CH CH OH CH COOH 2CO 2H C + → + + + 1.22 541
In DF, inoltre, possono attivarsi altre vie metaboliche che portano alla formazione
542
di acido propionico, etanolo oppure acido lattico. La formazione di propinato consuma
543
H2 (1.23), mentre la produzione di etanolo ed acido lattico (1.24 e 1.25) non generano H2
544 [32]: 545 O H COOH CH CH H O H C6 12 6 +2 2 →2 3 2 +2 2 1.23 546 2 2 3 6 12 6H O 2CH CH OH 2CO C → + 1.24 547 2 3 6 12 6H O CH CHOHCOOH 2CO C → + 1.25 548 549
1.6. PARAMETRI CHE INFLUENZANO LA DARK FERMENTATION
550
551
Come tutti i processi biologici, anche la DF è influenzata da diversi fattori. Il fattore
552
più importante è l’inoculo, poi ci sono diversi fattori ambientali capaci di influenzare la
553
DF sia direttamente che indirettamente.
554
555
INOCULO
556
I batteri capaci di generare H2 sono ampiamente diffusi negli ambienti naturali.
558
Essi, infatti, possono vivere nel suolo, nelle deiezioni animali, nei fanghi dei trattamenti
559
di acque reflue etc. [33-35]. Tutti questi materiali possono essere usati come fonte
560
d’inoculo per la produzione di H2 in DF. Purtroppo, però, in questi stessi materiali oltre
561
ai produttori di H2 si ritrovano anche i consumatori di H2, che possono essere soppressi
562
da alcuni pretrattamenti che, comunque, non intaccano la capacità produttiva dei batteri
563
idrogeno produttori. I pretrattamenti includono: shock termici, trattamenti acidi, basici,
564
aerazione, congelamento e scongelamento, trattamenti chimici; cloroformio, sodio
2-565
bromo etansolfonato o acido 2-bromo etansolfonico o iodopropano [36]. Attraverso i
566
pretrattamenti è dunque possibile ottenere delle colture miste arricchite di idrogeno
567
produttori.
568
Gli idrogeno produttori sono, generalmente, batteri anaerobi stretti anche se alcuni
569
anaerobi facoltativi sono stati identificati come capaci di produrre H2. Gli anaerobi
570
facoltativi producono ATP in presenza di O2 attraverso la respirazione aerobica; in
571
assenza di O2, però, essi dono capaci di passare alla fermentazione anaerobica. Le specie
572
di Enterobacter sono i più comuni batteri anaerobi facoltativi capaci di produrre H2 [25].
573
Escherichia coli, potenzialmente, è in grado di generare H2 da zuccheri semplici anche se
574
sono necessarie modifiche genetiche per incrementarne la produttività [37]. Klebsella
575
oxytoaca si è rivelata in grado di produrre H2 anche in presenza del 10% di O2
576
nell’ambiente [38]. Oh et al. [39] hanno isolato Citrobacter sp. Y19 che può produrre H2
577
sia da CO e H2O che da glucosio.
578
I batteri anaerobi sono capaci di usare un’ampia gamma di carboidrati per produrre
579
H2 con un tasso di produttività alto. I maggiori produttori di H2 sono i clostridi (fam.
Clostridiacae), altre specie minori appartengono alle famiglie Streptococcaceae, Thermotogales e
581
Bacillus [40-42]. All’interno di queste famiglie possono essere presenti ceppi mesofili e
582
termofili. I mesofili crescono in un range di temperature compreso tra 25 e 40 °C, i
583
ceppi termofili possono crescere a temperature più elevate (alcuni ceppi ipertermofili
584
anche fino a 80 °C) [25].
585
Poiché i batteri produttori di idrogeno appartengono a generi ben definiti, si è
586
pensato di utilizzare colture pure come inoculo da utilizzare in DF. Clostridium e
587
Enterobacter sono stati quelli più ampiamente utilizzati e studiati come inoculo per la DF.
588
Molti studi sono stati condotti con culture pure su glucosio come substrato ed in
589
modalità batch [29]. Ma è comunque auspicabile testare la produzione di H2 da colture
590
pure su rifiuti organici che rendono il processo più industrializzabile al fine di ottenere lo
591
smaltimento di rifiuti accoppiato alla produzione di energia.
592
La produzione di H2 da batteri anaerobi stretti (e.g. Clostridium sp.) è più alta rispetto
593
a quella ottenuta da anaerobi facoltativi (e.g. Enterobacter sp.) [43-44]. Tuttavia, una
co-594
cultura può rappresentare un’interessante soluzione [45-46]. Una co-cultura di C.
595
butyricum e E. aerogens può rendere l’ambiente più favorevole alla DF: E. aerogens, infatti
596
può consumare l’ossigeno disciolto nel substrato liquido, garantendo le condizioni
597
anaerobiche ottimali per la crescita di C. butyricum. Questa soluzione, di fatto,
598
permetterebbe di evitare l’utilizzo di agenti riducenti costosi come L-cisteina che
599
permettono di mantenere le condizioni di anaerobiosi necessarie per le colture pure.
600
601
SUBSTRATI
602
Il substrato utilizzato, ovviamente, è fondamentale per la produzione di H2. Tutta la
604
materia organica, teoricamente, può essere utilizzata per generare H2, ma le vie
605
metaboliche che i microorganismi scelgono di seguire in base al substrato dato possono
606
condurre alla produzione più o meno abbondante di H2. I substrati più utilizzati per la
607 produzione di H2 sono: 608 Materiali lignocellulosici 609 Reflui di caseificio 610 Melassi 611 Materiali amidacei 612 Scarti alimentari 613
I materiali lignocellulosici derivano dall’agricoltura e dall’industria del legno. Poiché
614
contengono cellulosa ed emicellulosa, essi costituiscono la maggiore fonte rinnovabile di
615
esosi e pentosi che possono essere utilizzati per la produzione biologica di H2. La
616
cellulosa, però, deve essere degradata in zuccheri semplici prima di poter essere utilizzata
617
[47]. Taguchi et al. [48] hanno ottenuto 4.46 mmol H2 mmol -1
glucosio da idrolizzato di
618
cellulosa. Levin et al. [49] hanno riportato una produttività di 1.6 mol H2 mol -1
glucosio
619
da fibre di legno delignificato. Teoricamente, per ogni g di cellulosa, è possibile ottenere
620
567 mL H2 [50] ma, all’aumentare della concentrazione di cellulosa diminuisce la resa in
621
H2 [51]. La produzione di H2, comunque, viene incrementata attraverso l’acidificazione
622
dei materiali lignocellulosici. La produttività può essere incrementata da 10 a 136 volte
623
rispetto ai materiali non trattati [52-54].
624
I reflui di caseificio sono ricchi in lattosio e, teoricamente, sono adatti per produrre
625
H2. Diversi autori [55-66] hanno condotto esperimenti per verificare la possibilità di
produrre H2 da reflui di caseificio. Questi studi riportano rese in H2 vanno da 1.1 a 3.5 627 mol H2 mol -1 lattosio. 628
Le melasse sono i rifiuti degli zuccherifici. Sono una buona fonte di saccarosio che
629
può essere facilmente degradato anaerobicamente a glucosio che può essere fermentato a
630
H2. Ren et al. [67] riportano una produttività di 26.13 mol H2 kg -1
COD (domanda
631
chimica di ossigeno) rimosso usando un substrato basato su melasso.
632
I materiali amidacei sono i residui di molti processi produttivi dell’industria
633
alimentaria. Siccome l’amido è un polimero di glucosio, è un’ottima fonte da cui
634
produrre H2 in DF. Zhang et al. [68] hanno riportato una resa massima di 92 mL H2 g -1
635
di amido, utilizzando un substrato basato su amido. Van Ginkel et al. [69] hanno
636
ottenuto 2.1 L H2 L-1 di refluo della lavorazione delle patate addizionato di nutrienti. Gli
637
stessi autori, hanno ottenuto 0.9 L H2 L-1 di refluo di lavorazione delle mele addizionato
638
di nutrienti. Anche il riso è un materiale amidaceo e i residui della sua lavorazione
639
possono essere utilizzati per la produzione di H2. Fang et al. [70] hanno testato la
640
produzione di H2 utilizzando un refluo della lavorazione del riso contenente una
641
concentrazione di 5.5 g L-1 di carboidrati, ottenendo una resa di 346 mL H 2 g
-1
642
carboidrato.
643
Gli scarti alimentari domestici ed industriali sono materiali estremamente eterogenei
644
ed ampiamente diffusi che contengono grosse quantità di carboidrati utilizzabili per la
645
produzione di H2 in DF. Kim et al. [71] hanno riportato una produzione massima di
646
122.9 mL H2 g -1
carboidrato-COD da scarti alimentari. Pan et al. [72] hanno riportato
647
una resa di 57 mL H2 g -1
solidi volatili (VS). Kim et al. [73] hanno ottenuto 1.9 molH2
648
mol-1 esoso utilizzando gli scarti alimentari della caffetteria universitaria.
650
pH
651
652
Il pH è considerato come uno dei parametri chiave per la produzione di H2 in DF,
653
poiché esso può influenzare direttamente l’attività dell’idrogenasi [74]. Diversi studi sono
654
stati condotti per trovare il pH ottimale per la produzione di H2 biologico ed essi variano
655
tra 4.5 e 9. Questa disomogeneità nei valori riportati come ottimali può essere spiegata
656
con le differenze di substrato, fonte di inoculo, pretrattamenti applicati all’inoculo e le
657
condizioni operative adottate [25, 75-76]. Inoltre, i vari studi riportano i risultati dove
658
solo il pH iniziale era stato corretto e, durante la DF, non c’era stato nessun controllo
659
del pH [77]. Durante la DF, però, non viene prodotto solo H2, ma anche acetato,
660
butirrato ed etanolo, la presenza dell’acido acetico e butirrico porta ad un calo del pH
661
che influenza le vie metaboliche [78]. A pH compreso tra 4.5-6.0, infatti, la produzione
662
di acetato e butirrato sembra essere favorita, mentre, si ritiene che a pH neutro o alcalino
663
siano promosse la produzione di etanolo ed acido propionico [28, 79-80]. Altri autori
664
suggeriscono che la produzione di etanolo (solventogenesi) rappresenti il segnale che i
665
Clostridia stanno passando dalla fase esponenziale di crescita, quando l’H2 viene prodotto
666
in maniera abbondante insieme all’acido acetico e butirrico (acidogenesi), alla fase
667
stazionaria, cioè, quando l’H2 non viene più prodotto. Tale passaggio è causato
668
dall’accumulo di acidi grassi volatili (VFA) durante la fase di crescita esponenziale [81].
669
La solventogenesi rappresenta un metodo di disintossicamento della biomassa batterica
670
dall’eccesso di VFA associato al basso pH del substrato [82]. Infatti, quando la
671
concentrazione di VFA è elevata, la forza ionica della soluzione aumenta: gli acidi
indissociati non polari penetrano la parete cellulare dei batteri e, a valori bassi di pH del
673
substrato, rilasciano protoni dentro la cellula batterica che ha un pH interno più elevato
674
[83], questo implica un incremento dell’energia richiesta per mantenere il pH
675
intracellulare neutro. Tale surplus di energia grava sul coenzima A e dei gruppi fosfato
676 [25]. 677 678 TEMPERATURA 679 680
La temperatura è uno dei parametri operativi più importanti (insieme al pH) in DF.
681
La temperatura, infatti, influenza il tasso di idrolisi del substrato e quello di produzione
682
di H2. È stato dimostrato che un aumento della temperatura, in uno specifico range, può
683
accelerare la produzione di H2 che però crolla bruscamente appena fuori dal range di
684
temperatura ottimale [84]. I range di temperatura in cui può essere condotta la DF sono
685
in mesofilia (25-40 °C), termofilia (40-65 °C) o ipertermofilia (65-80 °C) [85]. In
686
condizioni di termofilia e ipertermofilia si presume di ottenere il massimo rendimento e
687
la massima produttività di H2 a causa della maggiore attività delle reazioni biochimiche
688
così come suggerito dalle equazioni termochimiche [30]. Inoltre, la produzione di H2 ad
689
alte temperature può essere un efficace soluzione per evitare la contaminazione di batteri
690
consumatori di H2 [25]. Generalmente, la DF in termofilia ed ipertermofilia sembra
691
avere delle prestazioni superiori in termini di produzione di H2, ed è largamente accettato
692
che più H2 possa essere prodotto in termofilia piuttosto che in mesofilia. Tuttavia, i dati
693
reperibili in letteratura non supportano questa idea [86].
La scelta della temperatura operativa, infatti, influenza le specie batteriche coinvolte
695
nella DF e molti batteri mesofili hanno una migliore cinetica biochimica rispetto ai
696
batteri termofili a parità di substrato, inoltre, le alte temperature possono indurre la
697
denaturazione termica delle proteine e degli enzimi influenzando negativamente l’attività
698
microbica [87].
699
700
PRESSIONE PARZIALE D’IDROGENO
701
702
Come descritto in precedenza (cfr. par. 1.5.1.), durante la fermentazione
703
“clostridica”, l’idrogenasi è coinvolta nel processo di ossidazione-riduzione reversibile
704
della ferredoxina. Se la concentrazione di H2 nella fase liquida è eccessiva l’ossidazione
705
della ferredoxina diviene meno favorevole rispetto alla sua riduzione e ciò riduce la
706
capacità produttiva di H2 [32]. Così, la pressione parziale di H2 (PH2) in un reattore dove
707
avviene la DF può influenzare la produzione di H2: un’alta PH2 è inibente, al contrario,
708
una bassa PH2 può facilitare il rilascio di H2 nello spazio di testa [88-89]. La riduzione
709
della PH2 durante la DF può portare ad un incremento nella resa in H2. Diversi autori
710
[90-91] sono riusciti ad incrementare le rese in H2 diffondendo N2 oppure Ar,
711
rispettivamente, nel liquido. Un maggior rilascio di H2, comunque, può essere ottenuto
712
anche incrementando la velocità di agitazione [92].
713
714
AZOTO E FOSFORO
715
L’azoto è un fattore di crescita molto importante per i batteri poiché è il
717
componente degli acidi nucleici, delle proteine e degli enzimi. Allo stesso modo, anche i
718
fosfati sono un importante nutriente poiché servono come tamponi nelle reazioni
719
biochimiche. Dunque, un appropriato livello di azoto e fosforo sono necessari per
720
ottenere un’elevata proliferazione dei batteri idrogeno produttori [32]. L’azoto
721
ammoniacale è la fonte di azoto più largamente studiata, i dati disponibili in letteratura
722
però sono inconsistenti: Bisaillon et al. [93], per esempio, riportano come ottimale una
723
concentrazione di 0.01 g N L-1, Salerno et al. [94], invece, riportano una concentrazione
724
ottimale di 7 g N L-1.
725
Il fosforo è necessario per la produzione di H2. È stato dimostrato che aumentando
726
la concentrazione di fosfati, in un appropriato range, si può aumentare la produzione di
727
H2, tuttavia, un eccesso della concentrazione di fosfati può ridurre drasticamente tale
728
produzione [93, 95].
729
Un appropriato C/N e C/P sono fondamentali per la produzione di H2 in DF, ma
730
vari rapporti di C/N e C/P sono riportati come ottimali: Argun et al. [96] riportano un
731
rapporto C/N 200 e C/P 1000 come ottimale, al contrario, O-Thong et al. [97]
732
riportano come ottimale C/N 74 e C/P 559.
733
734
IONI METALLICI
735
736
Gli ioni metallici influiscono sulla crescita cellulare come cofattori di enzimi,
737
processi di trasporto e deidrogenasi. Un’alta concentrazione di ioni metallici, però, può
738
inibire l’attività batterica [98]. Lin e Lay [99] riportano che i nutrienti più importanti per i
batteri idrogeno produttori sono magnesio, sodio, zinco e ferro. Lo ione magnesio è un
740
importante cofattore che attiva quasi 10 enzimi (esochinasi, fosfofruttochinasi,
741
fosfogliceratochinasi etc.) che partecipano al processo di glicolisi durante le prime fasi di
742
DF [100]. Anche il Fe2+ è stato ampiamente studiato in DF poiché la sua presenza è
743
fondamentale per l’idrogenasi [25]. I dati disponibili in letteratura per la concentrazione
744
ottimale di Fe2+ sono inconsistenti: Liu e Shen [101] riportano che la concentrazione
745
ottimale è 10 mg Fe2+ L-1, ma Zhang et al. [102] riportano una concentrazione ottimale
746
di 589.5 mg Fe2+ L-1, O-Thong et al. [97], d’altra parte, riportano che la concentrazione
747
ottimale è 257 mg Fe2+ L-1, infine, Lee et al. [103] riportano una concentrazione ottimale
748 di 4000 mg FeCl2 L -1 . 749 750
CONFIGUARAZIONE DEL REATTORE
751
752
La configurazione del reattore è riconosciuta come un altro importante parametro
753
per aumentare la resa e la produttività di H2. Vari studi hanno correlato la produzione di
754
H2 con la quantità di popolazione microbica, così, differenti strategie sono state
755
elaborate per evitare il dilavamento della popolazione microbica dal reattore [104-106].
756
Queste strategie includono la granulazione del fango e la formazione di biofilm al fine di
757
aumentare la concentrazione batterica all’interno del reattore. Le configurazioni dei
758
reattori che sono stati: reattori agitati a flusso continuo (CSTR), reattori anaerobici a
759
letto fluidificato (AFBR), reattori anaerobici in batch sequenziali (ASBR), reattori a letto
760
fisso o impaccati, reattori UASB, reattori a letto filtrante, reattori a letto misto, reattori a
761
flusso a pistone e bireattori a membrana (MBR) [32].
Altri studi si sono focalizzati sulla fermentazione semi-secca (10-20 % di sostanza
763
secca) e secca (>20% sostanza secca) per la produzione di H2, poiché l’interesse per la
764
produzione di H2 da biomasse residue è in aumento [82, 107-109], è stata studiata anche
765
l’influenza della ritenzione della sostanza secca (SRT) e il tasso di carico organico (OLR)
766
sulla produzione di H2. Ma, anche in questo caso, i dati in letteratura sono controversi.
767
Gavala et al. [110], per esempio, riportano che il tasso di produzione di H2 in un reattore
768
UASB è più elevata che in un CSTR con un tempo di ritenzione basso, il CSTR, però, ha
769
sempre avuto una maggiore produzione di H2 a tutti i tempi di ritenzione testati. Show et
770
al. [105] hanno confrontato le prestazioni di un CSTR e di un AFBR per la produzione
771
di H2. Questi sistemi avevano differenti strategie di crescita batterica: CSTR a biomassa
772
sospesa, CSTR con fango granulare, AFBR con fango granulare e AFBR con biofilm. La
773
massima produzione di H2 è stata ottenuta con CSTR a biomassa sospesa (1.92 mol H2
774
mol-1 glucosio), i sistemi granulari e il biofilm hanno raggiunto una produzione massima
775
di H2 di 1.83 ±0.09 mol H2 mol -1
glucosio e 1.81 ±0.08 mol H2 mol -1
glucosio,
776
rispettivamente.
777
Tempi lunghi di SRT favoriscono la crescita di microorganismi idrogenotrofi, tempi
778
corti di SRT, d’altro canto, possono ridurre l’utilizzo del substrato con un conseguente
779
dilavamento della biomassa attiva [111]. L’ORL, invece, può influire sull’accumulo di
780
VFA e sui cambiamenti di pH che influenzano la composizione della biomassa attiva
781
con conseguente modifica delle vie metaboliche [77].
782
783
1.7. REFLUI DI CASEIFICIO
784
Come detto in precedenza (cfr. par. 1.5.), la fonte da cui più facilmente si ricava
786
idrogeno sono gli zuccheri. Pertanto, i reflui di caseificio, che sono ricchi in lattosio
787
sembrano essere adatti per la produzione di H2 (cfr. par. 1.6.2.).
788
I reflui di caseificio sono ampiamente diffusi in quasi tutto il mondo, poiché essi
789
derivano dal processo di caseificazione del latte. Tutti formaggi propriamente detti
790
vengono prodotti aggiungendo il caglio al latte che porta alla caseificazione della caseina
791
che porta alla formazione di una massa pastosa detta “cagliata” e di una fase liquida detta
792
“siero di latte” (SL) [112]. La rottura della cagliata e la sua successiva lavorazione
793
portano alla produzione del formaggio, SL, invece, è il liquido di scarto. In Italia, quasi
794
sempre SL viene utilizzato per la produzione di ricotta, composta maggiormente dalla
795
caseina e dalle sieroproteine non coinvolte nella caseificazione. Il liquido di scarto di tale
796
produzione è detto scotta che, di fatto, è un SL parzialmente deproteinizzato. Poiché il
797
lattosio è poco coinvolto nella produzione di ricotta, la scotta ha praticamente lo stesso
798
quantitativo di lattosio che da solo costituisce almeno il 75% della sostanza secca.
799
Inoltre, sono presenti anche minerali (8-10% della sostanza secca), urea, acido citrico,
800
lattico ed urico, ed anche vitamine del gruppo B [113-116].
801
802
1.7.1. DISPONIBILITA’ DEI REFLUI DI CASEIFICIO
803
804
Ogni anno nel mondo si stima che vengano prodotte circa 180-190 milioni di
805
tonnellate di SL; ma solo il 50% viene utilizzato dall’industria alimentare. In Europa,
806
annualmente, vengono prodotte 40 milioni di tonnellate di SL, il 68% delle quali viene
807
utilizzato maggiormente per l’alimentazione animale [117]. I reflui di caseificio hanno un
carico organico troppo elevato per essere smaltiti così come sono; il loro valore di COD
809
può arrivare fino a 80 g O2 L -1
[118]. Attualmente il carico organico dei reflui di
810
caseificio viene abbattuto mediante processi biologici aerobi in vasche di ossidazione
811
prima di essere immessi nelle acque superficiali.
812
813
1.7.2. ALTERNATIVE ALLO SMALTIMENTO
814
815
Come detto in precedenza, solo il 50% del SL prodotto annualmente nel mondo
816
viene utilizzato dalle industrie alimentari e mangimistiche. Così, circa 95 milioni di
817
tonnellate di SL sono ancora disponibili per un’ulteriore valorizzazione prima dello
818
smaltimento. Sia SL che la scotta sono ancora ricchi di sieroproteine ad alto valore
819
biologico che potrebbero essere recuperate attraverso l’ultrafiltrazione con membrane
820
selettive [119]. Le varie frazioni proteiche ottenute possono poi essere utilizzate per
821
specifici utilizzi, il permeato che deriva dall’ultrafiltrazione è ancora ricco in lattosio e
822
questo permetterebbe di avere a disposizione, annualmente, 4523 tonnellate di lattosio
823
per una loro ulteriore valutazione. Gli scarti di caseificio, inoltre, potrebbero essere
824
utilizzati per la fertirrigazione [120], per la produzione di polidrossibutirrato [121]
825
oppure per la produzione di energia; poiché il lattosio è formato da 2 molecole di esoso,
826
teoricamente, da esso è possibile ottenere 8 mol H2 mol-1 di lattosio [16] e questo lo
827
rende particolarmente appetibile per una sua valorizzazione energetica specialmente in
828
DF [65].
829
830
2. OBIETTIVO DELLA RICERCA
832
L’attività di dottorato è stata svolta nell’ambito del progetto “Sostenibilità della
833
filiera agroalimentare” (SO.FI.A., CTN01_00230_450760.). Tale progetto finanziato dal
834
Ministero dell'istruzione, dell'università e della ricerca era inquadrato all’interno del
835
Cluster Tecnologico Agrifood Nazionale (CL.A.N.). Il progetto SO.FI.A. era articolato
836
in 5 Obiettivi Realizzativi (O.R.) e l’attività di dottorato è stata svolta all’interno
837
dell’O.R.4:Recupero di sottoprodotti e biomolecole dell’industria lattiero-casearia.
838
Precisamente l’attività svolta presso CREA-ZA, ha riguardato la valorizzazione degli
839
scarti di caseificio per la produzione biologica di H2 e CH4.
840
Come detto in precedenza, in Italia, dal SL si ricava la ricotta, il cui scarto è detto
841
scotta. La scotta, oltre ad essere ancora ricca in lattosio, contiene ancora delle
842
sieroproteine con un alto valore biologico. Un importante produttore italiano di latticini,
843
partner del progetto, era interessato al recupero delle siero proteine che, poiché hanno
844
un alto valore biologico, hanno un fiorente mercato. La scotta fornita da questo
845
produttore è stata ultrafiltrata nell‘impianto di UF di ENEA (altro partner del progetto)
846
al Laboratorio Bioprodotti e Bioprocessi, Centro Ricerca Casaccia (Roma). Il refluo
847
liquido, ricco di lattosio, è stato valutato al fine di utilizzarlo per produrre H2. L’obiettivo
848
specifico del è stato la valorizzazione energetica degli scarti di caseificio (scotta e
849
permeato), utilizzandoli per la produzione di H2 in DF mediante l’utilizzo di consorzi
850
microbici non selezionati. Le attività svolte sono state focalizzate sulla valorizzazione del
851
permeato di scotta (più povero della scotta) per la produzione di H2 e sull’ottimizzazione
852
dei parametri che maggiormente influenzano la DF in una condizione in cui ci siano
853
diverse popolazioni microbiche all’interno del reattore anaerobico. L’evoluzione delle
popolazioni microbiche, infatti, è stata studiata mediante l’utilizzo della tecnica dell’high
855
throughput sequencing (HTS) che, permette di ottenere un responso rapido ed un’alta
856
copertura nell’identificazione delle comunità microbiche con costi relativamente bassi
857
[122]. L’HTS è stata utilizzata recentemente per lo studio della microbiologia dei reattori
858
di digestione anaerobica dei reflui industriali [123-124] ed anche per descrivere le
859
comunità microbiche in reattori in cui veniva prodotto H2 che avevano diverse
860
condizioni operative [125-126]. Più di recente, Etchebehere et al. [127] hanno utilizzato
861
tale tecnica per confrontare le popolazioni residenti in 20 reattori in cui veniva prodotto
862
H2, in diversi laboratori del Sud America.
863
In questa tesi, l’attenzione è stata maggiormente focalizzata sul substrato e sul pH.
864 865
3. MATERIALI E METODI
866 867 3.1. SUBSTRATI 868 869I substrati utilizzati durante il progetto di ricerca sono stati scotta, permeato di
870
scotta e liquame suino. La scotta è stata reperita in 4 caseifici diversi (G, H, R, S), la
871
scotta “G” è stata ultrafiltrata dall’ENEA (come riportato in precedenza) usando
872
membrane con cut-off 30 kDa. Sia le scotte che il permeato sono stati congelati a -28°C
873
immediatamente dopo la loro produzione e scongelati poco prima del loro utilizzo. Il
874
liquame suino è stato raccolto dalla vasca di stoccaggio della porcilaia sperimentale del
875
Consiglio per la ricerca in agricoltura e l’analisi dell’economia agraria, Centro Zootecnia e
876
acquacoltura, (CREA-ZA) sita a S. Cesario sul Panaro (MO), dopo omogeneizzazione
meccanica ed utilizzato fresco. Tutti i substrati sono stati utilizzati tal quali senza alcuna
878
aggiunta chimica o pretrattamenti, la loro composizione è riportata in Tab.1.
Tabella 1. Caratterizzazione dei substrati utilizzati nei vari esperimenti. Deviazione standard in parentesi (n=3), TS= solidi totali, FW= peso fresco, VS = solidi volatili. 880 ID TS % FW VS % FW Total N % FW Ammonium N % FW pH Alcalinity (mg CaCO3 L -1) Total P % TS Organic C % TS COD (gO2/L -1 ) C/N Lactose g L-1 Pig slurry 1.19 (0.3) 0.79 (0.25) 0.11 (0.01) 0.08 (0.01) 7.4 (0.3) 15329.33 0.02 (0.01) 30.52 (5.84) 9.53 (2.65) 3.12 (0.85) 0.00 Scotta "G" 5.87 (0.03) 5.07 (0.21) 0.07 (0.01) 0.01 (0.00) 5.7 (0.3) 751.25 (1.77) 0.03 (0.00) 37.59 (3.13) 54.50 (2.12) 31.28 (5.46) 50.3 (0.1) Scotta "H" 6.42 5.19 0.06 0.01 5.91 519.00 0.04 33.18 52.00 36.66 46.3 Scotta "R" 6.78 5.77 0.09 0.01 6.20 656.00 0.05 41.99 58.00 31.53 51.2 Scotta "S" 6.62 5.93 0.10 0.01 6.12 658.00 0.04 44.48 60.00 29.33 49.7 Permeate 5.85 (0.09) 5.21 (0.14) 0.03 (0.00) 0.01 (0.00) 6.1 (0.1) 592.50 (47.30) 0.02 (0.00) 36.51 (1.67) 54.25 (1.50) 80.10 (6.85) 50.6 (0.4) 881
![Figura 3. Processi attualmente disponibili per la produzione biologica di idrogeno [7]](https://thumb-eu.123doks.com/thumbv2/123dokorg/8113281.125245/14.892.165.746.131.527/figura-processi-attualmente-disponibili-produzione-biologica-idrogeno.webp)
![Figura 4. Meccanismo di generazione di idrogeno nelle alghe [7].](https://thumb-eu.123doks.com/thumbv2/123dokorg/8113281.125245/15.892.253.714.447.885/figura-meccanismo-generazione-idrogeno-alghe.webp)
![Figura 7. Vie metaboliche che permettono di generare H2 in dark fermentation [7].](https://thumb-eu.123doks.com/thumbv2/123dokorg/8113281.125245/21.892.159.698.139.604/figura-vie-metaboliche-permettono-generare-h-dark-fermentation.webp)
![Figura 9. Vie metaboliche seguite da Enterobacter spp. (a) e Clostridium spp. (b) in DF [30]](https://thumb-eu.123doks.com/thumbv2/123dokorg/8113281.125245/24.892.112.785.623.903/figura-vie-metaboliche-seguite-enterobacter-spp-clostridium-spp.webp)