INTRODUZIONE 4 1. ANISAKIDOSI E ANISAKIS – CARATTERISTICHE
GENERALI 7
1.1 Tassonomia 7
1.2 Anisakidosi nell’uomo 9
1.3 Ciclo vitale 12
1.4 Epidemiologia 14
1.5 Infezione acuta e sensibilizzazione 20
2. PATOGENESI 27
2.1 Caratteri generali e differenze con le altre infezioni elmintiche 27
2.2 Fisiopatologia 29
2.3 Invasività 30
2.4 Meccanismi immunopatologici 34
2.5 Risposta immune innata 35
2.6 Eosinofilia 37
2.7 Risposta immune adattativa 39
2.8 Ruolo delle proteasi e inibitori delle proteasi nelle reazioni
allergiche 43
3. ALLERGENI MAGGIORI 46
3.1 Vie di esposizione antigenica 46
3.2 Caratterizzazione e Isolamento degli antigeni 46
3.4 Cross- reattività antigenica 51
4. CLINICA 55
4.1 Manifestazioni cliniche acute 55
4.2 Manifestazioni cliniche croniche 57
4.3 Forma ectopica o extra-intestinale 58
4.4 Esposizione e sensibilizzazione 59
4.5 Prevalenza di Orticaria e Anafilassi da A.simplex 62
4.6 Anisakidosi Gastro allergica (GAA) 63
4.7 Ruolo degli allergeni cosiddetti ‘’nascosti’’ nell’allergia ad
Anisakis 70
5. SUSCETTIBILITA’ GENETICA 73
5.1 Ruolo dell’Atopia 73
5.2 Anisakis simplex e HLA 74
6. DIAGNOSI 75
6.1 Criteri diagnostici 75
6.2 Sensibilizzazione senza sintomi allergici 76 6.3 Diagnosi di anisakidosi gastro-allergica acuta 77 6.3 Diagnosi di sensibilizzazione ad Anisakis associata ad orticaria
cronica 78
6.4 ImmunoCAP e WB: procedure, razionale, vantaggi e svantaggi 80
7. CONFRONTO TRA IMMUNOCAP E WESTERN BLOT NEL RILEVARE LO STATO DI SENSIBILIZZAZIONE AD ANISAKIS
85
7.1 materiali e metodi 85
7.2 Risultati 88
8. CONCLUSIONI 103
INTRODUZIONE
L’anisakidosi è una parassitosi umana dovuta all’ingestione accidentale di larve di anisakidi attraverso il consumo di prodotti ittici crudi o poco cotti.
Questi nematodi utilizzano piccoli crostacei, plancton e varie specie di pesci come ospiti paratenici e hanno come ospiti definitivi i mammiferi marini, mentre l’uomo si configura come ospite accidentale.
Anche se circa il 90% delle segnalazioni di anisakidosi proviene dal Giappone (dove il consumo di carne di pesce cruda è diffusissimo) questa zoonosi rappresenta un problema di sanità pubblica in crescente diffusione in tutto il mondo, sia per l’aumentata consapevolezza clinica di tale patologia, sia per la globalizzazione nel consumo di generi alimentari che si è verificata negli ultimi anni nel mondo occidentale. Una volta ingerita la larva vitale L3 penetra le pareti gastrointestinali e rilascia i propri prodotti metabolici; l’esposizione antigenica stimola la sensibilizzazione dell’ospite e lo sviluppo di una risposta immunitaria prevalentemente di tipo Th2. La presentazione clinica tipica prende il nome di anisakidosi gastro-allergica e prevede la comparsa di sintomi di natura gastrointestinale e sintomi di tipo allergico anche molto gravi, fino allo shock anafilattico. La larva, può essere espulsa tramite vomito o rimozione chirurgica, ma se permane nella parete intestinale provoca la
formazione di un granuloma eosinofilico, con cronicizzazione della patologia.
Nel corso degli anni è stato poi evidenziato che anche l’ingestione pesce cotto può provocare la comparsa di una sintomatologia per molti versi sovrapponibile a quella delle allergie alimentari; la cottura della carne, infatti, uccide il parassita ma non diminuisce la potenza di alcuni allergeni termostabili.
Anche se per la sensibilizzazione è necessario il contatto con una larva vitale, le reazioni di ipersensibilità associate all’ingestione di larve morte di anisakidi sono probabilmente una forma di presentazione clinica più diffusa dell’infezione stessa, e questo pone a rischio il consumo di prodotti precedentemente considerati sicuri.
In primo luogo, questa tesi descrive l'epidemiologia, i meccanismi immunopatologici e le manifestazioni cliniche associate all’esposizione agli anisakidi, sia per quanto riguarda l’infezione con larve vitali, sia per quanto concerne le altre vie di esposizione antigenica.
In seguito, si concentra su un aspetto ad oggi controverso e affrontato da molti studi, che è quello della diagnosi di sensibilizzazione ad Anisakis. La diagnosi di anisakidosi e di allergia ad Anisakis si basa, oltre che su un’anamnesi compatibile e, per alcuni autori, un prick-test positivo, su
analisi sierologiche che valutano la presenza di IgE specifiche
anti-Anisakis.
L’interpretazione di questi test è però complicata dal fatto che gli antigeni maggiori di Anisakis possiedono un’intensa cross-reattività sia verso nematodi ad esso strettamente correlati, sia verso parassiti dell’ordine degli Ascaridi, e infine verso alcuni allergeni ambientali o alimentari. Specialmente per questo motivo, i test diagnostici ad oggi più utilizzati hanno una specificità poco elevata, risultando in un alta percentuale di falsi positivi. .
Lo scopo di questa tesi è quello di confrontare la metodica dell'immunoCAP e quella del Western Blot valutandone sensibilità, specificità, e affidabilità diagnostica, in particolare per quanto riguarda l'identificazione di pazienti ''a rischio'' di sviluppare risposte allergiche ad un successivo contatto con la larva di Anisakis.
In collaborazione con l'Università La Sapienza di Roma, i sieri di 33 pazienti per cui era stata richiesta la ricerca di IgE specifiche anti-Anisakis sono stati dunque testati con entrambe le metodiche, e i risultati emersi comparati e discussi.
1. ANISAKIDOSI E ANISAKIS – CARATTERISTICHE GENERALI
1.1 Tassonomia
Come illustrato in Tab. I, Anisakis spp. appartiene alla famiglia delle Anisakidae, insieme ad altri generi inclusi lo Pseudoterranova, il Phocascaris e il Contracaecum. Questi nematodi, comunemente chiamati anisakidi, utilizzano i mammiferi marini, gli uccelli acquatici e i rettili come ospite definitivo e i crostacei e il krill come ospite intermedio. Il krill è composto da piccoli crostacei invertrebrati appartenenti all'ordine Euphausiacea che compongono lo zooplancton, cibo primario di balene, mante, squali balena, pesce azzurro e uccelli acquatici. I pesci e i molluschi ( in particolare il calamaro) sono utilizzati come ospiti paratenici che trasportano lo stadio infettivo della larva.
Regno Animalia Tipo Nematoda Classe Secernentea Sottoclasse Spiruria Ordine Ascarididia Famiglia Anisakidae
Fig 1:larva di Anisakis, m.o
(www.molecularlab.it)
Tab 1 :
Integrated Taxonomic Information System
Le specie più comunemente implicate con l’infezione nell’uomo, sono
A.simplex e Pseudoterranova decipiens, entrambi con una distribuzione
potenzialmente cosmopolita. (Oshima, 1987;Smith and Wootten, 1978). L’identificazione delle specie nel genere degli Anisakidi è tipicamente complicata da una mancanza di caratteristiche morfologiche distintive, in particolare per quanto riguarda le larve; si conoscono diverse specie di
Anisakis e Pseudoterranova, ma per la distinzione è necessaria l’analisi
molecolare.
Studi di genetica molecolare hanno dimostrato che entrambe queste specie comprendono diverse sottospecie, spesso con diverso interessamento geografico e di ospite.
Per quanto riguarda il complesso di A.simplex sono state descritte almeno tre sotto specie: A.simplex, che si trova nel nord Atlantico, A.
simplex C, che si trova nel nord del Pacifico e nelle acque a sud del 30°
parallelo, e A. Pegreffi, diffuso soprattutto nel mar Mediterraneo. (Mattiucci et al., 1997).
Fig.2: Distribuzione geografica di Anisakis Simplex (A) e Anisakis Pregreffi (B) e Anisakis Simplex C (C) (Khun et al., 2011)
1.2 Anisakidosi nell’uomo
L'anisakidosi è un'infezione parassitaria del tratto gastrointestinale causata dall'ingestione di prodotti ittici crudi o non sufficientemente cotti contenenti le larve di Anisakis simplex –o altri membri del genere Anisakis- , per il quale l’uomo rappresenta un ospite accidentale.
Questa parassitosi causa frequentemente sintomi gastrointestinali, che possono associarsi a reazioni immunologiche da gravi a severe – generalmente di tipo allergenico - fino allo shock anafilattico.
Nonostante sia stato lo zoologo tedesco Leuckart a documentare nel 1876 il primo caso di infezione umana da parte di un anisakide in Groenlandia, la malattia è stata descritta in modo più ampio negli anni ’60 in Olanda, in seguito al verificarsi di un’epidemia dovuta al consumo
di ‘’aringhe verdi’’ (ovvero aringhe crude sotto sale). P.H van Thiel verificò la presenza di un nematode marino nel centro di flemmoni eosinofilici intestinali in questi pazienti che si presentavano con dolore addominale acuto, con 154 casi documentati tra il 1955 e il 1968. L’infezione fu messa in relazione, appunto, con l’ingestione di larve nel terzo stadio di A.simplex (L3) dovuta al consumo di pesce crudo o poco cotto. (Van Thiel, 1960 1962)
Circa 20.000 casi di anisakidosi sono stati riportati, ad oggi, nel mondo; di questi più del 90% provengono dal Giappone e la maggior parte dei restanti dalla Spagna, Olanda e Germania . (Audicana et al., 2002)
Nel corso degli ultimi 30 anni si è assistito ad un marcato aumento della prevalenza di anisakidosi in tutto il mondo. Questo aumento è dovuto a vari fattori, il principale dei quali è, probabilmente, un’applicazione più diffusa delle tecniche diagnostiche, in particolare dell’endoscopia , che permette di fare diagnosi in molti casi in passato attribuiti ad altre cause (Oshima, 1987). A questo fattore si somma l’aumentata domanda globale di carne di pesce e la recente crescita nella tendenza, specialmente in Europa e negli U.S.A, a consumare di carni crude o poco cotte secondo la tradizione Asiatica, che aumenta il rischio di esposizione al parassita (McCarthy and Moore, 2000 )
Negli anni novanta è poi emersa la consapevolezza che anche l’ingestione di larve morte – e quindi il consumo di pesce infetto indipendentemente dal tipo di cottura – può causare reazioni di ipersensibilità anche grave, e che questa forma di presentazione clinica è in realtà più diffusa dell’infezione stessa.
Quindi i sintomi allergici si verificano non solo in seguito all’infezione vera e propria da parte del parassita ( “Anisakidosi gastroallergica” ) , ma possono seguire la semplice esposizione ad allergeni per l’ingestione di larve morte .
Inoltre è stato dimostrato che l’allergia da A. simplex si comporta come altre gravi allergie alimentari, in cui nei lavoratori esposti l’inalazione o il contatto cutaneo con quantità minime di allergene possono causare reazioni come congiuntiviti, asma e dermatiti , andando quindi a costituire un rischio professionale. Reazioni allergiche attribuibili all’A.
simplex possono addirittura derivare dal consumo di carne di pollo,
presumibilmente a causa della nutrizione con farine di pesce.
L’esposizione a parassiti della famiglia Anisakidiae e ai loro allergeni è dunque una condizione diffusa e dalle variegate manifestazioni cliniche.
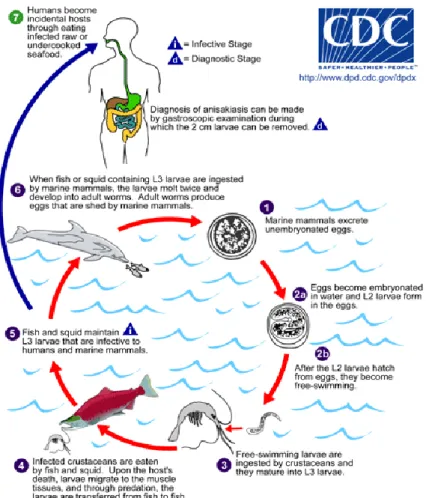
Fig 3: ciclo vitale di Anisakis M. T Audicana e M. W. Kennedy, 2008
1.3 Ciclo vitale
Lo stadio infettivo della larva (L3) si trova nella carne di pesci o cefalopodi e può essere incidentalmente ingerita dall’essere umano, causando l’anisakidosi che costituisce una zoonosi.
Queste larve si trovano nel terzo stadio evolutivo, e il loro sviluppo è arrestato fino a quando non vengono ingerite da mammiferi marini come delfini e foche, nello stomaco dei quali progrediscono attraverso due ulteriori stadi evolutivi fino a raggiungere lo stadio adulto. Dopo
l’accoppiamento degli adulti, la femmina fecondata produce delle uova che vengono espulse in acqua con le feci.
Qui si ha la crescita dell’embrione e la formazione della larva L2. Quando l’uovo si schiude le larve vengono ingerite dai primi ospiti intermedi (paratenici), di piccoli crostacei che costituiscono insieme al plancton il krill. Il krill a sua volta viene ingerito dal secondo ospite intermedio, che è rappresentato da varie specie di pesci.
Nell’ospite intermedio la larva persiste in uno stadio di blocco di sviluppo (ipobiosi) fino a quando non viene ingerita dall’ospite definitivo.
Si sviluppa quindi l’ultimo stadio larvale (L3) che può passare direttamente al suo ospite definitivo (mammiferi marini) per completare il suo ciclo biologico oppure essere ingerito da un ospite accidentale (nel quale il parassita non evolve a successivi stadi di sviluppo ) che può essere l’uomo se quest’ultimo si ciba di pesce crudo o poco cotto che contenga al suo interno la larva di Anisakis.
Esemplari adulti di A.simplex si ritrovano principalmente nel tratto gastrointestinale di cetacei (delfini, focene e balene ), mentre l’adulto di Pseudoterranova spp. e Phocascaris spp. vive nei pinnipidi (foche, leoni marini e trichechi). Alcune specie di Contracechi raggiungono lo stadio
maturo in pinnipidi, mentre altri maturano in uccelli marini come cormorani, pellicani ed aironi.
I pesci e I molluschi cefalopodi (gamberi) si infettano cibandosi di plankton o krill che contengono la larva nel terzo stadio, che attraverso il tratto intestinale si porta nei visceri e va incontro a incapsulazione (Anderson, 1992). Quando un pesce infetto è ingerito da un altro pesce, la larva incapsulata viene digerita e si ripete il ciclo. Questo fattore è importante da un punto di vista epidemiologico e di sicurezza del cibo, dal momento in cui il ripetuto trasferimento della larva nei pesci tramite la catena alimentare risulta in un ampio accumulo di larve, specialmente nei pesci di più grossa taglia e adulti (alcuni arrivano ad ospitare centinaia o addirittura migliaia di larve incapsulate) (Smith and Wootten, 1978).
1.4 Epidemiologia
Come già accennato, il Giappone, dove si registra un’incidenza di 2000 nuovi casi per anno, detiene la più elevata incidenza di anisakidosi. In Europa l’infezione è apparentemente meno frequente, con una significativa prevalenza dei casi in Olanda, Germania, Francia e Spagna, dove il numero dei casi riportati è aumentato rapidamente negli ultimi
anni probabilmente anche per un’aumentata consapevolezza da parte del personale medico.
In Spagna è stato stimato che l’allergia all’A.simplex sia maggiormente diffusa rispetto a qualsiasi altra allergia alimentare, nonché coinvolta quasi nel 10% delle reazioni anafilattiche (Baeza et al., 2005)
In Giappone è più diffusa l’Anisakidosi gastrica, mentre in Europa è più comune l’Anisakidosi intestinale. La differenza potrebbe in realtà essere dovuta alle indagini diagnostiche (in Giappone è molto più diffuso l’utilizzo di tecniche endoscopiche , in relazione alla maggiore consapevolezza ed incidenza della parassitosi e del cancro gastrico). La trasmissione dell’Anisakidosi è chiaramente collegata alle tradizioni di consumo alimentare di pesce crudo o poco cotto. Diversi piatti sono considerati ‘’ad alto rischio’’, in particolare il sushi e sashimi Giapponesi, le aringhe affumicate o sotto sale Olandesi, il Nordico
gravlax ( salmone essiccato), l’Hawaiano lomi-lomi (carpaccio di
salmone), il cheviche nel Sud America (pesce e frutti di mare crudi marinati con limone) , e lo Spagnolo boquerones en vinagre (alici sott’aceto).
Nell’ovest dell’Europa le aringhe sono la principale specie coinvolta per quanto riguarda l’infezione, mentre in Spagna la maggior parte dei casi
sono riportati in seguito al consumo di alici (Engraulis encrasicholus) e sardine ( Sardina pilchardus ).
Per quanto riguarda le manifestazioni allergiche, invece, nel nord della Spagna predomina il nasello cotto ( M. merluccius) strettamente seguito, di nuovo, dalle alici. E’ sempre più chiaro che A.simplex è la fonte principale di allergeni alimentare tra gli adulti della popolazione della regione Basca della Spagna, dove il consumo medio di pesce si aggira intorno ai 90g a persona per giorno.
Per quanto riguarda l’Italia, queste sono le specie ittiche in cui sono più frequentemente rinvenute larve di Anisakis:
Pesce sciabola Aguglia Suro
Nasello Pesce Tamburo Pesce S.Pietro
Lanzardo Murena Melù
Pagello Fragolino Alice Rana Pescatrice
Triglia di Scoglio Sardinia Tombarello
Gallinella Sgombro Pesce Castagna
Ricciola Boga Tracina
Molva Pagro
Busbana Scorfano
Tab 2: specie ittiche più frequentemente infettate da Anisakis - Laboratorio di Ittiopatologia - Dipartimento di Sanità Pubblica Veterinaria e Patologia Animale, Bologna - 2007
Studi epidemiologici in Giappone indicano che l’anisakidosi è più frequente nelle popolazioni della costa (in particolare dove gli abitanti sono coinvolti nell’industria del pesce) e negli uomini tra i 20 e 50 anni. Gli autori Giapponesi hanno anche dimostrato che la risposta IgE mediata contro gli antigeni escreti o secreti (ES) di A. simplex è presente nell’ 87,5% di pazienti con anisakidosi gastrica diagnosticata endoscopicamente, nel 75% di pazienti con orticaria indotta da sgombro maculato, ma solo nel l’8,3% dei pazienti con orticaria di origini sconosciute e nel 19% dei normali controlli.
I risultati di uno studio di prevalenza riguardo alla sensibilizzazione e allergia in un gruppo di 150 casi di pazienti con orticaria, angioedema o anafilassi, comparato con un gruppo di controllo (donatori di sangue
sani) hanno indicato che la prevalenza di sensibilizzazione all’A.simplex era del 26% rispetto al 12.6 % del controllo.
La sensibilizzazione fu considerata clinicamente rilevante solo nel 31% dei casi studiati; 12 pazienti hanno ricevuto la diagnosi di allergia ad A.
simplex che sarebbe stata etichettata come idiopatica se questi nuovi
allergeni non fossero stati indagati. Inoltre, IgE specifiche per A.Simplex sono stati anche rinvenute in pazienti con dermatite atopica in Giappone. E’ quindi chiaro il bisogno di valutare maggiormente l’impatto clinico dell’esposizione ad A. Simplex ed ai suoi allergeni. (Audicana e Kennedy, 2002 )
Le tabelle sottostanti elencano i casi riportati di anisakidosi nel mondo, nella sua presentazione con (Tab. 3 ) o senza (Tab. 4 ) sintomi allergici.
Tab. 3: Rapporti di Allergia ad A. Simplex nel mondo (con riferimento particolare ai casi di anafilassi)
1.5 Infezione acuta e sensibilizzazione
L’infezione gastrointestinale acuta con una larva vitale L3 di A.simplex provoca un danno tissutale in seguito all’invasione delle pareti gastrointestinali, con lo sviluppo di un granuloma eosinofilico che può esitare in perforazione e addome acuto e allo stesso tempo indurre forti reazioni allergiche.
In seguito alla sensibilizzazione A.simplex agisce quindi come agente eziologico di reazioni allergiche mediate da IgE, con sintomi tipici che vanno dall’angioedema isolato all’orticaria fino allo shock anafilattico. Recentemente è inoltre emerso che non solo le larve vitali, ma anche l’ingestione tramite il cibo di materiale di parassiti morti può essere pericoloso, potendo scatenare sia reazioni allergiche immediate potenzialmente letali che condizioni croniche e debilitanti.
Si concorda generalmente sul fatto che nella maggior parte dei casi sia necessaria un’infezione vera e propria per dare inizio alla sensibilizzazione allergica all’ Anisakis. Questa ipotesi è però difficile da stabilire con certezza, dato che alcuni casi di anisakidosi possono passare inosservati oppure non vengono appropriatamente indagati clinicamente.
Non può però essere esclusa la possibilità che la sensibilizzazione possa avvenire in seguito all’esposizione al solo antigene, in assenza di
un’infezione con la larva viva; ci sono infatti evidenze sperimentali che indicano che i materiali del nematode possono generare una risposta allergica di tipo Th2 senza bisogno di infezione (Hewitson et al., 2009) 1.6 Modello murino di anafilassi indotta da proteine parassitarie
Per meglio studiare gli aspetti specifici del processo anafilattico indotto dal parassita è stato messo a punto un modello murino di allergia ad
A.simplex che mima quella umana.
I topi sono stati sensibilizzati per via intraperitoneale (con estratti proteici crudi, normalmente utilizzati per lo skin test negli uomini), tramite differenti protocolli che utilizzavano diverse quantità di dosi sensibilizzanti. Dopo sei settimane sono stati trattati per via intravenosa o orale con A.simplex, quindi sono state determinate le immunoglobuline specifiche , le IgE policlonali, i sintomi anafilattici, i livelli plasmatici di istamina e i profili citochinici.
La somministrazione per via intravenosa aveva lo scopo di mimare l’invasione della mucosa gastrica da parte della larva, mentre quella per via orale l’ingestione di antigeni parassitari della larva morta.
Nei topi sensibilizzati le IgE, IgG1 e IgG2 specifiche sono comparse dalla terza settimana. Le IgE policlonali hanno avuto il picco con una cinetica diversa : come si può osservare in Fig 2a, hanno iniziato a crescere già alla prima settimana, raggiungendo rapidamente valori
elevati entro la terza settimana. Dalla terza alla settima settimana hanno continuato a crescere ma con una cinetica più lenta, per poi diminuire, come tutte le altre immunoglobuline, dalla settima settimana in poi.
Fig 4: 2005 British Society for immunology, Clinical and Experimentale Immunology
a) Livelli sierici di IgE totali (□ ▪) e specifiche (○ ●) misurate nel gruppo di topi sensibilizzati (▪● ) e nel gruppo controllo (□○) per 10
settimane.
b) Livelli sierici di IgG1 specifiche e IgG2a in entrambi i gruppi
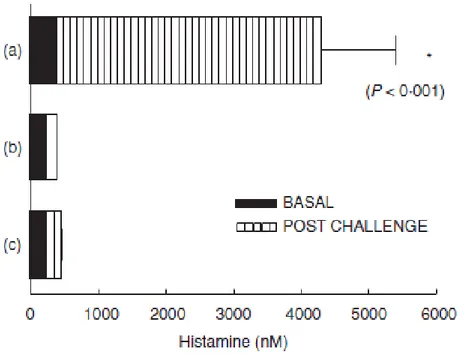
A. Simplex somministrato per via intravenosa ha prodotto sintomi
anafilattici e rilascio di istamina nel plasma; I sintomi sono apparsi tra i 3 e gli 11 minuti e sono durati 30 minuti. Se il parassita veniva somministrato per via orale invece non si osservavano sintomi o rilascio di istamina a 2 ore, vedi Fig. 3 . Nei gruppi controllo (topi non
sensibilizzati) invece non è stato registrato alcun sintomo né a seguito di carico orale, né intravenoso.
I sintomi sono stati valutati attraverso uno score che assegnava un punteggio alle varie presentazioni: 0: nessun sintomo; 1: strofinamenti e graffi sulla testa e intorno al naso; 2: gonfiore intorno agli occhi e alla bocca, diarrea, erezione pilifera, ipo/iperattività con aumento della frequenza respiratoria; 3: sibili, respirazione sdifficoltosa, e cianosi attorno alla bocca e alla coda; 4: apatia sotto stimolazione o tremori e convulsioni 5: morte.
I tre diversi protocolli di sensibilizzazione ( rispettivamente tre gruppi con 2, 3 o 4 iniezioni peritoneali per settimana) hanno dimostrato che esiste una correlazione tra il numero di dosi sensibilizzanti e lo score clinico.
Fig 5: Rilascio di istamina plasmatica dopo somministrazione di A. Simplex (2005 British Society for immunology, Clinical and Experimentale Immunology) a) Istamina plasmatica 8’ dopo carico i.v in topi sensibilizzati
b) Istamina plasmatica 30’ dopo carico g.i in topi sensibilizzati c) Istamina plasmatica 8’ dopo carico i.v nel gruppo controllo
Il profilo citochinico sviluppato, in entrambi i casi, ha confermato un pattern misto Th1 e Th2, diverso quindi da quello osservato nei modelli classici di anafilassi o allergia agli antigeni alimentari.
Sono state descritte differenze tra infezione ed esposizione antigenica nel senso che la reinfezione induce una risposta Th2 più forte, mentre i soli antigeni lo fanno in modo molto più blando o non lo fanno affatto. (Baeza et al, 2005)
Questa non responsività al carico orale con antigeni di A.simplex ha rinforzato la convinzione che una larva vitale sia necessaria a stimolare
la maggior parte delle reazioni allergiche nell’uomo; recentemente è stato però dimostrato che sia i parassiti vivi che gli estratti crudi di L3 causano reazioni allergiche in topi sensibilizzati oralmente con proteine di A.simplex, provocando reazioni allergiche importanti con prurito, irritabilità, diarrea e gonfiore attorno agli occhi entro un’ora dalla somministrazione. (Audicana e Kennedy 2008)
Ciò sarebbe dovuto all’ipereattività colinergica o al blocco adrenergico provocato da antigeni dell’Anisakis, che potrebbe provocare la comparsa di sintomi allergici anche mediante una stimolazione nervosa diretta, senza coinvolgere quindi l’attivazione del sistema immune.
E’ stato condotto uno studio in vitro sulla motilità intestinale dopo esposizione ad estratti parassitari di tessuto di duodeno, digiuno e ileo di ratto e in contemporanea uno studio in vivo sulla propulsione intestinale del bolo su animali infettati 4 ore prima con delle larve L3 di A. simplex . Il risultato ottenuto ha dimostrato che le larve L3 di A. simplex, sia vive che morte, possono indurre iperattività colinergica e blocco adrenergico in tutto il piccolo intestino e, come conseguenza, provocare sintomi gastrointestinali, angioedema e orticaria. E’ significativo il fatto che possano farlo molto prima che le IgE specifiche siano dosabili, perché il meccanismo è indipendente da esse. (Sánchez-Monsálvez et al., 2003)
2. PATOGENESI
2.1 Caratteri generali e differenze con le altre infezioni elmintiche
In generale le infezioni elmintiche sono caratterizzate dallo sviluppo di reazioni di tipo allergico, e possiedono inoltre un’attività modulatoria sul sistema immune. (Carvalho et al, 2006 , Harnett et al, 2006)
In seguito a un’infezione da parte di nematodi intestinali i linfociti Th2 producono e rilasciano citochine, il che si traduce nello sviluppo di mastocitosi, risposta IgE mediata ed eosinofilia. (Urban et al 1992 ) Queste sono appunto le manifestazioni tipiche della risposta immune verso elminti che parassitano i tessuti dell’ospite , anche se ancora deve essere chiarito quali tra questi elementi siano realmente associati all’espulsione del parassita. (Audicana and Kennedy 2008).
Oltre a promuovere una risposta immune in senso Th2, le infezioni elmintiche possono modulare le risposte contro altri antigeni non parassitari, causandone in alcuni casi il potenziamento, in altri la soppressione ( Carvalho et al, 2006 )
E’ stato infatti dimostrato che queste infezioni sono coinvolte nell’alterazione della tolleranza dei linfociti T. (Belkhaid 2006). Questo può implicare per l’ospite lo sviluppo di patologie quali malattie autoimmuni, intolleranza ad antigeni orali, aumento della suscettibilità
ad infezioni secondarie e diminuita efficacia dei vaccini. (Abbas et al. 1996, Zaccone et al. 2006)
Questa capacità di modulare la responsività del sistema immune non necessita strettamente della presenza di un’infezione attiva; gli stessi antigeni parassitari hanno infatti simili proprietà, nonostante raramente manifestino la stessa efficacia di un’infezione da parte del parassita vivo. ( Allen et al. 1996)
La maggior parte delle infezioni elmintiche inducono malattie croniche piuttosto che acute, e questo è vero anche in casi di livelli molto alti di carica parassitaria. Il verificarsi di reazioni fulminanti è inoltre un evento raro, e assume un’importanza significativa solo nel momento in cui si abbia il rilascio accidentale di elevate concentrazioni di antigeni parassitari in circolo – per esempio durante un intervento chirurgico per la rimozione di cisti iatidee.
Gli elminti in cui l’uomo rappresenta un ospite naturale hanno infatti sviluppato meccanismi per superare ed evadere la risposta immune, e questo ne assicura la propria sopravvivenza. (Audicana and Kennedy 2008).
L’anisakidosi costituisce però un caso a parte, perché il parassita non si è adattato per sopravvivere nell’ospite umano –che ne rappresenta un ospite accidentale- e l’infezione è solamente transitoria. È inoltre da
sottolineare come in più del 90 % dei casi descritti , per sviluppare l’infezione è bastato il contatto con una sola larva. (Daschner et al. 2000) Per questi motivi bisogna ovviamente aspettarci alcune differenze nella patogenesi di A. simplex rispetto a quelle causate da altri elminti che parassitano l’uomo.
Gli studi condotti negli ultimi anni hanno indicato che, come nelle altre infezioni elmintiche, i cambiamenti che si verificano nel tratto gastrointestinale durante l’infezione con A. simplex sono comunque il risultato sia dell’azione diretta della larva durante l’invasione tissutale, sia delle complesse interazioni tra il sistema immunitario dell’ospite e le sostanze rilasciate o contenute nel parassita. (Audicana e Kennedy, 2002)
2.2 Fisiopatologia
Dopo meno di un’ora dall’ingestione della larva viva L3 questa aderisce alla mucosa gastrointestinale e il rilascia i enzimi proteolitici necessari per l’invasione della parete. La larva inizia a formare un vero e proprio tunnel, che si manifesta clinicamente come una lesione emorragica. Dopo 4 ore la penetrazione di mucosa e submucosa è completata, e si ha il rilascio di fattori chemiotattici di eosinofili con conseguente formazione di un flemmone eosinofilico e lesioni erosive. Dal settimo al
quattordicesimo giorno abbiamo la formazione di un granuloma, con induzione di una risposta di ipersensibilità di tipo 1. Le lesioni diventano ulcerose, rendendo molto elevato il rischio di perforazione e addome acuto. Successivamente al quattordicesimo giorno dall’ingestione si verifica la morte della larva, ma l’infiammazione granulomatosa a carico della mucosa può persistere, con cronicizzazione delle ulcerazioni attorno ai resti del parassita morto. (Audicana e Kennedy 2008)
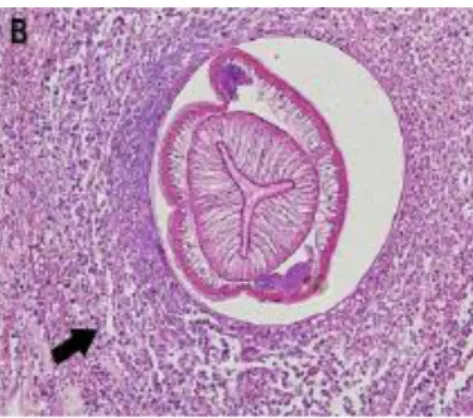
Fig 6: Biopsia ileale che mostra l’infiltrato eosinofilico attorno alla larva di Anisakis (Dong Baek Kang et al., 2010)
2.3 Invasività
Per invadere la mucosa gastrointestinale la larva L3 di A. simplex utilizza meccanismi di distruzione tissutale combinati con il rilascio di potenti enzimi proteolitici che sono capaci di degradare la matrice extracellulare. Sono state isolate da prodotti ES enzimi proteolitici di 54.3 kDa, 23.4 KDa e 25 e 26 kDa che vengono rilasciate in vitro da larve L3, simili alla tripsina dei mammiferi per quanto riguarda la loro attività enzimatica.
Sono stati inoltre caratterizzati un’enzima di 40 kDa che degrada il condrotin-solfato A e acido ialuronico e una serina proteasi di 30kDa simile a quella presente nel batterio Dichelobacter nodosus.
La capacità di invasione della larva associata alla presenza di sostanze anticoagulanti nei prodotti ES spiega la presenza di lesioni multiple, erosive e /o emorragiche , generalmente individuabili vicino alla lesione principale all’interno della mucosa gastrica di pazienti affetti da anisakidosi. (Audicana e Kennedy 2008)
Inoltre i prodotti ES rilasciati dalla larva sono importanti dal punto di vista immunologica. Lo dimostra il fatto che nel contesto delle lesioni acute è proprio attorno alla regione orale –da dove vengono rilasciati i prodotti ES- che si localizzano le risposte immuni umorali e cellulo-mediata ; questi prodotti, infatti, vengono legati degli anticorpi e formano complessi immuni insolubili. ( Ishikura 1990)
E stato poi dimostrato che alcuni antigeni ES , così come i componenti di superficie e quelli somatici del parassita, non solo inducono una risposta immune, ma hanno anche altri effetti, come stimolare la degranulazione diretta dei mastociti (per via IgE –indipendente) in topi sensibilizzati (Kobayashi, 1972)
Altri effetti dei prodotti ES includono : l’induzione di uno stato di immunosoppressione, associata con le componenti termolabili di
proteine da 66 e 95kDa , proprietà mutagene (Pethitory et al. 1996) per componenti proteiche di 10kDa, attività anticoagulante e chemiotassi di eosinofili associata con fattori termolabili del parassita; tutto ciò non danneggia la superficie della larva ma è parzialmente responsabile del danno tissutale indotto dal parassita. (Audicana e Kennedy 2008)
Fig 7: Rappresentazione schematica dei meccanismi immunopatologici di A.simplex nel tratto digerente (Audicana and Kennedy – 2008)
L’uomo può essere esposto agli antigeni di A. simplex da due differenti fonti: antigeni ES provenienti da larve vive e antigeni somatici e cuticulari delle larve morte e in disfacimento presenti nel cibo.
Per quanto riguarda la risposta innata, come descritto in Fig. 7, le cellule epiteliali rispondono secernendo molecole citotossiche come NO (1) e altre chemiochine e citochine (2) che attraggono leucociti polimorfonucleati (PMN), macrofagi tissutali, cellule dendritiche naive , basofili ed eosinofili. (3) La risposta innata può coinvolgere anche i recettori Toll-like (TLRs) (4) di cellule epiteliali e cellule dendritiche attivate.
Nella risposta immune adattativa invece la presentazione dell’antigene da parte delle cellule dendritiche stimola una doppia risposta di Th1 (5) e Th2 (6) . Possono essere reclutate anche altre cellule T come linfociti T regolatori e Th3.
Le citochine liberate dai Th1 (IFN gamma, TNF beta, IL-2 e IL-3) inducono la produzione di IgG2a, la produzione di anticorpi fissanti il complemento e opsonizzanti ( IgM, IgG per via classica, IgA per via alternativa) , l’attivazione dei macrofagi, citotossicità cellulare anticorpo dipendente e reazioni di ipersensibilità di tipo ritardato.
Le citochine prodotte dai Th2 (IL-4, Il-5, Il-6, IL-9. IL-10 e IL-13) promuovono la produzione di IgG1 e di IgA, ed attraverso la stimolazione di linfociti T la produzione di IgE specifiche e IgE policlonali.
La mastocitosi e l’eosinofilia sono indotte da una risposta Th2 e dalle citochine chemiotattiche, e potrebbero essere loro i diretti responsabili dell’espulsione del parassita. (7)
I basofili sono essenziali per l’iniziazione di una risposta di tipo Th2. L’eosinofilia potrebbe essere dovuta al rilascio di numerosi fattori chemiotattici sia da parte delle cellule epiteliali, linfociti T, mastociti, basofili, che da fattori derivanti direttamente dal parassita. (Audicana e Kennedy 2008)
2.4 Meccanismi immunopatologici
Il coinvolgimento di meccanismi immunologici nella patogenesi dell’anisakidosi acuta fu proposto per la prima volta nel 1964 con la cosiddetta ‘’ipotesi del doppio colpo’’ (Kuipers , 1964)
Studi sperimentali su cavie infettate per via orale hanno infatti dimostrato che la sensibilizzazione (quantificabile come risposta anticorpale ) e le lesioni erano di gravità maggiore alla reinfezione successiva.
Tali lesioni erano di natura tale da poter essere sostenute da reazioni di ipersensibilità di tipo uno, tre e quattro, che potrebbero quindi essere alla base dell’infezione da anisakis nell’essere umano.
2.5 Risposta immune innata
a) Cellule epiteliali:
Le cellule epiteliali sono spesso le prima a rispondere a stimoli infiammatori e immunitari, svolgendo un ruolo primario del reclutamento e attivazione di cellule infiammatorie in risposta alla presenza di parassiti enterici.
Si pensa per esempio che un aumento del tasso di turn over epiteliale nell’intestino crasso possa rimuovere i vermi dalla loro nicchia ottimale, portando alla loro espulsione, e che il tasso di movimento delle cellule epiteliali sia sotto il controllo di IL-3.
La risposta di tali cellule all’ingestione del parassita include l’attivazione di neutrofili, macrofagi tissutali, monociti, cellule dentritiche, basofili, ed eosinofili. (Audicana e Kennedy 2008)
b) Ossido Nitrico :
È assodato che l’ossido nitrico (NO) sia un potente agente antimicrobico, ed il suo ruolo nella difesa dell’ospite contro parassiti intra ed extracellulari è stato dimostrato proprio attraverso la sua azione su larve di nematodi come A. Simplex. Le basi biochimiche sembrano coinvolgere primariamente l’inattivazione di enzimi cruciali per il metabolismo energetico e la crescita del parassita. (James, 1995)
Le iNOS ( NO sintetasi inducibili) sono una famiglia di enzimi che catalizzano la produzione di ossido nitrico in grandi quantità a scopo difensivo. La produzione di NO avviene convertendo la arginina in L-citrullina e NO, e la sintesi di iNOS è stimolata dal lipopolisaccaride batterico e/o da citochine che upregolino la sua trascrizione.
Si pensa che il parassita possa mettere in atto meccanismi di evasione controreattivi , come lo scavenging di L arginina via arginasi ; La L-arginina è così sottratta enzimi iNOS e la produzione di NO viene ridotta. (Audicana e Kennedy 2008)
c) Sistema autonomo
Nel ratto l’ingestione di larve L3 di A.simplex, sia vive che morte può rapidamente indurre (entro 4 ore) un’iperattività colinergica e un blocco adrenergico nell’intestino, con conseguente sviluppo di sintomi digestivi . Questo suggerisce che risposte allergiche - come angioedema, vomito e orticaria - non riconoscano come unica eziologia quella mediata dalle Ig-E.
Come accennato precedentemente, un’iperreattività colinergica o un blocco adrenergico nel tessuto bersaglio possono causare queste manifestazioni tramite un meccanismo non immunologico, dando luogo a sintomi gastrointestinali molto tempo prima che IgE parassita
specifiche siano determinabili o comunque indipendentemente dalla loro presenza.
Le larve vitali stimolano reazioni generalmente al livello del duodeno, nel sito più frequente di penetrazione tissutale ed esposizione agli ES. Se il parassita si rompe o è disintegrato, allora c’è la probabilità che tutto il piccolo intestino venga esposto alle componenti interne del verme.
Questo è particolarmente significativo considerando che il 70% dei sintomi nelle reazioni anafilattiche contro A. simplex coinvolgono il sistema digestivo. (Sánchez-Monsálvez 2003)
2.6 Eosinofilia
Uno degli aspetti principali e distintivi delle lesioni infiammatorie locali provocate dalle larve di A.simplex è la presenza di un cospicuo infiltrato eosinofilico nel tessuto che circonda il parassita. Queste cellule, grazie alla presenza di anticorpi, aderiscono all’epicuticola parassitaria (in particolare attorno alla regione orale dove sono concentrati i prodotti ES) e rilasciano sostanze citotossiche. Queste sostanze in realtà non riescono a danneggiare il nematode, ma sono invece responsabili del danno tissutale che si osserva intorno al parassita sia nelle infezioni acute che croniche.
La concentrazione eosinofilica nelle aree tissutali danneggiate potrebbe non essere dovuta soltanto al rilascio dei numerosi fattori chemiotattici da parte dei linfociti T, mastociti e basofili che si verifica, in fase acuta, come stadio tardivo della risposta di ipersensibilità di tipo 1; in parte infatti potrebbe essere conseguente alla secrezione di sostanze chemiotattiche da parte del parassita stesso. (Audicana e Kennedy 2008) La possibilità che sostanze derivate dal parassita possano specificamente attrarre gli eosinofili è supportata dall’osservazione che estratti di A. simplex applicati all’ileo di conigli non sensibilizzati induce la formazione di lesioni caratterizzate da un infiltrato eosinofilico locale , con una scarsa presenza di mastociti e polimorfonucleati. L’aumento locale degli eosinofili interessa prevalentemente il tratto digestivo, spesso senza che si abbia un aumento a carica del sangue periferico, ed è associato all’ingestione del parassita vitale o a quella di antigeni di
A.simplex.
Ciò si può spiegare con la mancanza della fase migratoria del parassita che caratterizza le infezioni elmintiche associate più frequentemente ad eosinofilia ematica. (Iwasaki e Torisu 1982).
In vitro gli eosinofili sembrano incapaci di danneggiare l’Anisakis
2.7 Risposta immune adattativa
a) Risposta cellulo mediata
Le lesioni granulomatose osservate nella gastroenterite cronica e nelle forme ectopiche (vedi sotto) di anisakidosi indicano il coinvolgimento dell’immunità cellulo mediata, essendo tipiche delle reazioni di ipersensibilità di tipo IV.
Kikuchi e il suo gruppo nel 1990 hanno dimostrato il ruolo dell’immunità cellulo mediata di tipo IV sperimentalmente nei conigli e nelle cavie.
Uno studio immunopatogenetico dell’anisakidosi nell’uomo ha poi dimostrato il coinvolgimento della risposta Th2. Dall’analisi di biopsie intestinali di pazienti con anisakidosi (tutti andati incontro a chirurgia d’urgenza per dolore addominale acuto) sono stati trovati indicatori di una risposta Th2 , ovvero la presenza di mRNA per IL-4 e IL-5 ed eotaxina, ma senza trascrizione rilevabile di IFN gamma, IL-2 o IL-8. In queste biopsie era sempre presente un’infiltrato eosinofilico e linfocitario nella mucosa e sottomucosa, e molecole di derivazione eosinofilica potenzialmente coinvolte nel killing del parassita (iNOS, proteina basica maggiore, proteina eosinofilica cationica e proteina eosinofila X) e in
alcuni casi era identificabile anche la larva) . La maggior parte dei pazienti era inoltre positiva per la presenza di IGE specifiche anti antisakis. (Del Pozo, 1999 )
In uno studio condotto su pazienti immunodepressi malati sia di AIDS che di anisakidosi non sono state rinvenute lesioni granulomatose, e ciò depone a favore del coinvolgimento dell’immunità cellulare nella formazione di queste lesioni. (Audicana e Kennedy 2008)
b) Cinetica anticorpale
Gli anticorpi anti A.simplex in pazienti infetti riflettono l’intensa stimolazione immunologica che include sia una risposta Th1 sia Th2 . L’infezione causa una forte risposta immune, ed è stata osservata una progressione tipica da anticorpi IgM ad altri istotipi (IgG, IgA, e Ig E) durante i primi mesi dall’infezione iniziale, come è stato analizzato da prelievi seriali ed immunoblotting dove i più alti livelli di anticorpi antigene-specifici IgE, IgG e IgA si rilevavano dopo un mese di infezione; I livelli più altri di IgM si hanno entro 24 ore e il progressivo decadimento nei successivi 6mesi. (Daschner et al. 2002)
Generalmente, la risposta agli antigeni ES del nematode si manifesta precocemente e tende ad essere più intensa di quella indotta da antigeni somatici.
Diversi gruppi di ricerca hanno studiato la cinetica degli anticorpi specifici nel topo e nel coniglio, ma questi risultati non possono essere direttamente riferiti alla risposta immunitaria nell’uomo.
In uno studio, Cho et al. Hanno osservato e descritto il comportamento della risposta anticorpale specifica in ratti infettati oralmente con L3 per due volte, ad intervalli di 9 settimane . I risultati hanno suggerito che la risposta allergica era stimolata dalla reinfezione (picco dopo una settimana) ed era accompagnata da elevati livelli di IgM. (Audicana e Kennedy 2008)
Secondo uno studio di un gruppo Spagnolo del 2008, inoltre, in pazienti appendicectomizzati il titolo di Immunoglobuline specifiche contro A.
simplex risulta marcatamente più basso dopo il contatto con estratti
crudi di larve nel terzo stadio (L3).
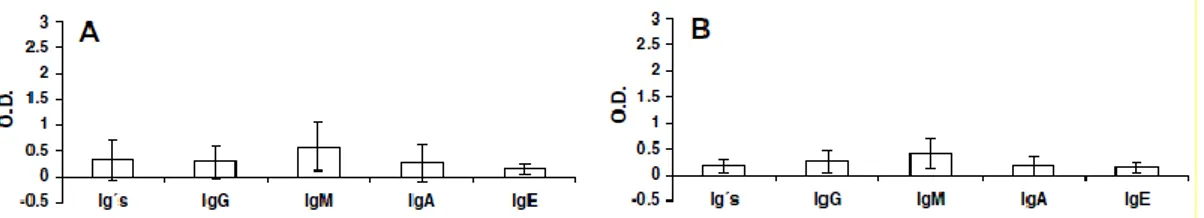
Escludendo pazienti con infezioni acute , malattie infiammatorie croniche o che avevano ricevuto trattamenti immunosoppressivi o vaccini nell’anno precedente lo studio, è stata selezionata una popolazione di 160 pazienti; 80 appendicectomizzati, e 80 no, come gruppo controllo (fig. 8).
Dosando il titolo anticorpale con una metodica ELISA, sono state trovate differenze significative per quanto riguarda le IgE totali , IgM e IgA
Fig. 8: Ig totali, IgG, IgM, IgA e IgE siero-specifiche per Anisakis Simplex in pazienti appendicectomizzati (B) e gruppo controllo (A), espressi come Densità Ottica (O.D)
J.C. Andreu-Ballester et al. - Experimental Parasitology (2008)
Questa differenza permane da tre mesi a tre anni post appendicectomia. La diminuzione potrebbe essere dovuta alla minore risposta contro i patogeni in seguito alla resezione di un’area di GALT (Gut-associated Lymphoid Tissue) . L’appendicectomia potrebbe quindi migliorare o annullare le reazioni allergiche IgE associate contro l’Anisakis. (Andreu-Ballester et al. 2008).
c) Anticorpi e Proteasi
Gli anticorpi prodotti durante l’infezione possono inibire il funzionamento biochimico di proteasi secrete da alcuni nematodi, come
Ascaris suum, Dictyocaulus viviparus, e Trichinella spiralis, . (Kennedy
1988, 1955)
Si è ipotizzato che proprio la risposta anticorpale contro le proteasi secrete da A. simplex potrebbe essere l’effettiva responsabile della morte delle larve che hanno invaso tessuti. Tramite la loro inibizione, infatti, vengono ostacolate sia l’acquisizione di nutrienti che la mobilità del
parassita, facilitando l’azione della risposta cellulo-mediata e degli altri effettori immuni.
Nel’ caso dell’Anisakis però il parassita si libera rapidamente dal legame anticorpale, in un modo simile a quello che si osserva nelle larve di
Toxocara canis. (Audicana e Kennedy 2008)
2.8 Ruolo delle proteasi e inibitori delle proteasi nelle reazioni allergiche
A parte il loro potenziale ruolo nell’invasione tissutale ed evasione del sistema immune, le proteasi potrebbero avere un’importanza addizionale, per esempio negli acari della polvere (Dermatophagoides spp) questi enzimi costituiscono degli ‘’allergeni maggiori’’ (ovvero i target delle IgE anticorpali in più del 50% dei pazienti allergici).
Inoltre, recenti lavori sul clivaggio del recettore di superficie cellulare CD23 (che è coinvolto nella regolazione delle IgE) dell’allergene proteasico del Dermatophagoides hanno fatto nascere l’idea che enzimi con un’appropriata specificità potrebbero indirizzare in modo diretto la risposta immune verso una polarizzazzione in senso Th2. (Audicana e Kennedy 2008)
Non è ancora chiaro se le proteasi sono allergeni veri e propri o modulano la risposta immune attraverso un meccanismo generale, ma data la grande quantità di proteasi che A.simplex secerne una volta entrato nell’ospite mammifero, il loro ruolo nelle reazioni allergiche deve essere approfondito. (Audicana 2002)
Andando a misurare il livelli di CD23 solubile (sCD23) in pazienti con anisakidosi gastrointestinale a 24 ore, un mese e 6 mesi dall’infezione i livelli sono risultati costanti, ma i pazienti con livelli più elevati di IgE totali e di IgE specifiche avevano anche elevati livelli di sCD23.
Questa correlazione tra sCD23 e livelli di IgE totali e specifiche fa pensare che la variabilità interindividuale di produzione di sCD23 sia un fattore importante nella presentazione di sintomi allergici, in quanto alti livelli di sCD23 predispongono alla produzione di un maggiore livello di IgE, indipendentemente dall’azione parassitaria (Daschner et al 2001) Oggi è assodato il fatto che le proteasi elmintiche e i loro inibitori siano allergeni prominenti tra quelli caratterizzati fino ad ora. Inibitori delle proteasi che fungono da allergeni per l’uomo , per esempio, includono Der p9 dal parassita della polvere, Api m 7 dall’ape mellifera, e Deld3 del pelo di gatto, insieme ad allergeni alimentari come Sola t 3 e Sola t 4 dalle patate, Act d 1 nel kiwi e Cuc m1 nel melone.
In A. simplex sono state delineate quattro classi principali di inibitori delle proteasi in base al tipo catalitico di proteasi inibite (I. Serine , II. Cisteine, III. Aspartato IV. Metalloproteasi ) (Knoks 2007); Recentemente sono stati identificati i due primi antigeni inibitori delle proteasi a causare allergie nell’uomo, Ani s4 e Ani s 6 , rispettivamente della classe II e I. (Rodriguez-Mahillo AI e Kobayashi, 2007)
La funzione di questi inibitori è quella di contrastare la risposta dell’ospite al parassita; deve essere ancora indagato se gli anticorpi prodotti contro A.simplex nell’infezione siano in grado di inibire la loro attività biochimica (come accade in altre infezioni di nematodi) e quindi di limitare i loro effetti immunomodulatori. (Audicana e Kennedy, 2008)
3. ALLERGENI MAGGIORI
3.1 Vie di esposizione antigenica
Nell’anisakidosi, il paziente può venire in contatto con gli antigeni del parassita tramite tre diverse fonti; l’intensità e la natura della risposta ad
A.simplex dipendono anche dal tipo e dall’origine degli allergeni ai quali
il paziente è stato esposto. Possiamo avere dunque un’esposizione a tutti gli antigeni ES oltre che agli antigeni somatici e cuticolari : questo avviene come risultato della penetrazione dei tessuti e successiva degenerazione della larva, che porta ad esposizione del profilo antigenico completo del parassita. Poi possiamo avere un’esposizione che riguarda solamente gli ES, nei casi in cui ci sia un’espulsione del parassita intatto (con possibile penetrazione di tessuto gastroenterico). Infine, può avvenire un contatto solamente con gli antigeni cuticolari e somatici provenienti da larve morte contenute nel cibo; in questo caso gli antigeni ES sarebbero presenti solamente in minime quantità. (Audicana e Kennedy 2008)
3.2 Caratterizzazione e Isolamento degli antigeni
Ad oggi sono stati descritti molecolarmente otto antigeni (da Ani s 1 a Ani s 8).
Sei di questi derivano da antigeni ES, due sono di origine somatica, mentre nessuno deriva dalla zona cuticolare del parassita.
Ani s 1 è un antigene ES che può presentarsi in diverse isoforme, e si è dimostrato altamente resistente al calore. Non si sa ancora a quale famiglia proteica appartenga, perché anche se mostra una certa somiglianza nella sequenza aminoacidica (dal 30 al 40% di identità) con gli inibitori di serin-proteasi di tipo Kunitz, manca di attività inibitoria (Shimakura et al. 2004).
Ani s 1 è un allergene maggiore (ovvero che causa una risposta IgE mediata in più del 50% dei pazienti) che non va confuso con un’altra proteina da 21-kDa, un allergene minore (riconosciuto solo dal 20% dei pazienti); il DNA di quest’ultimo allergene è stato infatti clonato nello stesso periodo in cui veniva caratterizzato l’allergene maggiore, e la proteina che ne deriva, che fu nominata Ani s 1 (Arrieta et al. 2000), è una proteina con struttura differente appartenente alla famiglia delle troponine dei nematodi. (Audicana e Kennedy, 2008)
Ani s 2 ed Ani s 3 sono gli unici due antigeni somatici descritti fino ad ora. Sono rispettivamente una paramiosina ed una tropomiosina, simili a quelle di altre specie. Ani s 2, per esempio, è simile alla paramiosina che costituisce l’allergene degli acari della polvere ( Blo t 11 dall’acaro
Probabilmente la somiglianza nella sequenza in queste proteine altamente conservate è la causa della cross-reattività che le IgE anti A.
simplex mostrano nei riguardi della Blattella germanica (una piccola
specie di scarafaggio) dei Chironomidi (insetti macroscopicamente simili alle zanzare appartenenti all’ordine dei Ditteri) , e degli Acari della polvere.
La proteina muscolare tropomiosina è coinvolta inoltre nella cross-reattività con allergeni dei gamberi (Pen a 1), scarafaggi (Per a 7), acari della polvere (Der p10 e Der f 10) e lumache. (Ferreira et al. 2004) Ani s 3 è termostabile e presenta geneticamente il pattern HLA di tipo DRBI *0404, che è quello responsabile del legame con le cellule T. (Guarneri et al. 2007). Ani s 3 ricombinante è in commercio e viene utilizzato per la diagnosi con microarray. (Audicana e Kennedy, 2008) Ani s4 ed Ani s6 sono antigeni ES e sono inibitori rispettivamente della cisteina e serina proteasi. Sono stati i primi inibitori di proteasi scoperti come allergeni per l’uomo. Ani s4 è situato sia nella ghiandola escreta, che al di sotto della cuticola, ed è resistente al calore. Ani s 6 non è un allergene maggiore ed ha una sequenza simile agli inibitori delle serin proteasi di altre specie animali.
Ani s 5 e Ani s 8 sono antigeni ES termostabili che condividono sequenza aminoacidica e possiedono cross reattività antigenica con
diversi membri della famiglia proteica dei nematodi SXP/RAL-2. Ani s 5 comunque non è un allergene maggiore.
Ani s 7 è una glicoproteina presente nei prodotti ES, è l’antigene target degli anticorpi UA3 MAb , e sembra che sia riconosciuto dal 100% dei pazienti allergici.
In Tab. 5 sono illustrate le principali caratteristiche degli allergeni di Anisakis
Nome Massa Molecolare
(kDA) Localizzazione Classe Allergenica
Ani s 1 21-24 ES
Omologia con un inibitore di serin-proteasi di tipo
Kunitz
Ani s 2 97 Somatico Paramiosina
Ani s 3 41 Somatico Tropomiosina
Ani s 4 9 ES Inibitore della
Cistein-proteasi
Ani s 5 15 ES Proteina SXP/RAL
Ani s 6 ES Inibitore della
Serin-proteasi
Ani s 7 139-154 ES Glicoproteina
Ani s 8 15 ES Proteina SXP-RAL
Tab. 5:Antigeni di Anisakis
3.3 Termostabilità degli antigeni
Già nel 1997 Audicana e Kennedy avevano sottolineato come la cottura o il congelamento del pesce infettato non fossero sufficienti a garantire la
distruzione del potenziale antigenico e proteggere dallo sviluppo di reazioni di ipersensibilità.
Recentemente, con la scoperta e caratterizzazione degli allergeni termostabili di A. simplex, sono aumentate le controversie sulla sicurezza del consumo di pesce infetto dopo cottura o congelamento. In uno studio del 2004 , tramite una metodica di immunoblotting le IgE specifiche di 27 pazienti sensibilizzati nei confronti di allergeni di A.
simplex sono state fatte reagire con estratti crudi di parassita
precedentemente trattati al calore (bollitura per 30 minuti) e/o digestione peptica. L’81% dei pazienti aveva IgE specifiche positive per antigeni resistenti alla pepsina, e il 67% aveva IgE specifiche positive per allergeni termostabili. Il 30% di essi riconosceva gli antigeni dopo entrambi i trattamenti. (Caballero e Moneo, 2004)
E’ ormai riconosciuto il fatto che l’ingestione di materiale derivato da parassiti morti sia potenzialmente pericoloso. La cottura, che uccide il parassita, non diminuisce la potenza degli allergeni.
In uno studio sperimentale è stato dimostrato che estratti crudi di Ascaris rimangono allergenicamente attivi anche dopo un passaggio in autoclave, che porta la temperatura dei campioni molto al di sopra si quella usata di routine nella cottura. Questa capacità di recuperare il potenziale allergenico potrebbe essere dovuto all’esistenza di epitopi contenenti
specifiche sequenze aminoacidiche, piuttosto che un recupero dovuto alla conformazione proteica. Inoltre, da lavori più dettagliati su ABA-1 purificato (un allergene di Ascaris che ha un omologo in A.simplex) è emerso che questa proteina richiede temperature eccezionalmente elevate prima di denaturarsi, e può inoltre andare incontro a rinaturazione in seguito al raffreddamento, recuperando la sua allergenicità. (Audicana e Kennedy 2004).
Si ricorda che Ascaris è antigenicamente cross-reattivo con Anisakis, come dimostra la presenza di IgE specifiche contro Ascaris lumbricoides in assenza di infezione da Ascaris dopo episodi di anafilassi dovute ad A. simplex. (Audicana, 2002)
3.4 Cross- reattività antigenica
Per quanto riguarda Anisakis spp. possiamo identificare tre tipi di cross-reattività; per prima cosa, questa può riguardare nematodi del pesce strettamente correlati ad esso, in particolare quelli del genere Anisakis,
Pseudoterranova, Phocascaris e Contracaecum, all’interno quindi della
famiglia degli Anisakidi. Anche se in letteratura le informazioni a riguardo sono scarsissime, è molto probabile che questo tipo di
cross-reattività esista, data la similarità antigenica che esiste all’interno del gruppo (Iglesias and Leiro, 1996)
In secondo luogo possiamo avere cross reazioni tra parassiti dell’ordine degli Ascaridi, per alcuni dei quali l’uomo può rappresentare l’ospite definitivo (A. lumbricoides) o accidentale (per es. Ascaris suum,
Baylisascaris spp., Toxocara spp.).
A questo riguardo ci sono evidenze sperimentali e dati clinici emergenti che sostengono un’estesa cross-reattività antigenica tra Anisakis e altri ascaridi. (Iglesias et al., 1996; Kennedy et al., 1988; Maldonado et al., 2004; Perteguer et al., 2003).
In Europa, la fonte più comune di infezione per quanto riguarda gli ascaridi si ha da parte del parassita Toxocara canis, specialmente nei bambini. E’ stato ipotizzato che la sensibilizzazione a questi parassiti possa trasferirsi anche agli allergeni dell’Anisakis, anche se questa possibilità deve essere ancora valutata più estesamente . Ad oggi, non ci sono dati clinici che colleghino l’esposizione agli ascaridi con la sensibilizzazione agli allergeni di Anisakis. (EFSA journal, 2010). Anzi, alcuni studi condotti in Spagna indicano che l’alta prevalenza di sensibilizzazione ad Anisakis in soggetti che non avevano una predisposizione o storia di allergia non ha relazione con l’esposizione a precedenti malattie parassitarie, e l’ipotesi più probabile è l’esistenza di
precedenti episodi subclinici di anisakidosi. (Audicana e Kennedy, 2008).
Infine, come detto sopra, possiamo avere cross reazioni tra allergeni di nematodi anisakidi e allergeni ambientali (acari della polvere, scarafaggi) o alimentari provenienti da crostacei come gamberi e scampi. La cross reattività tra A.simplex e numerose specie di invertebrati è stata provata sperimentalmente attraverso diversi metodi; l’importanza clinica di questa cross reattività è ancora poco chiara e richiede analisi maggiori, ma sicuramente rappresenta un limite per l’affidabilità diagnostica dei test allergici per A. simplex, a causa dell’elevata frequenza di falsi positivi. (Guarneri et al. 2007).
I metodi di ImmunoCAP e IgE-immunoblotting infatti utilizzano dei complessi antigenici che contengono sequenze di carboidrati molto diffuse in natura, specie in altri parassiti, crostacei, insetti, acari, e piante (Johansson et al., 2001). Cross-reazioni tra Anisakis e crostacei (gamberi e scampi), insetti e acari coinvolgono sicuramente l’antigene maggiore comunemente chiamato ‘’panallergene’’, ovvero la tropomiosina (Lorenzo et al., 1999). Altre possibili fonti antigeniche di cross reazioni includono il cestode Echinococcus granulosus (Daschner et al., 2000), la
Blatella germanica , il Clonorchis sinensis, le pulci d’acqua (Daphnia)
Gli allergeni responsabili della cross reattività non sono stati identificati; nel migliore dei casi, è stato definito solo il loro peso molecolare (Guarneri et al., 2007).
In uno studio del 2007, tramite l’analisi dell’omologia tra sequenze aminoacidiche sono state identificate diverse proteine appartenenti a vari organismi significativamente simili ad Ani s 2 ed Ani s 3, e quindi potenzialmente in grado di produrre cross-reazioni.
Questa omologia è supportata anche dalla presenza in queste proteine di sequenze che legano alleli HLA DRB1 *0404 (fattore di rischio per lo sviluppo di allergia ad Anisakis) sia in Ani s 2 e Ani s 3 che nelle proteine omologhe.
Sia Ani s 1 che Ani s 3 hanno mostrato un’omologia significativa con 19 allergeni conosciuti ( 3 paramiosine e 16 tropomiosine) di moscerini, molluschi, crostacei, scarafaggi e acari.
Bisogna comunque ricordare che l’omologia aminoacidica –anche se altamente significativa- non si correla sempre alla presenza di IgE cross-reattive, presumibilmente perché anche piccole sostituzioni di amminoacidi possono provocare cambiamenti conformazionali negli epitopi tridimensionali riconosciuti dagli anticorpi ( Guarneri et. al, 2007).
Fig. 9: Similarità nelle sequenze della tropomiosina 4. CLINICA
4.1 Manifestazioni cliniche acute
L’Anisakis è, ad oggi, il solo parassita associato a prodotti ittici che causa reazioni cliniche di tipo allergico. Nonostante infatti alcuni studi abbiano evidenziato l’allergenicità di altri estratti parassitari basandosi su prick test positivi o dimostrazione di IgE specifiche nel siero, queste
non sono mai associate con reazioni allergiche evidenziabili clinicamente (EFSA journal 2010)
Le principali risposte cliniche acute all’A. simplex sono l’ Anisakidosi Gastro Allergica (GAA) e l’allergia all’ A.simplex. Nella GAA i sintomi allergici si presentano come sintomi addizionali nella fase acuta della parassitosi gastrica, dopo aver mangiato pesce crudo o poco cotto infettato con larve vive; nell’allergia all’A.simplex i sintomi si manifestano come risultato della contaminazione di prodotti ittici con allergeni, senza bisogno che la larva sia viva per scatenare tale reazione. Addizionali risposte allergiche che possono verificarsi sono l’Orticaria Cronica, che è associata alla sensibilizzazione con A. simplex ma i cui meccanismi non sono ancora stati ben chiariti, la gastroenterite eosinofilica e sintomi di natura reumatologica e dermatologica , rino-congiuntivite occupazionale ed asma.
L’allergia all’A.simplex e l’anisakidosi gastro allergica sono abbastanza diffuse in alcune regioni della Spagna (Audicana and Kennedy, 2008), ma sono raramente o addirittura non riportate in altri parti di Europa. Non si sa se ciò è dovuto alla mancata consapevolezza e scarsa applicazione dei test diagnostici, o a reali differenze nell’incidenza della malattia.
Le rimanenti manifestazioni allergiche associate con A. simplex sono invece molto rare.
Per quanto riguarda le alterazioni reumatologiche, sono state descritte manifestazioni cutanee ed artrite; in questi casi è stata dimostrata la presenza concomitante di reazioni di ipersensibilità del III oltre che del I tipo, associate all’esposizione antigenica. La rino-congiuntivite collegata ad A.simplex è stata descritta in pescivendoli o soggetti esposti (per contatto o inalazione) a carne cruda di pesce utilizzata per nutrire il pollame. E’ stato descritto un solo caso di dermatite da contatto in una casalinga. In tutti questi casi è stata dimostrata la presenza di una reazione di ipersensibilità di I tipo (IgE mediata e immediata) e di IV tipo (ritardata). (Audicana e Kennedy 2002).
4.2 Manifestazioni cliniche croniche
Quando le larve L3 riescono a penetrare nella mucosa senza essere successivamente espulse attraverso vomito e/feci o rimosse
chirurgicamente, possono provocare la formazione di lesioni croniche come ascessi e, più tipicamente, granulomi ad infiltrato eosinofilo (Takei e Powell , 2007).
In prossimità della lesione principale, in questi casi, è possibile riscontrare la presenza di lesioni multiple ben definite, erosive e/o emorragiche, determinate dall’azione delle proteasi e sostanze anticoagulanti secrete come ES.
Le lesioni croniche granulomatose possono presentarsi in forma paucisintomatica con melena e dolori colici, essere del tutto
asintomatiche, o complicarsi in quadri clinici gravi, come perforazione d’organo e peritonite, (Fazii, 2011), occlusioni intestinali (Dong Baek Kang et al., 2008) e, in rarissimi casi, intussuscezioni intestinali (Tomofumi Miura et al., 2010).
I tratti più interessati sono i primi tratti del canale digerente , in
particolare stomaco e duodeno, tuttavia sono stati segnalati anche alcuni casi di anisakidosi coinvolgente il colon ascendente (Kyong Rock Do et al., 2010) e sigma, in questo caso con possibile associazione con il carcinoma del colon (Hye Jin Yoo et al., 2008).
4.3 Forma ectopica o extra-intestinale
Benchè rare, sono state descritte forme cosiddette ‘ectopiche’ di anisakidosi, in cui la larva L3 vitale ingerita riesce non solo a penetrare la mucosa gastrointestinale, ma da essa riesce a migrare a sedi anche
lontane da quella dell’iniziale perforazione, attraversando vari organi e tessuti (Sakanari e McKerrow, 1989).
Lesioni granulomatose eosinofile ectopiche contenenti la larva L3 di
Anisakis sono state riscontrate in cavità addominale, parete addominale,
mesentere, grande omento (Cancrini et al., 1997), fegato, pancreas, polmoni (Matsuoka et al., 1994), milza, linfonodi e sottocute (Pampiglione et al., 2002)
I quadri sintomatologici in questo caso variano a seconda del distretto interessato, e come accade per le forme croniche, l’anisakidosi ectopica può essere anche asintomatica; la diagnosi in questo caso sarà casuale, in corso di procedure diagnostiche o chirurgiche effettuate per altre patologie.
4.4 Esposizione e sensibilizzazione
La teoria più condivisa è che nella maggior parte dei casi sia necessaria un’infezione vera e propria per dare inizio alla sensibilizzazione allergica all’ Anisakis.
Questa ipotesi è difficile da stabilire con certezza, dato che alcuni casi di anisakidosi possono passare inosservati oppure non vengono indagati clinicamente in modo appropriato.