1 INDICE
RIASSUNTO 3
ABSTRACT 4
IL DIABETE MELLITO 5
Definizione, classificazione e diagnosi del diabete mellito ... 5
Altre categorie di alterata regolazione glicemica: IFG e IGT ... 7
Diagnosi di diabete ... 8
IL DIABETE MELLITO DI TIPO 2 9 Epidemiologia e impatto socio – sanitario del diabete mellito di tipo 2 ... 9
La patologia diabetica: dati di prevalenza a livello nazionale ... 9
Prevalenza e incidenza del diabete di tipo 2 in Italia ... 9
Prevalenza e incidenza delle complicanze macrovascolari del diabete di tipo 2 in Italia ... 10
I costi del diabete ... 11
IL PANCREAS 14 Anatomia del pancreas ... 14
Vascolarizzazione e innervazione del pancreas ... 15
Embriologia del pancreas ... 16
Pancreas esocrino ... 17
Pancreas endocrino ... 17
LE CELLULE BETA 20 Le cellule β nel diabete di tipo 2 ... 21
Ruolo della massa beta-cellulare ... 23
Studi di morfometria ... 25
Morte β cellulare ... 26
Rigenerazione beta cellulare ... 27
Ruolo della funzione β cellulare ... 29
Secrezione di insulina da parte di isole DMT2... 31
Clusters ... 32
FENOTIPO MOLECOLARE DELLE BETA CELLULE NEL DMT2 34 Ruolo dei fattori genetici ... 34
2
Genotipo e fenotipo delle beta cellule umane ... 35
Dal genotipo al fenotipo ... 36
Implicazioni cliniche ... 38
FINALITA’ DELLA TESI 40 MATERIALI E METODI 41 Processazione del tessuto pancreatico ... 42
Preparazione dei campioni e fissazione in formalina ... 42
Deidratazione dei campioni e inclusione in paraffina ... 43
Preparazione delle sezioni tessutali ... 45
Immunoistochimica ... 45
Analisi morfometrica ... 47
Preparazione delle isole pancreatiche umane ... 50
Digestione del tessuto pancreatico ... 50
Purificazione ... 51
Preparazione del mezzo di coltura Medium M199 ... 51
Genotipizzazione ... 52
Estrazione del DNA ... 52
Genotipizzazione Taqman ... 53
Analisi statistica ... 54
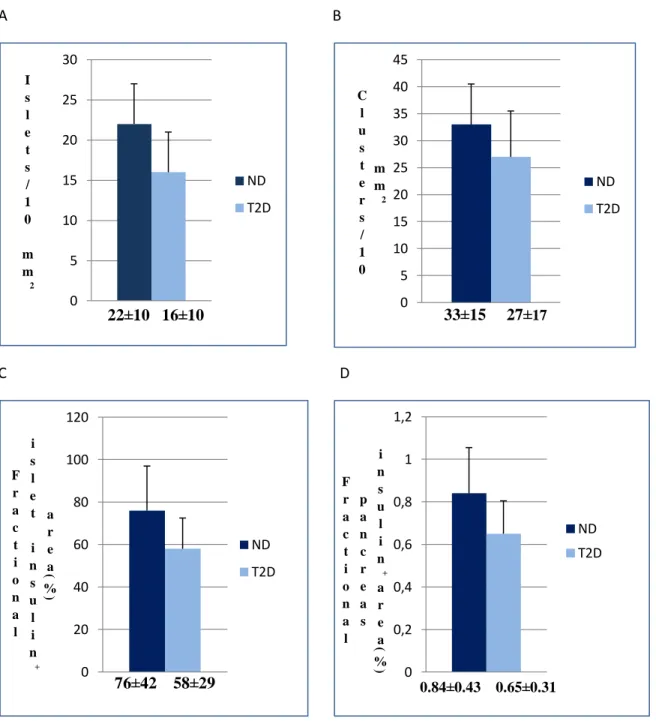
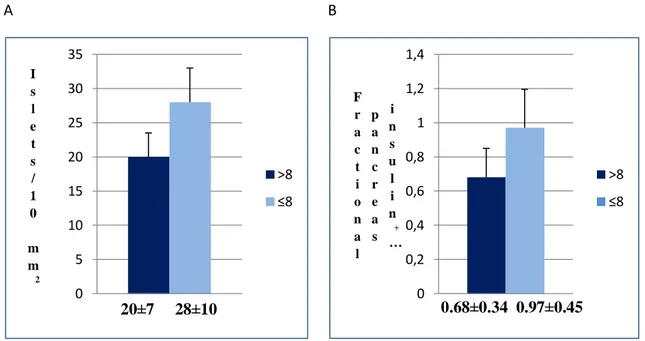
RISULTATI E DISCUSSIONE 55 Caratteristiche cliniche dei donatori ... 55
Analisi morfometrica ... 55
Genotipo e area insulare ... 57
CONCLUSIONI 58
3
RIASSUNTO
Il diabete di tipo 2, la forma più comune di diabete, è caratterizzato dalla ridotta massa funzionale delle beta cellule pancreatiche. A ciò contribuisce la ridotta quantità di beta cellule nel pancreas dei soggetti diabetici, alla cui quantificazione molti studi stanno mirando, così come notevole impegno viene dedicato alla ricerca delle cause e dei meccanismi che ne sono responsabili. Nella presente tesi, la candidata ha messo a punto e applicato tecniche di analisi immunoistochimica per la valutazione dell’area beta cellulare nelle isole e nel parenchima pancreatico, utilizzando pancreas di soggetti non diabetici e con diabete di tipo 2. Inoltre, è stato valutato il ruolo di geni associati con il diabete di tipo 2 nell’influenzare l’area delle beta cellule. Nella prima parte della tesi, sono state messe a punto e ottimizzate metodiche per la raccolta dei campioni e il loro stoccaggio; successivamente, sono state applicate tecniche per la quantificazione morfometrica del numero di isole e di “clusters” di beta cellule, nonché per il calcolo dell’area insulino-positiva nelle isole e nel tessuto pancreatico. Ciò ha consentito di documentare una riduzione altamente significativa dell’area positiva per insulina nelle isole pancreatiche e nell’intero tessuto. Nella seconda parte della tesi, e in collaborazione con altri gruppi, è stata studiata la relazione tra alcuni geni/loci associati al diabete di tipo 2 e noti per causare alterazioni della funzione beta cellulare in vivo (KCNJ11, TCF7L2,
HHEX, IGfBP2, CDKAL1, CDKN2A/2B, CDC123/CAMK1D, WFS1, JAZF1) e l’area
beta cellulare in soggetti non diabetici. In tal modo, si è dimostrato che quanto più elevato era il numero delle varianti associate con il diabete tanto minore è risultato il valore dell’area insulino-positiva nelle isole e nel parenchima pancreatico. In conclusione, ottimizzando e applicando metodiche per la quantificazione delle beta cellule pancreatiche, si è dimostrato che l’area beta cellulare è ridotta nelle isole e nel parenchima pancreatico dei soggetti con diabete di tipo 2, e che la presenza di varianti geniche associate con questa forma di diabete condiziona la quantità delle beta cellule.
4
ABSTRACT
Type 2 diabetes, the most common form of diabetes, is associated with pancreatic beta cell failure. Reduced beta cell amount contributes to the failure, and efforts are being done to quantify the reduction and understand the accompanying mechanisms. In the present thesis, the candidate has applied techniques of immunocytochemical analysis for the evaluation of beta cell area in the islets and in the pancreatic tissue of non-diabetic and type 2 diabetic organ donors; in addition, the role of genes/loci associated with the disease has been explored. In the first part, procedures for sample collection, handling and storage have been implemented and applied to the pancreatic tissue; afterwards, morphometric analyses have been developed to measure the number of islets and that of beta cell clusters, followed by quantification of insulin positive area in the preparations. This has allowed to demonstrate that in type 2 diabetic pancreases the main defect is due to decreased beta cell area in the islets as well as in the pancreatic tissue. In the second part, in collaboration with other groups, the candidate has explored the relationships between the presence of variants in genes/loci associated with type 2 diabetes and known to affect the beta cell in vivo (KCNJ11, TCF7L2, HHEX, IGfBP2, CDKAL1,
CDKN2A/2B, CDC123/CAMK1D, WFS1, JAZF1) and the amount of beta cells in
non-diabetic pancreases. This has provided evidence that the higher the number of variants, the lower the area positive for insulin in the islets as well as in the pancreatic tissue. The conclusions are that based on the methods implemented and applied by the candidate to study non-diabetic and type 2 diabetic pancreases, it has been possible to underscore that in human type 2 diabetes there is a significant reduction of beta cell area and that the presence of risk variants in genes/loci associated with this form of diabetes possibly contribute to this reduction.
5
IL DIABETE MELLITO
Definizione, classificazione e diagnosi del diabete mellito
Il diabete mellito (DM) è una delle malattie croniche più comuni e in netto aumento [1].
La sua crescente incidenza sembra essere principalmente associata a cambiamenti nello stile di vita, in particolare dieta ipercalorica, ridotta attività fisica ed obesità [1,2]. La
patologia è ritenuta una delle principali cause di malattie cardio-vascolari e responsabile della diminuzione dell’aspettativa di vita [1,2].
Il diabete comprende un gruppo di malattie metaboliche caratterizzate da iperglicemia, complicanze croniche (retinopatia, nefropatia, neuropatia) e aumentato rischio cardiovascolare; le possibili ripercussioni invalidanti sulla qualità della vita riguardano la perdita della vista, l’insufficienza renale fino alla necessità di dialisi o trapianto, le ulcere e le amputazioni degli arti inferiori, i sintomi di neuropatia vegetativa, gli episodi cardio- e cerebro- vascolari acuti. Le complicanze acute sono costituite dalla cheto-acidosi e dallo scompenso iperglicemico-iperosmolare non chetonico [3].
L’iperglicemia è causata da una ridotta secrezione insulinica, in molti casi combinata con una ridotta azione insulinica sulle cellule bersaglio. Livelli marcati di iperglicemia si associano a poliuria, polidipsia, calo ponderale e visione indistinta. Altre conseguenze dell’iperglicemia cronica sono le alterazioni dell’accrescimento e l’aumentata suscettibilità ad alcune infezioni. Spesso il diabete è associato ad altri fattori di rischio cardiovascolare, come l’ipertensione e la dislipidemia. L’iperglicemia e l’ipertensione sono considerati i determinanti maggiori per lo sviluppo e la progressione delle complicanze cardiovascolari; tuttavia sono fattori modificabili con l’intervento sullo stile di vita e sui farmaci [4].
Classificazione
La classificazione del diabete identifica quattro classi cliniche:
- Diabete di tipo 1 (DMT1) : costituisce il 5-10% di tutti i casi ed è causato dalla distruzione delle cellule β del pancreas, generalmente su base autoimmune in soggetti geneticamente predisposti; ciò che ne deriva è una carenza insulinica che richiede necessariamente terapia insulinica sostitutiva. Il DMT1 mostra una marcata tendenza alla chetoacidosi, presente anche all’esordio della malattia.
6
Nell’ambito di questa forma si riconoscono due sottotipi: il diabete immuno-mediato, comprende il 5-10% di tutte le forme di diabete, è dovuto a distruzione autoimmune cellulo-mediata delle cellule beta pancreatiche; il diabete idiopatico si verifica in una minoranza dei casi, soprattutto in soggetti Africani e Asiatici, e ha un’eziologia sconosciuta.
- Diabete di tipo 2 (DMT2) : costituisce il 90-95% dei casi di diabete e si caratterizza per un difetto progressivo della secrezione insulinica che si aggiunge ad un preesistente difetto dell’azione insulinica; ha scarsa tendenza alla chetoacidosi tuttavia essa può svilupparsi in particolari condizioni di stress (infezioni, traumi gravi, episodi cardiovascolari acuti).
È caratterizzato da due grandi difetti fisiopatologici: l'insulino-resistenza, condizione dovuta a difetti dell’azione insulinica a livello delle cellule epatiche, muscolari scheletriche e adipose, e la compromissione della funzione secretoria delle cellule beta pancreatiche. I due difetti possono variamente combinarsi tra loro. L’insulino-resistenza è, talora, il difetto che compare per primo, e nelle fasi iniziali, può essere compensato da un’ipersecrezione di insulina, tale da mantenere i livelli di glucosio nel sangue entro limiti fisiologici. Tuttavia, nel tempo, le beta cellule vanno incontro a un declino della funzione; questo porta alla comparsa delle prime alterazioni metaboliche, che progrediscono sino a portare all’insorgenza del diabete. Comunque, indipendentemente dalla presenza e dal grado di insulino-resistenza, l’insorgenza e la progressione del diabete mellito di tipo 2 sono determinate dalla disfunzione beta cellulare che può essere sostenuta da una alterazione della secrezione insulinica, da una riduzione della massa beta cellulare, o da una combinazione di entrambe.
Rara è l’insulino-dipendenza (necessità di insulina per la sopravvivenza). Questa forma di diabete è frequentemente associata a obesità o eccesso di tessuto adiposo a distribuzione addominale; il rischio di malattia è conferito da una marcata predisposizione genetica a aumenta al crescere dell’età, in presenza di sovrappeso/obesità, ridotta attività fisica, ipertensione e dislipidemia.
- Diabete gestazionale (GDM) : comprende qualsiasi forma di diabete o alterata regolazione glicemica diagnosticata per la prima volta in corso di gravidanza. La prevalenza varia dall’1 al 14% di tutte le gravidanze ed è in crescita in rapporto all’aumento dell’età media della donna in gravidanza e all’aumento dell’obesità nella
7
popolazione generale; si associa a complicanze materno-fetali prevenibili con un appropriato intervento sull’iperglicemia.
- Altri tipi di diabete: si tratta di forme associate ad altre condizioni o sintomi, come difetti genetici della funzione β-cellulare (rientrano in questa classe tutte le forme di
MODY - Maturity Onset Diabetes Of The Young), queste forme sono caratterizzate da
alterata secrezione insulinica con difetti minimi o assenti nell’azione dell’insulina; difetti genetici dell’azione insulinica dovute a mutazioni nel recettore dell’insulina; diabete secondario a malattie del pancreas esocrino (pancreatite cronica, carcinoma, trauma, infezioni, pancreasectomia) o a malattie endocrine (acromegalia, sindrome di Cushing, glucagonoma, e feocromocitoma (l’eccesso di ormoni quali ormone della crescita, cortisolo, glucagone, adrenalina prodotti in queste patologie antagonizzano l’azione dell’insulina); queste malattie si manifestano soprattutto in soggetti con deficit nella secrezione insulinica preesistenti; diabete indotto da farmaci (alcuni farmaci possono indurre una alterazione del metabolismo glucidico influenzando negativamente la secrezione insulinica, come gli agonisti -adrenergici, o inducendo insulino-resistenza, come i glucocorticoidi); diabete secondario ad infezioni (alcuni virus possono provocare una pancreatite con conseguente distruzione beta cellulare; questo può verificarsi in pazienti con rosolia congenita, infezione da coxsachievirus B, citomegalovirus, adenovirus e paramyxovirus); forme non comuni di diabete immuno-mediato comprendono la sindrome “Stiff-man”, forma di diabete associata alla produzione di anticorpi anti-recettore insulinico; associato a sindromi genetiche quali la sindrome di Down, la sindrome di Klinefelter e la sindrome di Turner.
Altre categorie di alterata regolazione glicemica: IFG e IGT
Le alterazioni della regolazione glicemica di grado inferiore al diabete comprendono l’alterata glicemia a digiuno (IFG) e la ridotta tolleranza al glucosio (IGT) : condizioni intermedie tra la normale regolazione glicemica e il diabete. La prevalenza di IFG e IGT, o di entrambi, è stimata intorno al 20% della popolazione adulta e tende ad aumentare proporzionalmente al crescere dell’età.
Le condizioni di IFG e IGT non si accompagnano ad alcun sintomo o segno clinico; tuttavia rappresentano un oggetto di interesse medico per l’elevato rischio di sviluppare diabete. In tutti i soggetti con IFG o IGT è importante ricercare altri fattori di rischio
8
cardiovascolare e procedere con una loro tempestiva correzione: il miglior risultato è stato ottenuto con interventi sullo stile di vita finalizzati alla riduzione del sovrappeso corporeo e all’aumento dell’attività fisica; anche l’impiego di alcuni farmaci (glitazoni, metformina) è risultato efficace.
Diagnosi di diabete
I criteri per la diagnosi di diabete al di fuori della gravidanza sono riportati nella Tabella 1.
Criteri per la diagnosi di diabete
Diabete: glicemia a digiuno ≥ 126 mg/dL oppure
sintomi legati all’iperglicemia (poliuria, polidipsia, calo ponderale inspiegato) e glicemia casuale (in qualsiasi momento del giorno) ≥ 200 mg/dL
oppure
glicemia due ore dopo OGTT (curva da carico di glucosio totale) 75g ≥ 200mg/dL oppure
emoglobina glicata ≥ 6.5 %
IFG: glicemia a digiuno compresa tra 100 e 125 mg/dL
IGT: glicemia due ore dopo OGTT (75g) compresa tra 140 e 199 mg/dL Tabella 1- Criteri per la diagnosi di diabete, IFG e IGT
Questi criteri devono essere utilizzati indipendentemente dal sesso e dall’età e sono quindi validi sia nei bambini che negli anziani [3,4,5,6]. Per la diagnosi del diabete è necessario e sufficiente il ricorso alla determinazione di laboratorio della glicemia su plasma venoso. Il test più raccomandato è la glicemia a digiuno. La determinazione della glicemia mediante glucometri portatili, validata per l’autocontrollo glicemico nel paziente diabetico, non è raccomandata per la diagnosi di diabete. La diagnosi del diabete non richiede altri test diversi dalla glicemia (chetonuria, insulinemia o C-peptide, test per autoimmunità, test di stimolo secrezione β-cellulare), anche se questi possono essere utili per tipizzare la forma di diabete. La determinazione dell’ emoglobina glicata (HbA1c), comunemente utilizzata come indice di compenso glicemico retrospettivo nel paziente diabetico, è oggi considerata anche per la diagnosi di diabete con metodo analitico standardizzato; come criterio per la diagnosi di diabete viene proposto un valore 6.5%.
9
IL DIABETE MELLITO DI TIPO 2
Il DMT2 è responsabile di circa il 90% di tutti i casi di diabete e deriva da una combinazione di fattori genetici e acquisiti che danneggiano la funzione β cellulare e la sensibilità dei tessuti all’insulina [1,2]. Si sta rafforzando sempre di più l’ipotesi che il
danneggiamento β cellulare possa essere il difetto cruciale per lo sviluppo e la progressione di questa forma di diabete, come dimostrato da vari studi prospettici.
Epidemiologia e impatto socio – sanitario del diabete mellito di tipo 2
Il diabete mellito è una patologia cronica di grande rilievo sociale ed esercita un notevole impatto sulla salute pubblica per l’entità della sua diffusione e la gravità delle sue complicanze.
Dall’analisi di dati internazionali, raccolti dall’Organizzazione Mondiale della Sanità (OMS), emerge un aumento della malattia in ogni parte del mondo.
La patologia diabetica: dati di prevalenza a livello nazionale
Per quanto riguarda il nostro paese, i dati riportati nell’annuario statistico ISTAT 2007 indicano che il 4,6% degli italiani (pari a circa 2 643 000 persone) è affetto da diabete. Si osserva (ISTAT 2007) inoltre che la prevalenza del diabete aumenta con l’età fino al 17,6% nella fascia oltre i 75 anni. Nella fascia di età tra 35 e 74 anni la prevalenza è maggiore fra gli uomini, mentre nella fascia di età oltre i 75 anni è più alta tra le donne. Per quanto riguarda la distribuzione geografica, l’area di prevalenza più alta è il Mezzogiorno, con un tasso del 5,6%, seguita dal centro con il 4,4% e dal Nord con il 4%. Dati più recenti, provenienti dall’ International Diabetes Federation, evidenziano una percentuale pari all’8.8% di soggetti diabetici di tipo 2 con età compresa tra i 20 e i 79 anni.
Prevalenza e incidenza del diabete di tipo 2 in Italia
Nell’ambito della popolazione diabetica i pazienti diabetici di tipo 2 sono la proporzione più rilevante (92%).
La prevalenza del DMT2 è in continua crescita a causa dell’aumento dell’obesità e della sedentarietà ma pone problemi di rilevazione più complessi. La malattia nei primi anni è spesso asintomatica, motivo per cui, non raramente, la diagnosi viene posta nel corso di accertamenti per altre patologie. Da ciò discende che la prevalenza della malattia nota,
10
desumibile da rilievi incrociati sul consumo di insulina e farmaci, dimissioni ospedaliere e centri di diabetologia è stimata intorno al 2,7-3%, mentre indagini di popolazione su ampia scala basate sulla curva da carico di glucosio (OGTT) forniscono percentuali sensibilmente più elevate, tra il 6 e l’11%.
Il fenomeno del DMT2 misconosciuto risulta così molto importante e poiché si associa frequentemente ad altre condizioni, quali obesità, ipertensione, dislipidemia, che concorrono a definire la cosiddetta “sindrome metabolica”, la sua presenza va sempre ricercata nelle persone che presentano una o più componenti di questa sindrome.
Prevalenza e incidenza delle complicanze macrovascolari del diabete di tipo 2 in Italia
Le persone affette da DMT2 presentano un rischio più elevato di sviluppare complicanze macroangiopatiche rispetto alla popolazione non diabetica ed hanno un’aspettativa di vita ridotta indipendentemente dall’età di esordio della malattia.
I dati di incidenza e prevalenza delle complicanze macrovascolari nei pazienti diabetici di tipo 2 in Italia provengono dallo studio DAI, nato dalla collaborazione tra Diainf (gruppo di studio Diabete ed Informatica), Associazione Medici Diabetologi (AMD) e Istituto Superiore di Sanità (ISS). [7] Obiettivo di questo studio di tipo osservazionale e
prospettico è stata la valutazione della prevalenza, dell’incidenza e dei fattori di rischio delle complicanze macrovascolari in pazienti con DMT2 diagnosticato secondo i criteri della World Health Organization (glicemia a digiuno superiore a 140mg/dL in almeno due occasioni, e/o glicemia superiore a 200mg/dL 120 minuti dopo carico orale di glucosio 75g), età superiore ai 40 anni, visitati in 201 servizi di diabetologia dislocati in tutto il territorio nazionale e seguiti dal 1998 al 1999 al 2002-2003. Sono stati indagati gli esiti di infarto del miocardio (IMA), cardiopatia ischemica (coronary heart disease, CHD), trombo-embolie cerebrali , amputazioni, interventi di angioplastica e di by-pass aorto-coronarico ed è stata effettuata l’analisi di rischio di tutte queste complicanze. In una popolazione di 14432 pazienti, il 19,3% dei soggetti presenta una o più complicanze macroangiopatiche (22,2 % negli uomini e 16,4% nelle donne) [8-10]. La
prevalenza di CHD è pari a 8,3% negli uomini e 10,3% nelle donne, di IMA da solo o con interventi di rivascolarizzazione è di 10,8% negli uomini e 3,9% nelle donne, di ictus è 3,4 % negli uomini e 2,6% nelle donne.
11
La prevalenza delle complicanze macroangiopatiche aumenta all’aumentare dell’età raggiungendo il 29,8% nella classe 80-84 anni negli uomini e il 28,2% nella classe sopra gli 85 anni nelle donne.
Analizzando l’andamento della prevalenza per età dei singoli eventi si osserva che, sia negli uomini sia nelle donne, la cardiopatia, rispetto ad altre complicanze, è fortemente associata all’età. La prevalenza di IMA è più elevata negli uomini rispetto alle donne in tutte le classi di età e la diminuzione della prevalenza di IMA e cardiopatia negli uomini con età superiore ai 75 anni è dovuta probabilmente ad un aumento della mortalità causa-specifica. La prevalenza di ictus risulta essere più alta negli uomini in particolare nelle fasce di età più giovani (inferiori ai 65 anni) e in quelle più anziane (maggiore di 85 anni).
Per quanto riguarda il rischio coronarico di questa popolazione, emerge come il rischio medio sia elevato (mediana intorno al 20% a 10anni); in termini pratici, se non trattato, il 45% dei soggetti è atteso sviluppare IMA o ictus a 10 anni [11].
Gli episodi di IMA, gli eventi coronarici maggiori (IMA, interventi di rivascolarizzazione e cardiopatia ischemica fatale) e gli eventi fatali sono significativamente più frequenti negli uomini [12,13]. L’incidenza di ictus evidenzia come
gli eventi cerebrovascolari nel diabete siano, seppur di poco, maggiormente a carico del sesso femminile [14].
I costi del diabete
Tutti i dati riportati dalla letteratura mondiale indicano che il diabete mellito è un patologia molto costosa (sia dal punto di vista sanitario che sociale) e che si possono realizzare risparmi significativi per il Servizio Sanitario, riducendo i costi causati dalle complicanze del diabete, attraverso un trattamento attento ed efficace della malattia. Il costo di qualsiasi malattia è formato da tre elementi:
- La spesa per l’assistenza sanitaria diretta (costi diretti: terapia d’emergenza, le ospedalizzazioni direttamente imputabili alla patologia e per le complicanze , i servizi medici e infermieristici, i trattamenti ambulatoriali e gli interventi chirurgici, i farmaci, gli esami di laboratorio, la strumentazione);
- I costi derivanti da perdita di produzione permanente o temporanea dipendente dalla malattia (costi indiretti: mortalità prematura, i sussidi di invalidità, il mancato guadagno per giornate lavorative perse);
12
- Lo scadimento della qualità di vita, la perdita di tempo libero e il dolore (costi tangibili). Da un progetto denominato CODE-2 (COst of Diabetes in Europe-Type 2) emerge che il costo medio annuo per l’assistenza al paziente diabetico è pari a 2 991 euro, che rapportato all’intera popolazione diabetica di tipo 2, ammonta a 5 170 milioni di euro, rappresentandoo il 6,65% dell’intera spesa sanitaria nazionale, pubblica e privata, in Italia.
Il 39% dei costi sanitari va a quelli sostenuti per il trattamento delle complicanze diabetiche e il 29% a quelli per il trattamento diretto della patologia risultando quindi maggiore il costo delle complicanze rispetto a quello del trattamento [15].Un’attenta
analisi dei dati dimostra come la prevenzione efficace delle complicanze sia un investimento largamente ed economicamente vantaggioso per la comunità [16].
Sulla base dei dati più recenti dell’Osservatorio ARNO-Diabete [17], ogni persona con
diabete costa mediamente al SSN 2 589 euro/anno che corrispondono al 54% in più di quanto il SSN spende per ogni persona senza diabete di pari sesso,età e seguita dallo stesso medico. Il costo dell’assistenza farmaceutica è dell’81% superiore nei soggetti con diabete rispetto alle persone senza diabete, mentre quello dei ricoveri è del 43% superiore. Nello specifico, i pazienti affetti da DMT2 richiedono un costo annuo di 2 337 euro ed è interessante osservare che solo il 18% è relativo al costo dei farmaci antidiabetici e l’82% deriva dall’acquisto di farmaci per patologie collaterali (farmaci del sistema cardiovascolare, per le dislipidemie, antiaggreganti piastrinici).
Secondo l’ International Diabetes Federation (2010) il costo risulta pari a 2 072 euro/anno.
I farmaci ipoglicemizzanti più frequentemente utilizzati, la metformina, le sulfoniluree e le associazioni precostituite sulfoniluree-metformina sono a bassissimo costo, ma altre categorie di antidiabetici orali (glinidi e glitazoni) e gli analoghi dell’insulina hanno prezzi più elevati.
Per quanto riguarda i ricoveri ospedalieri, essi costituiscono la prima fonte di spesa sanitaria nelle persone con diabete e sono quasi tutti motivati dalla comparsa di aggravamento delle complicanze del diabete. Accanto a questo, sono stati riscontrati aumenti di spesa per i ricoveri legati alle complicanze vascolari, sono stati riscontarti aumenti di spesa per ricoveri per patologie tumorali e degenerative, probabilmente legate alle stesse cause che favoriscono l’obesità e il diabete. In media i soggetti costano il 50% in più delle persone senza diabete in termini di DGR ospedalieri.
13
Infine, anche le prestazioni specialistiche ambulatoriali comportano una spesa del 20% superiore nei soggetti con diabete.
Possiamo così concludere che il diabete di tipo 2 è una malattia che si sta diffondendo rapidamente in tutto il mondo, colpendo quasi tutte la fasce d’età, spesso accompagnata alle altre componenti della sindrome metabolica, un cluster di condizioni che comprende l’obesità, l’ipertensione e la dislipidemia aterogena, strettamente legato agli stili di vita non salutari specie delle società occidentali, caratterizzati da iperalimentazione e sedentarietà. È quindi ovvio che la prevenzione del diabete, delle sue complicanze e delle patologie ad esso associate passa attraverso modifiche stabili dello stile di vita, che possono essere ottenute solo coinvolgendo pienamente il paziente in interventi educativi strutturati. Quando la malattia diabetica è conclamata e associata a complicanze , le linee guida [18] di terapia prevedono un trattamento dell’iperglicemia e di tutti i fattori di
rischio cardiovascolare presenti con target terapeutici fortemente costosi; occorre invece investire in prevenzione, per ridurre i costi economici e sociali a lungo termine.
14
IL PANCREAS
Anatomia del pancreas
Il pancreas è un organo ghiandolare situato profondamente nella cavità addominale, al di sotto dello stomaco, tra il fegato e la milza¸ consta di una componente esocrina e di una componente endocrina, si presenta di colore grigio-giallastro e aspetto lobulato (Figura 1). Nell’adulto ha un peso che può variare da circa 85 g nella donna a 100 g nell’uomo (1m); una lunghezza che oscilla da poco più di 10 fino a 20-25 cm; uno spessore di 1,4-4 cm e un’altezza di 3-9cm (2m).
È diviso in tre porzioni principali: la testa,la parte più spessa, situata nell’ansa duodenale, il corpo, separato dalla testa da un restringimento chiamato istmo, e la coda, a contatti nella sua parte terminale con la milza.
Nel complesso il pancreas è sostanzialmente costituito da tessuto esocrino (o acinare, che rappresenta di gran lunga la maggior parte del parenchima) ed endocrino (isole pancreatiche).
Il pancreas consta fondamentalmente di cellule esocrine, endocrine e duttali che, assieme alla componente ematica, coordinano e regolano l’equilibrio metabolico e nutrizionale dell’organismo.
La funzione esocrina è svolta dalle cellule acinari che secernono enzimi digestivi ed altre componenti non-enzimatiche nel duodeno. Le cellule acinari sono localizzate alle estremità di piccoli dotti i quali convergono in dotti via via più grandi fino a formare il dotto pancreatico principale, denominato dotto di Wirsung. Questo ha un decorso orizzontale nella coda e nel corpo, mentre nella testa si muove inferiormente e forma un arco convesso a destra. Spesso riceve un dotto secondario che drena la parte postero-inferiore della testa, compreso il processo uncinato. La parte antero-superiore della testa è in genere drenata dal dotto pancreatico accessorio di Santorini, presente nel 99% delle persone; esso può aprirsi direttamente nel duodeno o anastomizzare con il dotto di Wirsung [19].
La funzione endocrina del pancreas è sostenuta dalle isole di Langerhans, trattasi di piccoli aggregati di cellule distribuite nel contesto del tessuto esocrino. Queste cellule, attraverso il rilascio degli ormoni nel flusso sanguigno, regolano l’omeostasi glucidica. Entrambe le componenti, endocrina ed esocrina del pancreas, originano dall’epitelio endodermico, migrano nel mesenchima circostante e vanno poi incontro a differenziazione [20].
15 Figura 1 - Anatomia del pancreas (McGraw-Hill Companies
Vascolarizzazione e innervazione del pancreas
Il pancreas riceve sangue arterioso da diverse sorgenti. Alla irrorazione della testa provvedono le arcate arteriose pancreatico-duodenali, la dorsale e la ventrale, che si costituiscono per l’unione fra i rami di divisione dell’arteria pancreatico-duodenale superiore e quelli dell’arteria pancreatico-duodenale inferiore. Il corpo e la coda del pancreas ricevono sangue dall’arteria gastro-lienale e dall’arteria pancreatica suprema; quest’ultima, che può nascere dall’arteria celiaca o dalla mesenterica superiore, decorre dietro il corpo del pancreas diretta verso la faccia inferiore e si risolve poi in due rami, il sinistro e il destro [21,22]. All’interno dell’organo, i rami delle arterie pancreatiche si
dividono nelle arterie interlobulari e, infine, in reti capillari intorno agli acini. Le isole di Langerhans ricevono sangue direttamente dalle arteriole che all’interno dell’isola si ramificano in una rete di capillari fenestrati [23]. L’afflusso sanguigno delle isole
rappresenta circa il 10-20% del flusso sanguigno pancreatico totale, una proporzione molto elevata in rapporto al volume occupato dalle isole [24-27].
Il drenaggio venoso avviene attraverso le vene pancreatiche che fanno capo alla vena lienale e alle vene mesenteriche superiore e splenica.
16
I plessi linfatici dell’organo si formano dai capillari periacinari e perilobulari che decorrono vicino ai capillari sanguigni nel tessuto connettivo interstiziale. I tronchi ai quali danno origine fanno poi capo ai linfonodi pancreatico-lienali, connessi con i preaortici [24].
L’innervazione del pancreas è data dai fasci nervosi del plesso celiaco che contengono fibre del sistema simpatico e fibre parasimpatiche del nervo vago. All’interno del pancreas, tali fibre si distribuiscono alla parete dei vasi, altre formano plessi che si applicano alla membrana propria degli acini e si spandono con i rami terminali alla superficie e tra le cellule ghiandolari. Nelle isole, il sistema colinergico stimola la secrezione di insulina, glucagone e polipeptide pancreatico ed ha un effetto verosimilmente inibitorio sul rilascio di somatostatina; la stimolazione β-adrenergica induce rilascio di insulina, glucagone, somatostatina e polipeptide pancreatico, mentre la stimolazione -adrenergica inibisce la secrezione di insulina e somatostatina e induce il rilascio di glucagone [28-32].
Embriologia del pancreas
Molti delle informazioni relative allo sviluppo embriologico del pancreas derivano da studi condotti sui roditori [33]. In questo modello sperimentale i primi abbozzi del
pancreas, le evaginazioni dorsale e ventrale del foglietto endodermico, localizzate distalmente allo stomaco, compaiono durante il periodo embrionale E10.5 (10.5 giorni dopo il concepimento), corrispondente alla 4°-5° settimana di gestazione nella specie umana. Durante il periodo embrionale E11 ( 5° settimana di gestazione nell’uomo), l’evaginazione dorsale cresce e la ventrale ruota dorsalmente all’intestino, in direzione del pancreas dorsale. Dopo la migrazione del pancreas ventrale e la rotazione del duodeno, durante il periodo E12.5 (e l’inizio della 6° settimana di gestazione nell’uomo), le due evaginazioni si trovano in stretta prossimità. Durante il periodo E14.5 (e la fine della 7° settimana), le due evaginazioni si fondono e il sistema duttale si anastomizza [33].
Dall’evaginazione ventrale si formerà la porzione posteriore della testa del pancreas, mentre, dall’evaginazione dorsale si formerà la porzione più ampia del pancreas, comprendente parte della testa, tutto il corpo e la coda.
Per quanto riguarda la comparsa di cellule producenti ormoni, gruppi di cellule insulino-positive sono state individuate nel pancreas umano già dopo 10 settimane dal concepimento [34]. Alla 12°-13° settimana di gestazione sono state trovate cellule
17
indipendentemente immunoreattive per insulina, glucagone, somatostatina e polipeptide pancreatico [34]. Le cellule esocrine, endocrine e duttali si formano dall’epitelio
endodermico, la muscolatura liscia e il tessuto connettivo derivano dal mesenchima [35].
Pancreas esocrino
L’unità morfologica del pancreas esocrino è il lobulo, costituito da acini separati da tessuto connettivo. Gli acini hanno un aspetto tipicamente sferoidale, sono composti da cellule acinari connesse le une alle altre dalle giunzioni strette, si trovano all’estremità distale di una fitta rete di dotti ai quali si connettono attraverso le cellule centro acinari. Le cellule acinari hanno forma piramidale e, all’estremità apicale, presentano un esteso apparato secretorio costituito da reticolo endoplasmico rugoso e numerosi granuli di zimogeno; questi ultimi contengono gli enzimi digestivi amilasi, proteasi, nucleasi e lipasi. Gli enzimi, prodotti e secreti dalle cellule acinari come proenzimi inattivi, attraverso il sistema duttale raggiungono il duodeno [36], dove vengono attivati mediante
proteolisi. I dotti, deputati al trasporto del secreto pancreatico, sono delimitati da cellule epiteliali, che producono e secernono un fluido ricco di mucina e bicarbonato, la cui funzione, una volta raggiunto il duodeno, è quella di neutralizzare il prodotto acido dello stomaco [37]. A livello della parete duttale è talora possibile repertare cellule endocrine
sparse; sulla base di questa osservazione è stato ipotizzato che a livello dei dotti ci sia una popolazione di precursori cellulari dai quali potrebbero differenziarsi sia cellule endocrine che esocrine [38-40].
Pancreas endocrino
La funzione endocrina del pancreas è sostenuta da diversi tipi cellulari contenuti nelle isole di Langerhans. Queste strutture sono state identificate per la prima volta nel 1869 dal medico tedesco Paul Langherans: trattasi di aggregati cellulari costituiti fondamentalmente da quattro tipi di cellule: le cellule beta, le cellule alfa, le cellule delta e le PP (chiamate anche cellule gamma). Le diverse cellule endocrine differiscono tra loro per le caratteristiche citologiche e per la numerosità, oltre che per la funzione. Le cellule beta sono il tipo cellulare maggiormente rappresentato, secernono insulina in risposta al glucosio e alla stimolazione aminoacidica [41]. Queste cellule hanno una forma
poliedrica di piramide tronca; caratteristicamente, contengono granuli di insulina aventi un diametro compreso tra 250 e 300 nm, si ritiene che una beta cellula umana contenga
18
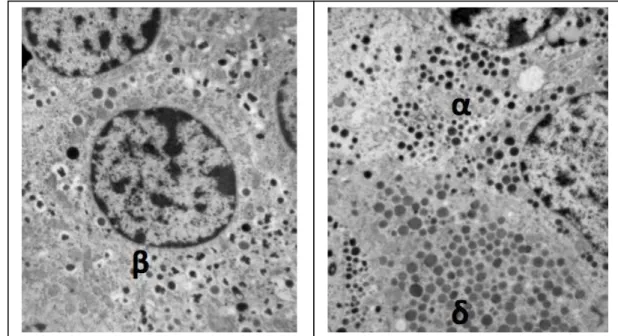
da 4 000 a 10 000 granuli. Questi possono essere distinti in granuli maturi, che presentano un core elettrondenso circondato da un alone chiaro, e granuli immaturi aventi, questi ultimi, un contenuto moderatamente elettrondenso e un alone meno appariscente. I granuli immaturi sono la sede dove avviene il processo di conversione enzimatica della pro-insulina a insulina e la formazione dei cristalli esamerici di insulina (Figura 2) [42-44].
Le cellule alfa hanno aspetto colonnare, sono generalmente più piccole delle cellule beta, contengono granuli secretori di glucagone, del diametro di 200-250 nm e aspetto elettropaco.
Le cellule delta sono più piccole sia delle cellule alfa che delle beta, hanno un aspetto dendritico, possiedono granuli di somatostatina che sono più grandi e meno elettropachi dei granuli delle alfa cellule.
Le cellule PP sono il tipo cellulare più variabile nelle diverse specie, contengono granuli allungati, elettrondensi, del diametro di 120-160 nm.
Figura 2 - Immagini di cellule endocrine insulari ottenute mediante microscopia elettronica. A sinistra è riportata l’immagine di una beta cellula umana; si apprezza il nucleo al centro e il citoplasma contenente i granuli che presentano un core centrale elettrondenso circondato da un
alone opaco. A destra è riportata l’immagine di una cellula alfa con granuli elettropachi e una cellula delta (Masini M.).
19
Nelle isole pancreatiche umane le cellule beta costituiscono il 70-80% della componente cellulare totale, le cellule alfa circa il 15-20%, le cellule delta il 5%, mentre le cellule PP sono presenti in piccola percentuale, circa l’1%. All’interno dell’isola le cellule endocrine hanno una distribuzione variabile a seconda della specie; nella maggior parte dei mammiferi le cellule beta giacciono al centro dell’isola e sono circondate da un sottile strato di cellule alfa o PP, e cellule delta [45]. Nell’uomo e negli altri primati,
questa separazione cellulare è meno definita, e le cellule alfa, beta e gamma sembrano avere una distribuzione casuale all’interno dell’isola [46].
Le isole possono avere dimensioni variabili, comprese tra 50 e 300 m; tuttavia, il diametro medio di un’isola è di 100-150 m; un’isola di queste dimensioni contiene circa 1 000 cellule beta. A seconda delle dimensioni, le isole possono presentare una composizione cellulare diversa; in particolare, le isole di piccole dimensioni contengono in prevalenza beta cellule e solo poche cellule non-beta, al contrario, nelle isole di dimensioni maggiori la componente non-beta cellulare è ben rappresentata, soprattutto da cellule alfa.
Il pancreas umano contiene un numero di isole variabile da 500 000 a 1 000 000 [47],
queste rappresentano l’1-2% del parenchima pancreatico totale. Per quanto riguarda la loro distribuzione nel pancreas, è stato riportato che queste sarebbero più numerose a livello della coda dell’organo rispetto al corpo e alla testa [47], successivamente è stato
invece rilevato che le differenze topografiche tra testa, corpo e coda non sarebbero dovute alla numerosità delle isole [47], bensì al loro volume [48]. In particolare, la
porzione di pancreas prossima al duodeno conterrebbe isole piuttosto piccole, mentre progredendo verso la estremità splenica dell’organo aumenterebbe la proporzione di isole più grandi [48]; fatto questo che contribuisce a determinare il gradiente insulare tra corpo
e coda [48]. Per quanto riguarda la distribuzione cellulare, la porzione di pancreas
corrispondente alla parte superiore della testa, corpo e coda, derivata dall’evaginazione dorsale, presenta isole ricche di cellule alfa e povere di cellule PP; mentre, la porzione di pancreas corrispondente alla parte inferiore della testa e processo uncinato, derivata dall’evaginazione ventrale, presenta isole povere di cellule alfa e ricche di cellule PP
20
LE CELLULE BETA
La beta cellula è il tipo cellulare maggiormente rappresentato all’interno delle isole di Langerhans, che costituiscono la componente endocrina del pancreas. Le isole pancreatiche, nell’uomo, ammontano a circa 2 milioni e sono disperse all’interno del pancreas esocrino, organizzate intorno a piccoli capillari nei quali secernono gli ormoni sintetizzati. Queste cellule sono localizzate principalmente al centro dell’isola, circondate dagli altri tipi cellulari, distinguibili tra loro per la diversa morfologia e per le diverse proprietà tintoriali. In risposta a vari stimoli di natura ormonale, nervosa e nutritizia, le cellule beta liberano l’ormone insulina con lo scopo di mantenere le concentrazioni plasmatiche di glucosio in un range molto ristretto, tale da permettere il funzionamento ottimale dei tessuti dell’organismo; tuttavia, in particolari condizioni, quali il digiuno prolungato o l’assunzione di cibo, si può assistere a più ampie oscillazioni di tale intervallo di normalità [51].
È stato calcolato che in un’isola di medie dimensioni (100-150 micron) ci sono circa 1000 cellule β, caratterizzate dalla presenza dei tipici granuli contenenti insulina.
La normale funzione beta cellulare dipende essenzialmente dall’integrità dei meccanismi che regolano la sintesi e il rilascio dell’insulina, nonché dalla massa complessiva delle cellule beta.
Il regolatore più importante della secrezione insulinica è il glucosio, anche se altri nutrienti od ormoni, neurotrasmettitori e farmaci possono influenzare il rilascio dell’ormone.
Dal punto di vista dinamico, il rilascio di insulina da parte della β cellula in risposta al glucosio riconosce principalmente una prima fase, rapida, della durata di pochi minuti, e una seconda fase, più prolungata [52,53]. Quando i valori della glicemia a digiuno si
mantengono nel range di normalità, la secrezione dell’insulina è minima, nell’ordine di 25 ng/min/Kg di peso corporeo nell’uomo; tuttavia, quando si verifica un incremento repentino della concentrazione plasmatica di glucosio, che aumenta di 2-3 volte e si mantiene su questi livelli, la secrezione insulinica aumenta in maniera significativa. Tale processo si esplica in due fasi distinte: la fase precoce e la fase tardiva [54].
La fase precoce si verifica entro 3-5 minuti dall’innalzamento della glicemia ed è attribuibile al rilascio dell’insulina preformata ed immagazzinata nei granuli secretori maturi, la quale viene immediatamente immessa in circolo. La quantità complessiva d’insulina secreta nella prima fase in risposta ad uno stimolo acuti fisiologico (per
21
esempio un pasto) o farmacologico (per esempio una sulfonilurea) rappresenta solo una piccola frazione (2-5%) dell’insulina contenuta all’interno dei granuli.
Il forte aumento iniziale della secrezione insulinica (circa 10 volte) si riduce di circa la metà nei successivi 5-10 minuti; infatti, dopo circa 15 minuti dallo stimolo iniziale, la secrezione si innalza una seconda volta (fase tardiva), raggiungendo in 2-3 ore un nuovo plateau. Tale aumento è dovuto sia alla liberazione di altra insulina preformata sia all’attivazione della sintesi insulinica e successiva liberazione dalle cellule beta.
Caratteristico di questa seconda fase è il fatto che la secrezione insulinica non è stabile ma si esplica in maniera pulsatile anche se la concentrazione del glucosio non subisce fluttuazioni. Inoltre, la pulsatilità della secrezione insulinica va di pari passo con le oscillazioni della concentrazione di Ca2+ nelle isole pancreatiche [55].
Per quanto riguarda la massa beta cellulare, i principali meccanismi che la regolano sono l’apoptosi (morte cellulare programmata), le dimensioni delle singole beta cellule, la replicazione (mitosi di cellule β pre-esistenti) e la neogenesi (formazione di cellule beta da precursori) [56].
Non è ancora ben noto quanto sopravviva una cellula beta ma si pensa alcuni anni (da 2 a 5). È noto invece che nei primi anni di vita la massa beta cellulare aumenta notevolmente, grazie a fenomeni di replicazione e di neogenesi. Successivamente, si raggiunge una sorta di equilibrio, che viene poi solitamente mantenuto durante la vita adulta [57,58]. Con l’avanzare dell’età, i processi apoptotici tendono a prevalere su quelli
rigenerativi e la massa cellulare si riduce leggermente.
In caso di necessità (ad esempio riduzione della sensibilità all’insulina, gravidanza), le cellule beta sono in grado di adattarsi alle nuove circostanze. In particolare, in caso di sovrappeso/obesità, l’insulino-resistenza che ne deriva viene compensata da un accentuato tasso di replicazione e neogenesi e dall’aumento di dimensioni delle singole β-cellule [57].
Le cellule β nel diabete di tipo 2
Fattori genetici e acquisiti determinano il danno di funzione e di massa della beta cellula nel DMT2 [52,58,59,60].
Numerosi geni sono stati associati ad alterazioni beta cellulari e tra questi ci sono geni che codificano per fattori di trascrizione , per proteine coinvolte nel metabolismo del glucosio o per molecole implicate nel segnale insulinico [62].
22
La glucotossicità (danni indotti da elevate concentrazioni di glucosio) e la lipotossicità (danni dovuti ad alte concentrazioni di acidi grassi) sono i fattori acquisiti maggiormente studiati [59,62,63,64]. È stato dimostrato che queste condizioni “dismetaboliche” inducono
alterazioni della secrezione insulinica, aumentata apoptosi, modifiche della trascrizione di geni importanti per la beta cellula [59,62]; inoltre, questi processi interferiscono con
quelli rigenerativi beta cellulari [63,64].
Dal punto di vista funzionale, il comportamento della secrezione insulinica da parte della beta cellula nel diabete di tipo 2 è variabile, con livelli di insulinemia che, in termini assoluti, possono essere aumentati, ridotti o normali, ma che, in relazione alle concentrazioni circolanti di glucosio, sono, per definizione, insufficienti a garantire una normale glicemia.
Il difetto funzionale più precoce è la progressiva riduzione, fino alla scomparsa, della prima fase della secrezione insulinica cui si può aggiungere un deficit a carico della seconda fase del rilascio dell’ormone [59,62,63,64,65].
Rilevante è il fatto che la secrezione insulinica in risposta a stimoli diversi dal glucosio (ad esempio arginina e sulfoniluree) è parzialmente conservata, sia nella quantità sia nella dinamica, anche a vari anni dalla diagnosi, dimostrazione del fatto che, nelle cellule beta del paziente diabetico di tipo 2, i granuli che contengono l’ormone ci sono ancora e sono pronti ad essere rilasciati al di fuori della cellula, ma il glucosio non riesce a far giungere il giusto segnale [66,67].
Dal punto di vista dinamico, oltre alle alterazioni a carico della prima fase della secrezione insulinica, nel DMT2 sono presenti dei difetti della normale pulsatilità del rilascio dell’ormone: diversi studi hanno dimostrato che le isole diabetiche mantengono una pulsatilità del loro rilascio di insulina ma l’ampiezza delle oscillazioni è ridotta rispetto a quella delle isole di controllo, soprattutto in risposta al glucosio [68].
Un aspetto ulteriore relativo al deficit funzionale della beta cellula nel DMT2 è l’aumentato rapporto tra proinsulina e insulina; nelle cellule beta, la proinsulina è convertita a insulina a C-peptide in modo tale che nel granulo maturo la quantità di proinsulina sia minima (inferiore al 10%). In caso di DMT2, probabilmente, la beta cellula non riesce a procedere in modo adeguato alla trasformazione della proinsulina, che viene quindi rilasciata in quantità significativamente più elevata [59,62].
Infine, nel diabete di tipo 2, si osserva un riduzione della massa beta cellulare.
[57,59,60,62,63,69]. Ciò dipende da una riduzione del numero totale di isole nel pancreas e da
23
della massa beta cellulare sembrano essere un’aumentata apoptosi non compensata da un adeguato tasso di formazione di beta cellule attraverso i processi rigenerativi. Inoltre, la quantità dei granuli di insulina è ridotta significativamente nelle cellule beta diabetiche, rispetto a quelle di controllo.
Si può quindi affermare che le alterazioni delle beta cellule pancreatiche, nel DMT2, sono di tipo qualitativo e quantitativo e caratterizzate dalla incapacità di rispondere in maniera congrua ai secretagoghi (glucosio), dalla perdita della normale dinamica del rilascio insulinico, dall’aumento del rapporto proinsulina/insulina e dalla riduzione della massa beta cellulare.
Ruolo della massa beta-cellulare
La funzione delle beta cellule è quella di secernere insulina così da mantenere i livelli plasmatici di glucosio in uno stretto intervallo di concentrazione fisiologica compreso tra 65 e 110 mg/dl. La normale funzione beta cellulare dipende sia dall’integrità dei meccanismi che regolano la sintesi e il rilascio dell’insulina, sia dalla massa complessiva delle cellule beta.
La massa pancreatica beta cellulare è regolata da quattro fattori principali: la replicazione beta cellulare (divisione mitotica di cellule beta preesistenti), le dimensioni beta cellulari, la neogenesi (origine di nuove cellule beta da cellule epiteliali duttali) [70-72] e l’apoptosi [71,73,74]. Il contributo di questi fattori è variabile, e può cambiare nel corso della vita o
quando la massa beta cellulare deve adattarsi a condizioni metaboliche particolari, come l’obesità e la gravidanza (Figura 3). Gli studi sui meccanismi che regolano la massa beta cellulare sono stati condotti, per lo più, nei roditori, e anche in questi modelli animali hanno risentito delle limitazioni tecniche dovute al fatto che marcatori di divisione cellulare, quale la Ki-67, compaiono in una breve fase del ciclo cellulare e la loro valutazione potrebbe portare ad una sottostima dell’incidenza delle cellule replicanti. Analogamente, le cellule apoptotiche e necrotiche sono efficientemente rimosse dall’attività dei macrofagi in vivo, pertanto l’esistenza di cellule apoptotiche, specialmente quando valutate su sezioni pancreatiche ex-vivo, potrebbe non essere facilmente apprezzata. La neogenesi, misurata come quantità di cellule insulino-positive nell’epitelio duttale, è relativamente rara e per rilevarla è necessaria l’analisi di molteplici sezioni di pancreas. Questi studi sono particolarmente complessi nell’uomo, per i quali l’unico materiale disponibile è costituito da campioni autotpici, biopsie pancreatiche, o tessuto ottenuto da donatori multiorgano. Nonostante le difficoltà tecniche, studi condotti
24
sia sull’uomo [70,75,76] che sui roditori [77,78], hanno consentito di elaborare un modello di
crescita e mantenimento della beta cellula nel periodo post natale. In circostanze normali, subito dopo la nascita, si verifica un picco transitorio di replicazione beta cellulare, seguito da un aumento transitorio della neogenesi beta cellulare [77]. In una fase tardiva
del periodo neonatale è stato osservato un modesto grado di apoptosi che contribuisce al rimodellamento delle isole. Durante questo periodo il tasso di apoptosi è comunque basso, ne deriva un incremento netto della massa beta cellulare. Queste osservazioni derivano soprattutto da studi su roditori; si ritiene, comunque, che un simile picco di crescita beta cellulare post-natale si verifichi anche nell’uomo [77]. Durante l’infanzia e l’adolescenza, i tassi di replicazione, neogenesi e apoptosi beta cellulare calano drasticamente, si raggiunge una sorta di equilibrio che viene mantenuto durante la vita adulta. In età senile, la massa beta cellulare tende a ridursi per una prevalenza della apoptosi sui fenomeni della replicazione e neogenesi. Nell’adulto la spettanza di vita di una cellula beta non si conosce esattamente, si ritiene, comunque, che sia di anni.
La massa beta cellulare ha la capacità di adattarsi ai cambiamenti del carico metabolico. Un esempio è dato dalla gravidanza: studi su roditori hanno evidenziato che, durante la gestazione, la popolazione beta cellulare materna può raddoppiare per compensare l’insulino-resistenza che si associa alla gravidanza [79]. Un tale adattamento è verosimile che si verifichi anche nell’uomo [79]. L’adattamento della massa beta cellulare alla condizione di insulino-resistenza che si verifica in gravidanza è sostenuto da un aumento della replicazione beta cellulare indotta dalla prolattina e dal lattogeno placentare [79]. Dopo il parto, il tasso di replicazione beta cellulare diminuisce e si verifica un aumento dei fenomeni apoptotici, che assicurano il ripristino della massa beta cellulare ai livelli pre- gravidici [77].
Un’altra condizione di sovraccarico metabolico che condiziona la massa beta cellulare è l’obesità in cui si verifica insulino-resistenza, questa condizione si associa ad un aumento della massa beta cellulare verosimilmente sostenuta sia dalla neogenesi, che dall’ipertrofia beta cellulare [70,80]. Un lieve aumento dell’apoptosi beta cellulare è stato osservato in soggetti obesi non diabetici [70]; comunque, in questa condizione, anche in presenza di apoptosi, l’aumento della replicazione e della neogenesi beta cellulare, e l’aumento di dimensioni delle cellule beta, portano ad un aumento netto della massa beta cellulare.
25 Figura 3- Grafico dei cambiamenti della massa beta cellulare in funzione dell’età,
in condizioni fisiologiche e patologiche.
Nel diabete mellito di tipo 1 è presente un deficit più o meno totale dei secrezione di insulina, dovuto alla distruzione autoimmune delle cellule beta. Nel diabete di tipo 2 la riduzione della secrezione insulinica è condizione necessaria per lo sviluppo e la progressione dell’iperglicemia. In questa forma di diabete, infatti, si ritiene che , a causa di fattori genetici e ambientali, inizialmente si sviluppi una condizione di insulino-resistenza, compensata per periodi variabili di tempo da una aumento della secrezione insulinica.
Nel diabete mellito di tipo 2 fattori genetici e acquisiti, non del tutto noti, concomitano nel determinare la riduzione della massa delle beta cellule. Ciò dipende da una riduzione del numero totale di isole nel pancreas e da una diminuzione delle beta cellule nelle isole.
Studi di morfometria
Nonostante la quantificazione delle β cellule del pancreas umano sia compito non facile, è possibile condurre studi morfometrici per determinare la quantità di isole nel pancreas non-diabetici e DMT2 e valutare l’area beta cellulare insulino-positiva (nelle isole o nel pancreas), il volume beta cellulare (assumendo le cellule come sferiche) e la massa beta cellulare (se disponibile il peso del campione di pancreas).
26
Comunemente, la quantità di beta cellule è ridotta nel diabete di tipo 2.
Diversi studi riportano che il numero totale delle isole è approssimativamente ridotto del 30% nei campioni pancreatici istologici di soggetti con DMT2 comparato a quello di individui non diabetici [81]. Risulta inoltre confermato che anche il volume beta cellulare è inferiore del 30-40% nelle isole DMT2 [82]. Infine, si può rilevare una riduzione del 24% dell’area beta cellulare nei campioni pancreatici di pazienti con diabete di tipo 2 [83,84].
Confrontando soggetti con glicemia alterata a digiuno e individui non diabetici (il gruppo era suddiviso in soggetti magri e obesi, in accordo con i valori di BMI- Body Mass Index) [85] risulta che i soggetti obesi con alterata glicemia a digiuno (IFG) o diabetici hanno una riduzione del 40-60% del volume beta cellulare rispetto ai casi non diabetici. Questo era causato da una diminuzione del numero di beta cellule anziché da modifiche della dimensione delle isole. Nel gruppo non obesi, il diabete era associato ad una diminuzione del 41% del volume beta cellulare. I casi DMT2, inoltre, avevano un’ aumentata frequenza di depositi di amiloide nelle isole, (il processo che porta alla formazione di amiloide inizia da un polipeptide associato alle isole, IAPP o amilina, secreto dalle β cellule) fenomeno che può contribuire alla morte di beta cellule [86].
Risultati pubblicati più recentemente [87] hanno confermato che la massa beta cellulare è ridotta (30%) nei casi di diabete. Inoltre, il numero di beta cellule è direttamente correlato al BMI e, inversamente, alla durata del diabete, e il tipo di terapia anti-diabetica non influenza la massa beta cellulare. Inoltre, dalla’analisi di dati morfometrici ottenuti da pancreas di soggetti magri e obesi (soglia BMI: 27 Kg/m2) diabetici e non [88], è stato rilevato che il volume beta cellulare era ridotto del 36% nei casi obesi DMT2 e non era influenzato dalle condizioni di diabete nei soggetti magri.
Nel complesso, i dati disponibili forniscono una forte evidenza del fatto che la quantità di beta cellule è significativamente ridotta nei pazienti con diabete di tipo 2.
Morte β cellulare
La perdita beta cellulare nel DMT2 sembra essere principalmente dovuta ad’aumentata apoptosi [85,88,89]. L’apoptosi è un tipo di morte cellulare morfologicamente caratterizzata da arrotondamento cellulare, formazione di vescicole e condensazione della cromatina. Difatti, nei campioni autoptici, l’apoptosi risulta aumentata negli obesi e nei magri DMT2 rispetto ai casi di controllo [85]. È stato osservato che l’apoptosi beta cellulare è 3 volte maggiore nei pazienti diabetici obesi, mentre le condizioni di diabete
27
non influenzano l’apoptosi negli individui magri [88], risultato confermato da studi di microscopia elettronica [89]; anche valutazioni su frammenti di DNA evidenziano che l’aumento della morte cellulare nelle isole raddoppiava in quelle di pazienti diabetici [90]. Questi cambiamenti erano accompagnati da un maggior numero di cellule positive alla caspasi 3 attivata [91], nonchè da una maggior attività delle caspasi 3,8 (queste proteine sono molecole chiave nell’induzione dell’apoptosi) [90].
Sono stati descritti altri modelli di morte cellulare [92], uno dei quali è l’autofagia, che non prevede la condensazione della cromatina ma vacuolizzazione del citoplasma [92,93]. In generale l’autofagia ha un ruolo benefico per la cellula per il fatto che regola il turnover delle proteine “aged” ed elimina strutture e organelli danneggiati [94]. Cellule che subiscono un’alterata autofagia possono essere condotte verso una morte di tipo apoptotico [92,93]. Recentemente è stata studiata l’autofagia in cellule beta di pazienti DMT2 e non: sono stati confermati, nelle isole beta dei diabetici rispetto ai controlli, aumentata morte cellulare e cambiamenti morfologici tipici dell’apoptosi [95].
Si può così concludere che la morte beta cellulare aumenta nei pazienti con diabete di tipo 2 e che essa è causata da apoptosi e possibile autofagia.
Rigenerazione beta cellulare
La rigenerazione beta cellulare si verifica per replicazione (proliferazione) di cellule pre-esistenti o per neogenesi da precursori. Normalmente, le cellule insulino-positive appaiono, nel pancreas umano, intorno all’ottava settimana di gestazione e, a 10 settimane dalla nascita, tutti i clusters contenenti più di 10 cellule insulino-positive sviluppano una stretta relazione con le strutture vascolari [96]; dopo altre 2-3 settimane, le
isole fetali umane contengono cellule e sono indipendentemente immunoreattive all’insulina, al glucagone, alla somatostatinae al polipeptide pancreatico [96]. Durante lo
sviluppo prenatale si osserva un aumento lineare dell’area beta cellulare, che raggiunge il 3% alla nascita [97]. La proliferazione beta cellulare è notevole durante la vita fetale,
aumentando ancora dalla nascita all’età adulta, a causa della crescita della dimensione delle isole. Il tasso relativo di crescita beta cellulare è massimo nell’infanzia e declina gradualmente proseguendo nell’età adulta [97-99]. Dopo i 20-30 anni di età, l’ indice di
replicazione beta cellulare sembra essere trascurabile. Diversi studi hanno concluso che, nell’uomo, le cellule beta sono completamente formate al’età suddetta; tuttavia, la massa beta cellulare può aumentare nel’età adulta in associazione a obesità o gravidanza. Ciò è stato dimostrato da diversi studi che mettevano a confronto soggetti obesi e non [85]:
28
soggetti obesi non diabetici (BMI:35 Kg/m2) presentavano un aumento del 50% del volume beta cellulare rispetto a soggetti magri non diabetici (BMI: 23 Kg/m2): l’apoptosi e la replicazione non mostravano differenza significative nei due casi e l’aumento di massa beta cellulare era attribuito ad una maggiore neogenesi e, indirettamente, da un aumentato numero di cellule insulino-positive su un dotto o vicino ad esso [85].
Anche lo stato di gravidanza è associato ad un notevole aumento di beta cellule, ma, per ragioni ovvie, i dati sono scarsi. Tuttavia, sono stati effettuati studi morfometrici relativi a isole pancreatiche durante la gestazione umana: sono stati analizzati pancreas ottenuti in seguito ad autopsia da donne decedute durante la gravidanza ed è risultato che l’area β cellulare aumentava di circa l’1,4% rispetto a donne non in gravidanza [100]. La media
delle dimensioni delle beta cellule non era differente e, durante la gravidanza, si osservavano isole più piccole piuttosto che un aumento delle loro dimensioni o della quantità di beta cellule per isola. Non erano stati rilevati né aumento della beta replicazione né variazioni nell’apoptosi, ma un aumento di dotti insulino-positivi e di cellule beta sparse. Interessante è il fatto che, in caso di diabete gestazionale, si assiste ad una riduzione dell’area totale insulinica, non a causa di un aumento di apoptosi bensì ad una ridotta rigenerazione [101].
Nelle isole DMT2, l’aumentata morte cellulare, discussa sopra, non è adeguatamente compensata da fenomeni rigenerativi. Analizzando campioni autoptici, è stato riportato che non esiste una differenza significativa nella frequenza di replicazione beta cellulare (staining con Ki67) tra gli obesi non diabetici e i DMT2 o i magri non diabetici e i DMT2
[85]. In modo simile, se la neoegenesi viene quantificata indirettamente tramite i dotti
cellulari immunoreattivi all’insulina, non si rilevano differenze tra gli obesi o i magri non diabetici e i DMT2 [85].
Risultati leggermente dissimili sono stati ottenuti esaminando la replicazione β cellulare tramite PCNA staining (Proiferating Cell Nuclear Antigen), da cui si ricavava [88] che
l’indice di proliferazione diminuiva negli obesi, ma non nei non obesi DMT2.
Al momento, non sono presenti studi che descrivono in modo dettagliato, e soprattutto preciso, la rigenerazione beta cellulare nell’uomo. Tuttavia, è stato possibile osservare che la rigenerazione beta cellulare può o meno essere ridotta in maniera significativa nel diabete di tipo 2. Chiaramente, anche se presente, la replicazione beta cellulare e/o la neogenesi non sono sufficienti a coprire l’aumento di cellule che risultano morire in questa forma di diabete.
29
Ruolo della funzione β cellulare
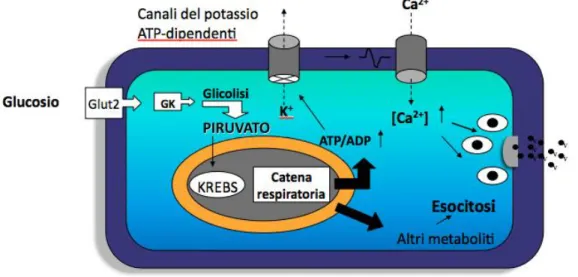
Il glucosio è l’unico zucchero d’importanza fisiologica per il controllo della secrezione insulinica. Il suo ingresso nelle beta cellule è mediato da specifici gluco-trasportatori (GLUT2 e nell’uomo anche GLUT1); una volta all’interno delle cellule, il glucosio viene fosforilato in posizione 6 ad opera della glucochinasi (GK, esochinasi IV) e in questa forma fosforilata viene indirizzato alla via glicolitica. La molecola di piruvato che alla fine ne deriva entra nel mitocondrio, dove viene convertito in acetil-CoA e, come tale, entra nel ciclo degli acidi tricarbossilici, dove si formano i nucleotidi ridotti FADH2 e NADH; questi entrano nella catena respiratoria dove, attraverso la cessione di elettroni, contribuiscono alla produzione di ATP. Con l’aumento della concentrazione ematica e, quindi, intracellulare del glucosio, aumenta anche il rapporto ATP/ADP all’interno della beta cellula. Questo determina la chiusura, a livello della membrana plasmatica, dei canali del potassio ATP-dipendenti, cui fa seguito la depolarizzazione della membrana e l’apertura dei canali del calcio voltaggio-dipendenti; l’ingresso degli ioni calcio nella cellula induce l’esocitosi dei granuli di insulina(Figura 4) [102,103].
Figura 4- Meccanismo di secrezione dell’insulina nella cellula beta (P.Marchetti et al., Regulatory Peptides, 2008)
30
Le cellule beta sono in grado di rispondere anche a sostanze diverse dal glucosio come alcuni aminoacidi, tra cui l’arginina e farmaci del gruppo delle sulfoniluree. A concentrazioni fisiologiche i singoli aminoacidi sono inefficaci, ma la loro combinazione, in proporzioni corrispondenti a quelle riscontrate nel circolo, ha un effetto stimolatorio
[104,105]. Gli effetti degli aminoacidi sulle cellule beta derivano, verosimilmente, da una
azione combinata che coinvolge sia meccanismi metabolici che biofisici. Questi, infatti, essendo poco metabolizzati dalle cellule insulari [106,107], portano ad un accumulo di
cariche positive all’interno della cellula [108,109] cui consegue la depolarizzazione della
membrana. Tuttavia, la capacità degli aminoacidi di indurre la secrezione insulinica è dipendente dalla presenza di glucosio [110].
Per quanto riguarda i farmaci, le sulfoniluree sono gli ipoglicemizzanti comunemente usati nel trattamento dei pazienti affetti da diabete mellito di tipo 2. Queste molecole, chiudendo i canali del K+ ATP-dipendenti sono in grado di indurre un aumento del rilascio insulinico (Figura 5).
La chiusura del canale non determina un cambiamento nel metabolismo della cellula beta ma è il risultato di una diretta interazione della molecola con SUR1, l’unità proteica regolatrice del canale [111-114]. Tutte le sulfaniluree hanno un meccanismo d’azione
simile ma differiscono per loro affinità per la subunità SUR1. In generale i composti con più alta affinità per il recettore, come ad esempio la glibenclamide, mostrano maggiore potenza ma anche minore reversibilità nella stimolazione della secrezione insulinica
[115,116].
Figura 5 - Meccanismo d’azione della glibenclamide e dell’arginina sulla secrezione dell’insulina.