INDICE
INDICE pag. 1
INTRODUZIONE pag. 2
CAPITOLO 1. Epidemiologia e vie di diffusione pag. 5
1.1 Incidenza pag. 5
1.2 Eziopatogenesi pag. 6
1.3 Meccanismi patogenetici delle metastasi ossee pag. 6 1.4 Reazione ossea: osteolisi ed osteogenesi pag. 9
CAPITOLO 2. Il Carcinoma tiroideo pag. 12
2.1 Epidemiologia pag. 12
2.2 Eziopatogenesi pag. 14
2.3 Anatomia patologica pag. 16
2.4 Diagnosi clinica e strumentale pag. 17
2.5 Diagnostica per immagini e medico-nucleare pag. 20
2.6 Trattamento pag. 26
2.7 Follow-up pag. 31
2.8 Trattamento della malattia in fase avanzata pag. 34 CAPITOLO 3. Il trattamento delle metastasi ossee pag. 41
3.1 Generalità pag. 41
3.2 Il trattamento chirurgico delle metastasi ossee pag. 48 3.3 Chirurgia delle metastasi dello scheletro appendicolare pag. 55 3.4 Chirurgia delle metastasi del rachide e del bacino pag. 63 3.5 Follow-up del paziente con metastasi ossee pag. 71
CAPITOLO 4. Materiali e metodi pag. 72
CAPITOLO 5. Risultati pag. 75
INTRODUZIONE
Le metastasi sono il principale indicatore di disseminazione di un processo morboso evolutivo dalla sua sede d'origine ad altri organi. L'osso, secondo solo a polmone e fegato è una delle principali sedi di metastatizzazione e le regioni più colpite risultano essere rachide, femore, omero, tibia, coste, sterno e teca cranica.
Le neoplasie primitive che più frequentemente metastatizzano all'osso sono mieloma multiplo (70-95%), Ca. mammario (65-75%), Ca. prostatico (65-75%), Ca.renale (20-25%), Ca. polmonare (30-40%), il melanoma maligno della pelle (14-45%) ed il carcinoma tiroideo (2-13%).
Molteplici fattori, quali la presenza di molecole adesive, la produzione di fattori angiogenetici ed osteoriassorbibili da parte delle cellule neoplastiche e soprattutto la complessa vascolarizzazione, che contraddistingue il tessuto osseo, come il plesso venoso di Batson a livello del rachide, spiegano la particolare predilezione delle neoplasie per lo scheletro.
I segmenti scheletrici possono essere colpiti tutti indistintamente sebbene sia stato ormai acquisito, anche dalla letteratura più recente, che ogni neoplasia predilige determinati segmenti ossei, come nel caso del rachide dorsale per il Ca. della mammella o il rachide lombare per il Ca. prostatico, e che metastasi a livello dei cingoli prossimali sono espressione di una malattia in fase più precoce rispetto alle acrometastasi.
A seconda della tendenza delle cellule neoplastiche ad invadere l'osso, sia essa invasiva e destruente oppure esuberante con rinforzo della trama ossea preesistente, le metastasi vengono classificate rispettivamente in osteolitiche (es. Ca. renale e
tiroideo) ed osteoblastiche (es. Ca. prostata).
Il carcinoma tiroideo, neoplasia relativamente rara, rappresenta l'1% delle neoplasie maligne della tiroide e colpisce più frequentemente il sesso femminile in età medio-avanzata.
Negli ultimi anni, grazie al miglioramento dell'inquadramento clinico-diagnostico dei pazienti, si è evidenziato un aumento dell'incidenza di forme precoci e spesso asintomatiche di tale neoplasia e ciò ha consentito un'evoluzione dei trattamenti chirurgici o meno ed una rapidità d'azione da parte dei medici, aumentando così di molti anni la sopravvivenza dei pazienti e, conseguentemente, anche il numero di pazienti con malattia metastatica in fase avanzata.
Le metastasi ossee si presentano, da letteratura, nel 2-13% circa dei pazienti con Ca. tiroideo; tali percentuali sono però chiaramente destinate ad aumentare. Hanno prevalenza variabile a seconda dell'istitipo (follicolare, papillare, anaplastico, midollare e a cellule di Hürthle), e predilezione per femore ed omero prossimale, rachide e bacino.
Una diagnosi precoce, così come un attento follow-up, sia della patologia tiroidea che delle eventuali metastasi, ossee e non solo, è fondamentale per un'accurata stadiazione della malattia e per l'elaborazione di un preciso iter terapeutico, date le numerosi opzioni di trattamento disponibili in ambito sia medico che chirurgico.
L'opzione chirurgica può essere presa in considerazione sia come indicazione primaria nel trattamento di una data lesione sia come trattamento palliativo a scopo di “salvataggio” in caso di fratture patologiche.
colpita ma anche del performance status e dell'aspettativa di vita del paziente; la scelta può riguardare un osteosintesi semplice, con chiodo o placca, un osteosintesi rinforzata con chiodo, placca semplice o doppia placca + cemento oppure la sostituzione protesica con protesi standard o megaprotesi cementate per lo scheletro appendicolare.
Per il rachide le opzioni sono generalmente stabilizzazione vertebrale + decompressione midollare o cifoplastica percutanea;
per il bacino è preferibile un trattamento conservativo, tranne in caso di lesioni localizzate in sede periacetabolare; in questi casi l'intervento chirurgico può comprendere, a seconda dell'entità della lesione, tecniche mini invasive percutanee come l'acetaboloplastica oppure chirurgia maggiormente demolitiva con coppe cementate ed anelli metallici di rinforzo.
L’oggetto di questo studio è stata una revisione critica della casistica nata dalla collaborazione tra l’UO di Endocrinologia I Universitaria e l’UO di Ortopedia e Traumatologia I Universitaria di Pisa riguardante pazienti con carcinoma tiroideo metastatico all‘osso sia trattati chirurgicamente che conservativamente al fine di valutare i trattamenti eseguiti, alla luce dei risultati ottenuti.
CAPITOLO 1
EPIDEMIOLOGIA E VIE DI DIFFUSIONE 1.1 Incidenza
Il termine metàstasi, che deriva dal greco meta = al di là e stasis = stato, posizione, viene comunemente utilizzato per indicare la disseminazione di un processo morboso evolutivo dalla sua sede di origine ad altri organi dell'individuo.
Le metàstasi possono essere distinte in settiche o neoplastiche a seconda della natura delle cellule di origine; le vie di diffusione sono molteplici, pertanto si parla di metastatizzazione per contiguità, per via linfatica oppure per via ematica.
Invasività e metastatizzazione sono caratteristiche distintive delle neoplasie maligne, considerate ormai importante oggetto di studio in quanto principali cause di morbilità e mortalità per il paziente oncologico e pertanto potenziali obiettivi per future strategie terapeutiche.
L'osso, secondo solo a polmone e fegato [1], è una delle principali sedi di secondarismo neoplastico e le regioni ossee più colpite risultano essere rachide, femore ed omero prossimali, tibia, coste, sterno e teca cranica.
Le neoplasie primitive che più frequentemente metastatizzano all'osso sono mieloma multiplo (70-95%), carcinoma mammario (65-75%), prostatico (65-75%), renale (20-25%), polmonare (30-40%), il melanoma maligno della pelle (14-45%) [2]
1.2 Eziopatogenesi
Molteplici fattori spiegano la predilezione di molte neoplasie per il tessuto osseo, in particolare l'imponente vascolarizzazione che lo caratterizza, la presenza di molecole adesive sulle cellule neoplastiche e la loro produzione di fattori angiogenetici ed osteoriassorbibili che ne favoriscono l'accesso alla matrice ossea e la successiva adesione e proliferazione [4].
La via di propagazione più frequente è quella ematogena, in particolare arteriosa per le lesioni dei dei cingoli dapprima prossimali (spalla e bacino) poi distali ( gomito e ginocchio), e venosa per le lesioni della colonna vertebrale grazie all'esistenza del Plesso di Batson, una rete di vasi extra vertebrali, vertebrali, intrarachidei, dalle pareti sottili e privi di valvole, che costituisce la principale via di connessione tra i territori della cava superiore e quelli della cava inferiore, anastomizzandosi ampiamente a vari livelli con vene della cavità toraco-addominale.
Le metastasi ai cingoli prossimali sono quindi espressione di una malattia in fase più precoce di quelle distali, ed in particolare, le acrometastasi sono considerate espressione di malattia molto avanzata [5].
1.3 Meccanismi patogenetici delle metastasi ossee
La metastasi ossea è un fenomeno multifattoriale, che si realizza con il contributo di agenti sia di tipo immunitario e biologico che emodinamico. Il processo di
invasione ossea si articola in varie tappe, la cui rivisitazione consente di individuare alcuni momenti fondamentali.
Il primo evento si caratterizza per il rilascio costante, da parte di tutti i tumori primitivi, di cellule che invadono il normale tessuto circostante attraverso la produzione di enzimi degradativi, quali proteasi o collagenasi. Successivamente, per diapedesi, le cellule neoplastiche sono quindi in grado di attraversare la rete vascolare capillare immettendosi così all'interno della circolazione sistemica.
Una volta in circolo tali cellule possono interagire con neutrofili, eritrociti, linfociti T, e piastrine e depositarsi anche in organi distanti, incluso l'osso; l'ultima tappa è infatti la colonizzazione e la crescita in situ.
L'osso è una sede comune per le metastasi a causa di un' importante vascolarizzazione capillare a basso flusso a livello midollare, di molecole adesive sulla superficie delle cellule neoplastiche che ne facilitano l'integrazione con le cellule stromali e per la produzione di fattori pro-angiogenetici e di riassorbimento osseo che consentono la crescita tumorale [4].
Un aspetto da considerare, ultimo in analisi e non per importanza, è che solo lo 0,1% degli emboli neoplastici sopravvive poiché il loro destino è legato ad un insieme di fattori che riguardano da un lato la tipologia di tumore primitivo e la sua attitudine infiltrante, dall'altro la reazione dell'ospite, condizionata dallo stato del sistema immunitario.
1.4 La reazione ossea: osteolisi ed osteogenesi
La risposta dell'osso alla colonizzazione metastatica non è sempre la stessa ma è strettamente legata al tipo di tumore, che può avere una tendenza invasiva, litica e distruttiva, oppure di tipo addensante con un effetto osteogenetico di rinforzo della trama preesistente.
La reazione periostale, in entrambe i casi, è di solito assente o scarsa; solo in casi eccezionali una metastasi osteoblastica può evocarne una che ricorda quella di un osteosarcoma.
Le metastasi osteolitiche sono presumibilmente causate dal rilascio,da parte delle cellule neoplastiche, di agenti osteoclastogenici all'interno del microambiente osseo; d'altra parte quelle osteoaddensanti sembrano essere il risultato del rilascio di fattori stimolanti la proliferazione, la differenziazione osteoblastica e quindi l'incontrollata produzione di tessuto osseo.
Lesioni puramente litiche o addensanti sono ad ogni modo gli estremi dello spettro di attività che guida la distruzione ossea da parte del tumore; tipicamente infatti entrambi i processi sono presenti in ogni segmento scheletrico colpito.
L'osteolisi, e l'ipercalcemia che inevitabilmente ne consegue, così come l'osteogenesi sono processi determinati dall'attivazione osteoclastica ed osteoblastica attraverso una lunga serie di mediatori molecolari che vengono costantemente rilasciati anche durante il fisiologico rimodellamento tissutale.
Il fattore attivante gli osteoclasti è stato individuato nella interleuchina 1 (IL-1), già evidenziato ben oltre 20 anni fa come prodotto dei linfociti capace di una potente azione di stimolo sul riassorbimento osseo.
I tumor necrosis factors sono polipeptidi, anche denominati citokine: il TNF α, prodotto dai macrofagi, e il TNF β, prodotto dai linfociti T attivati, hanno sull'osso azione analoga all' IL-1, di cui inoltre stimolano la sintesi; essi promuovono direttamente la proliferazione dei precursori degli osteoclasti e regolano indirettamente l'attività osteodestruente degli osteoclasti maturi.
La loro azione nell'osteolisi neoplasia-indotta è quindi strettamente legata alla reazione immunitaria dell'ospite.
Un altro membro della famiglia, RANK-L (receptor activator of nuclear factor kB ligand), è il principale mediatore fisiologico della produzione, attivazione e sopravvivenza degli osteoclasti e la maggior parte dei fattori pro-osteoclastogenici agiscono attraverso la via di up-regulation di tale fattore.
I trasforming growth factors α e β, polipeptidi simili agli epidermal growth factors (EGF) che stimolano la crescita e la replicazione cellulare, sono anch'essi prodotti delle cellule immunitarie e delle piastrine ma sono stati individuati anche in colture di cellule tumorali.
Determinante per l'osteolisi è anche il riassorbimento osseo dovuto alle cellule neoplastiche attraverso il rilascio di enzimi osteolitici. Tali enzimi possono essere prodotti anche da monociti attirati dalla necrosi ossea conseguente all'ischemia dei vasi intraossei dovuta alla compressione da parte delle cellule tumorali.
Il carcinoma della prostata, ed in alcuni casi quello della mammella determinano metastasi di tipo osteoaddensanti attraverso due possibili meccanismi:
1. Una ossificazione di tipo intramembranoso può determinarsi all'interno delle metastasi tumorali in grado di produrre uno stroma fibroso, come ad esempio quelle di carcinoma prostatico;
2. Una risposta reattiva degli osteoblasti del tessuto circostante è invece il principale meccanismo della neoformazione ossea presente nelle metastasi osteoaddensanti. Alla base di tale fenomeno vi è sicuramente un tentativo, da parte del tessuto normale, di compensare le alterazioni strutturali provocate dalle metastasi, analogamente a quanto succede nella riparazione delle fratture. In questi casi tuttavia tale neoproduzione può essere tanto esuberante a tal punto da creare ampie aree di tessuto osteoide non ancora calcificato che causano ulteriore indebolimento della struttura ossea.
L'attitudine osteogenetica non è svolta direttamente dalle cellule neoplastiche, ma per mezzo di induttori. Esse infatti stimolano l'osteogenesi ai bordi delle formazioni trabecolari con conseguente riduzione degli spazi midollari; ciò è responsabile dell'addensamento visibile nei radiogrammi.
Ne consegue che alcuni tumori si manifestano esclusivamente con una osteodistruzione (es. Carcinoma renale e tiroideo), altri con una elettiva osteosclerosi ( carcinoma bronchiale e prostatico) ed altri ancora con una duplice attitudine sia all'osteolisi che all'osteosclerosi (carcinoma mammario e polmonare) [6].
CAPITOLO 2
IL CARCINOMA TIROIDEO 2.1 Epidemiologia
Il carcinoma della tiroide, neoplasia relativamente rara, ad eziopatogenesi spesso non molto chiara, rappresenta circa l'1% delle patologie maligne della tiroide, con una lieve predilezione per il sesso femminile in età media ed avanzata.
Numerosi Registri Tumori indicano l'aumento di incidenza del carcinoma tiroideo. Tale incremento riguarda in particolare i carcinomi tiroidei a basso rischio (come evidenziato dalla stadiazione) ed infatti inversamente correlato alle dimensioni del tumore, alla presenza di linfoadenopatie laterocervicali palpabili e di metastasi a distanza. In generale, questo aumento di incidenza sembra più apparente e dovuto ad una più accurata e precoce diagnosi. I fattori che incidono su questo parametro sono il miglioramento dell'educazione sanitaria nella popolazione, l'introduzione e diffusione dell'ecografia nella diagnostica delle patologie tiroidee (con il progressivo aumento di prevalenza ed incidenza della patologia nodulare della tiroide), il miglioramento delle tecniche di diagnosi anatomo-patologica, in particolare per quanto concerne la diagnosi citologica su agoaspirato delle lesioni nodulari che hanno consentito la diagnosi di un elevato numero di carcinomi tiroidei asintomatici ed in fase preclinica. Tuttavia l'età avanzata al momento della diagnosi ed il riscontro di una malattia metastatica diffusa sono associati ad una prognosi peggiore indipendentemente dal tipo di tumore.
Circa il 94% sono carcinomi differenziati che derivano dalle cellule epiteliali follicolari e, da un punto di vista anatomopatologico, possono essere a sua volta classificati in due sottotipi: follicolare (15-20%) e papillare (70-75%). Un altro 5% è costituito dal carcinoma midollare della tiroide, un tumore neuroendocrino che origina dalle cellule parafollicolari o cellule C della tiroide; il rimanente 1% è rappresentato dal carcinoma anaplastico della tiroide che generalmente deriva dalla dedifferenziazione di un tipo differenziato.
Le metastasi ossee si presentano approssimativamente nel 2-13% dei soggetti con carcinoma differenziato, con una nettissima prevalenza per il tipo follicolare (7-28%) rispetto al papillare (1,4-7%); nel 25-50% dei pazienti con carcinoma anaplastico, sincrone a metastasi polmonari e nel 20% dei pazienti con carcinoma midollare sporadico [7].
La maggior parte delle localizzazioni ossee sono in regioni ad alta vascolarizzazione come il rachide, le coste, il femore prossimale e l'acetabolo.
Il tasso di remissione si aggira intorno al 7-20% mentre il tasso di sopravvivenza è generalmente buono ad esclusione del carcinoma anaplastico; la sopravvivenza a 10 anni nel CTD è di circa 80-95%, sebbene tale percentuale si riduca a circa il 13-21% quando compaiono metastasi ossee [3].
2.2 Eziopatogenesi
Sebbene l'eziologia sia conosciuta solo in pochi e rari casi di carcinoma papillare o follicolare familiare, sono stati tuttavia evidenziati dei fattori di rischio comuni alla maggior parte delle variante istologiche:
– Radiazioni ionizzanti: la pregressa esposizione del collo a radiazioni ionizzanti durante l’infanzia si associa ad una maggiore incidenza di carcinoma tiroideo (dato confermato dall’incidente nucleare di Chernobyl).
– Carenza iodica: sebbene i dati siano contrastanti, sembra che nelle aree iodiocarenti, vi sia un’aumentata frequenza di carcinomi tiroidei, con prevalenza soprattutto delle forme di tumore associate ad una maggiore invasività (carcinoma follicolare).
– Familiarità: un'origine familiare è stata ad esempio evidenziata nel 25% di tutte le forme di carcinoma midollare della tiroide che risultano essere associate a mutazioni del gene RET oppure a sindromi poliendocrine come la MEN-2;
– Età: il carcinoma papillare colpisce prevalentemente in giovane età ed ha una prognosi migliore rispetto al carcinoma follicolare o all'anaplastico che colpiscono maggiormente in età più avanzata e si associano a minor tasso di sopravvivenza e maggior incidenza di metastatizzazione alla a diagnosi.
– Sesso: il carcinoma tiroideo ha maggior prevalenza nel sesso femminile tuttavia la prognosi risulta essere peggiore nel sesso maschile;
– Massa corporea: Alcuni studi caso-controllo hanno dimostrato un aumento del rischio di carcinoma tiroideo in pazienti con elevato BMI (Body Mass Index) [8].
Il rischio sarebbe aumentato di 5 volte negli uomini e di 2 volte nelle donne obese (> 97° percentile), rispetto al rischio osservato nei soggetti con peso <3° percentile. Nelle donne (specie in epoca post-menopausale) un aumento di peso >14% sembra correlarsi positivamente con l'insorgenza del carcinoma tiroideo;
2.3 Anatomia patologica
Da un punto di vista antomo-patologico il carcinoma tiroideo può essere suddiviso nelle seguenti categorie: carcinoma follicolare, carcinoma papillare, carcinoma a cellule di Hürtle, carcinoma insulare, carcinoma anaplastico e carcinoma midollare.
Il carcinoma papillare a sua volta viene suddiviso in variante classica, variante follicolare e variante a cellule alte.
All'interno di ogni categoria è necessaria la distinzione in carcinoma ben differenziato, scarsamente differenziato ed indifferenziato, in base alle caratteristiche citologiche (ipercromasia nucleare, attività mitotica e necrosi cellulare) ed architetturali (presenza di aree solide) [9].
Il carcinoma papillare colpisce tipicamente donne giovani e talvolta bambini, è caratterizzato da indolenza e diffusione locale, sebbene sia documentata anche una predisposizione a metastatizzare a distanza, soprattutto a livello di polmone ed osso. La prognosi è generalmente buona, soprattutto nei giovani e se diagnosticato precocemente.
Il carcinoma follicolare, più diffuso del papillare nelle regioni iodiocarenti, predilige invece donne in età medio-avanzata, metastatizza preferibilmente a polmone ed osso e la prognosi migliora in caso di diagnosi tempestiva.
Il carcinoma anaplastico, più comune nell'anziano, è invece molto aggressivo e localmente invasivo.
Il carcinoma midollare è prevalentemente sporadico ma può tuttavia presentare un'origine familiare associata a mutazioni del gene RET oppure a sindromi poliendocrine come la MEN-2. Come il papillare è anch'esso caratterizzato da indolenza e diffusione locale nella maggior parte dei casi sebbene abbia una prognosi molto peggiore.
2.4 Diagnosi clinica e strumentale
Nel 90% dei casi il carcinoma tiroideo si presenta come una semplice nodularità a livello della ghiandola. Solo raramente la prima manifestazione è una linfoadenopatia cervicale (5%) o addirittura una metastasi a livello polmonare, osseo, epatico o cerebrale.
Un'importanza fondamentale nella patologia nodulare tiroidea riveste quindi la distinzione tra noduli maligni e benigni. Attualmente, l'esame citologico mediante agoaspirazione con ago sottile (FNA) semplice o sotto guida Ecografica (FNAC), è in grado di risolvere in gran parte questo problema.
Ove eseguito correttamente e interpretato da un citologo esperto, questo esame permette la diagnosi di natura dei noduli tiroidei con un elevato grado di sensibilità e specificità, tanto che l'introduzione dell'esame citologico nella pratica clinica ha permesso di ridurre drasticamente il numero degli interventi chirurgici. L'esame citologico permette inoltre di programmare il tipo di intervento più adeguato nei casi
La scintigrafia tiroidea con Pertecnetato-Tc99m, che si propone di studiare sede,
forma e dimensioni della tiroide e le sue alterazioni, permette di distinguere i noduli funzionanti, detti caldi, che concentrano il tracciante radioattivo e i noduli non funzionanti, detti freddi, che non hanno la capacità di concentrare il tracciante o la hanno solo in misura ridotta rispetto al tessuto tiroideo normale:
– la frequenza dei noduli caldi è maggiore nelle regioni dove persiste una carenza iodica, sono 3-4 volte più frequenti nelle femmine e d oltre i 40 anni; con rarissime eccezioni, sono benigni;
– i noduli freddi sono i più frequenti, rappresentando circa l'80% dei noduli tiroidei. L'ecografia tiroidea permette di distinguere tre tipi di noduli: noduli puramente liquidi, cistici , solidi e misti (con componente solida e liquida); i noduli cistici (fino al 15%) sono prevalentemente benigni; invece, è tra i noduli solidi o misti che si ritrova la maggior parte dei noduli maligni, in una proporzione di circa il 10%;
Nell'ambito della patologia tiroidea nodulare, lo scopo del percorso diagnostico è quello di selezionare i noduli tiroidei sospetti per carcinoma, da quelli benigni. Il percorso diagnostico include l'identificazione dei fattori di rischio, quali:
– Età: < 20 o > 60 anni – Sesso: maschi > femmine – Irradiazione su testa e/o collo
– Familiarità per carcinoma midollare – Familiarità per carcinoma papillare – Nodulo singolo
– Rapido accrescimento del nodulo
– Crescita sotto terapia soppressiva con LT4 (L-tiroxina) – Fissità, consistenza dura
– Linfoadenopatia e l'identificazione degli esami ematochimici più appropriati: TSH, FT3, FT4, Ab-TPO, Ab-Tg e Calcitonina.
Un'accurata anamnesi personale ed uno scrupoloso esame obiettivo forniscono elementi sulle caratteristiche della ghiandola tiroidea nonché sul numero, le dimensioni e la consistenza dei noduli; La palpazione permette inoltre di esplorare la presenza di adenopatie cervicali, frequenti nel caso di neoplasie papillari, specialmente nel bambino.
2.5 Diagnostica per immagini e medico-nucleare
La scintigrafia tiroidea utilizza comunemente il Tecnezio-99m come tracciante; una scansione planare proiezione anteriore è in genere sufficiente. Lo iodio radioattivo è attualmente utilizzato solo in casi particolari. La scintigrafia è in genere inutile nel caso di noduli < 1 cm (che non sarebbero visualizzati) o nei noduli ecograficamente cistici; valuta l'attività funzionale della ghiandola e dei noduli, permettendo di differenziare i noduli freddi (poco o affatto captanti) dai noduli caldi (ipercaptanti), per lo più benigni.
La scintigrafia con Tecnezio-99m o con lo iodio radioattivo non fornisce alcuna informazione sulla natura maligna o benigna del nodulo, in caso di nodulo ipocaptante. Gli altri traccianti radioattivi quali il Tallio-201 o il MIBI (2-methoxy isobutyl isonitrile) non hanno trovato un'applicazione routinaria nella diagnostica dei noduli tiroidei.
L'ecografia della tiroide eseguita con una sonda da7,5 MHz è sempre più utilizzata come primo esame diagnostico. Essa permette di distinguere, nel caso di una tiroidite, gli pseudo-noduli dai veri noduli tiroidei e può dare, inoltre, una misura precisa delle dimensioni dei noduli, del loro numero esatto e le loro caratteristiche solide, cistiche o miste.
La concomitanza di particolari caratteristiche ecografiche, in particolare l'ipoecogenicità del nodulo, la presenza di microcalcificazioni intranodulari, la perdita o l'interruzione della continuità dell'alone periferico, costituiscono elementi di
sospetto. Inoltre, l'ecografia permette di esaminare il parenchima tiroideo extra-nodulare e le stazioni linfonodali cervicali.
Ai fini della diagnosi differenziale dei noduli tiroidei, l'esame mediante tomografia assiale computerizzata (TAC) senza mdc o risonanza magnetica nucleare(RMN) non forniscono alcun elemento diagnostico differenziale ma possono essere molto utili durante una valutazione preoperatoria al fine di valutare i rapporti della neoplasia con trachea, vasi e esofago, fino ad una vera e propria estensione intratoracica.
La peculiarità dell' imaging medico-nucleare è quella di essere “funzionale”, cioè espressione di un processo metabolico che viene esplorato e visualizzato scintigraficamente attraverso l'utilizzo di opportuni radiofarmaci [10].
1. Scintigrafia totale corporea con Radioiodio
I radioisotopi dello iodio utilizzati per la scintigrafia sono Iodio-131, Iodio-123 e Iodio-124.
Lo Iodio-131, il radioisotopo più diffusamente impiegato e per il quale esiste la più ampia esperienza clinica, rappresenta il radiofarmaco di riferimento.
Lo Iodio-124 rappresenta un interessante radioisotopo emettitore di positroni che, pertanto, può essere utilizzato nella diagnostica PET ( tomografia ad emissione di positroni ) con i conseguenti vantaggi di un'elevata accuratezza e sensibilità diagnostica associata alla possibilità di eseguire importanti valutazioni dosimetriche
Nel work-up diagnostico del paziente portatore di neoplasie tiroidee dell'epitelio follicolare, la scintigrafia con radioiodio trova applicazione anche dopo tiroidectomia per valutare l'entità del parenchima tiroideo residuo e l'estensione della malattia tumorale (eventuali metastasi loco-regionali e a distanza) e nel corso del follow-up, per evidenziare una ripresa del processo neoplastico sospettata biochimicamente o con altre metodiche di imaging.
2. 18F-fluorodesossiglucosio FDG (PET)
La PET con 18F-FDG oltre a fornire accurate informazioni anatomiche relative alla sede o ai distretti di diffusione del processo tumorale, offre anche importanti indicazioni sul comportamento biologico della neoplasia. Elevata captazione di FDG, infatti, significa un metabolismo energetico aumentato, caratteristica questa che, generalmente, si associa alle neoplasie clinicamente più aggressive. La PET con 18F-FDG, pertanto, rappresenta una metodica di notevole accuratezza diagnostica in tutti gli istotipi a basso grado di differenziazione, come, ad esempio, le forme papillari “a cellule alte”,“a cellule colonnari” e il carcinoma insulare [12], [13].
In questi tumori la PET con 18F-FDG è indicata non solo durante il follow-up , ma anche e forse soprattutto, dopo tiroidectomia allo scopo di ottenere un'accurata valutazione dell'estensione di malattia, informazione indispensabile per una corretta gestione clinica del paziente.
La PET con 18F-FDG trova indicazione per la sua elevata accuratezza diagnostica anche nei pazienti portatori di tumori a cellule di Hürthle [14] e, più limitatamente, nei pazienti portatori di metastasi clinicamente occulte da carcinomi tiroidei differenziati.
3. Scintigrafia con analoghi della somatostatina radiomarcati
Studi condotti su tessuti tiroidei neoplastici hanno dimostrato che le neoplasie dell'epitelio follicolare della tiroide esprimono spesso diversi recettori per la somatostatina. Il significato funzionale di questi recettori e più ingenerale, del ruolo della somatostatina nel controllo della cellula tiroidea è al momento ancora oscuro. In ogni caso, diversi Autori hanno dimostrato che la scintigrafia con analoghi radiomarcati della somatostatina e, in particolare, il 111In-pentetreotide (Octreoscan® ) possiede una discreta sensibilità diagnostica (compresa tra il 70 e il95% nelle varie esperienze) nel dimostrare la presenza di lesioni metastatiche da carcinoma tiroideo [15].
Attualmente sono allo studio anche analoghi della somatostatina marcati con radiotecnezio, che presenterebbero il vantaggio di possedere un'emissione più favorevole per gli studi scintigrafici associata ad una ridotta esposizione per i pazienti.
Tra i radiofarmaci proposti, interessanti caratteristiche sembra possedere il 99mTc-EDDA/HYNIC-TOC [16].
somatostatina è ancora in fase di valutazione. Tuttavia, il riscontro di un'elevata captazione di questi radiofarmaci da parte di alcune neoplasie tiroidee rappresenta la premessa indispensabile per poter concepire terapie innovative con analoghi radiomarcati della somatostatina in pazienti non più responsivi al trattamento convenzionale con radioiodio.
4. Ultrasonografia
La diffusione di ecografi ad alta risoluzione e di sonde ad elevata frequenza (12-15 MHz) ha permesso di rilevare un numero sempre maggiore di nodulazioni non palpabili, anche di pochi mm di diametro [17].
Per esaminare in modo completo la ghiandola, l'indagine deve essere condotta con scala dei grigi e con Color-Doppler. Le caratteristiche nodulari che vengono valutate sono: il numero, le dimensioni, la forma, l'ecogenicità, la struttura, le calcificazioni puntiformi o a guscio, l'alone, i margini ed il flusso. Inoltre si esaminano i vari livelli linfoghiandolari regionali e si possono controllare le variazioni dimensionali nel tempo.
I rilievi più frequentemente associati al tumore tiroideo sono: la struttura solida, il diametro antero-posteriore > diametro trasversale, la spiccata ipoecogenicità, i margini irregolari, l'assenza di alone, la presenza di fini calcificazioni e la vascolarizzazione solo o prevalentemente intranodulare. Nessuna caratteristica tuttavia, possiede alta sensibilità e alto valore predittivo positivo.
La presenza di flusso solo o prevalentemente centrale è più frequentemente associata a neoplasia [18].
Tuttavia, la validità del Color-Doppler è controversa, in quanto nessun tipo di flusso consente di porre diagnosi o di escludere la presenza di neoplasia. L'importanza di definire i criteri ecografici per individuare i noduli tiroidei di possibile natura neoplastica risiede nella necessità di selezionarli per un accertamento bioptico, evitando procedure invasive inutili.
5. Esame citologico mediante aspirazione con ago sottile (FNA)
Gli esami diagnostici finora presi in considerazione forniscono indicazioni di presunzione sulla natura di un nodulo, ma solo l'esame citologico del materiale agoaspirato mediante ago sottile può fornire elementi veramente diagnostici. Infatti, la sensibilità dell'esame citologico per la diagnosi di carcinoma è del 65-99% e la specificità del 72-100% a seconda dei vari studi, con una percentuale di falsi negativi inferiore al 2%. La FNA sotto guida ecografica è il metodo di indagine pre-operatorio più diffuso, con una accuratezza globale che può raggiungere il 95%, superiore alla FNA guidata dalla sola palpazione: ciò nonostante nel 15% dei casi si ottiene un campione non diagnostico. Esistono controversie sulla gestione di questi pazienti; essi richiedono comunque la ripetizione della FNA, oppure la rivalutazione ecografica nel tempo, o ancora la resezione operatoria [19].
2.6 Trattamento
Il trattamento iniziale del carcinoma differenziato della tiroide (CDT) è di tipo
chirurgico prevede l'asportazione chirurgica totale della ghiandola, associata o meno
a linfoadenectomia del comparto centrale e/o latero-cervicale del collo in caso di positività a metastasi linfonodali.
A circa 3 mesi dall'intervento il dosaggio di TSH, TG, Ab-TG è necessario per individuare eventuali residui tumorali. La valutazione della loro resecabilità è fondamentale per il chirurgo per stabilire se procedere ad un nuovo trattamento di exeresi oppure considerare la terapia a scopo ablativo con radioiodio (131-I), quasi sempre la terapia di scelta tranne che in casi selezionati a basso rischio.
Valutazione del rischio per la selezione della modalità chirurgica (Linee guida AIOCC-AIRO-AIOM 2012)
Rischio basso alto
ESPOSIZIONE A RADIAZIONI NO SI METASTASI LINFONODALI NO SI STORIA FAMILIARE DI CARCINOMA TIROIDEO NO SI INVASIONE EXTRACAPSULARE NO SI METASTASI A DISTANZA NO SI
DIAMETRO TUMORALE 2 - 4 cm (limitato alla tiroide)
>4 cm o extratiroideo ETA’ (se papillare o
follicolare)
I pazienti sottoposti a tiroidectomia per CDT devono proseguire il trattamento con una terapia ormonale con L-tiroxina (LT4) al duplice scopo di correggere l'ipotiroidismo indotto dalla chirurgia e sopprimere i livelli ematici di TSH endogeno, necessaria poiché il TSH è il principale fattore di regolazione della crescita e della differenziazione della cellula tiroidea. Annullando lo stimolo proliferativo del TSH su eventuali residui di tessuto tiroideo tumorale è possibile contrastare la crescita ed il grado di funzionalità della neoplasia.
L'efficacia della terapia soppressiva nel ridurre la prevalenza di recidive e la mortalità tumore-specifica risulta evidente soltanto nei pazienti ad alto rischio, nei quali è stato dimostrato un aumento sia della sopravvivenza che dell'intervallo libero da malattia.
Nei casi a basso rischio, l'impiego di una dose sostitutiva di LT4 trova giustificazione nei possibili effetti collaterali a lungo termine, come l'aumentato rischio di angina e di fibrillazione atriale e l'accelerato metabolismo osseo con possibile aggravamento dell'osteoporosi post-menopausale.
Il trattamento ablativo del CDT con 131-I consiste nella distruzione del normale tessuto tiroideo residuo, quasi sempre presente anche dopo tiroidectomia totale [20].
Scopo principale del trattamento è quello di facilitare il follow-up,rendendo non dosabile la Tg ematica circolante ed eliminando zone iodocaptanti nel letto tiroideo oltre a distruggere eventuali microfocolai neoplastici presenti nel tessuto tiroideo residuo.
L'indicazione viene posta dopo stratificazione del rischio di recidiva o di mortalità tumore-specifica effettuata con classificazione TNM [21], distinguendo tre categorie
di pazienti per i quali i vantaggi vengono considerati in relazione ai possibili effetti indesiderati, inconvenienti e rischi a breve e lungo termine del trattamento ablativo:
– Pazienti a rischio molto basso
Pazienti con carcinomi papilliferi monofocali T1N0M0, con dimensione del tumore ≤1.0 cm, chirurgia completa ed istotipo favorevole.
In questi pazienti, la prognosi dopo intervento chirurgico è cosi favorevole da non poter essere migliorata da altre modalità di trattamento. Il tasso di recidiva a lungo-termine è infatti molto basso (inferiore al 2%) ed il trattamento ablativo di routine non è indicato, considerando gli inconvenienti di tipo pratico e psicologico per il paziente, il costo elevato ed i rischi, rari ma non assenti, ad esso connessi [21].
– Pazienti a basso rischio
Pazienti con CDT monofocali T1N0M0, con dimensione del tumore comprese tra 1 e 2 cm; CDT T1N0M0 multifocali e T2N0M0.
In questa categoria, l'indicazione va posta in maniera individuale nel singolo paziente considerando il grado di completezza chirurgica, il sottotipo istologico, l'età, la pregressa esposizione a radiazioni ionizzanti e tutti gli altri possibili fattori di rischio.
– Pazienti ad alto rischio
Pazienti con carcinomi T3 e T4 tutti i carcinomi N1e tutti i carcinomi M1
In tutti questi casi, l'indicazione al trattamento ablativo è universalmente accettata. Studi prospettici multicentrici hanno dimostrato sia una significativa riduzione della
mortalità e della progressione della neoplasia con miglioramento dell'intervallo libero da malattia, che una netta riduzione del tasso di recidive e di mortalità tumore-specifica 20 anni dopo il trattamento [22].
La valutazione dell'efficacia della terapia ablativa viene generalmente effettuata dopo circa 8 mesi, utilizzando un esame scintigrafico e/o attraverso il dosaggio dei livelli ematici di Tg ottenuti dopo stimolazione esogena o endogena del TSH.
In caso di residui tumorali non resecabili caratterizzati da inadeguata captazione di 131-I è da valutarsi l'impiego della Radioterapia esterna come valido sosituto della terapia ablativa che risulterebbe inefficace in tali casi.
Risulta pertanto essere indicata nei pazienti con età > 45 anni e con alto rischio di ricaduta locoregionale (stadio IVb, residuo macroscopico non resecabile, margini diffusamente infiltrati, linfonodi multipli fissi). L'istologia scarsamente differenziata o varianti istologiche aggressive non giustificano la radioterapia esterna ma possono essere variabili da valutare attentamente.
Stadiazione TNM del carcinoma tiroideo
CARCINOMI papillari e follicolari
Stadio ≤ 45 anni > 45 anni
I Ogni T, ogni N, M0 T1 N0 M0 II Ogni T, ogni N, M1 T2 N0 M0 III - T3 N0 M0 T1,T2,T3 N1a M0 IV A - T4a N0 M0 T4a N1a M0 T1,T2,T3,T4a, N1b, M0 IV B - T4b, ogni N M0 IV C - Ogni T, ogni N M1 CARCINOMI INDIFFERENZIATI sempre stadio IV Stadio Classificazione IV A T4a, ogni N, M0 IV B T4b, ogni N, M0 IV C Ogni T, ogni N, M1
2.7 Follow-up
Nel corso dell'ultimo decennio lo spettro dei pazienti con carcinoma tiroideo di tipo epiteliale si è modificato sostanzialmente. In seguito alla diffusione dell'ecografia e dell'agoaspirato ecoguidato come strumenti di prima linea per l'inquadramento diagnostico della patologia nodulare tiroidea, la diagnosi della maggioranza dei carcinomi tiroidei avviene in fase relativamente precoce. Inoltre, il carcinoma papillare, che attualmente rappresenta l'istotipo di gran lunga più frequente (80-90% dei casi), presenta un'aggressività in genere moderata ed un decorso relativamente indolente. Solo una minoranza dei carcinomi tiroidei si presenta al momento della diagnosi in fase avanzata o con caratteri istologici aggressivi. Le modalità e l'intensità del follow-up dei tumori della tiroide devono quindi basarsi sul rischio di mortalità o di recidiva di malattia presentato dai singoli pazienti. La stadiazione TNM consente di predire efficacemente il rischio di mortalità tumore-specifica, mentre una serie di caratteri clinici, strumentali ed istologici permette di meglio definire il rischio di recidiva di malattia. Ai fini pratici, per orientare le modalità del follow-up, è stata proposta la suddivisione dei pazienti operati per carcinoma tiroideo in tre gruppi: a basso, intermedio ed alto rischio di recidiva [23].
– basso rischio di recidiva: assenza di metastasi locali o a distanza, resezione completa del tumore, assenza di invasione delle strutture cervicali, istotipo non
– rischio intermedio di recidiva: istotipo aggressivo, reperto istologico (e non macroscopico) di diffusione extratiroidea o di invasione vascolare;
– alto rischio di recidiva: invasione macroscopicamente apprezzabile delle strutture cervicali, incompleta resezione del tumore, metastasi a distanza o captazione extratiroidea dello 131-I nella scintigrafia Total-Body post-ablazione.
Due sono gli scopi primari del follow-up del paziente con carcinoma tiroideo differenziato (CDT):
1) individuare precocemente le eventuali recidive e/o metastasi, stabilirne la capacità iodocaptante o meno ed intervenire di conseguenza con terapia radiometabolica con 131-I ad alte dosi o con altri presidi terapeutici;
2) mantenere la terapia ormonale a dosi tali da sostituire la funzione tiroidea con soppressione o meno dei livelli di ormone tireotropo, a seconda che il paziente sia stato dichiarato guarito oppure no;
Nella maggior parte dei casi la neoplasia tiroidea è caratterizzata da basso rischio di recidiva e mortalità tumore-specifica per cui non è necessario eseguire indagini strumentali particolari, costose e con effetto sfavorevole sulla qualità della vita del paziente.
In questi casi, il controllo nel tempo deve basarsi essenzialmente sullo studio ecografico del collo, sulla determinazione della tireoglobulina (Tg), in corso di terapia soppressiva o dopo stimolo con TSH umano ricombinante (rhTSH) [24] e sul
dosaggio degli ormoni tiroidei circolanti per il monitoraggio della terapia ormonale
Solo i casi ad alto rischio (carcinomi scarsamente differenziati, tumori localmente aggressivi o con metastasi a distanza) devono essere trattati e seguiti in modo più aggressivo. In questi casi, oltre alla scintigrafia corporea totale con 131-I può essere necessario utilizzare altre tecniche di imaging quali la tomografia assiale computerizzata (TC), la risonanza magnetica (RMN), la tomografia a emissione di positroni (PET), la scintigrafia ossea, nonché procedure endoscopiche quali la laringo-tracheoscopia e l'esofagoscopia, per identificare l'estensione della malattia e le sedi di metastasi.
2.8 Trattamento della malattia in fase avanzata
Il trattamento della malattia in fase avanzata si basa inevitabilmente su un approccio multidisciplinare in cui risultano coinvolte varie figure professionali, quali l'Endocrinologo, il Radioterapista, il Medico della terapia antalgica, il Chirurgo generale, l'Ortopedico ed il Fisiatra.
La scelta di approccio terapeutico varia costantemente in rapporto a molteplici fattori quali l'età ed il sesso del paziente, il suo stato di salute globale (Performance Status) e in ultimo, non per importanza, il tipo di tumore.
Le possibili opzioni riguardano generalmente la Terapia con radioiodio, il Trattamento con radioterapia esterna, il Trattamento con chemioterapia ed il Trattamento chirurgico.
1) Terapia con radioiodio
Il trattamento con 131-I rappresenta la terapia di scelta per le recidive da carcinoma differenziato della tiroide (CDT), locoregionali e a distanza, iodocaptanti e non suscettibili di trattamento chirurgico. Nonostante il trattamento con 131-I venga impiegato ormai da molti anni, restano margini di incertezza e frequenti controversie sull'ottimale attività di 131-I da somministrare[25].
Nel trattamento con 131-I delle metastasi caratterizzate da rapida clearance del radioiodio è possibile impiegare il pre-trattamento con litio, farmaco in grado di
inibire il rilascio di iodio dalla cellula senza interferire sul meccanismo di fissazione. Comunque, anche se è stato dimostrato che
l'uso del litio in tumori a rapida clearance permette di raddoppiare la dose di radiazione al tessuto tumorale, non esistono dati sul decorso clinico che permettano con sicurezza di raccomandarne un uso sistematico [26].
Le metastasi che possono beneficiare di tale trattamento sono generalmente metastasi polmonari , ossee o cerebrali.
Per quanto riguarda le metastasi polmonari da CDT la possibilità di cura con radioiodio dipende da diversi fattori quali dimensione delle lesioni, capacità iodocaptante e stabilità o grado di evoluzione delle lesioni metastatiche. Le micrometastasi polmonari intensamente captanti il radioiodio (pattern di tipo diffuso) e non evidenti allo studio Rx del torace sono quelle che meglio rispondono al trattamento con 131-I [27].
L'attività da somministrare può essere scelta in maniera empirica (100-300 mCi) o stimata su base dosimetrica, in modo da non eccedere mai, nel singolo trattamento, evitando il più possibile eventi tossici a carico del midollo osseo.
Il trattamento può essere ripetuto ogni 6-12 mesi, fino ad ottenere un'adeguata risposta terapeutica valutata su base scintigrafica o in termini di riduzione dei valori di Tg circolante.
Metastasi polmonari non-iodocaptanti alla 131-I SCT e metastasi polmonari intensamente positive allo studio PET con 18F-FDG non mostrano benefici dal trattamento con radioiodio, rimanendo immodificati i tassi di mortalità
tumore-Nelle metastasi non-iodocaptanti ed in casi selezionati possono essere prese in considerazione altre modalità di trattamento come l'asportazione chirurgica di lesioni solitarie, l'ablazione laser endobronchiale, la radioterapia esterna a scopo palliativo di lesioni intratoraciche sintomatiche e d il drenaggio pleurico e pericardico di versamenti sintomatici [26].
Nel caso delle metastasi scheletriche gli aspetti da considerare nella scelta della modalità di trattamento riguardano la loro presentazione, in forma solitaria o multipla, il rischio di frattura patologica o di compromissione neurologica, la presenza di dolore ed il grado di captazione del radioiodio. La chirurgia deve sempre essere considerata come la prima opzione terapeutica nei pazienti di età inferiore a 45 anni e con metastasi scheletriche solitarie, in quanto permette un miglioramento della sopravvivenza. Il trattamento con radioiodio viene utilizzato in caso di metastasi solitarie o multiple iodocaptanti,somministrando attività scelte in maniera empirica (150-300 mCi) o sulla base di una stima dosimetrica individualizzata. Nel caso in cui, per la sede delle metastasi, l'edema da radiazioni può causare complicanze neurologiche o dolore deve essere sempre considerato l'impiego di corticosteroidi prima del trattamento. In caso di metastasi dolorose non resecabili, oltre alla terapia con 131-I possono essere prese in considerazione altre forme di trattamento, come la radioterapia con fasci esterni, l'embolizzazione intra-arteriosa [29], l'ablazione con
radiofrequenze [30] e l'infusione di bifosfonati.
Le metastasi cerebrali da CDT non sono molto frequenti; si presentano in genere, in pazienti anziani, con malattia avanzata e sono associate a prognosi infausta.
Quando possibile, nel caso di lesioni singole in sedi appropriate,vengono trattate con resezione chirurgica e radioterapia esterna ed esistono pochi dati riguardo l'efficacia del trattamento con radioiodio. La radioterapia panencefalica costituisce l'indicazione standard nel caso di lesioni multiple.
In caso di trattamento con 131-I e prima della stimolazione per via esogena o endogena del TSH, allo scopo di minimizzare il possibile incremento dimensionale del tumore ed i fenomeni di flogosi attinica conseguenti al trattamento, è fortemente raccomandato l'impiego di corticosteroidi.
Il trattamento con radioiodio può essere definito ragionevolmente sicuro, comunque associato ad un rischio basso di complicanze a breve e lungo termine, correlate alla dose di attività cumulativa somministrata, quali ad esempio, il danno a carico delle ghiandole salivari, l'ostruzione dei dotti nasolacrimali e l'induzione di secondi tumori (leucemie, tumori delle ghiandole salivari e del colon-retto). Non è possibile indicare con certezza un valore di singola dose o una dose cumulativa assolutamente sicura e, per questo, è sempre necessaria un'accurata giustificazione che tenga conto sia dei vantaggi che dei rischi del trattamento.
Non è infrequente che pazienti sottoposti a tiroidectomia totale e trattamento ablativo ed apparentemente guariti presentino, nel corso del follow-up a lungo termine, livelli dosabili di Tg ematica circolante con scintigrafia con 131-I a dosi diagnostiche negativa [31].
Allo scopo di escludere recidive loco-regionali e a distanza è necessario in primo luogo eseguire lo studio ecografico del collo e l'esame TC spirale del torace a strato sottile (5-7 mm), ricordando che l'eventuale uso del m.d.c. organoiodato per lo studio del mediastino ritarda di alcuni mesi un successivo trattamento con 131-I.
Qualora non risultino evidenti lesioni curabili con chirurgia, può essere presa in considerazione la somministrazione di un'elevata attività di 131-I (100-200 mCi) a scopo diagnostico o terapeutico. Tale approccio può identificare malattia residua fino al 50% dei casi, a causa della maggiore disponibilità in circolo di radiofarmaco, del più alto accumulo intra-lesionale e del più elevato rapporto lesione/fondo.
Inoltre, il trattamento è tanto più efficace quanto più è precoce, poiché le cellule neoplastiche tiroidee di piccole metastasi sono nel complesso più sensibili alle radiazioni di quelle di ampie metastasi.
Qualora un'attività empirica di 131-I (100-200 mCi) non riesca a localizzare malattia residua, dovrebbe essere presa in considerazione l'esecuzione di uno studio PET con 18F-FDG, soprattutto in pazienti con valori di Tg non stimolata > 10-20 ng/ml. In caso di lesioni 131-I negative, ma PET-positive, non suscettibili di terapia chirurgica, possono essere prese in considerazione altre opzioni terapeutiche quali un trattamento radiante esterno,la chemioterapia, l'ablazione con radiofrequenze, la chemioembolizzazione o, in presenza di un quadro clinico stabile, osservazione e terapia ormonale soppressiva.
2) Trattamento con radioterapia esterna (EBRT)
Nelle neoplasie tiroidee le indicazioni attuali all'uso di questa modalità terapeutica sono generalmente empiriche data la scarsità in letteratura di studi prospettici randomizzati. Il trattamento con EBRT di pazienti affetti da neoplasie di derivazione epiteliale follicolare è stato proposto soprattutto quando le principali metodiche di cura (chirurgia, terapia radiometabolica con 131-I) non erano praticabili o hanno avuto scarsi presupposti di efficacia. Ciò era legato anche alla scarsa efficacia di tale metodica in rapporto agli eventi avversi ad essa correlati, data la stretta vicinanza della tiroide al midollo osseo ed a tutte le strutture contenute nel mediastino superiore che così entravano a far parte del volume di trattamento cosiddetto "elettivo".
Tale volume, morfologicamente complesso, si trova poi all'interno di sezioni corporee di spessore e conformazione assai differente: ciò rende pertanto molto difficile la programmazione e l'attuazione di una distribuzione di dose ottimale, tale da assicurare dosi efficaci al tumore e risparmiare adeguatamente gli organi a rischio. Ad oggi l'impiego della IMRT (Intensity Modulated Radiation Therapy)consente una distribuzione di dose più idonea ad irradiare un volume bersaglio di forma complessa con spessori diversi al proprio interno, permettendo un maggior risparmio agli organi critici.
con 131-I, chemioterapia antiblastica) in alcune situazioni cliniche ed in pazienti affetti da tumori di derivazione follicolare in fase avanzata di evoluzione.
Le moderne tecniche di EBRT consentono di conformare la dose anche a volumi complessi senza incremento sostanziale di danni iatrogeni ai tessuti sani circostanti con la possibilità di erogare anche dosi più elevate. Questo può comportare un miglioramento del risultato terapeutico, almeno in termini di contenimento delle recidive loco-regionali, con allargamento dello spettro delle indicazioni.
Indicazione particolare riveste il carcinoma anaplastico data la sua estrema aggressività che relega l'EBRT all'indicazione di palliazione, alla stregua degli altri metodi di cura.
3) Trattamento con chemioterapia
Nelle forme differenziate in progressione, quindi non più responsive al trattamento con radioiodio, il ricorso alla chemioterapia fornisce nel complesso risultati deludenti.
Da vari studi emerge chiaramente come le chemioterapie al momento disponibili non costituiscano un presidio efficace nel controllare l'evoluzione di una neoplasia in progressione. Sono tuttavia in fase di sviluppo e di valutazione nuovi approcci farmacologici, che sembrano promettere interessanti possibilità di successo.
CAPITOLO 3
IL TRATTAMENTO DELLE METASTASI OSSEE 3.1 Generalità
Le nuove conoscenze su eziologia e patogenesi di molte neoplasie, associate a metodiche di screening sempre più affidabili, hanno reso possibile diagnosticare molti tumori sempre più precocemente in modo da trattarli in fase sempre più iniziale.
Tuttavia il miglioramento delle terapie delle neoplasie primitive e la maggior sopravvivenza hanno indotto un maggior numero di pazienti metastatici.
Ad oggi quindi il termine "metastasi" non va più considerato come una condanna a breve termine per il paziente ma, soprattutto per quanto riguarda le metastasi ossee, è divenuto sinonimo di malattia con dignità autonoma, problematiche terapeutiche multidisciplinari ed aspettativa di vita talvolta lunga.
Il trattamento delle metastasi ossee deve quindi interessare molteplici aspetti e figure specialistiche diverse per mirare al controllo del dolore, alla prevenzione e/o al trattamento delle problematiche meccaniche determinate dal cedimento strutturale dell'osso sostituito dalla neoplasia e quindi al mantenimento di una buona qualità di vita della persona malata.
Lo scheletro è la terza sede più frequente per metastasi da carcinoma dopo polmone e fegato.
neoplasie con tendenza a dare metastasi ossee; a queste si devono aggiungere le neoplasie della serie ematologica, che danno localizzazioni ossee simili alle metastasi, e una gran parte di metastasi che vengono riscontrate solo in sede autoptica [5].
Sebbene quindi non sia possibile stimare una reale incidenza di tali lesioni in corso di neoplasie primitive è stato dimostrato come la loro diagnosi modifichi profondamente la sopravvivenza del paziente affetto da carcinoma: sempre secondo i dati del ACS la sopravvivenza a 5 anni cambia significativamente per i pazienti non metastatici rispetto a quelli invece già metastatici all'esordio.
Rispettivamente è stata osservata per il carcinoma della prostata una riduzione dal 100% al 33%, per il carcinoma della mammella dal 89% al 26% mentre per il carcinoma tiroideo dal 97% al 56%.
Questi dati dimostrano comunque che anche il paziente metastatico può avere una lunga sopravvivenza nonostante una malattia in stadio avanzato.
L'aspetto fondamentale per la scelta del trattamento, sia esso chirurgico o meno, riguarda la considerazione di molte variabili, quali le caratteristiche del tumore primitivo, il numero, la sede e le caratteristiche delle metastasi ossee e non, le condizioni cliniche del paziente, tutti aspetti che descrivono le possibilità di sopravvivenza del paziente affetto da quel tipo di tumore primitivo e da quel tipo di metastasi ossea ad esso correlata.
Quando l'aspettativa di vita risulta essere limitata il trattamento è generalmente di tipo palliativo, volto al controllo del dolore o al trattamento delle complicanze meccaniche; in caso invece di una buona e lunga aspettativa di vita il trattamento
delle metastasi deve essere più aggressivo e soprattutto adatto a durare nel tempo. Alla luce di ciò pare evidente come identificare i principali fattori prognostici sia indispensabile per scegliere il giusto iter terapeutico per ciascun paziente.
Attualmente, da un'accurata analisi della letteratura emergono delle comuni correnti di pensiero sull'identificazione di tali fattori prognostici ed in alcuni casi sono stati proposti anche dei sistemi a punteggio per la stadiazione del paziente con metastasi da carcinoma sia a livello dello scheletro assile che degli arti.
Dagli anni 90' ad oggi, dall'analisi di numerosi studi come quello di Tokuhashi et al. [32], Tomita et al. [33], Bohm et al. [34] e Kataghiri et al. [35] sono stati proposti molti parametri, da utilizzare a fini stadiativi, quali il tipo di tumore primitivo, la presenza ed il numero di metastasi viscerali (trattabili ed intrattabili), il Performance status (ECOG) del paziente [36], il numero delle metastasi ossee (isolate o multiple) o la presenza o rischio di frattura patologica (sede/dimensioni della lesione; tipo di lesione osteolitica o osteoaddensante).
I fattori più significativi descritti da tutti gli autori sono fondamentalmente due: il tipo di tumore primitivo e la presenza di metastasi viscerali.
Altri due fattori considerati importanti sono il numero di localizzazioni scheletriche (metastasi solitaria o multipla), se queste risultano essere sincrone o metacrone alla neoplasia primitiva al momento della diagnosi e la presenza di impending fracture o di frattura patologica.
Da ciò si evince quanto sia essenziale conoscere i principali carcinomi responsabili di metastasi ossee. Tumori a lenta crescita, spesso responsivi alle
rapida crescita possono esordire con la metastasi stessa.
La frattura patologica è chiaramente un'indicazione al trattamento chirurgico, anche in pazienti con condizioni generali molto scarse, e non è da meno l'impending fracture. Un' esatta definizione di “impending fracture” è tuttora difficile da reperire, sebbene sia ormai largamente accettato da tutti gli specialisti che può essere definita tale una condizione in cui almeno il 50% della massa ossea risulta distrutta poiché solo in questi casi ciò è evidenziabile attraverso un esame radiografico.
Nel 1989 Mirels [37] sviluppò un sistema a punteggio, combinando 4 diversi
aspetti delle lesioni metastatiche quali dolore, sede, tipo di metastasi ed estensione della stessa, per quantificare il rischio di frattura patologica e scegliere più attentamente l'eventuale trattamento da intraprendere; intervenire prima che la frattura si manifesti è molto più pratico per il chirurgo e soprattutto meno disagevole per il paziente.
Mirels scoring system:
1 2 3
Sede Arto superiore Arto inferiore Zona peritrocanterica
Dolore Lieve Severo Moderato
Lesione Osteoblastica Mista Osteolitica
Estensione <1/3 1/3 - 2/3 >2/3
Un punteggio ≤ 7 è indicativo di basso rischio di frattura, un punteggio di 8 è associato ad un rischio del 15% mentre il rischio cresce addirittura al 33% in caso di
punteggio ≥ 9.
La diagnostica del paziente oncologico con metastasi ossea ai fini di un adeguato iter terapeutico deve tener conto di alcuni esami fondamentali.
Se la primitività è già nota, il protocollo diagnostico da seguire sarà:
– Esame Rx standard del segmento scheletrico coinvolto, anche per
distinguere tra una metastasi dello scheletro assile da quello appendicolare; le metastasi osteoaddensanti appariranno come aree intraossee di opacità fortemente aumentata, con limiti sfumati ed aspetto "cotonoso" che frequentemente sconfinano dai limiti della corticale. Le metastasi osteolitiche sono aree di radiotrasparenza intraossea, a limiti sfumati, talora plurime, con frequente lisi della corticale;
– Scintigrafia Ossea Total Body per valutare il numero delle lesioni;
– TC Total Body con mdc oppure esame PET per determinare eventuali
metastasi viscerali;
– RMN con mdc per studiare i rapporti tra la lesioni e le parti molli circostanti.
Nel caso di lesioni del rachide sarà necessaria una RMN del rachide in toto;
– TC del segmento scheletrico coinvolto per studiare l'entità del danno
È tuttavia raccomandabile, in presenza di qualunque dubbio diagnostico, eseguire una biopsia, anche estemporanea, della lesione ossea; nel caso di lesioni del vertebrali si esegue generalmente un'agobiopsia TC-guidata oppure a Fluoroscopio-guidata.
Aspetto fondamentale da non trascurare è il rischio di frattura in sede di lesione metastatica; i parametri più significativi, sia pur non assoluti, che possono aiutare ad una valutazione oggettiva del rischio sono l'estensione dell'osteolisi superiore al 50% del diametro osseo, una sua estensione longitudinale maggiore di 25-30 mm e il dolore, soprattutto sotto carico.
L'esame TC del segmento interessato è pertanto l'esame più utile per eseguire tali valutazioni poiché dà una migliore e più precisa rappresentazione delle corticali; è tuttavia un esame importante per la scelta chirurgica per cui la sua esecuzione sarà da riservarsi a pazienti per i quali è già stata stimata una buona sopravvivenza e quindi la possibilità di essere sottoposti ad un eventuale trattamento chirurgico.
Procedura riservata ai pazienti da sottoporsi a trattamento chirurgico, e talvolta come trattamento palliativo, è l'angiografia preoperatoria con embolizzazione
selettiva. È una metodica angiografica terapeutica, il cui scopo è occludere i vasi
afferenti ad una neoformazione. Il meccanismo di azione è la necrosi ischemica indotta dall’occlusione dell’albero vascolare della lesione, la quale deve avvenire il più distalmente possibile a livello delle arteriole terminali prive di collaterali che sono l’unica fonte di apporto ematico al territorio da ischemizzare.
L’occlusione vascolare è provocata da materiale che blocca il flusso ematico e facilita la trombogenesi. Il materiale embolizzante viene introdotto selettivamente mediante cateterismo dei vasi arteriosi afferenti alla neoplasia. I materiali embolizzanti differiscono per caratteristiche fisico-chimiche, (liquidi e solidi) e per tipo di occlusione (permanente o temporanea).
I materiali embolizzanti liquidi sono N-Butil(2)Cianoacrilato, Alcool puro e Onyx mentre materiali embolizzanti solidi sono Microsfere, Spirali metalliche, Alcool polivinilico e Spongostan®.
L’embolizzazione arteriosa è una metodica non scevra da rischi che va eseguita soltanto presso centri specializzati al fine di ridurre eventuali complicanze, che in determinati distretti, come il rachide, potrebbero essere estremamente invalidanti.
Le complicanze sono essenzialmente rappresentate dalla embolizzazione di territori non lesionali.
3.2 Il trattamento chirurgico delle metastasi ossee
Il trattamento chirurgico delle metastasi ossee necessita innanzitutto di differenziare tra metastasi della colonna vertebrale e metastasi dello scheletro appendicolare e della pelvi.
I pazienti vengono quindi assegnati ad una delle seguenti classi:
• CLASSE 1 – metastasi scheletrica solitaria da tumore primitivo a buona prognosi (mammella, prostata, rene e tiroide) e con prolungato intervallo libero di malattia (> 3 anni) dal primitivo ai secondarismi.
• CLASSE 2 – frattura patologica nelle ossa lunghe principali (omero, radio, ulna, femore e tibia).
• CLASSE 3 – lesione a rischio di frattura patologica nelle ossa lunghe principali valutata in base ai seguenti parametri: lesione litica della corticale ≥ 2,5 cm, distruzione della corticale ≥ 50% del diametro e dolore persistente o progressione della lesione dopo radioterapia e/o chemioterapia;
• CLASSE 4 – lesioni metastatiche osteoblastiche, lesioni osteolitiche o miste in ossa non sottoposte a carico (ulna distale, coste, perone, clavicola), lesioni non a rischio di frattura nelle principali ossa lunghe, lesioni per le quali l'unico trattamento possibile è l'amputazione dell'arto, lesioni dell'ala iliaca, arco pelvico anteriore e scapola (eccetto quelli in Classe 1);
Quando e Come operare
I pazienti delle CLASSI 1, 2 e 3 devono essere inviati in prima istanza al chirurgo ortopedico per il trattamento chirurgico ed in seguito all’oncologo medico e/o al radioterapista per le terapie adiuvanti. I pazienti della CLASSE 4 devono essere trattati in prima istanza con terapie non chirurgiche (chemioterapia, radioterapia, terapia ormonale, etc.) ed in caso di fallimento meccanico (frattura patologica o progressione di malattia con lesione a rischio di frattura) o di dolore persistente dopo le terapie, rientrano nelle classi 2 e 3 e vengono trattati chirurgicamente (Tab.1). In alcuni pazienti della classe 4 possono essere adottate tecniche mini invasive.
Tab.1. Indicazioni al trattamento chirurgico e conservativo secondo la classe di appartenenza (CT: chemioterapia; HT: ormonoterapia; IT: immunoterapia; BP: bifosfonati)
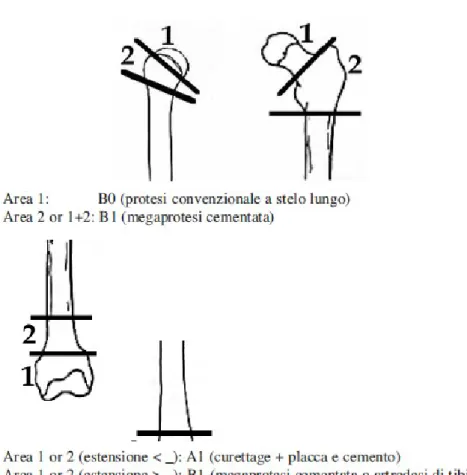
Il tipo di trattamento chirurgico e di ricostruzione viene deciso considerando diversi parametri biologici e biomeccanici e, nelle lesioni diafisarie, un sistema a punteggio permette di identificare la ricostruzione più appropriata per ogni singolo paziente. L’aspettativa di sopravvivenza, il tipo di tumore primitivo, il numero di metastasi scheletriche, la presenza di metastasi viscerali, l’intervallo libero da malattia e le condizioni generali del paziente sono i parametri biologici considerati. La sede e le dimensioni della lesione, l’aspetto radiografico e la prevista sensibilità alle terapie non chirurgiche sono i parametri biomeccanici considerati.
Classe 1:
I pazienti di questo gruppo possono sopravvivere a lungo ed il trattamento chirurgico in questi casi deve comprendere l’asportazione della lesione metastatica (possibilmente con margini ampi) e la ricostruzione con metodiche adatte a durare nel tempo. In questi pazienti, la metastasi viene trattata come un tumore primitivo e l’intervento è mirato ad un risultato oncologico e meccanico stabile a lungo termine. Una resezione articolare o intercalare in questi casi viene ricostruita con sistemi protesici modulari cementati e spaziatori intercalari.
Le lesioni metastatiche solitarie delle ossa spendibili (perone, coste, clavicola, ulna distale) possono essere facilmente resecate senza alcun residuo funzionale. Nelle lesioni di classe 1 della scapola è indicato eseguire una scapulectomia totale che determina la perdita della funzione in abduzione ed elevazione della spalla. La resezione dell’ala iliaca e dell’arco pelvico anteriore può essere eseguita senza importanti deficit funzionali residui. In questi casi, la ricostruzione scheletrica di