1. INTRODUZIONE
1.1 Gamma-glutamiltransferasi
1.1.1 Generalità, struttura e localizzazione
La γ-glutamil-transferasi (GGT, E.C. 2.3.2.2) è un enzima localizzato sulla membrana plasmatica di molti tipi cellulari del regno animale oltre a essere stato individuato in batteri e piante. Esso catalizza il primo passaggio del processo di degradazione del glutatione (GSH) extracellulare attraverso la scissione del legame γ-glutammilico (Tate e Meister, 1981).
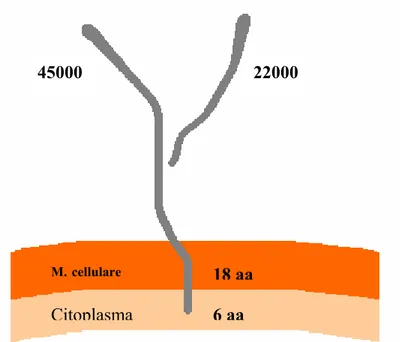
La GGT è una glicoproteina dimerica sintetizzata da un unico propeptide (Curthoys e Hughey, 1979) scisso in 2 subunità, una pesante (55-62 KDa) e una leggera (20-30 KDa), prima di raggiungere la membrana plasmatica (Barouki et al., 1984; Finidori et al., 1984); la subunità leggera, che presenta un dominio carbossi-terminale con attività catalitica, è unita alla subunità pesante mediante interazioni elettrostatiche (Tate e Meister, 1981); sulla porzione ammino-terminale della catena pesante è presente un dominio idrofobico che permette l’inserzione dell’enzima sul lato esterno della membrana cellulare, in questo modo entrambe le subunità risultano in contatto con l’ambiente extracellulare (Finidori et al., 1984).
Fig 1.1 Rappresentazione della GGT. Tutta l’attività catalitica dell’enzima è
presente all’esterno della cellula.
Pertanto l’enzima agisce su substrati extracellulari ed è stato dimostrato che la catena leggera stessa può avere attività proteasica ed è capace di digerire la catena pesante (Gardell e Tate 1979). Tale attività in vivo sembra essere mascherata dalla catena pesante.
La GGT è preferenzialmente espressa a livello di tessuti epiteliali implicati in attività secretorie e di assorbimento. Elevata attività di GGT è riscontrabile sulla superficie luminale delle cellule del tubulo contorto prossimale del rene (mentre le cellule del tubulo distale e dei glomeruli ne sono praticamente prive), nelle cellule epiteliali delle vie biliari extraepatiche e dei canalicoli epatici, nelle cellule acinose del pancreas. Positive per attività di GGT sono anche le cellule endoteliali dei capillari del cervello (es. del plesso corioideo), del corpo ciliare e del midollo spinale, le cellule delle ghiandole sudoripare, delle ghiandole sottomandibolari, dei
18 aa 6 aa 22000 45000 M.cellulare Citoplasma
dotti galattofori, dell’epitelio bronchiale, dell’epididimo, delle vescicole seminali e della prostata (Hanigan e Pitot, 1985; Hanigan e Frierson, 1996). La GGT è inoltre presente in quasi tutte le linee cellulari del sangue e in particolare nelle piastrine è situata all’interno di granuli secretori. La GGT presente nel siero è quella rilasciata dalle membrane cellulari dei parenchimi dei vari organi, di conseguenza le sue variazioni riflettono le modificazioni quantitative della produzione e del rilascio dell’enzima nel sangue (Iannaccone e Koizumi, 1983).
1.1.2 Espressione genica, biosintesi e processamento della GGT
L’espressione dei geni della GGT riflette una complessa organizzazione tra le diverse specie e anche nell’uomo esistono differenze a seconda dell’organo d’origine e/o del tipo cellulare preso in esame (Chikhi et al., 1999). Nel genoma umano è presente una famiglia multigenica per la GGT che include almeno 7 differenti geni (Courtay et al., 1994) mappati sul cromosoma 22 nella regione 22q11.1-q11.2 vicino ai loci BCR (breakpoint cluster region) e IG-λ (Bulle et al., 1987; Collins et al., 1997). Sequenze correlate, probabilmente pseudogeni, sono state identificate sui cromosomi 18, 19, 20 (Figlewicz et al., 1993).
In una genoteca umana, costituita con DNA estratto da una linea cellulare di linfoblasti cariotipicamente normali, sono stati identificati dei cloni rappresentati da tutti i sette geni, ciò esclude che questi sette tipi di cloni genomici siano alleli di un singolo gene altamente polimorfico (Courtay et al., 1994). Di questi sette geni è stata analizzata l’espressione e per cinque di essi è stato individuato l’RNA, ma tra questi solo il gene I ha espressione ubiquitaria e dà origine ad una proteina completa
e funzionale. Per gli altri quattro geni espressi non è stata ancora identificata la relativa proteina (Courtay et al., 1994).
Studi di traduzione in vitro hanno permesso di stabilire che l’mRNA di tipo I completo è tradotto in un unico propeptide senza attività di GGT. La sequenza idrofobica all’estremità amminica permette alla proteina di essere traslocata nel lume del reticolo endoplasmatico.
Nel 1995, Brannigan e collaboratori hanno riconosciuto una superfamiglia di proteine chiamate idrolasi nucleofile N-terminali (Nucleofilo N-ter) caratterizzate da una struttura αββα presente nel dominio catalitico. Tutte le idrolasi nucleofile N-terminali sono trascritte e tradotte in un singolo propeptide processato autocataliticamente ad enzima attivo. Il processo di autocatalisi rende disponibile l’amminoacido nucleofilo N-terminale che catalizza l’idrolisi del legame amminico. La GGT, avendo tutte le caratteristiche appena menzionate, può essere considerata un membro della superfamiglia delle idrolasi nucleofile N-terminali (Suzuki and Kumagai, 2002). Tra i membri di questa superfamiglia si ricordano la penicillina G amilasi, il proteasoma, l’aspartilglucosaminidasi, la glutammica PRPP aminotrasferasi (GAT) e la L-amminopeptidasi-D-Ala-esterasi/amidasi (Oinonen e Rouvinen, 2000).
La GGT non ha isoenzimi intesi come proteine di diversa sequenza aminoacidica ma con la stessa attività catalitica, però esiste una considerevole varietà di isoforme che differiscono nel loro contenuto in carboidrati; infatti ci sono otto potenziali siti di glicosilazione e la proteina è glicosilata in maniera eterogenea e tessuto specifica.
1.2 Attività catalitica della GGT
La GGT catalizza l’idrolisi di γ-glutamil composti attraverso il trasferimento del gruppo γ-glutammilico da un substrato donatore al gruppo amminico di un accettore amminoacidico o dipeptidico (Curthoys e Hughey,1979) (fig.1.2).
Fig1.2. Reazione catalizzata dalla GGT (Hanigan, 1998).
I principali accettori del gruppo γ-glutammilico sono: cistina, cisteina, L-glutammato, L-alanilglicina, glicilglicina, L-serilglicina (Griffith et al., 1979; Tate e Meister, 1981). Il glutatione è il principale substrato fisiologico dell’enzima, ma tutti i γ-glutammil composti sono substrati della GGT (Magnan et al., 1982).
Diverse sostanze sono in grado di inibire l’attività catalitica della GGT (Meister, 1983), tra queste troviamo l’acivicina [acido L-(αS,5S)-α-ammino-3-cloro-4,5-diidro-5-isossazolo-acetico], un potente inibitore irreversibile della GGT che si lega stabilmente alla serina in posizione 406 sulla catena leggera dell’enzima (Smith et al., 1995) e il complesso serina-borato, che agisce con un meccanismo di inibizione competitiva in quanto la serina mima la struttura α-carbossilica del gruppo γ-glutammilico del substrato (Tate e Meister, 1978).
1.3 Il glutatione: struttura e generalità
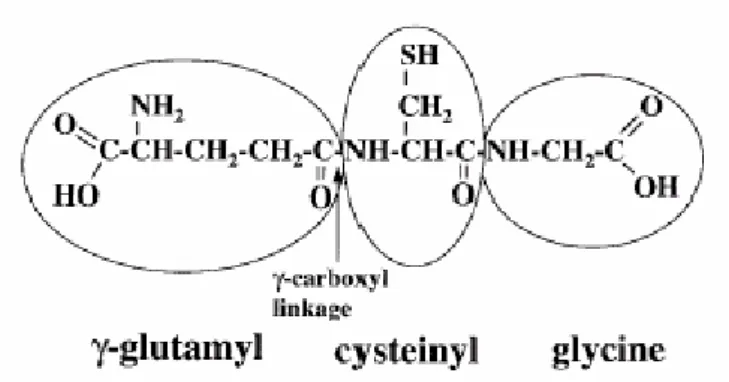
Il glutatione è un tripeptide ubiquitario presente in molte piante, microrganismi e in tutti i tessuti dei mammiferi. Composto da acido glutammico, cisteina e glicina (γ-glutamilcisteinilglicina), presenta la particolare caratteristica di avere i residui di acido glutammico e di cisteina uniti non da un normale legame peptidico, ma da un legame γ-glutammilico: è infatti il gruppo carbossilico (-COOH) sul carbonio γ dell’acido glutammico ad essere legato al gruppo amminico (-NH2)
sul carbonio α della cisteina (Fig.1.3.).
Fig. 1.3 Rappresentazione della struttura del glutatione (γ-glutammilcisteinilglicina).
La freccia indica il legame γ-glutammilico (Lu, 1999).
Il GSH rappresenta circa l’80% dei tioli non proteici a basso peso molecolare presenti nella cellula ed è distribuito in tre compartimenti: il 90% circa è dislocato a livello citosolico, il 10% nei mitocondri e una residua percentuale nel reticolo endoplasmatico (Meredith e Reed, 1982; Hwang et al., 1992; Lu, 1999).
Il glutatione può esistere in forma ridotta (GSH) e in forma ossidata (GSSG), la forma ossidata deriva dalla formazione di un ponte disolfuro tra due molecole di GSH. La forma ridotta è ampiamente predominante all’interno della cellula, con un rapporto che in condizioni normali è dell’ordine di 1:10/1:100 (Meister e Anderson,
cisteina conferisce al GSH proprietà antiossidanti che gli permettono di interagire con specie reattive dell’ossigeno o con altre sostanze elettrofile nell’ambito di numerosi sistemi antiossidanti intracellulari.
1.4 Le funzioni fisiologiche delle GGT
1.4.1 Il ruolo antiossidante: la sintesi del glutatione
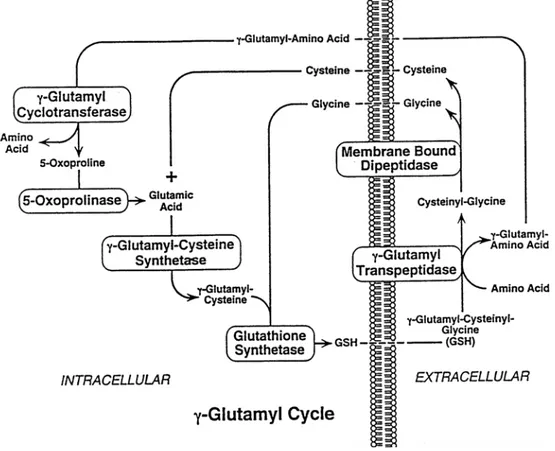
Le funzioni fisiologiche della GGT sono in parte oscure; le conoscenze a proposito del suo ruolo riguardano le funzioni che essa svolge a livello della membrana plasmatica. Qua la GGT catalizza il primo passo della degradazione extracellulare del glutatione (GSH), cioè l’idrolisi del legame gamma-glutamilico tra acido glutammico e cisteina, due dei tre amminoacidi (il terzo è la glicina) che compongono il GSH. La porzione γ-glutammilica viene donata a accettori amminoacidici i quali, trasportati all’interno della cellula, sono il substrato dell’enzima γ-glutamil-ciclotransferasi che li scinde nei corrispettivi amminoacidi (Griffith et al, 1979; Tate e Meister, 1981), e in 5-oxoprolina, la quale può essere nuovamente convertita in acido glutammico dall’enzima 5-oxoprolinasi e usata quindi per la resintesi del GSH intracellulare (Meister e Anderson, 1983). Il dipeptide cisteinil-glicina è idrolizzato dalle dipeptidasi di membrana in cisteina e glicina, che sono riassorbite dalla cellula e possono essere riutilizzate nella sintesi
de novo del GSH (Allison e Meister, 1981; Hanigan e Ricketts, 1993). La GGT
inoltre favorisce il recupero del GSH uscito dalla cellula secondo gradiente di concentrazione. L’insieme delle reazioni collegate all’attività di GGT e quelle che portano alla sintesi ed all’efflusso del GSH costituiscono quello che viene definito il
Il GSH è uno degli agenti riducenti più importanti ed è inoltre cofattore degli enzimi coinvolti nel metabolismo dell’acqua ossigenata, di perossidi organici e di radicali liberi. Poiché la GGT dà inizio alla degradazione del GSH extracellulare rendendo possibile la successiva captazione degli amminoacidi che lo compongono da parte della cellula (ciclo del γ-glutammile), viene considerata un enzima ancillare dei sistemi antiossidanti basati sul GSH; da questo punto di vista l’enzima potrebbe avere un ruolo protettivo contro il danno ossidativo intracellulare (Hanigan e Pitot, 1985; Hanigan et al.,1998) (Fig 1.4).
Fig 1.4 Ciclo del γ-glutammile (Lieberman et al., 1995)
Attraverso il ciclo del γ-glutammile la GGT gioca un ruolo importante per il trasporto transmembrana degli amminoacidi che compongono il glutatione fra cui la
cys, fondamentale per la sintesi proteica; in casi di deficit enzimatico, tuttavia, non sono stati riscontrati particolari problemi di trasporto di tali amminoacidi.
Un’ulteriore conferma del legame molto stretto fra glutatione e GGT si è avuta osservando che, se veniva inibita la produzione di glutatione nei topi attraverso dietilmaleato, la concentrazione di GGT-mRNA aumentava significativamente negli epatociti e così pure la concentrazione sierica dell’enzima (Moriya et al., 1994).
1.4.2 Escrezione degli acidi biliari.
Nel fegato l’attività di GGT è regolata dagli acidi biliari liberi e coniugati. Gli acidi biliari liberi (colato, chenodesossicolato, desossicolato) stimolano l’attività enzimatica della GGT con conseguente incremento delle reazioni di idrolisi e di transpeptidazione del GSH fondamentali per il rifornimento di amminoacidi utilizzati nei processi di coniugazione. Gli acidi biliari coniugati con glicina e taurina stimolano la reazione di idrolisi a livello di dotti biliari, ma inibiscono quella di transpeptidazione con un meccanismo di feed-back negativo, riducendo così la disponibilità degli amminoacidi necessari per la formazione dei coniugati (Abbott e Meister, 1983).
1.4.3 Il ruolo pro-ossidante della GGT
Se da un lato abbiamo visto come la GGT permetta la sintesi di un importante antiossidante intracellulare, d’altra parte negli ultimi anni si è sempre più indagato circa le possibili implicazioni pro-ossidanti che la GGT può assumere in particolari condizioni.
Il substrato della GGT, il GSH, è un tripeptide le cui proprietà antiossidanti sono basate sulle capacità riducenti del gruppo tiolico (-SH) del residuo amminoacidico di cisteina. I tioli, però, specialmente nella loro forma dissociata di anione tiolato (R- S¯), possono cedere elettroni (cioè possono ridurre) cationi metallici come ferro e rame. Questo fenomeno innesca il trasferimento degli stessi elettroni dai cationi metallici all’ossigeno molecolare, generando anione superossido e acqua ossigenata, i quali in presenza di Fe3+, libero (reazione di Fenton) o chelato all’ADP (reazione di Haber-Weiss), possono generare radicali idrossili che insieme al radicale tiile danno inizio alle reazioni a catena della perossidazione lipidica, con conseguente perdita della struttura e della stabilità della membrana cellulare, nonché delle sue importanti funzioni (Zalit et al., 1996).
LPO O H ° + O H-
O2
G SH Fe2+-AD P (Haber W eiss reaction)
G G T H+ H2O2 2H
+
O2
O2- °
CG CG- Fe3+ O2- ° H2O2
Thiolate anion Superoxide
dism utase
LPO C G ° Fe2+ O2
Thiyl radical
Fig.1.5 Reazioni proossidanti conseguenti all’attività della GGT.
E’ importante sottolineare come questi fenomeni avvengono almeno inizialmente sul lato esterno della membrana e quindi all’esterno della cellula, e perciò non sottoposti ai meccanismi di difesa in essa contenuti (Maellaro et al., 2000).
Mentre il GSH, a causa delle peculiari proprietà del gruppo carbossilico libero del suo residuo di acido glutammico, è poco propenso a ridurre cationi metallici, la sua idrolisi da parte della GGT determina il rilascio di un catabolita, la cistenilglicina, molto più reattivo ed estremamente efficiente nel ridurre i cationi metallici, innescando così la produzione di radicali liberi e specie reattive dell’ossigeno.
L’azione proossidante della GGT è legata alla presenza di metalli redox attivi nell’ambiente extracellulare, cosa che in vivo è fortemente prevenuta grazie alla formazione di complessi quali ferritina, transferrina e ceruloplasmina che non permettono ai metalli di catalizzare reazioni con radicali liberi. A tal proposito è interessante osservare che l’attività di GGT è in grado di ridurre e di promuovere il rilascio degli ioni ferro legati alla transferrina (Drozdz et al., 1998; Dominici et al., 2003a) e che l’azione proossidante è stata osservata anche in presenza di ceruloplasmina (Glass e Stark, 1997), ovvero due sorgenti fisiologiche di ioni di metalli di transizione. Inoltre il rilascio di ioni ferro dalle loro forme di immagazzinamento è stato osservato in molte condizioni fisiopatologiche, un processo questo che potrebbe rendere i metalli disponibili per promuovere l’azione proossidante della GGT (Paolicchi et al., 2002a).
E’ stato anche osservato che l’attività di GGT poteva promuovere l’ossidazione GSH-Fe dipendente delle lipoproteine a bassa densità (LDL) umane isolate promuovendo un processo che si ritiene essere fondamentale nella formazione della placca aterosclerotica e del danno vascolare (Berliner e Heinecke, 1996; Paolicchi et al., 1999).
1.4.4 Il metabolismo del nitrosoglutatione
Il nitrosoglutatione (GSNO) è un metabolita del GSH e dell’ossido nitrico (Hart, 1985) che può avere numerose attività farmacologiche come ad esempio l’inibizione dell’aggregazione piastrinica, la protezione dal danno da riperfusione cardiaca e durante l’esposizione ad agenti ossidanti (Konorev et al., 1995). Il GSNO, appartenendo alla classe dei composti γ-glutammilici, è un possibile substrato per l’enzima GGT. Hogg e collaboratori (1997) hanno dimostrato che in vitro la GGT, in presenza di Gly-Gly come accettore della reazione di transpeptidazione, catalizzava la conversione di GSNO in 5-nitroso-cistenil-glicina (CG-SNO) con una Km più elevata di quella in presenza di GSH (Singh et al. 1995). Il CG-SNO in presenza di ioni metallici di transizione si dissociava spontaneamente in Cys-Gly e NO.
Zeng e collaboratori (2001), studiando il meccanismo di decomposizione del GSNO usando cellule endoteliali di aorta bovina (BAEC), hanno concluso che il meccanismo di decomposizione del GSNO mediato da tali cellule endoteliali comportava la riduzione di disolfuri extracellulari a gruppi sulfidrilici che a loro volta riducevano il GSNO. Pertanto questi autori hanno ipotizzato che il GSNO si degradasse in seguito ad una modificazione dello stato di ossido-riduzione dell’ambiente extracellulare. La GGT potrebbe partecipare a tali modificazioni tramite la promozione di reazioni pro-ossidanti che comportano una modulazione dei gruppi tiolici delle proteine sulla superficie esterna della membrana cellulare (Dominici et al., 2003b; Corti et al., 2005)
1.4.5 Il metabolismo dei leucotrieni e deficit di GGT
I leucotrieni (LTs) sono una classe di mediatori lipidici attivi
nell’infiammazione derivanti dall’acido arachidonico prodotti dall’azione dell’enzima lipossigenasi. Questa classe di molecole comprende il diidrossieicosatetraenoato LTB4 e i cisteinil-leucotrieni (LTC4 ,LTD4 e LTE4) che rappresentano costituenti biologicamente attivi da tempo conosciuti come “sostanze della risposta breve all’anafilassi”. I leucotrieni, C4 e D4 inclusi, legano specifici recettori sulle cellule muscolari liscie causando prolungata broncocostrizione (Anderson et al., 1982; Bernstrom e Hammarstrom, 1982). Il leucotriene LTC4 è coniugato ad una molecola di GSH ed è convertito in LTD4 dall’attività enzimatica della GGT, l’idrolisi del residuo di Gly da LTD4 porta alla formazione di LTE4 (Lewis et al., 1990).
E’ stato dimostrato inoltre che i cisteinil-leucotrieni sono vasocostrittori particolarmente potenti delle arterie coronariche e sono associati con eventi ischemici (Allen et al Circulation, 1998). Inoltre è noto che inibitori dell’enzima 5-lipoossigenasi e antagonisti dei recettori per i cisteinil-leucotrieni sono efficaci per ridurre l’estensione dell’infarto e dell’aritmia indotta dalla riperfusione in modelli animali e in ischemie indotte sperimentalmente. Il fatto che il livello di produzione dei cisteinil-leucotrieni aumenti nei pazienti con malattia coronarica è un ulteriore prova che i cisteinil-leucotrieni siano effettivamente implicati negli eventi coronarici e cardiaci. Per capire l’effettivo coinvolgimento dei leucotrieni nella risposta contrattile è stata confrontata l’entità di questo evento con la capacità delle arterie
coronariche, arterosclerotiche e non, di legare il LTC4 e il LTD4. Le arterie non
aterosclerotiche non rispondevano ai leucotrieni LTC4 e LTD4; al contrario queste
molecole inducono contrazione dose-dipendente sulle arterie aterosclerotiche che rispondevano con potenti contrazioni al LTC4 e con contrazioni più modeste al
LTD4. L’iper-reattività delle arterie coronariche arterosclerotiche ai leucotrieni
LTC4 e LTD4 non risentiva dell’azione di mediatori derivati dall’endotelio (Allen et
al., Circulation, 1998), ma era piuttosto dovuta ad un aumento del numero dei
recettori e quindi al potenziamento del sistema di trasduzione del segnale. Invece, non sembravano essere presenti recettori per cisteinil-leucotrieni nelle arterie coronariche non aterosclerotiche come suggerisce l’incapacità di LTC4 e LTD4 di
indurre la loro contrazione. Il ruolo della GGT nella modulazione degli effetti biologici dei cisteinil- leucotrieni non è stato ancora del tutto approfondito.
Il deficit di GGT è un disturbo molto raro e solo un esiguo numero di pazienti affetti è stato descritto in letteratura; proprio il metabolismo dei cisteinil-leucotrieni è stato recentemente studiato in tre pazienti con deficienza di GGT (Mayatepek et
al., 2004). Questi hanno mostrato un incremento nella concentrazione plasmatica e
urinaria di LTC4 insieme alla totale assenza di LTD4 e LTE4, mentre la sintesi di LTB4 è rimasta invariata. La deficienza di GGT può essere considerata come un errore ereditario della sintesi dei cisteinil-leucotrieni. Per motivi non ancora chiari, nei topi tale deficit è associato a gravi disturbi come ritardo di crescita e morte precoce. Tuttavia anche nei soggetti umani diversi disordini neurologici sono correlabili con la deficienza di GGT, in particolare per quanto riguarda il metabolismo dei leucotrieni; infatti, un deficit di sintesi di LTC4 è stato associato
ad una sindrome che può risultare fatale, la quale include una severa ipotonia muscolare, ritardo psicomotorio, sterilità e microcefalia (Mayatepek et al., 1998).
1.5 Effetti delle reazioni pro-ossidanti GGT dipendenti
Le specie reattive dell’ossigeno giocano un ruolo fondamentale nella modulazione di molte funzioni cellulari. In questo contesto la GGT e le reazioni proossidanti, conseguenti alla sua attività enzimatica, possono partecipare alla regolazione del metabolismo cellulare.
1.5.1 Azione modulatoria della GGT sui gruppi tiolici delle proteine
L’azione proossidante GSH/GGT dipendente può interferire con lo stato ossido-riduttivo dei gruppi tiolici delle proteine di membrana. Infatti queste sono il bersaglio primario delle molecole pro-ossidanti generate nell’ambiente extracellulare dall’azione della GGT. Il grado di ossidazione dei gruppi sulfidrilici delle proteine presenti sulla superficie cellulare è infatti aumentato in seguito alla stimolazione dell’attività di GGT mentre il processo è prevenuto dalla sua inibizione (Dominici et al., 2003). Il coinvolgimento di H2O2in questo processo è indicato dal
fatto che l’ossidazione dei gruppi sulfidrilici delle proteine è significativamente prevenuta in presenza di catalasi.
L’ossidazione dei tioli proteici della superficie cellulare non sembra essere dovuta alla sola interazione di H2O2, prodotta dall’attività della GGT, con i gruppi
sulfidrilici delle proteine (Radi, 1991; Quesada, 1996), ma è anche legata a processi di S-tiolazione che consistono nella formazione di un ponte disolfuro tra un gruppo
Molti dei gruppi sulfidrilici delle proteine si trovano nei siti attivi degli enzimi, la S-tiolazione ha quindi la duplice funzione di proteggere i sulfidrili delle proteine da un’ossidazione irreversibile e di modulare, in modo reversibile, la loro funzione (Coan et al., 1992; Schuppe-Koistinem et al., 1994; Sahaf et al., 2005). Infatti la “detiolazione”, processo attraverso cui si ha la riduzione dei disolfuri misti, ne ripristina la funzione (Del Corso et al., 1993; Ravichandran et al., 1994, Cabiscol e Levine, 1996). Un numero sempre maggiore di molecole sembra essere modulato tramite S-tiolazione, sia proteine di membrana che proteine citosoliche (Sen e Parker, 2002; Sies e Parker, 2002) come ad esempio H-ras (Mallis et al., 2001), la chinasi p59 delle cellule T (Hehner et al., 2000), la fosfatasi PTP1B (Barrett et al., 1999), c-jun (Klatt et al., 1999) NF-kB/p50 (Pineda-Molina et al., 2001) e la caspasi 3, implicata in processi apoptotici (Davis et al., 1997).
Anche la cisteinil-glicina originatasi dal catabolismo del GSH ad opera della GGT può concorrere alla formazione di ponti disolfuro con le proteine (Pompella et
al., 2003; Corti et al., 2005). La S-cisteinilglicilazione così come la S-tiolazione può
assumere due significati. In primo luogo, può essere interpretata come una difesa nei confronti dei danni ossidativi irreversibili (Coan et al., 1992; Thomas et al., 1995; Seres et al., 1996). In quest’ottica, essendo la GGT espressa ad alti livelli sia nei tumori che nelle metastasi (Tew et al., 1996) potrebbe contribuire alla resistenza delle cellule cancerogene nei confronti degli effetti citotossici dello stress ossidativo come nel caso di molti farmaci antitumorali ad attività proossidante (Daufeub et al., 2002; Paolicchi et al., 2002b; Paolicchi et al., 2003). In secondo luogo la S-cisteinil-glicilazione può avere una funzione regolatoria. E’ stato osservato che l’aumento della S-cisteinil-glicilazione comporta una diminuzione della S-glutatiolazione, ciò
potrebbe essere considerato un meccanismo mediante il quale le cellule esprimenti attività di GGT, come le cellule tumorali (Tew et. al, 1996), riescono a modulare lo stato redox e la funzione di proteine importanti presenti nella matrice extracellulare e sulla superficie di altri tipi cellulari, quali per esempio le cellule del sistema immunitario o endoteliali (Corti et al., 2005).
1.5.2 Bersagli molecolari intracellulari della GGT: NF-kB AP-1 e TNFR1
NF-kB è un fattore di trascrizione ubiquitario implicato nella regolazione di un ampio numero di geni che controllano vari aspetti delle risposte immunitarie ed infiammatorie (Baeuerle e Henkel, 1994). Diverse sono le evidenze sperimentali a favore di una modulazione cellulo-specifica dell’attività di questo fattore di trascrizione in relazione all’attività di GGT. Utilizzando cellule di criceto V79-GGT che esprimono un transgene per GGT, è stato visto che la produzione di specie reattive dell’ossigeno GGT-dipendente promuoveva sia il legame di NF-kB al DNA sia l’attivazione del gene (Accaoui et al., 2000). Un altro studio su cellule di melanoma umano Me665/2/60 ha dimostrato che la stimolazione dell’attività dell’enzima o la sua inibizione determinavano rispettivamente la stimolazione o l’inibizione della traslocazione nucleare di NF-kB (Maellaro et al., 2000). Tuttavia in concomitanza a una aumentata attività dell’enzima è stato osservato un diminuito legame di NF-kB al DNA come se questo fosse un meccanismo di autoregolazione per prevenire un’eccessiva attivazione di questo gene in condizioni di persistente stress ossidativo (Dominici et al., 2003b).
Analogamente, l’attività di GGT sembra essere in grado di promuovere il legame di AP-1 al DNA; l’acivicina ma anche altri inibitori della attività di GGT
sopprimono questo effetto a conferma del coinvolgimento dell’enzima (Paolicchi et
al., 2002a).
Il tumor necrosis factor receptor I (TNFR1) è un recettore che presenta nel dominio extracellulare alcuni motivi ricchi in cisteine direttamente coinvolti nel legame con il tumor necrosis factor-α (TNF-α, Chen et al., 1995). Ciò suggerisce che la GGT modificando lo stato redox delle cisteine presenti sul TNFR-I possa influenzare l’affinità di legame del TNF-α al recettore e di conseguenza modulare le risposte cellulari a questa citochina (Dominici et al., 2004).
La possible modulazione del TNFR-I da parte dell’attività di GGT è stata studiata in due cloni della linea cellulari di melanoma Me665/2 caratterizzati da diversi livelli di attività enzimatica. In queste cellule sono state identificate cinque forme di TNFR-I distinte per il grado di ossidazione dei residui di cisteina. La forma più ossidata è costitutivamente presente nel clone cellulare 2/60, caratterizzato da un’elevata espressione di GGT, ed è possibile osservarla nel clone 2/21 in seguito all’induzione dell’espressione dell’enzima. La modulazione del recettore TNFR-I in seguito all’attività di GGT potrebbe modificare l’affinità di legame del TNFα, e quindi modulare la risposta cellulare (Dominici et al., 2004).
1.5.3 Effetti sulla proliferazione cellulare e apoptosi
L’apoptosi ha un importante ruolo biologico di regolazione nella maggior parte dei processi fisiologici come il differenziamento, l’omeostasi e la rimozione di cellule anormali in tutti i tessuti (Granville et al., 1998). Il controllo del meccanismo di morte cellulare programmata è modificato se non addirittura eliminato in cellule tumorali. E’ nota da tempo l’interconnessione tra proliferazione cellulare,
regolazione del ciclo e apoptosi, tanto che una alterazione del ciclo cellulare, peraltro inevitabilmente presente nelle cellule cancerose, può influenzare in maniera diretta la sensibilità della cellula agli stimoli apoptotici (Rudin e Thompson, 1997).
I dati raccolti nel corso di ricerche sulla linea cellulare di carcinoma ovarico umano A2780 hanno messo in evidenza come l’H2O2 e l’ossidazione dei tioli
prodotti dall’attività di GGT durante il catabolismo del GSH svolgessero una azione antiproliferativa (Perego et al., 1997). Mentre, nella linea cellulare U937 di istiocitoma umano, Del Bello e collaboratori hanno osservato che la produzione di specie ossidanti mediata dalla GGT costituiva uno stimolo antiapoptotico per le cellule e di conseguenza l’inibizione dell’enzima determini arresto della crescita e frammentazione del DNA caratteristica dell’apoptosi.
1.5.4 GGT nei tumori e resistenza a farmaci
La GGT è espressa in condizioni fisiologiche in numerosi organi e tessuti ed è stata trovata espressa ad alti livelli in lesioni maligne e premaligne nelle quali è considerata un fattore che conferisce un vantaggio per la moltiplicazione delle cellule neoplastiche. Inoltre l’attività di GGT sembra essere coinvolta nella resistenza delle cellule maligne ai farmaci alchilanti (Pompella et al., 2006).
Il vantaggio sulla crescita cellulare si pensa sia dovuto al fatto che la GGT, con la sua attività, favorisce la ricostituzione del GSH intracellulare (ciclo di Meister, Orlowski e Meister, 1970) e conseguentemente fornisce una protezione nei confronti del danno ossidativo. Inoltre, la GGT permette lo sfruttamento del GSH esxtracellulare come fonte di cisteina (ciclo di Meister, Orlowski e Meister, 1970), amminoacido essenziale e limitante la sintesi proteica. Come è stato già detto nei
paragrafi 1.5.1-3, la GGT cellulare può influenzare il ciclo cellulare (proliferazione e apoptosi) e modulare l’attività di numerose proteine come recettori o fattori di trascrizione (TNFR1, NF-kB).
Il catabolismo del GSH extracellulare ad opera della GGT di membrana genera il dipeptide Cys-Gly e importanti osservazioni sono state fatte circa un ruolo di questo dipeptide nella resistenza ai farmaci antiblastici dei tumori che esprimono GGT. È stato dimostrato che la Cys-Gly formava un complesso con il cis-diammino-dicloro-platino (CDDP) riducendo la citotossicità del farmaco (Daubeuf
et al., 2002, Paolicchi et al.2003).
1.5.5 Effetti della GGT sulle proteine LDL
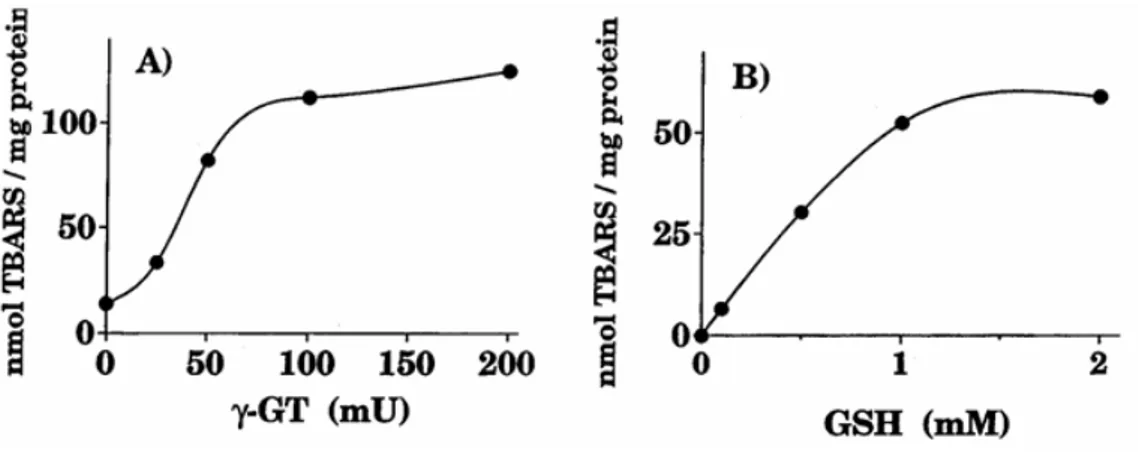
E’ stato discusso che in presenza di Fe2+ l’attività catalitica della GGT promuoveva la formazione di ROS i quali a loro volta potevano innescare il processo di perossidazione lipidica (Minotti, 1993). In studi successivi è stato verificato che le lipoproteine LDL erano ossidate in un sistema nel quale fossero presenti GGT, GSH, ADP-Fe3+ e GlyGly come accettori della reazione di transpeptidazione (Paolicchi et
al., 1999). Gli esperimenti hanno mostrato che in miscele di reazione che includono
i complessi e GSH, quest’ultimo poteva ridurre il ferro ma la velocità di tale reazione aumentava significativamente in presenza di GGT e di GlyGly. Questo effetto è stato osservato in un intervallo esteso di attività di GGT (0-200 mU/ml) e di concentrazione di GSH (0-2 mM, Paolicchi et al. 1999).
Fig 1.6 Ossidazione delle LDL dipendente dal GSH e dalla GGT
Incubazioni (1ml di volume finale) contenti LDL (0.1 mg prot/ml), Gly-Gly (20 mM) e ADP-Fe(III) (150 µM ADP-15 µM FeCl3) in PBS pH 7.4, 37°C. A)Le reazioni sono state iniziate mediante l’aggiunta di GSH (2mM), in più aumentando le concentrazioni di GGT.
(B) GGT era mantenuta costante (50 mU/ml) e le reazioni sono state iniziate aggiungendo
concentrazioni crescent di GSH. (Paolicchi et al., 1999)
Esperimenti aggiuntivi hanno indicato che l’ossidazione delle LDL dipendente dal GSH poteva essere promossa sia dalla GGT in presenza della trasferrina come sorgente di ioni ferro, sia da cellule esprimenti un elevato livello di attività di GGT sulla superficie, come ad esempio le cellule di epatoblastoma (HepG2) o le cellule monoblastoidi (U937) (Paolicchi et al., 1999). Le cellule in questo caso possono essere considerate come sorgente sia di GGT che di GSH, quest’ultimo infatti è normalmente rilasciato dalle cellule (Meister et al., 1995). Queste ultime due osservazioni sono una prima indicazione che l’ossidazione delle LDL mediata dal sistema GSH e GGT possa avvenire in condizioni fisiologiche.
1.6 Ruolo della GGT sierica
Dal 1961 la determinazione della GGT sierica è utilizzata come marcatore diagnostico di disfunzione epatica (Szczeklik et al., 1961), neoplasie incluse e di consumo eccessivo di alcool (Whitfield et al., 2001). La misurazione dell’attività sierica della GGT mediante il saggio con il substrato γ-glutamil-p-nitroanilide è un semplice test di laboratorio ed è considerato il marcatore più sensibile nella diagnosi di colestasi e di steatosi epatica, anche indotte dall’alcool o da farmaci. L’elevazione di GGT sierica può essere riscontrata anche in pazienti con epatopatia cronica conseguente all’infezione da HCV nei quali rappresenta un indice prognostico sfavorevole di risposta al trattamento con interferone (Battezzati et al., 1992; Paolicchi et al., 2005). Nonostante la sensibilità del test, l’utilizzo diagnostico della GGT sierica è limitata dalla bassa specificità.
1.6.1 La GGT sierica: origine e caratteristiche chimico-fisiche
Come già detto (paragrafo 1.1.2), nel genoma esiste una famiglia di geni per la GGT, ma solo il gene I è trascritto e tradotto nella proteina completa e cataliticamente attiva (Courtay et al., 1994). Per cui non esistono isoforme enzimatiche dal punto di vista della struttura proteica, invece la glicosilazione è tessuto specifica e contribuisce all’eterogeneità di peso molecolare e di carica osservate nelle proteine estratte da vari tessuti. La GGT sierica sembra essere di origine epatica come suggerito da studi condotti da Huseby e collaboratori (1981), dai quali risulta che la GGT presente nel siero aveva le stesse caratteristiche di quella estratta dal fegato per quanto riguarda il PM, il contenuto di residui di acido
sialico e il grado di glicosilazione. Questi parametri erano invece distinti rispetto a quelli della GGT ritrovata nelle urine, rene e pancreas (Huseby et al., 1981).
Studi successivi hanno dimostrato la presenza di due frazioni diverse di GGT nel siero, una idrofilica e una idrofobica che differiscono per carica, dimensione e densità. La forma idrofilica, apparentemente identica a quella ottenuta dopo il trattamento proteolitico utilizzato per la purificazione della GGT da tessuto, era presente in piccola quantità e sembrava circolare nel sangue come enzima libero (Huseby et al.,1982a; Huseby et al., 1982b; Huseby et al., 1982c). Per quanto riguarda la frazione idrofobica, è stato proposto che fosse costituita da GGT trasportata dalle lipoproteine sieriche VLDL, LDL, HDL e chilomicroni. Si supponeva che l’associazione della GGT con le lipoproteine avvenisse tramite il dominio lipofilico localizzato all’estremità ammino-terminale e responsabile della normale inserzione dell’enzima nella membrana plasmatica. Infatti, l’enzima associato alle LDL consisteva in una catena pesante intera, ciò indica che era coinvolta la forma anfipatica dell’enzima. (Paolicchi et al., 2003a).
L’associazione dell’enzima GGT con le lipoproteine è stata studiata da Huseby e collaboratori (1982) nel siero di pazienti con patologie epatobiliari. E’ stato osservato che il 60-80% dell’attività totale della GGT era legata in complessi con le lipoproteine. Questi ultimi potevano essere separati in due principali frazioni mediante cromatografia per gel filtrazione o elettroforesi in gel di agarosio. Una frazione era caratterizzata da un alto peso molecolare (PM > 600000) e β-mobilità ed era stata ritrovata nel siero di molti pazienti con colestasi. L’altra frazione contenente GGT eluiva in corrispondenza dell’intervallo di PM da 250000 a 450000 e migrava con α1α2-mobilità. Tali PM erano compatibili con complessi tra
lipoproteine e questa associazione sembrava essere confermata dalla presenza di attività di GGT nelle frazioni di lipoproteine plasmatiche separate mediante ultracentrifugazione per gradiente di densità. La maggior parte dell’attività della prima frazione (PM > 600000) sembrava associata con le lipoproteine VLDL – LDL, mentre la GGT presente nella seconda frazione (PM: 250000 – 450000) sembrava essere associata con le lipoproteine HDL come osservato nel 70% del siero di pazienti non itterici. Infine entrambe le frazioni erano eterogenee per quanto riguarda le dimensioni, la carica e la densità (Huseby et al., 1982a).
In uno studio condotto successivamente da Wenham e collaboratori (1984) la GGT del siero è stata separata, tramite cromatografia per esclusione molecolare, in tre frazioni con PM relativo di 1000000, 250000-500000 e circa 120000. In questo studio l’attenzione è stata focalizzata principalmente sulla frazione di GGT con PM intermedio (250000-500000) isolata da pazienti con malattie epatiche. Anche in questo studio è stato dimostrato che tale frazione consisteva in un complesso tra GGT e lipoproteine ad alta densità (HDL). Inoltre le proprietà fisiche di questa frazione, sia la carica che la massa, potevano essere alterate in seguito all’incubazione del siero con la bile (Wenham et al.,1984).
1.6.2 GGT sierica nel contesto delle patologie cardiovascolari
L’attività di GGT nel sangue fornisce indicazioni di alterazioni patologiche a livello epatico ed è il parametro di scelta utilizzato nel monitoraggio dell’abuso di alcol. La sua associazione con il rischio di morbilità e mortalità era inizialmente riportata in questa prospettiva (Kristenson et al., 1980; Peterson et al., 1983). Conigrave e collaboratori (1993) per primi hanno osservato che la GGT potesse avere un valore
prognostico indipendentemente dalle malattie epatiche e dal consumo di alcol; infatti studi successivi hanno confermato il ruolo della GGT come predittore indipendente di mortalità per tutte le cause (Brenner et al., 1997; Arndt et al., 1998; Karlson et al., 2000). In particolare per quanto riguarda le malattie cardiovascolari, è stato osservato che i livelli di GGT sierica erano correlati con un aumentato rischio di infarto del miocardio (Betro et al., 1973; Hood et al., 1990; Wannamethee
et al., 1995). Questa associazione potrebbe essere spiegata in parte dalla già
conosciuta correlazione positiva tra la GGT ed i noti fattori di rischio coinvolti nella patogenesi dei disordini cardiovascolari, come ad esempio il cambiamento della composizione dei lipidi nel sangue (Van Barneveld et al., 1989; Jousilahti et al., 2000), l’indice di massa corporea (Nilssen et al., 1990; Daeppen et al., 1998), l’ipertensione (Miura et al., 1994; Yamada et al., 1995), l’intolleranza al glucosio (Umeki et al., 1989), l’insulino resistenza (Rantala et al., 2000) e il diabete di tipo 2 (Perry et al., 1998; Lee et al., 2003); i livelli di GGT correlavano positivamente anche con nuovi fattori di rischio cardiovacolari come la proteina C-reattiva, il fibrinogeno e gli F2-isoprostani (Lee et al., 2003). Una correlazione negativa invece è stata osservata con l’attività fisica e i valori di HDL (Ruttmann 2005).
Nel 1995 Wannamethee e collaboratori hanno focalizzato la loro attenzione sulle malattie ischemiche del cuore (ischemic heart disease, IHD). In uno studio prospettico su larga scala (7613 uomini di mezza età e 11 anni di follow-up) i livelli di GGT nell’intervallo fisiologico risultavano associati con il rischio di mortalità per tutte le cause e questa osservazione era in gran parte dovuta all’incremento delle morti per IHD nel quintile superiore della distribuzione della GGT. Dopo aver corretto l’analisi statistica per gli altri fattori di rischio, elevati livelli di GGT
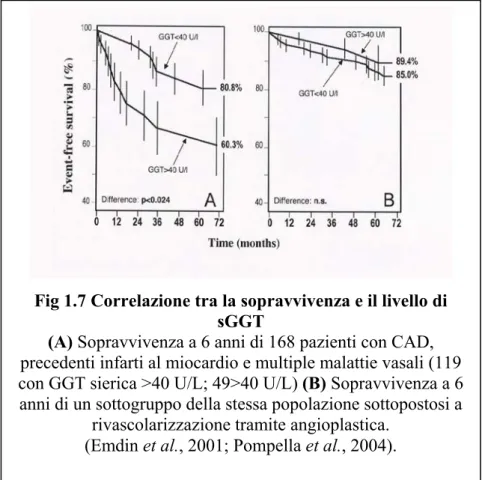
(quintile superiore, GGT > 24 U/L) erano ancora associati con un significativo aumento di mortalità per tutte le cause e per IHD. L’aumentato rischio di mortalità per IHD risultava più marcato nei pazienti con una manifesta malattia ischemica del cuore e particolarmente in quelli con un precedente infarto del miocardio al momento del reclutamento nello studio. Queste osservazioni hanno suggerito l’esistenza di un collegamento tra la GGT sierica e l’evoluzione dell’aterosclerosi (Wannamethee et al. 1995). La presunta connessione della GGT con la patologia aterosclerotica ha ricevuto un ulteriore conferma in studi prospettici condotti da Emdin e collaboratori (2001). Lo studio prevedeva un follow-up di sei anni su 469 pazienti con sindrome ischemica e malattia coronarica (CAD) documentata angiograficamente. Dopo correzione per altri fattori di rischio cardiovascolari (età, fumo di sigaretta, colesterolo, frazione di eiezione del ventricolo sinistro, indice di massa corporea, diabete mellito) e per fattori confondenti (alanina amminotransferasi sierica, consumo di alcol) il valore prognostico dell’attività della GGT sierica per morte cardiaca e infarto non fatale è stato confermato. In particolare, il significato prognostico della GGT sierica era più evidente in un sottogruppo di pazienti con aterosclerosi diffusa (malattia multivasale) e un precedente infarto del miocardio. Il rischio risultava aumentato usando due differenti valori soglia di GGT (25 o 40 U/l) e la maggior parte degli eventi cardiaci erano concentrati nei primi tre anni dopo il primo infarto. Il significato prognostico della GGT sierica risultava così correlato con la diffusione delle lesioni aterosclerotiche nelle arterie coronariche. Ancora più interessante è il fatto che il valore prognostico della GGT scompariva nei soggetti sottoposti a rivascolarizzazione mediante angioplastica o by-pass, procedure che comportano la
stabilizzazione della placca (Amoroso et al., 2001). Quindi la prognosi sfavorevole segnalata dall’elevata GGT sierica sembrava essere applicabile su pazienti con placche vulnerabili, suggerendo che esista una connessione tra la GGT e i processi coinvolti nella destabilizzazione della placca (Fig 1.7).
Un recente studio prospettico di Ruttmann e collaboratori (2005), condotto su 163,944 soggetti adulti austriaci ha definitivamente confermato che i livelli di GGT nel siero sono un fattore prognostico indipendente per eventi fatali di forme croniche di CAD (coronary artery disease) e per eventi cardiaci acuti. Questa conclusione risultava vera per entrambi i sessi con una chiara relazione dose-risposta e una maggiore importanza nei soggetti giovani (età < 60 anni). Ruttmann e
Fig 1.7 Correlazione tra la sopravvivenza e il livello di sGGT
(A) Sopravvivenza a 6 anni di 168 pazienti con CAD,
precedenti infarti al miocardio e multiple malattie vasali (119 con GGT sierica >40 U/L; 49>40 U/L) (B) Sopravvivenza a 6 anni di un sottogruppo della stessa popolazione sottopostosi a
rivascolarizzazione tramite angioplastica. (Emdin et al., 2001; Pompella et al., 2004).
collaboratori hanno stabilito che i valori sierici di GGT che assumono significato prognostico per gli eventi cardiovascolari erano all’interno dell’intervallo fisiologico. Inoltre, sono stati individuati i valori limite sia per i maschi che per le femmine (maschi, 15,5 U/l corrispondenti a 27,6 U/l a 37 °C; femmine, 10,5 U/l corrispondenti a 18,7 U/l a 37 °C). Simili risultati sono stati trovati anche da Lee e collaboratori (2006) in uno studio su una popolazione di 28,388 finlandesi nel quale è stata evidenziata un’associazione indipendente tra la GGT sierica e la malattia coronarica nella popolazione generale. Tale associazione era più forte nei soggetti con meno di 60 anni e tra i consumatori di alcool; in particolare la misura della GGT sierica nei soggetti con diebete di tipo 2 era di aiuto per valutare il rischio futuro di CAD. Che la GGT sierica fosse un forte predittore di eventi coronarici acuti in uomini apparentemente sani (1878 soggetti) e indipendentemente dagli altri fattori di rischio per malattie cardiovascolari è stato confermato anche dallo studio MONICA (Meisinger et al., 2006).
Sebbene le cause più note di elevazione della GGT siano l’abuso di alcool e le malattie epato-biliari, il rischio cardiovascolare associato all’elevazione della GGT risultava essere del tutto indipendente da questi suoi determinanti, e ciò non è strano se si considera che in tutti gli studi, compresi i più recenti, il rischio cardiovascolare cresceva progressivamente con il crescere dei valori di GGT all’interno dell’intervallo di riferimento, ma non al di sopra di esso, mentre i valori di GGT associati all’abuso di alcool ed alle epatopatie si trovavano in un intervallo assai più alto, all’interno del quale il rischio cardiaco non cresceva più (Fig. 1.8, Kazemi-shirazi et al.,2007).
Figura 1.8 Livelli di attività serica di GGT e mortalità.
Le categorie di GGT serica corrispondono ai seguenti intervalli di attività: (1) < 9 U/L per le donne e < 14 U/L per gli uomini; (2) 9-17 U/L e 14-27 U/L; (3) 18-26 U/L e 28-41 U/L; (4) 27-35 U/L e 42-55 U/L; (5) >35 U/L e > 56 U/L. La categoria 1 è utilizzata come riferimento.(Kazemi-Shirazi et al.,2007)
1.6.3 La GGT nei disordini metabolici
Recentemente è stato studiato anche il ruolo della GGT in tutta una serie di condizioni fisiopatologiche, quali ad esempio l’obesità addominale, l’insulino- resistenza e il diabete mellito di tipo 2 ed è stata osservata una correlazione positiva tra la GGT e tutte queste condizioni. In particolare è stato visto che più alti valori di GGT correlavano positivamente con l’insorgenza di diabete mellito di tipo 2 mentre nessuna correlazione era presente con il diabete di tipo 1 (Barbieux et al., 1990). Sempre nello stesso studio, significative erano le correlazioni fra indice di massa corporea (BMI) e GGT sia nei soggetti diabetici sia nei controlli. Questa associazione è stata ulteriormente confermata da uno studio di Rantala e
Malattie cerebro-vascolari Cardiopatia ischemica Cause vascolari Tutte neoplasticheCause non Neoplasie
Cause di mortalità Ris chio r elativ o (95% IC) Malattie cerebro-vascolari Cardiopatia ischemica Cause vascolari Tutte neoplasticheCause non Neoplasie
Cause di mortalità Ris chio r elativ o (95% IC)
collaboratori (2000) che ha evidenziato elevati coefficienti di correlazione fra livelli di GGT e i componenti della sindrome metabolica come pressione arteriosa sistolica, livelli di trigliceridi, indice di massa corporea e insulino resistenza. Sempre a favore di questi risultati, nell’ambito dello studio di Framingham, studiando 3451 soggetti, si è stabilito che un aumento delle GGT era un fattore predittivo di esordio di sindrome metabolica e incidenza di eventi cardiovascolari (Lee et al., 2007). Inoltre in uno studio di Lim e collaboratori (2007) è stata individuata un’associazione positiva tra l’obesità e il diabete di tipo 2 solo negli individui con valori di GGT nella fascia alta dell’intervallo di riferimento (≥ 36 U/L), particolare che, per altro, è riscontrabile negli studi appena menzionati. In definitiva, l’attività di GGT associata ai valori di indice di massa corporea permette di individuare soggetti con un alto rischio di sviluppare diabete di tipo 2.
1.6.4 GGT e insufficienza renale cronica
Un recente studio coreano (Ryu et al., 2007) porta all’attenzione anche una possibile associazione fra livelli di GGT e l’insorgenza di insufficienza renale cronica (IRC). Lo studio condotto su 10,337 soggetti ha messo in evidenza che, con l’aumentare dei valori di GGT, aumentava anche il rischio di IRC (riscontro di proteinuria manifesta o filtrato glomerulare (VFG) < 60 ml/min), e che tale correlazione si manteneva significativa anche dopo le adeguate correzioni per età, peso, consumo di alcool, VFG basale, livelli di TG e HDL-C. Si è così giunti alla conclusione che la GGT potrebbe rappresentare un marcatore indipendente e precoce di sviluppo di insufficienza renale cronica.
1.6.5 GGT e aterosclerosi
L’aterorosclerosi è caratterizzata dall’accumulo di depositi di colesterolo nell’intima delle arterie di grande e medio calibro. Questa deposizione porta anche alla proliferazione degli elementi cellulari dell’intima che gradualmente si ispessisce portando a una riduzione del lume vascolare e di conseguenza del flusso sanguigno.
Si ritiene che lo sviluppo della placca ateromatosa inizi con il danno dell’endotelio associato con una varietà di fattori di rischio quali l’età, il sesso, fattori genetici, l’ipertensione, iperlipidemia, il dibete mellito e il fumo di sigaretta. Sotto l’influenza di vari stimoli l’endotelio può essere attivato, acquisisce così nuove proprietà funzionali e antigeniche e aumenta la permeabilità a vari costituenti del plasma.
Questo processo determina la deposizione di lipidi nella parete vascolare, trasportati dalle lipoproteine LDL, l’adesione dei monociti ematici all’endotelio, seguita dalla loro migrazione nell’intima e dall’attivazione in macrofagi: si forma così una prima lesione non ostruttiva chiamata stria lipidica. Con il progredire del processo infiammatorio, un elevato numero di macrofagi e linfociti viene attratto nella lesione da citochine chemiotattiche ed indotto a moltiplicarsi. L’attivazione di tali cellule determina la liberazione di enzimi idrolitici, citochine, chemochine e fattori di crescita che instaurano un ciclo di accumulo di monociti-macrofagi che internalizzano colesterolo e si trasformano in cellule schiumose. Le cellule muscolari lisce, indotte a migrare e proliferare nell’intima da diversi stimoli, assumuno le caratteristiche di miofibroblasti secernenti collagene portando alla
formazione di tessuto fibroso che contribuisce al progressivo ingrandimento della lesione.
L’ossidazione delle LDL rappresenta un evento cruciale nella patogenesi dell’aterosclerosi, principalmente nell’iniziazione delle lesioni (Stocker e Keaney, 2004). Le LDL ossidate sono implicate in numerosi processi fondamentali nel processo aterosclerotico: inducono la trasformazione di monociti e macrofagi in cellule schiumose descritta in precedenza, sono capaci di stimolare le cellule endoteliali e le cellule muscolari lisce a secernere la proteina-1 chemiotattica dei monociti e favorire così la loro migrazione all’interno della parete cellulare; possono favorire l’attivazione endoteliale ed essere chemiotattiche per i linfociti T e i macrofagi.
E’ stato dimostrato che i processi ossidativi, che generano specie reattive dell’ossigeno (ROS), sono coinvolti in molti eventi responsabili della progressione della placca aterosclerotica. I ROS, infatti, possono stimolare la proliferazione delle cellule muscolari lisce, contribuendo allo sviluppo e all’espansione della lesione, nonchè alla sua destabilizzazione, in quanto stimolano l’attività delle metalloproteasi e inbiscono quella dei loro inibitori. Inoltre, anche apoptosi e vie di trasduzione del segnale sono modificate dall’azione dei prodotti dello stress ossidativo. Attraverso l’inibizione della sintesi di NO derivato dalle cellule endoteliali, i ROS possono anche essere implicati nella disfunzione endoteliale, termine con il quale si indicano tutte le modificazioni responsabili della perdita dell’omeostasi del tessuto endoteliale.
Diversi enzimi, espressi da elementi cellulari presenti nella placca (cellule endoteliali, fagociti, cellule muscolari lisce, fibroblasti) sono stati proposti come
possibile fonte di agenti ossidanti coinvolti nello sviluppo della placca, come ad esempio, NADPH-ossidasi, NO-sintasi, xantina ossidasi, mieloperossidasi, lipoossigenasi, enzimi mitocondriali.
1.6.6 La GGT nella placca aterosclerotica
Studi biochimici hanno dimostrato che la GGT produceva specie reattive dell’ossigeno in vitro (Paolicchi et al., 1999), pertanto si è ipotizzato che potesse avere un ruolo nella patogenesi della placca
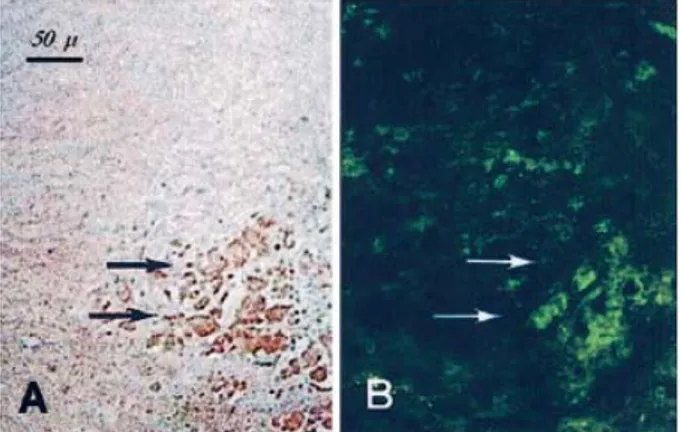
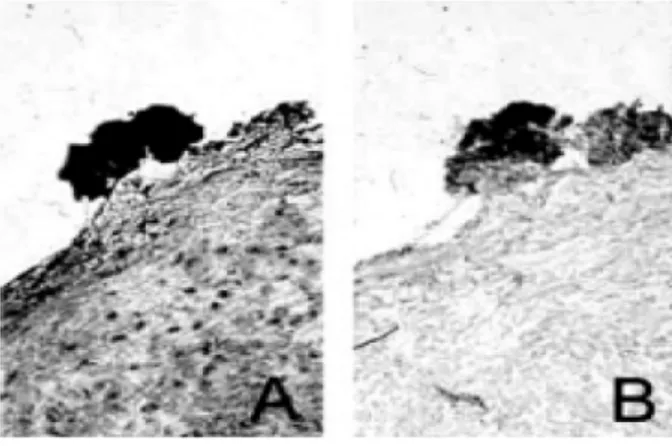
Il ruolo patogenetico della GGT nella progressione dell’aterosclerosi e nelle sue complicanze è suggerito da studi istochimici che hanno rivelato un’intensa attività di GGT nel core lipidico di lesioni aterosclerotiche umane, dove erano localizzate anche le cellule schiumose derivate dai macrofagi CD 68+ ( Paolicchi et al., 1999; Paolicchi et al., 2004 ). L’attività di GGT co-localizzava anche con le LDL ossidate (Fig. 1.9; Emdin et al., 2002), ed è stata riscontrata anche in microtrombi aderenti alla superficie dell’ateroma. (Fig. 1.10; Dominici et al., 2003a).
Fig. 1.9 Colocalizzazione dell’attività di GGT con le LDL ossidate.
Placca di un’arteria cerebrale umana.
A) Dimostrazione istochimica dell’attività di GGT
Fig. 1.10 GGT cataliticamente attività in microtrombi presenti sulla superficie di una placca aterosclerotica umana.
A) Ematossilina / Eosina;
B) Dimostrazione istochimica dell’attività di GGT (Dominici et al., 2003a)
L’origine dell’attività di GGT riscontrata nelle lesioni aterosclerotiche non è comunque chiara e soprattutto non è chiaro se essa partecipi attivamente alla malattia in qualità di fattore pro-ossidante o ne sia semplicemente un epifenomeno. Riguardo l’origine della GGT nella placca possono essere prese in considerazione due sorgenti: una endogena, a carico degli elementi cellulari della placca (cellule infiammatorie e muscolari lisce), ed infatti nelle lesioni è presente l’mRNA per la GGT (Franzini, 2007); una esogena mediata dalle lipoproteine LDL. A supporto di quest’ultima, uno studio suggeriva che la GGT sierica fosse parzialmente adsorbita alle lipoproteine circolanti, incluse le LDL (Huseby, 1982; Watanabe et al., 1984). Questo aspetto è stati recentemente indagato in una popolazione di pazienti con malattia delle arterie coronarie (CAD) documentata angiograficamente (Paolicchi et
al., 2006). Sia nei controlli sia nei CAD la quantità di GGT associata con le
β-lipoproteine (β-LP), che includono le LDL, IDL e VLDL, era direttamente proporzionale al livello totale di GGT nel siero; tuttavia, nei CAD la frazione di GGT associata con le β-LP era significativamente più bassa rispetto ai controlli
(Fig. 1.11), è stato così proposto che la diminuzione dell’attività di GGT associata alle β-LP nei CAD fosse dovuta alla riduzione dell’associazione tra l’enzima e le LDL, oppure all’aumentata internalizzazione dei complessi LDL-GGT all’interno della lesione aterosclerotica. Quest’ultima ipotesi, che prevedeva l’aumentato ingresso dei complessi LDL-GGT seguito dall’accumulo di GGT dentro la lesione, potrebbe spiegare la già riportata correlazione tra alti livelli di GGT nel siero e le conseguenze cliniche dell’aterosclerosi.
Fig. 1.11 Livelli di GGT leganti β-LP
(A) Correlazione lineare tra livelli di GGT leganti β-LP con
corrispondente GGT totale nel siero in 39 soggeti sani. (B) Livelli di attività di GGT legante β-LP nei controlli, in pazienti CAD e in soggetti sani con elevate livelli di GGT persistenti. (Pompella et al., 2004; Paolicchi
et al., 2006a).
Controls CAD High GGT
0 10 20 30 40 50 β -L P-bo un d G G T (% o f to ta l s e ru m a c tiv it y)
Controls CAD High GGT
0 10 20 30 40 50
Controls CAD High GGT
0 10 20 30 40 50 β -L P-bo un d G G T (% o f to ta l s e ru m a c tiv it y)