5. DISCUSSIONE
I risultati ottenuti hanno mostrato che 48 h dopo l’acquisizione del condizionamento contestuale alla paura, si osserva a livello delle strutture corticali e sottocorticali della porzione medio-temporale del cervello di ratto, una modulazione positiva della trascrizione dei geni che codificano per la complessina 1, per la phosphoprotein enriched in astrocytes (PEA-15) e per la subunità 6 del complesso F0 dell’ATP sintasi (F6) .
5.1 Clone 1VH5
Le complessine costituiscono una piccola famiglia di proteine presinaptiche solubili, rappresentata nel cervello da 2 isoforme principali altamente omologhe , la complessina 1 (CPLXI) e la complessina II (CPLXII). Esiste anche una terza isoforma dall’espressione molto ristretta (Mcmahon, Missler, Li, Sudhoff; 1995; Reim, Mansour, Varoqueaux, McMaon, Sudhoff, Brose, Rosenmund; 2001). CPLXI e CPLXII sono altamente conservate nei mammiferi, infatti per la complessina II si riscontra nella sequenza aminoacidica un’identità del 100% tra uomo, ratto e topo. Le complessine colocalizzano e si legano strettamente al complesso SNARE (solubile N-ethylmaleimide-sensitive-factor attachment protein receptor ) delle membrane presinaptiche (Chen, Tomchick, Kovrigin, Araç, Machius, Sudhoff, Rizo; 2002). Recenti evidenze sperimentali supportano l’idea che esse possano svolgere un ruolo di
rilievo nella modulazione degli eventi tardivi associati al rilascio dei neurotrasmettitori Ca 2+- dipendente (Reim, Mansour, Varoqueaux, McMaon, Sudhoff, Brose and Rosenmund; 2001).
I neurotrasmettitori sono liberati dall’esocitosi delle vescicole sinaptiche, attraverso una reazione molto veloce e strettamente controllata. La velocità dell’esocitosi è critica per le funzioni neurali e richiede un meccanismo a cascata di interazioni tra proteine che potrebbero mediare le seguenti funzioni: l’ancoraggio delle vescicole sinaptiche alla membrana plasmatica, i passaggi di preparazione della vescicola verso la zona attiva di rilascio e l’effettiva liberazione del neurotrasmettitore sotto l’influsso del Ca2+ (Sudhof; 1995).
Durante queste fasi si ha, nell’elemento presinaptico, la formazione del complesso SNARE che coinvolge il legame tra la sinaptobrevina (proteina integrale della membrana vescicolare) e 2 proteine della membrana presinaptica: la sintaxina e la SNAP-25 (Sollen; 1993). L’energia liberata dalla formazione del complesso SNARE può essere utilizzata per superare la barriera energetica richiesta per la giustapposizione delle 2 membrane, facilitandone successivamente la fusione (Hanson; 1997). Si pensa che inizialmente le vescicole vengano ancorate alla membrana plasmatica attraverso un meccanismo indipendente dallo SNARE e successivamente vadano incontro a reazioni di preparazione associate alla formazione di questo complesso, che le rendono pronte per il rilascio in seguito all’influsso di Ca2+ (Sudhof; 1995). Il maggior candidato come sensore per il Ca2+ è la sinaptotagmina, una proteina integrale della membrana vescicolare (Geppert & Sudhof; 1998). Esistono numerose proteine in grado di modulare la liberazione delle vescicole tra le quali le complessine sembrano avere un ruolo cruciale. Infatti doppi
knockout CPXI e CPLXII non sono vitali e studi in vitro hanno evidenziato una riduzione drastica del rilascio del neurotrasmettitore nei neuroni di ippocampo privi di entrambe le isoforme di complessina.
I risultati di numerosi studi (Chen, Tomchick, Kovrigin, Araç, Machius, Sudhoff, Rizo; 2002), hanno dimostrato che la complessina si lega con una conformazione ad α-elica antiparallela, al solco tra la sinaptobrevina e la sintaxina nel complesso SNARE. Il legame con la complessina non altera la struttura del core complex ma stabilizza l’interfaccia sinaptobrevina/sintaxina. Poichè questa interfaccia deve sopportare le forze repulsive tra la membrana sinaptica e le vescicole, questo risultato suggerisce un modello in cui la complessina stabilizzerebbe la fase di preparazione alla fusione delle vescicole che coinvolge il complesso SNARE già preventivamente assemblato e che costituisce un tappa fondamentale per la liberazione del neurotrasmettitore innescata dal Ca2+ (fig. 20) (Chen, Tomchick, Kovrigin, Araç, Machius, Sudhoff, Rizo; 2002)
Fig.20- Modello della funzione della complessina nel rilascio del neurotrasmettitore
Naturalmente possono essere proposti anche modelli alternativi della funzione delle complessine. Ad esempio, l’assemblaggio del complesso SNARE potrebbe avvenire solo dopo l’ingresso del calcio nel terminale presinaptico e la stabilizzazione offerta dal legame tra SNARE e complessina poterebbe estendere l’emivita del complesso aumentando in questo modo la probabilità di fusione tra le membrane. Questi modelli suggeriscono che la regolazione dei livelli di espressione della complessina potrebbe rappresentare un meccanismo di regolazione dell’efficienza del rilascio dei neurotrasmettitori indotta dall’influsso di Ca2+ durante quei fenomeni di plasticità presinaptica che potrebbero essere alla base del processamento delle informazioni nel cervello (Chen, Tomchick, Kovrigin, Araç, Machius, Sudhoff, Rizo; 2002).
Sebbene la funzione delle complessine nel cervello non sia stata ancora completamente chiarita, numerosi studi hanno dimostrato una loro implicazione nei fenomeni di apprendimento e memoria, e cambiamenti della loro espressione in numerose patologie psichiatriche (schizofrenia e depressione) e neurodegenerative (morbo di Parkinson, encefalopatia di Wernicke e corea di Huntington) (Harrison & Eastwood; 1998)
Studi di ibridazione in situ hanno evidenziato che CPLX I e CPLX II presentano patterns di distribuzione differenti nel cervello dei roditori, sebbene siano presenti regioni cerebrali in cui sono espresse entrambe le isoforme (Freeman & Morton; 2004). Da questi studi è emerso che la CPLX I è espressa principalmente a livello delle sinapsi assosomatiche, mentre la CPLX II soprattutto a livello delle sinapsi assodendritiche. Dato che nell’ippocampo e nella corteccia le sinapsi
assosomatiche e assodendritiche sono rispettivamente inibitorie e eccitatorie, questi risultati hanno condotto a pensare che la CPLXI potesse modulare la trasmissione inibitoria e al contrario la CPLXII quella eccitatoria. In realtà questa distinzione non sembra essere così netta, infatti nel ratto CPLX II è ampiamente espressa anche nei neuroni inibitori GABAergici dello striato.
Le ultime evidenze sperimentali suggeriscono che CPLX I e CPLX II non solo sono omologhe funzionalmente, dal momento che svolgono lo stesso ruolo sia nelle sinapsi inibitorie che eccitatorie, ma anche che il loro ruolo dipende dal circuito neuronale in cui sono espresse. Per quanto riguarda la CPLX I gli studi di ibridazione in situ hanno evidenziato un’alta espressione dell’ mRNA della proteina a livello della corteccia (strato IV e V), del nucleo della banda diagonale, dell’ippocampo (soprattutto campo CA3), del talamo, della substantia nigra (pars compacta), del nucleo del setto mediale e del cervelletto (soprattutto a livello dei nuclei cerebellari profondi). Questi risultati fanno ipotizzare che la CLPXI svolga un ruolo primario nei programmi di apprendimento di tipo motorio e nel processamento delle informazioni sensoriali, sebbene non possa essere escluso a priori un suo coinvolgimento nelle funzioni cognitive superiori, nei comportamenti emozionali e nel controllo dei movimenti volontari. Quest’idea è supportata anche dall’osservazione dei knockout genici (KO). Topi KO omozigoti per CPLXII (Cplx2-/-) presentano anomalie nei fenomeni di esplorazione e nei comportamenti sociali e mostrano deficit progressivi nella coordinazione motoria e nell’apprendimento; KO omozigoti per CPLXI (Cplx1-/-) sviluppano una forte atassia, senza presentare neurodegenerazione a livello cerebellare. Il fenotipo dei topi Cplx1-/- è complesso, essi soffrono di sporadici attacchi
apoplettici, sono incapaci di riprodursi e normalmente muoiono dopo circa 2 mesi dalla nascita. Il comportamento di questi topi non è stato caratterizzato nel dettaglio, poiché la loro morte precoce rende pressoché impossibile un’analisi dettagliata del fenotipo comportamentale.
Un recente studio ha dimostrato che topi Cplx1-/- sottoposti a modificazioni del regime alimentare, sono in grado di sopravvivere normalmente, questo ha permesso di analizzarne il fenotipo comportamentale. E’ stato dimostrato che i Cplx1-/- soffrono di una forte atassia e presentano anomalie nei comportamenti complessi che includono non solo deficit motori ma anche alterazioni del comportamento che riflettono deficit emotivi (Glynn, Dreuw, Reim, Brose and Morton; 2005).
I topi Cplx1-/- mostrano notevoli danni nella coordinazione motoria e nella locomozione che includono difetti nell’andatura, incapacità nel nuoto e nella corsa, distonia e tremori a riposo. Sebbene il fenotipo motorio degenerato domini sugli altri sintomi, i Cplx1-/- mostrano anche altri difetti comportamentali; in particolare presentano deficit nel comportamento esplorativo saggiati in differenti procedure comportamentali, risposte di panico se vengono posti in acqua e altri deficit in compiti che riflettono reattività emotiva.
Le alterazioni del comportamento dei topi Cplx1-/- sono in linea con i dati relativi all’espressione della proteina nelle diverse strutture cerebrali .
Essendo la CPLXI altamente espressa nel cervelletto non stupisce che i Cplx1-/- soffrano di atassia, invece la perdita di funzione a livello del talamo è alla base delle alterazioni degli aspetti cognitivi del controllo motorio, come la pianificazione e l’esecuzione di strategie motorie
complesse. Atassia, distonia e tremori dominano sugli altri fenotipi motori nei Cplx1-/-, la presenza di tremori a riposo è particolarmente interessante alla luce del fatto che rappresenta uno dei primi sintomi riscontrabili nel morbo di Parkinson e che alterazioni dei livelli di CPLXI sono stati identificati nel cervello di soggetti affetti da tale patologia.
L’elevata espressione della CPLXI a livello della corteccia, dell’ippocampo e dei nuclei mediali del setto, è alla base delle alterazioni comportamentali riscontrate nei Cplx1-/-. Deficit nel comportamento esplorativo e sociale riflettono alterazioni nelle funzioni cerebrali superiori; infatti questi comportamenti richiedono non solo coordinazione motoria ma anche integrazione degli input sensoriali.
L’espressione della CPLXI a livello della corteccia dell’ippocampo e del setto mediale , strutture coinvolte nella memoria e apprendimento, fa ipotizzare che questa proteina possa essere implicata anche in queste funzioni cognitive superiori.
Lo studio degli aspetti cognitivi nei Cplx1-/- è limitato a causa degli ingenti danni motori, in più non esistono procedure che possano saggiare funzioni come memoria e apprendimento, che non richiedano un certo livello di coordinazione motoria. Fino a quando non saranno ideate tali procedure la vera estensione dei danni nei Cplx1-/- resterà sconosciuta.
Recenti ricerche (Nelson, Backlund and Alkon; 2004) tuttavia hanno dimostrato che la CPLXI ha un ruolo di rilievo nella fase di consolidamento della memoria in seguito a apprendimento spaziale. Questa fase è accompagnata da una riorganizzazione molto estesa dei contatti sinaptici e delle strutture dendritiche, durante la quale gli
eventi biochimici predominanti sono rappresentati da modificazioni nell’espressione e nella distribuzione di alcune proteine. Molte fra queste sono in grado di interagire con altre molecole o con altre proteine e modulazioni di tali interazioni poterebbero mediare riarrangiamenti a livello dei dendriti o delle strutture sinaptiche, rendendo la cellula capace di immagazzinare nuove informazioni. Ad esempio sono stati osservati cambi strutturali actina–dipendenti a livello dei dendriti dopo fear conditioning. Uno studio molto recente (Nelson, Backlund and Alkon; 2004) ha evidenziato le modificazioni delle interazioni tra proteine che avvengono nell’ippocampo durante la fase di consolidamento della memoria spaziale. Da questa analisi è emerso che 24 h dopo l’addestramento, si assiste ad una riduzione dell’interazione Ca2+-dipendente tra la CPLXI e due differenti proteine: la proteina simile a Drac1 e p25 α. Drac1 è una piccola GTP-asi coinvolta nella sinaptogenesi, nella crescita e nelle modificazioni morfologiche degli assoni.
L’interazione Ca2+-dipendente tra CPLXI e le altre proteine, suggerisce un possibile ruolo di queste nella fase di acquisizione e consolidamento della memoria. Infatti, l’influsso di calcio nel terminale sinaptico ridurrebbe l’interazione tra la CPLXI e i suoi binding partner aumentando i livelli di CPLXI libera permettendole così di esplicare le sue funzioni modulatorie sul meccanismo di liberazione delle vescicole sinaptiche. Sebbene sia stato dimostrato che modificazioni dell’interazione tra queste proteine non siano legate a cambiamenti significativi nei loro livelli di espressione, non si può escludere che questi fenomeni possano essere il risultato di un bilanciamento tra un incremento e una riduzione dei livelli trascrizionali in due aree differenti dell’ippocampo.
La sovrespressione del gene della complessina 1 48 h dopo CFC ci induce a pensare che il consolidamento della traccia mnemonica possa essere almeno in parte legato a fenomeni di plasticità presinaptica a lungo termine. Ormai da anni è riconosciuto il coinvolgimento degli eventi di plasticità presinaptica e delle proteine presinaptiche nei processi di memoria e apprendimento negli invertebrati (Kandel; 2001; Roberts & Glanzman; 2003). Nei mammiferi invece il ruolo svolto dalla plasticità presinaptica, dai segnali di traduzione e dai meccanismi di rilascio presinaptici nella memoria a breve e a lungo termine ha ricevuto molta meno attenzione rispetto ai fenomeni di plasticità postsinaptica. Data la stretta coincidenza nei meccanismi molecolari tra apprendimento e memoria negli invertebrati e nei mammiferi è probabile che meccanismi presinaptici possano svolgere un ruolo prominente anche nella formazione della memoria nel cervello dei mammiferi.
5.2 Clone 1VB9
PEA-15 è una piccola proteina (15 KDA) inizialmente identificata come fosfoproteina presente in modo rilevante negli astrociti cerebrali (Araujo, Danziger, Cordier, Glowinski and Chneiweiss; 1993) e successivamente dimostrata essere ampiamente espressa in differenti tessuti e altamente conservata nei mammiferi (Estelles, Yokoyama, Nothias, Vincent, Glowinski, Vernier and Chneiweiss; 1996; Danziger, Yokoama, Jay, Cordier, Glowinski and Chneiweiss; 1995). E’ un monomero composto all’estremità N-terminale da un dominio
implicato nell’induzione della morte cellulare (death effector domain o DED) e da una lunga coda C-terminale dalla struttura irregolare. DED è un dominio di legame omotipico ritrovato in proteine che controllano l’apoptosi (Renganathan, Vaidyanathan, Knapinska and Ramos; 2005).
Nella coda C-terminale sono presenti due distinti siti di fosforilazione: il residuo di serina 104 (Ser104) localizzato all’interno del motivo LTRIPSAKK, che rappresenta la sequenza di consenso per la proteinchinasi C (PKC); il residuo di serina 116 (Ser116) incluso nel motivo DRQPSEEEIIK, che costituisce un target molecolare per la proteinchinasi Ca2+-calmodulina-dipendente di tipo II (CaMKII). PEA-15 risulta essere regolata da fosforilazioni multiple Ca2+ -dipendenti che sono alla base della presenza in vivo di tre diverse isoforme: non fosforilata (N), monofosforilata (Pa) e bifosforilata (Pb) (Renaulta, Formstechera, Callembautd, Juniera and Chneiweiss; 2003). Ciò suggerisce che PEA-15 possa svolgere un importante ruolo nell’integrazione e nella regolazione dei segnali intracellulari. Infatti è stato dimostrato il suo coinvolgimento nella modulazione delle vie di trasduzione del segnale che mediano l’apoptosi e la proliferazione cellulare negli astrociti (Renaulta, Formstechera, Callembautd, Juniera and Chneiweiss; 2003).
A queste cellule sono state attribuite diverse funzioni, tra le quali spicca la capacità di dare inizio a risposte dinamiche quando vengono stimolate in vivo da una grande varietà di molecole segnale. Gli astrociti sono inoltre coinvolti nella crescita neuronale attraverso il rilascio di fattori neurotrofici, e nella sopravvivenza dei neuroni maturi poichè svolgono un ruolo cruciale nel flusso di substrati energetici verso i neuroni. Queste cellule possono anche modulare la
trasmissione nervosa attraverso la rimozione degli ioni e l’inattivazione dei neurotrasmettitori. La presenza sulle membrane degli astrociti di recettori per neurotrasmettitori, fattori di crescita, ormoni e citochine fa si che segnali extracellulari siano in grado di dare inizio a risposte interne, mediate da un incremento del calcio intracellulare o dalla produzione di secondi messaggeri. Uno dei più importanti eventi è la stimolazione delle chinasi e la successiva fosforilazione di specifiche fosfoproteine che costituiscono il target finale dei segnali extracellulari e che mediano diverse funzioni quali il riarrangiamento dei microtubuli o la comunicazione intercellulare. La fosforilazione di PEA-15 è regolata da diversi ormoni e neurotrasmettitori quali la noradrenalina, il peptide vasoattivo intestinale e l’endotelina. Inoltre tutti i segnali in grado di determinare un aumento della concentrazione intracellulare di Ca2+ determinano un aumento della fosforilazione di PEA-15.
Analisi immunoistochimiche hanno rivelato che PEA-15 presenta una distribuzione a rete nel citoplasma degli astrociti simile a quella dei microtubuli e di conseguenza colocalizza con la β-tubulina, anche quando lo stato di polimerizzazione è modificato da farmaci. Ulteriori analisi hanno evidenziato che Pb presenta una maggiore affinità per i microtubuli rispetto a N e Pa, suggerendo che l’interazione tra PEA-15 e la tubulina possa essere regolata dallo stato di fosforilazione (Danziger, Yokoama, Jay, Cordier, Glowinski and Chneiweiss; 1995). La presenza di siti di fosforilazione conservati durante l’evoluzione, l’incremento di Pb durante l’ontogenesi e l’associazione preferenziale di Pb con la frazione stabile dei microtubuli, suggeriscono che PEA-15 possa avere un ruolo nella regolazione della morfologia cellulare. Così come altre fosfoproteine gliali coinvolte nella plasticità
citoscheletro-mediata della morfologia astrocitica, quali la vimentina e la proteina fibrillare acida gliale, anche PEA-15è substrato della PKC. L’attivazione di questa chinasi promuove, infatti, un cambio nella morfologia astrocitica da una forma protoplasmica a una forma a stella. In un recente studio è stato dimostrato un aumento dell’espressione del gene della vimentina negli astrociti dell’ippocampo 24 h dopo CFC, suggerendo che in questa forma di apprendimento possano essere coinvolti anche cambiamenti della morfologia astrocitica (Mei, Li, Dong, Jiang, Wang and Hu; 2005). La modulazione positiva della PEA-15 da noi riscontrata potrebbe essere correlata a questo genere di fenomeni, in partcolare la sua fosforilazione potrebbe regolare la polimerizzazione della tubulina o alternativamente modificare l’interazione dei microtubuli con gli altri elementi citoscheletrici. Numerosi geni specifici o abbondanti negli astrociti, presentano variazioni dei loro livelli di espressione in risposta al CFC. Queste osservazioni sono in accordo con recenti scoperte che dimostrano che la glia controlla e stabilizza il numero delle sinapsi in vitro e suggeriscono la possibilità che queste cellule possano partecipare attivamente ai cambiamenti associati alla plasticità sinaptica (Ullian, Sapperstein, Christopherson and Barres; 2001).
Nel cervello è stata dimostrata un’elevata espressione di PEA-15 a livello dell’ippocampo; sebbene anche i neuroni esprimano la proteina questo fenotipo è implicabile essenzialmente a un maggior arricchimento di PEA-15 livello degli astrociti (Danziger, Yokoama, Jay, Cordier, Glowinski and Chneiweiss; 1995). Anche altri marker astrocitari quali la vimentina, GFPA e la glutammina sintetasi sono presenti in maggior quantità nell’ippocampo rispetto ad altre aree
cerebrali (Schmidt-Kaster & Szymas; 1990). Questo potrebbe essere correlato al ruolo svolto dal glutammato nell’attività neurale nell’ippocampo. Gli astrociti, infatti, sono provvisti di processi che rivestono i contatti sinaptici (Peters, Palay and Webster; 1991) ed esprimono anche recettori e siti di assunzione con cui possono interagire i neurotrasmettitori rilasciati durante l’attività sinaptica (Barres; 1991). Queste caratteristiche provvedono gli astrociti di una squisita sensibilità nel rilevare aumenti dell’attività sinaptica. Infatti, queste cellule possiedono potenti sistemi di uptake del glutammato regolati dalla via della PKC e di conseguenza il trasporto gliale contribuisce alla terminazione della corrente sinaptica eccitatoria. Studi in vitro hanno dimostrato che segnali che hanno come bersaglio gli astrociti possono modificare l’attività neuronale attraverso meccanismi che coinvolgono la modulazione delle gap junction o il rilascio del glutammato. Essendo la fosfoproteina più abbondante e substrato della PKC, PEA-15 potrebbe essere coinvolta nella trasduzione del segnale intracellulare, supportando questi fenomeni attraverso la modificazione della sua interazione con i microtubuli o partecipando al rimodellamento della forma negli astrociti dell’ippocampo (Danziger, Yokoama, Jay, Cordier, Glowinski and Chneiweiss; 1995). Da questi dati si può ipotizzare che l’aumento di espressione della PEA-15 48 h dopo CFC, e allo sviluppo di espansioni terminali negli astrociti che vanno a rivestire i nuovi contatti sinaptici che si formano durante il processo di consolidamento dell’associazione tra gli stimoli e che sono alla base della memoria a lungo termine. Inoltre, la sovraespressione di questa proteina potrebbe essere anche correlata alla stabilizzazione, da parte degli astrociti, delle modificazioni nella trasmissione sinaptica.
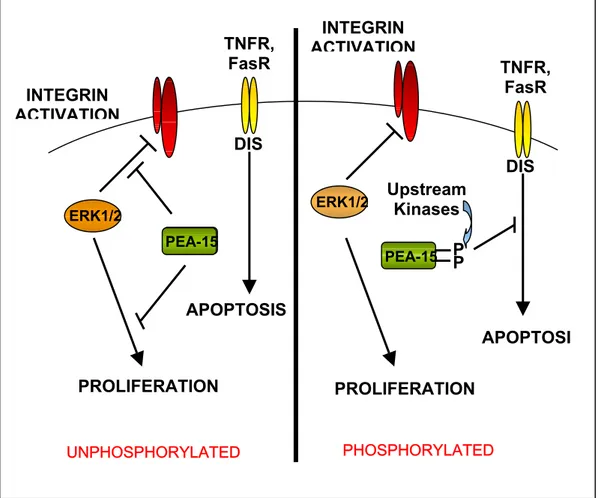
Numerosi studi (fig.21) hanno dimostrato inoltre che PEA-15 è una proteina multifunzionale e svolge un ruolo fondamentale nella regolazione e nell’integrazione dei segnali intracellulari che controllano: proliferazione, morfogenesi ed apoptosi. In particolare questa proteina protegge gli astrociti da meccanismi apoptotici estrinseci innescati dal TNFα (Estelles, Charlton and Blau; 1999), regola l’azione della cascata delle MAPchinasi (ERK1/2) legandosi ad esse e alterandone la localizzazione subcellulare (Ramos, Hughes, Renshaw, Scwarts, Formestecher, Chneiweiss and Ginsberg; 2000; Formstecher; 2001) e modula i meccanismi di attivazione delle intregrine (Ramos, Kojima, Hughes, Fenczik and Ginsberg; 1998)
INTEGRIN ACTIVATION PHOSPHORYLATED UNPHOSPHORYLATED ERK1/2 ERK1/2 PEA-15 PEA-15 Upstream Kinases APOPTOSI APOPTOSIS TNFR, FasR TNFR, FasR DIS DIS PROLIFERATION P P INTEGRIN ACTIVATION PROLIFERATION
PEA-15 risulta, inoltre essere strettamente e inversamente correlata con la proliferazione cellulare (Renaulta, Formstechera, Callembautd, Juniera and Chneiweiss; 2003).
L’attivazione della via delle ERK 1/2 è essenziale per la progressione del ciclo cellulare. PEA-15 interagisce con ERK 1/2 modulando le risposte cellulari attivate dalle vie di trasduzione di queste chinasi senza bloccarne l’attivazione. Questa proteina non è substrato di ERK 1/2, il legame con PEA-15 in vitro e in vivo non inibisce la capacità di ERK di fosforilare i suoi substrati, anche quelli nucleari (Gaumont-LeClerc, Mukhopadhyay, Goumard and Ferbeyre; 2004). PEA-15 altera i segnali delle MAPK sequestrandole nel citoplasma, bloccando il loro ingresso nel nucleo e/o promuovendone l’uscita. PEA-15 non interferisce con l’attività di ERK 1/2, infatti non ostacola la fosforilazione dei suoi substrati citosolici, come la statmina, ma blocca la fosforilazione di quelli nucleari, come Elk-1, con conseguente inibizione della trascrizione ERK-dipendente. Quindi PEA-15 modula le risposte cellulari mediate da ERK 1/2 impedendo il suo accumulo nel nucleo. Altri studi inoltre hanno dimostrato che la sovraespressione di PEA-15 conduce ad un aumento dell’attivazione di ERK 1/2, infatti molte linee cellulari tumorali e astrociti in coltura continuano a proliferare pur esprimendo alti livelli di PEA-15. Ciò suggerisce che l’interazione tra PEA-15 e ERK 1/2 sia soggetta a regolazione attraverso modificazioni postraduzionali. Recentemente è stato dimostrato che la fosforilazione sui due residui di serina (Ser104 e Ser116 ) nella coda C-terminale di questa proteina, è in grado di regolare il legame con ERK 1/2 e che la fosforilazione di PEA-15 su entrambi i residui blocca l’interazione con le MAPK (Krueger, Chou, Glading, Schaefer and Ginsberg; 2005). Usando mutanti
fosfomimetici e non fosforilabili di PEA-15 è stato dimostrato che la fosforilazione limita la sua capacità di bloccare la localizzazione nucleare e l’attività trascrizionale di ERK 1/2, permettendo quindi la proliferazione di cellule che la esprimono ad alti livelli (Krueger, Chou, Glading, Schaefer and Ginsberg; 2005). Entrambi i siti di fosforilazione sono presenti sulla coda carbossiterminale e questo suggerisce che la fosforilazione potrebbe ostacolare stericamente il legame con ERK 1/2.
È interessante notare che la fosforilazione di PEA-15 è necessaria affinché essa possa legarsi al DISC (death inducing signaling complex) e prevenire l’attivazione delle caspasi. Tale evento potrebbe essere mediato dall’interazione del dominio DED con componenti del DISC che presentano lo stesso dominio, come ad esempio FADD. Poichè ERK 1/2 interagisce parzialmente con il DED di PEA-15, è stato ipotizzato che la fosforilazione di questa proteina impedisca il legame con le MAPK, rendendo questo dominio disponibile al legame con il DISC, bloccando così l’apoptosi (Robinson; 2002).
L’espressione di PEA-15, seppur limitata a livello dei neuroni, e la sua interazione con le MAPK (chinasi coinvolte nel consolidamento della memoria in diverse strutture tra cui l’amigdala basolaterale) suggeriscono un suo possibile ruolo anche nei fenomeni di plasticità sinaptica neuronale. L’attività di questa proteina in questo caso, potrebbe essere regolata non solo da meccanismi postraduzionali, ma anche attraverso la regolazione della sua espressione genica. Infatti, un recente studio (Mei, Li, Dong, Jiang, Wang and Hu; 2005), ha evidenziato una riduzione dell’espressione di PEA-15 nell’ippocampo 0,5 e 6 h dopo CFC. Questi risultati ad una prima lettura risultano essere contrastanti con quelli ottenuti dal nostro studio, ma potrebbero
essere interpretati alla luce del fatto che questa proteina presenterebbe un meccanismo di regolazione temporalmente bifasico nella sua trascrizione.
Si può dunque suggerire un modello, non certo esente da speculazioni, del possibile ruolo svolto da PEA-15 durante l’apprendimento della paura legata al contesto. Durante le fasi precoci del consolidamento della memoria, PEA-15 subirebbe un controllo negativo dell’espressione. La fosforilazione di PEA-15 consentirebbe la traslocazione di ERK 1/2 nel nucleo e la conseguente trascrizione di geni importanti per la formazione di nuove sinapsi. Nella fase tardiva invece PEA-15 subirebbe un incremento di espressione e una riduzione nei livelli totali di fosforilazione, con conseguente riduzione della trascrizione genica. La presenza della forma non fosforilata bloccherebbe la traslocazione di ERK 1/2 nel nucleo rendendolo disponibile per i suoi substrati citosolici, come la statmina, e questo porterebbe alla stabilizzazione delle strutture sinaptiche di nuova formazione e al potenziamento dell’attività nervosa. Studi recenti hanno infatti dimostrato che la via delle MAPK e la loro attività sono necessarie per il consolidamento della memoria alla paura nell’amigdala (Schafe, Atkins, Swank, Bauer, Sweatt and LeDoux; 2000) e che la statmina, substrato di ERK 1/2 e potente inibitore della polimerizzazione dei microtubuli, svolge un ruolo fondamentale nei fenomeni di paura innata e appresa livello dell’amigdala (Shumyatsky, Malleret, Shin, Takizawa, Tully, Tsvetkov, Zakharenko, Joseph, Vronskaya, Yin, Schubart, Kandel, and Bolshakov; 2005). Topi privi di statmina presentano deficits nella memoria alla paura e sono incapaci di riconoscere un pericolo. La statmina è una fosfoproteina citosolica coinvolta nei meccanismi
dinamici di assemblaggio e disassemblaggio dei microtubuli (MT) (Beltmont & Mitchinson; 1996). Infatti, ne previene la formazione interagendo con gli etererodimeri di tubulina, in seguito a fosforilazione, invece, la statmina libera la tubulina permettendone l’assemblaggio. Quindi la regolazione della dinamica dei microtubuli potrebbe essere un punto cardine nei fenomeni plastici che avvengono nelle vie neurali associate alla paura. Naturalmente saranno necessari studi approfonditi per testare il nostro modello, in quanto i dati fino ad oggi in nostro possesso non permettono di dimostrare nè un aumento di PEA-15 a livello dell’amigdala e di altre specifiche regioni cerebrali, né un suo pattern di coinvolgimento diretto nei fenomeni di plasticità neurale.
5.3 CLONE 1VA6
L’ATP sintasi è un complesso enzimatico multisubunità associato alla membrana mitocondriale interna, che accoppia il flusso di protoni transmembrana alla sintesi di ATP. Questo enzima sfrutta l’energia del gradiente protonico (forza motrice protonica) che si instaura a cavallo della membrana interna in seguito alla respirazione cellulare, utilizzando il flusso ionico che passa attraverso la membrana per guidare la sintesi di ATP da ADP+Pi (fosfato inorganico). Questo enzima presenta due domini maggiori, un domino globulare catalitico consciuto come F1, che sporge nella matrice mitocondriale e un dominio che costituisce un canale protonico all’interno della membrana, conosciuto come F0. Entrambi i domini sono dotati di attività rotatoria e sono collegati tra loro da uno stelo centrale e da uno
periferico. F6 è parte di quello periferico e agisce come uno statore nel prevenire la tendenza delle subunità di F1 a ruotare con l’elemento centrale. L’ATP sintasi è un enzima mitocondriale, tuttavia nei mammiferi tutte le subunità, ad eccezione di F6 e F8, vengono codificate dal DNA nucleare.
Molti genomi mitocondriali sono molecole di DNA circolari a doppia elica superravvolte. Il contenuto genico in termini di numero e funzione è molto anche in specie molto diverse tra loro, anche se la dimensione del genoma varia. Negli animali il genoma mitocondriale è inferiore a 20Kb. Nello specifico il DNA mitocondriale (mtDNA) dei mammiferi codifica per: 2 RNA ribosomali (rRNA), 22 transfer RNA (tRNA) e 13 polipeptidi che sono parte del sistema multienzimatico che accoppia respirazione e fosforilazione ossidativa (OXPHOS). Più di 70 tra le circa 85 subunità polipeptidiche che costituiscono questo complesso, sono codificate dal DNA nucleare, solo 13 sono codificate dall’mtDNA.
Uno studio recente sul condizionamento associativo visivo-olfattivo in Periplaneta americana ha evidenziato un aumento dell’espressione del gene mitocondriale F6 nel SNC durante la fase di consolidamento dell’associazione tra gli stimoli (Pinter, Lent and Strausfeld; 2005). Evidenze sperimentali suggeriscono l’esistenza di centri nervosi associati alla memoria e all’apprendimento, analoghi nei mammiferi e negli insetti che mostrano un’organizzazione funzionale e meccanismi molecolari simili (Cayre, Malaterre, Scotto-Lomassese, Strambi and Strambi; 2002; Heisemberg; 2003). Ad esempio è stato dimostrato che le forme di memoria mediate dall’ippocampo nei mammiferi, negli insetti invece richiedono l’integrità dei paired mushroom bodies neuropilis (Mizunami, Okada, Li and Strausfeld; 1998; Strausfeld &
Li; 1999). Infatti, queste strutture mostrano un’organizzazione citoarchitettonica simile a quella dell’ippocampo e sono coinvolte nell’integrazione dei segnali multimodali e contestuali (Mizunami, Okada, Li and Strausfeld; 1998; Strausfeld & Li; 1999). Per identificare l’espressione genica legata al consolidamento dell’apprendimento è stata analizzata una componente caratteristica del comportamento di foraggiamento degli insetti che consiste nel movimento delle antenne verso uno stimolo olfattivo. Questo movimento definito risposta di proiezione delle antenne (APR), in P. americana può essere soggetto a condizionamento associativo accoppiando lo stimolo olfattivo (US) con un altro stimolo sensoriale (CS) (Lent & Kwon; 2004). I cervelli degli animali condizionati e dei controlli sono stati asportati durante il periodo critico della fase di consolidamento della memoria e l’espressione genica differenziale è stata osservata costruendo due librerie di cDNA tramite la tecnica dell’SSH. Lo screening primario ha permesso di identificare numerosi geni differenzialmente espressi; l’espressione differenziale è stata confermata tramite real time RT-PCR. Da questo studio è emerso che tra i geni sovraespressi durante la fase di consolidamento vi sono trascritti codificati da mtDNA (COX e F6). Questo dato è in linea con i risultati da noi ottenuti nel ratto e potrebbe essere spiegato alla luce del fatto che, durante la fase di consolidamento le strutture sinaptiche vadano incontro a cambiamenti morfo-strutturali. Infatti, i terminali sinaptici sono ricchi di mitocondri che forniscono DNA autonomo per soddisfare la necessità locale di espressione genica senza utilizzare il lungo trasporto attraverso gli assoni (Pinter, Lent and Strausfeld; 2005). Da tempo è stato dimostrato che alcune forme di plasticità sinaptica a lungo termine a livello delle connessioni tra
neurone sensoriale e motorio in Aplysia, dipendono da sintesi proteica locale a livello delle terminazioni presinatiche (Casadio, Martin, Giustetto, Zhu, Chen, Bartsch, Bailey and Kandel; 1999). Gli assoni sensoriali isolati, previa rimozione del corpo cellulare, sono ancora capaci di sintetizzare proteine e questi fenomeni sono stimolati dalla 5-HT (Martin, Casadio, Zhu, Rose, Chen, Bailey and Kandel; 1997). Recenti studi hanno dimostrato che mRNA sono presenti negli assoni e nei terminali sinaptici e che la 5-HT ne regola la traduzione contribuendo alla plasticità sinapsi-specifica. Alcuni di questi mRNA, localizzati a livello delle sinapsi, codificano per elementi del citoscheletro, suggerendo che la sintesi proteica locale sia richiesta per la crescita di nuove connessioni sinaptiche, associate ad un persistente aumento della forza sinaptica (Moccia, Chen, Lyles, Kapuya, Kalachikov, Sphan, Frank, Kandel, Barad and Nartin; 2003). Di conseguenza la sintesi proteica locale svolge un importante ruolo nei fenomeni di plasticità sinaptica legata all’appendimento negli invertebrati. Nei mammiferi si ritiene che nei neuroni maturi la sintesi proteica avvenga soltanto a livello post-sinaptico nei dendriti (Steward & Schuman; 2001), tuttavia ci sono chiare evidenze che nei neuroni in via di sviluppo siano presenti meccanismi traduzionali, sia negli assoni che nei dendriti (Brittis, Lu and Flanagan; 2002). Quindi si può ipotizzare che l’aumento dell’espressione dei geni mitocondriali durante i fenomeni di plasticità sia legato alla necessità di una maggiore quantità di energia per far fronte alle esigenze della sintesi proteica a livello locale.
Ulteriore conferma del fatto che modificazioni dell’espressione dei geni mitocondriali e in particolare di F6 siano coinvolte nelle risposte plastiche del SNC, derivano da studi effettuati sulla plasticità,
associata allo sviluppo, nella corteccia visiva del gatto (Yang, Silver, Ellis and Mover; 2001). Infatti il primo mese di vita rappresenta un periodo critico per la plasticità neuronale nella corteccia visiva, durante il quale lo sviluppo anatomico e fisiologico delle strutture cerebrali, in parte ancora immature, dipende dalle esperienze visive. L’allevamento al buio rallenta l’intero time-course di questo periodo critico e prolunga la plasticità neurale oltre il normale limite di tempo, permettendo di separare i fenomeni associati alla plasticità neuronale da quelli associati alla generale maturazione. Ciò rappresenta un sistema ideale per isolare cambiamenti nell’espressione genica coinvolti nei fenomeni di plasticità. Da questo studio è emerso che alcuni geni mitocondriali, tra cui la F6, mostrano un incremento di espressione in entrambe le condizioni, durante il periodo in cui la plasticità risulta essere massima, indicando l’esistenza di una stretta correlazione tra l’espressione di questi geni e la plasticità neurale (Yang, Silver, Ellis and Mover; 2001).
Infine è interessante notare che mutazioni puntiformi a livello della sequenza nucleotidica che codifica per F6, sono responsabili di patologie associate a lesioni cerebrali e demenza, come la sindrome di Leigh e la necrosi striatale bilaterale (Schon, Santra, Pallotti, Girvin; 2001). Evidenze sperimentali hanno suggerito che la funzione mitocondriale e lo status energetico dei neuroni possano essere sensibilmente e sinergicamente regolati dall’attività neuronale, infatti cambiamenti nel metabolismo energetico sono osservabili anche in seguito a induzione di LTP(Wieraszko;1982).
Uno studio interessante ha dimostrato che esiste una modulazione attività-sinaptica-dipendente dei geni mitocondriali nell’ippocampo di ratto (Williams, Thompson, Mason-Parker, Abraham and Tate; 1998).
Per identificare i geni tardivi che possano essere coinvolti nel mantenimento dell’LTP, è stata creata una libreria di cDNA dal giro dentato dell’ippocampo di ratto, 48 h dopo induzione dell’LTP nelle sinapsi della via perforante. Questa libreria è stata sottoposta a screening differenziale con sonde generate dalla stessa libreria e da un’altra derivante da tessuti di controllo. Questa analisi ha evidenziato un aumento dell’espressione del gene mitocondriale dell’rRNA 12s. Ulteriori controlli hanno dimostrato una generale sovraepressione di tutti i geni mitocondriali, senza un concomitante aumento dell’espressione del gene nucleare codificante per il trasportatore di glucosio glut-3, suggererendo una possibile correlazione tra l’attività mitocondriale e il mantenimento dell’LTP. Successivamente è stato dimostrato che questo incremento della trascrizione mitocondriale è indipendente dall’attivazione dei recettori NMDA e dall’induzione dell’LTP. Infatti si ritrova anche in seguito a stimolazioni a bassa frequenza o in presenza di antagonisti dell’NMDA, situazioni che precludono l’instaurarsi dell’LTP (Williams, Thompson, Mason-Parker, Abraham and Tate; 1998). Tuttavia stimolazioni a bassa frequenza possono determinare cambiamenti sinaptici persistenti che modificano la successiva possibilità di indurre LTP in queste sinapsi. Quindi l’attività a livello delle sinapsi poche ore prima della stimolazione può influire sulla responsività della sinapsi al nuovo input (fenomeno definito metaplasticità).
Una possibile spiegazione della correlazione tra l’incremento dell’espressione dei geni mitocondriali e la plasticità sinaptica, può essere offerta dal fatto che l’ATP prodotto dai mitocondri è utilizzato per il trasporto assoplasmatico rapido e per la sintesi di
macromolecole e neurotrasmettitori. Inoltre i cambi morfologici, come la rimozione delle connessioni preesistenti e la formazione di nuovi contatti sinaptici, che si osservano in seguito all’instaurarsi di fenomeni a lungo termine, sono strettamente dipendenti da processi che richiedono energia (trascrizione e traduzione). Quindi una sinapsi che modula la sua capacità di essere potenziata o depressa o che sia sottoposta a cambiamenti morfologici, necessita di una produzione più elevata di energia. Questo potrebbe essere ottenuto attraverso un aumento dell’attività mitocondriale o un accumulo di mitocondri a livello dei siti plastici, che determinano in entrambi i casi un aumento dei livelli di espressione del mtRNA. Numerose evidenze sperimentali supportano queste ipotesi: infatti, l’inibizione cronica dell’attività della citocromo ossidasi (COX), produce deficit nella memoria spaziale (Bennet, Mlady, Fleshner and Rose; 1996) e l’attività mitocondriale è correlata al potenziamento post-tetanico della trasmissione sinaptica, a livello delle giunzioni neuromuscolari del gambero. Ulteriori conferme arrivano dallo studio di patologie neurodegenerative associate a deficit mnemonici, come il Morbo di Alzheimer, dove si assiste a una riduzione dell’mRNA della COX, indice di una riduzione del metabolismo ossidativo (Chandrasekaran, Giordano, Brady, Stoll and Martin; 1994). Tutte queste osservazioni sono in linea con le nostre scoperte, infatti in seguito allo screenig primario si può osservare un aumento dell’espressione di molti geni mitocondriali tra cui diverse subunità della citocromo ossidasi e la NADHdeidrogenasi, questi risultati andranno verificati in futuro.