I
propellenti
CAPITOLO 2.
I propellenti
2.1.
L’etano
3
H C
H C
3
Figura 2.1 Una molecola di etano osservata lungo il legame C-C: conformazione eclissata e conformazione sfalsata.
L’etano è un composto chimico organico appartenente agli idrocarburi alifatici, secondo termine del gruppo degli alcani. A temperatura e pressione ambiente è un gas estremamente infiammabile, esplosivo in miscela con l'aria, incolore e inodore. Industrialmente si ottiene per distillazione frazionata del gas naturale, di cui è uno dei principali componenti, insieme al metano. In laboratorio può essere ottenuto per elettrolisi (elettrolisi di Kolbe) dell'acido acetico. Nell'industria chimica, è la materia prima per la produzione dell'etene per cracking catalico (processo attraverso cui si ottengono idrocarburi paraffinici leggeri per rottura delle molecole di idrocarburi paraffinici pesanti). Per via della repulsione elettrostatica reciproca tra gli elettroni, l'etano tende ad assumere preferibilmente una conformazione sfalsata, dove l'angolo diedro formato da due legami C-H ciascuno su un diverso atomo di carbonio è di 60°; la barriera energetica tra le due conformazioni è comunque
sufficientemente bassa da consentire anche a basse temperature una rotazione completa attorno al legame che unisce i due atomi di carbonio. La Tabella 2.1 riassume le principali proprietà dell’etano.
Etano
Nome IUPAC Etano
Caratteristiche generali
Formula bruta o molecolare
2 6
C H
Massa molecolare [uma] 30,07
Aspetto gas incolore
Numero CAS 74-84-0 Proprietà chimico-fisiche Densità , in c.n. [g l^-1] 1,3562 Temperatura di fusione [°K] 90,3 (-182,7°C) 0 fusH ∆ [kJ mol^-1] 0,583 0 fusS ∆ [J °K^-1 mol^-1] 6,46 Temperatura di ebollizione [°K] 184,5 (-88,6°C) 0 eb
H
∆
[kJ mol^-1] 10 Proprietà termochimiche 0 fH ∆ [kJ mol^-1] -84 0 fG ∆ [kJ mol^-1] -32 0S
[J °K^-1 mol^-1] 229,2 0 p C [J °K^-1 mol^-1] 52,5 Indicazioni di sicurezza Flash point [°K] 138 (-135°C) Temperatura di autoignizione [°K] 788 (515°C) Limiti di esplosione 3 - 12,5% vol.L’etano
19
2.1.1. Proprietà termodinamiche
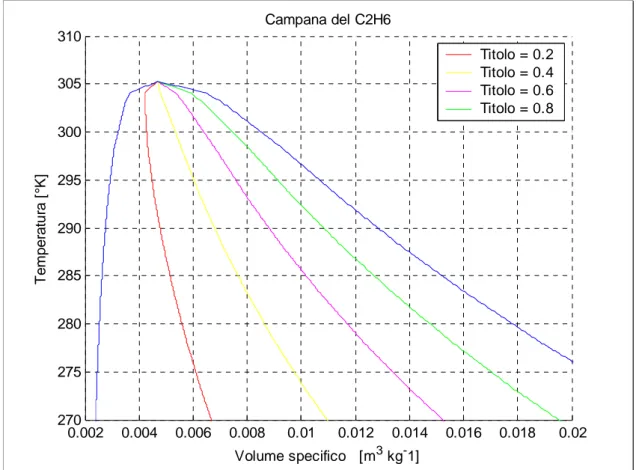
L’etano è non criogenico, può essere immagazzinato in opportune bombole in condizioni di vapore saturo a temperatura ambiente. La sua temperatura critica vale 305.25 °K a cui corrisponde una pressione critica di 49 atm. La Figura 2.2 mostra la curva a campana dell’etano.
0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016 0.018 0.02 270 275 280 285 290 295 300 305 310 Campana del C2H6 T em peratu ra [°K ] Volume specifico [m3 kg-1] Titolo = 0.2 Titolo = 0.4 Titolo = 0.6 Titolo = 0.8
Figura 2.2 Campana dei vapori saturi del C2H6.
L’Appendice B riporta i dati termodinamici utilizzati nei calcoli svolti nel presente lavoro di tesi.
2.2.
Il perossido di idrogeno
Figura 2.3 Struttura della molecola del perossido di idrogeno (H2O2).
Il perossido di idrogeno, noto anche come acqua ossigenata, è il più semplice dei perossidi. La sua formula chimica è H2O2. La sua molecola non è planare; i due legami O-H formano tra loro un
angolo diedro di 111°. A temperatura ambiente è un liquido incolore viscoso e poco stabile, che può decomporsi spontaneamente. Per questo non viene mai utilizzato puro, ma in soluzione acquosa in percentuali mai superiori al 60%. Il pericolo di esplosione è dovuto alla facilità con cui si decompone convertendosi in acqua e ossigeno gassoso con reazione esotermica:
2 2
2
2 298
H O
→
H O O
+
+
kJ
per grammo mole H2O2L'aumento della temperatura provocato dall'emissione di energia rende il sistema ancora meno stabile, provocando una reazione di dissociazione a catena. La decomposizione è inoltre catalizzata dalla presenza di ioni metallici, specialmente del ferro. Industrialmente, viene prodotto con svariati processi; uno dei più diffusi è per elettrolisi dell'acido solforico o del bisolfato di ammonio (NH4HSO4), seguito dall'idrolisi dello ione perossidisolfato ((SO4)2--) che si viene a formare. Un altro processo passa invece per l'auto-ossidazione dell'idrochinone (p-C6H4(OH)2) o di suoi derivati. Dal punto di vista chimico, è un energico reagente ossidante e viene utilizzato in numerose applicazioni: come agente sbiancante, nella sintesi chimica, nella bonifica del suolo, nel trattamento delle acque, per il trattamento superficiale dei metalli, nell’elettronica e nella disinfezione. Ad elevate concentrazioni (High Test Peroxide HTP) viene impiegato come monopropellente o bipropellente nelle applicazioni propulsive. La Tabella 2.2 riassume le principali proprietà del perossido di idrogeno.
Il perossido di idrogeno
21
Perossido di idrogeno
Caratteristiche generali
Formula bruta o molecolare
H
2O
2Massa molecolare [uma]
34,0
Aspetto
liquido incolore
Numero CAS
7722-84-1
Proprietà chimico-fisiche Densità, in c.n. [g l^-1]1,24
Temperatura di fusione [°K]272,6 K (-0,4°C)
Temperatura di ebollizione [°K]423 K (150°C)
Proprietà termochimiche 0 fH ∆ [kJ mol^-1]-187,8
0 fG ∆ [kJ mol^-1]-120,4
0S
[J °K^-1 mol^-1]109,6
0 p C [J °K^-1 mol^-1]89,1
Indicazioni di sicurezzaTabella 2.2 Prospetto delle proprietà del perossido di idrogeno.
Le caratteristiche fisiche del perossido di idrogeno (hydrogen peroxide, HP) variano a seconda della sua concentrazione. A pressione e temperatura ambiente il perossido di idrogeno è un liquido molto denso (Figura 2.4), che può essere immagazzinato anche per lunghi periodi di tempo, aspetto che lo rende particolarmente adatto all’utilizzo in applicazioni orbitali. La Tabella 2.3 mostra un confronto tra la densità del perossido di idrogeno e altri propellenti di uso comune.
Propellente Densità [Kg dm^-3] NTO 1.431 MMH 0.874 Acqua 1 Perossido di idrogeno 1.4422 Ossigeno liquido 1.14 Etanolo 0.7893 Metanolo 0.7914 Propanolo-1 0.8035 Butanolo-1 0.8098
Tabella 2.3 Densità di vari propellenti.
Figura 2.4 Densità del perossido di idrogeno in funzione della concentrazione per varie temperature.
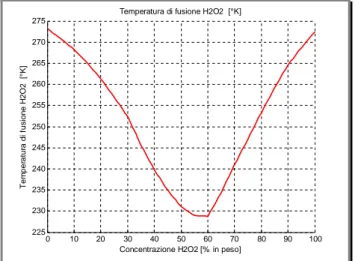
Il perossido di idrogeno (per tutte le concentrazioni) bolle ad una temperatura superiore a 100°C e congela a temperatura minore di 0°C. La Figura 2.5 mostra l’andamento del punto di congelamento al variare della concentrazione.
0 10 20 30 40 50 60 70 80 90 100 225 230 235 240 245 250 255 260 265 270 275
Concentrazione H2O2 [% in peso]
Tem per atur a di f usion e H 2O2 [°K]
Temperatura di fusione H2O2 [°K]
Il perossido di idrogeno
23
2.2.1. Pressione di vapore
La pressione di vapore del perossido di idrogeno, se confrontata con quella degli altri propellenti, è relativamente bassa. Per evitare problemi di cavitazione durante il pompaggio sono sufficienti pressioni di entrata alla pompa più basse rispetto agli altri propellenti.
In Figura 2.6 è riportato l’andamento della pressione di vapore alle varie concentrazioni.
Figura 2.6 Pressione di vapore del perossido di idrogeno al variare della concentrazione.
Il perossido di idrogeno diluito in acqua è una miscela di due sostanze. Osservando l’andamento della pressione di vapore in funzione della concentrazione si può notare come la pressione totale, somma delle pressioni parziali dei due componenti della miscela, diminuisca all’aumentare della concentrazione ed aumenti all’aumentare della temperatura. Il comportamento della pressione parziale di H2O2 in funzione della concentrazione è opposto a quello della miscela:
all’aumentare della concentrazione aumenta la pressione di vapore parziale di H2O2.
2.2.2. Calore specifico
Il perossido di idrogeno ha un elevato calore specifico, assimilabile a quello dell’acqua. Questo lo rende un buon refrigerante nel caso in cui lo si voglia utilizzare come fluido di raffreddamento in un sistema rigenerativo
0 10 20 30 40 50 60 70 80 90 100 2.6 2.8 3 3.2 3.4 3.6 3.8 4 4.2
Concentrazione H2O2 [% in peso]
C a lo re sp ec ifico H 2 O 2 [ kJ kg -1 °K -1)]
Calore specifico H2O2
Figura 2.7 Calore specifico del perossido di idrogeno al variare della concentrazione.
Le caratteristiche della molecola di HP sono peggiori rispetto a quelle dell’acqua. All’aumentare della concentrazione si ha una diminuzione del calore specifico, Figura 2.7.
2.2.3. Proprietà tossicologiche
Il perossido di idrogeno, come propellente, è considerato “non tossico” in quanto rispetto ad altri propellenti, cancerogeni e velenosi per l’uomo anche in piccole quantità, ha effetti molto più contenuti. Con le opportune protezioni la sua manipolazione è più semplice rispetto ad esempio a quella dell’idrazina. La sua bassa pressione di vapore comporta in questo ambito notevoli facilitazioni.
Sulla pelle concentrazioni al 5% in peso e oltre possono causare irritazioni e ustioni. Spruzzi negli occhi di H2O2 causano dolore e per concentrazioni superiori al 6% in peso possono provocare
danni gravi e permanenti. Se ingerito può provocare ustioni a bocca, gola ed esofago. In alcuni casi può provocare il rigonfiamento degli organi interni a seguito della sua decomposizione. Ad elevate concentrazioni può essere letale. L’inalazione di vapori di H2O2 irrita le vie respiratorie. Il limite di
esposizione (LTV) è di 1.0 ppm (1.4 mg H2O2/m 3
di aria) per un periodo massimo di 8 ore al giorno e 40 ore la settimana.
2.2.4. Proprietà chimiche
L’ H2O2 è una molecola molto reattiva. Può reagire come ossidante e come riducente. Può
formare altri composti perossidati sia organici che inorganici. Può formare, infine, composti di addizione.
Il perossido di idrogeno
25
2.2.5. Proprietà di decomposizione
Il perossido di idrogeno si decompone in modo spontaneo in acqua ed ossigeno liberando energia. La reazione esotermica è la seguente:
2 2
2
2 298
H O
→
H O O
+
+
kJ
per grammo mole H2O2 (0.1)La velocità di decomposizione è normalmente molto lenta. L’effetto della luce o del calore o l’entrare in contatto con altri materiali possono accelerare notevolmente la decomposizione. I principali fattori che intervengono nella decomposizione sono:
• L’assorbimento di luce può causare la decomposizione fotochimica
• La presenza di contaminanti (sali di metalli come ferro, rame, cromo, vanadio, tungsteno, molibdeno, argento e metalli del gruppo del platino) può causare la decomposizione omogenea
• Il contatto con opportuni catalizzatori provoca la decomposizione eterogenea
Ossido di rutenio RuO4 Platino Pt
Ossidi di manganese Mn2O3
MnO2
Osmio Os
Ossidi di ferro FeO
Fe2O3
Palladio Pd
Ossidi di cobalto CoO Iridio Ir
Ossidi di nickel NiO
Ni2O3 Rodio Rh Ossido ed idrossido di piombo PbO Pb(OH) 2 Argento Ag
Ossido di mercurio HgO Oro Au
Tabella 2.4 Elenco dei catalizzatori più attivi.
La catalisi eterogenea rappresenta una delle metodologie più efficaci per la decomposizione del perossido di idrogeno, con le attuali tecnologie in questo campo, come vedremo meglio in seguito, è possibile decomporre in modo totale il perossido di idrogeno secondo la reazione (0.1) ottenendo vapore d’acqua e ossigeno a temperature superiori ai 800 °K capaci di provocare l’autoaccensione di un idrocarburo.
2.2.6. Effetti della decomposizione
Il perossido di idrogeno si decompone con continuità in acqua ed ossigeno anche alle basse concentrazioni. La velocità di decomposizione dipende dai fattori riportati precedentemente. In qualunque situazione è necessario che i gas prodotti dalla reazione trovino sfogo altrimenti in un serbatoio sigillato si ha un aumento della pressione. Per questo motivo il perossido di idrogeno non può essere conservato in serbatoi ermeticamente chiusi.
2.3.
Applicazioni propulsive del perossido di idrogeno
Oltre agli elementi già evidenziati nel capitolo introduttivo e nei paragrafi precedenti, ci sono altre caratteristiche del perossido di idrogeno che semplificano il suo utilizzo come propellente. In particolare, il perossido di idrogeno non reagisce chimicamente con gli elementi od i composti presenti nell’atmosfera. Questo consente di utilizzarlo in missioni in atmosfera come il controllo di reazione in un veicolo transatmosferico. L’utilizzo del perossido di idrogeno come ossidante (previo naturalmente decomposizione in ossigeno e vapore d’acqua) permette inoltre di ottenere impulsi specifici paragonabili ai classici sistemi NTO-Idrazina con notevoli vantaggi in termini di sicurezza e non tossicità. Da questo punto di vista vari idrocarburi possono essere utilizzati; l’etano presenta vantaggi da un punto di vista termodinamico come pressurizzante e iniettato in camera in fase gassosa si accende spontaneamente con i prodotti caldi della dissociazione del perossido e permette una combustione efficiente con tempi di residenza in camera molto piccoli a tutto vantaggio della compattezza del sistema.
In Germania il perossido di idrogeno fu prodotto in modo industriale già dalla fine del XIX secolo. Il primo a riconoscerne le sue potenzialità propulsive fu Hellmuth Walter, che nel 1938 realizzò in Germania la sua prima applicazione nel sistema di assistenza per il decollo del velivolo Heinkel He 176. Il perossido di idrogeno veniva decomposto nel motore in modo omogeneo da un catalizzatore liquido e permetteva di ottenere una spinta di 5783 N. La decomposizione del perossido di idrogeno fu utilizzata per azionare le turbopompe del sistema di alimentazione delle V2.
Dopo la Seconda Guerra Mondiale, studi sul perossido di idrogeno sono stati effettuati sia in Gran Bretagna sia negli USA. Si è impiegato in una prima fase perossido di idrogeno all’80% e successivamente a concentrazioni più elevate (HTP 85%). Per la decomposizione dell’H2O2 sono stati
sviluppati principalmente letti catalitici in argento. I risultati di questi studi hanno portato negli UK allo sviluppo di motori bipropellenti che utilizzavano come ossidante il perossido di idrogeno (Gamma 201 e 301 - impiegati nei velivoli Black Knight e Black Arrow - Spectre e Stentor.). Negli USA sono stati sviluppati dall’USAF sistemi per aumentare la spinta negli aeroplani chiamati AR (Aircraft Rocket).
Negli anni 50 e 60 il perossido di idrogeno è stato abbondantemente utilizzato in sistemi di reazione e controllo (Reaction Control Systems) sia di aerei – X-1 e X-15 – sia di veicoli spaziali (Mercury, Syncom, Comsat).
Dal 1960 al 1980, e soprattutto durante la guerra fredda, aspetti come costi operativi e tossicità furono trascurati alla ricerca delle prestazioni migliori. Si scelse di puntare soprattutto sull’ossigeno liquido e, nel campo dei propellenti non criogenici, sulla miscela ipergolica tetrossido di
azoto-Applicazioni propulsive del perossido di idrogeno
27
idrazina. Tra il 1985 e il 1987 il perossido di idrogeno non venne praticamente utilizzato per la propulsione negli Stati Uniti.
A partire dal 1990 il bisogno di propellenti a basso costo, non tossici ed ecologici ha riaperto la ricerca sul perossido di idrogeno.
Attualmente i progetti più interessanti sono seguiti negli Stati Uniti e in Gran Bretagna:
• Spacecraft Reaction Control : il Lawrence Livermore National Laboratory sta lavorando a
micro-propulsori da 27 N che operano con H2O2 all’85%.
• Upper Stage Main Propulsion : l’Orbital Science Corporation sta sviluppando un motore
bi-propellente da 45000 N per la propulsione dello stadio finale.
• Lanciatore Commerciale BA-2 : la Beal Aerospace ha il programma di una piattaforma di
lancio che utilizza in ogni stadio perossido di idrogeno e kerosene JP. Una volta completato, il primo stadio fornirà una spinta superiore alle 1500 tonnellate.
• Ricerca e Sviluppo della Formulazione di un Combustibile Ipergolico: La Naval Air Warfare
Weapons (NAWC) sta conducendo ricerche con varie formulazioni di combustibile per sviluppare l’autoaccensione con perossido di idrogeno.
• Ricerca su Razzi Ibridi : dal 1991 la Purdue University e la University at Surrey stanno
2.4.
Riferimenti
[1] M.F. Easton, A.G. Mitchell, W.F.K. Wynne-Jones, Trans. Faraday Soc. 48:796 (1952). [2] G. Scatchard, G.M. Kavanagh, L.B. Ticknor, J. Amer. Chem. Soc. 74:3715-3720 (1952). [3] CEFIC, Hydrogen Peroxide Bulk Storage Guideline.
[4] M. Kroutil, M. Vender, Chem. Prumysl., 14:412-415 (1956).
[5] M. Ventura, P. Mullens, The Use of Hydrogen Peroxide for Propulsion and Power, AIAA Paper 99-2880, , 35th AIAA/ASME/SAE/ ASEE Joint Propulsion Conference, Los Angeles, USA, June 1999.
[6] V. Bombelli, T. Marée, J.L. Moerel, D. Simon, Economic Benefits of the Use of Non-Toxic
Monopropellants for Spacecraft Applications, AIAA Paper 2003-47, 39th AIAA/ASME/SAE/ASEE Joint Propulsion Conference, Huntsville, USA, July 2003.
[7] M. Ventura, G. Garboden, A Brief History of Concentrated Hydrogen Peroxide Uses, AIAA Paper 99-2739, 35th AIAA/ASME/SAE/ASEE Joint Propulsion Conference, Los Angeles, USA, June 1999.
[8] David R. Lide Editor in chief Handbook of chemistry and physics 84th edition 2003-2004 CRC press
[9] Bramanti C., Cervone A., d’Agostino L., Assessment of the Propulsive Performance of Fuel
Vapour Pressurized Hydrogen Peroxide – Ethane Rocket Engines, XVIII Congresso Nazionale
AIDAA, Volterra, Italy, September 2005.
[10] Fuel Vapor Pressurized Rocket Propulsion Technology, NASA Phase 1 SBIR Contract NAS
8-97153 between NASA-Marshall and Utah Rocketry, Salt Lake City, Utah, March to September 1997.