Capitolo 4.
Test di reattività
Nel processo di desolforazione ad umido calcare-gesso, il calcare si dissolve nella
sospensione absorbente e neutralizza l’SO2 assorbita e, in presenza di aria, precipita
CaSO42H2O (gesso). Pertanto la reattività del calcare, cioè la velocità con cui si dissolve, è
uno dei parametri più importanti nei processi di desolforazione ad umido poiché va ad influenzare direttamente il tempo di residenza della sospensione nel sistema, la qualità del
gesso prodotto nonché la velocità di trasferimento dell’SO2 dalla fase gas alla fase liquida
con conseguenti effetti sui costi di investimento e di esercizio dell’impianto. La reattività è funzione delle principali variabili di processo:
• pH della sospensione; • temperatura;
• granulometria e composizione del calcare.
Nel presente capitolo si descrivono l’apparato e la procedura delle prove di reattività e i risultati ottenuti; infine, si confronta la reattività dei campioni di marmettola con quella del calcare commerciale.
4.1 Apparato e procedura sperimentali
Ogni licenziatario di un processo desolforativo ha un proprio metodo e uno standard di definizione della reattività. Per caratterizzare i campioni di marmettola e di calcare è stata scelta la procedura utilizzata nei laboratori di ENEL Produzione e Ricerca di Pisa [4.1], che prevede una dissoluzione del calcare con HCl, alla temperatura di 50°C e a pH costante pari a 5; quest’ultima scelta è dettata dal fatto che il pH tipico di un sistema DeSOx a umido è compreso tra 4.5 e 5.5.
La velocità di dissoluzione del calcare, quindi, può essere valutata mediante titolazione con HCl, in base alla seguente reazione:
CaCO3 (s) + 2HCl → CaCl2 + H2O + CO2 (g) (4.1)
La reattività dei vari campioni è stata valutata con un apparato chiamato TitroLine alpha, mostrato in Fig. 4.1. E’ stata utilizzata una piastra riscaldante dotata di agitatore magnetico, su cui è stato posato il becker contenente la sospensione del campione in esame. La temperatura è mantenuta ad un valore costante di 50°C grazie ad un regolatore manuale ed una termocoppia immersa nella sospensione. Il pH è mantenuto ad un valore costante pari a 5.00 ± 0.10 grazie ad un “autotitrator” che preleva HCl 1M da una bottiglia e lo immette nella sospensione. Su un display si legge il volume di HCl aggiunto e il pH.
all’aggiunta di HCl 1N si ha una fase transitoria iniziale in cui il pH decresce fino a portarsi a pH costante pari a 5 in pochi minuti. La durata complessiva della prova è di circa 45 minuti.
I dati relativi al volume di HCl aggiunto nel tempo vengono acquisiti in automatico dallo strumento e resi disponibili al termine di ogni prova.
Al fine di simulare la dissoluzione del calcare in condizioni simili a quelle di un assorbitore commerciale, è stata impiegata una matrice sintetica contenente calcio, cloruri e solfati. Il criterio seguito è stato quello di ottenere al termine della titolazione, nell’ipotesi che il calcare si sciolga completamente, una soluzione con la seguente composizione:
[Ca2+]=3000 ppm, [Cl-]=5000 ppm e [SO
42-]=3000 ppm [4.1]. .
Dato che le prove sono state eseguite impiegando 0,5 g di campione secco in 100 ml di
soluzione, questa ultima è stata preparata sciogliendo 3,66 g di CaCl2·2H2O e 4,44 g di
Na2SO4 in 1L di acqua distillata.
4.2 Risultati e considerazioni
Poiché il rapporto stechiometrico tra CaCO3 e HCl è 1 a 2 (vedi reazione (4.1)), si può
affermare che per neutralizzare 1 mmole di CaCO3 servono 2 mmoli di HCl, pertanto, se si
impiegano 0,5 g di CaCO3, per la completa neutralizzazione serviranno 10 mL di HCl 1N.
L’andamento della conversione nel tempo viene determinato direttamente dalla quantità di HCl aggiunto. La conversione si ottiene dal rapporto tra il volume di HCl aggiunto e quello richiesto per la completa dissoluzione dei carbonati contenuti nel campione. Il contenuto di
carbonati disponibile per la dissoluzione corrisponde al CaCO3 equivalente del campione
(vedi Tab. 3.3).
0 5 10 15 20 25 30 35 40 45 50 0 10 20 30 40 50 60 70 80 90 100 calcare RS1 AG SP2 RFR TN2 conv er si one % tempo (min)
Figura 4.2 Curve di titolazione a pH=5 e T=50°C, normalizzate sul contenuto di CaCO3 equivalente.
Riguardo alla reattività, ENEL prevede dei valori di accettabilità [4.1], al di sotto dei quali il calcare risulta non idoneo per la desolforazione ad umido dei fumi di combustione. Secondo tali criteri il calcare deve avere una conversione:
> 20 % dopo 8 minuti; > 30 % dopo 13 minuti; > 40 % dopo 17 minuti; > 60 % dopo 30 minuti.
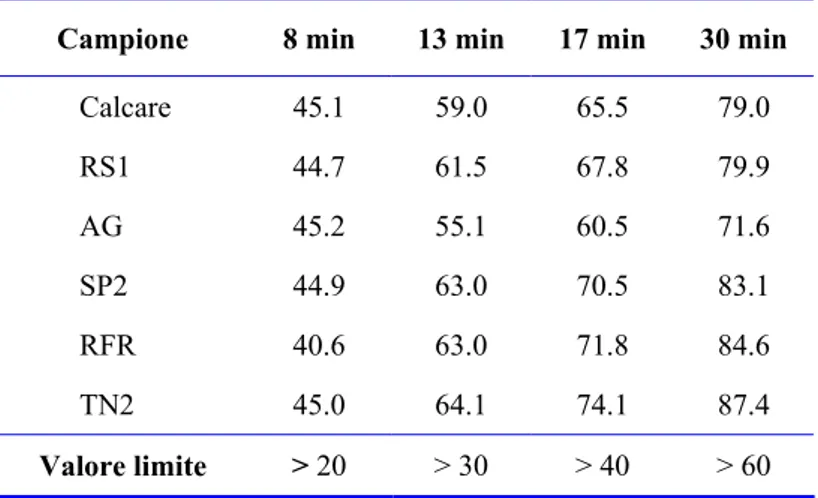
Tabella 4.1. Percentuale di dissoluzione a pH=5 e aT = 50°C a vari tempi.
Campione 8 min 13 min 17 min 30 min
Calcare 45.1 59.0 65.5 79.0 RS1 44.7 61.5 67.8 79.9 AG 45.2 55.1 60.5 71.6 SP2 44.9 63.0 70.5 83.1 RFR 40.6 63.0 71.8 84.6 TN2 45.0 64.1 74.1 87.4 Valore limite > 20 > 30 > 40 > 60
Confrontando le reattività dei vari campioni, si nota che essi hanno velocità di dissoluzione diverse all’inizio della prova, imputabili alla frazione più fine che si dissolve per prima, dopodiché le curve di titolazione assumono pendenze paragonabili.
Il campione di marmettola bianca TN2, con granulometria più fine e con contenuto di Mg trascurabile, risulta il campione più reattivo. I campioni di marmettola colorata mostrano reattività intermedie tra il TN2 e il calcare, ad eccezione del campione AG che mostra la minore reattività. Ciò può essere imputato al suo maggiore contenuto di Mg (1.4 %); infatti il magnesio, sotto forma di dolomite, tende a ridurre la reattività del materiale calcareo come riportato in molti altri studi [4.2- 4.4].
Il calcare commerciale pur avendo una granulometria leggermente più grossolana (Fig. 3.8) mostra una reattività paragonabile a quella delle marmettole colorate.
Riferimenti bibliografici Cap. 4
4.1 ENEL Direzione Costruzioni, Unità Laboratorio Centrale – “Metodologie analitiche per la caratterizzazione del processo calcare – gesso e del trattamento spurghi della desolforazione” Rapporto di Prova 9C00080RMPPC120, Piacenza 1994.
4.2 Hosten, C., Gulsun, M., 2004. Reactivity of limestone from different sources in
Turkey. Minerals Engineering 17, 97-99.
4.3 Stumpf, Th., Roeder, A., Hennicke, H.W., 1984b. The reaction behaviour of
carbonate stone dusts in acid solutions, more particularly of sulphurous acid. Part II: Important influence parameters, and measurement on various carbonate stone dusts for flue gas desulphurisation. ZKG 37 (9), 455-462 (in German).
4.4 Ukawa, N., Takashina, T., Shinoda, N., Shimizu, T., 1993. Effects of particle size
distribution on limestone dissolution in wet FGD process applications. Environ.