1. INTRODUZIONE
1.1 Approcci per la formulazione di un vaccino
contro il virus dell’immunodeficienza umana:
problematiche connesse alla risposta
immunitaria
Dall’identificazione del virus dell’immunodeficienza umana (HIV) ad oggi sono stati compiuti innumerevoli sforzi per la messa a punto di un vaccino, purtroppo senza aver raggiunto risultati soddisfacenti. Nonostante la disponibilità di modelli animali sui quali condurre gli esperimenti e la messa in campo d’ingenti risorse scientifiche ed economiche, ad oggi non è ancora possibile prevedere quando sarà disponibile un vaccino contro HIV. Le difficoltà che s’incontrano sono molteplici e dovute alle caratteristiche biologiche di HIV e dei lentivirus più in generale ed alla complessità dell’interazione che s’instaura fra ospite ed agente infettivo. I lentivirus come HIV ed il virus dell’immunodeficienza felina (FIV) colpiscono direttamente le cellule del sistema immunitario e sono inoltre estremamente variabili, due fattori che nel loro insieme rendono molto difficile la preparazione di un vaccino. L’infezione è inizialmente fronteggiata da una risposta immunitaria, sia cellulo-mediata sia umorale, che tuttavia non è in grado di eliminare completamente il virus. Tra i diversi effettori, i linfociti T citotossici (CTL) sono molto efficaci per combattere le infezioni virali (Zinkernagel 2000); pertanto, sarebbe auspicabile individuare un immunogeno capace di stimolare i CTL che, una volta attivati, potrebbero riconoscere ed eliminare il virus e le cellule infettate. In HIV la risposta CTL è responsabile della riduzione della viremia nelle fasi iniziali di infezione e nel mantenimento asintomatico nelle fasi di
latenza, mentre un declino dell’attività CTL è associato con la progressione dell’AIDS (Rinaldo et al., 1995).
Non è ancora ben chiaro tuttavia se l’induzione di un’immunità cellulo-mediata sia sufficiente per garantire una buona copertura per lunghi periodi. Inoltre, un problema da non sottovalutare nell’eventuale induzione della sola risposta CTL, è rappresentato dal rapido adattamento del virus. HIV, ad esempio, ha sviluppato dei meccanismi che riducono l’espressione delle proteine del complesso maggiore di istocompatibilità (MHC), esposte sulla superficie delle cellule infette ed essenziali per il riconoscimento da parte dei CTL degli antigeni virali presentati dall’MHC stesso. Lo stesso HIV inoltre ha elaborato un meccanismo con il quale varia questi antigeni rendendo quindi inutili i linfociti CTL prodotti in seguito al riconoscimento dell’antigene parentale (Ali et al., 2005).
La risposta umorale è anch’essa importante per contenere la replicazione virale. Gli anticorpi ad attività neutralizzante generalmente impediscono l’entrata del virione nelle cellule target grazie al loro legame col corecettore virale (Parren et al., 1999; Sharma et al., 2006), altri creano aggregati delle particelle virali circolanti o possono indurre alterazioni strutturali ed attivazione del complemento con conseguente lisi della cellula infetta (Deeks et al., 2006).
Tra i vari meccanismi, uno dei più efficaci è l’azione neutralizzante anticorpo-mediata. Sfortunatamente una delle maggiori difficoltà risiede nell’individuare immunogeni contenenti epitopi che inducano anticorpi neutralizzanti efficaci e che non siano soggetti a mutazioni a seguito della selezione operata dal sistema immune. La glicoproteina virale codificata dal gene env (Env) dei lentivirus è in grado di stimolare sia la produzione di CTL sia di anticorpi neutralizzanti ed è quindi una componente vaccinale essenziale (Flynn et al., 1996; Hosie et al., 1996; Ye et al., 2004). Env è tuttavia particolarmente soggetta a deriva genetica per la continua pressione del sistema immune a cui è sottoposta. Ciò si traduce in un’elevata eterogeneità genetica che
rappresenta uno dei principali ostacoli per l’induzione di attività neutralizzante e citotossica ampia e duratura. Il solo impiego di Env come immunogeno vaccinale si è dimostrato infatti poco efficace. Quindi l’approccio più prudente nello sviluppare un vaccino anti-AIDS è senz’altro rappresentato dalla contemporanea stimolazione di più componenti del sistema immunitario mediante immunizzazione verso molteplici antigeni virali.
1.2 Esperimenti di vaccinazione
Numerosi e vari sono stati i tentativi, condotti seguendo diverse linee di ricerca, per lo sviluppo di vaccini che conferiscano una buona protezione contro le infezioni da lentivirus. I modelli animali hanno permesso di saggiare l’efficacia di vari vaccini sviluppati attraverso metodiche tradizionali ed innovative. Come descritto più diffusamente in seguito, FIV ed il suo ospite naturale, il gatto, rappresentano un buon modello con il quale sperimentare nuovi approcci vaccinali (Bendinelli et al., 1995). In questo modello, vaccini costituiti da virus intero inattivato o cellule infette inattivate hanno fornito elevata protezione dalla sfida con ceppi omologhi primari o leggermente eterologhi purché attenuati per propagazione in vitro (Hosie et al., 2000; Karlas et al., 1999; Matteucci et al., 1997). E’ stato dimostrato tuttavia che tale approccio induce una risposta limitata nel tempo (Matteucci et
al., 2000).
Sono stati anche sperimentati vaccini a subunità, costituiti generalmente dalla proteina Env o da peptidi contenenti epitopi neutralizzanti (Flynn et al., 1997). Benché sia stato dimostrato che questo tipo di vaccini inducano significativi livelli anticorpali, anche ad attività neutralizzante, non hanno conferito protezioni significative ed in alcuni casi la risposta immune ha facilitato l’attecchimento del ceppo
sfidante (Osterhaus et al., 1996). I deludenti risultati ottenuti con quest’approccio fanno intendere che la sola proteina Env non è di per sé sufficiente o, probabilmente, che è necessario utilizzarla nella sua conformazione nativa.
Analogamente i vaccini a DNA, pur se considerati sicuri ed in grado di presentare gli immunogeni non hanno fornito risposte soddisfacenti quando utilizzati per vaccinazione contro i lentivirus.
Un importante obbiettivo da raggiungere nella ricerca di vaccini anti-lentivirali è rappresentato dall’induzione di un ampio spettro di protezione. Dalle numerose prove effettuate si ritiene che un vaccino attenuato replicazione-competente possa fornire una risposta più robusta e duratura e probabilmente a largo spettro. I vaccini replicazione-competenti se non propriamente attenuati possono revertire a fenotipo virulento causando una malattia simile al virus selvaggio. E’ essenziale quindi apportare delle modificazioni tali da rendere il ceppo vaccinale stabilmente attenuato. L’ingegneria genetica costituisce un valido sistema. Rimuovendo geni importanti per patogenicità e non necessari alla replicazione virale è possibile produrre vaccini vivi stabilmente attenuati. Un esempio in tal senso è dato dagli studi condotti presso i nostri laboratori. Cloni molecolari di FIV mutati nel gene accessorio ORF-A hanno mostrato in vivo ed in vitro ridotta patogenicità in quanto incapaci di infettare i linfociti, pur mantenendo la capacità di infettare i macrofagi (Pistello et al., 2002). Quando sperimentati come vaccini, hanno conferito protezione parziale dalla sfida con un ceppo FIV virulento, suggerendo che il carico virale o la risposta immune indotta non sono ottimali per fornire una protezione efficace (Pistello et al., 2005). Su questo aspetto si è incentrato il lavoro della tesi nella quale si è provveduto ad aumentare il contenuto antigenico del vaccino, intervenendo su alcuni aspetti della replicazione di FIV al fine di ottenere virioni e cellule infette con un contenuto antigenico più elevato.
1.3 Brevi cenni su morfologia ed organizzazione
genomica di FIV
FIV appartiene al genere Lentivirus (famiglia Retroviridae) di cui fanno parte anche HIV e SIV.
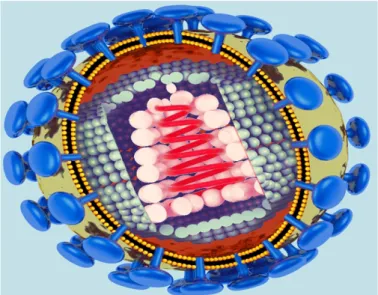
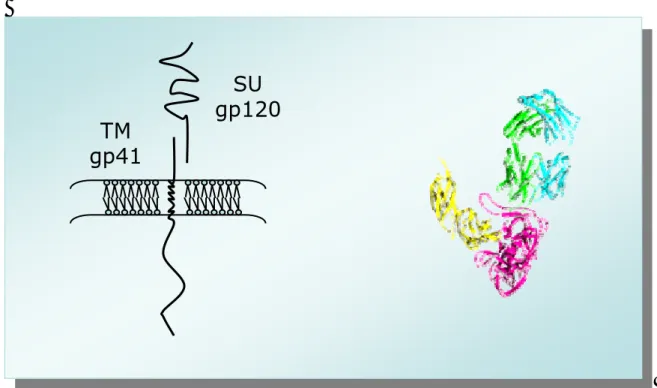
Al microscopio elettronico il virione maturo (Fig 1.1) si mostra come una particella sferica con diametro compreso tra 100-125 nm, in cui si riconosce una regione centrale elettrondensa, detta core, circondata esternamente dall’envelope, costituito da lipidi e proteine derivate dalla membrana citoplasmatica delle cellule da cui il virus fuoriesce per gemmazione e dalle glicoproteine Env presenti, nella particella virale matura, in due distinte proteine, la prima esposta nella parte esterna della particella (glicoproteina di superficie, SU), la seconda intersecata nel doppio strato lipidico, con una porzione esterna che ancora la SU ed una porzione citoplasmatica. Questa glicoproteina è chiamata transmembrana (TM). SU è altamente glicosilata ed ha un peso molecolare di 95 kD; TM invece ha un peso molecolare di 40 kD.
La proteina di matrice (MA) ha un peso molecolare di circa 14.5 kD, è internamente associata all’envelope e la sua funzione sembra essere quella di guidare la corretta incorporazione delle proteine di superficie nel virione maturo. La parte centrale del core è costituita dal capside proteico a simmetria icosaedrica che racchiude il genoma virale, costituito da due filamenti identici di RNA con polarità positiva. Strettamente associate al genoma si trovano la proteina nucleocapsidica di 10 KD (NC) e le proteine enzimatiche trascrittasi inversa (RT), integrasi (IN), proteasi (PR) e dUTPasi (DU).
Il DNA provirale di FIV (Fig. 1.2), come gli altri retrovirus, presenta due sequenze uguali ripetute alle estremità 5’ e 3’, denominate long terminal
repeat (LTR) in cui si ritrovano sequenze regolatorie non codificanti,
cellulari ed essenziali per aumentare la frequenza d’inizio trascrizione (Bigornia et al., 2001).
Tra le due LTR vi sono tre cornici di lettura principali (ORF) dette gag,
pol ed env, affiancate da altre piccole ORF che codificano per proteine
regolatorie denominate rev, vif e ORF-A (Talbott et al., 1989; Tomonaga e Mikami, 1996).
Il gene gag codifica per le proteine del capside, p24 (CA), NC e MA. Le tre proteine sono inizialmente prodotte come un’unica poliproteina precursore di 55 kD, che viene tagliata successivamente dalla proteasi nelle fasi finali del ciclo replicativo.
Il gene pol è parzialmente sovrapposto a gag e codifica per RT, IN, PR e DU. Queste proteine sono ottenute da un precursore Gag-Pol prodotto in quantità prossime al 10% rispetto a Gag ed a seguito del mancato riconoscimento del segnale di stop presente alla fine di gag.
Il gene env codifica per TM (altrimenti detta gp41) e SU (gp95), entrambe coinvolte nelle prime fasi dell’infezione virale. Tali proteine sono originate in seguito a tagli operati su una poliproteina precursore di 130 kD.
La SU ha la funzione di legare il recettore ed il corecettore cellulare e rappresenta il principale determinante del tropismo di FIV (Vahlenkamp
et al., 1997; Lerner ed Elder, 2000). Essa, inoltre, contiene epitopi che
inducono la formazione di anticorpi neutralizzanti e di altri effettori della risposta immune dell’ospite. La TM ha invece attività fusogena che si esplica non appena si verifica l’interazione tra i recettori, consentendo l’ingresso del virus nella cellula ospite. A seguito dell’attività fusogena, l’effetto citopatico caratteristico delle colture cellulari infettate da lentivirus è la formazione di sincizi, cellule giganti multinucleate ottenute a seguito della fusione delle membrane citoplasmatiche tra cellule adiacenti (Garg et al., 2004).
Oltre ai geni strutturali, FIV possiede atri geni le cui proteine svolgono un’importante, a volte essenziale, funzione regolatoria. Il gene vif, localizzato fra i geni pol ed env, è altamente conservato tra i vari isolati
di FIV (Maki et al., 1992) e codifica per una proteina di 29 kD, la cui funzione è essenziale per l’infettività del virione sia in vitro sia in vivo (Lockridge et al., 1999).
Il gene rev è composto da due esoni, il primo dei quali si estende dall’estremità 3’ del gene pol fino ad env, mentre il secondo è localizzato all’estremità 3’ del gene env (Phillips et al., 1992). La proteina Rev è prodotta da eventi multipli di splicing e possiede un dominio in grado di interagire con un elemento Rev responsivo (RRE), situato all’estremità del gene env e parzialmente sovrapposto alla 3’ LTR. Rev sembra svolgere un ruolo importante nel coordinare e modulare la replicazione virale, veicolando al citoplasma gli mRNA non processati e quelli singolarmente processati.
Il gene ORF-A è situato tra vif ed il primo esone di rev. La proteina prodotta ha debole azione transattivante delle LTR (Bigornia et al., 2001) ed è importante per la formazione del virione maturo e per la sua infettività (Gemeniano et al., 2003). Sembra inoltre avere localizzazione nucleare ed essere in grado di indurre arresto del ciclo cellulare in G2,
funzioni simili a quelle riscontrate per Vpr di HIV (Gemeniano et al., 2004).
Figura 1.1: Schema virione maturo di FIV. (Tratto da www.med-ars.it
©2003, modificata)
LTR
gag
pol
rev
vif
Orf A
env
RRELTR
1.4 Replicazione virale
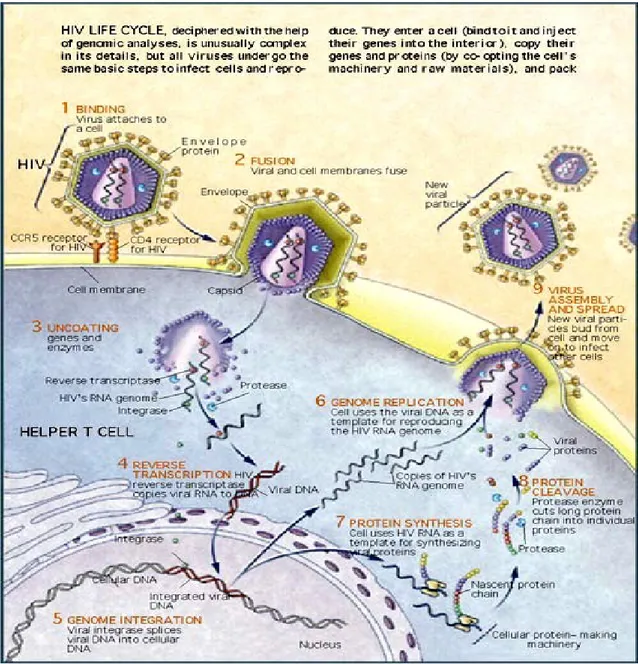
Il ciclo replicativo di FIV è simile a quello degli altri lentivirus (Fig 1.3). Il virus aderisce alla cellula ospite grazie all’attacco di SU al recettore CD134 ed al corecettore CXCR4 presenti sulla superficie cellulare (Shimojima et al., 2004; De Parseval et al., 2004). Il virus penetra poi nella cellula attraverso la fusione, mediata da TM, del suo rivestimento lipoproteico con la membrana della cellula ospite. Questo processo consente il rilascio del capside nel citoplasma, dove viene parzialmente disgregato per liberare l’RNA virale, che viene retrotrascritto ad opera della RT in una molecola di DNA a doppio filamento che viene trasportato all’interno del nucleo e si integra nel genoma cellulare ad opera della IN. A questo punto il DNA virale si trova in forma di provirus ed è espresso dalla RNA polimerasi II cellulare che trascrive numerose copie di RNA, che nel citoplasma verranno in parte tradotte in proteine virali ed in parte costituiranno il genoma della progenie virale.
Nell’assemblaggio del virione sono coinvolte tre proteine: la NC, che interagisce col genoma virale permettendone l’introduzione nel virione nascente; CA, che andrà a formare il capside virale e MA, che interagisce con la membrana cellulare per favorire l’incorporazione delle proteine SU e TM. Il virione a questo punto gemma dalla cellula, acquisendo l’envelope e dopo una fase di maturazione in cui avvengono una serie di tagli proteolitici ad opera dalla proteasi ed il consolidamento della particella stessa, il virione acquisisce la sua forma definitiva e diventa infettante.
Fig 1.3 Ciclo replicativo di HIV
1.5 Endocitosi della glicoproteina Env
Nelle ultime fasi del ciclo replicativo le proteine Env dei lentivirus sono esposte sulla superficie delle cellule infette e poi, come avviene fisiologicamente per gran parte delle proteine cellulari, sono convogliate in vescicole citoplasmatiche e degradate. Questo meccanismo, chiamato endocitosi, riduce di conseguenza il contenuto di Env sull’envelope della particella virale.
Anche se non è necessaria per la gemmazione virale, che può avvenire comunque in sua assenza, Env sembra determinare il luogo in cui avviene l’assemblaggio ed il rilascio della progenie virale dalla membrana plasmatica. E’ stato dimostrato che, sia in HIV che in SIV, l’aminoacido tirosina presente nella sequenza segnale di endocitosi è importante per il rilascio polarizzato della progenie virale da una specifica regione della membrana plasmatica nei linfociti, favorendo così la trasmissione cellula-cellula del virus. Inoltre, il domino citoplasmatico della TM dei lentivirus, piuttosto lungo rispetto a quello di altri Retrovirus, fa ipotizzare che questa sequenza possa avere altre funzioni specifiche (Deschambeault et al., 1999).
Dal punto di vista virale, l’endocitosi potrebbe rappresentare un adattamento protettivo del virus stesso per sfuggire agli anticorpi, essendo la glicoproteina Env capace di stimolare una forte reazione immunitaria. E’ stato dimostrato, sia in SIV che in HIV, che tale processo di endocitosi avviene grazie al riconoscimento di alcuni residui aminoacidici della regione intracitoplasmatica della TM da parte di complessi proteici clatrina-dipendenti come AP1 e AP2, anche se ad oggi non se ne conosce in dettaglio il meccanismo (Boge et al., 1998; Berlioz-Torrent et al., 1999). In particolare, una regione ricca di leucine presente nel domino citoplasmatico della TM di HIV sembra interagire con il fattore cellulare AP1 e rivelarsi essenziale per determinare la localizzazione subcellulare di Env (Wyss et al., 2001).
In HIV è stato notato che mutazioni nel dominio citoplasmatico della TM causano variazioni delle capacità infettive, dipendentemente dal tipo di cellula infettata. Ad esempio, virus con delezioni nel dominio citoplasmatico della gp41 sono risultati incapaci di crescere in cellule linfocitarie H9, ma capaci di infettare cellule linfocitarie M8166. Questi virioni mutanti ottenuti in seguito a trasfezione in cellule H9 hanno mostrato una ridotta incorporazione di Env sulla propria superficie, mentre quelli generati dalla trasfezione in cellule M8166 hanno mantenuto livelli di Env simili a quelli espressi dal wild-type. Questi risultati sottolineano la grande importanza del dominio citoplasmatico della TM nel determinare l’infettività virale (Akari et al., 2000).
Recenti studi condotti su cloni SIV mutati nel dominio citoplasmatico della TM, hanno confermato l’incremento del contenuto di Env sulla superficie delle cellule infettate e sui virioni stessi. Questo poteva far pensare che, se da un lato veniva aumentata l’immunogenicità, dall’altro potevano aumentare anche le capacità infettive. Nello stesso studio è stato tuttavia accertato che ad un sensibile incremento di Env sui virioni non corrispondeva un aumento dell’infettività rispetto ai wild-type (Yuste et al., 2004). Questo risultato implica quindi che una riduzione del processo endocitotico si potrebbe tradurre in una maggiore risposta immunologica anti-Env senza, dall’altro lato, aumentare l’infettività del virus.
Esperimenti di vaccinazione con virus SIV attenuati e difettivi per endocitosi di Env hanno dimostrato che il siero di animali vaccinati presentava elevati titoli di anticorpi anti-Env (Fultz et al., 2001). In studi con HIV condotti sulle scimmie è stato osservato che la risposta immune indotta da cloni HIV mutagenizzati nel dominio endocitotico era di maggiore intensità rispetto a quella del wild-type (Ye et al., 2004). Studi condotti attraverso mutanti casuali sulla sequenza del gene env hanno evidenziato che il processo di endocitosi viene seriamente compromesso quando viene modificata una tirosina presente nel dominio citoplasmatico e conservata in SIV, in HIV e in FIV (Hosie et al.,
2005; Bowers et al., 2000; Sauter et al., 1996). In generale nei lentivirus la tirosina è sempre preceduta da una glicina che sembra avere un ruolo importante nell’interazione con le proteine della cellula ospite (Boge et al., 1998). In esperimenti di vaccinazione condotti su scimmie usando due cloni SIV, uno con delezione di glicina e tirosina nel dominio citoplasmatico della TM e l’altro con sostituzione della tirosina con l’isoleucina, è stato dimostrato che entrambi i cloni presentavano una ridotta infettività in vivo, dovuta probabilmente ad una riduzione della capacità replicativa e ad un aumento della suscettibilità del virus all’attacco degli anticorpi (Fultz et al., 2001).