Capitolo 4
Modellazione matematica della meningite
In questo capitolo ci proponiamo di analizzare alcuni dei modelli di meningite attualmente disponibili in letteratura, evidenziandone gli obiettivi, gli strumenti matematici utilizzati, le ipotesi su cui si basano, la struttura compartimentale, i risultati fondamentali e le criticità nelle assunzioni o nella determinazione delle conclusioni.
La letteratura modellistica sull'argomento è in generale molto recente (il primo modello, degli studiosi finlandesi Ranta, Makela ed Arias, risale al 1999), e si focalizza principalmente sulla spiegazione di alcuni aspetti della meningite anziché sul controllo delle malattie; a questa regola fanno eccezione uno studio del 2004 dello stesso gruppo scandinavo, relativo alla predizione di scoppi epidemici in ambienti chiusi, ed uno del 2005 di Trotter, Gay ed Edmunds, concentrato sull'effetto della campagna di vaccinazione sul serogruppo C condotta nel Regno Unito a partire dalla fine del 1999.
I modelli di cui ci occupiamo in questo capitolo sono quelli apparsi più significativi sia dal punto di vista della plausibilità delle ipotesi, sia dal punto di vista dei risultati ottenuti, e l'ordine di trattazione è quello cronologico. Una tabella riepilogativa riguardante i modelli non trattati in questo capitolo si trova in fondo al capitolo.
4.1 Il modello di Coen, Cartwright e Stuart (2000)
Obiettivo
L'obiettivo principale di questo modello [1] è quello di testare statisticamente alcune ipotesi sui processi alla base delle infezioni meningococciche, effettuando in tal modo una selezione dei modelli ammissibili; viene posta particolare attenzione alla valutazione dell'influenza del carriage di Neisseria lactamica su quello di Neisseria meningitidis.
Strumenti
La modellizzazione sia di N. lactamica (Lactamic Carriage, LC) che di N. meningitidis (Meningococcal Carriage, MC) si basa su modelli compartimentali di base, strutturati per età; si
utilizzano poi i dati a disposizione per determinare la durata media del carriage per entrambe le infezioni e l'andamento della forza di infezione rispetto all'età, mediante un fitting sui dati reali avente come parametro di ottimizzazione la minima devianza binomiale. Infine si determina, sulla base della distribuzione dei carrier MC, la frazione di essi che svilupperà l'infezione.
Ipotesi
Si trascura la variabilità antigenica e genetica del meningococco, e dunque si considera un
solo ceppo (niente competizione tra serogruppi o lineage differenti) con parametri tempo-costanti e dipendenti al più dalla fascia di età;
la popolazione umana è suddivisa per fasce di età ed in classi di Suscettibili, Infetti o Rimossi,
al loro interno omogenee;
la malattia si sviluppa in una frazione dei portatori sani di meningococco, Φ (a), che viene
detta tasso di acquisizione per carrier della malattia ed è dipendente dalla fascia di età;
il tasso di guarigione (inverso della durata media del carriage) r1 è supposto indipendente
dall'età;
la forma delle forze di infezione λ per il LC e il MC è scelta tra poche famiglie di funzioni
determinate a priori sulla base di altre malattie a trasmissione aerea (morbillo, orecchioni e rosolia);
si assume che i dati a disposizione siano stati raccolti con metodiche la cui sensibilità è
prossima al 100%;
il modello è valido solo per contesti epidemiologici caratterizzati da una predominanza del
pattern endemico, in quanto i dati utilizzati sono stati tutti rilevati in questo ambito;
la dipendenza del carriage dal manifestarsi della malattia e la dipendenza dal tempo dei tassi
di attacco della malattia nelle varie fasce di età sono considerate trascurabili: ciò permette di determinare la strutturazione per età dei pattern del carriage e della malattia;
l'uscita dal comparto dei portatori sani della frazione di individui attaccati da malattie
menigococciche non ne influenza significativamente la prevalenza del carriage, visto che il loro numero è estremamente esiguo, e non viene dunque tenuta in considerazione.
Struttura dei modelli preliminari
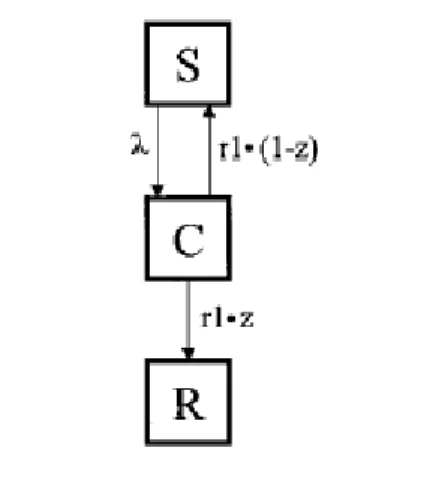
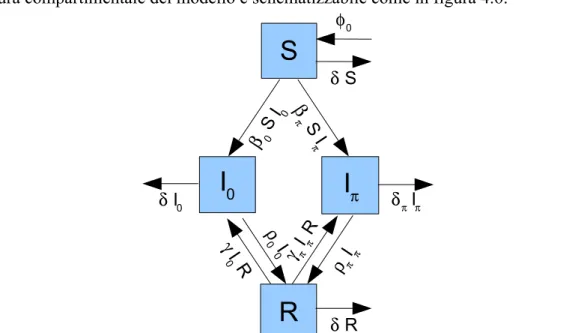
Inizialmente Coen et al. ipotizzano che i processi di LC e di MC siano entrambi riconducibili, uno indipendentemente dall'altro, a un modello di tipo SIR-SIS combinato, una modifica del modello SIR in cui una frazione 1 – z degli infetti guariti torna nel comparto dei suscettibili, mentre la frazione residua z finisce nel comparto dei rimossi, secondo lo schema di figura 4.1. Il comparto C (dei portatori sani, o carriers) corrisponde al comparto degli infetti nei modelli classici; per z = 1, il modello si riconduce a un sistema SIR, per z = 0 si tratta di un modello SIS, mentre per tutti i valori intermedi di z si ha un modello ibrido SIS-SIR.
Le equazioni di questo modello sono analoghe a quelle descritte nel capitolo 1: d S a
da =C a r11−z−S aa d Ca
da =S a a−C a r1 d R a
Stima dei parametri
Dai dati di carriage asintomatico di N. meningitidis su 158 bambini, raccolti nel '75-'76 in Belgio e forniti da un articolo di De Wals (1983) è stata stimata la durata media di tale carriage attraverso un modello a decadimento esponenziale, ottenendo un valore di 13,3 mesi, corrispondente a un r1 pari a 0,904 / persona / anno. Tale valore viene poi utilizzato per tutte le età, nonostante sia ricavato da
dati solamente su bambini; tuttavia il sistema immunitario in età infantile potrebbe funzionare diversamente da quello di un adulto, senza contare che nell'adulto ci possono essere delle difese anticorpali pregresse al carriage che ridurrebbero la durata media; in effetti, la durata media usata nella maggior parte degli altri studi è di circa 9 mesi. La durata del carriage di Neisseria
lactamica è stata stimata in modo più rudimentale in 3,5 mesi sulla base dei dati di Gold et al. (1978) su bambini in USA e di Blakeborough et al. (1982) su una comunità in Nigeria comprendente tutte le fasce di età.
Il modello è stato adattato al variare di z e dei parametri della forma generale della forza di infezione λ(a) (v. più avanti) a dati reali di LC e MC presi dallo studio di Gold et al. e da un articolo di Cartwright et al. (1987) contenente dati provenienti dalla Gran Bretagna in periodo epidemico; l'utilizzo di questo set di dati combinato aumenta l'affidabilità statistica dei risultati, ed è considerato legittimo dagli autori in quanto i due contesti presentano una situazione socio-economica ed una storia epidemiologica molto simile, nonostante siano presi in continenti diversi, a quasi un decennio di distanza gli uni dagli altri e in condizioni diverse rispetto alla presenza dell'epidemia. Riguardo a quest'ultima obiezione, è noto in effetti dalla letteratura che il periodo epidemico nei paesi ricchi non influenza i valori di carriage, come si può notare anche dall'accordo tra i dati raccolti in Norvegia da Caugant (1994) in periodo non epidemico con quelli di Cartwright.
Il metodo per valutare la qualità dell'adattamento si basa sulla minima devianza binomiale L, definita come: L=2
∑
a=1 a= n{
RalnqRa aNa Na− Raln[
Na− Ra Na1−qa]
}
dove:Ra è il numero di portatori sani nella classe di età a, qa è la prevalenza prevista dal modello,
Na è il numero totale di persone in quella classe.
Per l'interpolazione dei dati di LC, si è utilizzata per la forza di infezione una forma generale
analoga a quella proposta da Farrington per morbillo, orecchioni e rosolia, consistente in una curva inizialmente crescente, culminante in un massimo, e poi decrescente fino a un valore asintotico non nullo; con questa ipotesi il modello migliore risulta essere il modello combinato con z = 0.13 (quindi molto vicino ad un modello SIS); se la forma generale di Farrington viene modificata leggermente con un fattore correttivo ∆(a), in modo da decadere ulteriormente per le età più alte, il modello più adatto risulta quello SIS, che per semplicità viene preferito nel proseguio dell'articolo.
Farringtona=[ a−e−a / ]
a=1 e− a
L a=Farrington a
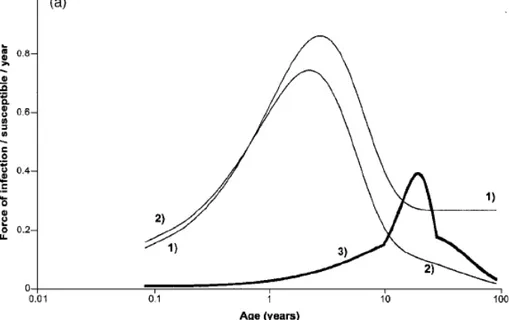
Il picco nella forza di infezione risulta essere in questo caso corrispondente ai 2,4 anni.
Per il carriage del meningococco, invece, nessun modello semplice è risultato adeguato a riprodurre i dati disponibili; solo il modello SIS fornisce previsioni corrette per la maggior parte delle fasce di età, ma la prevalenza prevista risulta troppo alta per l'età infantile; questa discordanza si può ridurre in modo accurato introducendo arbitrariamente una immunità temporanea al contagio attorno ai due anni di età.
Modello definitivo
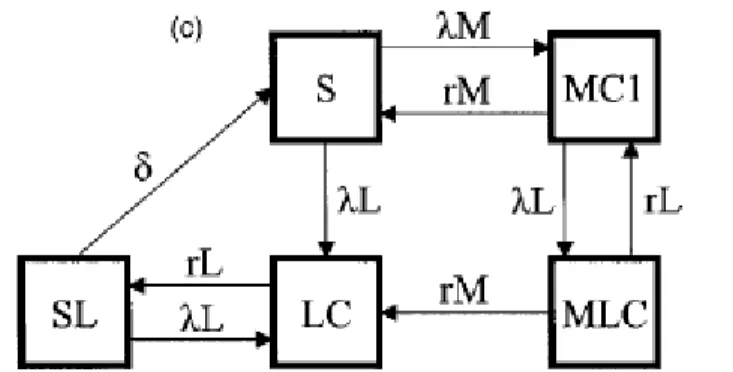
Viste le ipotesi della letteratura sull'immunità da N. lactamica, Coen et al. hanno utilizzato, anzichè un'immunità temporanea arbitraria, un modello in cui il carriage di N. lactamica inibisce il carriage del meningococco per tutta la durata dell'infezione e per un tempo medio di 1/δ = 4,65 anni dopo il termine del carriage, secondo lo schema di figura 4.2. E' prevista, anche se ci si aspetta che sia rara, la presenza contemporanea di LC e MC, attraverso il comparto MLC. Nel seguito
dell'articolo, tuttavia, questo comparto viene totalmente ignorato, probabilmente perchè complica le cose senza fornire dei vantaggi interpretativi.
In questo modello il LC e il MC sono singolarmente sistemi SIS, seppur legati dall'inibizione nel carriage meningococcico da parte dell'LC; l'interpolazione dei dati mostra un buon accordo, ma solo se si utilizza come forza di infezione λM per il MC una funzione di Farrington modificata attraverso la sovrapposizione, a livello della fascia di età 18-22, di una gaussiana che giustifichi il picco nel carriage meningococcico corrispondente proprio a queste coorti:
Gau a= e −a−2
22
M a=MAX [Farringtona , Gaua ] .
Per quanto riguarda il processo di sviluppo della malattia, i dati sono presi da Jones e Mallard (1993), che hanno raccolto dati relativi alla popolazione britannica sotto i 25 anni divisi per età; a
questi sono stati aggiunti due ulteriori valori, forniti dal Public Health Laboratory Service inglese, corrispondenti alle fasce di età 20-25 anni e >25; la modellazione segue l'ipotesi suggerita da Goldschneider (1969) che la malattia avvenga in una frazione dei portatori dipendentemente da alcune condizioni come lo stato pregresso di immunità. Tale frazione Φ(a) è supposta da Coen et al. dipendente dalla sola età dell'individuo, con un andamento scelto tra quattro possibili funzioni con andamento decrescente per valori alti di a. Quella che è risultata migliore per l'interpolazione dei dati è stata una funzione composta dal valore massimo tra tre esponenziali decrescenti con valori diversi dei parametri.
In figura 4.3 e 4.4 sono mostrate le forme delle due FOI e del tasso di attacco per carrier della malattia.
Il grafico di Φ(a) non è coerente con l'espressione matematica della funzione data nell'articolo: essendo tutti esponenziali decrescenti, non potrebbe mostrare l'andamento crescente che si rileva
per a > 0,1, nè potrebbe mostrare un valore asintotico diverso da zero per a → 100. Probabilmente c'è un errore nell'articolo, visto che non si capisce che senso abbia mettere due parametri
Figura 4.4: Tasso di attacco per carrier di N. meningitidis.
Figura 4. 3: Forze di infezione di N. lactamica (2) e di N. meningitidis (3); la (1) rappresenta la funzione di Farrington non modificata.
moltiplicativi davanti a Φ3(a).
Risultati
Il risultato più interessante del modello è senza dubbio la conferma del ruolo inibitorio del MC da parte del LC, senza il quale non è possibile giustificare causalmente la distribuzione dei dati sul MC. Il modello individua una protezione continuativa del LC nei confronti dei meningococchi per circa 4,65 anni successivi alla colonizzazione da N. lactamica, che può essere interpretato, come già proposto da Goldschneider et al. (1969), con lo sviluppo di anticorpi crossprotettivi che agiscono su epitopi antigenici comuni ai due Neisseria.
Il modello indica anche come poco probabile l'insorgenza di immunità temporanea in seguito a carriage asintomatico di MC, in quanto i risultati del fitting favoriscono per questo fenomeno il modello SIS contro tutti gli altri. Tuttavia questa conclusione sembra meno stringente, dato che non
viene considerata l'eterogeneità dei ceppi batterici: l'immunità potrebbe essere selettiva rispetto al ceppo e quindi non essere rilevata da un modello che tiene conto di tutti i ceppi in un unico comparto.
Le forze di infezione λL e λM trovate con l'interpolazione dei dati corrispondono sostanzialmente a quelle individuate per altre vie da Gold et al. e da Olsen et al. (1991); per quanto riguarda la gaussiana correttiva che è stata introdotta nella λM, essa potrebbe tenere conto da un lato della progressiva perdita di immunità da Neisseria lactamica dovuta alla riduzione della corrispondente forza di infezione, e dall'altro dell'assunzione nella fascia di età interessata di comportamenti sociali maggiormente a rischio (come ad es. l'assembramento in dormitori studenteschi e militari). In ogni caso, il picco da essa introdotto nella λM giustifica il corrispondente picco di portatori sani nei dati reali, e di conseguenza il picco di casi di meningite per questa fascia di età, che compensa e supera la contemporanea riduzione del tasso di acquisizione per carrier.
La determinazione dell'andamento del tasso di acquisizione per carrier, Φ(a), è analoga a quanto calcolato da Kaiser et al. su dati statunitensi relativi ai casi secondari, sebbene questo studio sia
condotto su una tipologia abbastanza rara, oltre che molto particolare, di pazienti e non si conosce la significatività dei dati.
Attraverso gli andamenti delle λ e di Φ(a) si può giustificare il picco di casi di notifica che si registra intorno ai 6 mesi come una compensazione tra la crescente frazione di portatori sani e la riduzione del tasso di attacco. Secondo Coen et al., l'aumento dei casi da 1 a 6 mesi potrebbe essere dovuto alla riduzione dell'immunità materna che induce l'aumento del carriage, tuttavia è noto che
tale immunità agisce principalmente sul tasso di attacco per carrier, che in effetti cresce nei primi mesi secondo il grafico mostrato. Inoltre, la diminuzione monotona della forza d'infezione dopo il
picco della gaussiana attorno ai 19 anni dovrebbe rendere giustizia dell'immunità acquisita progressivamente dalla popolazione in seguito al carriage ripetuto dei meningococchi; il modello
non mostra comunque il meccanismo secondo cui si sviluppa l'immunità.
Punti critici
• La spiegazione della sola strutturazione per età del carriage e della malattia può avere valore
per la comprensione dell'epidemiologia della meningite, ma è poco interessante dal punto di vista della predizione dell'andamento dinamico e della valutazione delle strategie di controllo.
• Dal punto di vista della capacità descrittiva di questo modello, il non tenere conto della
variabilità antigenica del meningococco e della competizione tra i diversi ceppi è una semplificazione forse troppo riduttiva, sia per spiegare i meccanismi della malattia in periodo endemico, sia al fine di spiegare l'insorgenza di epidemie, possibilità totalmente
pregiudicata in questo modello, come esplicitamente ammettono gli autori.
• Un altro aspetto rilevante che il modello trascura è il meccanismo di acquisizione
dell'immunità in seguito al carriage asintomatico del meningococco o di N. lactamica; tale approssimazione rende la determinazione del tasso di acquisizione un esercizio matematico di valore puramente descrittivo, che non fornisce spiegazioni di alcun tipo sulle cause che producono il suo andamento peculiare.
4.2 Il modello di Stollenwerk, Maiden e Jansen (2002)
ObiettivoQuesto studio [2] si ripropone di mostrare come una condizione necessaria per l'occorrenza di outbreak epidemici di meningite è l'eterogeneità della popolazione batterica, ed in particolare della patogenicità dei ceppi in gioco.
Strumenti
Si utilizzano ancora modelli base alla Anderson&May, stavolta di tipo SIRS, con degli elementi stocastici tempodiscreti che rendono necessario trattare il modello con strumenti non deterministici (catene di Markov, Master Equation, random walk; le trattazioni sono riportate in dettaglio in un articolo del 2002). I parametri sono scelti in modo arbitrario per determinare dei risultati qualitativi, ma alcuni indicatori derivanti dal modello vengono messi a confronto con dati reali di meningite e sepsi meningococcica e di infezioni da pneumococco e Hib in Gran Bretagna.
Ipotesi
La popolazione meningococcica viene distinta in un ceppo totalmente innocuo e in un ceppo
patogenico, sulla base della seguente osservazione: sebbene la virulenza media di Nm sia molto bassa rispetto ad altre patologie, esiste un certo numero di strain la cui virulenza è alcuni ordini di grandezza maggiore; per aversi una media bassa è dunque necessario che esista una compensazione da parte di meningococchi ancora meno virulenti della media, e dunque praticamente inoffensivi;
si utilizza un modello SIR modificato per tenere conto della competizione tra il ceppo
benigno e quello patogeno;
lo strain invasivo ha la stessa trasmissibilità β di quello non invasivo, in quanto è noto (da
Anderson e May) che un trade-off positivo tra virulenza e trasmissibilità condurrebbe alla selezione evoluzionistica di un patogeno con virulenza intermedia;
quando la malattia si sviluppa, lo fa contemporaneamente all'acquisizione del batterio e
dunque non si passa tramite lo stato di portatore sano;
si può essere infettati da un solo strain alla volta, non essendo noti casi di meningite dovuta
a due strain diversi, e dal momento che anche durante il carriage la coinfezione è piuttosto rara; d'altra parte, inserire la possibilità di co- o sovra-infezione complica la trattabilità del modello ma non sembra modificare la sostanza dei risultati;
chi si ammala non trasmette l'infezione, perchè si ipotizza che venga rimosso da contatti
sociali fintanto che perdura la sua condizione;
poichè la scala dei tempi di interesse è quella di un focolaio epidemico, la popolazione viene
assunta costante; inoltre essa è omogenea e senza strutturazione per età;
il numero di contatti medio per individuo è considerato costante;
si introduce una possibilità di variazione µ del ceppo innocuo per modellare l'introduzione
di ceppi patogenici in seguito a variazione genica.
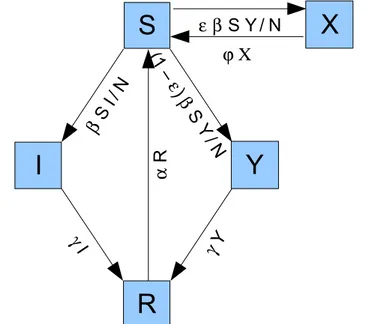
Struttura
questo si aggiunge un comparto Y corrispondente ai portatori sani del ceppo virulento, a cui si accede da S per infezione da Y, e da cui si accede ad R in seguito a guarigione dal carriage. Inoltre, si ha un comparto X degli individui che hanno sviluppato forme sindromiche: una frazione ε dei nuovi infetti del gruppo Y finisce da S direttamente nel comparto X, mentre la restante frazione 1- ε finisce in Y; i malati possono guarire o morire con un tasso identico ϕ: gli eventi sono indistinguibili per il modello ed hanno entrambi l'effetto di spostare un individuo da X a S; questo
passaggio è forse poco rigoroso rispetto alla verosimiglianza epidemiologica, in quanto la guarigione dovrebbe indurre una qualche forma di immunità; tuttavia ci si aspetta che la frazione di individui in questo comparto sia talmente irrisoria da non influenzare sostanzialmente l'andamento generale.
Il ceppo innocuo può subire con probabilità µ una variazione genetica che introduce un ceppo virulento: in questo caso uno dei nuovi infetti del ceppo benigno finisce nel comparto Y anzichè in I; di conseguenza, solo una frazione 1 – µ dei nuovi carrier del ceppo innocuo finisce effettivamente in I. La casualità legata alla formazione di un ceppo virulento in modo episodico per mutazione di un ceppo non patogeno rende il modello stocastico e tempo-discreto.
Lo schema generale che riassume i trasferimenti tra i vari comparti è rappresentato nella figura 4.5.
Risultati
Il modello viene rappresentato matematicamente come un processo markoviano in cui vengono definite le probabilità di tutte le possibili transizioni da un comparto all'altro, e su cui si eseguono delle simulazioni numeriche.
Per mostrare la necessità di una diversità nella virulenza della popolazione meningococcica, gli autori pongono inizialmente a zero il numero di infetti con il ceppo innocuo e mantengono basso il valore di ε, in modo da simulare la situazione di virulenza omogenea; in questo caso le simulazioni mostrano la presenza di casi sporadici di malattia, ma non dei raggruppamenti di casi (cluster) riconoscibili come scoppi epidemici; anche provando a tenere conto, attraverso una variazione sinusoidale di β, della variabilità stagionale della trasmissibilità, come suggerisce Cartwright per giustificare l'insorgenza di outbreak, il modello risulta inadeguato.
Quando invece si tiene in considerazione il modello nella sua completezza ( I ,≠0 , ε alcuni
Figura 4.5: Schema compartimentale del modello di Stollenwerk et al.
I
Y
R
S
X
β S I / N (1 – ε) β S Y / N γ Y γ I α R ε β S Y / N ϕ Χordini di grandezza più grande rispetto al caso precedente), si rilevano scoppi epidemici con il tipico andamento di ascesa, picco e ridiscesa, in corrispondenza di ciascun nuovo ingresso di ceppo patogenico nella popolazione, sia in condizioni di parametri costanti, che con β variabile sinusoidalmente.
Considerando una situazione in cui il ceppo benigno è dominante (pochissimi casi di infezione da ceppo invasivo rispetto al totale dei carrier) ed all'equilibrio, il modello SIRS può essere rappresentato con una descrizione deterministica classica basata su equazioni differenziali; è allora immediato ricavare il valore di equilibrio per la frazione dei suscettibili, che risulta pari a
Seq=N
, ed il numero di rimpiazzamento per lo strain virulento,
S 1−
N ; sostituendo il
valore di Seq si ottiene che il numero di rimpiazzamento all'equilibrio è 1 – ε: pertanto, il numero di rimpiazzamento di uno strain virulento risulta essere sempre minore di uno, e cioè uno strain virulento con stessa trasmissibilità di quello non virulento sarebbe destinato inesorabilmente a scomparire.
Sotto la stessa ipotesi di piccole variazioni rispetto alla situazione di dominanza del batterio non patogenico, Stollenwerk et al. impostano un processo random walk che tiene conto soltanto del sottosistema relativo al ceppo virulento, ed in particolare dei fenomeni di acquisizione del carriage o della malattia e di guarigione, le cui probabilità per unità di tempo però non dipendono dalla
trasmissibilità, contrariamente a quanto ci si aspetterebbe; in questo modo si ottiene la
distribuzione di probabilità che avvenga un outbreak con X casi, che è una funzione parametrica solo rispetto ad ε; per valori via via più piccoli di ε, tale distribuzione decade sempre meno rapidamente rispetto a X. In particolare, sebbene la media sia sempre pari ad un caso per outbreak, la varianza della distribuzione risulta 2 / ε, e cioè minore è la patogenicità del ceppo, maggiore è la probabilità di generare scoppi epidemici di una certa importanza.
Dalla stessa analisi si può stimare anche il rapporto varianza/media, che risulta sempre minore di
12
; nelle infezioni con popolazione eterogenea la distribuzione dei casi dovrebbe essere
poissoniana (in quanto ogni nuovo infetto è equiprobabilmente passibile di sviluppo di malattia), e dunque il rapporto varianza/media risulterebbe unitario. Calcolando tale rapporto per i casi di notifica di meningite e sepsi di diverse regioni del Regno Unito, si ottengono valori molto lontani dall'unità, prossimi a 50 per la sepsi e 13 per la meningite, mentre per le meningiti da Hib e da pneumococco risulta di poche unità (rispettivamente circa 5 e 7): ciò confermerebbe l'importanza che assume l'eterogeneità della popolazione batterica nell'epidemiologia della Neisseria meningitidis rispetto agli altri batteri responsabili di meningiti; il valore maggiormente elevato per la sepsi confermerebbe l'ipotesi di Whalen (1995), secondo cui i batteri iperinvasivi sono più inclini a manifestarsi sotto questa forma.
Sempre dall'analisi del random walk sul sottosistema del ceppo infettivo, risulta che il tasso di comparsa di nuovi strain è proporzionale alla dimensione della popolazione N.
Un'ipotesi alternativa alla necessità dell'eterogeneità nella virulenza batterica per spiegare la formazione di epidemie è la coinfezione con altri agenti patogeni, suggerita da molti studiosi, ma al momento confermata solo per l'influenza A. Stollenwerk et al. respingono questa ipotesi, argomentando che questo meccanismo dovrebbe agire in modo del tutto analogo anche su Hib e pneumococco, e non riuscirebbe dunque a spiegare la grande diversità tra questi patogeni, riscontrata dai dati sperimentali sul rapporto media/varianza. L'alto valore di questo parametro nei dati britannici relativi al meningococco farebbe inoltre pensare alla presenza nella popolazione di molti più outbreak di quanto sia riconosciuto; i focolai che vengono identificati sarebbero cioé soltanto una piccola parte di quelli totali, i più facili da rilevare perchè ad esempio aventi luogo in comunità chiuse come scuole e dormitori.
risultati del loro modello. Se si accetta la conclusione che gli outbreak più rilevanti sono causati dai ceppi con virulenze minori, la chemoprofilassi risulta una strategia di controllo poco efficace, in quanto in questi casi le percentuali di carriage del batterio sarebbero particolarmente alte, e la sua applicazione non sarebbe praticabile anche se fosse focalizzata sul solo batterio invasivo. Al contrario, poichè essa non protegge da una successiva riacquisizione del batterio, potrebbe creare delle sacche di suscettibili e favorire le condizioni per uno scoppio epidemico particolarmente ampio.
La vaccinazione può invece risultare efficace perchè riduce i suscettibili a disposizione e dunque, diminuendo il numero di rimpiazzamento, anche la durata del focolaio epidemico. Anche quando non sono disponibili dei vaccini a vasto raggio d'azione, come avviene per il serogruppo B a causa della scarsa immunogenicità della sua capsula, è pensabile ricorrere alla ricerca di vaccini che agiscano su antigeni specifici del lineage responsabile dell'epidemia in corso, allo scopo di limitarne gli effetti (come avvenuto per un'epidemia causata dal gruppo B in Nuova Zelanda).
Punti critici
• Uno dei risultati più significativi a cui perviene il modello è la conclusione che il numero di
rimpiazzamento per i ceppi altamente invasivi è certamente minore di uno; ciò condannerebbe tali ceppi all'estinzione entro un tempo relativamente breve a partire dalla loro comparsa. Tuttavia, il fatto che esistano da decenni ceppi altamente virulenti smentisce questo risultato, che è legato principalmente a due ipotesi, entrambe abbastanza dubbie: (1) viene utilizzato lo stesso β per il ceppo innocuo e per quello virulento, mentre Taha et al.
(citati tra i riferimenti bibliografici da Stollenwerk et al.) suggeriscono chiaramente che il ceppo può sopravvivere soltanto se l'aumentata patogenicità è un fattore collaterale dell'aumentata trasmissibilità; questo aspetto è centrale nel modello successivo di Ancel Meyers et al., e viene affrontato in termini di capacità di re-infezione del comparto dei rimossi. Nel caso in cui si utilizzi un βY diverso da β per il batterio virulento, il numero di rimpiazzamento calcolato nell'articolo andrebbe moltiplicato per un fattore Y
e
potrebbe dunque risultare facilmente maggiore di uno, dato che normalmente ε è molto piccolo;
(2) l'ε che viene sottratto al valore unitario è dovuto all'assunzione che i malati non possano trasmettere l'infezione ad altri; tuttavia ciò contrasta con l'esistenza riscontrata di casi secondari e con gli alti tassi di carriage tra i contatti stretti di un paziente.
• Non ci sono informazioni dettagliate sui dati utilizzati: in particolare l'alto rapporto
varianza/media potrebbe derivare da un'eterogeneità consistente nei serogruppi che hanno causato le malattie meningococciche a cui si riferivano i dati; inoltre non è noto se se esistesse un'epidemia di influenza A contemporanea alla raccolta dei dati di meningococco, Hib e pneumococco, per valutare l'argomento secondo cui gli autori rifiutano la tesi della co-infezione.
• Una scelta non giustificata da Stollenwerk et al. è l'utilizzo del compartimento dei rimossi,
introdotto forse per tenere in considerazione l'effetto inibitorio che Neisseria lactamica, e potenzialmente anche altri meningococchi benigni, hanno sul carriage per un certo tempo. Tuttavia, la possibilità di immunità temporanea e con gli stessi parametri anche per i carrier del ceppo invasivo rimane arbitraria, anche in considerazione del suggerimento da parte di Coen et al. di utilizzare un sistema SIS.
• La modellazione di un solo ceppo patogeno trascura le conseguenze della competizione tra
ceppi virulenti con caratteristiche diverse e rende quindi difficile valutare la significatività delle elaborazioni statistiche sui dati reali, in quanto questi hanno a che fare certamente con
ceppi molto diversi tra loro. Esiste comunque anche un modello con più strain, pubblicato dagli stessi autori in un altro articolo.
• La costanza della popolazione viene giustificata con la considerazione che i fenomeni di
interesse hanno a che fare con periodi epidemici; tuttavia nei risultati delle simulazioni la scala dei tempi, e di conseguenza le durate dei focolai risultano dell'ordine di decenni.
• In generale i parametri sono senza unità di misura e scelti in modo piuttosto arbitrario; se da
un lato l'obiettivo del modello è comprensibilmente quello di mostrare un fenomeno solo da un punto di vista qualitativo, d'altra parte questa arbitrarietà potrebbe confondere i risultati. Sarebbe opportuno svolgere delle simulazioni con diversi ordini di grandezza dei parametri e valutare se gli stessi fenomeni permangono o derivano da casi particolari degli spazi dei parametri.
• L'impostazione nel random walk di probabilità indipendenti da β per le transizioni allo stato
di carrier o di malato non è spiegata ragionevolmente, e lascia dubbi seri sulla validità dei risultati.
• La scelta di una popolazione totalmente omogenea per numero di contatti è piuttosto poco
realistica, vista l'importanza che possono avere i contatti domestici ed altre situazioni di assembramento; tuttavia, per un modello di base potrebbe non risultare un elemento determinante. Un discorso analogo vale per la strutturazione per età, che plausibilmente avrebbe complicato l'interpretazione del modello rispetto all'obiettivo dichiarato.
4.3 I modelli di Ancel-Meyers, Levin, Richardson e Stojiljkovic
(2003)
Obiettivo e strumenti
I modelli proposti da questo gruppo di studiosi si concentrano sugli effetti che l'evoluzione genetica all'interno di una popolazione meningococcica hanno sull'epidemiologia della malattia.
In entrambi gli articoli [3, 4] vengono presentati due tipi di modelli: quelli ecologici, relativi alla dinamica della popolazione meningococcica all'interno di un singolo ospite umano (“within-host”), e quelli epidemiologici, relativi alla diffusione del batterio nella popolazione umana (“between-host”).
Per i modelli within-host l'obiettivo è mostrare come il phase shifting, il meccanismo principale di variabilità genetica e di adattamento del batterio in un nuovo organismo, è il responsabile comune delle variazioni di molti dei parametri che caratterizzano i modelli epidemiologici classici.
Con i modelli between-host si vuole valutare che effetti abbia la presenza e la trasmissione in una popolazione umana di un ceppo batterico ad alto phase shifting (ceppo mutante) attraverso le variazioni dei parametri da esso influenzati, quali la trasmissibilità, la virulenza e la durata del carriage. Questo secondo tipo di modelli è quello su cui ci soffermeremo principalmente, in quanto di maggiore rilevanza dal punto di vista dell'epidemiologia.
Insieme, i due tipi di modelli mirano ad evidenziare che il phase shifting è un fattore importante nello sviluppo della competizione tra ceppi, e andrebbe tenuto presente come determinante epidemiologico in luogo dei singoli parametri di virulenza o trasmissibilità.
Risultati del modello within-host
La rapidità di phase-switching causa la produzione di un alto numero di cellule con fenotipo mutato rispetto alla cellula madre, e dunque produce delle popolazioni batteriche che si adattano più facilmente ad ambienti diversi rispetto a quello di provenienza della cellula madre. Un ceppo batterico mutante sarà pertanto più capace di infettare un individuo che aveva già sviluppato delle difese immunitarie contro antigeni meningococcici; allo stesso modo, avrà maggiori possibilità di sopravvivere e proliferare in un ambiente diverso dall'epitelio nasofaringeo, come il sangue o il liquido cerebrospinale, e quindi di provocare la malattia. Dall'altra parte, la caratteristica di presentare molti errori di replicazione fa sì che molte delle cellule figlie siano inadatte a vivere in un ambiente simile a quello in cui la cellula madre risulta ben adattata, e di conseguenza riduce la densità batterica relativa a questi ceppi; questo ritarda la risposta immunitaria dell'ospite, prolungando in ultima analisi la durata media del carriage, e riduce la capacità di trasmissione verso nuovi ospiti aventi una situazione immunologica analoga.
E' dunque l'eterogeneità immunologica della popolazione ospite a favorire l'aumento del numero di batteri ad alto phase-switching, come sembra confermato dai dati relativi alle pandemie, in cui l'eterogeneità della popolazione è massima, ed in cui si osserva un progressivo aumento dei batteri ipermutanti.
Il modello ecologico within-host, simulando alcuni semplici meccanismi legati al phase shifting, conferma tutte queste considerazioni qualitative, e mostra anche come un certo numero di batteri possa in qualche caso penetrare nel sangue, pur senza riuscire a causare sepsi a causa della loro inettitudine all'ambiente e della rimozione da parte della risposta immunitaria; tale meccanismo
mostra in modo chiaro come può nascere l'immunità umorale al meningococco anche da quello che apparentemente è solo un carriage e che in realtà costituisce una meningococcemia occulta.
4.3.1 Modello between host semplice
I modelli epidemiologici between-host si focalizzano in particolare sul bilancio tra l'aumento nella virulenza e nella capacità di re-infezione di individui rimossi, trascurando le differenze nella durata del carriage e ipotizzando solo in alcuni casi differenze di trasmissibilità.
Strumenti
Il più semplice [3] tra quelli proposti è un modello SIR con competizione tra due diversi ceppi, molto simile a quello utilizzato da Stollenwerk et al. Vengono calcolati i valori di equilibrio e a partire da questi si valutano le condizioni di invasione del ceppo mutante; ove ciò non è possibile, si effettuano simulazioni qualitative con parametri scelti in modo arbitrario.
Ipotesi
la popolazione è divisa in classi di S, I ed R omogenee e senza struttura di età;
sono ammessi per i due ceppi valori diversi di trasmissibilità β, del tasso di reinfezione γ e
del tasso di guarigione ρ; di fatto, nella maggior parte delle analisi svolte nello studio, β e ρ
sono considerati uguali;
si considera un tasso di mortalità δ per i compartimenti S ed R, ed uno per ciascuno dei due
comparti di infetti in conseguenza della capacità di sviluppare la malattia (il numero di casi di malattia non viene esplicitamente considerato dal modello); in particolare il tasso di mortalità associato al ceppo mutante (δπ) è maggiore di quello del ceppo wildtype (δ0) in
virtù degli effetti del phase-shifting;
il tasso di nascita è uguale a quello di mortalità totale (popolazione costante), ed i nuovi nati
rientrano tutti nel comparto S;
non sono ammesse co-infezioni tra i due ceppi.
Struttura
La struttura compartimentale del modello è schematizzabile come in figura 4.6:
Figura 4.6: Schema compartimentale del modello between-host semplice di Ancel Meyers et al.
R
S
β S0 I0βπ S I π ρ Iππ γ Iππ R ρ 0 I 0 γ I 0 R φ0 δ SI
π δ π IπI
0 δ I0 δ RSi tratta di un modello SIR del tutto simile a quello di Stollenwerk, con la differenza che la distinzione tra i due gruppi di infetti non è tra un ceppo virulento ed uno innocuo ma tra un ceppo mutante ed uno a basso phase shifting, detto anche wildtype; è prevista la possibilità di re-infezione dei rimossi (anzichè la perdita di immunità proposta da Stollenwerk), e non si tiene traccia del numero dei malati.
Nei modelli successivi la struttura del modello semplice viene in un caso replicata per tener conto dell'eterogeneità della popolazione umana rispetto alla condizione immunologica, nell'altro modificata per valutare gli effetti dell'eterogeneità immunologica che sorge in seguito all'infezione.
Risultati
Sulla base delle prevalenze delle possibili configurazioni di equilibrio, vengono studiate le condizioni per cui si può avere invasione del ceppo; gli equilibri possibili sono:
a) popolazione interamente suscettibile (R, I0 e Iπ = 0);
b) il ceppo wildtype è endemico e non ci sono carrier del ceppo mutante;
c) il ceppo mutante è endemico e non ci sono carrier del ceppo wildtype ( (b) e (c) sono dunque equilibri di competizione esclusiva);
d) entrambe le malattie coesistono in un equilibrio endemico.
Nel caso (a) è sufficiente calcolare i valori del numero di rimpiazzamento R0 e Rπ, che risultano,
rispettivamente: R0= N0 00 e R= N ,
e come di consueto questi due valori devono essere maggiori di uno per potersi avere un'epidemia dell'uno o dell'altro ceppo.
Nel caso (b) la condizione di invasione è data dal coefficiente Q0, che rappresenta il potenziale infettivo di un singolo infetto inserito nel comparto del ceppo mutante, e dal cui valore dipende la posibilità di scatenare un'epidemia di ceppo mutante nel contesto dell'equilibrio del ceppo wildtype (quando Q0 < 1). Risulta: Q0=N00 N000 =R0GG0 RG0G , essendo Gi= i ii .
Ancel Meyers et al. considerano gli effetti contrastanti dell'aumento della virulenza e della maggiore capacità di reinfezione sul valore di Q0, considerando tutti gli altri parametri uguali tra i due ceppi. Sostituendo i rispettivi parametri alle grandezze Ri e Gi nella condizione Q0 < 1, risulta in definitiva:
0
1 0−N
,
essendo ∆ la differenza di letalità (che è legata alla differenza di virulenza) tra il ceppo mutante e quello non mutante. In sostanza, per poter generare un'epidemia all'interno dell'equilibrio endemico
del ceppo wildtype, il ceppo mutante deve avere un tasso di re-infezione dei rimossi che sia tanto più grande quanto maggiore è la differenza di letalità.
Considerazioni inverse con calcoli del tutto analoghi, si possono fare nel contesto dell'equilibrio (c), in quanto Qπ = 1 / Q0.
Se si vuole tenere in considerazione le condizioni socio-demografiche di affollamento, la scarsità di igiene e le condizioni ambientali avverse, si può supporre che esse aumentino le trasmissibilità β,
γ0 e γπ in modo equivalente, moltiplicandole per un fattore k; la condizione di invasione diventa
allora
0
1
0− N k
,e cioè le condizioni ambientali renderebbero ancora più grande il fattore moltiplicativo di γ0, e dunque più improbabile l'invasione. Nell'articolo la conclusione che se ne trae è proprio quella
opposta, ma si tratta di un errore. La conclusione di questa modellazione forse troppo semplificativa non è coerente con quanto è noto dalla letteratura, in quanto le condizioni ambientali avverse sembrano facilitare lo scoppio di epidemie in un contesto endemico. In effetti nell'articolo successivo non viene fatta menzione dell'influenza degli aspetti socio-ambientali.
Il numero di infetti del ceppo mutante all'equilibrio indicato con (d) può essere calcolato analiticamente e rappresentato su un grafico 3D avente in ascissa i valori di γπe di ∆. Tale grafico
mostra che la prevalenza di equilibrio ha andamento strettamente crescente rispetto a γπ, e
strettamente decrescente rispetto a ∆. L'equilibrio (d) si regge sulla “divisione di risorse” tra il ceppo wildtype, che infetta preferenzialmente i suscettibili, e il ceppo mutante, che infetta preferenzialmente i rimossi grazie alla sua capacità di adattarsi alle loro difese immunitarie.
Dopo lo studio sui valori di equilibrio Ancel Meyers et al. eseguono delle simulazioni qualitative (in cui il tasso di natalità viene assunto costante, anzichè pari al tasso di mortalità totale), stimando i parametri sulla base dei dati di carriage e malattia di un'epidemia di meningite in Gambia nel 1982 e 1983. L'andamento qualitativo a partire dall'equilibrio (a) evidenzia che gli infetti del ceppo mutante si diffondono più tardi rispetto ai wildtype (in quanto viene inserito un infetto solo nel ceppo wildtype ed è necessario attendere che si sia formato un numero sufficiente di rimossi in seguito al carriage di questo ceppo); con il progredire dell'epidemia, tuttavia, la frazione di infetti da ceppo mutante aumenta fino a coprire circa 1/3 del totale dei casi. Questo aumento nel tempo della frazione di ceppi altamente mutanti, rilevato in numerosi studi su epidemie, sarebbe da imputare alla capacità di re-infezione del mutante, che permette al batterio di sfruttare maggiormente il serbatoio dei rimossi.
Punti critici
• Le scelte effettuate nella modellazione non sono state giustificate in modo rigoroso, e nel
complesso sembra che ci sia poca cura per la verosimiglianza epidemiologica del modello.
• Il fitting dei dati relativi all'epidemia in Gambia viene effettuato in modo poco trasparente e
apparentemente arbitrario, inoltre l'utilizzo del tasso di mortalità senza il comparto dei malati rende necessaria un'approssimazione in più per adeguare i dati di notifica (solitamente forniti come casi clinici, oltre che come casi letali).
• L'eccessiva semplicità del modello e l'arbitrarietà nella stima dei parametri non permette di
tenere conto contemporaneamente di tutte le possibili variabilità dei parametri legate al phase shifting, che costituiscono probabilmente la novità più interessante del modello.
• Le previsioni del modello sono di carattere strettamente qualitativo, e forniscono
informazioni utili a livello di comprensione generale dei meccanismi di trasmissione, ma non dal punto di vista del controllo.
4.3.2 Modello between host suddiviso per classi immunologiche
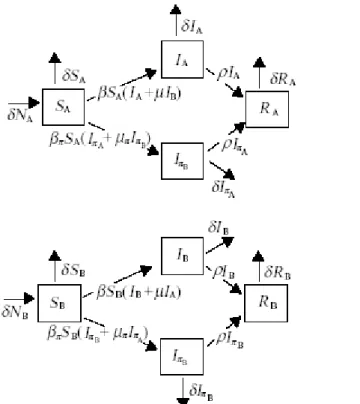
Il modello precedente viene complicato introducendo una distinzione di origine genetica nelle caratteristiche immunologiche della popolazione ospite, che viene dunque suddivisa in due gruppi distinti.
Ipotesi
La popolazione è suddivisa in due classi immunologiche A e B omogenee al loro interno, in
cui gli individui rimangono dalla nascita alla morte;
esiste una probabilità di contagio da un infetto di una classe a un suscettibile dell'altra,
proporzionale alla capacità di adattamento del batterio ad ambienti nuovi, e dunque al phase shifting;
non è ammessa in questo caso la reinfezione dei rimossi;
il tasso di mortalità δ è considerato identico per tutti i comparti ed anche per i due ceppi, e la
popolazione è mantenuta costante da un tasso di natalità pari a δ N;
il ceppo mutante può avere una trasmissibilità βπ minore di quella β0 del wildtype.
Struttura
La struttura del modello, mostrata in figura 4.7, rimane analoga a quella precedente, con una suddivisione per classi analoga a quella effettuata da Hethcote (vedi capitolo 1).
Risultati
Anche in questo caso vengono studiati gli equilibri possibili e ci si sofferma in particolare sulle condizioni di invasione di due di essi: (a) il caso di una popolazione totalmente suscettibile (SA + SB
Figura 4.7: Schema compartimentale del modello between host diviso per classi immunologiche di Ancel Meyers et al.
= 1) e (b) quello in cui il ceppo wildtype è endemico, ma non ci sono infetti con il ceppo mutante. Nel caso dell'equilibrio (a) si calcola il numero di rimpiazzamento relativo al ceppo mutante per entrambi i gruppi, ottenendo:
R A= SASB
e
R B= SBSA
.
Il risultato interessante è che, anche se in ciascuna delle due popolazioni prese separatamente non ci fossero le condizioni per un invasione, la capacità di reclutare suscettibili all'interno dell'altro gruppo immunologico permette di aumentare il numero di rimpiazzamento fino eventualmente alla soglia che scatena l'epidemia; ciò è tanto più probabile quanto maggiore è il phase switching del batterio.
Per quanto riguarda l'equilibrio (b), sempre nell'ipotesi che il tasso di mortalità sia uguale per tutti, si ottiene invece:
R A=1 010
,
e ciò vuol dire che per potersi avere invasione, il maggiore tasso di adattamento legato al phase shifting deve compensare sufficientemente la concomitante riduzione nel tasso di trasmissibilità che avviene a causa dello stesso determinante.
Viene poi eseguita una simulazione a partire dall'equilibrio (a), in cui si valuta l'introduzione simultanea di batteri wildtype e mutanti nella sola popolazione A; risulta che, anche considerando lo svantaggio nella minore trasmissibilità, il ceppo mutante riesce a invadere più rapidamente la classe B grazie alla sua migliore adattabilità.
4.3.3 Modello between host con eterogeneità immunologica indotta
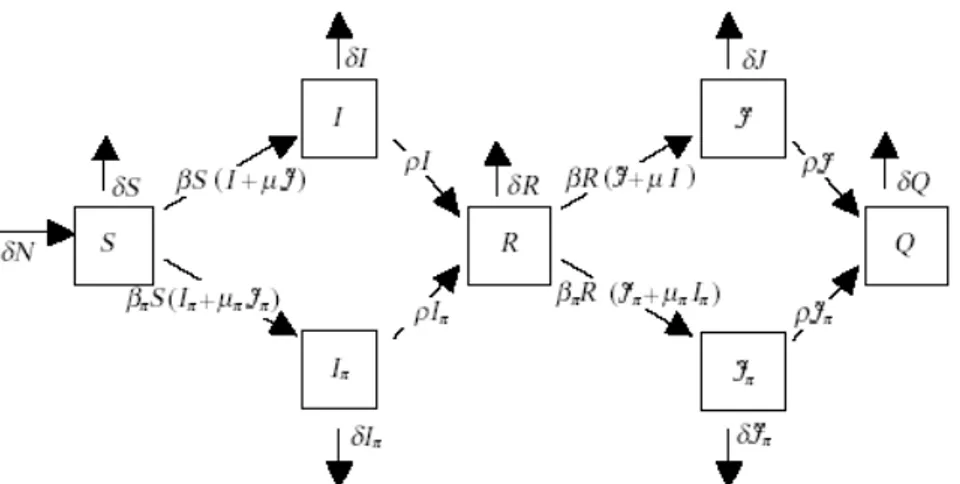
Ipotesi In questo caso la differenziazione immunologica non è intrinseca nella popolazione, ma è
generata dall'infezione mediante due possibili ceppi antigenicamente differenti, che producono i comparti di infetti I e J; ciascun ceppo può presentare una variante ad alto phase shifting;
anche in questo caso, esiste la possibilità di trasmissione dallo strain J allo strain I o
viceversa, dipendente dalla capacità del ceppo di adattarsi attraverso una maggiore o minore velocità di phase shifting (considerate uguali per I e per J).
Struttura
La struttura è composta da due modelli SIR con competizione tra wildtype e mutante, disposti in cascata, con il comparto R dei rimossi dall'infezione con il ceppo I che fa da comparto dei suscettibili per il ceppo J, come indicato in figura 4.8.
Risultati
Nel caso di un equilibrio del tipo (a) (sia gli I che i J nulli), la condizione per l'invasione del ceppo I mutante, non essendoci rimossi all'equilibrio, è il classico R=S
, che si avrebbe per un
modello SIR semplice; in questo caso la capacità di mutazione non ha rilevanza.
Nel caso di un equilibrio dominato dalle varianti wildtype dei ceppi I e J, il valore del numero di rimpiazzamento dipende ancora una volta dalla compensazione tra la minore trasmissibilità e la maggiore capacità di adattarsi ad individui che sarebbero suscettibili solo all'altro ceppo antigenico:
R= .
Rispetto al modello precedente, in questo caso hanno rilevanza i valori di ρ e δ nel determinare il risultato di tale equilibrio.
Ancel Meyers et al. mostrano inoltre che risultati del tutto analoghi si ottengono simulando numericamente la competizione tra i non mutanti e i mutanti nell'invasione della popolazione, nelle stesse condizioni del modello precedente.
Punti critici
• Quest'ultimo modello appare poco utile rispetto alle conclusioni che se ne traggono, e
considera una sorta di 'propedeuticità' tra le infezioni che appare piuttosto irrealistica.
• I risultati dei due modelli con eterogeneità non aggiungono molto al modello semplice, ma
dimostrano in modo formale come l'eterogeneità immunologica della popolazione possa favorire il diffondersi di ceppi altamente mutanti rispetto a quelli di tipo wildtype.
4.4 Il modello di Trotter, Gay e Edmunds (2005)
Tra i modelli di meningite fin qui sviluppati, quello di Trotter, Gay e Edmunds [5] è probabilmente quello che più si sofferma sull'efficacia delle strategie di controllo, essendo stato orientato esplicitamente alla valutazione della campagna di vaccinazione contro il serogruppo C decisa dal Ministero della Sanità del Regno Unito alla fine del 2003. Esso si avvale di un modello estremamente complesso, con alcune centinaia di compartimenti, risolto per via numerica con del software dedicato e parametrizzato sulla base dei dati derivanti dal follow-up della strategia.
Obiettivo
Come detto, il modello ha lo scopo di valutare gli effetti, sia diretti che indiretti (relativi cioé all'immunità di gruppo) della campagna di vaccinazione contro il serogruppo C condotta in Inghilterra e Galles dal novembre 1999 al dicembre 2000; inoltre, esso si propone di effettuare delle predizioni di lungo termine sugli effetti di sei diverse strategie di vaccinazione che si sarebbero potute implementare (tra cui quella effettivamente realizzata), e di tre eventuali modifiche future alla vaccinazione di routine.
Strumenti
Il modello, un SIS con strutturazione per età e competizione tra due tipologie di batteri, è stato parametrizzato ed adattato ai dati di notifica pre- e post-vaccinazione; è stata applicata un'analisi di sensitività dei risultati rispetto ad alcuni parametri incerti, in particolare la durata dell'immunità conferita dal vaccino, l'efficacia sulla riduzione del carriage, e i modelli di interazione (mixing patterns) utilizzati.
Ipotesi
Si considera la competizione tra il gruppo C e tutti gli altri gruppi (compresa la
colonizzazione da Neisseria lactamica);
la popolazione è strutturata in 75 gruppi di età, di ampiezza un anno, secondo il modello
realistico di Schenzle (1984): non c'è mortalità fino al 74° anno di età, al termine del quale tutti gli individui muoiono, e non ci sono migrazioni; la dimensione della popolazione è costante;
non è ammessa l'infezione contemporanea con più di un gruppo meningococcico o con Nl;
la forza di infezione è funzione dell'età; per il gruppo C varia anche nel tempo a seconda
della frazione di carrier presenti, mentre per gli altri gruppi, riuniti in un'unico comparto O, è considerata tempocostante;
il tasso di guarigione è tempocostante sia per C che per O, e solo per quest'ultimo varia con
l'età a seconda della proporzione di portatori di lactamica e meningococco in ogni gruppo (poichè i due batteri hanno tassi di guarigione diversi);
il numero di malati del gruppo C è una frazione dei carrier, θi, dipendente dall'età; i malati
non vengono spostati dal comparto dei carrier; si trascurano le malattie meningococciche relative ad altri serogruppi che quello C;
la vaccinazione è un evento discreto che trasferisce una proporzione ψi, pari alla copertura
la vaccinazione non induce alcuna variazione nelle dinamiche di trasmissione di altri gruppi,
pertanto la forza di infezione relativa a questi ultimi non varia in seguito alla vaccinazione;
il comparto dei carrier vaccinati è totalmente immune all'acquisizione della malattia, ed i
suscettibili vaccinati hanno una protezione parziale γ verso l'acquisizione del carriage del gruppo C che riduce la loro forza di infezione di un fattore 1 – γ;
il modello di interazione considerato nel caso base è un mixing preferenziale ristretto
all'interno di una fascia di età ampia tre anni, e deriva dall'osservazione che la maggior parte dei casi secondari di malattia durante gli scoppi epidemici sono concentrati su un intervallo ±1 anno rispetto all'età del caso primario;
la durata della protezione del vaccino dalla malattia e dal carriage è supposta identica
(sebbene siano state fatte delle simulazioni anche con durate diverse).
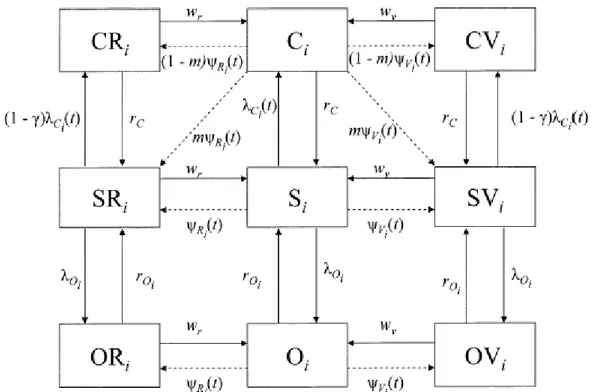
Struttura
Lo schema generale del modello è rappresentato nella figura 4.9. I tre blocchi C, S e O nella colonna centrale rappresentano un doppio sistema SIS, in cui il comparto S dei suscettibili è in comune e C ed O rappresentano rispettivamente gli infetti per il gruppo C e per tutti gli altri gruppi, compresa la lactamica, che dunque competono per la colonizzazione degli S. Questa struttura di base è replicata nella colonna di destra e di sinistra per tenere conto della vaccinazione, effettuabile in due modalità diverse: quella di routine (a sinistra), che verrà eseguita dall'inizio della campagna in poi su tutti gli individui in età infantile per mantenere nel tempo gli effetti della vaccinazione sulla popolazione; e quella di catch-up (a destra), specifica della campagna, che serve per immunizzare tutte le persone fino a una certa età (nel caso specifico, 25 anni).
La popolazione è strutturata in 75 gruppi di età ampi un anno, individuati dall'indice i; al termine di ciascun anno, gli individui si spostano dal gruppo i al gruppo i+1; gli individui muoiono tutti e soli al termine del 74° anno di età ed una identica quantità viene introdotta come nuove nascite nel gruppo dei neonati (0 anni), in modo da mantenere costante la popolazione. Non è chiaro secondo
Figura 4.9: Schema compartimentale del modello di Trotter, Gay e Edmunds riferito a un solo gruppo di età.
quale proporzione i neonati vengano ripartiti nei tre gruppi centrali, ma è plausibile che finiscano tutti nel comparto dei suscettibili.
La forza di infezione per il gruppo C è data da Cit=
∑
j ijCjt CVj e dipende dunque, oltre che dal numero di carrier presenti, anche dal pattern di interazione attraverso βij. I carrier vaccinati CV possono essere meno infettivi, secondo un fattore δ. I CR non contribuiscono alla trasmissione dell'infezione, ma non sono chiare le ipotesi epidemiologiche alla base di questa assunzione.
L'immunità viene persa con tasso wR e wV, che regola il ritorno dai comparti dei vaccinati a quelli corrispondenti della colonna centrale.
E' previsto che una frazione m dei portatori sani guarisca dal carriage immediatamente dopo la vaccinazione, e che dunque venga trasferita direttamente al comparto dei suscettibili vaccinati SV o SR; inoltre, anche se non è esplicito nello schema, si tiene conto del fatto che i carrier vaccinati potrebbero guarire più velocemente, attraverso un fattore z che influenza il valore di rC.
Stima dei parametri
La parametrizzazione del modello consiste nella stima del maggior numero di coefficienti possibile, riducendo al minimo quelli che resteranno parametri della simulazione. Innanzitutto vengono stimate le forze di infezione λ e il tasso di attacco per carrier della malattia θ, considerando il solo modello S, C, O, sulla base del fitting degli stessi dati di carriage utilizzati da Coen et al. (Gold, 1978, e Cartwright, 1987); per quanto riguarda la stima dei λCi, si è utilizzata una formula simile alla precedente, ma modificata per rappresentare il mixing preferenziale:
Ci=i
∑
i−h ih Cit CVit
1−
∑
i=0 74 CitCVit
,essendo 2h+1 l'ampiezza della fascia di età all'interno della quale si ha la preferenza dei contatti. Per stimare βi, si è utilizzato il miglior fitting sui dati di carriage variando i valori di ε e di h (h = 1 oppure 2); il miglior fitting si è ottenuto con ε = 0.98 e h = 1, valori che sono stati utilizzati nel caso base. Le prevalenze di equilibrio previste dal modello senza vaccinazioni sono state usate come condizioni iniziali del modello con vaccinazioni. Le coperture efficaci ψ della vaccinazione nelle due modalità sono state stimate dai dati pre- e post-vaccinazione.
La durata del carriage per il comparto O, r1
Oi , è stata stimata considerando una durata di 4 mesi per Neisseria lactamica (Gold, 1978) e 9 mesi per i vari ceppi di meningococco (De Wals, 1985) e valutando per ciascuna età la frazione di carrier dell'uno e dell'altro; la durata del carriage di C,
1
rC , sembra essere minore dei 9 mesi relativi agli altri ceppi, ed è stata lasciata come parametro nelle analisi di sensitività. Altri parametri sono stati la protezione parziale del vaccino relativamente al carriage, γ, e la durata degli effetti diretti del vaccino, w1
i ; nel caso base tale durata media è stata assunta di 15 mesi nel caso della vaccinazione a 2, 3, e 4 mesi, 5 anni per le vaccinazione sui bambini di un anno, e 10 anni per la vaccinazione su persone di età superiore. Si è posto arbitrariamente m = 0, z = 1 e δ = 1.
Risultati
gruppo C. Poichè il carriage del gruppo C è piuttosto raro rispetto ad altri meningococchi e a Neisseria lactamica, raramente esso è capace di generare un'immunità negli individui (la quale insorge gradualmente in seguito a colonizzazioni ripetute); pertanto ci si aspetta che la vaccinazione mirata al gruppo C non induca un aumento di suscettibili legato alla mancata immunizzazione.
La strategia di vaccinazione del Ministero della Sanità britannico è consistita nella vaccinazione di routine a 2, 3 e 4 mesi e nel catch-up in un primo momento di tutti gli individui sotto i 18 anni, successivamente esteso a quelli sotto i 25. Tale strategia è stata confrontata nell'ambito delle simulazioni con altre 5 ipotizzabili; dopodichè si sono valutati gli effetti di interventi futuri per la modifica della strategia corrente.
Confrontando i risultati delle simulazioni per diversi valori di rC con i dati di notifica, è risultato che la migliore approssimazione secondo il metodo dei minimi quadrati si ha quando la durata del carriage per il gruppo C , r1
C , è attorno ai 3 mesi, confermando l'ipotesi di una trasmissione
veloce del serogruppo in esame. Si è visto inoltre che il mixing proporzionale è un modello di interazione inadeguato rispetto ai risultati del mixing preferenziale; esso fornisce previsioni eccessivamente ottimistiche, in quanto i benefici della vaccinazione si trasmettono in modo più rapido alle varie fasce di età rispetto al caso di mixing preferenziale ed ai dati reali. In generale l'accordo delle previsioni del modello con il dati sul numero di casi di malattie pre- e post-vaccinazione è molto buono; ad esempio, la riduzione prevista nel carriage per gli adolescenti è del 71%, contro un 66% effettivamente verificatosi.
E' stato poi calcolato il valore di R0 come autovalore dominante della cosiddetta “next-generation matrix”, data da:
G=d H E ,
con d durata del carriage del gruppo C, H=diag iSi , ed
E=
[
1− 1− 1− ... 1− 1− ... 1− 1− ... 1− 1− ... 1− 1− 1− ... ... ... ... ... ... ...]
.R0 risulta minore di 1,36, piuttosto basso come ci si poteva aspettare in un'infezione SIS con un basso numero di infetti; la copertura vaccinale minima pC necessaria per eliminare l'infezione risulta pari al 26,5%: l'infezione dunque è facilmente controllabile, tanto più che una parte dei suscettibili (12,7%) finisce nel comparto O delle colonizzazioni con altri ceppi, riducendo di fatto il valore del numero di rimpiazzamento effettivo.
Viene calcolata inoltre un'approssimazione dell'andamento temporale di R(t) come rapporto tra le proporzioni di carrier che si rilevano a distanze di 3 mesi (pari alla durata del carriage) per ogni t:
Rt ≈
∑
iCit3 mesi
∑
i
Cit ,
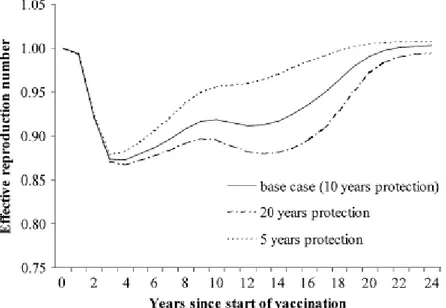
in realtà viene utilizzata una formula leggermente diversa a causa del trasferimento annuale degli individui nella classe di età successiva. L'andamento previsto di R(t) con la strategia utilizzata in Inghilterra e Galles è quello mostrato di seguito (figura 4.10):
Si vede che tale parametro scende rapidamente sotto il valore 1 in conseguenza della campagna di vaccinazione, e risale con in un tempo che dipende dalla durata della protezione diretta. Trotter et al. ipotizzano che potrebbe essere necessario somministrare una dose di rinforzo (booster) quando R(t) inizia a raggiungere valori prossimi a 1, sebbene in corrispondenza di quell'istante temporale i carrier possano avere una prevalenza molto piccola: ciò perchè l'aumento di R(t) segnala un maggior numero di suscettibili nella popolazione, che potrebbe favorire lo scoppio di una epidemia.
In generale il modello mostra che la diminuzione rapida nel numero totale di casi si ottiene solo per quelle strategie che uniscono alla vaccinazione di routine le vaccinazioni catch-up sui giovani inferiori ai 18 o ai 25 anni; questo succede perchè la memoria immunologica dei bambini è ridotta, mentre le vaccinazioni orientate agli adolescenti riducono drasticamente il carriage grazie alla protezione parziale γ e hanno una protezione diretta dalla malattia di più lungo termine. La vaccinazione di routine a 2, 3, e 4 mesi o soltanto ai 12 mesi produce all'incirca lo stesso numero di casi di malattia, con la differenza che nella seconda strategia si ha una distribuzione dei casi molto più concentrata sui bambini inferiori ad un anno di età.
Per quanto riguarda la valutazione dei possibili cambi di strategia in futuro, si è stimato che:
• nel caso in cui la durata della protezione sia breve (attorno ai 5 anni), risulta necessaria la
somministrazione di una dose di rinforzo a tutti i bambini di 12 anni che avevano ricevuto la vaccinazione di routine nella prima infanzia; in caso di protezione lunga, l'incidenza della malattia dopo 12 anni è ancora troppo bassa per avere grandi benefici attraverso il booster; inoltre, se si ammette che la protezione contro il carriage possa avere una durata minore rispetto alla protezione della malattia, allora l'immunità di gruppo si riduce anticipatamente e la dose booster diventa necessaria;
• spostare la vaccinazione di routine dalle tre dosi a 2, 3 e 4 mesi alla dose singola a 12 mesi
dopo 5 o 10 anni dall'inizio della campagna riduce notevolmente i costi e non produce un aumento nei casi su bambini di età inferiore ad un anno grazie al fatto che dopo questo tempo sussiste un'immunità di gruppo consistente;
• aggiungere allo spostamento di routine precedente anche una dose all'età di 12 anni riduce
ulteriormente il numero di casi evitati, sebbene tale riduzione sia poco apprezzabile vista la già ridotta prevalenza della malattia in seguito alla campagna.
La capacità di ridurre, anche di poco, la trasmissibilità del carriage per gli individui vaccinati è la
Figura 4.10: Andamento di R(t) previsto dal modello di Trotter et al. al variare della durata media della protezione vaccinale
proprietà che ha permesso sostanzialmente il successo della strategia adottata nel Regno Unito, con una riduzione nel numero dei casi prevista dell'88% già con valori di γ pari a 0,3.
Punti critici
• L'ipotesi su cui si fonda la semplicità di questo modello è la possibilità di trascurare
l'immunizzazione legata al carriage ripetuto a causa del fatto che tale condizione è piuttosto rara per il gruppo C. Poichè non è possibile fare la stessa approssimazione nel caso di altri serogruppi, non si può generalizzare il modello a serogruppi diversi.
• Benché il focus principale dello studio sia esplicitamente il gruppo C, si usano
semplificazioni forti nella modellazione degli altri gruppi. Ad esempio i tassi di infezione del gruppo O dovrebbero, come quelli del gruppo C, essere dipendenti dalla prevalenza di carriage, sebbene ciò possa complicare notevolmente la parametrizzazione.
• Il modello non tiene inoltre in considerazione il meccanismo di acquisizione progressiva di
immunità legato al carriage di Neisseria lactamica o ad altri serogruppi. In prima analisi, sembrerebbe che trascurare questa immunità equivalga a studiare una situazione di worst-case: i risultati positivi della campagna dovrebbero essere ancora migliori nel caso in cui si tenga conto dell'aumento della popolazione immune a causa del carriage di O. Poichè però il modello trascura anche i possibili effetti del vaccino sul carriage di altri gruppi (in particolare di Nl), non si tiene conto dell'eventuale riduzione di immunità naturale indotta dal vaccino, e del conseguente possibile aumento dell'incidenza delle malattie meningococciche relative ad altri gruppi.
• Il motivo per cui i carrier vaccinati secondo routine non possono trasmettere l'infezione non
è stato spiegato dagli autori.
• L'utilizzo di fasce di età uniformi e ampie un anno rende trattabile il modello, tuttavia
potrebbe essere troppo semplificativa nel gestire il primo anno di età ed eccessivamente dettagliato (e dunque oneroso) negli anni successivi ai 25; potrebbe essere più appropriato dividere in fasce di età di ampiezza non uniforme, più o meno come fatto da Coen et al., ma bisogna valutare quanto ciò complichi le simulazioni. L'ipotesi di costanza della popolazione potrebbe non essere molto verosimile con i tempi di simulazione (24 anni) considerati.
• E' noto dalla letteratura che il θi non può essere semplicemente un coefficiente, ma deve
essere una funzione non lineare del carriage. Ad esempio, θi potrebbe essere proporzionale al numero di nuovi carrier, come sostengono gli studi che mostrano un aumento del tasso di attacco per carrier nei periodi in cui è maggiore l'incidenza del carriage, sebbene tale correlazione potrebbe esere associata all'introduzione di un ceppo altamente virulento e trasmissivo.
• La scelta di inserire pochi valori e arbitrari per i parametri m, z e δ lascia inesplorate alcune
ipotesi interessanti ammesse dal modello; potrebbero forse essere stimate dai dati in modo meno rudimentale, o in alternativa usate come parametro per un fitting.
• I dati utilizzati per l'interpolazione delle forze di infezione, come puntualizzato dagli stessi
autori, non sono molto recenti; inoltre la stima del mixing pattern è piuttosto controversa, nonostante il modello abbia mostrato un ottimo accordo con i dati sperimentali.
Riferimenti bibliografici
[1] Coen P. G., Cartwright K., Stuart J. (2000) Mathematical modelling of infection and disease due to Neisseria meningitidis and Neisseria lactamica. International Journal of
Epidemiology 29, 180–188.
[2] Stollenwerk N., Maiden M. C. J., Jansen V. A. A. (2004) Diversity in pathogenicity can
cause outbreaks of meningococcal disease. PNAS, 101, 10229-10234.
[3] Ancel L. W., Levin B. R., Richardson A.R., Stojiljkovic I. Two-tiered evolution of
Neisseria Meningitis: How within-host ecology and between-host epidemiology expedite
phase shifting.
[4] Ancel Meyers L., Levin B. R., Richardson A. R., Stojiljkovic I. (2002) Epidemiology,
hypermutation, within-host evolution and the virulence of Neisseria meningitidis. Proc.
R. Soc. Lond., 270, 1667–1677.
[5] Trotter C. L., Gay N. J., Edmunds W. J. (2005) Dynamic Models of Meningococcal Carriage, Disease, and the Impact of Serogroup C Conjugate Vaccination. American