IV.
RISULTATI
E DISCUSSIONE
La quantità di proteine presenti nel siero umano, già in condizioni standard, è ampia e variegata. Inoltre la letteratura ci informa largamente sull’aumento della concentrazione di alcune di esse quali la α-2-macroglobulina [De Sain-van der Velden et al., 1998], aptoglobina [Whittaker, 1968] e Retinol Binding Protein [Yamada et al., 1997] in presenza di infiammazione o sindrome nefrotica. Tuttavia tali variazioni dipendono da una gran quantità di variabili come il tipo di patologia e la conseguente terapia, l’anamnesi, l’età e il sesso del paziente.
In questa tesi l’attenzione è stata concentrata soprattutto sulla ricerca di un comportamento comune a tutti, indipendentemente dai singoli casi personali, motivo per cui sono stati scelti pazienti con patologie molto diverse tra loro.
In letteratura è noto il rinvenimento di frammenti di albumina nelle urine e nel plasma di pazienti nefropatici [Candiano et al., 2006] e diabetici [Osicka et al., 2004]. Quando la patologia progredisce attraverso l’insufficienza renale cronica sino alla sindrome uremica conclamata si constata la progressiva degradazione, fino alla totale soppressione, della funzione renale con conseguente anuria. Nel circolo ematico si accumulano, così, sostanze tossiche che normalmente sono escrete con le urine.
Il metabolismo di proteine a basso PM prevede l’escrezione con le urine, mentre per le proteine ad alto peso molecolare il catabolismo
siti di degradazione dell’albumina si trovano a livello dei muscoli e della pelle. Infatti in caso di anuria la letteratura documenta il rinvenimento in circolo di proteine a basso PM [Clark et al., 2003], ma la sorte dell’albumina negli stessi soggetti non è ben chiara. La precedente tesi ha documentato la presenza di frammenti di albumina nel siero di un paziente con insufficienza renale cronica all’interno di un range di pH ristretto (3-5,6). Nel presente lavoro si vuole confermare quanto è venuto alla luce nel lavoro precedente considerando un numero più elevato di pazienti e un range più ampio di pH. A tale scopo verranno tenute in maggior considerazione le bande e gli spot visibili nella zona dei bassi pesi molecolari, in particolare verrà presa visione delle parti comprese al di sotto dei 25 kDa.
1. ELETTROFORESI MONODIMENSIONALI
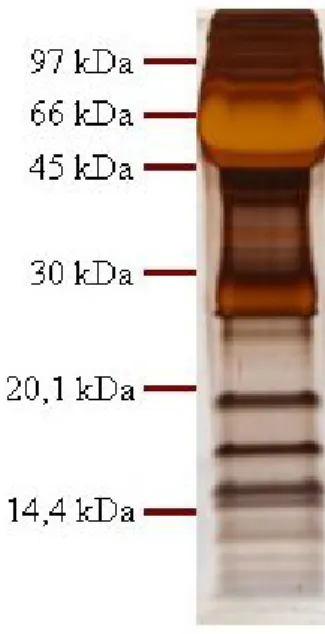
In prima istanza sono state eseguite elettroforesi monodimensionali con lo scopo riscontrare un effettivo aumento delle bande a basso PM nei campioni considerati. La figura 8 riporta una elettroforesi monodimensionale del siero normale totale. La quantità di proteine totali caricate è di 15 μg, dose eccessiva per la visualizzazione delle proteine ad alto peso molecolare, ma che consente di evidenziare numerose bande a pesi molecolari minori di25 kDa. Le successive indagini sono state condotte come da protocollo ma verranno riportate le immagini che comprendono solo questo intervallo di pesi molecolari.
Fig. 8 SDS-PAGE del siero
normale totale. Sono stati caricati 15μg di proteine totali in un gel al 17% di poliacrilamide.
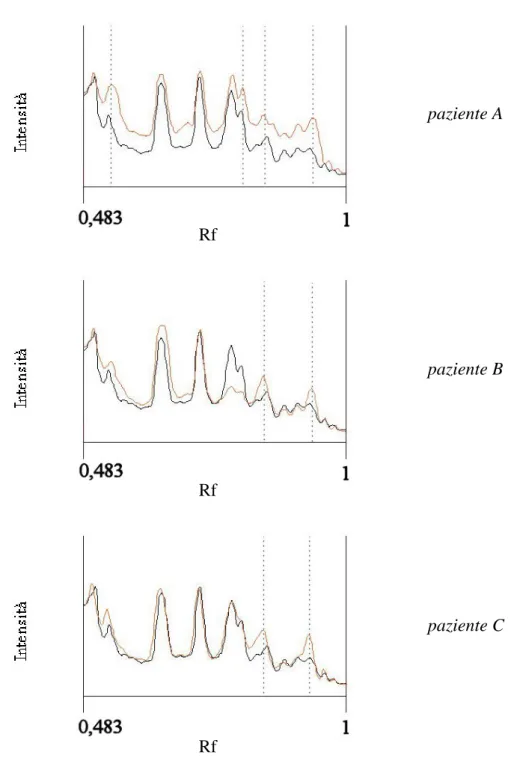
La figura 9 mostra i tracciati elettroforetici di un siero normale e tre patologici, affiancati dai tracciati densitometrici.
Controllo paziente A paziente B paziente C
25 kDa
14,4 kDa 19 kDa
Fig. 9 SDS-PAGE nelle condizioni indicate da Laemmli ed analisi densitometrica eseguita
I tracciati densitometrici dei patologici sono stati sovrapposti al tracciato densitometrico del controllo per poterne fare un paragone (Fig. 10): è possibile osservare, così, caratteri tipici che distinguono un caso dall’altro. paziente A Rf paziente B Rf paziente C Rf
Fig 10 Tracciati densitometrici. Paragone tra ogni singolo paziente (linea rossa) e il
controllo (linea nera). Con i tratteggi verticali sono evidenziate le zone dei pesi molecolari dove si riscontrano le maggiori differenze.
In questo modo risulta indiscussa una effettiva maggior concentrazione delle bande a peso molecolare minore di 20 kDa.
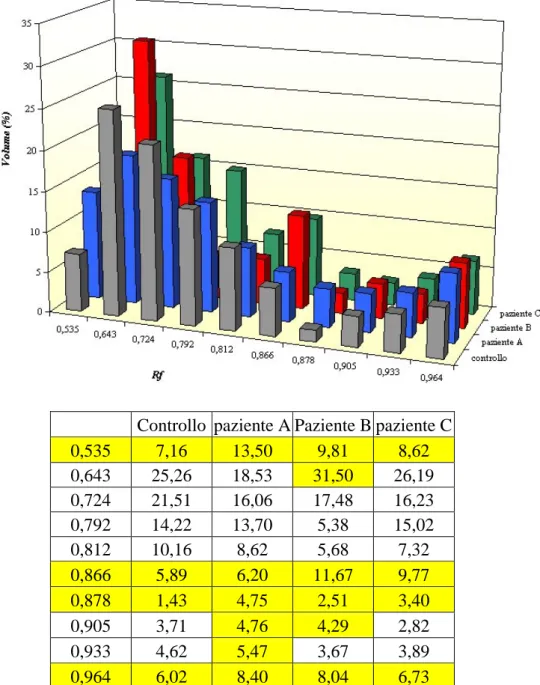
La figura 11 mostra un istogramma in cui è riportato il volume delle singole bande in percentuale rispetto al totale delle bande della stessa lane presenti nell’intervallo di PM considerato.
Controllo paziente A Paziente B paziente C 0,535 7,16 13,50 9,81 8,62 0,643 25,26 18,53 31,50 26,19 0,724 21,51 16,06 17,48 16,23 0,792 14,22 13,70 5,38 15,02 0,812 10,16 8,62 5,68 7,32 0,866 5,89 6,20 11,67 9,77 0,878 1,43 4,75 2,51 3,40 0,905 3,71 4,76 4,29 2,82 0,933 4,62 5,47 3,67 3,89 0,964 6,02 8,40 8,04 6,73
Fig. 11 Confronto della misura del volume percentuale delle singole bande rispetto al totale
I picchi più alti indicano una maggior quantità di proteine presenti nella banda, a quel valore di Rf, rispetto alle altre bande dello stesso paziente. In generale tutti i pazienti mostrano picchi più alti del controllo a valori di Rf di 0,535, 0,866, 0,878 e 0,964; mentre mostrano picchi più bassi a valori di Rf di 0,724 e 0,812. In particolare il paziente A mostra una maggiore quantità di peptidi delle bande presenti a Rf=0,905 e Rf=0,933 mentre il paziente B a Rf=0,643 e Rf=0,905. Il paziente C ha percentuali di espressione che ricadono nel comportamento generale menzionato precedentemente.
Le bande che risultano più marcate nei campioni dei pazienti rispetto al controllo sono state prelevate e mandate a sequenziare. I risultati che riguardano il contenuto della banda a Rf=0,643 (PM~21 kDa) ha indicato una netta prevalenza di RBPP (Retinol Binding Protein Precursor). Questo dato conferma quanto era già noto dalla letteratura [Yamada et al., 1997]. Sebbene siano evidenti differenze nell’entità delle bande a basso PM, soprattutto a carico dei patologici, il sequenziamento non ha fornito risposte. Se la spettrometria di massa avesse dato risposte nette sarebbe stato un notevole vantaggio per la rapida diagnosi di danni renali data la velocità di applicazione del saggio e della attendibilità della risposta. Purtroppo nelle condizioni attuali questo non può essere applicato.
Per questo motivo si è ritenuto opportuno raffinare l’indagine e vedere attraverso elettroforesi bidimensionali la distribuzione di tali peptidi.
2. ELETTROFORESI BIDIMENSIONALI
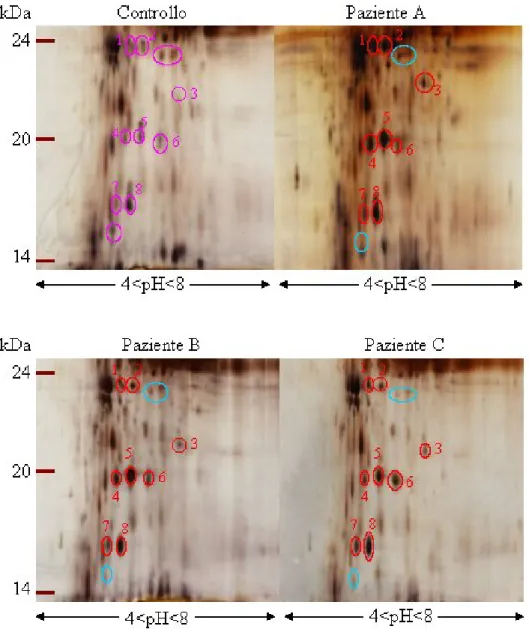
Gli stessi campioni oggetto dell’indagine preliminare attraverso SDS-PAGE sono stati sottoposti a elettroforesi bidimensionale all’interno di un range di pH tra 3 e 10 (Fig.12). Le caratteristiche generali risultanti da questo tipo di indagine sono ricorrenti in tutti e tre i casi. In particolare sono stati evidenziati spot più marcati a pesi molecolari di circa 24 kDa, 22 kDa, 21 kDa e 17kDa (contraddistinti da cerchi rossi) e spot meno marcati a pesi molecolari che si aggirano intorno ai 24kDa e 15kDa (contraddistinti da cerchi azzurri).
L’immagine riportata comprende valori di pH tra 4 ed 8 per centrare la zona d’interesse.
Tutti gli spot più intensi (indicati con numeri rossi in Fig. 12) sono stati prelevati e mandati a sequenziare. I risultati ottenuti ci informano sulla natura di una parte di essi. In particolare la proteina dello spot n. 5 del paziente A e del paziente C risulta essere il precursore dell’Aptoglobina e che lo spot n. 8 di tutti e tre i pazienti risulta essere il precursore della Transtiretina. Il sequenziamento dello spot n. 2 del paziente A è risultato essere, invece, un frammento di albumina. Gli spot analoghi dei pazienti B e C non hanno fornito nessuna risposta al sequenziamento, per cui non possiamo avere la certezza che anche nel loro caso questo spot corrisponda a un frammento di albumina.
Fig. 12 Immagine ritagliata da 2DE del controllo e dei tre patologici. In questi ultimi
risaltano gli spot delle proteine più marcate (in rosso) e di quelle meno marcate (in azzurro).
Le limitate informazioni che ci sono giunte dal sequenziamento ci hanno spinto a indagare ancora più approfonditamente attraverso la reazione con opportuni anticorpi.
3. WESTERN BLOT E
IMMUNORIVELAZIONE
La figura 13 illustra quanto ottenuto in seguito a immunorivelazione di due elettroforesi bidimensionali: una del controllo e una del paziente A. L’immagine visualizzata è compresa tra valori di pH di 4,5 e 8,5 per ingrandire la zona d’interesse.
Fig. 13 Western Blot del controllo e di un patologico. In viola sono evidenziati gli spot
presenti in entrambi i campioni raffigurati. In bianco sono evidenziati gli spot presenti solo nel paziente A. Il risultato del sequenziamento ha confermato che gli spot viola sono frammenti di albumina.
Da questa prova risulta evidente la massiccia presenza di frammenti di albumina a bassi pesi molecolari. Una parte degli spot messi in evidenza dall’anticorpo sono presenti sia nel controllo che nel patologico (segnati in viola in Fig. 13), mentre altri compaiono solo nel paziente A (in bianco in Fig. 13). Tutti gli spot numerati in figura 13 sono stati prelevati e mandati a sequenziare. Il risultato della
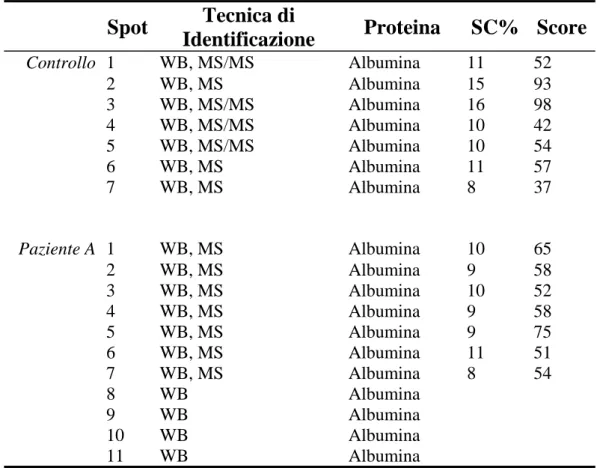
spettrometria di massa ha confermato che si tratta di frammenti albumina (Tabella 2).
Spot Tecnica di
Identificazione Proteina SC% Score
1 WB, MS/MS Albumina 11 52 2 WB, MS Albumina 15 93 3 WB, MS/MS Albumina 16 98 4 WB, MS/MS Albumina 10 42 5 WB, MS/MS Albumina 10 54 6 WB, MS Albumina 11 57 Controllo 7 WB, MS Albumina 8 37 1 WB, MS Albumina 10 65 2 WB, MS Albumina 9 58 3 WB, MS Albumina 10 52 4 WB, MS Albumina 9 58 5 WB, MS Albumina 9 75 6 WB, MS Albumina 11 51 7 WB, MS Albumina 8 54 8 WB Albumina 9 WB Albumina 10 WB Albumina Paziente A 11 WB Albumina
Tabella 2 In questa tabella sono riportati i numeri degli spot considerati sia nel controllo
che nel paziente A. Sono indicate le tecniche che hanno permesso la loro identificazione come frammenti di albumina: Western Blot (WB) e spettrometria di massa (MS). Sono inclusi i risultati giunti dalla spettrometria di massa: la copertura della sequenza (SC%) indica la percentuale della sequenza della proteina identificata coperta dai dati della MS, e lo Score che indica una probabile misura della validità dell’identificazione della proteina tramite MS.
La presenza di frammenti di albumina anche nel siero del controllo viene spiegata dalla letteratura come il possibile effetto dell’azione antiossidante svolto dalla proteina. Infatti in seguito a questa reazione la molecola di albumina risulta danneggiata e quindi più suscettibile all’attacco delle proteasi sieriche [Haliwell 1988].
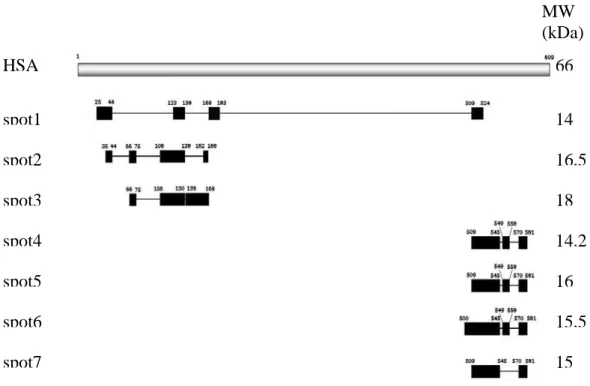
Durante il trattamento per la spettrometria di massa gli spot presenti nel gel vengono digeriti con tripsina. I peptidi proteolitici risultanti sono raffigurati come rettangoli neri in Fig. 14. In seguito l’identificazione del frammento è ottenuta cercando il miglior appaiamento tra le masse determinate sperimentalmente e quelle calcolate dalla digestione teorica della proteine presenti nel database [Sechi, 2004]. MW (kDa) HSA 66 spot1 14 spot2 16,5 spot3 18 spot4 14,2 spot5 16 spot6 15,5 spot7 15
Fig. 14 Schema della distribuzione, all’interno della sequenza di HSA, dei peptidi ottenuti
dalla digestione triptica dei frammenti di albumina presenti negli spot numerati da 1 a 7 nel paziente A.
Gli spot numerati 1-3 sono stati identificati come frammenti N-terminali; gli spot numerati 4-7 sono stati identificati come frammenti C-terminali.
Purtroppo il sequenziamento degli spot numerati 8-11, presenti solo nel paziente A e totalmente assenti nel controllo, non ha fornito risposte.
Lo spot 1 del paziente A risultato dal sequenziamento potrebbe sembrare un unico frammenti compreso tra gli aa 25 e 524. Se così fosse non risulterebbe visibile nella zona del gel corrispondente ai 14 kDa ma ben più in alto. Di conseguenza il frammento presente nello spot indicato deve essere necessariamente costituito dall’unione di frammenti ancora più piccoli situati a grande distanza.
Un’interpretazione, fornita in occasione della scoperta di frammenti simili nelle urine, e solo parzialmente anche nel plasma, di pazienti nefropatici [Candiano et al., 2006], spiega la possibile esistenza di legami covalenti tra questi frammenti. In effetti all’interno dei frammenti triptici risultanti dalla MS sono presenti residui cisteinici che fanno ipotizzare la presenza di ponti disolfuro con la conseguente formazione di molecole cistiniche. Tuttavia la loro esistenza simultanea all’interno dello stesso spot potrebbe essere dovuta all’esistenza di altri legami covalenti che mantengono unite le due sequenze. Un'altra ipotesi è quella della esistenza di un frammento unico (dall’aminoacido 25 fino all’aminoacido 183) che si collega al peptide di 15 aminoacidi C-terminale (dall’aminoacido 509 all’aminoacido 524) attraverso un legame covalente. Il peso molecolare totale risultante dall’unione di queste due parti rientra nell’errore sperimentale ammesso.
Tali legami potrebbero non aver risentito delle condizioni riducenti applicate durante la procedura della 2DE perché protetti dal ripiegamento dei frammenti o perché le condizioni denaturanti e riducenti adottate sono troppo deboli.
Fig.15 Sequenza aminoacidica dell’albumina umana. In rosso è evidenziata la zona in cui
ricadono i frammenti identificati negli spot 1-3. In blu è evidenziata la zona in cui ricadono i frammenti identificati negli spot 4-7. In giallo sono segnati i ponti disolfuro.
Gli spot 1-3 sono dati da frammenti appartenenti prevalentemente all’estremità ammino-terminale e ricoprono un’area indicata in rosso in Fig. 15; mentre gli spot 4-7 sono dati da frammenti appartenenti all’estremità carbossi-terminale e rientrano nell’area indicata di blu in Fig. 15.
Certi aspetti delle procedure dialitiche, incluso il materiale della membrana da dialisi e la presenza di prodotti batterici nel dialisato, hanno l’effetto di sovra-stimolare la produzione di radicali da parte dei neutrofili [Ward et al., 2003]. L’albumina contiene solo una cisteina ridotta (Cys-34) ma, data l’abbondanza di questa proteina nel plasma, l’albumina viene considerata come la più grande riserva di gruppi tiolici reattivi nel circolo sanguigno. Per questo motivo essa rappresenta la difesa maggiore contro l’aumentato stress ossidativo osservato in pazienti emodialitici [Himmelfarb et al., 2001].
Nonostante questo l’albumina osservata negli emodializzati sembra avere un’attività di scavenger di radicali ridotta rispetto all’albumina delle persone sane. Infatti, sebbene reagisca in maniera considerevole, non solo non riesce ad abbassare la minaccia dello stress ossidativo nell’organismo ma, anzi, sembra stimolare la catena ossidativa dei neutrofili umani [Mera et al., 2005]. Questi risultati suggeriscono che l’albumina è esposta allo stress ossidativo tanto da subire cambiamenti conformazionali e funzionali che si riflettono in un alterazione delle sue proprietà biologiche [Mera et al., 2005]: a tal proposito è stato osservato un abbassamento del contenuto di α-eliche
accompagnato una maggior esposizione delle regioni idrofobiche della proteina. Sono stati osservati anche cambiamenti della carica netta che suggeriscono che l’aumento di carica negativa riflette l’ossidazione dei residui aminoacidici basici His, Lys e Arg [Levine et al., 1994].
Inoltre, per quanto riguarda i siti di legame con farmaci identificati da Sudlow, mentre le proprietà del sito I non risultano particolarmente alterate, quelle del sito II appaiono significativamente diminuite. Questo abbassamento di legame di farmaci come il ketoprofene è causato probabilmente da un cambiamento conformazionale che coinvolge il sito II (nel sottodominio III A) [Iwao et al., 2006a] che può essere dovuto all’ossidazione dell’Arg-410, un sito target dello stress ossidativo, situata per l’appunto nel sottodominio III A [Ahmed et al., 2005].
Studi recenti hanno inoltre notato che l’albumina ossidata ha un tempo di emivita ridotto probabilmente dovuto a un maggiore uptake da parte di fegato, milza e reni (Tabella 3). Lo stesso processo a carico di altri organi non subisce particolari variazioni.
(μL/hr) Fegato Reni Milza HSA-controllo 24±4,2 48±5,3 32±2,7
HSA-ossidata 5058±341,6 1188±208,2 2118±322,1
Tabella 3 Uptake dell’HSA-controllo e dell’HSA-ossidata in topi. [Iwao et al, 2006b]
Questo può essere spiegato con l’abbondanza di recettori di scavenger situati proprio in questi tessuti [Iwao et al., 2006b].
Da quanto detto fino a questo momento appare evidente che l’intenso stress ossidativo che si instaura nei pazienti con insufficienza renale cronica e in trattamento emodialitico causa enormi sconvolgimenti nella struttura e quindi nella funzionalità dell’albumina.
Questi cambiamenti rendono la proteina molto diversa da come si presenta nelle condizioni standard, quindi anche le sue funzioni risultano enormemente alterate. Il risultato di tale cambiamento è un indebolimento generale della struttura che risulta così più facilmente offesa all’interno delle alterate condizioni patologiche.
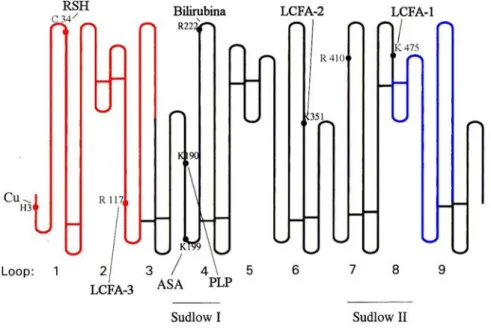
Isiti più sensibili a tale stress, in particolare la Cys-34 e la Arg-410, si trovano agli estremi della sequenza aminoacidica (Fig. 16).
Fig. 16 Figura schematica dei siti di legame sulla molecola di albumina. ASA:
Acetilsalicilato. PLP: piridossalfosfato (vitamina BB6). LCFA-1, -2, -3: siti di legame per
acidi grassi a catena lunga in ordine decrescente di specificità. RSH: sito di formazione di disolfuri misti costituito dalla Cys-34. Sono stati messi in evidenza l’entremità N-terminale (in rosso) e l’estremità C.terminale (in blu) che risultano frammentate in conseguenza dello stress ossidativo.
I frammenti identificati dal sequenziamento degli spot presi in esame nel presente lavoro sono situati alle due estremità della catena polipeptidica come può essere visto in Fig. 16. Questo suggerisce che le estremità della catena risultano le zone più deboli perché maggiormente esposte quindi sensibili alle condizioni esterne. La frammentazione delle estremità della proteina può essere dovuta all’azione di enzimi proteolitici di natura esopeptidasica che in condizioni di IRC o in dialisi risultano più attivi o più concentrati rispetto alle condizioni standard.