Capitolo 4
Il problema biologico-biomedico
4.1 FISIOPATOLOGIA DELLA ROTTURA DELL’AAA E SUA
PREVENZIONE
4.1.1 Introduzione
L' aterosclerosi, ossia l’indurimento della parete arteriosa, è la malattia dei nostri tempi, della società occidentale. L'allungamento della vita media, il fumo, le abitudini alimentari, hanno ribaltato negli ultimi 40-50 anni il quadro delle cause di morte nella popolazione adulta. In particolare l'aneurisma dell'aorta addominale, la cui patogenesi è nella quasi totalità legata all'aterosclerosi, ha presentato un tale incremento, dovuto anche all'affinamento dei processi di diagnosi, da portarlo ad essere la XIII causa di morte tra tutte le cause. L'interesse però per tale entità nosologica non scaturisce solo dalla sua importanza nella società ma anche dai punti oscuri sulla sua formazione e rottura, e dalle ricerche di base sulla biomeccanica e biochimica che nuove prospettive hanno aperto sulla sua origine e sviluppo. Tutto ciò fà dell'aneurisma dell'aorta addominale un capitolo a parte nello studio della aterosclerosi e che oggi assume un particolare interesse, sanitario e scientifico.
L’aneurisma dell’aorta addominale dunque, definito dalla Società Internazionale di Chirurgia Cardiovascolare come una dilatazione segmentale, circoscritta e permanente della parete del vaso superiore al diametro di 3 cm o che raggiunge il 150% del valore teorico normale, in fase di rottura costituisce una delle situazioni d’emergenza a più elevata mortalità.
L'aneurisma aortico addominale è piuttosto comune. Le statistiche compiute negli USA hanno dimostrato che esso si pone al tredicesimo posto tra le cause di morte con 15,000 decessi all'anno. E' stato inoltre notato che la mortalità per tale patologia è anche in netto incremento, contrariamente a ciò che si verifica per le patologie aterosclerotiche cerebrovascolare e coronarica, che sono invece in diminuzione. Caratteristica epidemiologica degli aneurismi addominali è la netta predominanza maschile, da 3:1 fino ad 8:1, nelle varie casistiche. Tradizionalmente gli aneurismi addominali sono stati associati all'aterosclerosi come causa più frequente. Tuttavia, come vedremo, ricerche cliniche e sperimentali hanno, nel corso degli anni, portato allo sviluppo di teorie alternative in grado di spiegare il fenomeno, fino alla definizione di un particolare tipo di aterosclerosi "dilatante" contrapposta a quella "stenosante". Recentemente la " Society for Vascular Surgery" e la "International Society for Cardiovascular Surgery, Committee on Standards in Reporting" hanno suggerito il termine "non specifico" come nomenclatura preferita per questi tipi di aneurismi. Però, come per l'aterosclerosi, ipertensione e fumo di sigarette sono state coinvolte nella eziologia dell'aneurisma addominale. L'aneurisma dell'aorta addominale è presente otto volte più frequentemente nei pazienti fumatori rispetto ai non fumatori. Tuttavia nel 1985 Cronenwett e collaboratori dimostrarono che, oltre l'ipertensione, era la malattia cronica ostruttiva polmonare la patologia associata che determinava la rottura dell'aneurisma più precocemente. Nel corso degli anni 80 una serie di lavori clinici indicarono che l'aneurisma dell'aorta addominale si comportava come un processo morboso particolare piuttosto che come una semplice conseguenza dell'aterosclerosi:
in uno studio comparato su soggetti operati con protesi aorto-bifemorale per malattia occlusiva o per aneurisma, al follow-up dopo 10 anni, solo i primi dimostravano un alta incidenza di claudicatio, ischemia agli arti od ostruzione del bypass;
c' è una incidenza aumentata di neoplasie epiteliali nei pazienti con aneurisma;
l'ernia inguinale è più frequente nei pazienti con malattia aneurismatica dell'aorta addominale rispetto a quelli con malattia occlusiva;
la genetica influenza lo sviluppo di questa patologia, almeno in una parte dei pazienti, se non in tutti.
Gli studi clinici hanno quindi non solo suggerito ma in parte dimostrato che l'aneurisma dell'aorta addominale è una malattia particolare, una entità nosologica unica. Questa ipotesi è stata suffragata da studi sperimentali sulla biochimica e biomeccanica della parete arteriosa sana ed aneurismatica.
4.1.2 Biochimica della rottura dell’AAA
In uno studio autoptico del 1970 Sumner e collaboratori per primi dimostrarono che il contenuto di collagene e di elastina della parete aneurismatica era inferiore a quello di una parete normale od aterosclerotica. Da allora numerose ricerche sono state condotte su queste due molecole e sugli enzimi proteolitici che le attaccano, l'elastasi e la collagenasi. I livelli sierici di entrambi gli enzimi sono aumentati nei pazienti con aneurisma. Inoltre il livello di collagenasi nella parete dell'aneurisma si correla bene con le dimensioni dell'aneurisma. Menashi e collaboratori hanno dimostrato che un aumento sicuro della collagenasi si verifica solo nei tessuti prelevati da aneurismi rotti. Tuttora è aperta una discussione sul fatto che la presenza di collagenasi preceda e provochi la formazione dell'aneurisma ovvero che ne sia la conseguenza. Esistono però dei brillanti studi sperimentali che hanno dimostrato l'importanza degli enzimi proteolitici nella dilatazione e rottura delle arterie. E’ stato studiato l'effetto dell’elastasi e della collagenasi sulla resistenza alla pressione di carotidi canine: l’elastasi provoca una dilatazione vasale ed una accentuata rigidità; la collagenasi invece aumenta la compliance del vaso. Aumentando la pressione la carotide si rompe. L'effetto è ancora più evidente se il trattamento è sequenziale (elastasi +collagenasi). Tale esperimento è stato compiuto anche su arterie umane, in particolare su arteria iliaca esterna ed interna. Quest'ultima viene spesso coinvolta da processo aneurismatico se è presente un aneurisma dell'aorta addominale. Nell’arteria iliaca esterna è ben visibile la similitudine con il comportamento della carotide del cane. Infine lo studio della arteria iliaca interna umana ha mostrato una estrema sensibilità di questa arteria al trattamento proteolitico. Infatti quando il trattamento veniva attuato con entrambi gli agenti proteolitici, l'arteria giungeva alla rottura prima che il ciclo pressorio fosse completato. Tale risposta drammatica dell’arteria dimostra che essa è deficitaria nel collagene parietale o nelle connessioni collagene-elastina. In conclusione l'elastina è responsabile della compliance arteriosa ma è il collagene a fornire alla parete arteriosa la forza tensile.
4.1.2 Etiopatogenesi
Raramente la formazione dell’aneurisma è diretta conseguenza di cause specifiche quali: Trauma
Infezioni acute (salmonellosi, brucellosi) Infezioni croniche (tbc)
Vasculiti (arterite a cellule giganti, Takayasu)
Malattie connettivali (Marfan, Ehlers-Danlos tipo IV).
Nella maggior parte dei casi non si identifica un fattore determinante e, dal momento che la lesione è invariabilmente associata ad un severo danno aterosclerotico della parete, sono tradizionalmente ritenuti come di natura degenerativa.
Non e’ ancora perfettamente chiarita l’esatta patogenesi della dilatazione aortica: l’elastolisi appare comunque il momento chiave del rimaneggiamento della parete vasale.
Questa notoriamente e’ formata da tre strati:
- l’intima: costituita da collagene ricco di elastina; nel tessuto subintimale sono presenti cellule miointimali. E’ in questo strato che si verifica l’accumulo di lipidi;
- la media: formata da strati concentrici di elastina, collagene e da un piccolo numero di cellule miointimali. E’ in questo strato che si verificheranno le alterazioni che portano alla formazione dell’aneurisma;
- l’avventizia e’ costituita da collagene e fibre elastiche.
Il collagene si distende solo del 4% rispetto alla lunghezza originale ma garantisce una forza tensile che previene una sovradistensione da ipertensione. L’elastina si espande del 50-70% rispetto alla sua lunghezza originale, favorendo in tal modo la distribuzione della pressione su tutta la parete. A basse pressioni l’elastina sopporta da sola lo stress sulla parete mantenendo costante l’equilibrio fra stress murale e deformazione parietale.
Nell’aneurisma il collagene e’ più denso, meno deformabile ed ispessito, con la conseguente incapacità di distendersi durante il ciclo cardiaco.
La formazione dell’aneurisma e la sua espansione si verificano in conseguenza della perdita di fibre elastiche e di collagene in grado di sopportare l’ipertensione parietale. Tale perdita avviene ad opera di elastasi e collagenasi (principalmente MMPs: Matrix Metalloproteinasi) oltre che di cellule infiammatorie quali macrofagi, polimorfonucleati e neutrofili.
La frammentazione dell’elastina ed il conseguente indebolimento della tunica media inizialmente determinano solo un limitato incremento del diametro aortico in quanto il collagene, la placca intimale e l’ispessimento dell’avventizia concorrono a mantenere lo spessore parietale. L’infiltrazione successiva delle cellule infiammatorie porta alla frammentazione del collagene, la parete perde la forza tensile e viene sbilanciato l’equilibrio emodinamico con conseguente distensione della parete del vaso. Inizialmente la rottura completa dell’aorta e’ evitata da un complesso meccanismo di rimaneggiamento che consiste in neosintesi del collagene. In questa fase il collagene parietale e’ aumentato del 77% mentre l’elastina e le fibre muscolari si riducono sino a valori del 92%. In seguito a queste alterazioni e per la concomitanza dei fattori emodinamici la parete aortica da cilindrica diventa sferica per resistere maggiormente allo stress parietale, e si dilata.
Attualmente non si conoscono le cause che portano al processo proteolitico. Sebbene il danno arteriosclerotico coesista nella patologia aneurismatica, esso non può esserne considerato la causa determinante.
In sintesi il processo di degradazione parietale che successivamente porta alla formazione dell’aneurisma consiste in:
1. frammentazione delle fibre elastiche 2. ridotta concentrazione di elastina 3. degradazione del collagene avventiziale.
4.1.3 I classici fattori di rischio dell’AAA Le Dimensioni
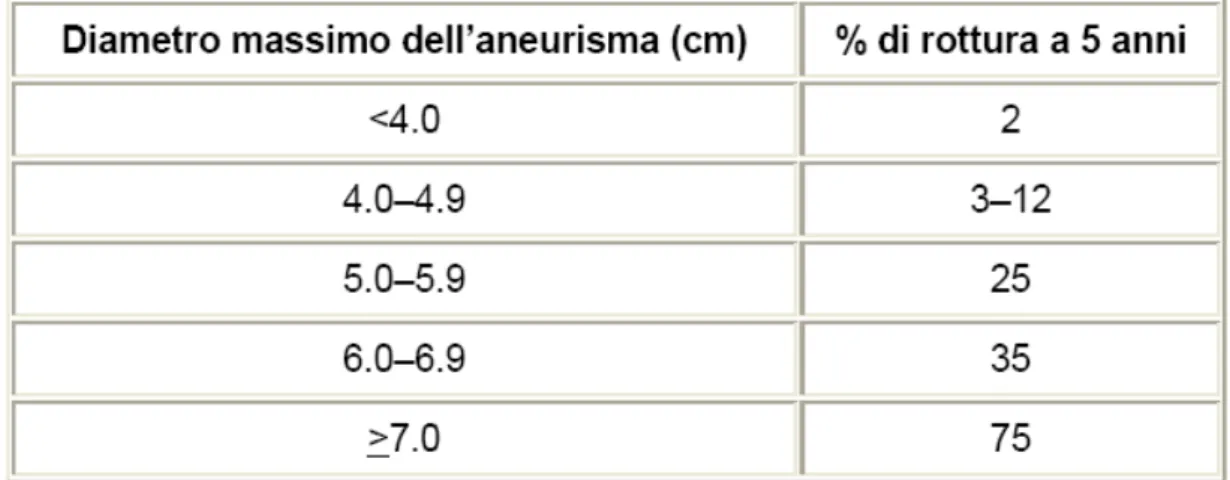
La grandezza dell'aneurisma è il parametro oggi universalmente accettato per giudicare se l'intervento su un AAA è procrastinabile oppure no. Ovvero se il rischio di rottura è abbastanza grande da giustificare il rischio di un intervento.
L'autore di tale importante parametro è stao Szilagyi nel 1972 che dimostrò una sopravvivenza del 6% in pazienti con un aneurisma addominale aortico maggiore di 6 cm. Molti studi hanno evidenziato che aneurismi più piccoli presentano una velocità di rottura dallo 0% allo 5,4% ogni anno. Tuttavia si sono accumulati dati ancora contrastanti. In una recente pubblicazione infatti, alcuni ricercatori trovarono che in 72 pazienti con AAA in realtà la grandezza dell’aneurisma non era così importante come fattore di rischio per la rottura. Infatti i dati mostrano che la dimensione media di un aneurisma aveva un diametro di 6,4 cm in 9 pazienti con la rottura dell’aneurisma stesso, mentre il diametro era di 6,1 cm in 63 pazienti senza rottura dello stesso.
Figura 4.2 – Rischio di rottura di un AAA in base al diametro
Ipertensione
Grazie ad alcuni studi, si è trovato che la pressione del sangue diastolica registrata ad un tempo iniziale è predittiva per una successiva rottura.
Infatti l’ipertensione diastolica è molto più frequente tra i pazienti che hanno subito la rottura di un aneurisma in confronto alla totale popolazione dei pazienti aneurismatici. Inoltre in una serie di pazienti con AAA non trattato chirurgicamente, si è visto che era presente nel 67% dei pazienti con rottura (in 23% senza rottura) una pressione sanguigna più alta di 150/100.
Per definizione l’ipertensione è diagnosticata in quei pazienti con una pressione arteriosa media superiore ai 108 mmHg. Essa è determinante anche per la velocità di espansione dell’AAA. E’ stato dimostrato infatti che la velocità di espansione annuale è strettamente correlata con la pressione del battito e quella sistolica, correlata negativamente con la pressione sistolica.
COPD
Il COPD, ossia un disturbo polmonare ostruttivo è stato identificato come il più importante fenomeno che può portare alla rottura di un AAA. Questo disturbo è stato trovato nel 42% dei pazienti con rottura dell’aneurisma, e solo nel 10% dei pazienti con un AAA senza rottura.
Fattori genetici
C’è una predisposizione agli aneurismi addominali aortici all’interno di una stessa famiglia. Infatti è stato dimostrato che c’è una storia di rotture di aneurismi nel 40% delle famiglie che hanno aneurismi familiari e che c’è una relazione tra il numero di parenti di primo grado e la frequenza di rottura degli AAA.
Laparotomia
Molti pazienti presentano rotture di AAA nelle prime 5 settimane dopo una laparotomia eseguita per disturbi non correlati. Si è ipotizzato che il trauma chirurgico potrebbe provocare il fenomeno attraverso l’attivazione della collagenolisi.
I livelli di siero sia della collagenase che dell’elastase aumentano nei pazienti con AAA ma questo incremento è probabilmente successivo alla formazione dell’aneurisma. Tuttavia, la partecipazione della collagenase alla rottura di un AAA è sperimentalmente sostenuta da numerosi studi.
Trombo intraluminale
Lo spessore del trombo intraluminale risulta utile per ipotizzare il rischio di rottura di un AAA. Infatti si è trovato che il trombo intraluminale medio è di 9mm in 9 pazienti con rottura di un aneurisma ed ha uno spessore di 19 mm in 63 pazienti senza rottura dell’aneurisma.
Configurazione o forma
É una causa molto dibattuta. Sappiamo che un aneurisma può essere fusiforme od irregolare, con una forma pseudo-circolare o comunque abbastanza regolare.
Sono stati studiati dei piccoli aneurismi addominali aortici con la tomografia computerizzata e poi è stata divisa la circonferenza dell’aneurisma stesso in 8 parti. E’ stato calcolato il raggio di curvatura
(Rc) di ogni segmento. La TC di alcuni pazienti con AAA espanso (espansione = 0,5 cm/anno) è
stata messa a confronto con quella di pazienti con aneurismi stabili (espansione di 0,2 cm/anno). E’ stato trovato che l’appiattimento nella curvatura del segmento di parete era associato significativamente con un incremento di velocità di espansione nei piccoli AAA. E’ quindi stata esclusa un’associazione tra la configurazione dell’aneurisma ed il rischio di rottura.
Fumo
I fumatori hanno un rischio di aneurisma maggiore in confronto ai non fumatori. Il rischio di morte per rottura dell’aneurisma stesso è fortemente aumentato nei fumatori di sigarette, di sigari e di pipe. Inoltre è stato dimostrato che non è possibile separare l’influenza che ha il COPD nello studio. Infezioni
Sono state recentemente dimostrate infezioni croniche delle placche nelle arterie coronariche dovute alla Chlamydia pneumoniae, e la loro relazione con la rottura di esse è sotto studio. Si è visto che molte infezioni sono state riscontrate nella maggior parte degli aneurismi addominali aortici.
Metalloproteinasi
Le metalloproteinasi di matrice (MMP) sono una famiglia di proteasi contenenti zinco che degradano la matrice extracellulare e le membrane basamento. Si pensa che questi enzimi giochino un ruolo nei processi essenziali per la crescita tumorale, l’invasione e le metastasi. Sono stati accumulati negli ultimi due decenni numerosi studi clinici e sperimentali sul ruole delle proteinasi (collagenasi ed elastasi). Parleremo di questa famiglia di enzimi e del ruolo che hanno all’interno della proteolisi del collagene nei prossimi paragrafi.
4.1.4 Screening e prospettive
La prognosi dei pazienti con Aneurisma dell'aorta addominale è stata correlata con il diametro dell'aneurisma: infatti è stato riportato un rischio elevato di rottura quando l'aneurisma superava il diametro critico di 4-5 cm. Il tasso di espansione annuo di un aneurisma varia da 3 ad 8 mm con una media di 4 mm. La sopravvivenza a 5 anni va dal 17 % al 61%, a seconda delle statistiche. La mortalità operatoria dell'aneurisma addominale varia enormemente se l'intervento viene compiuto in condizioni di emergenza o se si tratta di un intervento d'elezione.
In pratica la mortalità reale dell'aneurisma rotto dovrebbe essere calcolata nel modo seguente: - il 50% dei pazienti muore prima dell'arrivo in ospedale;
- il 24%dei pazienti muore prima dell'intervento;
- il 42% dei pazienti muore per complicanze post-operatorie fatali.
In totale l'80% dei pazienti con aneurisma rotto dell'aorta addominale muore. Di quì la necessità di diagnosticare l'aneurisma addominale precocemente, eventualmente con programmi di screening. La diagnosi di aneurisma dell'aorta addominale può essere compiuta con una serie di metodiche:
la palpazione permette al medico di base od allo specialista di sospettare con un notevole margine di sicurezza la presenza di un aneurisma addominale;
l'Ecografia è il metodo oggi più diffuso per lo screening dell'aneurisma addominale, perchè rapido, preciso, poco costoso;
la Tomografia Computerizzata (TAC), con o senza mezzo di contrasto, è il metodo corrente che permette la migliore definizione delle dimensioni e caratteristiche dell' aneurisma; l'Angiografia, tradizionale o digitalizzata, il metodo preferito dai chirurghi vascolari per la
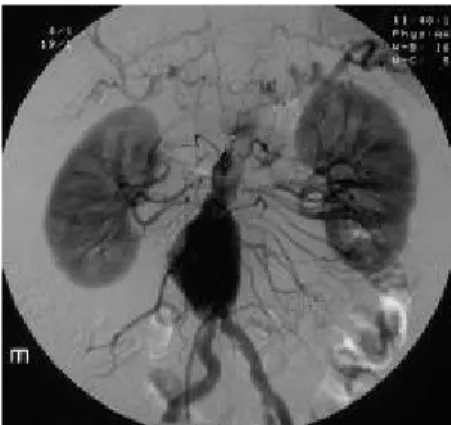
ottima definizione dell'albero vascolare a valle dell'aneurisma, è oggi adottato in misura minore, particolarmente se il paziente presenta le caratteristiche della rottura;
la Risonanza Magnetica Nucleare(RMN) è metodo eccellente di risoluzione dell'aneurisma e dei vasi senza l'uso del mezzo di contrasto ma presenta costi e tempi di esame ancora elevati.
Negli ultimi anni vari programmi di screening sono stati intrapresi nel mondo per provare o meno l'efficacia di tali iniziative allo scopo di limitare l'aumento delle morti per aneurisma rotto dell'aorta addominale
Se molte sono le tematiche scientifiche che ruotano attorno a tale patologia, oggi il tema centrale è la prevenzione della morte dei pazienti nei quali un aneurisma non diagnosticato giunge alla rottura. Nel mondo non c'è però parere unanime sulle linee di politica sanitaria per il trattamento dell'aneurisma dell'aorta addominale. Se da un lato ci sono le esperienze incoraggianti degli screening di massa già citati, c'è anche chi pensa che tale politica porterebbe, se fosse diffusa a grandi popolazioni, al collasso delle istituzioni sanitarie. C’è quindi bisogno di migliorare la terapia chirurgica dell'aneurisma rotto unitamente ad un più attento controllo ed indicazione da parte dei medici. Ma soprattutto bisogna riuscire ad intervenire a monte di questo processo di espansione del vaso e quindi prima del formarsi dell’aneurisma stesso, ossia riuscire a capire a fondo i meccanismi che portano alla degradazione del collagene della parete aortica in modo da prevenire la dilatazione del vaso. Per fare questo nei prossimi paragrafi andremo a vedere più nel dettaglio quello che, secondo molti studi, risulta uno dei processi fondamentali nella formazione di aneurismi: la proteolisi del collagene.
Con esso vedremo i principali enzimi artefici del processo ( Metalloproteinasi di matrice) ed i loro inibitori (inibitori delle metalloproteinasi).
4.2 LA PROTEOLISI DEL COLLAGENE
La proteolisi è per definizione il processo di degradazione delle proteine da parte dell’organismo. Le proteine, come tutti i componenti cellulari, presentano un determinato turnover. La vita media delle proteine può variare da pochi minuti a più giorni. Spesso i processi di proteolisi intervengono quando il ripiegamento della proteina non avviene in modo corretto o quando la proteina non serve più (degradazione fisiologica). Esistono molti processi proteolitici, ma quello che ci interessa per questo lavoro di tesi è il processo che porta alla degradazione di una delle componenti fondamentali della parete aortica, il collagene.
Un programma di ricerca multidisciplinare, sostenuto dal US National Heart, Lung and Blood Institute, identifica nella degradazione proteolitica del tessuto connettivo della parete aortica uno dei meccanismi principali nello sviluppo di un AAA.
La parete aortica contiene muscoli lisci, elastina e collagene disposti in strati concentrici con l’obiettivo di resistere alla pressione arteriosa.
La media dell’aorta sembra degradarsi negli AAA per mezzo di processi proteolitici. Questo implica un incremento nella concentrazione di enzimi proteolitici in relazione ai loro inibitori nell’aorta addominale. Vari studi hanno dimostrato un’attività aumentata delle metalloproteinasi di matrice (MMP) in persone con AAA. Le MMP, così come altre proteinasi, sono secrete nella matrice extracellulare degli AAA dai macrofagi e dalle cellule muscolari lisce aortiche. Le metalloproteinasi di matrice ed i loro inibitori sono presenti nel normale tessuto aortico e sono responsabili del remodeling della parete vasale. Nel tessuto aneurismale, c’è però la tendenza all’aumento dell’attività delle MMP che favorisce la degradazione di elastina e collagene. Il problema è che il meccanismo che porta alla degradazione di collagene ed elastina nella parete aortica di un AAA da parte delle MMP è attualmente sconosciuto. Dunque il sorgere di un AAA è il risultato di un fallimento delle maggiori proteine strutturali dell’aorta (elastina e collagene). I fattori che portano a questo sono sconosciuti, ma chiaramente esiste una predisposizione genetica. Recenti ricerche hanno posto il loro interesse nel ruolo delle metalloproteinasi, un gruppo di enzimi responsabili del remodeling tissutale.
4.3 LE METALLOPROTEINASI DI MATRICE: STRUTTURA E FUNZIONE
4.3.1 Introduzione
Le Metalloproteinasi di Matrice (Matrix Metalloproteinases, MMP), conosciute anche come matrixine, sono una famiglia di enzimi proteolitici, la cui attività catalitica di tipo endopeptidasico, come indicato dallo stesso nome, è dipendente dalla presenza di specifici ioni metallici. Le MMP hanno una potente azione degradativa nei confronti di componenti proteici della matrice extracellulare (ExtraCellular Matrix, ECM) e possiedono, inoltre, attività di cleavage verso molecole presenti sulla membrana cellulare e verso altre molecole proteiche pericellulari.
L’attività di questi enzimi è fondamentale per lo svolgimento di numerosi processi fisiologici; a titolo puramente esemplificativo, le MMP sono riconosciute come indispensabili sia per il corretto sviluppo embrionale, sia per il rimodellamento/turn-over tissutale e per la riparazione di ferite nella vita adulta. Allo stesso tempo, però, le MMP sono coinvolte in svariati processi patologici sia di tipo infiammatorio che degenerativo (ad es. artriti, artrosi) e, inoltre, nell’acquisizione del fenotipo invasivo e/o metastatizzante delle neoplasie.
Tale molteplicità di funzioni svolte dalle MMP è accompagnata da precisi meccanismi di regolazione, che, quando perdono di efficienza, possono appunto determinare la comparsa di eventi patologici. I meccanismi di controllo dell’attività delle MMP sono molto articolati e agiscono a differenti livelli; oltre ad essere conosciute dai meccanismi di regolazione a livello trascrizionale, le MMP, al pari degli enzimi pancreatici, sono secrete come “zimogeni” cioè come enzimi che si attivano solo dopo la rimozione di un pro-peptide inibitorio. Inoltre, l’attività delle MMP è ulteriormente regolata da molecole con azione inibitoria chiamate Inibitori Tissutali delle MMP (Tissue Inhibitors of Metalloproteinases, TIMP).
Gli organismi superiori producono numerose e diverse MMP, ciascuna delle quali si contraddistingue per possedere un proprio profilo di espressione, localizzazione, attivazione, inibizione e clearance così come uno specifico pannello di substrati da degradare. Tuttavia, alcune funzioni delle diverse MMP sono sovrapponibili; in questo modo, l’attività delle MMP è, per certi aspetti, ridondante, ma, allo stesso tempo, è vantaggiosa per l’organismo perché garantisce una sorta di meccanismo compensatorio, nel caso di perdita di funzione di qualche MMP.
4.3.2 Organizzazione delle MMP
Le MMP sono altamente conservate nel processo evolutivo tanto che la loro presenza è stata dimostrata nelle piante e negli invertebrati oltre che nei vertebrati superiori. In questi ultimi ad oggi sono state identificate 25 distinte MMP, di cui 22 hanno un omologo nell’uomo.
In generale, le MMP condividono una serie di caratteristiche sempre identiche, rappresentate dallo Zinc binding motif, dal Met-turn e da un’elevata omologia di sequenza, che determinano complessivamente un’elevata conservazione delle loro struttura.
La nomenclatura delle MMP associa normalmente all’acronimo MMP un numero che di solito si riferisce alla sequenza cronologica della scoperta. In aggiunta, le MMP possono essere raggruppate e, di conseguenza, anche nominate sulla base dell’organizzazione dei loro domini. La maggior parte delle MMP sono secrete; tuttavia, 6 mostrano un dominio transmembranario e sono espresse come molecole di superficie.
Genericamente e in modo schematico, la struttura delle MMP può essere così organizzata:
1. peptide segnale N-terminale (chiamato anche pre-dominio) che è rimosso dopo avere indirizzato la proteina durante la sua sintesi verso il reticolo endoplasmatico;
2. propeptide, che garantisce la latenza dell’attività fino alla sua rimozione; 3. dominio catalitico legante lo zinco;
4. hinge-region cioè una regione cerniera, che varia in lunghezza e composizione aminoacidica tra le MMP e influisce sulla specificità dei substrati;
5. dominio per l’emopessina, che influenza varie funzioni tra cui il legame con i TIMP.
La MMP7 e la MMP26 rappresentano un’eccezione perchè non possiedono questo dominio analogamente alla MMP23, che, invece, possiede in questa posizione un dominio ricco in cisteina e prolina chiamato “IL-1 type II receptor-like domain”.
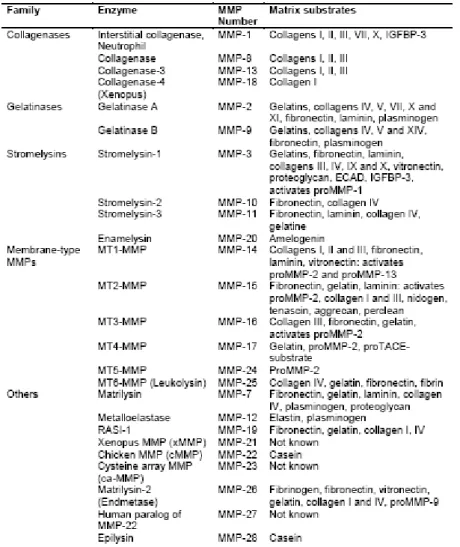
A seconda della specifica MMP considerata possono essere presenti altri domini come ad esempio quello per la fibronectina o il dominio transmembranario di tipo 1. Sulla base della specificità per i substrati, della similarità nella sequenza e nell’organizzazione dei domini, le MMP dei vertebrati sono state divise in 6 distinti gruppi secondo il loro dominio e alla loro abilità a degradare componenti individuali della matrice extracellulare (figura 4.4):
Matrilisine: gli enzimi di questo gruppo non possiedono il dominio per l’emopessina e comprendono la matrilisina 1 (MMP7) e la matrilisina 2 (MMP26). Oltre a processare vari componenti della ECM (collagene di tipo I, IV, fibronectina etc), la MMP7 degrada anche il pro-TNFα, il Fas-ligand la E-caderina e altre molecole di superficie;
Collagenasi: appartengono a questo gruppo la MMP1, MMP8, MMP18 (Xenopus); sono caratterizzate dalla capacità di digerire il collagene interstiziale di tipo I, II, e III insieme ad altre molecole della matrice extracellulare. Sono composte da un dominio catalitico e da un dominio simile a quello per l’emopessina;
Stromelisine: possiedono lo stesso dominio delle collagenasi. La stromelisina 1 (MMP3) e la stromelisina 2 (MMP10) hanno una simile specificità di substrato, anche se l’attività della MMP3 è più efficiente. Oltre a degradare vari componenti della ECM, la MMP3 partecipa all’attivazione di numerose pro-MMP. La stromelisina 3 (MMP11) è generalmente raggruppata nonostante il nome tra le “altre MMP” perché la sequenza e la specificità di substrati divergono da quella delle altre stromelisine;
Gelatinase: appartengono a questo gruppo la Gelatinasi A e B, che rappresentano rispettivamente le MMP2 e 9. Questi enzimi hanno inserito nel dominio catalitico 3 ripetizioni di un dominio legante la fibronectina. L’azione degradativa è diretta verso la gelatina, la laminina e il collagene di tipo IV e V, cioè il collagene non fibrillare che è il maggiore componente della membrana basale; solo la MMP2 può anche digerire collagene di tipo I e III;
MMP Membrane Type: il nome di queste MMP deriva dal fatto che sono molecole di membrana (Membrane Type MMP, MTMMP); le prime 4 MTMMP (corrispondenti in ordine alle MMP14, MMP15, MMP16 e MMP24) sono dotate di un dominio transmembranario di tipo I, mentre le MT5MMP e MT6MMP (MMP17 e MMP25) sono proteine ancorate alla membrana attraverso la molecole del GPI (glicosil fofsfatidil inositolo). Con l’eccezione della MT2MMP, le altre MTMMP hanno tutte la capacità di attivare la proMMP2 oltre a digerire numerosi componenti delle ECM (collegene tipo I, II e III). Inoltre, la MT1MMP è conosciuta per svolgere un ruolo fondamentale nei processi di angiogenesi e di regolazione della produzione del VEGF;
Gruppo delle “altre MMP”: appartengono a questo gruppo 7 MMP. La MMP12 o metalloelastasi è conosciuta per essere espressa nei macrofagi dove svolge un ruolo fondamentale nei processi di migrazione digerendo appunto l’elastina e numerose altre proteine. La MMP19 sembra essere un auto-antigene espresso nei pazienti affetti da artrite reumatoide. La MMP20, o enamelisina, digerisce l’amelogenina ed è primariamente espressa a livello dentale. La MMP23 non possiede il cysteine-switch-motif a livello di predominio e al posto del dominio emopessinico presenta un dominio ricco in cisteina e prolina chiamato “IL-1 type II receptor-like domain”. La MMP23 è stata proposta come MMP di membrana di tipo II perché possiede un dominio transmembranario a livello N-terminale del predominio. Inoltre sempre nel propeptide, è presente un motivo che riconosce la furina ed è perciò clivata a livello dell’ Apparato di Golgi e rilasciata come proteina già attiva nello spazio extracellulare. Appartengono infine a questo gruppo la MMP22, con funzione ancora ignota, e la MMP28, principalmente espressa nei keratinociti.
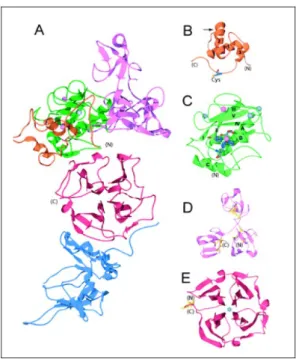
4.3.3 Struttura delle MMP
Il prodominio: la struttura, presente nelle MMP2, 3 e 9, consiste in 3 α-eliche e altrettante forcelle di connessione. La prima forcella tra l’elica 1 e 2 è una regione sensibile all’azione di proteasi ed è chiamata “bait-region”, cioè regione esca. Al contrario, l’estesa regione peptidica localizzata dopo l’elica 3 partecipa alla formazione di un solco destinato a legare il substrato in corrispondenza del dominio catalitico; è in questa regione che si trova il c.d. “cystein switch”, che costituisce un quarto sito di legame per lo zinco del sito attivo mantenendo l’enzima in forma inattiva. Considerando la MMP nella sua struttura tridimensionale, l’orientamento del pro-peptide rispetto al solco del sito attivo risulta essere opposto a quello che assume il substrato (Figura 4.5).
Il dominio catalitico: consiste di 5 foglietti-β (I, II, III, IV, V), 3 α-eliche (A, B, C) e forcelle di connessione. In questo dominio è contenuto: uno zinco catalitico, uno zinco strutturale e 3 ioni calcio. Il solco destinato a ricevere il substrato (substrate binding cleft) risulta formato dal IV foglietto β e dall’elica B insieme alla successiva forcella.
Come già detto, 3 istidine coordinano lo zinco del sito attivo, il cui quarto legame avviene con una molecola di acqua, quando il prodominio è stato clivato; il residuo di acido glutammico che risiede vicino alla prima istidina è fondamentale per la catalisi.
Nelle MMP2 e 9 a si trovano in questo dominio 3 regioni leganti la fibronectina, inserite tra il V foglietto β e l’elica del sito catalitico; il dominio per la fibronectina è formato da 2 foglietti β antiparalleli connessi da una corta α-elica e stabilizzati da 2 ponti disolfuro (Figura 4.6).
Il dominio per l’emopessina: possiede 4 ripetizioni di foglietti β orientati a elica (4-bladed β-propeller) con un singolo ponte disolfuro stabilizzante. Attraverso questo dominio sia la MT1-MMP che la MT1-MMP9 formano degli omodimeri asimmetrici. Inoltre, la MT1-MMP9 può legare, attraverso questo dominio, anche l’estremità C-terminale del TIMP2, in modo mutuamente esclusivo rispetto alla possibilità di formare degli omodimeri. La MMP2, al contrario, lega con questo dominio il TIMP2. In generale il dominio emopessinico è importante perché determina la specificità di diversi substrati ed è richiesto per l’attivazione della proMMP2 (Figura 4.6).
Figura 4.5 – Struttura 3 D delle MMP
4.3.4 Attivazione delle MMP
Come altri enzimi proteolitici, le MMP, in una sorta di meccanismo autodifensivo, sono sintetizzate primariamente come zimogeni, cioè proenzimi inattivi (definite perciò come proMMP). La latenza è garantita dal gruppo sulfidrilico di una cisteina a livello dell’estremità C-terminale del prodominio; questo gruppo sulfidrilico rappresenta il quarto sito di legame per lo zinco presente nel sito attivo del dominio catalitico.
L’attivazione si verifica quando il legame gruppo sulfidrilico – ione zinco (c.d. cystein to zinc switch) è rimosso; a questo punto il sito attivo, in cui il quarto legame è rimpiazzato con una molecola di acqua, può attaccare i legami peptidici delle proteine target delle MMP.
“In vitro”, l’attivazione delle MMP può essere mediata da molti agenti chimici quali ad esempio SDS, glutatione ossidato, agenti caotropici, oltre che da bassi valori di pH e da trattamento al calore. Questi agenti probabilmente agiscono interferendo direttamente con l’interazione tra la cisteina e lo zinco del sito attivo.
“In vivo” l’attivazione della maggior parte delle MMP a livello extracellulare avviene per proteolisi. Tale attivazione procede generalmente per step e può essere iniziata o da altre MMP, a loro volta già attivate, oppure da numerose serin-proteasi. Il primo attacco proteolitico avviene a livello della bait region del prodominio. Quando questa prima parte del prodominio è rimossa, si verifica una destabilizzazione complessiva di tutta questa regione comprendendo anche l’interazione cisteina-zinco del sito attivo.
L’attivazione completa della MMP è mediata da una successiva processazione intermolecolare da parte di altre MMP parzialmente o totalmente attivate; di conseguenza, lo step finale dell’attivazione è MMP-dipendente.
Sebbene la maggior parte delle proMMP sia attivata in sede extracellulare, esistono alcune eccezioni rappresentate da MMP11 (stromelisina 3), MMP23, MMP28 e dalle MTMMP. Queste MMP contengono tra il loro propeptide e il dominio catalitico una sequenza che riconosce enzimi furina-simili; ciò permette a queste MMP di essere direttamente attivate in sede intracellulare. Dal momento che questi enzimi sono principalmente secreti già in forma attivata, la regolazione della loro espressione e l’attività di specifici inibitori risultano particolarmente critici per la corretta regolazione della loro attività.
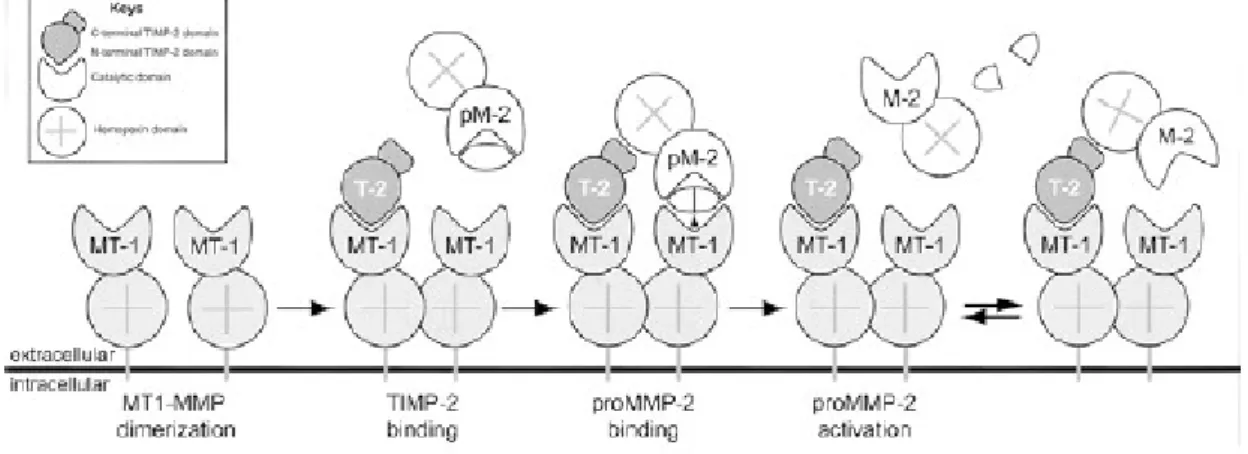
Attivazione della MMP2
La proMMP2 è refrattaria all’attivazione mediata da serin-proteasi. Il principale meccanismo di attivazione avviene a livello di membrana cellulare ed è mediata dall’azione contemporanea di MTMMP e del TIMP2. Tutte le MTMMP, ad eccezione della MT4MMP possono attivare la
proMMP2. L’attivazione mediata dalla MT1MMP è stata quella più estensivamente studiata. In modo schematico può essere così riassunta:
1 la proMMP2 forma un complesso, attraverso il suo dominio emopessinico, con il terminale carbossilico del TIMP2;
2 il dominio N-terminale inibitorio del TIMP2 essendo libero si lega alla MT1MMP sulla superficie cellulare;
3 le MT1MMP a loro volta con i domini emopessinici possono formare omodimeri o multimeri sulla superficie cellulare;
4 la proMMP2 risulta in questo modo legata alla superficie cellulare, dove può essere attivata attraverso la presentazione della bait region ad altre MT1MMP adiacenti e non inibite da TIMP;
5 la MMP2 risulta parzialmente attivata; si dissocia dalla membrana cellulare e completa l’attivazione ad opera di una processazione intermolecolare.
Figura 4.7 – Modello di attivazione della proMMP-2 da parte della MT1-MMP e del TIMP2. L’MT1-MMP attivo lega una molecola di TIMP-2 attraverso il suo dominio per l’emopossina. Il secondo MT1-MMP attivi poi scinde la regione di proMMP-2, attivandola parzialmente. L’MMP-2 si dissocia dalla membrana ed è pienamente attivata da processi intermolecolari.
4.3.5 Inibizione dell’attività delle metalloproteinasi
Aldilà delle loro funzioni di rimodellamento del tessuto connettivo, le MMP sono conosciute per la loro importanza nei processi proteolitici. Sotto condizioni fisiologiche, l’attività delle MMP è controllata almeno a tre livelli:
trascrizione,
attivazione proteolitica della forma del zimogeno,
inibizione dell’enzima attivo per mezzo degli inibitori endogeni.
La maggior parte delle MMP sono espresse nei tessuti adulti a bassi livelli o non sono affatto espresse in condizioni di riposo.
Dunque una migliore conoscenza del meccanismo che controlla l’attività delle MMP fornisce nuove prospettive per l’intervento terapeutico, dato che molti farmaci sono pensati per colpire questi punti chiave della regolazione ( Figura 4.8 ).
Figura 4.8 – Inibitori delle metalloproteinasi (TIMP) nell’ambiente pericellulare.
Inibitori endogeni
L’attività delle MMP è strettamente controllata da molti inibitori endogeni. Nei fluidi tissutali, il principale inibitore delle MMP è l’α2-macroglobulina, una grossa proteina sierica che lega le MMP e crea un complesso irreversibile. Tuttavia, gli inibitori delle MMP più studiati sono i TIMP ( Tissue inhibitors of Metalloproteinases ).
I TIMP sono inibitori peptidici di peso molecolare compreso tra 21 e 29 kDa, che legano le MMP secondo un rapporto stechiometrico di 1:1. Nei vertebrati sono stati identificati 4 diversi TIMP (TIMP1, 2, 3 e 4). Analogamente alle MMP, anche l’attività dei TIMP è regolata in condizioni fisiologiche. I TIMP hanno un’estremità N e C terminale di, rispettivamente, 125 e 65 aminoacidi, ciascuno contenente 3 ponti disolfuro. L’estremità N-terminale è quella con azione inibitoria sulle MMP. La struttura complessiva tridimensionale dei TIMP è riferibile ad un “cuneo” che si inserisce a livello del solco del sito attivo nel dominio catalitico delle MMP.
Da un punto di vista funzionale, è noto che i TIMP, oltre l’inibizione delle MMP, svolgono altre funzioni come la stimolazione dell’attività eritroide e della crescita cellulare.
Tra le altre molecole capaci di regolare l’attività proteolitica delle MMP, possiamo sottolineare la trombospondina-2 e il RECK (reversion-inducing cysteine-rich protein with Kazal domain motifs ), una glicoproteina ancorata al GPI. Altri regolatori chiave della matrice extracellulare sono il TEPI2 ( tissue-factor patway-inhibitor-2), un inibitore della protease della serina che può agire come inibitore delle MMP e il PCPE (procollagen C-terminal proteinase enancer), una molecola che possiede un’attività inibitoria significativa. Altri inibitori potrebbero venire nascosti nei domini NC1 del collagene IV oppure nel dominio legante la laminina, che sono strutturalmente simili alle TIMP. Tuttavia, può essere interessante sottolineare che gli inibitori endogeni possono anche agire da attivatori. Questa funzione inaspettata è stata descritta abbastanza bene per il TIMP2 nel caso dell’attivazione della MMP2.
Inibizione esogena
Negli ultimi anni le MMP sono state coinvolte in una varietà di disturbi importanti, inclusi cancro (crescita e metastasi), aterosclerosi, artrite ed enfisema. Ci sono state anche delle conferme a queste ipotesi, avendo scoperto ad esempio che più alte velocità di metastasi sono accompagnate da più alti livelli di MMP. Recenti studi, basati sullo sviluppo di topi, suggeriscono con maggiore evidenza che c’è un punto in cui gli inibitori delle MMP sviluppano l’obiettivo di opporsi al processo stesso.
Inibitori naturali
Sfortunatamente, la maggior parte dei composti sintetici prodotti di recente sono abbastanza specifici verso il resto delle MMP ma, con dosi terapeutiche, risultano tossici, anche se meno di altri agenti antitumorali. Tuttavia, studi sull’inibitore delle MMP peptido-mimetico sono ancora in fase di trial clinico. Dall’altro lato, tra i composti biologicamente attivi dei prodotti naturali, il polifenolo del tè verde causa una buona inibizione delle MMP. E’ stato riportato che composti di estratti
naturali (come epigallo chatechin gallate EGCG) sono capaci di inibire l’attività enzimatica di varie MMP come anche l’attivazione della proMMP-2.
4.3.6 Meccanismi molecolari dell’attività delle MMP
Sebbene le MMP possano virtualmente degradare tutto lo spettro di componenti proteici che costituiscono l’ECM, l’attività proteolitica delle MMP è diretta anche nei confronti di altre molecole sia circolanti che presenti sulla superficie cellulare o pericellulare.
Da ciò deriva che le MMP, oltre ad essere coinvolte nei processi di rimodellamento della matrice sia fisiologici che patologici, risultano in grado di influenzare il comportamento cellulare attraverso numerosi meccanismi.
Rimodellamento della ECM
La degradazione della ECM, operata dalle MMP in concerto con altri gruppi di molecole proteolitiche quali principalmente le serin-proteasi, è un processo che permette, distruggendo fisicamente le barriere strutturali, l’invasione cellulare dei tessuti circostanti. Tuttavia la ECM non deve essere considerata solo come una semplice impalcatura, perché la sua degradazione può fortemente influenzare il comportamento cellulare in conseguenza della liberazione numerose molecole bioattive che normalmente sono sequestrate nella ECM stessa. Queste molecole sono molto numerose e possiedono funzioni tra loro molto differenti: fattori di crescita, proteine che legano i fattori di crescita e molecole che rappresentano i ligandi per recettori cellulari di adesione (ad es. per le integrine). Di conseguenza, la ECM risulta implicata nella regolazione di numerosi processi cellulari quali la forma, il movimento, la crescita, la differenziazione e la sopravvivenza. Per estensione, tutti questi processi possono essere alterati dall’azione delle MMP, che modificando la normale composizione e organizzazione della ECM, influenzano tutti i segnali derivati dalla matrice. Ad esempio, per dimostrare come l’attività delle MMP possa influenzare il comportamento cellulare, la degradazione MMP-dipendente delle fibrille native di collagene determina l’esposizione di siti altrimenti criptati che possono essere legati da integrine di cellule neoplastiche di melanoma, consentendone la sopravvivenza e la crescita.
Degradazione di molecole di superficie
Le MMP possiedono attività degradativa anche diretta verso molecole proteiche presenti sulla superficie cellulare come, per esempio, nei confronti di molecole di adesione.
Infatti, le MMP3 e 7 degradano le molecole di adesione cellulare E-caderina, rilasciando un frammento solubile, che inibisce l’aggregazione cellulare e promuove fenomeni di tipo invasivo. Ancora, alcune MTMMP possono degradare delle transglutamminasi tissutali di superficie che, come co-recettori di integrine, promuovono l’adesione e la diffusione delle cellule attraverso il legame con la fibronectina favorendo o inibendo l’invasione di cellule con fenotipo neoplastico a seconda della particolare composizione della ECM in cui si trovano.
Sempre nell’ambito del rimodellamento di molecole di superficie, le MMP possono determinare anche il rilascio di molecole bioattive. Ad esempio, la MMP3 può determinare la liberazione dai leucociti di L-selectina e può anche rilasciare il fattore di crescita HB-FGF in forma attivata. La MMP7 a sua volta può indurre apoptosi cellulare mediata dal recettore FAS determinando il rilascio del ligando attivato per il FAS dalla superficie delle stesse cellule con un meccanismo autocrino. La liberazione del ligando per il FAS può prevenire in certi contesti la progressione neoplastica, ma, allo stesso tempo, può essere responsabile della selezione di sottopopolazioni neoplastiche resistenti all’apoptosi FAS-mediata. Le MMP2 e 9 possono attivare il TGF-β e almeno 7 diverse MMP possono attivare il precursore del TNF-α legato alla membrana cellulare.
Oltre ad attivare e/o rilasciare numerosi fattori di crescita e citochine, le MMP possono rilasciare anche i recettori specifici per tali molecole. Ad esempio, la MMP2 libera dalla superficie cellulare il recettore 1 per l’FGF, che mantiene dopo il rilascio la capacità di legame con l’FGF influenzandone di conseguenza la biodisponibilità.
Regolazione di segnali paracrini
Le MMP possono intervenire anche nella regolazione di segnali con azione paracrinasia inattivando direttamente le molecole responsabili di tali segnali sia, in alternativa, degradando i recettori destinati al legame con tali molecole ad azione paracrina. Per esempio le MMP possono direttamente degradare molecole con azione paracrina quali angiotensina I e II, bradichinina e la sostanza P.
4.3.7 Zimografia
La zimografia è una tecnica elettroforetica utilizzata per identificare l’attività proteolitica di enzimi separati sulla base del loro peso molecolare su speciali gel di poliacrilamide in condizioni non denaturanti. Separando gli enzimi sulla base del peso molecolare, questa tecnica garantisce di poter separatamente identificare la forma proenzimatica dalla forma attivata delle MMP. Inoltre, l’elettroforesi garantisce un’efficiente separazione di questi enzimi anche da eventuali TIMP. La tecnica consiste nell’impiegare gel di poliacrilammide che sono stati polimerizzati inglobando il substrato specifico della MMP da investigare; ad esempio con la gelatina se si vogliono studiare le MMP2 e 9 o con il collagene se si intende studiare la MMP1. Alla corsa elettroforetica è fatta seguire una fase prima di rinaturazione con speciali buffer contenenti Triton X 100, che rimuove i residui di SDS presenti nel gel di poliacrilammide; a questa prima fase è fatta seguire una seconda fase di incubazione in condizioni di temperatura idonea e in presenza di cofattori in modo da favorire l’attività dell’enzima. La tecnica si conclude con la colorazione del gel con Blu di Comassie o con un altro colorante generico per le proteine. La presenza nel campione analizzato di attività MMP è evidenziata con la presenza di bande “non colorate” che rappresentano l’esito della digestione da parte dell’enzima delle proteine substrato presenti nel gel. Questa tecnica è molto sensibile perché, prolungando il tempo di incubazione, permette di evidenziare picogrammi di enzima. Per evitare di prolungare eccessivamente la fase di digestione enzimatica, fatto che può esitare nella saturazione dell’attività dell’enzima, i tempi di incubazione devono essere settati sulla base del tipo di matrice analizzata e quindi del suo normale contenuto di MMP per consentire di lavorare con la zimografia in una fase di incremento dell’attività enzimatica e non in una fase di plateau per eccessiva attività.
4.3.8 Ruolo delle MMP nella patologia aneurismatica dell’aorta
Gli aneurismi aortici addominali, come già accennato all’inizio di questo capitolo, rappresentano un disturbo potenzialmente fatale, caratterizzato dalla distruzione dell’elastina della tunica media, dall’infiammazione cronica della parete aortica e dalla perdita di cellule muscolari lisce (SMC). Fattori come l’età, l’ateroscelosi, un’alta pressione sanguigna e il fumo sono stati tutti collegati alla patogenesi di un AAA. Tuttavia, l’origine della formazione di un aneurisma aortico addominale rimane ancora poco chiaro, poiché questo disturbo vascolare degenerativo include anche una componente genetica ereditaria.
Il rimodellamento tissutale è una caratteristica associata alla degenerazione progressiva della parete aortica, la cui integrità strutturale dipende primariamente dall’elastina e dal collagene. Recenti studi hanno enfatizzato il ruolo delle proteinasi elastolitiche nella distruzione e degradazione di alcuni membri della famiglia delle metalloproteinasi di matrice, incluso le proteinasi che degradano il collagene, come collagenasi e gelatinasi, e quelle che degradano l’elasina, come l’elastase.
Nei soggetti sani, la quantità di differenti proteine della matrice extracellulare (ECM) raggiungono un equilibrio tra sintesi e degradazione. Le MMP sono espresse a bassi livelli nei tessuti sani ma giocano un importante ruolo nel rimodellamento della ECM in numerosi stati patologici, incluso l’AAA. La regolazione di queste MMP avviene non solo a livello di espressione genica ma anche ad un livello posttraslazionale con attivazione enzimatica delle loro forme di proenzima. Di questi attivatori, è stato dimostrato che la membrane type 1 MMP (MT1-MMP), una MMP che lega la membrana, gioca un ruolo cruciale nell’attivazione della gelatinase MMP-2 alla superficie cellulare. Anche le attività catalitiche delle MMP sono parzialmente controllate da inibitori specifici chiamati inibitori del tessuto delle MMP (TIMP). Tra questi, il TIMP-3 promuove specificatamente la morte per apoptosi delle cellule muscolari lisce, che contribuiscono a ridurre la formazione di neointime in vitro e in vivo. Così, si è cominciato a pensare che un bilancio alterato tra MMP e TIMP possa portare ad una distruzione incontrollata di elastina e collagene all’interno della parete aortica e allo sviluppo dell’AAA. C’è un considerevole interesse nel capire i meccanismi cellulari e biochimici che sottolineano il rimodellamento tissutale negli aneurismi. Risultati di recenti studi hanno mostrato un ruolo centrale per alcune particolari MMP nella patogenesi degli AAA. Per esempio, sono state riportate le espressioni delle gelatinasi 2 e 9 e della metalloelastase MMP-12 a livello di mRNA e di proteine nei tessuti degli AAA in comparazione con aorte sane. Il ruolo chiave delle MMP nello sviluppo di AAA è anche fortemente supportato da dati che mostrano che inibitori delle MMP sintetici e il TIMP-118 blocca la crescita dell’aneurisma in un modello di topo.
Una delle caratteristiche degli aneurismi aterosclerotici dell’aorta è la diffusa distruzione proteolitica delle proteine strutturali di matrice nella parete aortica, particolarmente l’elastina. Si pensa che la degradazione dell’elastina sia determinata in larga parte dalle MMPs, una famiglia di enzimi secreti dalle cellule muscolari lisce e dai macrofagi.
Vari tipi di MMPs sono capaci di degradare le componenti chiave della matrice extracellulare, come l’elastina, il collagene e i proteoglicani.
Le più importanti MMPs documentate in esperimenti in vitro e su animali sono: MMP-2 (gelatinasi A), MMP-9 (gelatinasi B) e MMP-12 (elastasi macrofagica); diversi studi hanno mostrato che i pazienti portatori di un aneurisma aterosclerotico hanno livelli sierici elevati di queste MMPs se confrontati con individui sani.
Il dato interessante è che i topi mancanti del gene MMP-9 non sviluppano aneurismi aterosclerotici in nessun segmento aortico, ma essi riacquistano questa capacità subito dopo un trapianto di midollo osseo con ricostituzione delle cellule ematiche e riacquistata capacità di produrre la MMP-9.
Le MMPs sono regolate da una famiglia di inibitori endogeni (TIMPs), che si ritrovano aumentati nel tessuto aneurismatico. Nelle pareti aortiche aneurismatiche c’è un concomitante aumento sia delle MMPs che delle TIMPs, a favore dell’esistenza di meccanismi che tendono a prevenire la progressione della “degradazione aneurismatica” : topi mancanti del gene TIMP-1 mostrano aneurismi aterosclerotici di grosse dimensioni.
La conoscenza del ruolo svolto dalle MMPs soprattutto nello sviluppo degli aneurismi aterosclerotici dell’aorta addominale sottorenale ha fatto in modo che l’inibizione delle MMPs si possa affermare come logica strategia terapeutica, il cui obiettivo è quello di sopprimere lo sviluppo e la crescita degli aneurismi aterosclerotici, quando questi si trovano nelle fasi iniziali della propria Evoluzione. Basandosi sul fatto che le tetracicline mostrano sostanziali proprietà anti-metalloproteinasiche, è stato provato che il trattamento con la doxiciclina può effettivamente sopprimere lo sviluppo di aneurismi creati sperimentalmente in animali di laboratorio. Il trattamento con la doxiciclina sopprime anche l’espressione della MMP-9 nei tessuti aneurismatici umani e recenti studi dimostrano anche che la doxiciclina riduce i livelli sierici di questa MMPs. Uno studio clinico randomizzato hadimostrato che la doxiciclina può avere effetti benefici anche sul tasso di crescita degli aneurismi.
In definitiva, l’aneurisma aterosclerotico dell’aorta può essere considerato come una patologia causata da uno squilibrio tra la distruzione della matrice extracellulare e la sua riparazione; studi sperimentali dimostrano che la produzione di collagene è necessaria per stabilizzare la parete aortica aneurismatica. Poiché il collagene è prodotto dalle cellule muscolari lisce della tonaca media
e dai fibroblasti, una riduzione di questi gruppi cellulari, per un fenomeno infiammatorio cronico, si traduce in una riduzione della capacità di riparazione della matrice extracellulare con impossibilità di bloccare l’evoluzione del processo aneurismatico.
Danno endoteliale e trattamento degli aneurismi
Fino a pochi anni fa, poiché la terapia medica era inefficace nel trattamento di queste patologie, la sopravvivenza dei pazienti era legata al solo trattamento chirurgico convenzionale, mentre ora essa si può avvalere anche del trattamento endovascolare, il cui obiettivo è quello di escludere l’aneurisma, mantenendo l’integrità e la pervietà dell’endoprotesi nel tempo.
Il trattamento chirurgico convenzionale consiste fondamentalmente nella resezione del tratto aortico malato e nell’interposizione di una protesi vascolare, mentre il trattamento endovascolare consta dell’inserimento di un’endoprotesi, che deve escludere l’aneurisma dal flusso sanguigno.
I dati fino ad ora pubblicati in letteratura sono chiari nell’affermare che il trattamento endovascolare delle patologie aneurismatiche dell’aorta si sta affermando come trattamento di scelta per una minore percentuale di morbilità e di mortalità rispetto all’approccio chirurgico tradizionale, anche se mancano ancora ampi follow-up a lungo termine.
Come già detto, il danno endoteliale è alla base delle patologie aneurismatiche dell’aorta; per questo, una volta effettuato il trattamento, chirurgico o endovascolare, il danno endoteliale dovrebbe scomparire. La persistenza del danno endoteliale dopo trattamento endovascolare è alla base della formazione degli endoleaks.
L’endoleak, che rappresenta attualmente il punto debole di tutte le procedure endovascolari, è la persistenza di flusso ematico nello spazio periprotesico; nella maggior parte dei casi, la persistenza di flusso, associata o meno ad alta pressione diastolica, comporta espansione dell’aneurisma e incremento del rischio di rottura dell’aorta.
L’endoleak può essere generato da un’incompleta adesione dell’endoprotesi alla parete aortica o derivare dalla vascolarizzazione aortica stessa, come per esempio da un’arteria collaterale dell’aorta che va a rifornire per via retrograda l’aneurisma escluso dalla protesi; sia nel primo che nel secondo caso il danno endoteliale ha un ruolo di primo piano.
Sostanzialmente, l’endoprotesi aortica determina danni sulla tonaca endoteliale dell’aorta stessa. Tali danni si realizzano soprattutto nei confronti di quelle zone dove l’endoprotesi si ancora: i colletti prossimale e distale. Qui il danno endoteliale determina scollamento della protesi dalla tonaca endoteliale con possibile insorgenza di endoleak tipo I .
L’endoleak tipo I, quindi, non è solo una complicanza connessa al dispositivo endoprotesico, ma è anche una complicanza legata al danno endoteliale prodotto dall’endoprotesi. La diagnostica degli
endoleaks tipo I è fondamentalmente strumentale; essa si realizza con l’ecocardiografia transesofagea e l’angiografia durante la procedura endovascolare e con l’angio-TC e l’angio-RMN nel follow-up a breve e lungo termine.
Valutazione laboratoristica del danno endoteliale
A parte la diagnostica strumentale, è possibile valutare il danno endoteliale con esami di laboratorio; negli ultimi anni si è andato affermando, nei pazienti che hanno subito l’impianto di un’endoprotesi in aorta, il dosaggio sierico delle MMPs, che vengono considerate come possibili markers di danno endoteliale.
Come già detto in precedenza, le MMPs sono coinvolte nella formazione degli aneurismi aterosclerotici dell’aorta sia nel suo tratto addominale sottorenale sia nel suo segmento toracico discendente; quindi, il grosso limite del dosaggio delle MMPs nei pazienti sottoposti ad impianto di un’endoprotesi aortica sta nel fatto che esso ha un suo razionale solo per quei pazienti che hanno subito la riparazione endovascolare di un aneurisma aterosclerotico.
Alcuni studiosi hanno dimostrato che i livelli sierici di MMP-9 di pazienti con un aneurisma aterosclerotico dell’aorta addominale sottorenale tornano nella norma più velocemente nei pazienti che ricevono il trattamento endovascolare rispetto a quelli che vengono sottoposti a trattamento chirurgico convenzionale; nel caso in cui ci si trovi di fronte alla presenza di un endoleak nei pazienti trattati per via endovascolare, i livelli ematici di MMP-9 restano costantemente elevati. Questi autori concludono il loro studio affermando che l’MMP-9 può essere usato come marker per la scomparsa del danno endoteliale dopo il trattamento sia chirurgico che endovascolare ed inoltre può essere considerato un buon marker laboratoristico per la diagnosi non strumentale degli endoleaks.
I valori plasmatici normali di MMP-9 variano a seconda dei laboratori e sono compresi generalmente tra 7 e 62 ng/ml, mentre i valori nei pazienti con un aneurisma aterosclerotico documentato sono correlati con il diametro dell’aneurisma stesso e sono comunemente compresi tra 86 e 402 ng/ml.
Alcuni autori hanno addirittura proposto di usare le MMPs come markers per il followup di pazienti con un endoleak già diagnosticato senza la necessità di sottoporre i pazienti a continue indagini strumentali.
Riassumendo, numerose pubblicazioni hanno dimostrato che le MMPs sono coinvolte nella formazione dell’aneurisma aterosclerotico e i loro livelli plasmatici preoperatori sono correlati anche con il diametro dell’aneurisma stesso; dopo trattamento endovascolare i valori tornano nella norma (figura 1), tranne nel caso in cui ci sia un endoleak, soprattutto tipo I, che rifornisca la sacca
e non permetta la diminuzione dei livelli sierici delle MMPs (figura 2). Quindi, i livelli sierici delle MMPs possono essere usati sia per valutare il danno endoteliale sia per seguire nel tempo i pazienti con un endoleak già diagnosticato senza l’esigenza di sottoporre questi pazienti ad ulteriori esami strumentali ravvicinati nel tempo.
Discussione
Il nesso di causalità tra aterosclerosi e formazione degli aneurismi dell’aorta è oggetto di discussione in letteratura, con dati che non sembrano confermare in tutti i casi questa stretta connessione; l’assioma “niente aterosclerosi – niente aneurisma” continua ad essere una semplificazione del problema sempre più obsoleta.
A tal proposito, numerosi studi hanno cercato di indagare un’eventuale predisposizione genetica per la formazione degli aneurismi aortici. Ultimamente, vari studi hanno identificato i geni delle MMPs e degli inibitori tissutali di queste proteine come possibili siti di mutazione per l’insorgenza di aneurismi dell’aorta; inoltre, recenti studi hanno indagato la possibilità che polimorfismi genici potessero essere alla base della patogenesi degli aneurismi dell’aorta.
Comunque, numerosi autori sono concordi nel riconoscere alle MMPs il ruolo di principale artefice nella formazione degli aneurismi; la degradazione dell’elastina e del collagene attuata dalle MMPs è fondamentale nella formazione e nella crescita degli aneurismi dell’aorta.
Alla degradazione di queste proteine strutturali si associa generalmente una mancata inibizione da parte degli inibitori tissutali delle metalloproteinasi, testimoniando il fatto che alla base della formazione degli aneurismi dell’aorta esiste uno squilibrio tra sintesi e riparazione della matrice extracellulare.
Basandosi sull’evidenza del coinvolgimento delle MMPs nella formazione degli aneurismi e considerando le proprietà anti-metalloproteinasiche delle tetracicline, numerosi studi sono stati rivolti ad indagare la regressione di piccoli aneurismi in seguito alla somministrazione di doxiciclina. Sono stati riportati risultati eccezionali con la somministrazione continua di doxiciclina a pazienti con piccoli aneurismi dell’aorta addominale sottorenale; studiosi hanno chiarito che la doxiciclina inibisce la metalloproteinasi tipo 2 ed inoltre hanno definito i meccanismi con cui questa inibizione avviene.
Inoltre, numerosi autori hanno cercato di identificare altre nuove strategie terapeutiche per inibire la formazione e la crescita degli aneurismi dell’aorta; è stato anche dimostrato che la crescita degli aneurismi dell’aorta addominale sottorenale può essere bloccata con la somministrazione di trapidil, un agente antipiastrinico che inibisce le MMPs tramite l’inibizione della via del CD40 – CD40 ligando. Infine, si è vista l’importanza dello stress ossidativo nella formazione degli aneurismi
aterosclerotici dell’aorta toracica discendente; partendo da questo principio, essi hanno dimostrato che la somministrazione di farmaci che riducono lo stress ossidativo, come le statine e gli inibitori del recettore tipo 1 dell’angiotensina II, possono bloccare la crescita di aneurismi che si localizzano in aorta toracica.
Una volta che è avvenuto il trattamento dell’aneurisma, chirurgico o endovascolare, il danno endoteliale deve scomparire; dopo trattamento endovascolare la persistenza del danno endoteliale può essere alla base dello sviluppo della complicanza più frequente e più temuta della procedura endovascolare: l’endoleak. Queste considerazioni hanno fatto in modo che si sviluppasse il dosaggio routinario preoperatorio delle MMPs nei pazienti che devono essere sottoposti a trattamento. Numerosi autori hanno descritto in letteratura la loro esperienza con il dosaggio di queste proteine e alcuni autori concludono che alcuni tipi di MMPs possono essere usati come markers per la riduzione o scomparsa del danno endoteliale, che testimonierebbe indirettamente la buona riuscita dell’intervento, chirurgico o endovascolare.
Nel caso in cui dopo trattamento endovascolare ci siano ancora elevati livelli sierici di metalloproteinasi allora è ipotizzabile che ci sia persistenza del danno endoteliale con probabile presenza di un endoleak. Il dosaggio laboratoristico delle MMPs nel periodo postoperatorio dopo procedura endovascolare è utilizzato da molti centri per non sottoporre i pazienti a ripetuti esami strumentali.
Riassumendo, le basi patogenetiche della formazione degli aneurismi dell’aorta cominciano a delinearsi proponendo come protagoniste incontrastate le MMPs, il cui ruolo è ampiamente stato definito in letteratura. Ciò nonostante restano ancora punti oscuri riguardo soprattutto al dosaggio di queste proteine e alla loro inibizione con farmaci dalle spiccate proprietà antimetalloproteinasiche. Infine, in futuro, sicuramente si cercheranno di chiarire ulteriormente i meccanismi della formazione degli aneurismi con la possibilità che nuove vie patogenetiche facciano la loro comparsa in letteratura come possibili protagoniste o coprotagoniste di questo processo patogenetico.