INDICE:
1 INQUINAMENTO DA OZONO TROPOSFERICO... 3
1.1 MONITORAGGIO ED ESPOSIZIONE ALL’OZONO DEGLI ECOSISTEMI FORESTALI... 3
1.2 CARATTERISTICHE E GENESI DELL’OZONO TROPOSFERICO... 18
1.3 INGRESSO DELL’OZONO E FORMAZIONE DELLE ROS ... 22
1.4 MECCANISMI DI RISPOSTA DELLE PIANTE ALL’OZONO ... 27
1.4.1 Acido ascorbico ... 33
1.4.2 Glutatione ... 40
1.4.3 Enzimi del ciclo di Halliwell-Asada... 40
1.5 ETILENDIUREA (EDU) ... 44
2 SCOPO DELLA TESI... 52
3 MATERIALI E METODI... 54
3.1 SELEZIONE DELLE PIANTE E TRATTAMENTO CON EDU... 54
3.2 PARAMETRI DI CRESCITA ... 56
3.3 PARAMETRI FISIOLOGICI ... 56
3.3.1 Misura degli scambi gassosi e della fluorescenza della clorofilla a... 56
3.4 PARAMETRI BIOCHIMICI ... 57
3.4.1 Estrazione del liquido apoplastico... 57
3.4.2 Estrazione degli enzimi antiossidanti dal materiale residuo cellulare (RCM) ... 57
3.4.3 Determinazione delle attività enzimatiche ... 58
• Ascorbico perossidasi (APX) ... 58
• Deidroascorbico riduttasi (DHAse)... 58
• Glutatione riduttasi (GR)... 58
• Determinazione del contenuto proteico ... 59
3.4.4 Determinazione del contenuto di azoto (N) fogliare ... 59
3.4.5 Determinazione del contenuto di acido ascorbico e deidroascorbico... 59
3.4.6 Determinazione del contenuto di H2O2... 60
3.4.7 Determinazione del contenuto delle sostanze che reagiscono con l’acido tiobarbiturico ... 60
3.4.8 Estrazione e determinazione del contenuto di pigmenti fotosintetici... 60
3.5 ANALISI STATISTICA ... 61
4.1 PARAMETRI DI CRESCITA ... 62
4.2 PARAMETRI FISIOLOGICI ... 63
4.2.1 Valutazione degli scambi gassosi e della fluorescenza della clorofilla a... 63
4.3 PARAMETRI BIOCHIMICI ... 64
4.3.1 Azoto (N) totale... 64
4.3.2 Contenuto di perossido di idrogeno (H2O2)... 65
4.3.3 Stima della perossidazione lipidica ... 66
4.3.4 Sistemi antiossidanti... 67
4.3. 4 a Contenuto di acido ascorbico e deidroascorbico... 67
• APOPLASTO... 67
• SIMPLASTO... 69
4.3.4 b Ascorbico perossidasi (APX)... 70
• APOPLASTO ... 70
• SIMPLASTO... 71
4.3.5 Deidroascorbico riduttasi (DHAse) e glutatione riduttasi (GR)... 72
4.3.6 Contenuto fogliare in pigmenti fotosintetici ed accessori ... 74
5 DISCUSSIONE... 77
INTRODUZIONE
1 INQUINAMENTO DA OZONO TROPOSFERICO
1.1 MONITORAGGIO ED ESPOSIZIONE ALL’OZONO DEGLI ECOSISTEMI FORESTALI
Dalla fine degli anni ’70 le preoccupazioni generate dalla drammatica perdita di vitalità della vegetazione forestale in Europa centrale e nel Nord America, associata alla crescente consapevolezza dell’importanza degli ecosistemi forestali sia da un punto di vista ecologico che economico, ha gettato le basi per una serie di studi volti a ricercare le cause responsabili del cosiddetto “forest decline”. I principali sintomi osservati in relazione a questo fenomeno erano: ingiallimento e perdita delle foglie, riduzione della crescita del diametro del fusto, prematuro declino della crescita in altezza del fusto, morte delle radici assorbenti, produzione di rami di forma e lunghezza anormale, eccessiva produzione di gemme avventizie ed alterazione della frequenza di fruttificazione (Borghetti e Giannini, 1998).
Tale graduale deterioramento sembrava non essere riconducibile a fattori di stress ben precisi di natura biotica ed abiotica, perciò si cominciò a parlare di “danno di nuovo tipo”. I danni osservati, possono essere infatti visti come il risultato di un complesso di interazioni tra fattori di stress considerati “tradizionali” (alterazioni climatiche, disponibilità di nutrienti e di acqua, azione dei patogeni) e gli agenti inquinanti atmosferici ritenuti come i principali responsabili del forest decline (Schmieden e Wild, 1995; Olson et al., 1992). Questo fenomeno è stato così sempre più messo in correlazione con i danni indotti dall’inquinamento atmosferico (Ciesla e Donabauer, 1994), che nel bacino del Mediterraneo rappresenta infatti una delle principali cause del deperimento delle specie arboree (Inclán et al., 1999, Fumagalli et al., 2001), manifestandosi, non solo attraverso un’azione fitotossica diretta, ma anche inducendo nelle piante un’aumentata suscettibilità a fattori stressanti abiotici e a malattie parassitarie, soprattutto secondarie ed opportunistiche. Per questo motivo vennero svolte diverse indagini per comprendere i presunti effetti avversi degli inquinanti atmosferici sulle foreste (Schütt e Cowling, 1985; Innes, 1993; Ferretti, 1997).
Le prime indagini condotte a livello europeo evidenziarono che tale fenomeno di deperimento, responsabile della morte delle foreste, era limitato e localizzato alle regioni cosiddette “triangolo nero” (Skelly e Innes, 1994; Kandler e Innes, 1995) (Cecoslovacchia,
Polonia e Germania). Bisogna però sottolineare che la maggior parte degli studi interessarono gli alberi di abete rosso, abete e faggio presenti in Europa centrale (Innes, 1993), e pochi furono rivolti al potenziale impatto degli inquinanti sulle foreste del Sud Europa, dove la composizione delle specie e la loro associazione, le pratiche gestionali, l’impatto antropico e le attuali condizioni ambientali e climatiche, differivano molto da quelle presenti nell’Europa centrale e settentrionale. Infatti, l’alta radiazione solare, la diffusa emissione dei precursori degli ossidanti fotochimici (NOX, VOCs, NMHC) e i
prolungati periodi di siccità, suggerivano che specifici inquinanti e le interazioni siccità-inquinante potessero diventare fattori di stress addizionali per le piante (Naveh et al., 1980; Lorenzini, 1993; Schenone, 1993), contribuendo a rendere le foreste del sud potenzialmente sensibili alle fluttuazione e cambiamenti climatici (Kräuchi, 1993; Naveh, 1995). Sulla base di queste considerazioni alla fine degli anni 80, maggiori attenzioni sono state poste alle foreste del Mediterraneo (Clauser et al., 1989; Bussotti et al., 1992a,b).
E’ attualmente accertato che i cambiamenti climatici e gli inquinanti atmosferici sono due fattori fortemente legati, sebbene in molte ricerche scientifiche applicate e nelle negoziazioni politiche vengano ancora considerati separatamente.
In particolare l’inquinate più interessante per i suoi effetti negativi sulle foreste e le sue relazioni col cambiamento climatico è l’ozono (O3) troposferico. L’aumento della
temperatura e della radiazione solare assumono un ruolo rilevante per la loro capacità di promuovere l’incremento dell’O3 atmosferico, in presenza dei suoi precursori. A sua volta,
un elevato livello di base di O3 influenza il clima sia direttamente, per il fatto di essere un
potente gas serra, che indirettamente, in quanto va a influenzare la concentrazione di altri gas serra come il metano. In Europa, il bacino Mediterraneo, e l’Italia in particolare, sono considerati aree a maggior rischio di O3 a causa delle condizioni climatiche prevalenti
(Paoletti et al., 2005b).
Nell’ambito del deperimento forestale, l’ozono riveste quindi un ruolo importante per il fatto di esercitare la propria fitotossicità anche a concentrazioni piuttosto basse.
L’ozono è un normale componente gassoso della troposfera. L’emissione dei composti organici volatili (VOC) e l’ossido di azoto (NOx), prodotti dalle combustioni antropogeniche, interferiscono con il normale ciclo ossidativo fotochimico di formazione e degradazione dell’O3, determinando incrementi della concentrazione di O3 rispetto ai
livelli naturali (ambientali) (Stockwell et al., 1997). Quando si verifica questa condizione l’O3 diventa un inquinante, con effetti avversi sulla salute umana e delle piante (US EPA,
ma in espansione anche in quelli in via di sviluppo (Vingarzan, 2004); inoltre, contrariamente a quanto si potrebbe immaginare frequentemente le concentrazioni di O3
sono più elevate nelle aree rurali che in quelle urbane (Paoletti et al., 2005b).
Su scala mondiale si assiste ad una riduzione generalizzata dei picchi di concentrazione dell’ozono ambientale, che risultano meno frequenti grazie alle locali diminuzioni delle VOC e dell’NOx ottenute attraverso il progresso tecnologico, come ad esempio le marmitte catalitiche e alle limitazioni normative, mentre sono aumentati i livelli medi annuali, secondo un trend che sembra venga sostenuto anche in futuro. In Europa ad esempio la concentrazione media annua di O3 è aumentata di circa l’8% dal 1996, mentre
le concentrazioni massime di breve periodo hanno mostrato un trend decrescente durante il periodo 1990-2000, in accordo con la diminuzione del 29% dell’emissione dei precursori dell’O3 nell’UE (Unione Europea) (EEA, 2003). La spiegazione di questo cambiamento è
stata attribuita al trasporto dell’O3, e dei suoi precursori, dall’Asia, attraverso il Nord
America, all’Europa (Lin et al., 2000; Coyle et al., 2003; Simmonds et al., 2004; Vingarzan, 2004). Infatti, in molte regioni asiatiche in via di sviluppo, America latina ed Africa, l’aumento delle concentrazioni basali è accompagnato dall’incremento delle emissioni deiprecursori dell’O3, suggerendo che l’impatto dell’inquinante sulle foreste e
sulleculture diventerà molto significativo in queste aree (Emberson et al., 2003).Studi e monitoraggi condotti alle medie latitudini dell’emisfero settentrionale suggeriscono un incremento annuale delle concentrazioni basali di O3 compreso tra lo 0,5 e il 2%
(Vingarzan, 2004), dovuto soprattutto all’incremento a livello mondiale delle emissioni degli ossidi di azoto. Un aumento nelle concentrazioni ambientali di O3 di pochi ppb
potrebbe avere un più grande impatto sulla vegetazione rispetto ad una diminuzione nella concentrazione dei picchi di 5-15 ppb (Grennfelt, 2004). Questo trasporto quindi contribuisce a mantenere alti livelli basali di O3 anche nelle aree remote, facendo stimare
concentrazioni dell’inquinante potenzialmente tossiche, tali da causare danni fogliari e riduzione delle crescita (Fig.1.1).
Figura 1.1. Superficie forestale globale in cui i picchi di concentrazione in Luglio superano il valore di 60 ppb (Fowler et al., 1999).
Come mostrato dalla figura 1.1, la distribuzione su scala globale dell’O3 evidenzia
come nel periodo compreso tra il 1950 e il 1970 la superficie forestale complessiva esposta a concentrazioni di O3 maggiori di 60 ppb sia triplicata. Dal 1990 l’esposizione a tale
concentrazione ha interessato il 24% della superficie forestale globale ed in base alle previsioni questa percentuale arriverà nel 2100 al 50%, risultando pari a circa 17 milioni di km2 di foreste (Fowler et al., 1999). Si tratta di una previsione allarmante, dal momento che piante con un’elevata sensibilità nei confronti dell’inquinante sono già a rischio in presenza di 40 ppb di O3 (Holopainen, 1996).
In quest’ottica i Paesi mediterranei costituiscono l’area europea con le concentrazioni di O3 più elevate; per esempio in Italia si registrano livelli che sono in media 3 volte
Figura 1.2. Valori medi di AOT40 forestale misurati nel periodo 2000-2003 in Italia (Ferretti et al., 2007).
In America del nord e in Europa occidentale l’entità delle emissioni dei precursori dell’O3 si sono ridotte di circa il 30% tra il 1990 ed il 2000 (EEA, European Environment
Agency,2003). Come evidenziato dalle figure 1.3 e 1.4, tale decremento continua tutt’oggi e, in base a quanto riportato in “Europe’s environment: the third assessment” (2003), i modellidi previsione per il 2010 mostrano una riduzione dell’esposizione a concentrazioni di O3 troposferico superiori ai valori soglia.
Figura 1.3. Emissioni di NOx da processi industriali e dal comparto energetico. Anni 2000-2015. (Rains = modello matematico di riferimento; NEC/Gothenburg Target = obiettivi europei per il 2010) (Fonte: elaborazione ENEA su dati ENEA/APAT)
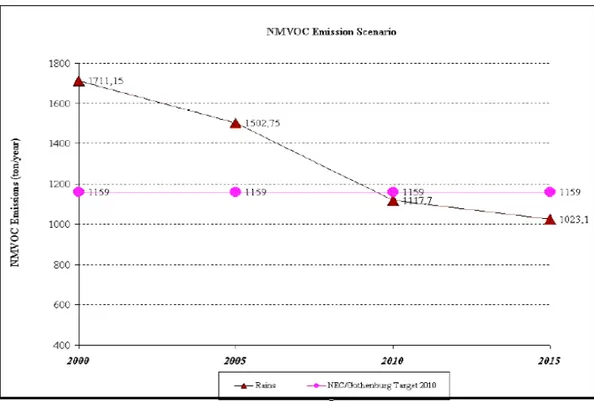
Figura 1.4. Emissioni di composti organi volatili (COV). Anni 2000-2015. (Rains = modello matematico di riferimento; NEC/Gothenburg Target = obiettivi europei per il 2010) (Fonte: elaborazione ENEA su dati ENEA/APAT).
Tutte queste considerazioni mettono in evidenza il fatto che i livelli di O3 in Europa
non dipendano soltanto dalla nostra politica di emissioni, ma anche da quella di altri continenti (Derwent et al., 2004) e per tale motivo l’inquinamento da O3 è passato da
considerazioni fatte su scala locale a quella su scala globale.
L’Europa, ed in particolar modo quella meridionale, è interessata da concentrazioni molto elevate di O3 soprattutto nella stagione estiva, quando le condizioni di temperatura e
luce sono più favorevoli alla sua produzione (Lorenzini et al., 1994, Nolle et al., 2002). In particolare, in Italia esse superano i limiti stabiliti per proteggere la salute umana e la vegetazione (EEA, 2003, 2005).
Proprio per far fronte a tale problema, a partire dai primi anni ’90 dello scorso secolo, l’Unione Europea ha iniziato a sviluppare una politica mirata alla riduzione della concentrazione atmosferica di O3, come di altri inquinanti dannosi per gli ecosistemi
vegetali. Oggi, il testo a cui ogni Stato europeo deve far riferimento è la Direttiva 2002/3/CE, recepita in Italia con il D.Lgs n.183 del 21/05/2004, in cui sono stati fissati gli obiettivi primari a lungo termine, le soglie di allerta e le soglie di informazione per evitare, prevenire o ridurre gli effetti dannosi dell’O3 sulla salute umana (Tabella 1.1) e
sull’ambiente. In tale direttiva sono stati forniti metodi e criteri per la valutazione della concentrazione ambiente di O3, sulla base della quale rendere disponibili per la
popolazione adeguate informazioni ed inoltre è stata promossa una sempre maggiore collaborazione tra gli Stati membri per la riduzione dei livelli di tale inquinante.
Tabella 1.1: Valori soglia, obiettivi a lungo termine e valori bersaglio di concentrazione di ozono per la protezione della salute umana, come previsto dalla Direttiva 2002/3/CEE (EEA, 2005).
Obiettivo Valore (µ/m3) Obiettivo
Soglia di informazione 180 Media su 1 ora
Soglia di allarme 240 Media su 1 ora
Obiettivo a lungo termine 120 Media su 8 ore, massimo giornaliero Valore bersaglio 120 Media su 8 ore, massimo giornaliero
In previsione della prossima applicazione della Dir. 2002/03/CE in Italia, prevista a regime per il 2010, è quindi indispensabile aumentare le conoscenze sui livelli di O3 e dei
suoi reali effetti sulla vegetazione; il monitoraggio degli ecosistemi forestali è quindi un importante strumento per capire la relazione O3-vegetazione. A tal fine diversi ricercatori
hanno tentato di definire standard di qualità dell’aria per l’O3 (Gregor et al., 2001;
Ashmore et al., 2004; Musselman et al., 2006; Wieser e Tausz, 2007; EPA, 2007).
L’indice di esposizione si basa sul concetto di “dose effettiva”, ossia deve rilevare le caratteristiche dell’esposizione che più direttamente sono correlate con la quantità di O3
assorbita dalla vegetazione (Grünhage e Jäger, 1994).
Per stimare il rischio per le colture e le foreste, l’indice più appropriato deve essere di tipo cumulativo, in quanto generalmente le specie vegetali risultano interessate da un’esposizione di tipo cronico, ossia a basse concentrazioni di inquinante per lunghi periodi di tempo. A tale proposito, si fa riferimento al concetto di livello critico, definito come “la concentrazione, l’esposizione cumulativa o il flusso stomatico cumulativo dell’inquinante atmosferico al di sopra della quale possono verificarsi effetti negativi sui recettori, come le piante, gli ecosistemi ed i materiali, sulla base delle conoscenze attuali” (UN/ECE, 2004).
Nell’area UN/ECE i due principali approcci al concetto di livello critico (CLe) sono: - livello critico basato sulla concentrazione (CLec),
- livello critico basato sul flusso (CLef).
Essi identificano l’esposizione cumulativa (O3 cumulato al di sopra di una soglia di x
ppb, AOTx) o il flusso cumulativo (flusso di O3 cumulato, al di sopra una soglia y, AFsty)
che causa una riduzione dal 5% del raccolto (UN/ECE, 2004).
Il livello critico che comunemente viene adottato per l’O3 si basa sull’indice di
esposizione cumulativa AOT40 (Accumulated Ozone Exposure Over a Threshold Concentration of 40 ppb) (UBA, 1996). Questo indice è espresso come sommatoria delle eccedenze delle concentrazioni medie orarie di O3 al di sopra del valore di 40 ppb in un
determinato intervallo di tempo ed è calcolato durante le ore del giorno in cui si registra una radiazione globale uguale o superiore a 50 W m-2. Vengono quindi escluse le ore notturne, durante le quali sono stati misurati soltanto valori trascurabili di deposizione dell’O3 sulle colture agricole e sulle specie arboree forestali (WHO, 2000).
Sulla base dell’AOT40 l’Europa ha stabilito i livelli critici per l’O3, oggi definiti
come quei valori sopra i quali ci si aspettano effetti negativi sulla crescita della vegetazione sensibile. Tali livelli sono stati fissati nella Direttiva 2002/03/CE, vincolando tutti gli stati membri dell’Unione.
Il livello critico (CLec) per gli ecosistemi forestali è stato fissato in 10.000 ppb h,
recentemente portata a 5.000 ppb h ma solo per le specie più sensibili e per le condizioni più favorevoli all’assorbimento di O3 (Karlsson et al., 2004), come media di 5 anni nelle
ore di luce della stagione vegetativa (aprile a settembre), mentre per le colture agrarie e gli ecosistemi seminaturali è stato fissato a 3.000 ppb h, calcolato nelle ore di luce nel periodo maggio-luglio (UN/ECE, 2004). Il livello di 6 ppm è riferito alle specie orticole e, per le nazioni che aderiscono all’UN/ECE (Italia inclusa), fino a 9 ppm all’ora di AOT40 per tutti i tipi di vegetazione.
Per quanto riguarda la situazione italiana, il Ministero delle Politiche Agricole e Forestali ha avviato nel 1995 il Programma Nazionale Integrato per il Controllo degli Ecosistemi Forestali (CONECOFOR) per il monitoraggio forestale intensivo, con l’obiettivo di studiare le interazioni ecologiche tra le componenti strutturali e funzionali degli ecosistemi forestali ed i fattori di pressione e di cambiamento su larga scala (inquinamento atmosferico, cambiamenti climatici, variazione dei livelli di biodiversità). Tale Programma, svolto nel quadro della Convenzione Internazionale UN/ECE sull'Inquinamento Atmosferico Transfrontaliero a Lungo Raggio ed in attuazione del Regolamento (CE) n. 2152/2003 sul monitoraggio delle foreste e delle interazioni ambientali (Forest Focus), è il primo ed unico esperimento riuscito di Rete ecologica a lungo termine su scala nazionale. Esso è basato su 31 aree permanenti sparse su tutto il territorio nazionale e rappresentative di tutte le principali comunità forestali italiane (faggete, peccete, cerrete, leccete, foreste planiziali, ecc.). I risultati ottenuti dal monitoraggio intensivo delle condizioni delle foreste su vasta scala, sia spaziale sia temporale, dovranno garantire una solida base scientifica su cui fondare i provvedimenti delle politiche ambientali internazionali in riferimento alla gestione delle foreste.
Le misure effettuate con i campionatori passivi dislocati presso le aree di monitoraggio permanente della Rete CONECOFOR, hanno stimato livelli di O3 pari a circa
15.000 ppb h in molti siti della Penisola e degli Appennini, con una punta massima annuale di 45.500 ppb h in Sicilia, tutti valori ben al di sopra della soglia di rischio per le piante stabilita a livello internazionale (10.000 ppb h). In base ai primi dati disponibili, la situazione degli altri Paesi europei partecipanti al Programma Paneuropeo di monitoraggio intensivo degli ecosistemi forestali appare a grandi linee analoga a quella italiana soltanto in Spagna, mentre sembra di gran lunga migliore nella zona centro europea, con valori al di sotto della soglia di danno di 10.000 ppb h. In molte delle aree di monitoraggio sono stati
osservati chiari sintomi dei danni arrecati dall’O3 alle foglie, mentre riduzioni
dell’accrescimento ed aumento della defogliazione delle piante sono risultati parzialmente correlabili all’azione dell’O3. Questi risultati costituiscono le prime evidenze sperimentali
dei potenziali effetti dell’inquinante atmosferico sulla vitalità delle foreste, la loro capacità di sequestro del carbonio ed il livello di biodiversità.
L’Italia (e l’Europa del sud in generale) sulla base dei dati ottenuti dalle stazioni di monitoraggio, localizzate prevalentemente nelle zone urbane e nelle aree sub-urbane (EEA, 2003, 2005), ha riportato il superamento dei livelli CLec. La figura 2.4 mostra i valori medi di AOT40 forestale nel periodo 2000-2003, ottenuti da 41 stazioni automatiche della rete nazionale di monitoraggio della qualità dell’aria e da 26 siti di campionamento passivo appartenenti al Programma CONECOFOR. Nel 98% dei siti forestali monitorati si registrava il superamento dei livelli critici, evidenziando, perciò, il grave rischio a cui sono sottoposte le nostre foreste.
Negli ultimi anni in Europa si è aperto un forte dibattito sulla possibilità di sostituire, per la valutazione del rischio su scala regionale, gli indici di esposizione con modelli di flusso cumulato, poiché questi ultimi tengono conto dell’influenza dei fattori climatici ed ontogenetici sull’assorbimento dell’O3, mentre gli indici di esposizione dipendono solo
dalle condizioni atmosferiche che determinano gli episodi fotochimici, prescindendo dalle caratteristiche degli organismi e dalle funzioni che regolano l’assunzione di O3 (Ashmore,
2005).
Gli indici di flusso che sono stati proposti da Pleijel et al. (2004), Karlsson et al. (2004) e Uddling et al. (2004) assumono un valore soglia di flusso al di sotto del quale non si hanno effetti da O3 e che può essere correlato con la capacità della pianta di detossificare
l’O3 assorbito.
Nonostante l’introduzione di modelli sempre più precisi e che considerano un sempre maggior numero di parametri ambientali, valutando i sintomi di piante forestali esposte alla presenza dell’O3, viene riscontrata la mancanza di una chiara relazione tra la frequenza ed
intensità dei sintomi e l’esposizione all’O3 (valutata utilizzando sia i livelli critici di
esposizione che di flusso) (Bussotti et al., 2003; Ferretti et al., 2004; Ferretti et al., 2007). Ciò è probabilmente dovuto alle seguenti cause:
- mancata specificità degli indicatori utilizzati per monitorare gli effetti dell’O3
(produttività, diametro del fusto, sintomi fogliari visibili, trasparenza della chioma), che possono essere soggetti a variazioni anche ad opera di differenti fattori di stress;
- inadeguatezza dei livelli critici (CLec e CLef) fissati. I valori di AOT40, pari a
3.000 e 5.000 ppb h rispettivamente per le colture agrarie e per le foreste non risultano infatti realistici, ed inoltre gli stessi valori non possono essere applicati alle diverse condizioni ambientali e climatiche presenti in Europa;
- difficoltà, nella valutazione degli effetti dell’esposizione all’O3, di trasferire i valori
CLe (CLec e CLef), definiti in condizioni controllate e su semenzali alle situazioni reali, attraverso funzioni di risposta lineare. Infatti, nelle condizioni di campo, agiscono simultaneamente molti fattori, che possono modificare la risposta delle piante ad un singolo inquinante. E’ ormai assunto l’impossibilità di considerare i semenzali come surrogati degli alberi adulti (Manning, 2005);
- presenza di limitazioni ambientali all’uptake di tale inquinante e quindi al suo ingresso all’interno della pianta, soprattutto nell’Europa meridionale. Queste sono costituite dal deficit idrico estivo (riduce la conduttanza stomatica, e quindi l’uptake, proprio nel periodo caratterizzato dai livelli di O3 più elevati (Matyssek et al., 2007), e/o
dalla salinificazione delle acque superficiali (se utilizzate per irrigare riducono il potenziale idrico del suolo e possono quindi indurre condizioni di stress idrico). L’assorbimento dell’O3 è anche legato alle caratteristiche della vegetazione mediterranea, costituita
prevalentemente da sclerofille, che tollerano meglio l’O3 grazie al maggior spessore delle
foglie caratterizzate da piccoli spazi intercellulari, al basso tasso di traspirazione e alle forti emissioni di isoprenoidi, capaci di proteggere le membrane plasmatiche dagli stress ossidativi, come la siccità, elevate temperature e O3 (Loreto et al., 2004).
Le limitazioni che l’ambiente pone all’uptake di O3 costituiscono i fattori chiave che
portano ad attribuire una sempre maggiore importanza all’utilizzo di modelli e livelli critici basati sul flusso (UN/ECE, 2004), per il fatto di coinvolgere anche i fattori climatici e le caratteristiche della vegetazione presente. Tali modelli possono inoltre fornire le basi per previsioni sul futuro impatto di mutevoli esposizioni all’O3 in relazione ai cambiamenti del
clima (Ashmore, 2005).
Una debolezza generale dei modelli di flusso è che la concentrazione interna dell’O3
è assunta uguale a zero (Laisk et al., 1989). Moldau e Bichele (2002), hanno presentato dei dati relativi ad esperimenti con concentrazioni estreme di O3 (540-1140 nmol mol-1) che
indicavano basse concentrazioni interne, ma diverse da zero. Inoltre, in genere, il flusso stomatico di O3 non viene misurato, ma calcolato sulla base della conduttanza stomatica al
vapor d’acqua, moltiplicata per il coefficiente di conversione che tiene conto della diffusività dell’acqua e dell’O3. La misura diretta del flusso stomatico di O3 a livello
fogliare ha mostrato però che il calcolo convenzionale del flusso induce una sovrastima del 25-50% (Grulke et al., 2007). Se validato per l’area mediterranea ed inserito nei modelli di flusso di O3, questo risultato porterebbe a ridurre il rischio da O3 per le nostre foreste. Un
ulteriore difetto dei modelli attuali è che sono basati su misure di flusso a stato stazionario, mentre è stato dimostrato che uno degli effetti più subdoli dell’O3 è l’alterazione dei
meccanismi di chiusura stomatica in risposta agli stress (Paoletti, 2005a; Grulke et al., 2007). In seguito all’esposizione all’O3, infatti, gli stomi sono più lenti nel rispondere alla
riduzione dell’intensità luminosa e all’aumento dello stress idrico. Questo effetto è stato dimostrato in specie agrarie e forestali non native (Grulke et al., 2007), e in latifoglie sempreverdi mediterranee (A. unedo, Paoletti, 2005a). Un altro fattore non inserito nei modelli attuali è rappresentato dalla traspirazione notturna. In passato si pensava che le piante non traspirassero di notte perché gli stomi si chiudono in risposta al buio. Oggi sappiamo invece che molte specie arboree manifestano una parziale attività traspirativa anche di notte, per quanto il significato funzionale di questo fenomeno non sia ancora noto. La traspirazione notturna è stata riportata anche in piante esposte sperimentalmente e giornalmente all’O3 (Matyssek et al., 1995; Weiser e Havranek, 1995; Grulke et al., 2004,
2007). L’alterazione dei meccanismi di chiusura notturna degli stomi ad opera dell’O3,
oltre ad aggravare le perdite idriche notturne, aumenta la quantità di O3 assorbito nelle 24
ore. Inoltre, durante la notte il potenziale di detossificazione risulta più basso (Paoletti, 2006) e questo può generare seri danni in presenza di elevate concentrazioni notturne di O3, come accade nei siti remoti italiani (Paoletti et al., 2007d).
Il processo per la definizione di standard normativi basati sul flusso di O3 è
comunque lungo ed impegnativo (Paoletti e Manning, 2007), per cui gli standard basati sull’esposizione rappresentano ancora un metodo pratico per riassumere la qualità dell’aria (Paoletti et al., 2007d). Questo penalizza i paesi mediterranei, caratterizzati da livelli di O3
3 volte superiori a quelli del Nord Europa (Matyssek et al., 2007).
Tuttavia considerando solamente il periodo estivo, caratterizzato da deficit idrico, si riscontra un andamento analogo dei due indicatori. In base a considerazioni riguardanti la disponibilità idrica risulta infatti che l’AOT40 rappresenta un indicatore distorto
dell’uptake di O3 solo quando l’approvvigionamento idrico alle piante non è regolare. In
questo caso, infatti, i valori massimi di conduttanza stomatica variano da periodo a periodo e così anche i flussi stomatici. In condizioni xeriche, invece, la conduttanza stomatica (Gs) risulta essere costantemente vicina al suo valore minimo e quindi il flusso di O3 dipende
esclusivamente dalla sua concentrazione esterna. Risulta perciò che in ambienti serici, quali quello mediterraneo, l’AOT40 può rivestire ancora un ruolo importante come indicatore dell’uptake stomatico (Ferretti et al., 2007).
Un’ulteriore possibilità da vagliare sperimentalmente è l’utilizzo di un livello critico diversificato a seconda del tipo di vegetazione prevalente dell’area in esame, piuttosto che l’elaborazione di un unico indice sempre più complesso. Dato che le risposte all’O3 sono
specie-specifiche, occorre migliorare la conoscenza della sensibilità all’O3 delle nostre
specie forestali più rappresentative. Per definire la relazione dose-risposta nella vegetazione mediterranea gli esperimenti devono essere condotti nelle condizioni più realistiche possibili ed in sinergia con gli altri fattori, in particolare siccità e aumento della CO2 atmosferica.
Come evidenziato all’ultimo convegno per “Specialist in Air Pollution Effects on Forest Ecosystems” (Paoletti et al., 2007f), per approfondire la conoscenza degli effetti dell’O3 sulle foreste, è necessario comprendere e quantificare i meccanismi biochimici di
detossificazione e di riparazione del danno ed includere questi parametri nei modelli di flusso.
Per migliorare i modelli di valutazione del rischio da O3 è opportuno quindi passare
dagli indici di esposizione tipo AOT40 ad indici basati sul flusso effettivo di O3, inclusivo
sia dei meccanismi di evitanza che quelli di detossificazione e riparazione del danno (Matyssek et al., 2007).
Per misurare le concentrazioni di O3 generalmente si usano tre tipi di tecniche:
analitiche, passive o biologiche. Le centraline automatiche di monitoraggio contengono sofisticati strumenti analitici che misurano non solo l’O3 ma anche altri inquinanti (ossidi
di azoto, polveri…). I detector per l’O3 generalmente si basano sull’assorbimento dell’UV,
che è selettivo per l’O3 e fornisce informazioni veloci, affidabili e sicure. Tramite i dati in
continuo si può calcolare l’indice di esposizione all’O3, l’AOT40 (de Leeuw e van
Zantvoort, 1997). La rete italiana di rilevamento dell’O3 non ha una distribuzione
omogenea sul territorio delle centraline di monitoraggio che risultano invece concentrate prevalentemente nelle aree urbane, sia perché sono alimentate a corrente, sia perché
l’interesse è concentrato sugli effetti degli inquinanti sulla popolazione, che vive prevalentemente nelle città. La mancanza di stazioni di rilevamento nelle aree rurali non permette di comprendere appieno l’esposizione all’O3 delle nostre foreste.
Esistono diversi tipi di campionatori passivi per l’O3. Un esempio è costituito da
campionatori basati sulla reazione tra l’indaco e l’O3 che porta alla formazione di isatina,
determinabile per via spettrofotometrica (Buffoni, 2002). In laboratorio si determina la quantità di composto che ha reagito e, quindi, la concentrazione dell’inquinante nel periodo in cui il campionatore è stato esposto all’aria (in genere 15 giorni). Il campionamento passivo fornisce un dato cumulato (giorno e notte nel periodo di esposizione). Recentemente sono state sviluppate delle tecniche che permettono con buona approssimazione di derivare l’AOT40 anche dai campionatori passivi (Tuovinen, 2002).
Per conoscere il livello di O3 in ambienti rurali, oltre all’uso dei campionamenti
passivi, si può ricorrere al biomonitoraggio, cioè all’uso di un organismo per ottenere informazioni sulla qualità dell’ambiente (Matthews et al., 1982). Tale sistema di analisi valuta gli effetti integrati dell’inquinamento e dei fattori che possono intervenire a modificare la risposta delle piante agli inquinanti (fattori ambientali, stato fisiologico della pianta stessa). Il biomonitoraggio, è pertanto in grado di fornire informazioni sul rischio biologico associato all’esposizione (Paoletti et al., 2005a). Il bioindicatore oggi più diffuso a livello internazionale è rappresentato da una cultivar di trifoglio (Trifolium repens cv Regal) con due suoi cloni: NC resistente e NC sensibile (http://icpvegetation.ceh.ac.uk/). Dal momento che questo trifoglio non si adatta bene al clima mediterraneo, soffrendo di numerose avversità parassitarie, nelle regioni che presentano tali condizioni il bioindicatore più classico è rappresentato dalla cv di tabacco (Nicotiana tabacum) Bel W3. Attualmente, tuttavia, in Italia non sono disponibili inventari nazionali di biomonitoraggio dell’ozono (Paoletti et al., 2005a).
Finora gli indicatori più utilizzati per caratterizzare i danni da O3 sulle foreste in
campo sono stati i sintomi visibili tipo-ozono ed i parametri di crescita. Il parametro più comunemente usato in Europa è la defogliazione (trasparenza delle chiome) che è comunque altamente aspecifico dipendendo da una molteplicità di fattori, quali le specie, il genotipo, le proprietà del suolo e del clima, la gestione forestale, la competizione per le risorse ed altri (Ferretti et al., 2003b). I risultati di 10 anni di monitoraggio lungo una griglia 16x16 km in Europa hanno mostrato che la defogliazione aumenta al crescere del livello di O3 e che questo aumento è più marcato in una specie mesofila come il faggio che
non in una xero-torrelante come il leccio (Klap et al., 2000). Un’analisi della variazione geografica delle condizioni delle chiome ha evidenziato che i maggiori valori di defogliazione si osservavano nelle regioni meridionali, in particolare per il faggio, attribuendo però questa risposta all’adattamento allo stress idrico (Bussotti et al., 2001).
Oggi l’attenzione sugli effetti visibili dell’O3 si concentra sui così detti danni fogliari
tipo-ozono (Paoletti e Schaub, 2002). La variabilità dei sintomi facilita gli errori diagnostici, per cui è corretto riferirsi solo ai sintomi attribuibili ad O3 (appunto
“tipo-ozono” o ozone-like). Il danno tipo-ozono si manifesta usualmente sotto forma di una punteggiatura scura (più piccola di 1mm) sulla pagina superiore della foglia oppure come una pigmentazione diffusa sulla pagina superiore, che può consistere in una bronzatura o in un arrossamento. In ogni caso la pagina inferiore della foglia è esente da sintomi. Solo verso la fine della stagione, il danno da O3 può manifestarsi anche sulla pagina inferiore. I
sintomi non sono mai presenti sulle nervature e mostrano un effetto età ed un effetto ombra. L’effetto età fa si che le foglie più giovani siano esenti da sintomi, mentre quelle più vecchie siano maggiormente danneggiate, forse perché esposte da più tempo sebbene, più probabilmente, entrino in gioco ragioni di ordine fisiologico e biochimico. L’effetto ombra impedisce il manifestarsi dei sintomi sulla parte ombreggiata della foglia. Manuali fotografici per il riconoscimento dei sintomi sono oggi disponibili anche on-line
(http://www.gva.es/ceam/ICP-forests/, http://www.ozone.wsl.ch), oltre che su comune
supporto cartaceo (Sanz et al., 2001, Innes et al., 2001). Al momento, il rilievo dei sintomi tipo-ozono in campo fornisce ancora dati solo qualitativi, cioè vengono indicati la presenza/assenza dei sintomi e le specie sintomatiche. Nel 2004, nel “Submanual for the Assessment of Ozone Injury on European Forest Ecosystems” (
http://www.icp-forests.org/Manual.htm) dell’UN/ECE ICP Forests sono state introdotte delle modifiche
allo scopo di consentire una valutazione quantitativa dei sintomi e favorire quindi i confronti fra i siti e nel corso del tempo. In Italia, sintomi fogliari tipo-ozono sono stati segnalati su varie specie di latifoglie (Paoletti e Schaub 2002, Paoletti et al., 2003, Paoletti et al., 2005), mentre in altre specie, soprattutto sempreverdi, sia conifere che sclerofille mediterranee, questi sintomi non sono stati ancora diagnosticati in campo.
Comunque i sintomi visibili hanno mostrato un’ampia variabilità da individuo ad individuo (Paoletti et al., 2004b) e non è certo che la crescita sia il parametro più idoneo a riassumere gli effetti in campo. Come già accennato, la valutazione dell’effetto dell’O3
sull’accrescimento delle specie forestali è stata finora effettuata in condizioni controllate (camere chiuse o a cielo aperto) e su piante giovani o giovanissime. Un’alternativa è oggi
rappresentata dall’utilizzo dell’etilendiurea (N-[2-(2-oxo-1-imidazolidini)etil]-NO-fenilurea), abbreviata come EDU, usata con successo per prevenire i danni da ozono e studiare gli effetti dell’inquinante sulla crescita di varie specie erbacee e di alcune specie legnose. Questa tecnica innovativa per lo studio degli effetti dell’O3 su alberi adulti in
campo, di cui si parlerà diffusamente nel paragrafo 1.5, permetterebbe di ovviare ai limiti presenti nello studio della valutazione dose-risposta per le piante forestali.
1.2 CARATTERISTICHE E GENESI DELL’OZONO TROPOSFERICO
L’ozono è un gas azzurrognolo, la cui molecola è costituita da tre atomi di ossigeno (O3) (Fig. 1.5). Ha un peso molecolare di 48 Dalton, densità pari a 2,14 g l-1e possiede un
elevato potere ossidante, conferitogli da un potenziale redox pari a +2,07 V. Tale gas è in grado di reagire con composti organici, organismi biologici e vari tipi di materiale oltre ad essere soggetto a continue reazioni di produzione e di degradazione, l’equilibrio tra le quali determina la concentrazione dello stesso nell’atmosfera.
Figura 1.5. Rappresentazione schematica della molecola di ozono.
In atmosfera è presente in concentrazioni dell’ordine di 20-80 µg/m3e per il 90% si trova nello strato di atmosfera che si estende tra i 15 ed i 50 km di altezza dalla superficie terrestre, denominato stratosfera. In stratosfera l’O3 si forma per scissione fotolitica
dell’ossigeno biatomico (O2) ad opera delle radiazioni ultraviolette (hv) e successiva
ricombinazione dell’ossigeno atomico con l’ossigeno molecolare, secondo le seguenti reazioni:
O2 + hν → O + O (λ < 242.4 nm: ultravioletto)
dove M rappresenta una generica molecola presente nell’atmosfera, come azoto o ossigeno, in grado di assorbire l’energia in eccesso rilasciata dalla reazione e di stabilizzare la molecola di O3 che si è formata. Dalla stratosfera, l’O3 può passare nella troposfera, lo
strato di atmosfera più vicino alla superficie terrestre (compreso tra 0 e 10 km di altezza) per azione di correnti verticali, rappresentando quindi una fonte naturale di O3 troposferico.
Infatti, improvvisi aumenti delle concentrazioni di questo inquinante si possono verificare a causa di forti venti discendenti, come il föhn, e da intrusioni di aria dalla stratosfera particolarmente frequenti nella stagione primaverile (Ballarin Denti, 1997).
Mentre la presenza di tale gas nella stratosfera è essenziale in quanto, avendo un’azione filtrante e protettiva nei confronti delle radiazioni solari ultraviolette, garantisce la sopravvivenza degli esseri viventi e degli ecosistemi, nella troposfera si comporta da pericoloso inquinante, con effetti nocivi sulla salute umana, sui materiali e sulla vegetazione (Heagle, 1989).
La presenza di O3 nella troposfera è comunque prevalentemente dovuta a complesse
reazioni fotochimiche che avvengono direttamente in tale regione. Tali reazioni coinvolgono la radiazione solare, gli ossidi di azoto (NOx), emessi come gas di scarico
dagli autoveicoli, ed i composti organici volatili (VOC, Volatile Organic Compounds) di origine sia antropica che naturale. Le principali sorgenti dei VOC sono costituite dal circuito del carburante (produzione, distribuzione ed uso), dall’industria e dall’impiego dei solventi organici, anche se nel periodo estivo l’emissione di idrocarburi dalla vegetazione (terpeni ed isoprene) rappresenta un contributo che, in certe aree, può essere paragonabile o addirittura predominante rispetto a quello delle emissioni antropiche (Ballarin Denti, 1997). La presenza delle radiazioni ultraviolette nella troposfera determina una serie di reazioni che inducono la continua formazione e distruzione di O3 secondo un ciclo
fotolitico che ha inizio con la riduzione del biossido d’azoto a monossido di azoto, liberando ossigeno monoatomico:
NO2 + hν → NO + O
L’ossigeno atomico può ricombinarsi con l’ossigeno molecolare, diventando così un precursore dell’O3:
Il monossido di azoto reagisce quindi con l’O3 formato dando nuovamente origine a
biossido di azoto ed ossigeno biatomico:
NO + O3 → NO2 + O2
Questa terza reazione “consuma” O3 e ciò fornisce la spiegazione dell’apparente
paradosso che vede le più basse concentrazioni di tale inquinante monitorate proprio nelle aree urbane, in cui le emissioni di ossido di azoto superano di gran lunga quelle rilevabili nelle zone rurale, dove l’O3 e gli ossidi di azoto vi arrivano perché trasportati dal vento. Il
risultato netto di questo ciclo è un rapido ricambio di NO2 a livello della troposfera, senza
che si verifichi alcun accumulo di O3. Tale ricambio risulta in particolare favorito da
elevate concentrazioni di NO e più esattamente da un rapporto NO2/NO spostato a
vantaggio del monossido di azoto.
In condizioni normali, quindi, il ‘ciclo dell’NO2’ porta semplicemente a un rapido
ricambio di questo gas in quanto l’O3 e l’NO si formano e si decompongono in quantità
uguali. Tuttavia, la presenza di composti organici volatili (idrocarburi) altera tale ciclo fotolitico, andando a modificare l’equilibrio dinamico delle varie specie chimiche coinvolte. Infatti, la loro reazione con l’ossigeno atmosferico o con il radicale idrossilico (HO•) porta alla formazione di composti intermedi, quali il radicale alchilperossido (ROO•) e idroperossido (HOO•), che interferiscono a livello della reazione di ossidazione dell’NO, sostituita dalla più veloce reazione:
NO + ROO •→ RO• + NO2
NO + HOO • →HO• + NO2
L’NO viene perciò ossidato a NO2 a scapito della reazione tra questo e l’O3 e il ciclo
di reazioni così ottenuto conduce all’accumulo del gas inquinante nella troposfera (Gerosa et al., 1998) (Fig.1.6).
La formazione ed accumulo di tale inquinante nella troposfera non dipende solo dalla presenza dei suoi precursori, ma anche dalle particolari condizioni metereologiche, in quanto nelle reazioni interviene la radiazione solare e quindi le condizioni di forte irraggiamento, tipiche della stagione primaverile-estiva, favoriscono tale processo. Anche l’elevata temperatura, la bassa umidità relativa e la stabilità atmosferica determinano una
massiccia produzione fotochimica di O3, mentre i venti e le brezze contribuiscono a
ridistribuirlo, fino a interessare zone remote come quelle rurali e montane (Ballarin Denti, 1997).
Il tipico andamento giornaliero della concentrazione di O3 è rappresentato da una
curva “a campana”, con un valore massimo corrispondente alla massima intensità luminosa con un fattore di ritardo di circa un’ora (il tempo, cioè, necessario per l’innesco delle reazioni). Nonostante la produzione di O3 sia tipica delle aree urbane ad alta densità
veicolare è ampiamente accertata la presenza di elevate concentrazioni in zone lontane dai punti di emissione dei suoi precursori, come le aree rurali e forestali (Ranieri et al., 2001; Ashmore, 2005). I precursori dell’O3 possono infatti essere trasportati per grandi distanze
(European Environment Agency, EEA, 2003) e, a causa dei movimenti di trasporto orizzontali, nelle aree rurali si verifica un accumulo di NO2, in condizioni di assenza o
scarsità di NO. Ciò determina un’elevata produzione di O3 troposferico, che non viene però
“consumato”, poiché non avviene la reazione tra O3 e NO.
Figura 1.6. Azione interferente degli inquinanti organici nel ciclo fotolitico degli ossidi di N, con conseguente apertura di questo ed accumulo netto di O3.
1.3 INGRESSO DELL’OZONO E FORMAZIONE DELLE ROS
L’O3, quando viene a contatto con la superficie esterna delle foglie, può reagire con i
componenti cuticolari oppure diffondere attraverso gli stomi all’interno della foglia (Polle, 1998). Essendo trascurabile il suo ingresso attraverso la cuticola fogliare (diecimila volte inferiore rispetto a quello stomatico) (Kerstiens e Lendzian, 1989), la sua principale via di penetrazione risulta quella stomatica (Tausz et al., 2006).
Il fattore decisivo nel determinare la fitotossicità dell’O3 è rappresentato dalla
quantità effettiva di inquinante che raggiunge i siti reattivi all’interno della foglia (Ferretti et al., 2003a; Tausz et al., 2006). Il flusso dell’O3 è regolato dalle condizioni chimiche e
fisiche che incontra durante la transizione dalla fase gassosa a quella liquida. E’ noto che parte dell’O3 troposferico viene degradato sulla superficie esterna e sulla cuticola, piante
esposte all’inquinante evidenziano infatti alterazioni nella componente cerosa della cuticola (Günthard-Goerg, 1994). La frazione di O3 che invece raggiunge gli stomi penetra
nelle foglie, in particolare negli spazi intercellulari, secondo la legge di Fick: F = g x (Ca –
Ci), dove F indica il flusso, g la conduttanza stomatica al gas in questione, Ca e Ci le
concentrazioni di tale gas rispettivamente all’esterno e all’interno della foglia. Nel caso dell’O3 quest’ultima viene considerata uguale a zero a causa dell’elevata velocità delle
reazione chimiche in cui è coinvolto l’O3 nella camera sottostomatica (Laisk et al., 1989).
Risulta perciò evidente che i fattori in grado di influenzare maggiormente il flusso dell’ozono all’interno del mesofillo sono la concentrazione esterna del gas e la conduttanza stomatica, quest’ultima a sua volta correlata al numero, alle dimensioni degli stomi, al grado e durata della loro apertura. Giocano un ruolo importante anche la richiesta evapotraspirativa dell’atmosfera, lo stato idrico del sistema pianta-terreno, nonché il tempo di esposizione.
E’ ancora poco conosciuto come l’O3 influenzi il funzionamento stomatico (Paoletti
e Grulke, 2005). Sono stati suggeriti come possibili meccanismi le variazioni di attività fotosintetica, i segnali dell’acido abscissico (ABA) e/o dell’etilene, la generazione di un burst ossidativo direttamente nelle cellule guardia (bibliografia riportata in Kangasjärvi et al., 2005). Recenti lavori hanno mostrato che le specie reattive dell’ossigeno (ROS) derivate dall’O3 costituiscono segnali essenziali che mediano la chiusura stomatica indotta
infatti la chiusura stomatica attraverso l’attivazione dei canali di calcio presenti nella plasmamembrana.
Fattori ancora più importanti nella regolazione del flusso dell’O3 sono rappresentati
dall’effettiva area del mesofillo esposta all’inquinante, lo spessore della parete cellulare e la presenza di molecole detossificanti capaci di reagire con l’ozono (o con le ROS da esso derivate) e quindi limitarne il flusso prima che esso possa raggiungere e danneggiare le plasmamembrane (Chameides, 1989).
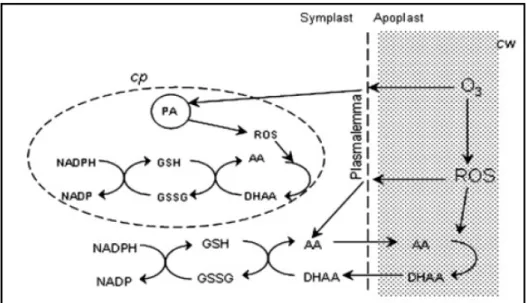
L’O3, una volta penetrato nella camera sottostomatica, tende a distribuirsi negli spazi
extracellulari (Fig. 1.7) e, nella fase acquosa della matrice apoplastica, reagisce immediatamente generando le ROS, quali il radicale superossido (O2.-), il perossido di
idrogeno (H2O2), il radicale idrossilico (OH.-) (Laisk et al., 1989).
L’origine delle ROS nell’apoplasto non è stata ancora stata completamente chiarita. Secondo alcuni autori deriverebbero direttamente dalla decomposizione spontanea dell’O3
nell’apoplasto, ipotesi non sostenuta pienamente in quanto sembra che la diretta dissoluzione dell’ozono in ambiente acquoso si realizzi soltanto a pH relativamente elevati, lontani da quelli fisiologici. Secondo altri, la formazione delle specie reattive dell’ossigeno sarebbe imputabile all’interazione dell’ozono con molecole organiche contenenti legami C-C, quali gli acidi grassi della componente lipidica delle plasmamembrane o gli idrocarburi endogeni emessi dalle piante (etilene, isoprene, terpeni) (Salter e Hewitt, 1992).
Infine, secondo le più recenti acquisizioni, si verificherebbe un’attiva generazione di H2O2 e O2.- da parte della cellula, il cosiddetto “burst ossidativo”, sia durante che dopo
l’esposizione all’O3 (Pellinen et al., 1999). In particolare, le prime ROS generate
direttamente o indirettamente dall’O3 stimolerebbero un’ulteriore produzione di ROS da
parte di sistemi enzimatici quali il complesso NAD(P)H-ossidasi legato al plasmalemma in associazione con le superossido dismutasi, ed alcune isoforme perossidasiche extracellulari pH-dipendenti (Lamb e Dixon, 1997; Bolwell, 1999; Scheel, 2002). Dal momento che la capacità delle perossidasi di produrre H2O2 è massima in ambiente neutro o basico, la loro
attività sarebbe favorita dalla temporanea alcalinizzazione dello spazio extracellulare, conseguente all’ingresso dell’O3.
Figura 1.7. Rappresentazione schematica del meccanismo di uptake dell’ozono attraverso le aperture stomatiche.
Le ROS sono molecole altamente tossiche il cui bersaglio primario è rappresentato dai lipidi e dalle proteine di membrana, con conseguente perdita della permeabilità selettiva, alterazione dell’integrità cellulare e possibile produzione di molecole messaggero (Schraudner et al., 1998). Una volta aperta questa nuova via di azione possono andare a modificare o distruggere diversi costituenti cellulari come proteine, lipidi, pigmenti, acidi nucleici ecc. Si tratta quindi di effetti diretti, sebbene alcuni studi abbiano evidenziato anche una loro possibile azione indiretta a livello genetico, interferendo ad esempio sulla trascrizione dell’enzima Rubisco (ribulosio-1,5-bifosfato carbossilasi/ossigenasi) (Pell et al., 1997). A tal proposito sembra che le ROS prodotte in uno specifico sito cellulare possano influenzare altri comparti cellulari, ad esempio attraverso il trasferimento dell’H2O2, molecola capace di diffondere attraverso i canali dell’acqua, o attraverso
l’induzione di una complessa rete di traduzione del segnale di stress, che vede coinvolte numerose molecole messaggero e, probabilmente variazioni dell’equilibro redox cellulare.
La fitotossicità dell’O3 non dipende quindi dal suo accumulo in elevate
concentrazioni all’interno dei tessuti vegetali, ma dalla sua capacità di dare origine, già nella fase acquosa dello spazio extracellulare (apoplasto), alle ROS.
Il concetto di stress ossidativo è stato introdotto da Halliwell (1981) quando pose il problema della tossicità dell’ossigeno, arrivando alla conclusione, più tardi confermata da Fridovich (1998), che i responsabili di tale fenomeno fossero le reazioni ossidative coinvolgenti le ROS.
Negli organismi vegetali le ROS sono continuamente prodotte come risultato del normale metabolismo aerobio cellulare, in particolare in processi metabolici quali il trasporto di elettroni nei cloroplasti durante la fotosintesi e nei mitocondri durante la respirazione (Sharma e Davis, 1997; Foyer e Noctor, 2003). In condizioni fisiologiche stazionarie le cellule vegetali mantengono in equilibrio la produzione delle ROS e la loro eliminazione attraverso l’azione di sistemi antiossidanti di natura enzimatica e non, spesso confinati in particolari comparti. Tale equilibrio può essere facilmente perturbato da diversi fattori ambientali biotici ed abiotici come siccità, basse temperature, carenze nutrizionali, presenza di ferite, agenti patogeni, metalli pesanti, inquinanti atmosferici ecc.(Alonso et al., 2001; Baier et al., 2005; Ranieri et al., 2005).
Mentre le ROS sono da molto tempo considerate come sostanze tossiche per la vita della cellula, è attualmente chiaro che possono anche agire come messaggeri nelle risposte cellulari all’ambiente; la pianta produce infatti tali molecole per controllare vari processi come lo sviluppo, la difesa da vari fattori di stress, la morte cellulare programmata, il comportamento stomatico ecc. La capacità della pianta di indurre un suicidio cellulare geneticamente programmato (PCD) è un aspetto centrale dello sviluppo e della difesa. Nel caso ad esempio di un’esposizione all’O3 (Conklin e Last, 1995; Sandermann, 2000) o
all’ossigeno singoletto (Leisinger et al., 2001) la pianta stimola la produzione di segnali ROS, le risposte ipersensibili (HR) e la resistenza sistemica acquisita (SAR) (Kangasjärvi et al., 2005).
In tale ottica i sistemi di difesa antiossidanti non costituiscono solo una protezione contro le ROS, ma hanno il potenziale di mediare e controllare i segnali di trasduzione (Foyer e Noctor, 2005).
Le somiglianze riscontrate tra le risposte indotte dall’ozono e la risposta ipersensibile osservata nell’interazione incompatibile pianta-patogeno hanno suggerito che l’ozono possa comportarsi alla stregua di un elicitore fungino. In questo modo gli effetti dell’O3 si
esplicherebbero attraverso una cascata di eventi regolati dall’induzione di molecole segnale che medierebbero la stimolazione di risposte secondarie a livello genetico, metabolico ed ormonale.
E’ stato suggerito che le ROS agiscano insieme a composti che viaggiano sistematicamente ed abbiano la capacità di attivare la produzione di altre ROS in parti distanti della pianta. La possibilità di queste molecole di viaggiare a lunga distanza nelle piante è ancora dibattuta, per il fatto che molte di esse sono altamente reattive e sono detossificate immediatamente dai sistemi di scavenging dell’apoplasto.
Quindi a causa della duplice natura delle ROS (tossica e segnale) le cellule vegetali potrebbero utilizzare come minimo due diversi meccanismi per regolare la loro concentrazione intracellulare: uno che permetta la delicata modulazione di bassi livelli delle ROS allo scopo di farle agire come segnali e l’altra che consenta la loro detossificazione per evitare il raggiungimento dei livelli tossici, specialmente durante lo stress.
Tra le ROS, l’H2O2 in particolare è stata oggetto di crescente attenzione. Infatti di per
sé l’H2O2 è solo moderatamente tossica e in basse concentrazioni è in grado di attivare i
geni di difesa, ma in presenza di metalli di transizione può essere ridotta a radicale idrossilico, fortemente reattivo e quindi estremamente pericoloso per la cellula. Ciò avviene, ad esempio, tramite la reazione di Fenton, che prevede la riduzione dell’acqua ossigenata a radicale idrossilico ad opera del Fe2+:
Fe2+ + H2O2 → Fe3+ + OH- + OH•
L’accumulo di H2O2 a livello apoplastico in piante esposte ad O3, nonché una stretta
connessione tra la produzione di questa ROS e la sensibilità all’inquinante, sono ampiamente testimoniati in letteratura da studi condotti su numerose specie vegetali, tra cui betulla (Betula pendula) (Pellinen et al., 1999), pomodoro (Lycopersicon esculentum) (Wohlgemuth et al., 2002) ed alcuni genotipi di arabidopsis (Arabidopsis thaliana) (Rao e Davis, 1999). Una formazione precoce di H2O2, è tipica delle specie o cultivar O3
-resistenti. Nelle specie sensibili, invece, la produzione delle ROS sembra continuare anche dopo la fine del trattamento, estendendosi all’interno della cellula e provocando, in ultima istanza, la comparsa di necrosi fogliari (Schraudner et al., 1998, Pellinen et al., 1999).
1.4 MECCANISMI DI RISPOSTA DELLE PIANTE ALL’OZONO
L’ozono è uno dei principali inquinanti dell’aria in grado di influenzare negativamente la crescita delle piante, lo sviluppo e quindi la produttività se la capacità antiossidante della pianta non risulta sufficiente.
I tipici danni da ozono comprendono la diminuzione del contenuto in clorofilla e del tasso fotosintetico, cambiamenti nell’allocazione del carbonio, l’aumento dell’attività antiossidante e la riduzione della biomassa. In aggiunta, l’ozono appare indebolire la resistenza delle specie vegetali ad un ampio range di fattori abiotici e biotici (Skärby et al., 1998).
A livello cellulare l’O3 determina effetti distinti a seconda del tipo di esposizione
all’inquinante. A tal proposito si distinguono effetti acuti, conseguenti ad esposizioni ad elevate concentrazioni dell’inquinante per brevi periodi di tempo ed effetti cronici, nel caso di prolungate esposizioni della vegetazione a dosi inferiori. Un’esposizione di tipo cronico non produce generalmente danni visibili ma determina piuttosto cambiamenti dal punto di vista biochimico e fisiologico che provocano riduzione di vigore e di crescita, effetti molto simili a quelli generati da una senescenza precoce (Pell et al., 1997). Sono ad esempio tali i disturbi nel metabolismo degli zuccheri, l’inibizione della fotosintesi con conseguente riduzione della crescita, gli sbilanciamenti nello stato di ossido-riduzione di alcuni metaboliti e di molecole intermediarie della catena di trasporto elettronico fotosintetico, nonché la produzione delle ROS. L’esposizione di tipo acuto, invece, provoca generalmente danni visibili, che consistono essenzialmente nella manifestazione di sintomi quali lesioni necrotiche (Pell et al., 1997; Kangasjärvi et al., 2005). Tale condizione induce risposte d’ipersensibilità analoghe a quelle attivate in seguito all’attacco di fitopatogeni (Sandermann, 1996), come la comparsa di lesioni fogliari (di colore porpora, bianco-avorio, brunastro) localizzate negli spazi internervali della pagina adassiale principalmente delle foglie mature, la cui formazione è dovuta essenzialmente all’azione delle ROS, e all’induzione di morte cellulare programmata mediata da una serie di molecole messaggero prodotte in seguito all’esposizione all’O3. La comparsa di sintomi visibili sulla superficie
fogliare rappresenta pertanto la manifestazione macroscopica di una serie di eventi e modificazioni che si realizzano a livello cellulare e che si concludono con la morte della cellula stessa.
L’O3 determina alterazioni anche a livello fisiologico, in quanto l’attacco della
membrana del cloroplasto da parte delle ROS comporta la conseguente riduzione dell’attività fotosintetica. Tali effetti negativi possono manifestarsi prima dell’apparizione
di sintomi visibili di danno sulla superficie fogliare e la loro entità dipende dalla specie vegetale, dall’età della foglia, dalla durata di esposizione all’O3 e dalle condizioni
ambientali (Castagna et al., 2001). I meccanismi coinvolti nella riduzione del tasso di assimilazione della CO2 non sono stati ancora pienamente chiariti (Pell et al., 1997;
Schreiber et al., 1986). Alcuni autori hanno correlato la diminuzione dell’attività fotosintetica con una riduzione della conduttanza stomatica (Hill e Littlefield, 1969; Moldau et al., 1993). Comunque, la riduzione della conduttanza fogliare non sembra essere, almeno nelle foglie mature, la causa primaria della riduzione della fotosintesi in presenza di O3 (Grandjean-Grimm e Fuhrer, 1992), mentre la riduzione nell’efficienza di
carbossilazione gioca un ruolo essenziale nel determinare variazioni nel processo fotosintetico (Pell et al., 1992, 1994; Farage e Long, 1999). Infatti alcuni autori hanno legato la riduzione della fissazione della CO2 a cambiamenti a livello del mesofillo,
attraverso l’inibizione dell’attività e della quantità della Rubisco, enzima chiave del ciclo di Calvin e/o l’alterazione del trasporto elettronico, alla base del processo fotosintetico (Guidi et al., 2000; Castagna et al., 2001; Ranieri et al., 2001b).
La diminuzione dell’attività fotosintetica determina un decremento nella produzione di zuccheri solubili ed amido, con la conseguente riduzione della crescita, fenomeno aggravato dalla sottrazione di una parte delle risorse destinate all’accrescimento per potenziare i processi di detossificazione e di difesa (Guderian et al., 1985).
Le misure sulla fluorescenza della clorofilla a forniscono informazioni utili circa le alterazioni dell’attività fotosintetica causate dall’esposizione all’inquinate (Reiling e Davison, 1994; Ciompi et al., 1997; Guidi et al., 1997; Shavnin et al., 1999), sebbene le risposte siano limitate al fotosistema II (PSII), complesso di pigmenti-proteine presente sulla membrana tilacoidale da cui ha inizio il trasporto fotosintetico di elettroni. Nell’apparato fotosintetico infatti la luce è assorbita dai pigmenti antenna e l’energia di attivazione è trasferita ai centri di reazione; la fluorescenza costituisce una forma di dissipazione dell’energia luminosa attraverso l’emissione di luce.
I valori di fluorescenza che vengono generalmente presi in considerazione sono il massimo valore di fluorescenza (Fm), osservato quando tutti i centri di reazione del PSII
sono chiusi, e la quantità d fluorescenza (Fo) che si osserva quando tutti i centri sono aperti.
Il rapporto Fv/Fm indica l’efficienza del PSII (cioè la massima efficienza con cui i centri di reazione aperti sono in grado di catturare l’energia luminosa assorbita dal sistema antenna), dove Fv è detta fluorescenza variabile (Fv = Fm-Fo). Misure della fluorescenza della
seguito ad esposizione all’ozono (Reiling eDavison, 1994; Ciompi et al., 1997; Lorenzini et al., 1999; Ranieri et al., 2001b). Una riduzione del rapporto Fv/Fm, comunemente
ritenuto un segnale di fotoinibizioneè stata frequentemente osservata come conseguenza dell’esposizione ad O3(Loreto et al., 2004; Paoletti et al., 2007e).
Come già precedentemente descritto, nelle normali condizioni ambientali l’O3 è
associato ad un’elevata irradianza ed è stato quindi ipotizzato che lo stress luminoso possa provocare un danno aggiuntivo nelle piante sottoposte a stress da O3. Dato che la presenza
di O3 determina profonde alterazioni a carico del processo fotosintetico, sia attraverso gli
effetti sulla conduttanza stomatica, che interferendo con la capacità di fissazione della CO2
da parte degli enzimi del ciclo di Calvin, può facilmente realizzarsi uno squilibrio tra la quantità di energia luminosa assorbita dalle antenne dei fotosistemi e quella utilizzabile a fini fotosintetici, con un conseguente aumento del rischio di fotoinibizione. Infatti, a causa del ridotto utilizzo di NADPH nel processo di fissazione della CO2, gli elettroni, non
potendo “scaricarsi” sul NADP+, accettore finale nella catena di trasporto tilacoidale,
reagiscono con l’O2 determinando la produzione di ossigeno singoletto e anione
superossido O2•−, responsabili dell’inattivazione e degradazione della proteina D1 del PSII e di un conseguente processo di degradazione a carico delle altre componenti proteiche dello stesso centro di reazione, con completa distruzione di tale fotosistema (Ciompi et al., 1997; Ranieri et al., 2000b). Nel contrastare tale sequenza di eventi dannosi è di cruciale importanza il meccanismo di dissipazione termica dell’eccesso di energia luminosa attraverso il ciclo delle xantofille (Foyer e Mullineaux, 1994; Demming-Adams e Adams, 1996; Yamamoto e Bassi, 1996; Niyogi et al., 1998; Ranieri et al., 2000b, 2001a). Le xantofille rappresentano uno dei principali gruppi di carotenoidi, composti isoprenoidi a 40 atomi di carbonio caratterizzati da numerosi doppi legami coniugati, normalmente presenti come pigmenti accessori nei complessi antenna dei due fotosistemi (LHCI e LHCII). Tali composti, oltre al ruolo di recettori luminosi, possiedono una funzione protettiva, in quanto neutralizzano lo stato eccitato delle molecole di clorofilla allo stato di tripletto, dell’ossigeno singoletto e probabilmente delle altre specie tossiche dell’ossigeno (ROS), che si formano nel cloroplasto soprattutto in seguito ad uno stress di tipo fotoossidativo.
Il ciclo delle xantofille prevede la conversione della violaxantina a zeaxantina, attraverso l’intermedio anteraxantina,tramite reazioni di de-epossidazione, ed il cammino inverso per via epossidativa in caso di buio o bassa intensità luminosa. (Fig. 1.8, 1.9).
Il meccanismo di azione della zeaxantina non è stato ancora chiarito, ma sono state proposte due ipotesi: secondo la prima, sarebbe possibile un trasferimento diretto di energia dalla clorofilla alla zeaxantina, mentre ciò non potrebbe avvenire tra la clorofilla e la violaxantina (Gilmore e Yamamoto, 1993); secondo l’altra ipotesi, peraltro non escludentisi a vicenda: la conversione di una molecola meno polare, violaxantina, ad una più polare, zeaxantina, indurrebbe un riarrangiamento nella struttura dell'LHCII che faciliterebbe la dispersione dell’eccesso di energia (Horton et al., 1996).
Figura 1.8. Rappresentazione schematica delle xantofille Violaxantina, Anteraxantina e Zeaxantina, coinvolte nel ciclo delle xantofille.
La formazione di zeaxantina richiede tre principali condizioni: presenza di ascorbato e di violaxantina, attivazione dell’enzima violaxantina de-epossidasi mediata da pH acidi, presenza di violaxantina (Hager e Holocher, 1994). La violaxantina de-epossidasi, localizzata sulla superficie interna delle membrane tilacoidali, funziona infatti solo in presenza di pH sufficientemente bassi (~5), generati dalla traslocazione dei protoni in associazione col trasporto elettronico, ed in presenza di una determinata concentrazione (>100µM) diascorbato in qualità di cofattore riducente, mentre la epossidasi ha un alto pH ottimale di ~7 e richiede NADPH (Yamamoto, 1985; Neubauer e Yamamoto, 1994). La stima dell’attivazione del ciclo delle xantofille attraverso “l’indice di depossidazione” DEPS (A/2+Z)/(V+A+Z) risulta quindi molto importante per individuare uno squilibrio nel processo fotosintetico e per capire come la pianta ha reagito allo stress aumentando le proprie difese.
Esiste inoltre uno stretto legame tra il ciclo delle xantofille e la biosintesi dell’acido abscissico (ABA), l’ormone chiave che controlla il meccanismo di chiusura stomatica (Ahlfors et al., 2004). Infatti l’accumulo di violaxantina potrebbe promuovere la biosintesi dell’ABA che dipende dalle xantine sintetizzate dalla violaxantina e le neoxantine violaxantine-derivate (Finkelstein e Rock, 2002).
Un importante ruolo antiossidante nei tessuti fotosintetici è svolto anche dal β-carotene, per la sua capacità di de-eccitare lo stato di tripletto della clorofilla a, prevenendo così la generazione dell’ossigeno singoletto, nonchè di rimuovere direttamente quest’ultimo. In questo caso l’energia verrebbe trasferita dalla clorofilla ai carotenoidi e successivamente dissipata sotto forma di calore. Comunque sembra che la zeaxantina faciliti la conversione della clorofilla da tripletto a singoletto in un modo più efficiente del β-carotene.
A livello ultrastrutturale, l’O3 provoca la perdita dell’integrità delle membrane
cellulari e la conseguente riduzione nella capacità di trasportare sostanze chimiche e di mantenere l’omeostasi. Le membrane degli organelli, e specialmente quelle dei cloroplasti, sono i bersagli più sensibili al danno da O3, che si manifesta tramite rigonfiamento dei
tilacoidi e produzione di plastoglobuli (Sutinen et al., 1990; Sellden et al., 1996; Holopainen et al., 1996). Come conseguenza deldanneggiamento dei cloroplasti si verifica il collasso delle cellule del mesofillo, secondo un tipico meccanismo di risposta