~ 4 ~
C
APITOLO
1
Introduzione
L’Organizzazione Mondiale della Sanità (OMS) definisce le piante medicinali come “ogni vegetale che contiene, in uno o più dei suoi organi, sostanze che possono essere utilizzate a fini terapeutici o preventivi, o che sono i precursori di sintesi chimico-farmaceutici”.
Oltre ad avere un ruolo molto importante nell’alimentazione dell’uomo, le piante sono state utilizzate fin dai tempi più antichi per curare numerose malattie. L’utilizzo delle piante per le loro proprietà curative nasce in maniera istintiva e casuale. L’uomo vede la pianta non solo come cibo, ma anche come medicina.
Il cuore, i polmoni, i reni, il cervello, le articolazioni, la pelle, il sistema immunitario, lo stomaco, l’intestino e tutti gli organi possono trarre effetti favorevoli dalle proprietà delle piante. La digestione viene facilitata, l’attività dell’intestino viene normalizzata, i processi riparativi a livello della pelle sono favoriti, l’organismo viene meglio protetto dalle aggressioni dei microrganismi, l’attività del cuore viene sostenuta, le scorie e le tossine vengono più facilmente eliminate, le articolazioni mantengono la loro flessibilità, le tensioni muscolari vengono annullate, la respirazione viene liberata. Inoltre le piante possono contribuire a mantenere giovane la pelle e resistenti i capelli, a evitare la pena interiore della depressione, a perdere peso senza soffrire troppo, a rimanere sereni, a trovare più facilmente il cammino da percorrere (Brigo, 2009).
Anche se il termine “fitoterapia” è stato introdotto solo agli inizi degli anni Venti dal medico francese Leclerc, l’uso delle piante rappresenta la forma
~ 5 ~
di cura più antica e universale. È noto come in ogni epoca storica e presso tutti i popoli, in ogni cultura e regione del mondo le piante medicinali siano state, infatti, il fondamento essenziale della terapia. Dall’India alla Cina, dal Tibet al Sud America esse continuano a essere la principale forma di cura per le popolazioni locali. In Occidente in tempi recenti si è assistito a una progressiva riscoperta delle piante medicinali. Così, se hanno cessato di essere usate a livello popolare sotto forma di preparazioni empiriche, hanno trovato sempre più spazio negli ordinati scaffali delle farmacie, disponibili a continuare il loro compito di prevenire e curare disturbi piccoli e grandi del corpo, disagi psichici, assicurare un più completo benessere, migliorare l’aspetto esteriore. Le piante continuano dunque a essere il polmone del nostro pianeta e una preziosa fonte di salute per l’uomo. Più del 60% dei farmaci che noi consumiamo hanno infatti la loro origine nelle cellule vegetali. Ed è sempre nelle piante che gli studiosi continuano a ricercare la soluzione alle continue sfide delle malattie (Brigo, 2009).
Nella lunga storia della fitoterapia è possibile individuare quattro grandi vie o tradizioni che confluiscono nella ricchezza e varietà della fitoterapia attuale. Si tratta della fitoterapia cinese, indiana, precolombiana ed europea.
L
A TRADIZIONE DELLA FITOTERAPIA CINESEL’imperatore cinese chiamato Shen Nung è un personaggio leggendario vissuto più di 4.000 anni fa che avrebbe introdotto sia l’agricoltura che l’uso delle piante in medicina. Egli compose la prima opera sulle piante cinesi intitolata Insegnamento del Coltivatore Celeste basato sulla
comprensione dei rimedi, descrivendo le proprietà di 365 preparati, di cui
ben 237 di origine vegetale, distinti in 3 categorie: farmaci “regali” o superiori, farmaci “ministeriali” e farmaci “assistenti” o inferiori. Il
~ 6 ~
ginseng, argomento di questa tesi, viene considerato come la più importante delle piante regali o superiori. Di questo gruppo fanno parte preparati come la liquirizia e lo zenzero, capaci di aumentare la vitalità della persona sia sana che malata, senza provocare effetti collaterali dannosi. Il secondo raggruppamento comprende i rimedi ministeriali, leggermente tossici, utilizzati in maniera selettiva nella cura specifica delle varie malattie. Di esse fa parte anche l’Angelica sinensis, nota anche come “ginseng delle donne”. Da ultimo vengono i preparati assistenti, considerati minori in quanto la dose curativa è molto vicina a quella tossica. A essi appartengono la noce vomica, l’aconito, l’elleboro. La quasi totalità dei farmaci elencati da Shen Nung sono in uso a tutt’oggi, a conferma della sua straordinaria capacità nell’intuire il potere curativo delle piante (Brigo, 2009).
Sorprendono infatti la concisione, la completezza, l’accuratezza e la bellezza dell’antica descrizione nella farmacopea di Shen Nung delle proprietà del ginseng confermate dalla ricerca scientifica moderna. «Ha gusto dolciastro e la sua proprietà è leggermente rinfrescante. Cresce nelle gole delle montagne. Si usa per ristabilire i cinque visceri, armonizzare le energie, rinvigorire lo spirito, alleviare l’ansietà, eliminare le sostanze tossiche, ravvivare gli occhi, allargare il cuore e migliorare il pensiero. Il suo uso continuo fortifica l’organismo e prolunga la vita».
La medicina cinese ha introdotto per prima alcuni fitocomplessi: le alghe marine, l’efedra sinica, il rabarbaro, la canapa indiana, la segale cornuta, il ginseng.
L
A TRADIZIONE DELLA FITOTERAPIA INDIANALa medicina indiana è basata fondamentalmente sull’antico sistema ayurvedico. Ayurveda, dal sanscrito ayus, «vita», e veda, «conosca», indica
~ 7 ~
la scienza della longevità. In una pagina della Caraka Samhita, uno dei trattati medici più antichi, vengono riferite le origini leggendarie dell’ayurveda, secondo le quali Indra, signore di tutti gli dei rivelò ai rishi, grandi saggi conoscitori della verità, la conoscenza delle cause e il trattamento delle malattie. Nella mitologia indiana, Dhavantari, dio della medicina, viene rappresentato con un vaso che contiene l’elisir della vita, capace di conservare la giovinezza e preservare dalla morte prematura. Secondo il concetto dei Veda, una vita completa è formata da 100 anni ed è divisa in quarti. Uno dei metodi di ringiovanimento o Kaya Kalpa consiste in una specie di ibernazione per un periodo di circa 3 mesi, durante il quale l’unico alimento è rappresentato dall’Emblica officinalis (Amalaki). Secondo l’ayurveda la salute è assicurata dall’equilibrio dei 3 Dosha, o principi generali, che regolano tutte le funzioni biologiche. Lo squilibrio di un solo Dosha è responsabile della malattia (Brigo, 2009).
L
A TRADIZIONE DELLA FITOTERAPIA SUDAMERICANALe medicine arcaiche messicana e peruviana, basate su elementi empirici, magici e religiosi, venivano praticate da guaritori sotto il severo controllo delle autorità. I giardini di Montezuma destarono la meraviglia dei primi conquistatori spagnoli: in uno studio del medico Francesco Hernandez (1571-1575) vengono catalogate 1.200 specie botaniche, molte delle quali provenienti dal Nuovo Mondo. Nelle regioni fredde del Nord America venivano usate le foglie del salice come antipiretico e l’echinacea per prevenire e trattare le malattie da raffreddamento. Le donne indiane facilitavano il parto con l’assunzione di caulofillo, mentre i Pellerossa usavano l’angelica per le affezioni intestinali. In Messico e Perù venivano utilizzate la coca per ridurre la fatica e la ratania come antidiarroico. Nell’Amazzonia si conoscevano anestetici, narcotici, allucinogeni (Brigo, 2009).
~ 8 ~
L
A TRADIZIONE DELLA FITOTERAPIA EUROPEA EMEDITERRANEA
o Cultura assiro-babilonese
Alcune tavolette di argilla della biblioteca di Ninive ritrovate in Assiria all’inizio di questo secolo portano impresse, a caratteri cuneiformi, ricette con l’indicazione di piante come la belladonna o la canapa indiana (Brigo, 2009).
o Cultura egizia
In Egitto antiche iscrizioni e pitture sulle pareti dei templi e delle tombe ci parlavo dell’uso che si faceva di almeno 500 diverse specie di piante intorno al 3000 a.C. Vi erano specialisti per ogni tipo di malattia. Numerose ricette dei grandi medici classici (Ippocrate, Dioscoride, Galeno) non sono che la trascrizione delle prescrizioni presenti nei papiri egizi. Il più antico manoscritto sull'argomento è un papiro (1550 a.C.) che G. M. Ebers, egittologo e romanziere tedesco (1837-1898), acquistò da un arabo che lo aveva trovato tra le ginocchia di una mummia. Vi contiene circa 700 ricette per differenti malattie. Inoltre include una descrizione molto accurata del sistema circolatorio, in quanto viene notata l'esistenza dei vasi sanguigni in tutto il corpo e la funzione del cuore come motore della circolazione del sangue.
Peraltro, sono stati proprio gli egizi a scrivere per la prima volta la parola “cervello” e a fornire la prima descrizione anatomica delle meningi e del liquido cerebrospinale. La parola “cervello” compare nel cosiddetto “papiro chirurgico” di Edwin Smith, un egittologo americano nato nel 1822 e morto nel 1906.
A motivo delle loro tecniche di imbalsamazione gli egizi sono stati anche i primi a elaborare un’arte aromataria con cui distruggere funghi e batteri responsabili dei processi di decomposizione. I principi odorosi attivi di
~ 9 ~
fiori, foglie, radici, resine, bacche, semi e frutti, assorbiti dagli oli usati come eccipienti, trovavano applicazione anche nella cosmesi e nell’igiene, e questi metodi rimasero in vigore sino alla scoperta dell'alambicco.
In Egitto anche le donne erano ammesse agli studi di farmacia e medicina. Cleopatra, per esempio, era un'illustre farmagnosta e possedeva un alambicco per la cosmesi. L'olio che porta il suo nome, composto di mirto e labdano, era ritenuto ottimo contro la caduta dei capelli (Brigo, 2009).
o Cultura greca
Aristotele (384-322 a.C.) e la sua Scuola filosofica danno inizio allo studio delle scienze naturali e della botanica. Ippocrate di Cos (460 ca.-375 ca. a.C.), il “padre della medicina”, raccoglie ed elabora le conoscenze mediche del suo tempo per dare a esse una prima base scientifica. Celebre è il suo Corpus Ippocraticum nel quale, per ogni forma di malattia, prescrive il rimedio vegetale adatto. Nel pensiero di Ippocrate, la funzione del medico è quella di aiutare la forza risanatrice della Natura con rimedi capaci di far ritrovare all’organismo l’equilibrio energetico. Teofrasto (372-287 a.C.), discepolo di Aristotele, è considerato il “padre della botanica”, in quanto affronta lo studio delle piante con criteri razionali. Mitridate (132-63 a.C.), re del Ponto, assistito dal suo medico, sperimenta su se stesso veleni di origine minerale e vegetale, cercando di indurre l’assuefazione del suo organismo mediante l’ingestione di dosi progressive (Brigo, 2009).
o Cultura romana
Nell’antica Roma prevale un atteggiamento di diffidenza nei confronti della raffinata cultura greca. Catone il Censore (234-149 a.C.) è uno dei primi Romani a sottolineare la necessità di rivolgersi alla Natura per dare sollievo alle sofferenze del corpo. In particolare egli è un grande estimatore delle proprietà del cavolo, a cui attribuisce il merito di aver tenuto lontani da Roma i medici per tre secoli. Nel suo trattato sull’agricoltura, De re rustica,
~ 10 ~
racconta come nel suo giardino coltivasse ben 120 piante medicinali. Dioscoride, vissuto a Roma al tempo di Nerone, è uno dei primi a raccogliere in maniera completa tutte le conoscenze terapeutiche del suo tempo. Nel suo trattato De Universa Medicina, egli conferisce un’ulteriore impronta scientifica allo studio delle sostanze naturali e riserva una cura particolare alla descrizione delle piante indigene ed esotiche allora conosciute. Nel II secolo d.C., Galeno, medico greco, anticipa le basi della medicina moderna nella sua opera, che manterrà per molti secoli un carattere dogmatico. Egli stabilisce una distinzione fra l’impiego delle singole piante medicinali, che definisce “semplici” e l’uso di più piante ad azione sinergica. Evidenzia inoltre l’efficacia dei singoli principi attivi di origine vegetale, ottenuti mediante l’uso di solventi comuni come l’aceto, il vino, l’olio. Proprio da queste innovazioni è derivato il termine di “preparato galenico”, che indica forme medicamentose costituite da più principi attivi di origine naturale e soprattutto vegetale, preparate in una forma farmaceutica adattta per la cura di una determinata malattia. Galeno è stato anche il primo studioso ad attribuire grande importanza alla qualità e alla genuinità delle droghe vegetali, in particolare quelle esotiche: pepe, zafferano, cannella, rabarbaro, zenzero (Brigo, 2009).
o Cultura araba
La cultura greco-latina viene ereditata dal mondo arabo, che amplia le conoscenze classiche. Dal VII al XII secolo vi è un rifiorire delle scienze nel mondo arabo. Gli studiosi possono spaziare da Oriente a Occidente grazie alla vastità dell’impero arabo. Le maggiori possibiltà di scambi commerciali consentono di acquisire la conoscenza di nuove piante medicinali e di sperimentare proprietà e impieghi terapeutici fino ad allora sconosciuti. Verso l’anno 1000 fanno la loro prima comparsa le farmacie e inizia un vero e proprio commercio di farmaci, profumi e coloranti tra
~ 11 ~
Oriente e Occidente. Gli elementi della medicina araba vengono raccolti nei cinque libri del Canone da Avicenna (980-1037) che per primo descrisse la tecnica della distillazione. Maimonide (1135-1204), erede di Avicenna, opera la fusione fra la tradizione biblica e le conoscenze del mondo arabo. In particolare, egli concentrò la sua opera sulle norme dietetiche e sulla modifica delle abitudini scorrette (Brigo, 2009).
o Cultura medievale
In Occidente, nell’epoca medievale lo studio della medicina è affidato ai religiosi. I monaci vivono ritirati in conventi dove la regola impone la preghiera, lo studio e l’assistenza degli infermi. Nei monasteri nascono orti botanici dove vengono coltivate le piante medicinali. Queste sono utilizzate per la cura degli ammalati, che vengono spesso ricoverati e curati nel convento stesso. Si vengono così a formare vere e proprie scuole di medicina, dirette dai monaci. Nel Medioevo le virtù terapeutiche dei vegetali vengono intuite attraverso un’analisi comparativa della forma e del colore dei frutti, delle foglie, delle radici, con la forma e il colore di organi e visceri del corpo umano. Su questa «similitudine magica delle signature» si intesse un interessante abbinamento tra organo e pianta corrispondente. Ildegarda (1098-1179), badessa benedettina del monastero Rupertsberg, definita “la santa guaritrice”, fu probabilmente la prima donna medico. Nel
De arboris definisce le proprietà di 250 piante medicinali, segnalando per
la prima volta le proprietà di alcune di esse, come arnica e pilosella. Alberto Magno (1193-1280), monaco dell’ordine domenicano, fu uno dei più grandi dotti del Medioevo e fu tra l’altro maestro di san Tommaso d’Aquino (Brigo, 2009).
o Cultura nordeuropea
Nelle regioni del Nord Europa i druidi utilizzavano 10 piante medicinali ritenute magiche: il vischio bianco di quercia nella preparazione della
~ 12 ~
bevanda dell’immortalità, lo stramonio, l’iperico, il giusquiamo, la circea o erba delle fate, il trifoglio a cinque foglie, la verbena o erba della divinazione, la maggiorana, la ninfea alba, il ginocchiello (Brigo, 2009).
o Cultura rinascimentale
La fitoterapia moderna ha origine nel periodo rinascimentale con la nascita delle prime scuole mediche laiche e delle prime università. La Scuola medica salernitana (secoli XI-XIII) fu la prima del suo genere e divenne famosa in tutto il mondo allora noto per i suoi maestri e per il suo orto botanico. Nel XII secolo sorge l’università di Montpellier, considerata da molti come l’erede della Scuola salernitana. Lo spagnolo Arnaldo da Villanova (1240-1312) ne è il maestro più illustre. Egli opera affidandosi alla ragione, uscendo dagli schemi empirici e dogmatici. È il primo a intuire che i principi attivi contenuti nelle piante vengono ceduti all’alcol durante la macerazione. Questo risveglio culturale coincide storicamente con il Rinascimento, durante il quale la mente umana, stimolata anche dalle recenti scoperte geografiche, cerca di dare una risposta scientifica alle conoscenze basate fino ad allora sull’empirismo.
Uno degli studiosi di rilievo di questo periodo fu Paracelso (1493-1541) che cercò di isolare dalle piante la loro “quintessenza”. Raggruppò i vegetali in base alle caratteristiche morfologiche, definendo così la “similitudine magica delle signature”. Questi esempi di ricerca favorirono la fioritura di orti botanici, dove gli studiosi avevano la possibilità di compiere studi ed esperimenti direttamente sulle piante fresche. Nacque così l’orto botanico di Padova per opera di Anguillara, Guillandini e Falloppio, seguito da quello di Pisa e da altri ancora. Tali orti botanici svolgevano anche funzioni di controllo sulla qualità e genuinità delle piante medicinali in commercio. Il progredire delle conoscenze nel campo della chimica e la messa a punto di apparecchiature adatte alla ricerca
quali-~ 13 quali-~
quantitativa, consentirono un allontanamento progressivo dall’empirismo e dalle manipolazioni magiche degli alchimisti verso una sempre maggiore verifica scientifica. L’apporto dello studioso svedese Carlo Linneo (1707-1778) è fondamentale per lo studio sistematico delle piante. Nella sua opera
Systema Naturae introduce, come principio di distinzione e di
classificazione delle piante, la distribuzione dei sessi nei fiori. Egli divide il regno vegetale in due grandi branche: le Crittogame, con stami e pistilli invisibili a occhio nudo e le Fanerogame, nelle quali tali organi sono ben visibili. Queste ultime, a loro volta, saranno divise dal naturalista svedese in 23 classi, in base alle loro differenze morfologiche (Brigo, 2009).
o Cultura moderna
La fitoterapia moderna si caratterizza soprattutto per la codificazione delle regole di raccolta, preparazione e utilizzazione delle piante medicinali. La ricerca attuale cerca inoltre di isolare, testare e riprodurre i principi attivi responsabili dell’attività farmacologica dei fitocomplessi. Si cerca infine di comprendere le ragioni dell’attività terapeutica diversa ottenuta con il fitocomplesso nella sua totalità, rispetto a quella ottenuta con i singoli principi attivi (Brigo, 2009).
A
RGOMENTO DEL PRESENTE LAVOROIn questo lavoro tratteremo di una pianta esemplare dell’erbario cinese: il ginseng. Utilizzato da millenni in estremo Oriente come rimedio del massimo yang ad azione tonica, stimolante e rivitalizzante, in grado di conservare la giovinezza, aumentare la vitalità, ristabilire l’energia, ridurre la fatica, migliorare l’umore, facilitare la memoria, favorire l’attività sessuale, stimolare le difese immunitarie, ottimizzare le prestazioni sportive, prevenire l’invecchiamento, il ginseng è stato considerato come vera e propria “panacea”.
~ 14 ~
In Asia il ginseng è così importante da meritarsi persino un proverbio: “Il genere umano ha la sua più alta espressione nel saggio, il mondo minerale nell’oro, le pietre preziose hanno la regina nella giada e il mondo vegetale ha il suo re nel ginseng”.
In particolare saranno analizzati gli effetti dei componenti del ginseng sul sistema nervoso centrale e i meccanismi di neuro protezione che questi esercitano.
~ 15 ~
C
APITOLO
2
Botanica e chimica del
Ginseng
Con il termine Ginseng si designano numerose specie ad attività tonica-adattogena (Tabella 1). Vanno distinti due gruppi principali (Bruni, 1999). • Il primo comprende specie nell’ambito del genere Panax, come il vero G. o G. cinese o G. coreano, P. ginseng, la specie principale, e le altre varietà e specie correlate asiatiche, P. notoginseng, P. pseudo-ginseng, P.
japonicus, P. trifolius, P. stipuleanatus, P. vietnamensis.
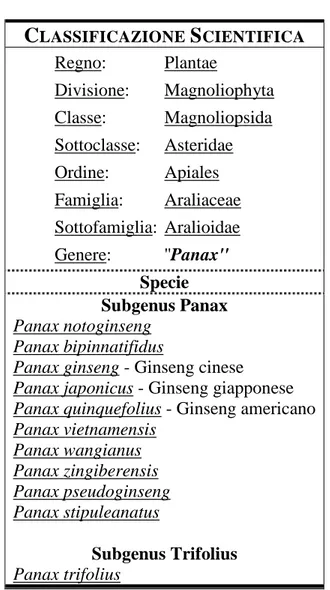
CLASSIFICAZIONE SCIENTIFICA Regno: Plantae Divisione: Magnoliophyta Classe: Magnoliopsida Sottoclasse: Asteridae Ordine: Apiales Famiglia: Araliaceae Sottofamiglia: Aralioidae Genere: ''Panax'' Specie Subgenus Panax Panax notoginseng Panax bipinnatifidus
Panax ginseng - Ginseng cinese Panax japonicus - Ginseng giapponese Panax quinquefolius - Ginseng americano Panax vietnamensis Panax wangianus Panax zingiberensis Panax pseudoginseng Panax stipuleanatus Subgenus Trifolius Panax trifolius
~ 16 ~
Ginseng asiatico (Panax ginseng= P.schinseng, P. pseudo-ginseng). Pianta erbacea (fam. Araliacee) di origine orientale. Caule solitario alto 40-50 cm, alle cui estremità sono disposte le foglie palmato-composte con 5 foglioline lungamente picciolate, inserite a verticillo. Le foglioline sono ellittiche e seghettate al margine. Infiorescenza terminale a ombrella semplice su uno scapo che emerge al centro della base delle foglie. I fiori sono diploclamidei, monoclini, con perianzio a 5 membri. I frutti sono delle piccole bacche rosse di due tipi: quelli con due semi a forma di fagiolo oppure con un solo seme di forma irregolarmente globosa. La parte ipogea può essere considerata divisa in tre parti: una “testa” o corona del rizoma; il “collo” o corto rizoma; il corpo della radice. La droga è costituita dalle radici essiccate, che hanno lunghezza tra i 3 e i 20 cm e complessivamente presentano aspetto cilindrico allungato, sono rastremate verso il basso e con tendenza ad incurvarsi verso il basso. Se sono presenti ramificazioni, queste sono limitate alla parte superiore ed in numero di una o due. La forma complessiva della radice può ricordare quella di un uomo, ed infatti da essa deriva il nome Ginseng che in cinese significa piccolo uomo. La superficie è rugosa per striature longitudinali e nella parte superiore si notano anellature più o meno marcate che confinano con il corto rizoma. La corteccia, spessa 3 mm, ha colore variabile dal giallastro al bruno chiaro, ma nella cosiddetta varietà coreana si hanno anche colorazioni decisamente rossicce; quest’ultime sono tuttavia il risultato del processo di essiccazione. Si raccoglie la radice in autunno al 4°-5° anno di coltivazione quando maggiori diventano il peso della droga ed il contenuto di principi attivi (Bruni, 1999).
Il Ginseng ha una distribuzione geografica molto limitata comprendente l’Estremo Oriente, ma le piante spontanee sono molto rare e quindi al
~ 17 ~
notevole fabbisogno si è provveduto da tempo mediante coltivazioni in Corea, Cina e Siberia.
La coltivazione del ginseng è piuttosto diversa da quella delle altre piante da raccolto (Figura 1). Una volta coltivato, non può essere ricoltivato nello stesso campo per almeno quindici anni. I campi devono essere attentamente selezionati poiché il prodotto dipende dalla natura del suolo e dalla posizione del terreno. È così esigente che il suolo deve essere preparato per due anni coltivando ripetutamente foglie fresche.
Il ginseng deve crescere all’ombra, senza l’applicazione di fertilizzanti chimici.
Figura 1-Coltivazioni di Ginseng.
È importante raccogliere le radici quando hanno raggiunto la massima crescita, ma è necessario che vi sia equilibrio tra la radice principale e le radici laterali. Il primo anno la radice principale si sviluppa con circa 30-40 radici laterali che cadono o vengono tagliate per essere trapiantate l’anno successivo. Dopo il trapianto nel secondo anno, le radici laterali crescono di nuovo. Nel terzo anno si raggiunge il massimo allungamento della radice principale ed il maggior numero di radici laterali. Nei seguenti 2-3 anni, mentre le radici laterali e sottili crescono sia in lunghezza che in volume, la radice principale si accresce soltanto in volume, così da determinare la caratteristica forma del ginseng.
~ 18 ~
La radice di ginseng appena raccolta è detta “susam” o ginseng fresco, poiché non è ancora stato seccato. Il susam contiene circa il 75% d’acqua e quindi può facilmente marcire, e di solito non dura più di una settimana. A seconda della diversa lavorazione della radice vi sono due tipi di ginseng: rosso e bianco. Nel Ginseng bianco, le radici raccolte fresche vengono lavate e rimosse le radici laterali. Dopo raschiatura e sbiancatura con anidride solforosa, le radici sono essiccate al sole oppure in essiccatore a 100-200 °C, ottenendo in questo modo la perdita degli strati più scuri. Nel Ginseng rosso, le radici fresche sono trattate con vapore a 120-130 °C per circa 2-3 ore e quindi essiccate, assumendo un aspetto rossastro e vetroso. • Il secondo gruppo comprende il Ginseng americano (Panax
quinquefolium) (Figura 2). Specie americana (fam. Araliacee) del Canada
molto simile nell’aspetto al Ginseng asiatico. A seguito dell’ampia richiesta del ginseng da parte delle popolazioni asiatiche si sono effettuate delle coltivazioni nel Wisconsin per la produzione del Ginseng americano, fino a raggiungere le centinaia di tonnellate che quasi totalmente sono esportate in Oriente. Costituzione ed usi analoghi a quelli del ginseng asiatico.
~ 19 ~
Il secondo gruppo comprende una serie di specie differenti per la classificazione sistematica e per la costituzione chimica, quali il Ginseng siberiano, Eleutherococcus senticosus, il Ginseng selvatico, Aralia
nudicaulis, il Ginseng dell’Alaska, ed Echinopanax horridum, sempre
nell’ambito delle Araliacee, ed ancora in altre famiglie il Ginseng sudamericano o brasiliano, Pfaffia paniculata, il Ginseng americano rosso selvatico, Rumex hymenosepalus, il Ginseng indiano, Withania somnifera, il Ginseng delle Ande, Lepidium meyenii (Bruni, 1999).
Figura 3-Radice di Ginseng.
La radice (Figura 3), droga del ginseng, contiene: polisaccaridi, vitamine, steroli, olio essenziale (0.5%), polieni, ma i principi attivi specifici sono delle saponine steroidali (1-3%), i ginsenosidi (detti anche panaquilin o panaxosidi). Presenti anche alcoli sesquiterpenici che sono considerati gli unici costituenti specifici, in quanto assenti negli altri Panax. Tuttavia, la composizione in saponine varia con la provenienza della droga: nel Ginseng coreano prevalgono i ginsenosidi, mentre in quello del Giappone i bisdesmosidi dell’acido oleanoico costituiscono circa la metà delle saponine ed infine nel Ginseng dell’Himalaya si registra una composizione intermedia rispetto ai precedenti.
~ 20 ~
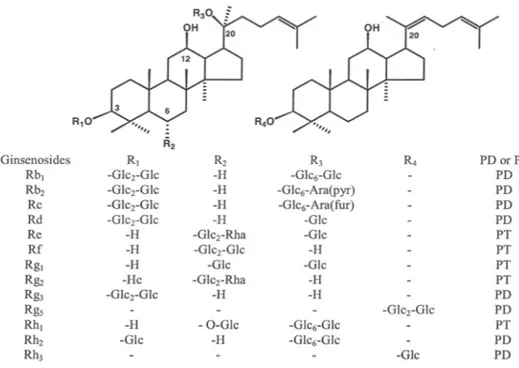
I ginsenosidi sono derivati triterpenici di tipo dammarano costituiti da 30 atomi di carbonio (Figura 4). Ciascun ginsenoside ha una comune struttura idrofobica di quattro anelli simil steroidea alla quale sono attaccate frazioni di zucchero (Nah et al., 2007). Circa 30 differenti tipi di ginsenosidi sono stati isolati ed identificati dalla radice di Panax ginseng (Baek et al., 1996). Questi sono classificati principalmente in ginsenosidi protopanaxadiolo (PD) e ginsenosidi protopanaxatriolo (PT) in accordo alla posizione delle diverse frazioni zuccherine al C-3 e al C-6. Ogni tipo di ginsenoside ha anche almeno tre catene laterali alle posizioni C-3, C-6 o C-20. Questa parte di catene sono libere o accoppiate a zuccheri contenenti monomeri, dimeri o trimeri. Queste componenti zuccherine potrebbero fornire specificità per gli effetti cellulari di ciascun ginsenoside (Choi et al., 2001b;
Rhim, 2003). Tuttavia, i ginsenosidi sono composti idrofobici, dato che non sono solubili in acqua.
Figura 4-Strutture chimiche dei principali tipi di ginsenosidi. Abbreviazioni per i carboidrati: Glc = glucopiranoside; Ara(fur) = arabinofuranosio; Ara(pyr) = arabinopiranoside; Rha =
ramnopiranoside. PD e PT stanno per protopanaxadiolo e protopanaxatriolo ginsenosidi, rispettivamente (Nah et al., 2007).
~ 21 ~
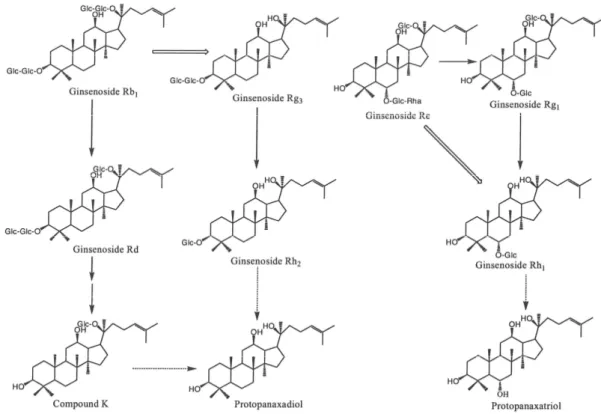
I principali componenti di ginseng fresco ed essiccato sono i manloyl-ginsenosidi Rb1, Rb2, Rc e Rd, e i manloyl-ginsenosidi Rb1, Rb2, Rc, Re, Rf, Rg1, e Rg2 (Tanaka et al., 1972). Tuttavia il ginseng rosso contiene anche i ginsenosidi Rg3, Rg5, Rh1 e Rh2 (Kitagawa et al., 1983). Se i vari tipi di ginseng sono somministrati per via orale agli esseri umani, i loro costituenti non possono essere facilmente assorbiti dall’intestino a causa della loro idrofilia (Hasegawa et al., 1997; Bae et al., 2002a). Inevitabilmente nel
tratto intestinale essi entrano in contatto con e sono metabolizzati dalla microflora intestinale. Ad esempio, PD ginsenosidi Rb1, Rb2 e Rc di ginseng fresco e bianco sono trasformati in 20-O-β-d-glucopiranosil-20(S)-PD (composto K) da batteri intestinali umani (Akao et al., 1998; Bae et al., 2000; Bae et al., 2002a). I PD ginsenosidi Rg3e Rg5 di ginseng rosso sono
trasformati nei ginsenosidi Rh2 e Rh3, rispettivamente (Bae et al., 2002b;
Bae et al., 2004a). I PT ginsenosidi Re e Rg1 sono trasformati nel
ginsenoside Rh1 e ulteriormente in PT (Figura 5) (Wang et al., 2000; Bae
et al., 2005). I metaboliti sono quindi facilmente assorbiti dal tratto
gastrointestinale, dal momento che la maggior parte dei metaboliti sono non polari rispetto ai componenti iniziali. Ad esempio, quando il ginsenoside Rb1 è somministrato per via orale a ratti, il suo metabolita, il composto K, ma non il ginsenoside Rb1, è assorbito nella circolazione (Akao et al., 1998). Quando estratti standardizzati di Panax ginseng (G-115, 100 mg) sono somministrati oralmente a esseri umani, alcuni metaboliti, come il composto K e i ginsenosidi Rg1 e Rh1, vengono rilevati nel sangue (Tawab et al., 2003). Questi metaboliti assorbiti possono produrre azioni farmacologiche. Tuttavia, molti ricercatori non hanno considerato il metabolismo dei componenti del ginseng da parte della microflora intestinale nella valutazione della farmacologia del ginseng.
~ 22 ~
Figura 5-Strutture e percorsi metabolici dei ginsenosidi Rb1, Re, Rg1 e Rg3 ad opera della microflora intestinale dell’uomo (Lee et al., 2006a).
~ 23 ~
C
APITOLO
3
Attività farmacologica del
Panax notoginseng
Prendendo in esame l’attività farmacologica e i componenti del sanchi ginseng (Panax notoginseng) (Tabella 2), si può affermare che la maggior parte delle scoperte farmacologiche è basata sulle saponine o glicosidi sterolici, sebbene siano stati segnalati polisaccaridi con attività immunopotenziante, proteine con attività antifungina, ribonucleasica e xilanasica, e un triacilglicerolo (la trilinoleina) con attività antiossidante. Sono state descritte le azioni di protezione dei componenti del Panax
notoginsneg nei confronti dell’ischemia cerebrale, gli effetti benefici sul
sistema cardiovascolare, e le attività emostatica, antiossidante, ipolipidemica, epatoprotettiva, nefroprotettiva e simil-estrogenica (Ng, 2006).
E
FFETTO SUL FEGATOLe saponine di P. notoginseng (PNS) hanno dimostrato un effetto protettivo sul danno epatico acuto indotto da tetracloruro di carbonio, paracetamolo, cloruro di cadmio e alcool allilico nei topi maschi (Liu et al., 1994). Le PNS estratte dai boccioli dei fiori proteggono contro il danno epatico indotto da galattosamina e lipopolisaccaride.
Dalla frazione di saponine epatoprotettive sono state isolate cinque saponine triterpeniche di tipo dammarano, comprendenti i notoginsenosidi -O, -P, -Q, -S e -T, e nove oligoglicosidi di tipo protopanaxadiolo noti (Yoshikawa et al., 2003).
~ 24 ~
Un estratto di acqua calda di P. notoginseng dopo somministrazione cronica orale di etanolo nei topi, ha impedito l’aumento nel siero di glutammato-ossalacetato transaminasi e glutammato-piruvato transaminasi e la perossidazione lipidica epatica (Lin et al., 2003).
Le PNS sono state utilizzate dopo trapianto autologo epatocellulare intrasplenico con il 70% di epatectomia. In questo modo gli epatociti sono stati protetti da danno ischemico da riperfusione nello stadio iniziale dopo il trapianto (Deng et al., 2001).
Wu et al. (2003) hanno riportato gli effetti delle PNS sull’espressione del fattore di necrosi tumorale α in ratti con fibrosi epatica.
Park et al. (2005) hanno mostrato che il P. notoginseng impedisce la fibrosi epatica e la disfunzione microvascolare nei ratti.
E
FFETTO SUI RENILe PNS possono essere utili per la prevenzione e il trattamento di fibrosi renale interstiziale (Wei et al., 2002) e nello stadio terminale di malattie renali (Wang et al., 2004b). Liu e Zhou (2000) hanno osservato che le PNS
proteggono da nefrotossicità indotta da cisplatino nei topi.
A
TTIVITÀ IPOGLICEMIZZANTE E EFFETTO SULLANEFROPATIA DIABETICA INIZIALE E MACROANGIOPATIA DIABETICA
Il ginsenoside Rg1 esercita un’azione ipoglicemizzante sul diabete indotto da allossana nei topi, mentre il livello di insulina circolante non è influenzato. Vengono stimolati l’assorbimento di glucosio, l’ossidazione del glucosio e la glicogenesi nel fegato. Dopo il trattamento con P.
notoginseng si è avuto un abbassamento del livello di trombossano B2 e un
~ 25 ~
riduzioni dei livelli urinari di albumina e β-2-macroglobulina e dei livelli ematici di α-1-microglobulina. Il progredire della nefropatia diabetica è stato ritardato. Liu et al. (2004a) hanno riportato gli effetti benefici delle
PNS su pazienti con macroangiopatia diabetica di tipo 2.
Tabella 2-Attività biologiche del Panax notoginseng (Ng, 2006).
ATTIVITÀ BIOLOGICA COMPONENTI/FRAZIONI CHIMICHE
Ipoglicemizzante Ginsenoside Rg1
Anti-nefropatia diabetica Estratto crudo Anti-macroangiopatia diabetica Estratto crudo
Epatoprotettiva Saponine
Nefroprotettiva Saponine
Immunomodulatrice Polisaccardidi Saponine Adiuvante immunologica Saponine
Antinfiammatoria Saponine Analgesica Trilinoleina Estratto acquoso Antiossidante Trilinoleina Estratto acquoso Ipolipidemica Saponine Antitumorale Estratto Ginsenoside Rb1 Simil-estrogenica Ginsenoside Rg1 Miglioramento della motilità
spermatica Frazione polisaccaridica Ginsenosidi Rc e Rb2 Emostatica Saponine Antitrombotica Saponine Trilinoleina Antiaterosclerotica Saponine Fibrinolitica Notoginsenoside R1 Antiaritmica Saponine Cardioprotettiva Saponine
Cronotropa e inotropa negativa Saponine Bloccante dei canali al calcio Saponine
Ipotensiva Saponine
Neuro protettiva Estratto crudo
Saponine
Antifungina Proteina
Ribonucleasica Proteina
~ 26 ~
A
TTIVITÀ ADIUVANTE IMMUNOLOGICA E AZIONE IMMUNO-STIMOLATRICE
I notoginsenosidi -D, -G, -H e -K aumentano i livelli sierici di IgG in topi sensibilizzati da ovoalbumina (Yoshikawa et al., 2001). Sun et al. (2003) hanno ottenuto risultati simili con le PNS. I polisaccaridi estratti dal P.
notoginseng hanno mostrato un’azione di incremento immunologico (Li,
1991).
Gao et al. (1996) hanno riportato quattro eteroglicani costituiti da glucosio, galattosio, arabinosio, mannosio e xilosio in differenti rapporti molari, che inducono la produzione di interferone γ.
Le PNS possiedono attività immunologica adiuvante (Sun et al., 2003, 2004).
A
TTIVITÀ ANTI-
INFIAMMATORIA E ANALGESICAÈ stata riportata l’attività antiinfiammatoria delle PNS. Li e Chu (1999) hanno osservato che il meccanismo d’azione antiinfiammatoria delle PNS è stato correlato all’inibizione del livello di Ca2+ nei neutrofili , all’attività della fosfolipasi A2 e alla diminuzione del contenuto di dinoprostone negli essudati infiammatori di ratto. Tuttavia, Wei et al. (1999) nei loro studi non hanno notato alcun effetto antiinfiammatorio delle PNS.
È stato notato l’aumento della soglia del dolore in topi con infiammazione indotta da liquido di paraffina dopo somministrazione intraperitoneale di PNS.
A
TTIVITÀ ANTI-
INFIAMMATORIA NELLA CARCINOGENESIMEDIATA DALL
’
INFIAMMAZIONEProve cliniche dimostrano che l’infiammazione cronica contribuisce al cancro (Hofseth e Ying, 2006). Le molecole chiave coinvolte nella
~ 27 ~
carcinogenesi dovuta all’infiammazione includono: il fattore nucleare kB (NF-kB); i recettori di tipo Toll; le specie reattive dell’ossigeno e dell’azoto (RONS); le ciclo ossigenasi (COXs); l’ossido nitrico sintetasi (NOSs); le citochine pro- e anti-infiammatorie; i metalli; gli enzimi antiossidanti; i ligandi del recettore attivato dal proliferatore del perossisoma; le chinasi; i fattori di crescita; le proteine soppressori del tumore, p53 e retinoblastoma (pRb) (Hofseth e Wargovich, 2007).
Studi indicano che il ginseng può essere utilizzato come potenziale agente chemiopreventivo o per il trattamento adiuvante. È stato dimostrato che alcuni tumori diminuiscono in modo significativo con l’uso del ginseng, tra questi i tumori della faringe, dello stomaco, del fegato, del pancreas e del colon (Kakizoe, 2000; Shin et al., 2000). I meccanismi con cui agiscono i componenti del ginseng sulle cellule tumorali includono l’inibizione del danno al DNA (Park et al., 2005), l’induzione dell’apoptosi (Volate et al., 2005), e l’inibizione della proliferazione cellulare (Kang et al., 2005). È inoltre sempre più evidente che il ginseng ha potenti effetti sulla cascata infiammatoria e può inibire la sequenza infiammazione-cancro.
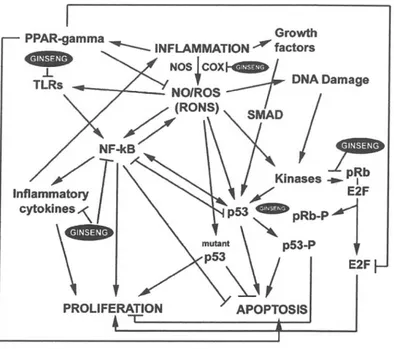
Ci sono prove che il ginseng ha effetti potenti sui componenti chiave nella cascata infiammatoria (Figura 6).
Il ginsan, un polisaccaride estratto dal P. ginseng, ha dimostrato l’inibizione di NF-kB in vitro e l’inibizione delle citochine pro-infiammatorie in vivo (Ahn et al., 2006). Un estratto di ginseng fermentato può inibire l’espressione inducibile del NOS (iNOS) e la successiva produzione di ossido nitrico.
Attualmente stanno analizzando gli effetti del P. quinquefolius sulla produzione di ossido nitrico nei macrogafi ANA-1 del topo e nelle cellule del colon, indagando sulle potenzialità del ginseng di inibire il cancro del colon.
~ 28 ~
È quindi interessante notare che il ginseng inibisce la produzione del fattore di necrosi tumorale α indotta dal lipopolisaccaride e altre citochine proinfiammatorie in macrofagi coltivati (Rhule et al., 2006). Un tale effetto, quindi, può avere un risultato chemiopreventivo.
Figura 6-Effetti del Ginseng sui componenti chiave coinvolti nella sequenza infiammazione-cancro. Abbreviazioni: COX, ciclossigenasi; MMP, metalloproteasi della matrice; NF-kB, fattore nucleare kB; NO, ossido nitrico; NOS, ossido nitrico sintetasi; pRb, proteina retino blastoma; PPAR, recettore attivato dal proliferatore del perossisoma; RONS, specie reattive dell’ossigeno e dell’azoto; ROS, specie reattive dell’ossigeno; TLR, recettore Toll-like (Hofseth
e Wargovich, 2007).
A
TTIVITÀ ANTIOSSIDANTE ED EFFETTO SUI LIVELLIPLASMATICI DEI LIPIDI
L’estratto acquoso di P. notoginseng si è dimostrato in grado di inibire l’emolisi. Il suo estratto organico svolge alcune attività inibitorie sulla perossidazione lipidica, mentre il suo estratto acquoso ha mostrato attività più deboli (Ng et al., 2004). Lin et al. (2003) hanno osservato che un estratto con acqua calda di P. notoginseng inibisce la perossidazione lipidica etanolo-indotta in omogenato di fegato di topo. È stata osservata l’attività ipocolesterolemica e ipotrigliceridemica delle PNS nei ratti e nelle
~ 29 ~
quaglie. Cicero et al. (2003) hanno osservato che, nei ratti, le radici polverizzate di P. notoginseng riducono la concentrazione di colesterolo totale nel plasma senza influire sul livello del colesterolo HDL.
A
TTIVITÀ ANTITUMORALEYu (1993) ha riferito che la droga Hua-sheng-ping, composta di erbe tra cui
P. notoginseng, si è dimostrata efficace su pazienti precancerosi.
Konoshima et al. (1999) hanno descritto l’effetto inibitorio dell’estratto di radice di P. notoginseng sui tumori della pelle nei topi. Chen et al. (2001a)
hanno osservato nei topi che l’estratto di P. notoginseng e il ginsenoside Rb1 aumentano la sensibilità di un tumore sperimentale, il sarcoma KHT, alle radiazioni ionizzanti. Chung et al. (2004) hanno osservato che il P.
notoginseng può essere efficacemente utilizzato per il trattamento del
cancro alla prostata nell’uomo.
Alcuni componenti del ginseng hanno mostrato tossicità nei confronti di cellule del cancro al seno (He et al., 2005).
La polvere di P. notoginseng incrementa la secrezione gastrica e la circolazione sanguigna della mucosa gastrica e riduce la formazione di malondialdeide in ratti con una lesione precancerosa allo stomaco (Shi et
al., 2003).
E
FFETTO SULLA MOTILITÀ SPERMATICA E ATTIVITÀ SIMIL-ESTROGENICA
L’estratto acquoso, l’estratto con n-butanolo e la frazione polisaccaridica del P. notoginseng migliorano la motilità degli spermatozoi. I ginsenosidi Rc e Rb2 aumentano la motilità spermatica (Chen et al., 2001b). L’attività
~ 30 ~
A
TTIVITÀ EMOSTATICAL’applicazione esterna delle PNS alla coda sezionata di ratto riduce il tempo di sanguinamento. Anche l’estratto alcolico di P. notoginseng ha dimostrato di avere un’azione di riduzione del tempo di sanguinamento (White et al., 2001).
E
FFETTO SULL’
AGGREGAZIONE PIASTRINICA E ATTIVITÀANTI
-
ATEROSCLEROTICAWang et al. (2004a) hanno riportato che le PNS riducono l’attivazione,
l’adesione e l’aggregazione piastrinica. Impediscono le trombosi e migliorano la microcircolazione in pazienti con sindrome da iperviscosità del sangue. Zhao et al. (1994) hanno rilevato effetti simili di un farmaco contenente P. notoginseng su pazienti con trombosi cerebrale.
Le PNS inibiscono la proliferazione di cellule coltivate di muscolo liscio aortico stimolate da siero ipercolesterolemico. Perciò possono ritardare la progressione delle lesioni aterosclerotiche.
E
FFETTO SUL SISTEMA FIBRINOLITICOIl notoginsenoside R1 stimola la produzione dell’attivatore tissutale del plasminogeno senza influire sull’attivatore del plasminogeno di tipo urochinasi o sull’inibitore-1 dell’attivatore del plasminogeno in colture di cellule umane endoteliali della vena ombelicale (Zhang et al., 1994). Il notoginsenoside R1 aumenta anche il potenziale fibrinolitico di colture di cellule muscolari lisce di arteria polmonare umana aumentando la sintesi di attivatori del plasminogeno. Questa azione di R1 può spiegare l’effetto benefico di P. notoginseng per il trattamento di malattie cardiovascolari (Zhang et al., 1997).
~ 31 ~
E
FFETTO SU PAZIENTI CON ANGINA PECTORIS CORONARICAIl trattamento di pazienti con una miscela di radici di P. ginseng e radici di
P. notoginseng produce miglioramenti sui sintomi generali e sulla forza
fisica insieme a cambiamenti nel metabolismo lipidico (Yuan et al., 1997).
E
FFETTO SUL SISTEMA CARDIOVASCOLARELe PNS esercitano un’azione antiaritmica (Li e Zhang, 1988). È stato riportato l’effetto di P. notoginseng sulla coagulazione intravascolare disseminata sperimentale. Wang e Chen (1984) hanno descritto l’effetto cardiaco e emodinamico delle PNS. Sono state osservate azioni depressive delle PNS sulla muscolatura liscia vascolare e i loro effetti cronotropo e inotropo negativi. Rao et al. (1987) hanno riportato l’azione di calcio antagonista delle PNS. Tuttavia, Zhang et al. (1999) hanno presentato prove che il ginsenoside Rg1 non è un antagonista del canale al Ca2+.
Le PNS diminuiscono la durata del potenziale d’azione veloce. Riducono la forza contrattile, la velocità massima di salita e l’ampiezza del potenziale d’azione lento, e la captazione del calcio da colture cellulari miocardiche. Gao et al. (1992) hanno osservato che la saponina panaxatriolo del P.
notoginseng ha una marcata attività antiaritmica nel modello di ratto con
ischemia indotta dalla legatura delle arterie coronarie e aritmie riperfuse. Le saponine riducono la dimensione degli infarti miocardici e proteggono dalla fibrillazione atriale indotta da CaCl2-acetilcolina e flutter atriale nel
topo. Hu et al. (1992) hanno dimostrato che l’estratto alcolico della coltura di P. notoginseng riduce la frequenza cardiaca e inibisce il restringimento degli archi aortici stimolato dalla noradrenalina. Le PNS inibiscono l’azione inotropa dell’ouabaina nell’atrio sinistro isolato di cavie. Li et al. (1993) hanno esaminato le azioni elettrofisiologiche della saponina panaxatriolo del P. notoginseng sulle fibre del Purkinje e nel cuore ovino.
~ 32 ~
Le saponine aumenteno la durata del potenziale d’azione senza influire sull’ampiezza, e bloccano i canali del potassio in uscita. Le PNS inibiscono totalmente l’ATPasi miocardica, ma non hanno effetto sullo scambio Na+ -K+ ATPasi miocardico. Il ginsenoside Rb1inibisce totalmente l’ATPasi miocardica e l’automatismo e la contrattilità di atri di cavie isolati. Il ginsenoside Rg1 inibisce l’ATPasi miocardica in minor misura.
Le PNS aumentano il livello di prostacicline nell’arteria carotide e riducono il trombossano A2 nelle piastrine del sangue nel coniglio. L’azione anti-aterosclerotica delle PNS può essere attribuita alla correzione dello squilibrio tra le due prostaglandine (Shi et al., 1990). Le PNS proteggono il cuore del ratto dai danni indotti dall’ischemia cardiaca con riperfusione. Ciò è stato osservato in una diminuzione della dimensione dell’infarto miocardico, riduzione della generazione di malondialdeide, rilascio cardiaco di creatininfosfochinasi e accumulo miocardico di Ca2+. Le PNS e l’Rb1, ma non l’Rg1, bloccano i canali del calcio (Xiong et al., 1989). In pazienti con ipertensione essenziale, il trattamento con PNS migliora la funzione diastolica del ventricolo sinistro; l’attività della pompa del calcio sul reticolo sarcoplasmatico risulta aumentata; il livello di calcio intracellulare miocardico è ridotto; la massa muscolare del ventricolo sinistro risulta aumentata (Feng et al., 1997).
La saponina panaxadiolo del P. notoginseng inibisce il battito indotto dall’isoproterenolo nell’atrio destro isolato del ratto e l’incremento della forza contrattile indotta dal Ca2+ nel colon isolato di cavia. Le saponine inibiscono il rilascio di Ca2+ intracellulare e il flusso di Ca2+ extracellulare bloccando i canali del calcio dipendenti dal potenziale e azionati dai recettori nella muscolatura liscia (Dan et al., 1993). L’estratto di P.
notoginseng diminuisce la pressione sanguigna nei conigli e nei ratti (Lei e
Chiou, 1986). Kwan (1995) ha riportato che le PNS possono agire come un antagonista insolito e selettivo del Ca2+ che non interagisce con i canali del
~ 33 ~
calcio di tipo L come nel caso della contrazione indotta dal KCl, ma possono invece interagire con i canali del Ca2+ azionati dai recettori come nel caso della contrazione indotta da fenilefrina.
Le PNS aumentano l’azione della pompa del calcio sul reticolo sarcoplasmatico con ridotta concentrazione di Ca2+ intracellulare miocardico, e diminuiscono la massa muscolare del ventricolo sinistro (Feng e Jiang, 1998). Le PNS inibiscono la distensione endotelio dipendente prevenendo l’aumento di concentrazione del Ca2+ nelle cellule endoteliali attraverso i canali del Ca2+ azionati dai recettori in presenza di canali cationici non selettivi aperti dall’acetilcolina o dall’acido ciclopiazonico (Kwan e Kwan, 2000).
Wu et al. (1995) hanno riferito che il ginsenoside Rg1 prolunga la refrattarietà ventricolare e la ripolarizzazione, e incrementa la soglia di fibrillazione ventricolare.
La trilinoleina, un triacilglicerolo del P. notoginseng, ha azione antitrombotica, antiaritmica e antiossidante. Questa riduce il danno da radicali liberi associato all’aterogenesi, e i danni miocardici dovuti a ischemia e riperfusione (Chan et al., 2002). La sintesi proteica indotta da angiotensina II, l’attività promotrice della catena pesante della β-miosina e la produzione di specie reattive dell’ossigeno intracellulare vengono inibite (Liu et al., 2004b).
Le PNS proteggono le arterie iliache di coniglio da danni endoteliali indotti (Chen et al., 2004).
E
FFETTI SU CERVELLO E OCCHILe PNS proteggono dall’amnesia indotta da scopolamina (Hsieh et al., 2000). Un aumento nel comportamento spontaneo si è osservato nei ratti dopo somministrazione orale di P. notoginseng (Cicero et al., 2000).
~ 34 ~
La perossidazione lipidica e i danni cellulari sono ridotti da un preparato di erbe contenente P. notoginseng in un modello di ratto con ischemia cerebrale incompleta da legatura bilaterale delle arterie carotidi comuni (Leung et al., 1991). Han et al. (1999) hanno riportato l’azione protettiva delle PNS sul danno ischemico cerebrale. La somministrazione di PNS entro 5 ore dall’inizio di ischemia cerebrale diminuisce l’edema cerebrale, le dimensioni dell’infarto e il deficit neurologico (He et al., 2004). La saponina panaxatriolo del P. notoginseng protegge dall’ischemia cerebrale focale nel cervello di ratto alleviando l’edema cerebrale (Yao e Li, 2002). Il trattamento ausiliario di pazienti con gravi lesioni cranio cerebrali con un preparato di P. notoginseng, produce un marcato effetto terapeutico. È stato rilevato un abbassamento della pressione intracranica (Ai et al., 2004). Le PNS impediscono il sovraccarico di Ca2+ e la formazione del complesso Ca2+-calmodulina nelle cellule nervose dopo danno cranio cerebrale (Han et
al., 1999).
Ma et al. (1999) hanno dimostrato che le PNS bloccano i canali al calcio nei neuroni. Le PNS, l’Rb1 e l’Rg1 attivano la Na+-K+ ATPasi sinaptosomiale del cervello di ratto. Le PNS e l’Rb1, ma non l’Rg1, inibiscono la Ca2+-Mg2+ ATPasi.
Le PNS proteggono i neuroni corticali coltivati di ratto dalla neurotossicità del glutammato (Ma et al., 1999) e i neuroni embrionali di pollo coltivati da danno cellulare ipossico indotto da NaCN. La perdita di ATP viene inibita e il ripristino di ATP viene accelerato; il rilascio di creatinchinasi viene ridotto. Le PNS riducono l’apoptosi e la necrosi nei neuroni, la concentrazione di calcio intracellulare neuronale e la perdita di lattato deidrogenasi (Zhu et al., 2003). La radice di P. notoginseng aumenta la crescita neuritica. Il notoginsenoside R aumenta la percentuale di cellule con neuriti multipolari. L’Rb1, l’Rb3 e l’Rb4 aumentano il numero di vene varicose (Tohda et al., 2002). Il ginsenoside Rd favorisce la
~ 35 ~
differenziazione degli astrociti dalle cellule staminali neurali (Shi et al., 2005). Le PNS sono vasodilatatrici dei vasi sanguigni nel cervello.
Il trattamento di pazienti affetti da occlusione venosa della retina con una combinazione di PNS e emodiluizione isovolumetrica riduce il tempo di circolazione retinica, e promuove la scomparsa dell’emorragia retinica, dell’edema, della perdita capillare e dell’edema maculare cistoide (Xi et al., 2000).
A
TTIVITÀ ANTIFUNGINAUna piccola proteina antifungina simile alla chitinasi con peso molecolare di 15 kDa (Lam e Ng, 2001a) e una proteina antifungina con peso di 35 kDa
(Lam e Ng, 2002a) sono state isolate dalle radici di P. notoginseng. La
prima inibisce la crescita del micelio in Fusarium oxysporum, Coprinus
comatus e Mycosphaerella arachidicola ma non in Rhizoctonia solani. La
seconda inibisce la crescita fungina in C.comatus, F.oxysporum, Botrytis
cinerea e Physalospora piricola ed esercita un’attività inibitoria sulla
trascrittasi inversa HIV-1.
A
TTIVITÀ RIBONUCLEASICA E XILANASICAUna ribonucleasi eterodimerica composta da una subunità di 27 kDa e una di 29 kDa è stata isolata dalle radici di P. notoginseng (Lam e Ng, 2001b).
Essa ha mostrato un’attività ribonucleasica potente. Sono state dimostrate attività antiproliferativa contro cellule L1210 leucemiche e attività antifungina contro C. comatus e P. piricola.
Una xilanasi a basso peso molecolare con attività inibitoria sulla trascrittasi inversa HIV-1 è stata isolata dalle radici di P. notoginseng (Lam e Ng, 2002b).
~ 36 ~
F
ARMACOCINETICA E BIODISPONIBILITÀLa farmacocinetica e la biodisponibilità dei ginsenosidi di P. notoginseng nei ratti sono stati studiati da Xu et al. (2003) e da Li et al. (2004a). il suo
profilo di escrezione è stato riportato da Li et al. (2004b). Le PNS sono
state assorbite in conigli in misura maggiore quando somministrate per via nasale rispetto ad altre vie. La formulazione in cellulosa microcristallina ha i vantaggi di un’alta biodisponibilità e una bassa irritazione.
~ 37 ~
C
APITOLO
4
Effetti dei ginsenosidi sui
canali ionici
Tra le molteplici attività farmacologiche svolte dal ginseng, di particolare importanza sono gli effetti che questa pianta medicinale ha sul sistema nervoso centrale e sul sistema nervoso periferico. Recenti studi hanno mostrato che i ginsenosidi regolano i diversi tipi di canali ionici, come i canali ionici voltaggio-dipendenti e i canali ionici ligando-dipendenti, in cellule neuronali. I ginsenosidi inibiscono in maniera stereospecifica le attività dei canali voltaggio-dipendenti al Ca2+, K+ e Na+. I ginsenosidi inibiscono anche canali ionici ligando-dipendenti come i recettori dell’N-metil-d-aspartato, alcuni sottotipi di recettori nicotinici dell’acetilcolina e i recettori della 5-idrossitriptamina di tipo 3. Competizione e esperimenti di mutagenesi sito-diretta hanno rivelato che i ginsenosidi interagiscono con i siti di legame del ligando o con i siti del poro del canale e inibiscono lo stato aperto dei canali ionici. I ginsenosidi possono quindi essere utili e costituire una potenziale scelta terapeutica nel trattamento di malattie neurodegenerative (Nah et al., 2007).
E
FFETTI DEI GINSENOSIDI SUI CANALI IONICI VOLTAGGIO-DIPENDENTI
Effetti sui canali al Ca2+ voltaggio-dipendenti
Il Ca2+ è un secondo messaggero per la regolazione della contrazione, della plasticità, della secrezione, della trasmissione sinaptica e dell’espressione
~ 38 ~
genica (Catterall, 2000). L’innalzamento del Ca2+ citosolico nelle cellule eccitabili è principalmente ottenuto attraverso l’afflusso di Ca2+ per mezzo dei canali al Ca2+ presinaptici, i quali sono attivati dalla depolarizzazione della membrana. L’innalzamento del Ca2+ presinaptico è strettamente collegato al rilascio di neurotrasmettitore. Recenti studi hanno mostrato che ci sono almeno 5 differenti sottotipi di canali al Ca2+ come i tipi L- (o long lasting), N-, P/Q-, R- (le cinque tipologie di canali al Ca2+ ad alto voltaggio, HVA) e T- (o transienti, a basso voltaggio, LVA), e le loro esatte funzioni fisiologica e farmacologica sono ancora sotto studio (Miller, 2001). Il Ca2+ citosolico è strettamente controllato in condizioni normali, in quanto il sovraccarico di Ca2+ citosolico porta alla produzione di radicali ossidativi e innesca l’attivazione di vari enzimi che sono nocivi per le cellule (Berridge, 1998). Ad esempio, condizioni anomale come ictus, ischemia o insulti eccitotossici sono stati collegati alla perdita dell’omeostasi del Ca2+ citosolico e alla conseguente o precendete induzione di eccitotossicità secondaria attraverso l’attivazione dei recettori N-metil-d-aspartato (NMDA)/non-NMDA. Dall’innalzamento dei livelli di Ca2+ intracellulare causato da eccessiva stimolazione dei canali al Ca2+ e/o dei recettori eccitatori NMDA si ha un indicatore precoce di danno eccitotossico alle cellule neuronali, agenti bloccanti l’innalzamento dei livelli di Ca2+ intracellulare regolando i canali al Ca2+ e/o i recettori NMDA potrebbero avere effetti neuroprotettivi (Nikonenko et al., 2005; Menne et
al., 2006).
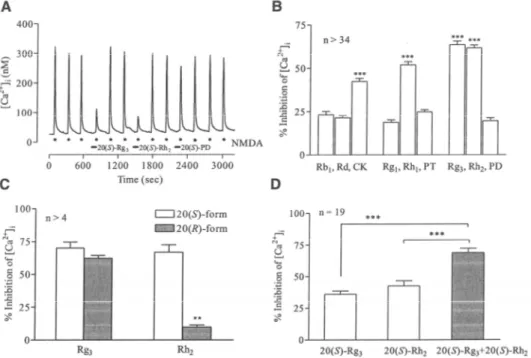
Studi recenti mostrano che i ginsenosidi inibiscono i canali al Ca2+ nelle cellule neuronali e in linee cellulari eterologhe. In neuroni sensoriali di ratto, ginsenosidi come Rb1, Rc, Re, Rf e Rg1 a 100 µM inibiscono in modo reversibile i canali al Ca2+ di tipo N e altri canali ad alto voltaggio (HVA) attivati per mezzo della tossina della pertosse (PTX) sensibile a proteine G (Nah et al., 2007). D’altra parte, Kim et al., (1998a) hanno
~ 39 ~
dimostrato che i ginsenosidi inibiscono i canali al Ca2+ in cellule cromaffini di ratto, che sono cellule neurosecretorie coinvolte nel rilascio di catecolamine in situazioni di stress. L’ordine di attività inibitoria dei ginsenosidi sui canali al Ca2+ di cellule cromaffini di ratto è: ginsenoside Rc > Re > Rf > Rg1 > Rb1. Il confronto tra i vari ginsenosidi è stato fatto utilizzando per ciascuno una concentrazione 100 µM. In cellule cromaffini bovine i ginsenosidi sono selettivi per i canali N-, P/Q- e R-, ma non per i canali al Ca2+ di tipo L (Choi et al., 2001a). È stato dimostrato che in
neuroni sensoriali di ratto il ginsenoside Rg3 ad una concentrazione di 100
µM inibisce più efficacemente i canali al Ca2+ di tipo L-, N- e P/Q- rispetto agli altri ginsenosidi testati. Lee et al. (2006b) hanno identificato i
principali componenti dei ginsenosidi o i metaboliti dei ginsenosidi che regolano i sottotipi di canali al Ca2+ clonati come i tipi α1C (L)-, α1B (N)-, α1A (P/Q)-, α1E (R)-, e α1G (T)- usando tecniche di voltage clamp. Essi
hanno definito ulteriori effetti dei ginsenosidi e dei loro metaboliti sulle correnti del Ba2+ (IBa) in ovociti di Xenopus che esprimono cinque differenti
sottotipi di canali al Ca2+. Questo studio ha dimostrato che tra i vari ginsenosidi come Rb1, Rc, Re, Rf, Rg1, Rg3, Rh2, il ginsenoside Rg3, ad una concentrazione di 100 µM, inibisce efficacemente tutti e cinque i sottotipi di canali al Ca2+, mentre il ginsenoside Rh2 inibisce più efficacemente i canali al Ca2+ di tipo α1C e α1E degli altri tipi di canale. Il
composto K, un metabolita di PD ginsenoside, inibisce fortemente solo i canali al Ca2+ di tipo α1G, mentre M4, un metabolita di PT ginsenoside, non
ha quasi nessun effetto su qualsiasi sottotipo di canali al Ca2+ esaminati. I ginsenosidi Rg3, Rh2 o il composto K spostano la curva di attivazione stazionaria in direzione depolarizzante nei tipi α1B e α1A senza spostare la
curva di inattivazione. Questi risultati rivelano che i ginsenosidi Rg3, Rh2 e il composto K sono regolatori del canale al Ca2+ e sono selettivi nell’inibizione di qualche sottotipo di canale al Ca2+. In aggiunta
~ 40 ~
all’inibizione del canale al Ca2+ attenuano l’aumento della capacità di membrana (∆Cm) stimolata in cellule cromaffini di ratto (Kim et al., 1998a).
l’ordine di attività inibitoria dei ginsenosidi, ad una concentrazione di 100
µM, sul ∆Cm è ginsenoside Rf > Rc > Re > Rg1 > Rb1. La diminuzione dei canali al Ca2+ e della capacità di membrana da parte dei ginsenosidi suggerisce che possono essere coinvolti da vicino nella regolazione del rilascio di neurotrasmettitori dalle terminazioni nervose.
Effetti sui vari canali al K+
Ci sono molti tipi di canali al K+ nelle cellule viventi. I seguenti tipi di canali al K+ sono stati identificati in sistemi neuronali e non neuronali: canali voltaggio-dipendenti, Ca2+-dipendenti, ATP-sensibili, e accoppiati a proteine G di tipo GIRK (G-protein-coupled inwardly rectifying) (Wickman e Clapham, 1995). La maggior parte dei canali al K+ è coinvolta nella regolazione della ripolarizzazione, durata della depolarizzazione in cellule eccitabili, e nel rilassamento della muscolatura liscia consentendo l’efflusso di ioni K+ dal citosol. È ben noto che i ginsenosidi rilassano i vasi sanguigni e altri muscoli lisci (Kim et al., 1999), ma il loro meccanismo non è ancora stato dimostrato chiaramente. Recenti studi mostrano che tutte le saponine del ginseng (ad una concentrazione di 50-500 µg/mL) e il ginsenoside Rg3 (100 µg/mL) attivano i canali al K+ Ca2+-dipendenti e ATP-sensibili nelle cellule muscolari lisce delle arterie coronarie del coniglio (Chung e Kim, 1999; Chung e Lee, 1999). Li et al. (2001) hanno dimostrato che i ginsenosidi (ad una concentrazione di 50 µg/mL) attivano i canali al K+ Ca2+-dipendenti in colture di muscolatura liscia vasale così come in cellule endoteliali. Nelle cellule endoteliali, il potenziamento dell’attività dei canali al K+ Ca2+-dipendenti da parte dei ginsenosidi può aumentare il flusso del Ca2+ e la secrezione di NO. Nel caso di cellule muscolari lisce dei vasi, questo effetto può inibire il flusso di Ca2+ e
~ 41 ~
rilassare le cellule della muscolatura liscia vasale. Questi risultati suggeriscono che i ginsenosidi potrebbero stimolare i componenti di membrana alla mobilizzazione intracellulare di Ca2+. Il Ca2+ mobilizzato attiverà i canali al K+ Ca2+-dipendenti, che a sua volta medieranno la ripolarizzazione delle cellule muscolari lisce depolarizzate ad opera di vari stimoli endogeni o esogeni.
D’altra parte, i canali GIRK sono conosciuti come regolatori della velocità di attivazione, del potenziale di membrana e delle risposte ai neurotrasmettitori, producendo quindi una iperpolarizzazione postsinaptica in cellule cerebrali. Nel cervello, i canali GIRK sono espressi principalmente nel bulbo olfattivo, nell’ippocampo, nel giro dentato e nella corteccia. Nel cuore, l’acetilcolina rilasciata dal nervo vago si lega ai recettori M2 e attiva i canali GIRK, rallentando il ritmo cardiaco (Dascal, 1997). Uno studio ha mostrato che il ginsenoside Rf attiva i canali GIRK quando i geni di questi canali sono coespressi negli ovociti di Xenopus con mRNA di cervello di ratto (Choi et al., 2002). Gli effetti del ginsenoside Rf sulla corrente GIRK è dipendente dalla concentrazione e reversibile. Altri ginsenosidi come i ginsenosidi Rb1 e Rg1 attivano debolmente questi canali. L’aumento della corrente GIRK indotto dal ginsenoside Rf è bloccato dal Ba2+, un bloccante dei canali al K+. L’attivazione dei canali al K+ Ca2+-dipendenti attraverso la mobilizzazione di Ca2+ intracellulare o l’attivazione dei canali GIRK ad opera dei ginsenosidi potrebbe fornire ulteriori prove del fatto che i ginsenosidi regolano lo stato elettrico delle cellule eccitabili.
Effetti sui canali al Na+ voltaggio-dipendenti
L’attivazione dei canali al Na+ voltaggio-dipendenti è direttamente coinvolta nell’induzione di potenziali d’azione in porzioni assonali e somatiche dei neuroni. Questi sono inoltre coinvolti nella propagazione
~ 42 ~
dell’informazione assonale o dendritica da una parte all’altra dei neuroni. Sono stati effettuati due studi sulla regolazione dei canali al Na+ da parte dei ginsenosidi. Jeong et al. (2004) hanno dimostrato che i ginsenosidi inibiscono i canali al Na+ specifici del cervello in linee cellulari tsA201 e in ovociti di Xenopus laevis. Precedentemente era stato usato estratto di ginseng (3 mg/mL) e ginsenoside Rb1 (a 150 µM) ad una concentrazione molto più elevata rispetto a quella usata in studi sulla regolazione di altri canali. Jeong et al. (2004) hanno mostrato che ad una concentrazione di 100 µM il ginsenoside Rg3 è molto più efficace degli altri ginsenosidi testati e hanno suggerito che il ginsenoside Rg3 possa essere un candidato per la regolazione del canale al Na+ neuronale. Ulteriori studi sui meccanismi molecolari alla base dell’inibizione del canale al Na+ indotta dal ginsenoside Rg3 usando mutagenesi sito-diretta, hanno rivelato che il ginsenoside Rg3 induce l’inibizione del tono e della risposta funzionale del picco di correnti al Na+ (INa) (Lee et al., 2005b). Il ginsenoside Rg3 produce
uno spostamento significativo della depolarizzazione nel voltaggio d’attivazione ma non altera lo stato stazionario del voltaggio di inattivazione. Le mutazioni nel sito di ingresso del canale, nella regione del poro, nei siti di legame della lidocaina/tetrodotossina, o nei segmenti sensibili al voltaggio non influiscono sul blocco tonico del picco di INa
indotto dal ginsenoside Rg3. Il ginsenoside Rg3 inibisce sia lo stato aperto che quello inattivato dei canali al Na+.
E
FFETTI DEI GINSENOSIDI SUI CANALI IONICI LIGANDO-DIPENDENTI
Effetti sui canali ionici NMDA-dipendenti
Il glutammato, uno dei maggiori neurotrasmettitori eccitatori nel sistema nervoso centrale, ha un ruolo importante nella plasticità e nella