2. MATERIALI E METODI
La specie
Posizione sistematica
L’occhione Burhinus oedicnemus (Linnaeus, 1758) appartiene all’ordine
Charadriiformes, sottordine Charadrii, famiglia Burhinidae. Tale famiglia è presente in
tutte le regioni biogeografiche, ad eccezione dell’Artide e dell’Antartide, e raggruppa nove specie, suddivise in due generi: Esacus (2 specie) e Burhinus (7 specie). Il genere
Esacus comprende le specie E. recurvirostris ed E. magnirostris presenti nell’Asia
meridionale e in Australia; il genere Burhinus comprende le specie B. senegalensis, B.
vermiculatus e B. capensis, presenti nel continente africano; B. bistriatus e B. superciliaris, distribuite nell’America centrale e meridionale; B. grallarius, diffuso in
Australia e Nuova Guinea. A queste si aggiunge B. oedicnemus, la specie a distribuzione geografica più ampia, il cui areale si estende dal sud dell’Inghilterra fino all’India, comprendendo anche le isole mediterranee e il Nord Africa. Di quest’ultima specie sono riconosciute sei sottospecie: B. o. oedicnemus (dal sud dell’Inghilterra ai Balcani), B. o. distinctus e B. o. insularum (isole Canarie), B. o. saharae (Nord Africa e isole del Mediterraneo), B. o. harterti (dalla Russia sud-orientale all’Iran), B. o. indicus (India e Sud-est asiatico) (Del Hoyo et al., 1996).
Morfologia
L’occhione è un uccello di taglia media e robusta, con ali e coda lunghe, testa voluminosa provvista di grandi occhi gialli contornati da un evidente sopracciglio e da una larga stria sulla guancia, entrambi bianchi (Figura 2.1). Il becco è robusto e di forma conica, giallo con la punta nera; le zampe sono piuttosto lunghe, gialle, con l’articolazione tarsale notevolmente ingrossata.
Figura 2.1 Esemplare adulto di occhione.
Il piumaggio è color sabbia, assai striato e con vermicolature che lo rendono notevolmente criptico, il dimorfismo sessuale è quasi assente (Cramp & Simmons, 1983). L’ala è caratterizzata da una banda bianca delimitata da due bande nere, ben visibile anche quando l’animale è in volo.
Il giovane si differenzia dall'adulto per la banda alare, che appare più larga, di colore bianco sporco tendente al marrone chiaro, senza bande scure al di sotto e al di sopra di essa. Inoltre il sopracciglio bianco sopra l'occhio è generalmente assente e le copritrici auricolari sono bianche, mentre negli adulti sono marrone chiaro (Green & Bowden, 1986).
Habitat
L’occhione predilige le regioni aride, steppiche e desertiche delle medie e basse latitudini, in vicinanza però di luoghi umidi e superfici d’acqua. Evita sia le aree ricoperte da densa vegetazione sia i climi freddi e ventosi delle latitudini più elevate (Cramp & Simmons, 1983).
Nidifica in ambienti aperti come brughiere, prati, pascoli, incolti, greti sassosi dei fiumi, zone costiere e dune sabbiose. Di recente, probabilmente a causa della riduzione e trasformazione dei siti di nidificazione abituali (Tucker & Heath, 1994), si è osservato un adattamento a nidificare in ambienti di origine antropica, quali campi coltivati, cave o zone dove la vegetazione viene mantenuta bassa (aree militari, campi da golf, ecc.) e perfino in vigneti e fattorie (Cramp & Simmons, 1983).
Distribuzione e fenologia
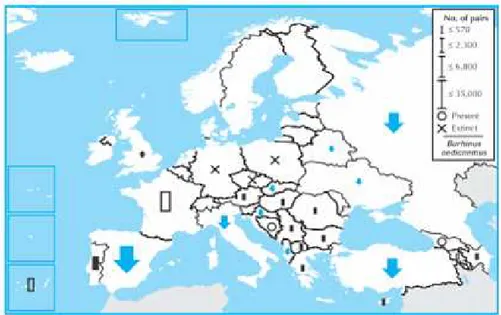
La sottospecie B. o. oedicnemus è presente in Europa orientale e occidentale (Figura 2.2); nel complesso Penisola Iberica, Francia e Russia ospitano circa il 95% della popolazione europea (Hagemeijer & Blair, 1997).
Figura 2.2 Distribuzione dell’occhione in Europa; in giallo la popolazione nidificante, in verde quella
sedentaria e in blu quella svernante (da del Hoyo et al., 1996; modificata).
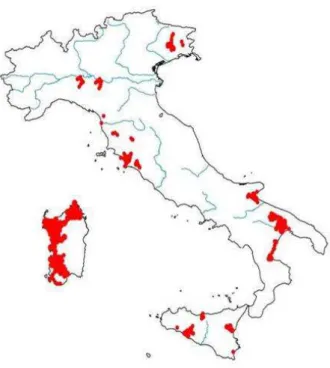
In Italia la presenza dell’occhione è frammentata e fortemente localizzata, anche se la sua distribuzione non è ben conosciuta a causa delle abitudini elusive e crepuscolari della specie (Meschini & Frugis, 1993; Bulgarini et al., 1998). Nella zona settentrionale della penisola la specie si ritrova soprattutto sui greti dei fiumi della Pianura Padana centro-occidentale, nelle aree magredili e nei greti fluviali delle pianure friulane. È scarsamente diffuso nell’Italia peninsulare, con concentrazioni maggiori lungo il litorale tosco-laziale. È presente in Puglia anche con popolazioni parzialmente sedentarie, mentre in Basilicata e Calabria è molto raro e localizzato. Risulta ben distribuito nelle grandi isole, Sardegna e Sicilia, con popolazioni sia migratrici sia parzialmente sedentarie (Figura 2.3. Brichetti & Fracasso, 2004). Una stima complessiva della popolazione nidificante italiana risulta essere di 1000 – 1500 coppie, complessivamente in diminuzione, ma con fenomeni di locale incremento (Brichetti & Fracasso, 2004).
Figura 2.3 Distribuzione dell’occhione in Italia (da Brichetti & Fracasso, 2004; modificata) Per quanto riguarda la fenologia, le popolazioni dell’Europa settentrionale ed occidentale e della Siberia occidentale sono principalmente migratrici, mentre nelle regioni meridionali possono essere stanziali o migratrici parziali. I principali quartieri di svernamento delle popolazioni nordeuropee si trovano nella parte settentrionale del continente africano, sebbene alcuni individui si fermino in Spagna e in Francia meridionale. Occasionalmente è stato registrato lo svernamento di qualche individuo in Inghilterra meridionale (Cramp & Simmons, 1983). In Italia popolazioni svernanti sono presenti in Calabria, Campania, Puglia, Sardegna, Sicilia, Toscana, con una consistenza numerica presumibilmente superiore alle 200 coppie (Brichetti & Fracasso, 2004).
Conservazione
L’occhione è una specie di rilevante interesse conservazionistico a causa del generalizzato declino numerico evidenziato sia a livello europeo che nazionale, principalmente causato dalla riduzione dell’habitat e dal suo degrado (Figura 2.4; Tucker & Heath, 1994). Per queste ragioni lo stato di conservazione dell’occhione viene indicato come SPEC 3 da BirdLife International (2004).
Figura 2.4 Andamento della popolazione di occhione nidificante in Europa (da BirdLife International,
2004).
La specie risulta inoltre inclusa negli allegati delle principali Convenzioni internazionali:
• Allegato I della Direttiva Uccelli (79/409/CEE), concernente la conservazione degli uccelli selvatici, come specie particolarmente protetta;
• Allegato II della Convenzione di Bonn (1979), relativa alla conservazione delle specie migratorie appartenenti alla fauna selvatica, come specie migratrice minacciata;
• Allegato II della Convenzione di Berna (1979), relativa alla conservazione della vita selvatica e dell’ambiente naturale in Europa, come specie rigorosamente protetta.
Per quanto riguarda il territorio nazionale, l’occhione risulta incluso nella Lista Rossa degli uccelli nidificanti in Italia come specie in pericolo (Calvario et al., 1999). I maggiori problemi per ciò che riguarda la conservazione della specie sono da imputare in particolare alla perdita di habitat ed al disturbo antropico. (Del Hoyo et al., 1996). È soprattutto la pressione antropica che incide sulla specie in esame, per la quale emerge un’interazione negativa con il pascolo e le pratiche agricolturali, quali l’incendio e la trasformazione di habitat semi-naturali in terre coltivabili. Tutte queste pratiche sottraggono territori di nidificazione e svernamento alla specie, costringendo le popolazioni di occhione all’uso di ambienti non ottimali, quali i campi coltivati stessi, in cui però la produttività risulta essere assai ridotta e in alcuni casi appena sufficiente al mantenimento della popolazione (Del Hoyo et al., 1996).
Biologia riproduttiva
La specie è essenzialmente monogama. La stagione riproduttiva inizia con l’arrivo delle coppie ai siti di nidificazione, in generale sembra che il maschio preceda la femmina ed inizi ad occupare un territorio di nidificazione (Cramp & Simmons, 1983). Gli occhioni si dimostrano fedeli ai siti di nidificazione durante gli anni, a meno di consistenti cambiamenti ambientali. La gran parte degli individui sembra riprodursi per la prima volta a 1 – 2 anni di età (Green & Griffiths, 1994), sebbene esista una certa frazione di animali di un anno che può tornare nei luoghi di nascita, senza però accoppiarsi (Cramp & Simmons, 1983). Il nido è molto semplice e viene costruito, presumibilmente da entrambi i partner, direttamente sul terreno; si limita spesso ad una leggera depressione o buca (ca. 16-22 cm di diametro per ca. 6-7 cm di profondità), che può essere arricchita, col procedere della cova, con piccoli sassi, rametti o escrementi di lepre (Figura 2.5; Cramp & Simmons, 1983).
Figura 2.5 Nido di occhione.
I nidi risultano generalmente ben distanziati tra loro, ma, in condizioni di habitat particolarmente favorevoli, le coppie possono nidificare anche a soli 75 m l’una dall’altra (Cramp & Simmons, 1983). L’occhione depone di norma 2 uova dalla colorazione notevolmente criptica, con un colore di fondo che può andare dal beige al grigio chiaro, variamente chiazzato e striato di marrone e grigio-viola (Figura 2.5). La
cova, a cui partecipano entrambi i partner, ha inizio dopo la deposizione del secondo uovo e dura circa 24 – 27 giorni, al termine dei quali la schiusa può avvenire in un unico giorno o in giorni consecutivi (Cramp & Simmons, 1983).
Subito dopo la schiusa, i pulcini sono coperti da piumino che, nelle parti superiori del corpo, ha una colorazione di fondo che va dal rosato pallido al giallo-bruno, finemente macchiettata di grigio chiaro; sottili linee nere attraversano la testa ed il corpo (Cramp & Simmons, 1983). Becco, iride e zampe sono inizialmente grigio-verdi (Figura 2.6).
Figura 2.6 Pulcino di occhione e uovo in schiusa.
I pulcini sono precoci e nidifughi e già dal secondo giorno di vita sono in grado di camminare ed allontanarsi dal nido. Vengono accuditi e alimentati da entrambi i genitori soprattutto nelle prime fasi dello sviluppo, ma rimangono dipendenti da loro fino all’involo, che avviene dopo 36 – 42 giorni dalla schiusa.
Foraggiamento
L’occhione si nutre principalmente di invertebrati terrestri (insetti e loro larve, lombrichi, gasteropodi e crostacei) e piccoli vertebrati (lucertole, rane e piccoli roditori) che caccia a vista (Martin & Katzir, 1994). Si alimenta singolarmente, a coppie o in piccoli gruppi (6 – 15 individui), durante le ore notturne, dal crepuscolo all’alba, quando gli invertebrati sono attivi sulla superficie del suolo (Cramp & Simmons, 1983). Questa tipologia di foraggiamento necessita di un ambiente aperto, caratterizzato da
vegetazione bassa e rada, tale da permettere l’individuazione delle prede senza impedimenti visivi (Figura 2.7).
Figura 2.7 Occhione in foraggiamento.
Area di Studio
Inquadramento geografico e geomorfologico
Il fiume Taro è uno dei principali affluenti di destra del fiume Po, nasce dal Monte Penna (1735 m s.l.m.), limite settentrionale dello spartiacque che separa la provincia di Parma da quelle di Piacenza e Genova. Il corso principale del fiume si sviluppa con direzione SW–NE nella provincia di Parma, per una lunghezza complessiva di circa 126 km. Dal punto di vista morfologico, idrologico e dinamico è un corso d’acqua a carattere torrentizio, con regime fluviale direttamente influenzato dalle precipitazioni.
Nella porzione più alta del suo corso, il fiume Taro, grazie all’energia acquisita per la forte pendenza, ha scavato il proprio alveo incidendo la roccia circostante e potendo così compiere un grande lavoro di erosione e trasporto di materiali anche grossolani (Centro Villa Ghigi, 1994). La litologia dei materiali è varia ed è legata al bacino di erosione: la maggior parte è costituita da ciottoli calcarei, arenacei e, in minor misura, ofiolitici. Questi materiali iniziano ad essere depositati in un’ampia conoide alluvionale presso Fornovo Taro, dove si verifica una brusca diminuzione di pendenza e il fiume
perde capacità di trasporto. Sopra tale conoide si snodano numerosi rami d’acqua intrecciati che si alternano a barre fluviali ciottolose; questa tipologia di alveo è definita
braided e deve la sua origine all’abbondante carico di fondo trasportato dal fiume
(Figura 2.8; Centro Villa Ghigi, 1994). Le piene fluviali favoriscono la formazione di canali e isole e ne modificano notevolmente la morfologia, anche di anno in anno.
Il Parco Fluviale Regionale del Taro include il tratto di conoide compreso tra il ponte stradale di Fornovo (130 m s.l.m.) e quello di Pontetaro (56 m s.l.m.), per una lunghezza di circa 20 km ed un’estensione di circa 2500 ha (Figura 2.9). La larghezza del letto, che nella zona del Parco rientra nella tipologia braided, varia dai 250 m nei pressi di Giarola ai 1250 presso Ozzano–Felegara. L’area Parco è interessata da un clima sublitoraneo padano con temperatura media annua di 13.5°C (stazione di Parma), piovosità concentrata in primavera e autunno, e con estati e inverni relativamente secchi.
Figura 2.9 Attuali confini della ZPS IT4020021 Medio e Basso Taro (Ministero dell’Ambiente).
Aspetti floristici e vegetazionali
La vegetazione presente nel Parco Fluviale Regionale del Taro è stata analizzata in dettaglio con il metodo fitosociologico (Biondi et al., 1997) e sono state individuate diverse associazioni, caratteristiche dei principali ambienti presenti nell’area di studio.
Il genere Potamogeton rappresenta il principale componente della vegetazione a idrofite sommerse e, nelle acque più o meno profonde, va a costituire fitocenosi sia monospecifiche che compenetrate tra loro. L’associazione
elofitiche tipiche dei canali e delle sponde del corso d’acqua. La vegetazione del letto fluviale ordinario, che si sviluppa su substrati limoso-ciottolosi, fortemente nitrificati dal deposito di materiali organici fluitati, è contraddistinta dall’associazione
Polygonum-Xanthietum italici. A queste specie dominanti si associano numerose
terofite nitrofile della classe Stellarietea mediae, provenienti da campi e ambienti ruderali. Su substrati limoso-argillosi, in ambiente più umido e sabbioso cresce l’associazione Cyperetum flavescentis mentre, in posizioni meno umide e più elevate del letto fluviale, Samolo valerandi-Caricetum serotinae. Sempre nelle zone più elevate del letto fluviale, in ghiaie frammiste a sabbia si riscontra sporadicamente la colonizzazione di Epilobio dodonaei-Scrophularietum caninae, che caratterizza l’aspetto del greto nel periodo tardo-estivo con le vistose fioriture di Epilobio dodonaei. Sui limi umidi ai margini del corso d’acqua, sommersi durante i periodi di piena, cresce una vegetazione erbacea dominata da Paspalum paspaloides. Nelle depressioni laterali del fiume con acque stagnanti durante la stagione invernale o al margine di profondi canali laterali si sviluppano associazioni dominate da Lythrum salicaria, che formano cinture vegetali profonde fino a 2 m. Su quelle porzioni di greto che solo occasionalmente vengono ricoperte dalle acque di piena si trovano dense fitocenosi dominate dall’esotica Solidago
gigantea, insieme a formazioni arbustive pioniere dell’associazione Salicetum incano-purpureae, che possono costituire anche piccole boscaglie.
Nella vegetazione dei terrazzi fluviali si osserva una evidente variazione floristica che procede allontanandosi dal greto. L’associazione Astragalo
onobrychis-Artemisietum albae è riferibile ai substrati ciottolosi, frammisti a sabbia, che ricoprono i
primi terrazzi, invasi saltuariamente dalle piene fluviali. La fascia degli arbusteti è riconducibile all’associazione Spartio juncei-Hippophaetum fluvialis. La fase di ricostruzione delle cenosi boschive è dominata dall’associazione Frangulo
alni-Prunetum avium, ed infine le formazioni forestali stabili sono riferibili a Aro italici-Alnetum glutinosae, con predominanza di Brachypodium sylvaticum. La vegetazione
ruderale e antropogena presente al margine dei boschi riparali, in prossimità dei sentieri e come infestante nelle colture agricole, è riconducibile alle classi Artemisietea vulgaris,
Metodologie utilizzate
Il comportamento spaziale della popolazione di occhione nidificante nel Parco del Taro è stato analizzato con due distinte metodologie. Inizialmente, negli anni dal 1999 al 2001, alcuni animali adulti sono stati seguiti nei loro spostamenti tramite la tecnica del radiotracking, che ha permesso di comprendere quali fossero le scelte spaziali operate dai singoli individui. Basandosi anche sulle informazioni ottenute da questa prima analisi di tipo più generale, si è passati ad uno studio di maggior dettaglio, realizzato negli anni 2007 e 2008, che ha previsto il rilievo di alcuni campi coltivati presi come campione ed il censimento notturno degli animali che si alimentavano in questi campi, per capire quali fossero le caratteristiche determinanti la scelta dell’habitat di foraggiamento.
Radiotracking
I soggetti sperimentali, individui adulti e nidificanti, sono stati catturati tramite trappole a caduta sul nido negli anni 1999 – 2001, nel tratto di fiume compreso tra le località di Noceto e Medesano. Al momento della cattura, oltre alla raccolta di dati biometrici, a tutti gli animali è stata applicata una radiotrasmittente (Biotrack, TW-4/Ag357) di circa 4.5 g (pari a 1 – 1.3% del peso dell’animale) che consentiva il riconoscimento individuale dei soggetti sulla base della frequenza di trasmissione del segnale (Figura 2.10).
La trasmittente è stata applicata alla base del secondo paio di penne timoniere tramite una colla a base di cianoacrilato e l’utilizzo di stringhe fissate attorno al rachide (Kenward, 2001); il tutto è stato infine ricoperto con colla tipo Bostik per impedire all’animale di introdurre il becco tra le fessure ed eventualmente rimuovere la trasmittente. Questa metodologia di applicazione non consente di seguire gli animali per periodi lunghi ma, in conseguenza della perdita della trasmittente durante il periodo di muta, permette di eliminare completamente il disturbo della marcatura, soprattutto durante la migrazione (settembre – novembre). Altri tipi di tecniche, ed in particolare l’imbracatura a zainetto, sono state evitate, poiché possono determinare una riduzione dei tassi di sopravvivenza degli animali marcati (si veda ad es. Dzus & Clark, 1996).
Le caratteristiche tecniche delle radiotrasmittenti utilizzate erano:
• Banda di frequenza: 150.700 – 151.000 MHz
• Dimensione: 22 × 13 × 7 mm
• Frequenza di emissione degli impulsi: 50 impulsi / min.
• Lunghezza dell’impulso: 25 ms
• Durata massima (in condizioni ideali): 4.9 mesi
• Portata massima (a livello del terreno): ca. 400 – 1200 m
Nel complesso sono stati marcati quattro animali nel 1999, sette nel 2000 e sei nel 2001, per un totale di diciassette animali. I singoli individui sono stati seguiti per un periodo variabile, che è dipeso dalla durata della permanenza della trasmittente sull’animale e da altri fattori non controllabili sperimentalmente (scomparsa dell’animale dall’area di studio, interruzione del segnale della radiotrasmittente).
Gli animali sono stati localizzati utilizzando una ricevente AVM-LA12 e due antenne Yagi a 3 o 4 elementi (Figura 2.11). Le singole localizzazioni (‘fix’), ottenute tramite triangolazione (Figura 2.12; Kenward, 2001) sono state ottenute da stazioni relativamente fisse durante il giorno, ma sostanzialmente variabili, nel corso dell’intero periodo di raccolta dei dati, in dipendenza degli spostamenti degli individui.
Figura 2.11 Radiotracking.
Figura 2.12 Triangolazione.
Allo scopo di ridurre eventuali distorsioni del segnale dovute sia alla topografia che alla vegetazione dell’area, sono state utilizzate, laddove possibile, stazioni di ascolto collocate in aree aperte, vicine all’animale, ma il più possibile lontane da aree boscate e
da edifici. Da ciascuna di queste stazioni venivano registrate l’ora e, tramite una bussola, le due direzioni di scomparsa del segnale, che individuavano un angolo, la cui bisettrice corrispondeva alla reale direzione in cui si trovava l’animale. Considerando la morfologia dell’area di studio e la sua generale accessibilità, si è potuto localizzare gli individui, specialmente durante il giorno, raccogliendo due sole direzioni di provenienza del segnale, poste, laddove possibile, a ca. 90° l’una rispetto all’altra, anche se, in particolar modo durante la notte, l’elevata mobilità dei soggetti rendeva talora necessario l’utilizzo di una terza direzione. La posizione del singolo individuo è stata ottenuta dall’intersezione delle bisettrici dei due angoli rilevati. Dato che gli occhioni tendono a muoversi piuttosto rapidamente durante il foraggiamento notturno, la localizzazione di tutti gli animali ha richiesto 1 – 2 ore durante le ore diurne e 4 – 6 ore durante quelle notturne.
Ciascun animale è stato seguito di giorno e di notte con cadenza quasi giornaliera durante l’intero periodo di studio. Le localizzazioni sono state suddivise in due gruppi: le localizzazioni diurne sono state raccolte nel periodo compreso tra l’alba ed il tramonto; quelle notturne nella parte restante della giornata. La posizione del singolo individuo è stata determinata in ogni ora del dì e della notte (salvo prematuro distacco della radio dall’animale), avendo cura di lasciare un intervallo di almeno 12 h tra fix diurni o fix notturni successivi, allo scopo di ridurre il più possibile fenomeni di autocorrelazione (van Winkle, 1975).
Gli home range degli animali sono stati calcolati sia mediante il metodo del Minimo Poligono Convesso (MPC), utilizzando tutte le localizzazioni, sia con il metodo “Adaptive Local Convex Hull” (LoCoH: Getz & Wilmers, 2004; Getz et al., 2007). Quest’ultima metodologia rappresenta una generalizzazione del metodo MPC e può essere essenzialmente intesa come un metodo di ‘kernel’ non-parametrico. In sintesi, il metodo prevede la definizione di MPC su vari sottocampioni di dati definiti spazialmente, secondo un criterio di vicinanza. Questa serie di ‘kernel’ non-parametrici viene poi unita, definendo quindi la distribuzione di utilizzo dell’area (UD). Il vantaggio di questo metodo, rispetto al metodo di kernel tradizionale, spesso consigliato per elaborare i dati di radiotracking (Worton, 1987, 1995; Seaman & Powell, 1996; Wauters
et al., 2007), è dato dal fatto che in questo caso la funzione di kernel emerge
direttamente dai dati a disposizione, senza assumere per questi alcuna distribuzione a priori. La dimensione dei sottocampioni utilizzati per i singoli MPC è stata definita tramite una procedura ‘adaptive’, ovvero utilizzando per ciascun punto il numero di
localizzazioni la cui distanza dal punto di riferimento era inferiore ad uno specifico valore soglia (Getz et al., 2007). Prove condotte con diversi valori soglia hanno indotto a considerare come ottimale un valore di 2000 m, peraltro assai prossimo al valore consigliato da Getz et al. (2007), pari alla distanza massima tra due localizzazioni del medesimo animale. La dimensione complessiva dell’home range costruito tramite LoCoH è stata calcolata utilizzando l’isopleta del 95%. La definizione della core area è stata invece condotta attraverso l’analisi incrementale delle aree sottese da isoplete di valore crescente (Kenward, 2001). Tutta le analisi sono state condotte tramite l’estensione ‘adehabitat 1.8.2’ (Calenge, 2006) del software R 2.8.1 (R Development Core Team, 2008).
Conteggi notturni e rilievi della vegetazione
A seguito dell’analisi condotta sui dati ottenuti tramite le tecniche di radiotracking e delle informazioni che ne sono state ricavate, ma considerando anche che l’errore presente in questo tipo di localizzazioni permette solo una conoscenza di scala piuttosto elevata circa le scelte spaziali, si è passati ad effettuare un tipo di analisi di maggior dettaglio. Un risultato piuttosto chiaro emerso dai dati di radiotracking è che in molti casi gli occhioni durante la notte compiono voli di foraggiamento verso aree coltivate adiacenti il greto fluviale. Per questo motivo i rilievi, effettuati dall’inizio di Maggio fino alla fine di Luglio, si sono svolti in aree perifluviali adibite prevalentemente ad uso agricolo, comprese tra il ponte ferroviario di Fornovo e la località di Locrino (Noceto).
Sulla base dei dati raccolti con il metodo del radiotracking, sono state selezionate varie aree campione (sette nel 2007 e sette nel 2008). Tali aree, dislocate su entrambe le rive, comprendevano ciascuna campi con diverse tipologie colturali; sono state selezionate in stretta vicinanza all’alveo (entro 1.2 km) ed erano facilmente accessibili e percorribili a piedi sia di giorno che di notte. Tutti i campi sono stati perimetrati, mappati tramite GPS (Garmin GPS 12CX) e rappresentati tramite il software ArcView GIS 3.2.
Il monitoraggio, effettuato una volta ogni dieci giorni, si è articolato in due fasi distinte: il rilievo diurno della vegetazione presente nelle varie particelle ed il censimento notturno degli animali che foraggiavano nelle medesime aree. La procedura del rilievo della vegetazione ha previsto l’utilizzo di un pannello di legno quadrettato suddiviso in unità di 10 cm, alto 1 m e fissato ad un’asta lunga 3 m (Figura 2.12).
Questo pannello è stato di volta in volta posizionato verticalmente nella vegetazione da un osservatore posto al margine del campo, onde evitare di arrecare qualsiasi danno alle colture. L’osservatore si poneva quindi di fronte al pannello, allineando lo sguardo con il margine superiore della vegetazione. Per ogni campo sono state effettuate quattro misurazioni in punti diversi scelti casualmente, annotando la tipologia colturale dominante, l’altezza massima della vegetazione (l’altezza della pianta più alta rilevata sul pannello), l’indice di copertura della vegetazione (l’altezza minima in cui la vegetazione copre 9 dei 10 quadrati contenuti in una riga del pannello), che di seguito verrà chiamato solo “altezza” per semplicità. Data la forte correlazione tra altezza massima e indice di copertura, tutte le analisi sono state condotte utilizzando solo il quest’ultimo parametro, in modo da evitare problemi di collinearità.
Figura 2.13 Posizionamento del pannello di legno quadrettato in un campo a foraggio (a sinistra) ed
esempio di misurazione dell’altezza massima e dell’indice di copertura della vegetazione (a destra).
Il censimento notturno degli animali è stato effettuato a partire dal tramonto e per un periodo di circa 3 ore, in corrispondenza dei giorni di rilievo della vegetazione, con due ripetizioni a serata per ogni area campione. Sono stati percorsi a piedi gli stradelli ai margini delle singole particelle, illuminando i campi con un faro alogeno portatile (Lightforce ML170 Striker, diametro 170 mm, lampada da 30W).
Nonostante le abitudini notturne, gli occhioni non posseggono alcun meccanismo riflettente all’interno del loro sistema visivo (tapetum lucidum; Martin & Katzir, 1994) e per questo motivo i loro occhi non brillano nel buio qualora illuminati da una sorgente luminosa di forte intensità. Questa caratteristica rende più difficile la loro
individuazione durante le ore notturne, limitando l’area coperta efficacemente dai rilievi. Per questa ragione sono stati inclusi nell’analisi solo gli esemplari di occhione avvistati oppure sentiti richiamare entro 200 m dal transetto, prendendo come riferimento il raggio d’azione del faro. All’interno di questa fascia è infatti ragionevole ipotizzare che tutti gli animali presenti siano effettivamente contattati. Allo scopo di verificare la reale assenza di occhioni, soprattutto nei coltivi con vegetazione alta, al termine di ciascun conteggio sono state utilizzate forme di scaccia tali da spaventare gli animali in modo da farli involare. Eventuali osservazioni occasionali, effettuate al di fuori del periodo di censimento oppure in aree differenti da quelle campione, sono state annotate a parte e non inserite nell’analisi.
L’analisi dei dati è stata condotta separatamente per i due anni tramite l’uso di Modelli Lineari Generalizzati di tipo misto (GLMM; Pinheiro & Bates, 2000), utilizzando una distribuzione degli errori di tipo ‘Poisson’ (Faraway, 2006). La variabile dipendente utilizzata è stata il massimo numero di occhioni rilevati per serata in ciascun campo. I fattori fissi sono stati: 1) la superficie del campo (in ettari), calcolata tramite software GIS; 2) la distanza minima in metri dalla ripa fluviale, misurata tramite GIS; 3) il mese del rilievo (fattore a 3 livelli: maggio, giugno, luglio); 4) il tipo di coltura [fattore a 4 livelli: foraggio (erba medica Medicago sativa, prato stabile, loglietto
Lolium perenne e avena Avena sativa), cereali (grano Triticum sp.pl. e orzo Hordeum vulgare), altro (pomodoro Lycopersicon esculentum e incolto), letame] e 5) l’altezza
(mediana delle misure ripetute per ciascun campo). Considerando il tipo di variabili incluse, nonché la numerosità del campione, non sono state prese in considerazione eventuali interazioni tra fattori fissi. I fattori ‘random’ utilizzati nel modello sono stati l’area campione e il campo nidificato all’interno dell’area campione. La scelta del modello più parsimonioso è avvenuta utilizzando il Criterio di Informazione Asintotica di Akaike (AIC; Burnham & Anderson, 2002), considerando come modello di partenza (modello ‘base’), il modello che includeva l’area del campo e la distanza dalla ripa.