Capitolo I
__________________________________________________________________
strutturali.
1Vengono denominate combretastatine le numerose sostanze isolate negli anni ‘80 da Combretum Caffrum Kuntze (Combretaceae)2, un salice africano deciduo (diffuso tra le regioni di Capo Eastern e di Transki)2b contenente sostanze capaci di inibire la crescita di cellule cancerose: le proprietà curative dei suoi estratti erano già note nella medicina tradizionale Zulu.2b Tutte le combretastatine finora isolate contengono più anelli benzenici sostituiti con gruppi ossigenati, ma le loro strutture possono essere di diversa natura: ad esempio, (Z)-stilbeniche come quelle delle combretastatine A-1 (1a) e A-4 (1b) o diidrostilbeniche come quella della combretastatina B-1 (2) oppure fenantrochinoniche, (combretastatina C-1, 3) o macrolattoniche (combrestastatina D-1, 4).2 OMeOR2 R1 OMe MeO MeO OH OMe OMe MeO MeO OH OMe O O MeO MeO O OH O O O 1a: R1=OH; R2=H (Combretastatina A-1)
1b: R1=R2=H (Combretastatina A-4)
2 (Combretastatina B-1)
3 (Combretastatina C-1) 4 (Combretastatina D-1)
A B
Tutte le combretastatine naturali note sono state saggiate su differenti linee cellulari ed in ogni caso mostrano attività antineoplastica nei confronti di cellule di leucemia linfocitica murina L1210 e P388.3,2 Le più bioattive sono comunque sempre quelle della serie A, con valori massimi di ED50a di circa 0.0009 µg/ml per la combretastatina A-1.3
a ED
50 (Effective Dose 50) è la quantità di una sostanza necessaria per produrre un effetto
combretastatine della serie A sono state studiate più approfonditamente delle altre. In particolare, sono risultate potenti inibitori della polimerizzazione della tubulina,3,4a-e a causa della loro forte affinità con il cosiddetto “sito della colchicina” presente in tale proteina.b Tra queste sostanze naturali la più attiva è la combretastatina A-4 (1b), con un valore di IC50c per quanto riguarda la polimerizzazione della tubulina compreso tra 0.53 e 0.3 µM.4f La struttura di 1b è stata assegnata mediante tecniche spettroscopiche e confermata per sintesi3a.
E’ stato anche trovato che 1b inibisce la crescita di linee cellulari di cancro del colon LoVO (ED50=0.005 µg/ml), HT 29 (ED50=0.02 µg/ml), Colo 205 (ED50=0.07 µg/ml), DLD-1 (ED50=0.0005 µg/ml) ed HCT-15 (ED50=0.0009 µg/ml).3a Inoltre la combretastatina A-4 è in grado di danneggiare la vascolatura dei tumori solidi al 10% della dose massima tollerata, causando così la morte del tessuto tumorale e lasciando intatta la normale vascolatura.5 Peraltro questa molecola mostra anche forte tossicità nei confronti di varie linee di cellule cancerose umane, incluse alcune che risultano multi drug resistant6a,6b e possiede attività antiangiogenica verso il linfoma umano non-Hodgkin6c.
Simili risultati di bioattività hanno promosso lo studio di metodi di sintesi delle combretastatine della serie A, ed in particolare di 1b. In letteratura sono state proposte a questo scopo, ad esempio, metodologie basate su olefinazioni di Wittig e risoluzione delle miscele E/Z ottenute,7a,7b condensazioni di Perkin seguite da decarbossilazione7c e cross-coupling di Suzuki7c.
Però, per quanto interessanti risultino le loro proprietà, le combretastine della serie A non si prospettano come una classe di farmaci ideali. Infatti a causa sia della labilità configurazionale del loro doppio legame Z, indispensabile per la bioattività, che della loro bassa farmacocinetica, dovuta alla limitata solubilità in acqua, possono risultare scarsamente efficaci in vivo.8
Proprio per questo motivo sono stati condotti molti studi di design e sintesi di analoghi strutturali di tali sostanze, basati tutti sul principio del bioisosterismo col farmaco naturale: il bioisosterismo consente, infatti, di modificare la struttura
b Per maggiori dettagli e chiarimenti vedere paragrafo 1.2. c IC
50 (Inhibitory Concentration 50%) è la concentrazione di una sostanza necessaria per causare
gruppi di riconoscimento della molecola.
Una classe di analoghi molto importante è quella che prevede semplicemente l’introduzione di funzionalità idrofile. Ad esempio ha destato notevole interesse 1c, il fosfato disodico di 1b,9a dotato di potente attività antivascolare9b-d e in grado, a concentrazioni ≥ 7.5 nmol/L, di arrestare le cellule alla metafase, causando la morte delle cellule mitotiche endoteliali proliferanti9e. L’induzione dell’apoptosi nelle cellule endoteliali da parte di questa molecola è inoltre associata a un prolungato arresto mitotico.9e Purtroppo questo farmaco ha un breve tempo di semivita perchè nel plasma defosforila al corrispondente fenolo.10 Altri analoghi di 1b solubili in acqua presentano terminazioni NH-amminoacidiche o O-glicosidiche sull’ossigeno fenolico in tale sostanza,11a-d ma i derivati glicosidici sembrano avere attività antitumorale più bassa delle normali combretastatine11b. Un altro profarmaco più idrofilo di 1b è l’acetammide 5, che causa l’interruzione nella vascolarizzazione dei tumori12 ed è attualmente in fase di sviluppo clinico per il trattamento di tumori solidi13. D’altra parte anche la sostituzione dell’ossidrile fenolico di 1b con gruppo amminico dà luogo ad un composto, denominato AC-7739 (1d), più solubile in acqua e con elevata attività antitumorale in vivo verso tumori solidi murini.14 Assai recentemente Pettit et al. hanno provato anche a eterificare l’ossidrile fenolico con uno spaziatore C-2 che porta un gruppo fortemente polare (ad esempio un sale di ammonio, un ossidrile od un gruppo solforico); però questi derivati, di formula generale 1e, non hanno mostrato attività particolarmente interessanti.15
OMe MeO MeO MeO MeO OMe OPO3Na2 OMe NH3 + Cl -OMe MeO MeO OMe O Y OMe MeO MeO OMe NHAc OPO3H2 1c 1d 1e 5
Un’altra serie di analoghi della combretastatina A-4 (1b) è derivata dall’introduzione di sostituenti elettronattratori di varia natura sul doppio legame etilenico di tale sostanze (ad esempio alogeni o gruppi quali il nitrile, il carbossile o il carbammile).16,17,18 Le attività biologiche di questi composti nei confronti della polimerizzazione della tubulina, nonché le loro citotossicità, risultano sempre inferiori a quelle del composto naturale18. Nonostante ciò alcuni analoghi di 1b con la porzione etilenica 1-alogeno o 1,2-dialogeno sostituita sono stati oggetto di un brevetto industriale per la cura di tumori di diverso tipo.19
Un’altra strategia utilizzata per la preparazione di analoghi della combretastatina A-4 (1b) privi del problema della stereomutazione e più idrofili ha comportato la sostituzione del doppio legame con un opportuno sistema X-Y lineare; un approccio di questo tipo ha condotto alla sintesi di sulfammidi20 o solfoni21 6, di diarilammine, diarileteri e arilbenzileteri 721 e di benzofenoni22 8. Tutti questi derivati hanno attività inferiore a 1b, ma risultano comunque più solubili in acqua di questa.20,21,22
OMeOMe OMe S [X] Ar O O MeO MeO OMe [Y] OH OMe O R1 OH OMe MeO MeO OMe 6 X= O, NH 7 Y=O, NH, CH2O 8 R1= H, OH
Un approccio alternativo consiste nell’inglobare il doppio legame Z di 1b in un anello eterociclico, in modo da bloccare la configurazione e contemporaneamente aumentare l’idrofilicità globale del profarmaco.
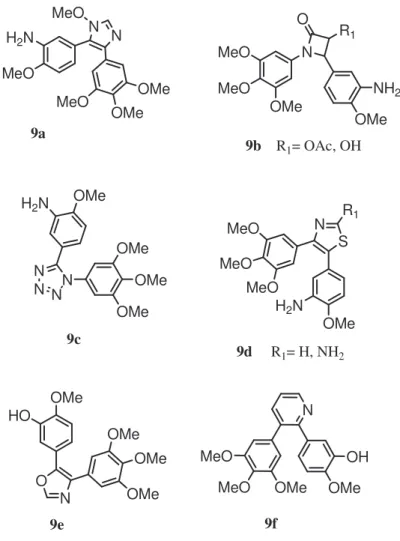
In questo ambito, numerosi studi sono stati dedicati a sostanze contenenti eterocicli azotati. A questo gruppo di analoghi appartengono ad esempio le sostanze riportate nella Figura 1, ovvero il tetrazolo 9c,23,24 i tiazoli 9d,23,24 l’imidazolo 9a,24 ossazolo 9e,24 la piridina 9f,27 e gli 1,4-diaril-2-azotodinoni29 9b, ma sono stati sintetizzati allo stesso scopo anche indoli,25 ossadiazoline,26 furazani,26 isossazoli,27 isossazoline27 e diarilossazaloni28. Particolarmente interessanti sono risultati i 9c e 9d, potentemente citotossici e dotati di un’eccellente attività antitumorale se somministrati per via endovenosa.24 Questi composti sono attivi anche in vivo e la loro attività antitumorale è comparabile a quella di AC-7739 (1d) alle stesse dosi.24 Invece composti imidazolinici 4,5-disostituiti, come 9a, sono risultati particolarmente efficaci per via orale contro il reticolosarcoma M5076 dei topi, essendo dotati di ottimi profili farmacocinetici, lunghi tempi di vita ed eccellente biodisponibilità.24
N N MeO H2N MeO OMe OMe MeO N O R1 MeO MeO OMe NH2 OMe N N NN OMe H2N OMe OMe OMe S N R1 MeO MeO MeO OMe H2N O N OMe OMe OMe OMe HO N OH OMe OMe MeO MeO 9a 9b R1= OAc, OH 9c 9d R1= H, NH2 9e 9f
Figura 1: Alcuni esempi di analoghi di 1b contenenti eterocicli azotati.
Minor interesse hanno forse mostrato simili analoghi di 1b contenenti solo zolfo come eteroatomo dell’anello eterociclico, quali derivati tiofenici.30
Invece, composti contenenti anelli eterociclici con solo ossigeno sono risultati assai interessanti.31 Ad esempio 10 ha valori di IC50 tra 8 e 9 ng/mL verso linee di cellule tumorali B16, HCT116 ed A431.32 D’altra parte, proprio nel laboratorio dove è stato preparato questo lavoro di Tesi, è stata recentemente sintetizzata un’ampia serie di 3,4 diarilfuranoni di formula generale 11, con risultati di notevole interesse per quanto riguarda l’attività antitumorale.33
11a : Ar1= 2-naftile Ar2 = 3,4,5-(CH3O)3C6H2 11b : Ar1= 4-CH3OC6H4 Ar2 = 3,4-(CH3O)2C6H3 11c : Ar1=Ar2 = 4-CH3OC6H4 11d : Ar1= 4-CH3SC6H4 Ar2 = C6H5 11e : Ar1= 3,4-(CH3O)2C6H3 Ar2 = 3,4,5-(CH3O)3C6H2 11f : Ar1= 4-CH3OC6H4 Ar2 = 3,4,5-(CH3O)3C6H2 11g : Ar1= 3,4-(OH)2C6H3 Ar2 = 3,4,5-(OH)3C6H2 11h : Ar1= 4-(OH)C6H4 Ar2 = 3,4,5-(OH)3C6H2 O O O MeO H2N OMe OMe MeO O Ar2 Ar1 O X X 10 12a: X=Cl 12b: X=Br
In particolare, i derivati 11a, 11b e 11d, preparati in modo altamente selettivo a partire dal 3,4-dicloro-2(5H)-furanone (12a),33 si sono rivelati altamente citotossici nel test del National Cancer Institute (NCI, USA) verso 60 linee di cellule tumorali umane.34 Infatti, i valori di MG-MIDd relativi al log GI50 per tali composti sono pari a –7.64, -6.88 e –6.22, rispettivamente,34 ed il valore di MG-MID per 11a è addirittura superiore a quello riportato in letteratura (-7.53)35 per la combretastatina A-4 (1b). Dai dati di citotossicità raccolti per i 3,4-diarilfuranoni 11 è stato possibile dedurre che quelli altamente citotossici non sono necessariamente caratterizzati dal gruppo 3,4,5-trimetossifenilico sul C-3 dell’anello furanonico e da un benzene poliossigenato sul C-4 di tale anello. E’ stato peraltro trovato che i polifenoli 11g e 11h, sintetizzati per demetilazione di, rispettivamente, 11e e 11f, sono meno citotossici dei corrispondenti derivati contenenti gruppi metossilici anziché ossidrili fenolici.33,34 Più recentemente è stato trovato, sempre nel nostro laboratorio, che anche due 4-(1-alchinil)-3-bromofuranoni, i composti 13a e 13b, sintetizzati con elevata regioselettività da 12b mediante una modifica della reazione di Sonogashira,36 sono significativamente citotossici verso molte delle linee cellulari del test NCI.36,37
d Log GI
50 (Grown inhibitory 50%) è il logaritmo decimale della concentrazione necessaria per
un’inibizione di crescita della cultura cellulare pari al 50%. Il cosiddetto MG-MID (mean graphic midpoint) è un valore correlato con la media dei log GI50 ottenuti, con un dato composto, su tutte
O R Br O N S MeO OMe OMe OMe COOMe H 13a: R=C6H5 13b: R=n-C4H9 14
Assai recentemente De Martino et al. hanno proposto anche composti di tipo (ariltio)indolico, che hanno mostrato un’eccellente attività nei confronti della polimerizzazione della tubulina e della crescita di cellule MCF-7 (carcinoma polmonare umano).38 In particolare, il 3-[(3,4,5-trimetossifenil)tio]-5-metossi-(1H)indol-2-carbossilato di metile (14) è il più potente fra tali derivati e presenta IC50 = 2,0 µM, risultando quindi 1.6 volte più attivo della colchicina e più o meno altrettanto attivo di 1b come inibitore della polimerizzazione della tubulina.38
Un simile approccio, ovvero l’incorporazione del sistema etilenico del composto naturale in una struttura ad anelli condensati, ha portato anche alla sintesi delle 4-arilcumarine (15a-b)39. Tali composti non presentano alcun effetto sulle topoisomerasi I e II, ma inibiscono l’assemblamento dei microtubuli, rappresentando quindi interessanti candidati per lo sviluppo preclinico di nuovi agenti antitumorali.39 O O OMe HO OMe R OMe 15a: R=OMe 15b: R=H
Le modifiche sul doppio legame etilenico sono spesso accompagnate da una serie di modifiche anche sugli anelli A e B della molecola. Peraltro l’anello A, ovvero il 3,4,5-trimetossfenile è probabilmente responsabile di un meccanismo di
un naftile41a-c fornisce un sistema che presenta un’attività di IPTe buona ma una citotossicità 20 volte inferiore a quella di 1b41b. Invece la sostituzione dell’anello 3,4,5-trimetossifenilico con un 3,4,5-trimetilfenile fa perdere attività alla molecola,42 probabilmente perché le interazioni con la tubulina sono di natura idrofobica e quindi alcune interazioni polari possono essere perdute a spese di una più bassa perdita entropica di binding. L’anello A può essere mimato anche da un più semplice 4-metossifenile43,44 oppure da un sistema perfluorurato44.
L’anello B è stato modificato in primo luogo sull’ossidrile fenolico, sostituendolo con gruppi polari come NH2 (libero o salificato)45, F46, Br47 oppure NO248. In alternativa lo stesso anello è stato sostituito interamente con gruppi naftilici,49 isochinolinici50 o chinoxalinici50. Gli analoghi naftilici delle combretastatine sono stati studiati approfonditamente, il che ha permesso di concludere che la sostituzione dell’anello B naturale con un gruppo naftilico può mantenere inalterata l’attività biologica ma dà luogo a composti più lipofili.50,51 D’altra parte i gruppi isochinolinici e chinoxalinici diminuiscono l’attività biologica e anche se aumentano l’idrofilicità delle molecole.50
In altri casi l’anello B è stato sostituito con gruppi eterociclici quali ad esempio, i furili.52 D’altra parte, come già citato, dagli studi effettuati nel nostro laboratorio è emerso che 4-(1-alchinil)-3-bromo-2(5H)furanoni 13 forniscono risultati significativi nei test di citotossicità verso cellule CCRF-CEM, HL-60(TB), K-562, RPMI-8226 e SR di leucemia umana.36,37,53 Anche se questi sistemi presentano notevoli differenze strutturali con 1b sembra comunque che l’unità furanonica, oltre a non necessitare del 3,4,5-trimetossifenile come sostituente, possa prevedere anche la presenza di un gruppo arilacetilenico per esplicare la sua attività citotossica.
e IPT (Inhibition of Polimerization of Tubuline): attività inibitoria di una sostanza nei confronti
combretastatine.
Le combretastatine sono sostanze in grado di interagire con la tubulina, una proteina presente nelle cellule e che è responsabile del movimento, del mantenimento della forma e della riproduzione cellulare, oltre che della suddivisione interna e del trasporto di sostanze nel citoplasma. Per comprendere meglio tali interazioni ed i loro effetti, può essere opportuno ricapitolare brevemente alcune nozioni di biologia e patologia cellulare.54,55
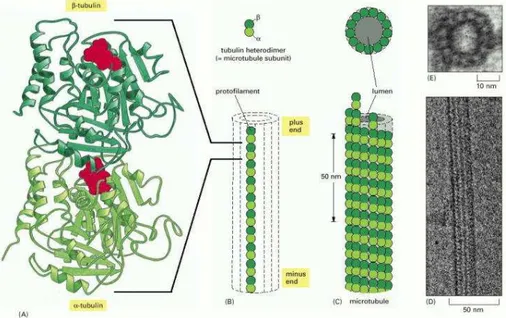
La tubulina è una proteina eterodimera flessibile (Figura 2) costituita da
due subunità, l’α e la β-tubulina, ciascuna delle quali possiede un sito per legare una molecola di GTP: nella subunità α questo nucleotide è intrappolato meccanicamente all’interfaccia tra i due dimeri e non può essere idrolizzato; nella subunità β si può anche trovare come GDP. L’idrolisi del GTP nella subunità β ha una forte influenza sulla dinamica della polimerizzazione, come sarà meglio spiegato in seguito.
Figura 2: A) struttura dell’eterodimero della tubulina con (in rosso) le molecole di GTP; B)
sistemazione di molte subunità nel protofilamento e C) nel microtubulo; D) Immagine di un microtubulo al microscopio elettronico; E) Immagine dell’intreccio di 13 microtubuli al microscopio elettronico.
La tubulina è l’unità monomerica dei microtubuli, strutture cilindriche cave lunghe alcuni µm, con diametro esterno di circa 25 nm e costituiti frequentemente
β-tubulina, i monomeri sono tenuti assieme da “deboli” interazioni non covalenti idrofobiche; lungo l’asse longitudinale del microtubulo la parte superiore di ogni unità β forma un’interfaccia con la parte inferiore di un’unità di α-tubulina adiacente, con un’interazione che è molto simile a quella che tiene unita le due subunità nel dimero. Perpendicolarmente a queste interazioni si hanno anche interazioni laterali di contatto tra unità dello stesso tipo (α-α e β-β). Le interazioni laterali e longitudinali creano quindi una struttura in cui i protofilamenti sono intrecciati in un’elica: questa sistemazione consente l’aggiunta o la perdita di subunità solo alle due estremità del filamento, e fornisce alla struttura una notevole resistenza alle sollecitazioni termiche dell’ambiente e allo stesso tempo una discreta labilità cinetica. Inoltre la polarità strutturale dei microtubuli assicura che le due estremità abbiano velocità di crescita differente in modo da dare una direzionalità alla polimerizzazione; per convenzione si definisce estremità (+) quella che cresce più velocemente ed espone la subunità β e estremità (-) l’altra, che espone la subunità α. Poiché la polimerizzazione e la depolimerizzazione sono fenomeni spontanei se il ∆G è minore di zero, l’energia libera che è connessa con questi processi può essere trasformata in lavoro per estroflettere membrane o separare cromosomi nella cellula in divisione.
Le subunità della tubulina sono enzimi in grado di idrolizzare il GTP e la velocità di idrolisi cresce se la subunità viene incorporata in un filamento: il gruppo fosfato diffonde all’esterno della proteina mentre l’unità GDP rimane intrappolata; in base a questo esistono due tipi di filamento, il filamento T, che lega una molecola di GTP all’estremità di crescita, e il filamento D, che lega una molecola di GDP in tale sito. In una cellula vivente la forma T prevale sulla D perché la concentrazione di GTP libero è più alta di quella di GDP. L’energia libera connessa all’idrolisi del nucleotide viene immagazzinata nel polimero e causa la facile dissociazione delle specie D: in conclusione, le forme T dei filamenti crescono in lunghezza, mentre quelle D decrescono in modo che tanto più una subunità è stata nel polimero e tanto più avrà idrolizzato il nucleotide e si dissocerà più facilmente. Questo meccanismo descrive l’instabilità dinamica dei microtubuli; infatti, se la velocità di addizione di una subunità è simile a quella di idrolisi si ha una probabilità finita che il filamento parta con una struttura T
e porta a continue catastrofi (passaggio dalla crescita alla distruzione del polimero) e salvataggi (passaggio da distruzione a crescita del polimero). Tutto questo contribuisce ad aumentare la diffusione dei nuclei di polimerizzazione e a rendere l’intero sistema del citoscheletro estremamente dinamico.
Lo stadio della polimerizzazione più lento, che quindi descrive la cinetica dell’intero processo, è il momento della nucleazione, ossia il momento iniziale della polimerizzazione. La cellula controlla questo stadio con catalizzatori molto efficienti, chiamati MTOC (Microtubule-Organizing Centre); questi complessi contengono una proteina detta γ-tubulina associata in gruppi anulari detti γ-TuRC (Tubulin Ring Complex) e sono presenti in tutte le cellule di insetti e vertebrati. Nella maggior parte delle cellule questo complesso è localizzato in un punto focale, con geometria a stella, detto centrosoma e costituito da strutture cilindriche arrangiate ad angolo retto, che prendono il nome di centrioli; questi organelli sono in grado di duplicarsi all’atto della divisione e costituiscono le estremità del fuso mitotico.
La dinamica dei microtubuli può essere controllata con sostanze di due tipi, proteiche o non proteiche.
Il controllo proteico sulla polimerizzazione può essere offerto da proteine come le statmine56, in grado di legare due eterodimeri di tubulina e di impedirne l’associazione alla catena in crescita; questo fatto diminuisce la velocità di elongazione del microtubulo, favorendo la forma D più labile e quindi la depolimerizzazione. La statmina è controllata da un meccanismo di fosforilazione che la può disattivare, consentendo in questo modo alla cellula un controllo della dinamica del citoscheletro. Un microtubulo formato può, invece, essere stabilizzato da un complesso detto MAPs (Microtubule Associated Proteins), un complesso proteico in grado di donare estrema rigidità al citoscheletro, utile, in particolare, nelle porzione assonica delle cellule neurali; i MAPs sono dotati di una porzione che lega il microtubulo e una che è invece in grado di funzionare da spaziatore tra microtubuli e quindi può favorire o prevenire l’associazione di queste strutture in sovrastrutture più complesse.
Un’ultimo tipo di proteine collegate alla dinamica del citoscheletro è quello delle cosiddette proteine di capping, in grado di complessarsi alle estremità del microtubulo definendone la lunghezza in un direzione; tra queste abbiamo già
vanno menzionate in particolare anche le catastrofine, in grado di indurre una catastrofe abbassando l’energia di attivazione della depolimerizzazione, e le proteine di termine che consentono ai microtubuli di ancorarsi saldamente a membrane e organelli. Particolare risulta la katanina, una proteina che, catalizzando l’idrolisi del GTP all’interno del microtubulo, porta alla suddivisione in due tronconi del polimero.
Anche molecole più piccole, non proteiche, possono controllare la polimerizzazione e la depolimerizzazione della tubulina legandosi sia al filamento preformato che alle subunità libere; queste sostanze vengono classificate in base al sito a cui si legano nella proteina. Un primo gruppo è quello delle tossine che interagiscono con il cosiddetto “dominio della Vinca”, come la vinblastina,57 in grado di destabilizzare i microtubuli e di favorirne la depolimerizzazione58; un secondo gruppo è quello dei tassoidi,59 tra cui il Taxol, che si legano al filamento già formato e sono in grado di stabilizzarlo.60 Infine, vicino al “dominio della Vinca” troviamo il “dominio della colchicina”61 (16) e dei colchicinoidi, composti in grado di destabilizzare i microtubuli.62 Quest’ultimo sito di legame è adiacente vicino all’interfaccia fra i dimeri di un protofilmento e se viene occupato da una molecola di colchicina è in grado di interrompere in modo substechiometrico tutte le funzioni dipendenti dai microtubuli, sopprimendo in particolare la mitosi.
O OMeOMe MeO OMe NHAc 16 A B C
La colchicina naturale è, in primo luogo, una molecola dotata di un centro e di un asse di chiralità con configurazione (7S, aR), anche indicato con (M, 7S),63 e tale configurazione ne determina l’attività biologica64; per questo motivo è indispensabile che anche il sito di binding della colchicina possegga una dissimmetria complementare. Studi 13C NMR hanno confermato che il sito di legame della colchicina alla tubulina è unico per concentrazioni < 20 µM, altrimenti altri siti con un’energia di binding più bassa diventano competitivi.65
una tasca aromatica.66 Infatti i residui di triptofano, presenti nelle vicinanze di questo sito, non sono in grado di trasferire energia di eccitazione, nonostante la sovrapposizione favorevole fra lo spettro di eccitazione della colchicina e quello di emissione dell’amminoacido.66
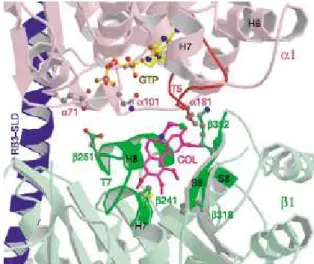
Nel 2004 sono stati effettuati alcuni studi cristallografici su un modello ristretto della tubulina che consiste in una coppia di eterodimeri complessati con un’elica di statmina (SLD, stathmin like domain) di RB3 (Rat Bacterial 3).67 Da questo lavoro è emersa un’ipotesi di orientazione della colchicina nel sito attivo dell’addotto tubulina-SLD-RB3 che viene comunemente estesa alla tubulina, nonostante le lievi differenze conformazionali tra le due proteine. Come si può notare in Figura 3 il sito attivo della colchicina è vicino al sito di legame della
GTP proprio nel cuore della subunità β, tra gli stands S8 e S9, l’avvolgimento T7 e le eliche H7 e H8. L’interazione con la subunità α è assicurata dalla vicinanza dell’avvolgimento T5 e questo fatto è consistente con il fatto che la colchicina stabilizza l’eterodimero. La posizione β318 ha un ruolo molto importante nella costrizione sterica del sito, come è possibile dimostrare facendo esperimenti di sostituzione di questa porzione nella proteina. Invece la posizione β241 è quella responsabile del legame con i tre metossili dell’anello A di 1b ed è occupata da un residuo di cisteina.67
Figura 3: posizione della colchicina nel sito dell’addotto tubulina-SLD-RB3.67
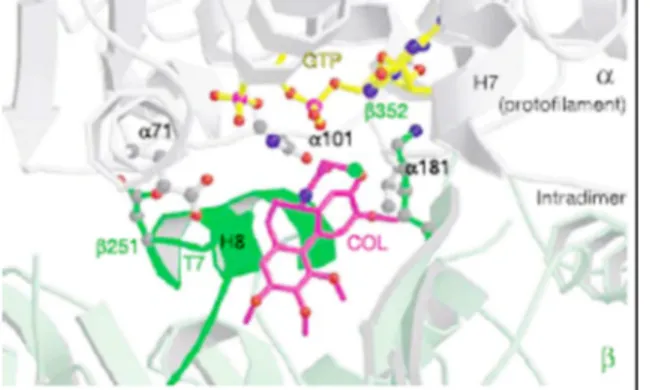
La posizione della colchicina nel suo sito è anche responsabile, come si è mostrato nella Figura 4, dell’instabilità delle interazioni laterali che tengono
particolare sui residui α101 e α181 e sul GTP. Inoltre la colchicina costringe l’avvolgimento T7 e l’elica H8 all’esterno del sito interferendo con l’altra subunità in particolare a livello della lisina β352.67
Figura 4: interazione sterica tra la colchicina e la subunità α dell’altro protofilamento.67
Le combretastatine sono appunto analoghi funzionali, oltre che strutturali, della colchicina. Sono in grado di occupare lo stesso sito, portando a un’instabilità dei microtubuli. Raffinati studi QSAR-5D (Quantitative structure-activity relation) hanno rilevato, attraverso la mappatura delle aree in funzione della natura dell’interazione, la presenza della cisteina in vicinanza dei tre metossili dell’anello A di 1b (area rossa in Figura 5), di una funzionalità in grado di accettare legame idrogeno presso i gruppi polari dell’anello B di 1b (area verde in Figura 5) e di una serie di altre interazioni idrofobiche (aree arancioni,
marroni e grige in Figura 5) in tutto il sito.68
Figura 5: modello del sito della tubulina ottenuto con 5D QSAR. Codice colore: rosso,
residuo salificato caricato positivamente; blu, residuo salificato caricato negativamente; giallo, donatore di legame-H; verde, accettore di legame-H; arancione, residuo idrofobico con densità di carica positiva; marrone, residuo idrofobico con densità di carica negativa; grigio, residuo idrofobico neutro.
L’analisi della relazione tra struttura e attività ha permesso di evidenziare l’importanza nel legame col sito attivo della tubulina sia dell’unità
degli obiettivi del design di nuovi farmaci per le cure del cancro è quello di ottenere ottimi leganti per la tubulina nel sito della colchicina, anche se non sempre tale indirizzo ha portato alla sintesi di composti con una citotossicità interessante.71
L’interazione delle combretastatine con la tubulina è in grado di arrestare il processo di proliferazione cellulare nel tumore; infatti la destabilizzazione dei microtubuli impedisce la formazione del fuso mitotico e quindi la divisione cellulare.
Inoltre le combretastatine sono anche in grado di bloccare la formazione di nuovi vasi sanguigni, utili a portare nutrimento al tumore. A questo proposito ricordiamo come alcuni tipi di tumore siano in grado di causare angiogenesi, una volta comparso all’interno del tessuto tumorale un fenotipo cellulare detto angiogenico. La comparsa del fenotipo angiogenico con la conseguente angiogenesi è un fenomeno importante nell’oncogenesi perché, oltre ad accelerare l’ossigenzione e la proliferazione, facilita la formazione di metastasi, mediante la migrazione di cellule tumorali nel sistema vascolare.55
D’altra parte l’angiogenesi è un processo in cui giocano un ruolo essenziale le cellule endoteliari, ed in particolare la loro mobilità e la loro struttura.55 Queste due caratteristiche sono connesse con l’attività del citoscheletro e quindi con polimerizzazione della tubulina; per questo le combretastatine possono essere considerate un valido target per abbassare l’angiogenesi e ridurre quindi la proliferazione del tessuto tumorale.55 In particolare la combretastatina A-472 (1b) è in grado di diminuire del 5% il flusso sanguigno ad un tumore dopo solo 1 h dalla somministrazione, lasciando intatta la normale vascolatura. Concentrazioni non citotossiche di questa molecola sono in grado di depolimerizzare i microtubuli e di disorganizzare la F-actinaf e la β-tubulina nelle cellule endoteliali, causando quindi modifiche nella forma di queste ultime. Le modifiche del citoscheletro portano alla formazione di adesioni focali delle cellule endoteliali, con conseguente strozzatura e occlusione del vaso e riduzione della perfusione del tessuto.72
f La F-actina è il doppio filamento elicoidale formato dall’actina, una proteina globulare che
tumorali l’apoptosi, ossia la morte programmata delle cellule. Nel 2002 fu scoperta e provata l’interazione di queste sostanze con differenti effettori del ciclo cellulare, tra cui alcune proteine responsabili della replicazione del DNA e del controllo del passaggio tra le fasig G2 e M e tra le fasi G1 e S del ciclo cellulare.73
Nel passare dalla fase G2 alla fase M la combretastatina A-4P (1c) è responsabile di un aumento della concentrazione di B-cicline nel nucleo e la sovraespressione di questa proteina, pur consentendo il passaggio della cellula alla fase di mitosi, la blocca in questo stato; le cellule con un arresto del ciclo cellulare in una fase diversa dalla G0 vengono quindi eliminate mediante apoptosi dallo stesso organismo tramite opportuni effettori.73
Invece, tra la fase G1 e la fase S, 1c può interagire con il sistema proteico che organizza la risposta ad un danno del DNA; infatti, prima di entrare nella fase S ogni cellula attraversa una fase di controllo dei filamenti del codice genico, detta DNA damage Checkpoint, durante la quale, se viene riscontrato un danno nella molecola prima della replicazione, vengono prodotte per cascata proteine di risposta, come la p21 e la p53, che inducono l’apoptosi. L’esposizione a 1c73 causa un aumento dell’espressione di queste proteine senza che sia contemporaneamente toccato il meccanismo di segregazione proteolitica di queste proteine, ossia la ligasi ubiquitaria Mdm-2.73
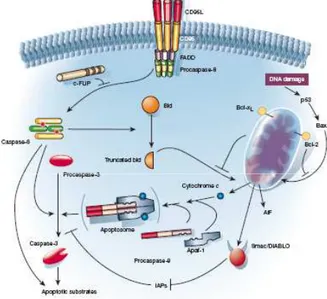
Questo evento simula un errore di trascrizione del DNA e attiva i meccanismi relativi all’apoptosi (per un esempio del path metabolico dell’apoptosi vedere Figura 6), che consistono nella liberazione di proteine note
come caspasi (Cysteine Aspartyl-specific protease) a partire dai precursori inattivi detti procaspasi. Le caspasi sono proteasi in grado di distruggere alcuni obiettivi proteici nella cellula idrolizzando i siti che contengono il residuo Asp e possono essere attivati con meccanismi differenti che dipendono dallo stimolo che induce l’apoptosi; il meccanismo più comune è quello dipendente dalle Granzime B, proteine introdotte nelle cellule bersaglio con meccanismo tipo perforina dalle cellule Killer (NKs, Natural killer cell) o dalle cellule CTL (Cytotoxic T
g Il ciclo cellulare è diviso in fasi: quando la cellula non sta compiendo atti riproduttivi si dice che
è in una gap phase, indicata con G1, solitamente seguita da una fase di replicazione dei
cromosomi, detta fase S, e da un’altra gap phase, G2. A questo punto la cellula è pronta alla
divisione (fase M) che è caratterizzata dalla mitosi e dalla citochinesi, che porta a due cellule figlie nuovamente in fase G1. Il ciclo prevede anche una fase di quiescenza G0 se le condizioni esterne
meccanismi che possono riguardare la membrana cellulare o quella mitocondriale sono di tipo recettoriale e passano attraverso la stimolazione sulla parte non citosolica di un recettore detto TNF (target necrosis factor) e la conseguente aggregazione nella porzione citosolica di una unità caspasi attivante. Il mitocondrio può contribuire al meccanismo apoptotico liberando nel citosol il citocromo c, responsabile dell’aggregazione di complessi proteici che causano l’attivazione delle procaspasi, detti apoptosomi. Infine anche altri sistemi membranosi come il reticolo endoplasmatico ruvido, l’apparato del Golgi e i corpi nucleari (NBs, nuclear body) sono in grado di generare la cascata apoptotica con meccanismi non ancora del tutto chiariti.
E’ stato provato che 1c73 agisce anche sul meccanismo stesso dell’apoptosi portando ad un aumento della quantità di caspasi 9 e 3, presenti nella cellula morente, senza soppressione del meccanismo che ne produce la disattivazione.
Figura 6: Schema di due path metabolici dell’apoptosi. Se il segnale apoptotico arriva
dall’esterno, grazie al legante CD95L viene riconosciuto dal recettore del DD (Death Domain) CD95, che transduce il segnale attraverso la proteina adduttrice FADD (Fas-associated Death Domain protein) alla procaspasi-8. Questa procaspasi-8 può essere inibita dalla c-FLIP, una proteina degradativa delle caspasi, oppure evolvere nelle caspasi e attaccare i suoi bersagli. Se il segnale arriva dall’interno, ad esempio un danno al DNA, le proteine di trasmissione p53 e Bax colpiscono il mitocondrio (se non vengono inibite da Bcl-2), liberando il citocromo c che attiva l’apoptosoma. Bid e Smac/DIABLO sono sistemi proteici di collegamento tra il segnale apoptotico interno e quello esterno che possono essere controllati mediante proteine inibitorie come IAP e Bcl-xL.74
della membrana nucleare e alla rottura del DNA in frammenti; il materiale così liberato viene riversato nello spazio intracellulare e fagocitato dalle altre cellule vicine oppure da macrofagi eventualmente presenti.
Il gruppo di ricerca presso il quale è stata preparata questa Tesi di Laurea, che già da vari anni opera nell’ambito della sintesi di sostanze naturali e loro analoghi con proprietà antitumorali,75 tenendo conto sia della grande importanza e dell’attualità presentate dalle ricerche sugli analoghi delle combretastatine, evidenziate nei paragrafi precedenti, sia degli interessanti risultati ottenuti con i furanoni di formula generale 11 e 13 (cfr. par. 1.1), ha deciso di intraprendere uno studio sulla sintesi e sull’attività antitumorale di analoghi della combretastatina A-4 (1b) costituiti da un anello 2H-piran-2-onico (17) opportunamente disostituito. Infatti la sostituzione del doppio legame stilbenico di 1b con uno di quelli presenti nell’anello di 17, oltre a garantire la stabilità configurazionale, può permettere di ottenere molecole più polari e quindi più idrofile (cfr. par. 1.1, discussione sui limiti di 1b). O O OMe MeO MeO OH OMe A B 17 1b
D’altra parte sono numerose le sostanze naturali dotate di attività antitumorale che contengono l’unità 17, sia variamente sostituita,76 sia condensata in posizione 3,4 con un anello benzenico (isocumarine).77 Tale unità peraltro è presente anche in molte sostanze di origine sintetica, per lo più analoghi dei succitati composti naturali, anch’esse dotate di proprietà antitumorali.78 Fra tutti questi composti può essere opportuno menzionare, al fine di comprendere le nostre scelte, le cumarine 15, citate nel paragrafo 1.1 come promettenti analoghi della combretastatina A-4 (1b) ed il (-)-nitidone (18), una sostanza naturale con spiccate proprietà antitumorali,79,80 nonchè alcuni analoghi di quest’ultimo composto, di formula generale 19, risultati anch’essi citotossici nei test dell’NCI su 60 linee cellulari. E’ da rilevare che sia 18 che vari composti 19 sono stati recentemente sintetizzati nel nostro laboratorio, come continuazione di una serie di studi sulla sintesi di derivati 2H-piran-2-onici.81
O OH O O O R O 18 19
Come parte di un progetto più ampio, obiettivo specifico di questo lavoro di Tesi è stato quindi l’individuazione di metodi generali per la sintesi di 2H-piran-2-oni 5,6-disostituiti di formula generale 20, 21 e 22, che rappresentano una classe di analoghi strutturali di 1b del tutto nuova, allo scopo principale di permettere la valutazione della loro attività antitumorale. E’ da rilevare che, come sarà specificato meglio nel paragrafo 2.1 in letteratura è descritto ben poco sulla sintesi di composti 20 e niente è riportato su quella dei composti 21 e 22.
O O O O Ar1 Ar2 O Ar1 Ar2 O Ar1 Ar2 20 21 22
Può essere opportuno specificare che è stato scelto di sintetizzare, insieme ai composti 20, più diretti analoghi di 1b, anche derivati 21 e 22 tenendo conto sia dei buoni risultati di bioattività già ottenuti dal nostro gruppo di ricerca con gli analoghi di 1b alchinilfuranonici (cfr. par. 1.1), sia del fatto che sono già noti vari (1-alchinil)-2H-piran-2-oni con significative proprietà antitumorali,78a,78b,79,80 fra i quali, come già citato, il (-)-nitidone (18) e alcuni composti di formula generale 19.
Per quanto riguarda invece i sostituenti Ar1 e Ar2 da introdurre nelle strutture 20, 21 e 22, è stato deciso di utilizzare sia quelli che corrispondono agli anelli A e B di 1b, ovvero il 3,4,5-trimetossifenile ed il 3-idrossi-4-metossifenile, sia una serie di gruppi aromatici ed eteroaromatici che, sulla base delle indicazioni riportate nella letteratura citata nel paragrafo 1.1, possono essere in grado di sostituire l’uno o l’altro dei succitati anelli del composto naturale, eventualmente con un vantaggio in termini di bioattività, idrofilicità e/o semplicità di preparazione.
nuovi analoghi di 1b, è stata programmata la preparazione dei composti 20b-h, 21a-h, 22a-b. O O O O Ar1 Ar2 O Ar1 Ar2 O Ar1 Ar2 20b: Ar1= C6H5 Ar2=3,4,5-(MeO)3C6H2 20c: Ar1= 3-F-4-(OMe)C6H3 Ar2=3,4,5-(MeO)3C6H2 20d: Ar1= 4-(CF3O)C6H4 Ar2=3,4,5-(MeO)3C6H2 20e: Ar1= 2-(6'-(OMe))naftil Ar2=3,4,5-(MeO)3C6H2 20f: Ar1= 3-(NH2)-C6H4 Ar2=3,4,5-(MeO)3C6H2 20g: Ar1= 3-(OH)-4-(OMe)C6H3 Ar2=3,4,5-(MeO)3C6H2 20h: Ar1= 3,4,5-(MeO)3C6H2 Ar2=3-F-4-(OMe)C6H3 20i: Ar1= 3,4,5-(MeO)3C6H2
Ar2= 3-(OH)-4-(OMe)C6H3 21a: Ar1= C6H5 Ar2=3,4,5-(MeO)3C6H2 21b: Ar1=3-F-4-(OMe)C6H3 Ar2=3,4,5-(MeO)3C6H2 21c: Ar1= 2-tienile Ar2=3,4,5-(MeO)3C6H2 21d: Ar1= 2-piridile Ar2=3,4,5-(MeO)3C6H2 21e: Ar1= N-metil-imidazolile Ar2=3,4,5-(MeO)3C6H2 21f: Ar1= 3-(OH)-4-(OMe)C6H3 Ar2=3,4,5-(MeO)3C6H2 21g: Ar1= 3,4,5-(MeO)3C6H2 Ar2=3-F-4-(OMe)C6H3 21h: Ar1= 3,4,5-(MeO)3C6H2 Ar2= 3-(OH)-4-(OMe)C6H3
22a: Ar1=3,4,5-(MeO)3C6H2
Ar2= C6H5
22b: Ar1=3-(OH)-4-(OMe)C6H3
Ar2=3,4,5-(MeO)3C6H2
22c: Ar1=3,4,5-(MeO)3C6H2
Ar2=3-(OH)-4-(OMe)C6H3
E’ da rilevare come, considerando che le posizioni 5 e 6 dell’anello (2H)-2-piranonico non sono equivalenti (contrariamente a quelle 1 e 2 della porzione etilenica di 1b), siano state programmate alcune coppie di composti in cui i sostituenti in tali posizioni sono invertiti (20c e 20h, 21a e 22a, 20g e 20i, 22b e 22c). Infatti è tutt’altro che scontato che questi regioisomeri abbiano la stessa bioattività, se non altro per motivi di ordine sterico e di diversa geometria molecolare.
Per quanto riguarda infine le metodologie da utilizzare per preparare i composti programmati, l’obiettivo è stato quello di individuare procedure altamente selettive e di validità generale, in grado di fornire i composti desiderati chimicamente puri in modo il più possibile breve, efficiente e pratico nonché in quantità sufficiente per approfondite indagini di attività antitumorale.
affinché ne fosse valutata la citotossicità nei confronti di linee di cellule tumorali umane.