57
Capitolo 4
Risultati e discussione
4.1 Profili di espressione ottenuti con RT-PCR per i canali IK e SK1-3
L’estrazione dell’RNA totale dalle cellule è stata eseguita secondo la procedura descritta nella sezione “Materiali e Metodi”. I campioni di RNA ottenuti sono stati analizzati mediante spettrofotometro NanoDrop. I risultati dell’analisi hanno mostrato un rapporto A260/A280 compreso tra
1,8 e 2,0 per tutti i campioni, indice di un buon grado di purezza dell’RNA estratto. Per quanto riguarda la stima della concentrazione, i valori sono espressi come rapporto μg/μl e rientrano nei range indicati nel manuale del kit fornito da Qiagen.
Successivamente all’analisi quali-quantitativa, l’RNA è stato valutato tramite elettroforesi, al fine di verificarne l’integrità.
L’RNA totale (1μg) è stato poi retrotrascritto, al fine di ottenere cDNA da utilizzare nelle reazioni di PCR.
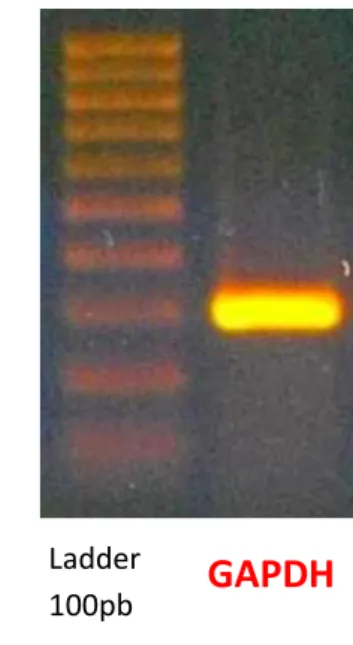
Per verificare l’efficacia dell’esecuzione del protocollo di retrotrascrizione, è stata eseguita una PCR iniziale con primer specifici per la GAPDH. Il gene della GAPDH è un gene costitutivo, definito anche housekeeping, in quanto, codificando per proteine fondamentali per la vita della cellula, è sempre presente ed espresso in misura simile nei diversi organi e tessuti di un organismo. Le condizioni di PCR per l’amplificazione con primer relativi alla GAPDH sono state perciò ottimizzate in modo da ottenere una sola banda elettroforetica delle dimensioni molecolari attese (vedi Tabella 10) ed evitare la formazione
58
di amplificati aspecifici. Nei diversi campioni, le bande relative alla GAPDH hanno esibito una stessa intensità, come è ragionevole aspettarsi dallo studio di espressione di un gene costitutivo.
Figura 14.Elettroforesi su gel di agarosio per il prodotto di PCR con primer relativi alla GAPDH.
Una volta verificata la corretta esecuzione del protocollo di retrotrascrizione è stato possibile procedere con l’indagine dell’eventuale espressione dei geni per i canali al potassio IK e SK1-3.
Nella sezione “Materiali e Metodi”, la Tabella 10 indica i protocolli utilizzati per le PCR eseguite e la lunghezza degli amplificati attesi. L’espressione dei canali IK e SK1-3 è stata indagata utilizzando, in tutti i casi, un protocollo di amplificazione che prevede l’impiego di un gradiente di temperatura per la ricerca della T di annealing ottimale per le coppie di primer scelti. Per i canali IK, delle otto temperature testate, tutte le T di annealing hanno portato all’amplificazione del prodotto atteso privo di aspecifico, anche se la banda più intensa risulta essere
GAPDH
300pb→
Ladder 100pb
59
quella ottenuta con Ta=55C. Anche per i canali SK1, sono state testate
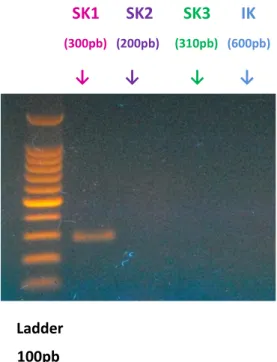
otto temperature e tutte le T di annealing hanno portato all’amplificazione della banda attesa di simile intensità, priva di aspecifico; in questo caso quella più intensa è stata ottenuta usando una Ta=63,4C. Per gli SK2, delle otto temperature testate, la banda più intensa è stata osservata alla temperatura di annealing di 60 °C, comunque sono state viste bande prive di aspecifico anche per le altre temperature testate. Infine per gli SK3, delle otto temperature testate, la migliore è risultata Ta=55,2 °C (fig.15 e 16).
60
IK
Figura 15.Elettroforesi su gel di agarosio per il prodotto di PCR con primer relativi ai canali IK su cellule A375.
Figura 16.Elettroforesi su gel di agarosio per il prodotto di PCR con primer relativi ai canali SK1 – SK2 – SK3 su
cellule A375. IK 600pb→ Ladder 100pb Ladder 100pb SK1 SK2 SK3 (300pb) (200pb) (310pb) Ladder 100pb Ladder 100pb
61
Come si evince dalle foto dei gel di agarosio in figure 15 e 16, la linea cellulare di melanoma cutaneo A375 esprime l’mRNA per le proteine oggetto di studio, IK e SK1-3.
Il profilo di espressione dei canali KCa in studio è stato valutato anche su
cheratinociti umani immortalizzati non tumorali HaCaT (fig.17)
Figura 17.Elettroforesi su gel di agarosio per il prodotto di PCR ottenuto con primer relativi ai canali IK e SK1-3
su cellule non tumorali HaCaT.
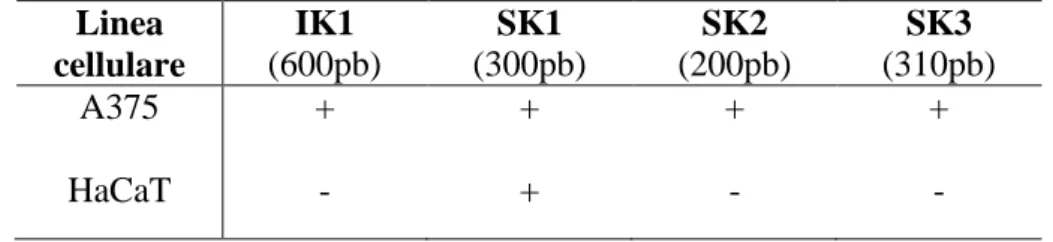
I risultati ottenuti evidenziano un diverso profilo di espressione (mRNA) tra la linea tumorale A375 e non tumorale HaCaT che esprime solo il sottotipo di canale SK1.
I dati ottenuti sono in linea con quanto si evince dalla letteratura, infatti, anche nel nostro modello sperimentale, si osserva una maggiore espressione (anche se valutata solo in termini qualitativi) degli mRNA per IK e SK1-3 in cellule tumorali rispetto alle cellule HaCaT. Questi dati possono suggerire un diverso ruolo funzionale svolto dai canali in studio in cellule tumorali rispetto alla cellule sane (come riportato nella
SK1 SK2 SK3 IK
↓ ↓ ↓ ↓
Ladder 100pb
62
“Introduzione” alla presente tesi ). Essendo le cellule HaCaT cheratinociti, questo non ci permette di indicare la sovraespressione dei canali in studio come un marker della cellula tumorale rispetto alla corrispondente sana. Tuttavia, la mancanza di espressione dei canali SK2, SK3 e IK nelle cellule epidermiche non tumorali può, invece, suggerire la possibilità di una buona selettività farmacologica di modulatori di questo canale a livello cutaneo.
I profili di espressione dei canali al potassio IK e SK1-3, risultati dalle RT-PCR condotte sul cDNA delle cellule A375 e HaCaT sono riassunti nella tabella seguente:
Tabella 11.Profilo di espressione ottenuto mediante RT-PCR qualitativa per i canali al potassio IK e SK1-3 sulle
linee cellulari umane di melanoma cutaneo A375 e cheratinociti HaCaT. Simboli: + : espresso - : non espresso +/- : debolmente espresso.
Linea cellulare IK1 (600pb) SK1 (300pb) SK2 (200pb) SK3 (310pb) A375 HaCaT + - + + + - + -
63
4.2 Valutazione dell’azione di CisPt e Temozolomide sulla vitalità cellulare
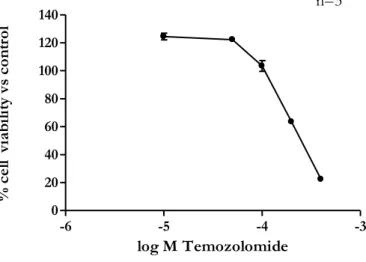
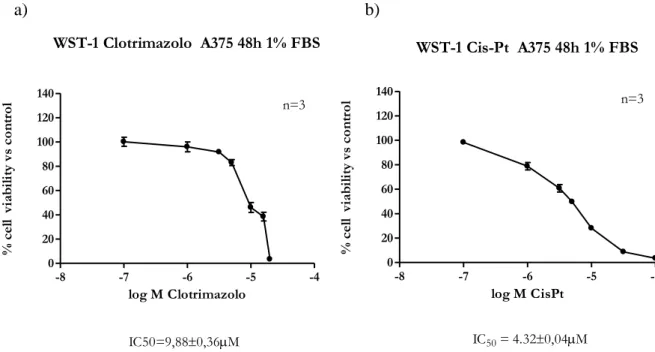
CisPt e Temozolomide sono stati testati in quanto usati come farmaci di riferimento in chemioterapia nel melanoma cutaneo [Azzabi A et al., 2005]. Il CisPt, farmaco alchilante, è stato testato in un range di concentrazione 0,1-100μM, mentre la Temozolomide (derivato del farmaco Dacarbazina) in un range di concentrazione più ampio 10-400µM come suggerito da dati in letteratura [Azzabi A et al., 2005]; entrambi i composti sono stati trattati per 48 ore di esposizione sulla linea cellulare di melanoma cutaneo umano A375. I risultati hanno mostrato che entrambi i composti sono in grado di ridurre la vitalità cellulare in modo concentrazione-dipendente (fig. 18 e 19), evidenziando una maggiore attività del CisPt (IC50~4,32µM) rispetto alla Temozolomide (IC50~250,86µM).
Figura 18. Riduzione della vitalità cellulare della linea A375, dopo trattamento con CisPt in un range di
concentrazione 0,1-100 μM, dopo 48h di esposizione, 1% FBS.
WST-1 Cis-Pt A375 48h 1% FBS -8 -7 -6 -5 -4 0 20 40 60 80 100 120 140 IC50 = 4.320,04M n=3 log M CisPt % c el l vi ab ili ty v s co nt ro l
64
Figura 19. Riduzione della vitalità cellulare della linea A375, dopo trattamento con Temozolomide in un range di
concentrazione 0,1-400 μM, dopo 48h di esposizione, 1% di FBS.
L’inibizione della vitalità cellulare indotta da CisPt e lo scarso effetto della Temozolomide sono in accordo con quanto riportato in letteratura dove sono presenti studi effettuati su linee cellulari di melanoma cutaneo A375, SKmel28 e DX3 [Reuland S.N. et al., 2011; Azzabi A et al., 2005]. La Temozolomide è un profarmaco inattivo che subisce una rapida idrolisi enzimatica a pH fisiologico, per dare il metabolita MTIC
(5-(3-methyltriazen-1-yl) imidazole-4-carboxamide) che viene
ulteriormente degradato a metabolita attivo citotossico AIC (4-Amino-5-imidazole-carboxamide). Si ipotizza che il metabolita MTIC eserciti la
sua attività antitumorale alchilando le posizioni O6 e N7
dell’amminoacido Guanina in DNA e RNA [NingaraJ S.N. et al., 2009]. Dati in letteratura evidenziano una resistenza alla Temozolomide, in diverse linee cellulari di melanoma cutaneo [Guida M. et al., 2010], in
WST-1 Temozolomide A375 48h 1% FBS -6 -5 -4 -3 0 20 40 60 80 100 120 140 n=3 IC50=250,860,86M log M Temozolomide % c el l vi ab ili ty v s co nt ro l
65
accordo con quanto osservato nel nostro modello sperimentale. Tale resistenza sembra essere dovuta all’elevata presenza dell’enzima di
riparazione del DNA MGMT (O6-methylguanine DNA
methyltransferase), deputato alla rimozione di gruppi alchilici da filamenti alchilati di DNA [Guida M. et al., 2010]. L’attivittà di agenti alchilanti, come la Temozolomide, dipende dalla loro capacità di formare addotti con il DNA e l’attività antineoplastica di questo farmaco è limitata dalla resistenza cellulare indotta dall’enzima MGMT [Guida M.
et al., 2010]. Pertanto elevati livelli di MGMT possono essere
responsabili della resistenza riscontrata con la Temozolomide. E’ stato anche riportato che l’inattivazione dell’enzima di riparazione MGMT attraverso O(6)-benzylguanine sensibilizza tutte le cellule di melanoma alla Temozolomide [Reuland N.S. et al., 2011]. Maggiore è l’espressione dell’MGMT e più rapida è la riparazione ai danni del DNA [Kim C. et
66
4.3 Valutazione dell’azione di bloccanti selettivi IK, Clotrimazolo e TRAM-34, sulla vitalità cellulare
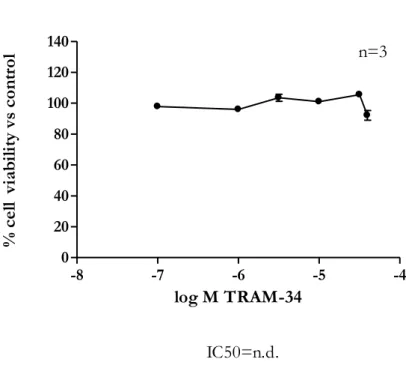
Sulla base di dati in letteratura relativi all’effetto antiproliferativo dei due bloccanti IK selettivi su linee cellulari tumorali umane [Abullaev et al., 2010; Lee E.L. et al., 2008], nel nostro modello sperimentale, abbiamo testato il Clotrimazolo in un range di concentrazione 0,1-20μM e il TRAM-34 in un range di concentrazione tra 0,1-40µM per 48 ore di esposizione. Come si evince dai dati riportati in figura 20 e 21, il Clotrimazolo è in grado di inibire la vitalità cellulare (IC50=9,88µM) mentre l’altro bloccante selettivo TRAM-34 ha dato un risultato inatteso, in quanto non ha mostrato effetti inibitori sulla vitalità cellulare a tutte le concentrazioni testate.
Figura 20. Riduzione della vitalità cellulare della linea A375, dopo trattamento con Clotrimazolo in un range di
concentrazione 0,1-20 μM, dopo 48h di esposizione, 1% FBS.
WST-1 Clotrimazolo A375 48h 1% FBS -8 -7 -6 -5 -4 0 20 40 60 80 100 120 140 n=3 IC50=9,880,36M log M Clotrimazolo % c el l vi ab ili ty v s co nt ro l
67
Figura 21. Riduzione della vitalità cellulare della linea A375, dopo trattamento con TRAM-34 in un range di
concentrazione 0,1-40 μM, dopo 48h di esposizione, 1%FBS.
Come detto precedentemente i risultati ottenuti non trovano completo riscontro con quanto riportato ad oggi in letteratura dove risulta che entrambi i bloccanti dei canali IK, sono in grado di ridurre la vitalità cellulare in modo concentrazione-dipendente su cellule di glioma umano U251 e U87 e di cancro epidermoide umano [Lee E.L. et al., 2008]. A supporto dei risultati ottenuti con Clotrimazolo sulle A375, ci sono dati in letteratura che riportano che tale bloccante è in grado di inibire la proliferazione cellulare su linee di melanoma murino B16F10
[Glass-Marmor L and Beitner R., 1997].
L’attività inibitoria sulla proliferazione cellulare del Clotrimazolo, derivato azolico antifungino, è stata riscontrata anche su altre linee cellulari tumorali come MCF-7 di cancro al seno, LL/2 di carcinoma
WST-1 TRAM-34 A375 48h 1% FBS -8 -7 -6 -5 -4 0 20 40 60 80 100 120 140 n=3 IC50=n.d. log M TRAM-34 % c el l vi ab ili ty v s co nt ro l
68
polmonare e CT-26 di adenocarcinoma del colon [Penso J., Beitner R., 2002; Meira D.D. et al., 2005]. Per quanto riguarda il meccanismo d’azione del Clotrimazolo, dati in letteratura riportano che tale bloccante, come tutti gli antagonisti della Calmodulina, induce una diminuzione della vitalità cellulare in conseguenza ad un distacco di enzimi glicolitici dal citoscheletro in cellule tumorali [Meira D.D. et al., 2005; Glass-Marmor L., Beitner R., 1997].
Il risultato ottenuto sulla linea A375 con l’altro bloccante IK, TRAM-34, è inatteso e non facile da spiegare. Il TRAM-34 è un derivato del Clotrimazolo, presenta un anello pirazolico sostituito al posto dell’anello imidazolico e ciò rende ancora più complesso dare un razionale al risultato ottenuto [Roy JW et al., 2009]. Un altro elemento che non supporta i dati ottenuti è legato alla maggiore affinità del TRAM-34 (Kd=20nM) rispetto a quella del Clotrimazolo (Kd=70nM). Con i risultati
finora ottenuti non è possibile giustificare questa diversa risposta del TRAM-34 ma tali dati suggeriscono due ipotesi: a) si può ritenere che l’azione del Clotrimazolo non sia legata all’antagonismo sul canale IK e b) si può pensare che l’effetto del TRAM-34 sul canale IK sia contrastato da altri meccanismi, propri di tale composto.
69 WST-1 Clotrimazolo A375 48h 1% FBS -8 -7 -6 -5 -4 0 20 40 60 80 100 120 140 n=3 IC50=9,880,36M log M Clotrimazolo % c el l vi ab ili ty v s co nt ro l
4.4 Valutazione dell’associazione Clotrimazolo-Cisplatino sulla vitalità di cellule A375
Visti i dati ottenuti con il bloccante selettivo IK Clotrimazolo (fig.22 a) e con il farmaco di riferimento per il melanoma cutaneo CisPt (fig.22 b), abbiamo deciso di testare l’associazione di questi due composti e valutare l’effetto sulla vitalità cellulare rispetto a quanto osservato col solo CisPt.
Figura 22.Riduzione della vitalità cellulare della linea A375, dopo trattamento a) con Clotrimazolo (0,1-20µM) b)
con CisPt (0,1-100µM), dopo 48h di esposizione, 1%FBS. .
L’associazione è stata testata a due differenti concentrazioni di CisPt. In figura 23 sono mostrati i dati ottenuti utilizzando CisPt a una concentrazione circa corrispondente all’IC50 (5µM) e Clotrimazolo testato 5µM, concentrazione in grado di inibire circa il 20% della vitalità cellulare. Nella figura 24 è stata valutata l’associazione tra CisPt 1µM, concentrazione inibente il 20% della vitalità cellulare e la stessa concentrazione di Clotrimazolo. In entrambe le condizioni sopra indicate,
WST-1 Cis-Pt A375 48h 1% FBS -8 -7 -6 -5 -4 0 20 40 60 80 100 120 140 IC50 = 4.320,04M n=3 log M CisPt % c el l vi ab ili ty v s co nt ro l a) b)
70
l’associazione Clotrimazolo-CisPt reverte l’effetto di inibizione della vitalità cellulare indotta dal solo CisPt.
Figura 23.Effetto sulla vitalità cellulare della contemporanea somministrazione di CisPt 5µM e Clotrimazolo 5µM,
dopo 48h di esposizione, 1%FBS.
Figura 24.Effetto sulla vitalità cellulare della contemporanea somministrazione di CisPt 1µM e Clotrimazolo 5µM,
dopo 48h di esposizione, 1%FBS.
I risultati ottenuti sono in linea con quanto riportato in letteratura infatti studi condotti sulla linea cellulare KB-3-1 di cancro epidermoide e sulla
***p≤0,0001 ***
Il parametro p è stato calcolato con t test
Il parametro p è stato calcolato con t test
*** ***p≤0,0001 M CisPt 5 M Clotr.5 M M+Clo tr.5 Cis-P t 5 0 20 40 60 80 100 % c el l v iab ili ty v s co nt ro l M CisPt 1 M Clotr .5 M M+C lotr.5 Cis-Pt 1 0 20 40 60 80 100 120 140 160 180 200 % c el l v iab ili ty v s co nt ro l
71
linea cellulare BEL-7404 di carcinoma al fegato, hanno evidenziato che la resistenza al CisPt è associata ad una alterazione dei flussi ionici del potassio con conseguente modifica della sensibilità delle cellule tumorali al CisPt [Liang X.J., et al., 2005; Lee EL et al., 2008].
Quindi, nonostante il CisPt sia uno dei più diffusi agenti antitumorali utilizzati nella terapia del cancro, è stato osservato che la sua efficacia è limitata dallo sviluppo di resistenza intrinseca o acquisita che ne limita drasticamente l’impiego come agente chemioterapico [Lee EL et al., 2008].
Alcuni studi hanno osservato che i meccanismi biologici cellulari connessi alla resistenza a tale farmaco, possono essere correlati alla perdita di proteine dalla superficie cellulare a causa di un difetto nel riciclaggio delle proteine stesse, alla composizione lipidica della membrana plasmatica e a meccanismi di riparazione del DNA [Liang X.J., et al., 2005].
72
4.5 Valutazione dell’azione del bloccante SK1-3 Apamina sulla vitalità di cellule A375
Il bloccante selettivo SK1-3 Apamina è un peptide neurotossico in grado di bloccare i canali SK grazie a due ponti disolfuro interni alla molecola e due residui di Arginina nelle posizioni 13 e 14 [Girault A. et al., 2012]. L’Apamina è stata testata in un range di concentrazione 0,1-100μM per 48 ore di esposizione sulla linea cellulare umana di melanoma cutaneo A375 (fig.25)
Figura 25.Riduzione della vitalità cellulare della linea A375, dopo trattamento con Apamina (0,1-100µM ), dopo
48h di esposizione, 1%FBS.
I risultati ottenuti sembrano suggerire un mancato coinvolgimento di questi sottotipi di canali nel controllo della vitalità di cellule A375; infatti, in accordo con quanto riportato in letteratura, studi effettuati su linee cellulari di melanoma cutaneo come IGR39 e IGR1, evidenziano
-8 -7 -6 -5 -4 0 20 40 60 80 100 120 140 WST-1 Apamina A375 48h 1%FBS n=3 IC50=n.d. log M Apamin % c el l vi ab ili ty v s co nt ro l
73
uno scarso effetto inibitorio dell’Apamina sulla vitalità cellulare (riduzione ~20%) sono [Tajima N. et al., 2006].
I meccanismi alla base dell’effetto osservato non sono ad oggi conosciuti.
4.6 Valutazione dell’azione dell’attivatore non selettivo IK e SK1-3, 1-EBIO sulla vitalità cellulare
L’attivatore non selettivo 1-EBIO (1-ethyl-2-benzimidazolinone) è stato testato in un range di concentrazione 0,1-300μM per 48 ore sulla linea cellulare di melanoma cutaneo umano A375 (fig.26).
Figura 26.Riduzione della vitalità cellulare della linea A375, dopo trattamento con 1-EBIO (0,1-300µM ), dopo
48h di esposizione, 1%FBS. -8 -7 -6 -5 -4 0 20 40 60 80 100 120 140 n=3 IC50=n.d. WST-1 1-EBIO A375 48h 1%FBS log M 1-EBIO % c el l vi ab ili ty v s co nt ro l
74
La scelta di testare un attivatore, in questo caso 1- EBIO non selettivo IK SK1-3, si è basata su dati in letteratura che indicano un coinvolgimento anche da parte di alcuni attivatori dei canali KCa nel controllo della
vitalità cellulare [Girault A. et al., 2012; Debska G. et al., 2009].
I risultati ottenuti sono in linea con i dati della letteratura, sulla linea di cancro epidermoide KB-3-1 in cui, anche elevate concentrazioni di 1-EBIO non provocano una inibizione della vitalità cellulare [Lee E.L. et
75
Capitolo 5
Conclusioni
Dai dati ottenuti nel nostro studio risulta che la linea cellulare A375 di melanoma cutaneo umano esprime l’mRNA per i canali IK, mentre tali canali non risultano espressi nelle cellule non tumorali HaCaT.
Il bloccante IK selettivo, Clotrimazolo, si è mostrato in grado di inibire la vitalità cellulare con un IC50 di 9,88µM dopo 48 ore di trattamento; mentre, l’analogo strutturale TRAM-34, anch’esso bloccante IK selettivo, non ha dato effetto in termini di riduzione della vitalità cellulare nel nostro modello sperimentale.
I risultati ottenuti testando l’associazione Clotrimazolo-CisPt, in accordo con la letteratura [Lee E.L. et al., 2008], hanno evidenziato una perdita dell’effetto inibitorio sulla vitalità cellulare indotta dal solo CisPt. Potrà essere utile approfondire questo dato per comprendere possibili meccanismi di resistenza tumorale spontanea al chemioterapico e trovare strategie per contrastarla.
I canali SK1-3 risultano tutti espressi nelle cellule A375 mentre le cellule non tumorali HaCaT esprimono solo l’mRNA per gli SK1. Tuttavia, il bloccante SK1-3 selettivo Apamina, non ha portato una riduzione della vitalità cellulare nel nostro modello sperimentale.
L’attivatore KCa non selettivo 1-EBIO, non ha portato alcun effetto
inibitorio sulla vitalità, in accordo con quanto riportato da Lee et al., 2008 sulla linea di cancro epidermoide KB-3-1. Tuttavia, sulla base dei dati riscontrati con l’associazione Clotrimazolo/CisPt e da dati riportati sempre da Lee et al., nel lavoro del 2008, sarà interessante valutare
76
apritori del canale IK in associazione con il CisPt, per verificare l’importanza del canale IK nell’azione del chemioterapico.
Con i dati finora a disposizione non è possibile stabilire un ruolo chiaro di questi sottotipi di canali al potassio nel controllo della vitalità cellulare in cellule di melanoma cutaneo umano A375. Il profilo funzionale di questi canali dovrà essere valutato testando ulteriori molecole più selettive.
77
Abbreviazioni utilizzate nel testo
1-EBIO: 1-ethyl-2-benzimidazolinone AIC: 4-Amino-5-imidazole-carboxamide
BKCa: Canali al potassio calcio attivati larga conduttanza
CaM: calmodulina CisPt: Cisplatino
CyPPA:
N-Cyclohexyl-N-[2-(3,5-dimethyl-pyrazol-1-yl)-6-methyl-4-pyrimidinamine
DMSO: dimetilsolfossido
EDTA: acido etilendiamminotetraacetico FBS: siero fetale bovino
GAPDH: gliceraldeide 3-fosfato deidrogenasi
GW542573X: 4-(2-methoxy-phenylcarbamoyloxymethyl)-piperidine-1-carboxylic acid tert-butyl ester)
IKCa: Canali al potassio calcio attivati intermedia conduttanza
KCNMA1: gene che codifica per canale BK
KCNMB1-4: gene che codifica per le subunità ausiliarie β1-β4 KCNN1-4: geni che codificano per i canali SK1-4
MGMT: O6-methylguanine DNA methyltransferase
78
NS309: 6,7-Dichloro-1H-indole-2,3-dione 3-oxime PCR: Polymerase Chain Reaction
RCK 1-2: domini di regolazione della conduttanza al potassio RF: RNase Free
RT-PCR: reverse transcriptase-polymerase chain reaction SKCa: Canali al potassio calcio attivati bassa conduttanza
TNF-α: tumor necrosis factor α
79
Bibliografia
Abdullaev IF, Rudkouskaya A, Mongin AA, Kuo YH (2010). Calcium-activated potassium channels BK and IK1 are functionally expressed in human gliomas but do not regulate cell proliferationPLoS One., 5(8):e12304.
Allen DH, Lepple-Wienhues A, Cahalan MD (1997). Ion channel phenotype of melanoma cell lines. J Membr Biol., 155(1):27-34.
Azzabi A, Hughes AN, Calvert PM, Plummer ER, Todd R, Griffin MJ, Lind MJ, Maraveyas A, Kelly C, Fishwick K, Calvert AH, Boddy AV.(2005) Phase I study of temozolomide plus paclitaxel in patients with advanced malignant melanoma and associated in vitro investigations. Br J Cancer. ;92(6):1006-12.
Berkefeld H, Fakler B, Schulte U.(2010). Ca2+-activated K+ channels: from protein complexes to function. Physiol Rev. ;90(4):1437-59.
Burg ED, Remillard CV, Yuan JX ( 2006). K+ channels in apoptosis. J Membr Biol., 209(1):3-20.
Chantome A, Girault A, Potier M, Collin C, Vaudin P, Pagès JC, Vandier C, Joulin V (2009). KCa2.3 channel-dependent hyperpolarization increases melanoma cell motility. Exp Cell Res., 315(20):3620-30.
De Marchi U, Sassi N, Fioretti B, Catacuzzeno L, Cereghetti GM, Szabò I, Zoratti M (2009). Intermediate conductance Ca2+-activated potassium channel (KCa3.1) in the inner mitochondrial membrane of human colon cancer cells. Cell Calcium., 45(5):509-16.
Debska-Vielhaber G, Godlewski MM, Kicinska A, Skalska J, Kulawiak B, Piwonska M, Zablocki K, Kunz WS, Szewczyk A, Motyl T (2009). Large-conductance K+ channel openers induce death of human glioma cells. J Physiol Pharmacol. , 60(4):27-36.
Dutta AK, Khimji AK, Sathe M, Kresge C, Parameswara V, Esser V, Rockey DC, Feranchak AP (2009 ). Identification and functional characterization of the intermediate-conductance Ca(2+)-activated K(+) channel (IK-1) in biliary epithelium. Am J Physiol Gastrointest Liver Physiol., 297(5):G1009-18. Felipe A, Vicente R, Villalonga N, Roura-Ferrer M, Martínez-Mármol R, Solé L, Ferreres JC, Condom E (2006). Potassium channels: new targets in cancer therapy.
80
Gavrilova-Ruch O, Schönherr K, Gessner G, Schönherr R, Klapperstück T, Wohlrab W, Heinemann SH (2002). Effects of imipramine on ion channels and proliferation of IGR1 melanoma cells. J Membr Biol., 188(2):137-49.
Girault A, Haelters JP, Potier-Cartereau M, Chantôme A, Jaffrés PA, Bougnoux
P, Joulin V, Vandier C (2012).
Targeting SKCa channels in cancer: potential new therapeutic approaches Curr Med
Chem., 19(5):697-713.
Glass-Marmor L, Beitner R. (1997)
Detachment of glycolytic enzymes from cytoskeleton of melanoma cells induced by calmodulin antagonists. Eur J Pharmacol. ;328(2-3):241-8.
Guida M, Cramarossa A, Fistola E, Porcelli M, Giudice G, Lubello K, Colucci G. (2010) High activity of sequential low dose chemo-modulating Temozolomide in combination with Fotemustine in metastatic melanoma. A feasibility study. J Transl
Med. ;8:115.
Hirukawa K, Muraki K, Ohya S, Imaizumi Y, Togari A (2008). Electrophysiological properties of a novel Ca(2+)-activated K(+) channel expressed in human osteoblasts.
Calcif Tissue Int., 83(3):222-9.
Hougaard C, Jensen ML, Dale TJ, Miller DD, Davies DJ, Eriksen BL, Strøbaek D, Trezise DJ, Christophersen P. (2009)Selective activation of the SK1 subtype of human small-conductance Ca2+-activated K+ channelsby 4-(2-methoxyphenylcarbamoyloxymethyl)-piperidine-1-carboxylic acid
tert-butyl ester(GW542573X) is dependent on serine 293 in the S5 segment. Mol Pharmacol. ;76(3):569-78.
Isoldi MC, Pereira EA, Visconti MA, Castrucci AM (2004). The role of calcium, calcium-activated K+ channels, and tyrosine/kinase in psoralen-evoked responses in human melanoma cells. Braz J Med Biol Res., 37(4):559-68. Jäger H, Dreker T, Buck A, Giehl K, Gress T, Grissmer S (2004). Blockage of intermediate-conductance Ca2+-activated K+ channels inhibit human pancreatic cancer cell growth in vitro. Mol Pharmacol., 65(3):630-8.
Joiner WJ, Khanna R, Schlichter LC, Kaczmarek LK. (2001) Calmodulin regulates assembly and trafficking of SK4/IK1 Ca2+-activated K+ channels. J Biol
Chem;276(41):37980-5.
Kim C, Lee CW, Kovacic L, Shah A, Klasa R, Savage KJ. (2010) Long-term survival in patients with metastatic melanoma treated with DTIC or temozolomide. Oncologist. ;15(7):765-71.
81
Kunzelmann K (2005). Ion channels and cancer. J Membr Biol., 205(3):159-73. Lee EL, Hasegawa Y, Shimizu T, Okada Y. (2008). IK1 channel activity contributes to cisplatin sensitivity of human epidermoid cancer cells. Am J Physiol Cell Physiol., 294(6):C1398-406.
Lepple-Wienhues A, Berweck S, Böhmig M, Leo CP, Meyling B, Garbe
C, Wiederholt M (1996). K+ channels and
the intracellular calcium signal in human melanoma cell proliferation. J Membr Biol., 151(2):149-57.
Liang XJ, Taylor B, Cardarelli C, Yin JJ, Annereau JP, Garfield S, Wincovitch S, Szakács G, Gottesman MM, Aszalos A. (2005) Different roles for K+ channels in cisplatin-resistant cell lines argue against a critical role for thesechannels in cisplatin resistance. Anticancer Res;25(6B):4113-22.
Ma YG, Dong L, Ye XL, Deng CL, Cheng JH, Liu WC, Ma J, Chang YM, Xie MJ (2010). Activation of cloned BK(Ca) channels in nitric oxide-induced apoptosis of HEK293cells. Apoptosis., 15(4):426-38.
Meira DD, Marinho-Carvalho MM, Teixeira CA, Veiga VF, Da Poian AT, Holandino C, de Freitas MS, Sola-Penna M. (2005)Clotrimazole decreases human breast cancer cells viability through alterations in cytoskeleton-associated glycolytic enzymes. Mol Genet Metab. ;84(4):354-62.
Meyer R, Schönherr R, Gavrilova-Ruch O, Wohlrab W, Heinemann SH (1999). Identification of ether à go-go and calcium-activated potassium channels in human melanoma cells. J Membr Biol., 171(2):107-15.
Nagy N, Szuts V, Horváth Z, Seprényi G, Farkas AS, Acsai K, Prorok J, Bitay M, Kun A, Pataricza J, Papp JG, Nánási PP, Varró A, Tóth A (2009). Does small-conductance calcium-activated potassium channel contribute to cardiac repolarization? J Mol Cell Cardiol., 47(5):656-63.
Ningaraj NS, Sankpal UT, Khaitan D, Meister EA, Vats TS. (2009) Modulation of KCa channels increases anticancer drug delivery to brain tumors and prolongs survival in xenograft model. Cancer Biol Ther. ; 8(20):1924-33. Palmer ML, Schiller KR, O'Grady SM (2008). Apical SK potassium channels and Ca2+-dependent anion secretion in endometrial epithelial cells. J Physiol., 586(3):717-26.
Potier M, Chantome A, Joulin V, Girault A, Roger S, Besson P, Jourdan ML, LeGuennec JY, Bougnoux P, Vandier C (2011). The SK3/K(Ca)2.3 potassium channel is a new cellular target for edelfosine. Br J Pharmacol., 162(2):464-79. Reuland SN, Goldstein NB, Partyka KA, Cooper DA, Fujita M, Norris DA, Shellman YG (2011). The combination of BH3-mimetic ABT-737 with the alkylating agent
82
temozolomide induces strong synergistic killing of melanoma cells independent of p53. PLoS One., 6(8):e24294.
Roy JW, Cowley EA, Blay J, Linsdell P ( 2010). The intermediate conductance Ca2+-activated K+ channel inhibitor TRAM-34 stimulates proliferation of breast cancer cells via activation of oestrogen receptors. Br J Pharmacol., 1;159(3):650-8. Sciaccaluga M, Fioretti B, Catacuzzeno L, Pagani F, Bertollini C, Rosito M, Catalano M, D'Alessandro G, Santoro A, Cantore G,Ragozzino D, Castigli E, Franciolini F, Limatola C (2010). CXCL12-induced glioblastoma cell migration requires intermediate conductance Ca2+-activated K+ channel activityAm J Physiol Cell
Physiol., 299(1):C175-84.
Shen Z, Yang Q, You Q (2009). Researches toward potassium channels on tumor progressions. Curr Top Med Chem., 9(4):322-9.
Silveira AB, Correa-Oliveira R, Matsuyama H, de Oliveira EC, Neto SG, Luquetti AO, Furness JB, d'Avila Reis D (2008). Decreased expression of IK channels in neurons from enteric nervous system is associated with the development of chagasic megacolon. Hum Pathol., 39(9):1406-7.
Stühmer W, Pardo LA (2010). K(+) channels as therapeutic targets in oncology.
Future Med Chem., 2(5):745-55.
Tajima N, Itokazu Y, Korpi ER, Somerharju P, Käkelä R.(2011) Activity of BK(Ca) channel is modulated by membrane cholesterol content and association with Na+/K+-ATPase in human melanoma IGR39 cells. J Biol Chem. , 286(7):5624-38.
Tajima N, Schönherr K, Niedling S, Kaatz M, Kanno H, Schönherr R, Heinemann SH (2006). Ca2+-activated K+ channels in human melanoma cells are up-regulated by hypoxia involving hypoxia-inducible factor-1alpha and the von Hippel-Lindau protein. J Physiol., 571(Pt 2):349-59.
Traut MH, Berg D, Berg U, Mayerhofer A, Kunz L (2008). Identification and characterization of Ca2+-activated K+ channels in granulosa cells of the human ovary. Reprod Biol Endocrinol., 8;7:28.
Verkman AS. (2005) More than just water channels: unexpected cellular roles of aquaporins. J Cell Sci., 118(Pt 15):3225-32.
Villalonga N, Ferreres JC, Argilés JM, Condom E, Felipe A. (2007)Potassium
channels are a new target field in anticancer drug design. Recent Pat Anticancer Drug
Discov.; 2(3):212-23.
Wang J, Xu YQ, Liang YY, Gongora R, Warnock DG, Ma HP (2007). An intermediate-conductance Ca(2+)-activated K (+) channel mediates B lymphoma cell cycle progression induced by serum. Pflugers Arch., 454(6):945-56.
83
Wang Z (2004). Roles of K+ channels in regulating tumour cell proliferation and apoptosis. Pflugers Arch., 448(3):274-86.
Weaver AK, Bomben VC, Sontheimer H (2006). Expression and function of calcium-activated potassium channels in humanglioma cells. Glia., 54(3):223-33.
Wrzosek A (2009). Endothelium as target for large-conductance calcium-activated potassium channel openers. Acta Biochim Pol., 56(3):393-404.
Wulff H, Miller MJ, Hansel W, Grissmer S, Cahalan MD, Chandy KG (2000). Design of a potent and selective inhibitor of the intermediate-conductance Ca2+-activated K+ channel, IKCa1: a potential immunosuppressant. Proc Natl Acad Sci U
S A., 97(14):8151-6.
Zhang L, Zou W, Zhou SS, Chen DD (2009). Potassium channels and proliferation and migration of breast cancer cells Sheng Li Xue Bao. , 25;61(1):15-20.
84
Indice figure
Figura 1.Le quattro maggiori classi di canali al potassio [Girault A. et al., 2012]. ... 6
Figura 2.Rappresentazione dei segmenti transmembrana e dell'associazione delle subunità α dei canali IKCa e SKCa [Bowden S. et al., Tocris]. ... 12
Figura 3.Struttura dei canali SKCa e legame alla Calmodulina (CaM) [Girault A. et al., 2012]. ... 13
Figura 4.Rappresentazione del complesso tra Ca2+-CaM-canale ( Ca2+-CaM-CaMBD) [Wissmann R. et al., 2001]. ... 14
Figura 5.Struttura dei canali BKCa [Berkefeld H. et al., 2010]. ... 16
Figura 6.Struttura delle subunità β dei canali BKCa [Berkefeld H. et al., 2010]. ... 17
Figura 7.Struttura delle acquaporine [Verkman AS., et al., 2005]. ... 19
Figura 8.Fattori che differiscono nei processi apoptosi e proliferazione cellulare[Kunzelmann Karl, 2005]. ... 23
Figura 9.Rappresentazione schematica del melanocita [National Cancer Institute]. 30 Figura 10.Strutture chimiche dei composti utilizzati nello studio. ... 37
Figura 11. Fotomicrografica delle cellule A375 a bassa densità (sinistra) ed alta densità (destra) di crescita. ... 38
Figura 12. Fotomicrografica delle cellule HaCaT. ... 39
Figura 13. A:Bioconversione del substato WST-1 in sale di formazano solubile. B: risultato di un esperimento visualizzato con WST-1. 1) indica i pozzetti che contengono solo cellule e mezzo, 2) indica pozzetti che contengono mezzo, cellule e WST-1: più scuro è il colore, più forte è l’attività metabolica delle cellule. ... 46
Figura 14.Elettroforesi su gel di agarosio per il prodotto di PCR con primer relativi alla GAPDH. ... 58
Figura 15.Elettroforesi su gel di agarosio per il prodotto di PCR con primer relativi ai canali IK su cellule A375. ... 60
Figura 16.Elettroforesi su gel di agarosio per il prodotto di PCR con primer relativi ai canali SK1 – SK2 – SK3 su cellule A375. ... 60
Figura 17.Elettroforesi su gel di agarosio per il prodotto di PCR ottenuto con primer relativi ai canali IK e SK1-3 su cellule non tumorali HaCaT. ... 61
Figura 18. Riduzione della vitalità cellulare della linea A375, dopo trattamento con CisPt in un range di concentrazione 0,1-100 μM, dopo 48h di esposizione, 1% FBS. ... 63
Figura 19. Riduzione della vitalità cellulare della linea A375, dopo trattamento con Temozolomide in un range di concentrazione 0,1-400 μM, dopo 48h di esposizione, 1% di FBS. ... 64
Figura 20. Riduzione della vitalità cellulare della linea A375, dopo trattamento con Clotrimazolo in un range di concentrazione 0,1-20 μM, dopo 48h di esposizione, 1% FBS. ... 66
85
Figura 21. Riduzione della vitalità cellulare della linea A375, dopo trattamento con
TRAM-34 in un range di concentrazione 0,1-40 μM, dopo 48h di esposizione, 1%FBS. ... 67
Figura 22.Riduzione della vitalità cellulare della linea A375, dopo trattamento a) con
Clotrimazolo (0,1-20µM) b) con CisPt (0,1-100µM), dopo 48h di esposizione, 1%FBS. ... 69
Figura 23.Effetto sulla vitalità cellulare della contemporanea somministrazione di
CisPt 5µM e Clotrimazolo 5µM, dopo 48h di esposizone, 1%FBS. ... 70
Figura 24.Effetto sulla vitalità cellulare della contemporanea somministrazione di
CisPt 1µM e Clotrimazolo 5µM, dopo 48h di esposizone, 1%FBS. ... 70
Figura 25.Riduzione della vitalità cellulare della linea A375, dopo trattamento con
Apamina (0,1-100µM ), doopo 48h di esposizione, 1%FBS. ... 72
Figura 26.Riduzione della vitalità cellulare della linea A375, dopo trattamento con
86
Indice tabelle
Tabella 1. Sottotipi di canali al potassio [Zheng S. et al., 2009]. ... 9
Tabella 2.Nomenclatura dei canali KCa [Girault A. et al., 2012]. ... 10
Tabella 3.Canali al potassio calcio attivati e sottotipi [Worzosek Antoni, 2009]. ... 11
Tabella 4.Espressione dei canali KCa in condizioni fisiologiche [Berkefeld H. et al.,
2010; Tharp D.L. and Bowles D. K., 2009; Weaver A.K. et al., 2006; Nagy N. et al., 2009; Burg E.D. et al., 2006]. ... 18
Tabella 5.Bloccanti e apritori dei canali IK e SK1-3 [Worzosek Antoni, 2009; Traut
M. H. et al., 2009; Girault A. et al., 2012; Berkefeld H. et al., 2010; Jäger H. et al., 2003; Felipe A. et al., 2006; Dunn P.M., 1998; Wang Zhiguo, 2004; Wuff H. et al., 2000; De Marchi U. et al., 2009; Roy JW et al., 2009; Potier M. et al., 2010; Lee L. E., et al., 2008; Dutta K. A. et al., 2009; Abullaev F. I. et al., 2010; Weaver A. K. et
al., 2006; Gavrilova-Ruch O. et al., 2002; Palmer L.M. et al., 2007; Wulff H: et al.,
2001]. ... 24
Tabella 6.Espressione dei canali IK e SK1-3 in differenti tipi di cancro [Sciaccaluga
M. et al., 2010; Weaver A.K. et al., 2006; Abdullaev F.I. et al., 2010; Jager H. et al., 2003; Hirukawa K. et al., 2008; Roy JW et al., 2009; Zhang L. et al., 2008; Potier M.
et al., 2010]. ... 27
Tabella 7.Canali KCa e loro espressione nel melanoma cutaneo umano[
Lepple-Wienhues A., 1996; Allen D.H. et al., 1996; Nilius B. and Wohlrab W.,1992; Chantome A. et al. , 2009; Gavrilova-Ruch O. et al., 2002; Tajima N. et al., 2011; Meyer R. et al., 1999; Tajima N. et al., 2006; Lee L. E. et al., 2008]. ... 32
Tabella 8.Profili di attività dei composti saggiati sui canali IK e SK1-3. ... 36 Tabella 9.Sequenze dei primer utilizzati. Tutti gli oligo sono stati forniti dalla ditta
Sigma Genosys (Milano). ... 40
Tabella 10.Per ciascuna coppia di oligo utilizzati, sono indicati in tabella: sequenza
-Ta -numero cicli di PCR e -lunghezza dell’amplificato atteso (pb). ... 55
Tabella 11.Profilo di espressione ottenuto mediante RT-PCR qualitativa per i canali
al potassio IK e SK1-3 sulle linee cellulari umane di melanoma cutaneo A375 e cheratinociti HaCaT. Simboli: + : espresso - : non espresso +/- : debolmente espresso. ... 62