Capitolo 5
Valutazione invasiva della funzione microcircolatoria
coronarica e del metabolismo miocardico nella
Cardiomiopatia Dilatativa
Introduzione
La Cardiomiopatia Dilatativa (CMD) è una malattia cardiaca primitiva caratterizzata dalla riduzione della capacità contrattile e dalla dilatazione delle camere cardiache. Oltre ai fattori eziologici noti da tempo (genetici, autoimmunitari, virali e tossici), recentemente è stato ipotizzato che la disfunzione del microcircolo coronarico e l’alterazione del metabolismo miocardico possano rappresentare due nuovi meccanismi patogenetici di questa malattia.
Alcuni studi eseguiti mediante tomografia ad emissione di positroni (PET) hanno dimostrato nella CMD la riduzione del flusso miocardico sia in condizioni di
riposo che durante iperemia indotta farmacologicamente o durante stress cronotropo (Neglia et al, 1995 e 2002), compatibilmente con una condizione di disfunzione del microcircolo coronarico. In altri studi la riserva coronarica microcircolatoria misurata invasivamente è risultata ridotta in pazienti con CMD (Parodi et al, 1993).
Da alcuni anni di sta affermando l’idea che il metabolismo miocardico possa essere alterato in pazienti con CMD e che possa rappresentare un nuovo bersaglio nella terapia dello scompenso cardiaco. E’ noto che il cuore in condizioni normali ottiene la maggior parte della sua energia (60-90%) dall’ossidazione degli acidi grassi (FFA), mentre la restante parte (10-40%) da quella di substrati glucidici (glucosio, lattato e piruvato) e in minima percentuale dai corpi chetonici (Stanley et al, 2002). Numerose evidenze mostrano nella CMD in condizioni basali una ridotta captazione e ossidazione di acidi grassi e un preferenziale metabolismo di tipo glucidico, una condizione cioè caratterizzata da un’inversione della fisiologica scelta di substrati. Prove di tale alterazione derivano da studi di modelli animali (Recchia et al, 1998 e 2002) o, nell’uomo, da studi con tomografia ad emissione di positroni mediante molecole radiomarcate come il 18FDG o l’11C-palmitato (Davila-Roman et al, 2002).
Nell’uomo non è mai stato studiato come varia il metabolismo miocardico in rapporto alle alterazioni del microcircolo coronarico ed in particolare durante condizioni di stress con aumentato lavoro cardiaco.
Scopo di questo studio e’ stato quello di valutare invasivamente in sala di cateterismo la funzione del microcircolo coronarico e le caratteristiche del metabolismo miocardico in condizioni basali, durante stress cronotropo indotto da pacing a 130 battiti/minuto e 15 minuti dopo la sua interruzione in un gruppo di pazienti affetti da CMD confrontandole con quelle di una popolazione di soggetti con normale funzione sistolica, normali dimensioni del ventricolo sinistro e albero coronarico indenne da lesioni significative. In tutti i pazienti è stata inoltre valutata la riserva coronarica durante vasodilatazione massima indotta da adenosina.
Materiali e metodi
Popolazione di studioLa popolazione di studio era costituita da pazienti affetti da Cardiomiopatia Dilatativa (CMD) e da soggetti con normale funzione ventricolare sinistra, indicazioni all’esame coronarografico (non CMD) per storia di dolore precordiale tipico e/o positivita’ di test di stimolo per ischemia e documentazione angiografica di coronarie normali.
I criteri di inclusione per i pazienti con CMD erano:
• documentazione all’ esame 2D-Eco di una frazione di eiezione (FEVS) < 50% e diametro telediastolico ventricolare sinistro (DTDVS) >56 mm
• arterie coronariche angiograficamente normali • età compresa fra i 20 e gli 80 anni
mentre quelli di esclusione erano:
• scompenso cardiaco avanzato classe (NYHA IV)
• disfunzione contrattile e/o dilazione ventricolare sinistra secondaria a cardiopatia ischemica;
• malattia valvolare del cuore; • ipertensione moderata/severa; • fumo di sigaretta;
• diabete insulino-dipendente;
• malattie sistemiche rilevanti (neoplasie, insufficienza renale, epatica, polmonare);
I criteri di inclusione per il gruppo dei soggetti con normale funzione ventricolare erano:
• documentazione all’ esame 2D-Eco di una frazione di eiezione (FE) > 50%, diametro telediastolico ventricolare sinistro (DTDVS) <56 mm;
• indicazione clinica all’esame coronarografico per storia di dolore precordiale tipico e/o positivita’ di un test di stimolo per ischemia;
• assenza di stenosi coronariche emodinamicamente significative; • età compresa fra i 20 e gli 80 anni.
I criteri di esclusione erano gli stessi della popolazione dei pazienti affetti da CMD.
Valutazione clinica della popolazione di studio
Durante il ricovero presso l’Istituto di Fisiologia Clinica-CNR di Pisa i pazienti di entrambi i gruppi sono stati sottoposti a test bioumorali, curva da carico glucidico, elettrocardiogramma, radiografia del torace e a studio ecocardiografico bidimensionale e Doppler per la determinazione della funzione ventricolare, del diametro telediastolico e della massa del ventricolo sinistro. La popolazione dei non CMD è stata inoltre sottoposta ad esami da stress (elettrocardiogramma da sforzo, Eco-stress o scintigrafia miocardica con 99mTc-Sestamibi) per la valutazione della presenza di ischemia inducibile e per l’indicazione all’esame coronarografico.
8 pazienti affetti da CMD e 1 della popolazione con normale funzione ventricolare sinistra sono stati infine valutati mediante tomografia ad emissione di positroni (PET) per la studio quantitativo della perfusione miocardica con 13NH3 entro 30 giorni dallo studio in sala di cateterismo.
Protocollo dello studio
Il giorno precedente all’esame coronarografico è stato proposto ai pazienti di aderire, in aggiunta alla valutazione angiografica delle coronarie, allo studio invasivo della funzione microcircolatoria coronarica e del metabolismo miocardico. La durata, le modalità e le finalità della procedura sono state accuratamente spiegate ad ogni paziente.
Lo studio è stato eseguito al mattino dopo digiuno notturno e la terapia coronaroattiva, inclusi nitrati, Ca++-antagonisti, β-bloccanti, ACE-inibitori o statine, è stata sospesa almeno 24 ore prima. Il definitivo arruolamento è avvenuto solamente dopo aver escluso alla coronarografia la presenza di stenosi emodinamicamente significative dell’albero coronarico.
Lo studio consisteva nella misurazione di alcuni parametri di funzione coronarica (pressione di perfusione coronarica, velocità di flusso, area di sezione dell’arteria interventricolare anteriore) e della differenza artero-venosa transmiocardica di metaboliti marcati (13C-lattato) e non (acidi grassi liberi, glucosio e β-OH-butirrato) in condizioni basali, durante stress cronotropo a 130 battiti al minuto e nella fase di recupero dopo l’interruzione della stimolazione. Veniva infine valutata la riserva coronarica durante vasodilatazione massima da adenosina.
Subito dopo il cateterismo diagnostico è stata somministrata in bolo per via endovenosa una preparazione contenente 110 mg di L-lattato-3-13C , seguita dalla sua infusione continua ad una velocità di 130 mg/h.
I pazienti sono stati successivamente instrumentati col posizionamento di:
• catetere guida in arteria interventricolare anteriore (IVA) per la misurazione della pressione di perfusione coronarica;
• guida Doppler avanzata nella porzione mediana del ramo interventricolare anteriore (IVA) della coronaria sinistra per la misurazione continua della velocità di flusso coronarico;
• catetere per ecografia intracoronarica avanzato sulla guida Doppler nella porzione mediana dell’ IVA per la misurazione continua del calibro del vaso; • catetere in seno coronarico per il campionamento di sangue venoso refluo
dal tessuto miocardico;
• catetere stimolatore in atrio destro.
Durante lo studio sono stati monitorati continuamente ECG, pressione di perfusione coronarica, velocità istantanea e media di flusso nell’IVA e calibro coronarico. Tali segnali, tranne il calibro coronarico, sono stati registrati in continuo su carta ed acquisiti on-line su PC mediante programma dedicato. Il segnale ecografico intracoronarico è stato acquisito per ciascuna fase dello studio su computer dedicato con sincronizzazione temporale con il segnale di velocità di flusso. In ciascuna fase dello studio sono stati prelevati in contemporanea campioni di sangue arterioso da arteria femorale e venoso dal seno coronarico per la determinazione delle concentrazioni dei metaboliti d’interesse.
Il protocollo prevedeva 4 fasi per una durata complessiva di circa 60 minuti.
Fase 1 (basale): dopo circa 45 min dall’infusione del lattato marcato e dopo il
completamento della coronarografia diagnostica e dell’instrumentazione del paziente iniziava il monitoraggio dei segnali emodinamici che veniva continuato ininterrottamente per tutto lo studio; si procedeva contemporaneamente al primo campionamento artero-venoso.
Fase 2 (P130): si iniziava successivamente una stimolazione mediante pacing
atriale portando la frequenza cardiaca dapprima a 110 bpm per 3 minuti per poi aumentare fino a 130 bpm o al di sotto del punto di Wencheback. Alla fine dei 3 minuti alla frequenza definitiva si procedeva al secondo campionamento artero-venoso.
Fase 3 (RP15): 15 minuti dopo l’interruzione del pacing ad alta frequenza si
procedeva al terzo ed ultimo campionamento artero-venoso seguendo il ritorno ai valori basali delle variabili emodinamiche e di flusso.
Fase 4 (adenosina): dopo il ripristino delle condizioni emodinamiche di base si
iniziava l’infusione sistemica di adenosina e.v. (140 μg/kg/min) per 3 minuti. L’infusione di adenosina veniva prematuramente interrotta se clinicamente non tollerata o se si verificavano una significativa brachicardia (FC < 50 battiti/min) o ipotensione (pressione sistolica < 90 mmHg). Al terzo minuto di infusione, o appena prima della sua sospensione, si procedeva all’ultima registrazione della velocità di flusso e dell’area di sezione coronarica mediante sonda ecografica intravascolare.
Misurazioni
Parametri emodinamici
Le misurazioni delle velocità di flusso e delle aree coronariche nelle varie condizioni dello studio sono state effettuate off line su tracciati ed immagini relativi. L’area di sezione dell’arteria discendente anteriore è stata corretta sottraendo al valore misurato mediante la sonda ad ultrasuoni intravascolare il calibro della sonda stessa (0,0074 cm2).
Il flusso coronarico dell’IVA, espresso in millilitri al minuto (ml/min) è stato derivato applicando la seguente formula:
Flusso dell’IVA (ml/min) = velocità di flusso (cm/sec) x area di sezione coronarica(cm2) x 60
Per fornire i valori di flusso per unità di massa di tessuto (ml/min/g) i valori di flusso assoluto calcolati come sopra sono stati corretti per la massa miocardica stimata di pertinenza dell’arteria discendente anteriore nel modo seguente.
Flusso coronarico specifico (ml/min/g) = Flusso misurato nell’IVA (ml/min) 54% della massa del ventricolo sinistro (g)
Che tale correzione fosse necessaria ed adeguata deriva dalle seguenti osservazioni.
E’ noto che in condizioni fisiologiche esiste una correlazione diretta tra la somma delle sezioni dell’albero coronarico e la massa miocardica totale (Wieneke et al, 2004). Tale dato era presente anche nella nostra popolazione di studio, dal momento che i soggetti affetti da CMD presentavano valori di massa miocardica ventricolare sinistra stimata ecocardiograficamente (287±60 g contro 171±26 g, p<0,001) e, come atteso, di area di sezione dell’IVA (0,122±0,039 cm2 contro 0,093±0,02 cm2, p<0,05) significativamente superiori a quelli dei normali, a conferma che l’IVA dei pazienti con dilatazione ventricolare irrorava una massa di tessuto maggiore di quella dei soggetti con normali dimensioni del ventricolo sinistro. Seguendo il classico modello di suddivisione del ventricolo sinistro in 17 segmenti utilizzato nelle metodiche di imaging, 7 di essi sono attribuiti alla discendente anteriore (Cerqueira et al, 2002). Recentemente tuttavia Peretzol-Valdes et al (2005) hanno dimostrato che in realtà sono 8 e non 7 i segmenti che devono esser considerati di assoluta pertinenza dell’IVA, e che per altri 4 esiste variabilità, potendo esser essi irrorati esclusivamente dall’IVA o dall’arteria circonflessa o dalla coronaria destra oppure dalla combinazione di due di esse. Tenendo conto di ciò, e considerando il diverso contributo percentuale alla massa del ventricolo sinistro delle porzioni basale, intermedia ed apicale del ventricolo sinistro (rispettivamente 42, 36 e 21%) (Edwards et al, 1981), abbiamo stimato che il territorio irrorato dall’IVA varia dal 43% (8 segmenti su 17) al 65% (12 su 17) della massa totale del ventricolo sinistro. Il flusso miocardico specifico è stato ottenuto correggendo il flusso miocardico misurato invasivamente nell’IVA per la media di questi due valori (54%).
Per confermare la validità del calcolo così ottenuto, abbiamo studiato mediante PET il flusso miocardico specifico (ml/min/g) nel territorio di distribuzione dell’ IVA in 9 pazienti della stessa popolazione (8 CMD e 1 normale). I valori medi di flusso specifico ottenuti dal flusso totale invasivo dopo correzione per il 54% della massa ventricolare rispetto a quelli ottenuti con metodica PET non risultavano significativamente diversi ( 0,54±0,06 contro 0,55±0,05, p=NS).
Le resistenze coronariche dell’IVA sono state calcolate dividendo la pressione media di perfusione per il valore di flusso coronarico specifico.
La riserva coronarica dell’IVA è stata calcolata sia dai valori di flusso (flusso da adenosina/flusso basale) che da quelli di resistenze (resistenze basali/resistenze minime).
Il lavoro cardiaco è stato stimato nelle varie condizioni dai valori di doppio prodotto, ottenuto come pressione aortica media (mmHg) x frequenza cardiaca (bpm).
Substrati cardiaci
I campioni ematici dall’arteria femorale e dal seno coronarico sono stati raccolti in siringhe di plastica trattate con eparina o EDTA che sono state immediatamente riposte in ghiaccio. Attenzione speciale è stata prestata nel drenare il sangue lentamente dal catetere in seno coronarico per evitare la potenziale contaminazione del campione con sangue dell’atrio destro.
Le concentrazioni di glucosio sono state misurate nel plasma dopo centrifugazione (1000g/15 min/0°C) utilizzando una reazione enzimatica seguita da rilevazione spettrofotometrica a 340 nm. Gli acidi grassi sono stati valutati nel plasma dopo centrifugazione usando un saggio colorimetrico. Il lattato non marcato è stato misurato nel sangue deproteinizzato utilizzando una reazione enzimatica seguita da rilevazione spettrofotometrica a 340 nm. L’arricchimento isotopico del lattato con L-lattato-3-13C è stato misurato attraverso gas cromatografia spettrometria di massa in campioni di plasma deproteinizzati con acido sulfosalicilico come precedentemente descritto (Neese et al, 1983).
Il consumo miocardico di lattato, glucosio e acidi grassi è stato calcolato moltiplicando la differenza di concentrazione artero-venosa dei substrati marcati e non per i valori di flusso miocardico specifico nelle varie condizioni secondo un
approccio precedentemente validato in letteratura (Neese et al, 1983; Gertz et al, 1988).
Gas analisi
La PO2 e la PCO2 sono stati misurati dal gas analizzatore. La PO2 è stata moltiplicata per 0,003 ed è stato aggiunto il contenuto di O2 misurato dall’analizzatore dell’emoglobina per ottenere il contenuto totale di ossigeno (vol/vol). I livelli di ematocrito sono stati ottenuti mediante centrifugazione.
Il consumo miocardico di ossigeno (MVO2) è stato calcolato moltiplicando la differenza artero-venosa di O2 per il flusso miocardico specifico.
La PCO2 nei campioni di sangue arterioso e venoso è stata calcolata secondo i metodi descritti da Davenport (Davenport et al, 1969). La produzione miocardica di CO2 (MCO2) è stata ottenuta moltiplicando la differenza seno coronarico-arteriosa della concentrazione di CO2 (mmol/L) per il flusso miocardico specifico.
Il quoziente respiratorio è stato calcolato dal rapporto MCO2/MVO2. I valori di quoziente respiratorio variano da 0,707 a 1, corrispondenti, rispettivamente, all’ossidazione di FFA e carboidrati come unico substrato.
Analisi statistica
Tutti i dati sono presentati come media±ESM. L’analisi statistica per le variabili cliniche discontinue è stata eseguita con test non parametrico χ2, per i dati emodinamici e metabolici con test T di Student per dati non appaiati nel confronto delle medesime condizioni tra gruppi, e con analisi della varianza con ANOVA e test di Fisher per il confronto delle varie condizioni all’interno dello stesso gruppo. E’ stato considerato significativo un valore di p<0,05.
Risultati
Caratteristiche della popolazione
Sono stati arruolati dall’ottobre 2003 al maggio 2006 19 pazienti, 10 con CMD e 9 con funzione ventricolare sinistra e coronarie normali. Fra i soggetti con funzione e coronarie normali, una paziente ha mostrato vasospasmo coronarico durante la fase di pacing risoltosi con infusione di nitrati intraarteriosi, per cui di questo caso sono stati analizzati solamente i parametri basali; in un altro paziente il catetere per i prelievi venosi in seno coronarico si è dislocato in atrio destro, per cui non sono stati ottenuti i dati di gas analisi e le concentrazioni dei substrati venosi; dell’ultimo paziente studiato alla data odierna non è ancora stata eseguita la misurazione delle concentrazioni di substrati.
Tenendo conto di ciò, sia la funzione microcircolatoria sia il metabolismo miocardico sono stati studiati durante tutte e 3 le fasi in 10 pazienti CMD e 6 normali e in condizioni basali in un altro normale. La funzione microcircolatoria è disponibile in ulteriori 2 pazienti normali.
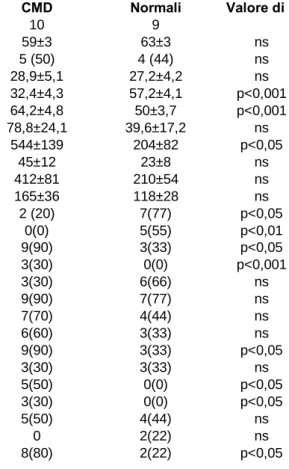
CMD Normali Valore di p
Numerosità 10 9
Età media 59±3 63±3 ns
Maschi, n (%) 5 (50) 4 (44) ns
Body mass index (kg/m2) 28,9±5,1 27,2±4,2 ns
FEVS 32,4±4,3 57,2±4,1 p<0,001 DTDVS 64,2±4,8 50±3,7 p<0,001 BNP (pg/ml) 78,8±24,1 39,6±17,2 ns Nt-pro-BNP (pg/ml) 544±139 204±82 p<0,05 Adrenalina (pg/ml) 45±12 23±8 ns Noradrenalina (pg/ml) 412±81 210±54 ns Aldosterone (pg/ml) 165±36 118±28 ns Angina n (%) 2 (20) 7(77) p<0,05
Positività a stress test, n (%) 0(0) 5(55) p<0,01
BBSx, n (%) 9(90) 3(33) p<0,05
Classe NYHA III(%) 3(30) 0(0) p<0,001
Ipertensione lieve, n (%) 3(30) 6(66) ns Dislipidemia, n (%) 9(90) 7(77) ns Diabete o IGT, n (%) 7(70) 4(44) ns β-bloccanti, n (%) 6(60) 3(33) ns ACE-inibit/AT-1 antagonisti, n (%) 9(90) 3(33) p<0,05 Statine, n (%) 3(30) 3(33) ns Digitale, n (%) 5(50) 0(0) p<0,05 Antialdosteronici, n (%) 3(30) 0(0) p<0,05 Antiaggreganti, n (%) 5(50) 4(44) ns Ca-antagonisti, n (%) 0 2(22) ns Diuretici, n (%) 8(80) 2(22) p<0,05
Tabella 5.1. Caratteristiche cliniche dei due gruppi
I due gruppi erano comparabili per età, sesso ed incidenza dei principali fattori di rischio cardiovascolare. I CMD, in accordo con i criteri di selezione, presentavano rispetto ai normali differenze significative di FE, DTDVS, presenza di BBSx, classe NYHA, valori di NT-pro BNP e uso di farmaci comunemente utilizzati nella terapia dello scompenso cardiaco. Tuttavia i CMD non differivano dai normali per i comuni indicatori di attivazione neuroendocrina. Tutti i normali avevano sintomatologia anginosa e/o positività ad un test da sforzo, condizione necessaria all’indicazione allo studio coronarografico; nessuno dei CMD che ha eseguito test da sforzo (6/10) ha invece mostrato positività per ischemia inducibile, sebbene vada precisato che 5 su 6 hanno dovuto interrompere lo sforzo per esaurimento fisico prima di raggiungere il valore target di frequenza cardiaca.
Emodinamica coronarica
In condizioni basali i pazienti con CMD avevano flussi significativamente inferiori (0,58±0,06 contro 0,87±0,05 ml/min/g, p<0,01) e valori di resistenze nel territorio dell’IVA aumentate (179,4±20,3 contro 121,1±5,4 mmHg/(ml/min/g), p<0,05) rispetto alla popolazione con normale funzione ventricolare sinistra (figura 5.1), in presenza di valori di pressione di perfusione coronarica media significativamente inferiori rispetto ai normali (89±3 contro 103±3 mmHg, p<0,01).
Durante vasodilatazione massima indotta da adenosina sia i CMD che i normali aumentavano significativamente il flusso coronarico specifico rispetto al basale, rispettivamente fino a 1,96±0,41 ml/min/g (p<0,01) e a 2,88±0,25 ml/min/g (p<0,001); le resistenze diminuivano significativamente (p<0,001), sempre rispetto al basale, fino a 50,9±10,5 mmHg/(ml/min/g) nei CMD e a 33,0±2,8 mmHg/(ml/min/g) nei normali. Tuttavia, la riserva coronarica calcolata dai valori di flusso (3,40±0,59 nei CMD contro 3,33±0,38 dei normali, p=ns) e di resistenze (3,99±0,75 contro 3,85±0,47, p=ns), non differiva tra i gruppi, pur rimanendo i valori di flusso più bassi e le resistenze del territorio dell’IVA più alte nei CMD in tutte le condizioni (figura 5.1).
0 ,5 1 1,5 2 2,5 3 3,5 4 Basale Adenosina Fl uss o IVA ( m l/ m in/ g) 0 1 2 3 4 5 R is er va co rona ri ca CMD Non CMD
* *
*
*
*
†† 0 ,5 1 1,5 2 2,5 3 3,5 4 Basale Adenosina Fl uss o IVA ( m l/ m in/ g) 0 1 2 3 4 5 R is er va co rona ri ca CMD Non CMD CMD Non CMD* *
*
*
*
†† 0 50 100 150 200 250 Basale Adenosina R esi st enz e I V A ( m m H g/ m l/m in /g ) 0 1 2 3 4 5 6 R ise rva r esi st en ze* *
*
***
† 0 50 100 150 200 250 Basale Adenosina R esi st enz e I V A ( m m H g/ m l/m in /g ) 0 1 2 3 4 5 6 R ise rva r esi st en ze* *
*
***
†Figura 5.1. Nei pannelli a sinistra sono rappresentati i valori di flusso (in alto) e di resistenze (in basso) dell’arteria interventricolare anteriore in condizioni basali e durante adenosina, in quelli a destra i valori di riserva coronarica e di resistenze. (†=p<0,05, ††=p<0,01 * *=p<0,01, * * * p<0,001 rispetto al basale)
Durante pacing atriale a 130 bpm in entrambi i gruppi si verificava un incremento del flusso coronarico specifico e una diminuzione delle resistenze coronariche, variazioni più marcate nei CMD, che presentavano un aumento di flusso del 40% (20% nei normali, p<0,05) con una parallela diminuzione del 28% delle resistenze (13% nei normali, p<0,05). A 15 minuti dalla interruzione del pacing fine tali parametri rientravano ai valori basali. Le variazioni di flusso e di resistenze nel territorio dell’IVA nei due gruppi sono riportate insieme a quelle di doppio prodotto
D o pp io pr od o tt o ( mmH g x b p m ) ,8 1 1,2 1,4 1,6 1,8 2 De lt a R P P Basale P130 RP15 0 2500 5000 7500 10000 12500 15000 17500 20000 Basale P130 RP15 D o pp io pr od o tt o ( mmH g x b p m ) ,8 1 1,2 1,4 1,6 1,8 2 De lt a R P P Basale P130 RP15 Basale P130 RP15 ,8 1 1,2 1,4 1,6 1,8 2 De lt a R P P Basale P130 RP15 Basale P130 RP15
***
***
***
***
† CMD Non CMD CMD Non CMD D o pp io pr od o tt o ( mmH g x b p m ) ,8 1 1,2 1,4 1,6 1,8 2 De lt a R P P Basale P130 RP15 0 2500 5000 7500 10000 12500 15000 17500 20000 Basale P130 RP15 D o pp io pr od o tt o ( mmH g x b p m ) ,8 1 1,2 1,4 1,6 1,8 2 De lt a R P P Basale P130 RP15 Basale P130 RP15 ,8 1 1,2 1,4 1,6 1,8 2 De lt a R P P Basale P130 RP15 Basale P130 RP15***
***
***
***
† D o pp io pr od o tt o ( mmH g x b p m ) ,8 1 1,2 1,4 1,6 1,8 2 De lt a R P P Basale P130 RP15 0 2500 5000 7500 10000 12500 15000 17500 20000 Basale P130 RP15 D o pp io pr od o tt o ( mmH g x b p m ) ,8 1 1,2 1,4 1,6 1,8 2 De lt a R P P Basale P130 RP15 Basale P130 RP15 ,8 1 1,2 1,4 1,6 1,8 2 De lt a R P P Basale P130 RP15 Basale P130 RP15***
***
***
***
***
***
***
***
† CMD Non CMD CMD Non CMD CMD Non CMD CMD Non CMD 0 ,2 ,4 ,6 ,8 1 1,2 1,4 F lu ss o IV A ( m l/m in /g ) Basale P130 RP15 ,8 ,9 1 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Basale P130 RP15 D el ta f lu sso IV A**
**
**
**
† † † † 0 ,2 ,4 ,6 ,8 1 1,2 1,4 F lu ss o IV A ( m l/m in /g ) Basale P130 RP15 ,8 ,9 1 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Basale P130 RP15 D el ta f lu sso IV A**
**
**
**
**
**
**
**
† † † † R es is te n ze IV A ( m m H g /m l/m in /g ) 0 50 100 150 200 250 ,6 ,7 ,8 ,9 1 1,1 1,2*
Basale P130 RP15 Basale P130 RP15 D el ta r esi st en ze † † †***
*
R es is te n ze IV A ( m m H g /m l/m in /g ) 0 50 100 150 200 250 ,6 ,7 ,8 ,9 1 1,1 1,2*
Basale P130 RP15 Basale P130 RP15 D el ta r esi st en ze † † †***
***
*
Figura 5.2. Variazioni del doppio prodotto (in alto), del flusso miocardico specifico (al centro) e delle resistenze nel territorio dell’IVA (in basso) in condizione basale, durante il pacing a 130 bpm e 15 minuti dopo il recupero. I pannelli a destra mostrano i valori assoluti, quelli a sinistra le variazioni percentuali rispetto al basale(†=p<0,05; †† =p<0,01;* =p<0,05 vs basale;**=p<0,01 vs basale;***=p<0,001 vs basale)
Metabolismo miocardico in condizioni basali e durante pacing
I dati di emodinamica coronarica e di metabolismo miocardico basale ottenuti in condizione basale, durante stress cronotropo e nel recupero sono riassunti in tabella 5.2.
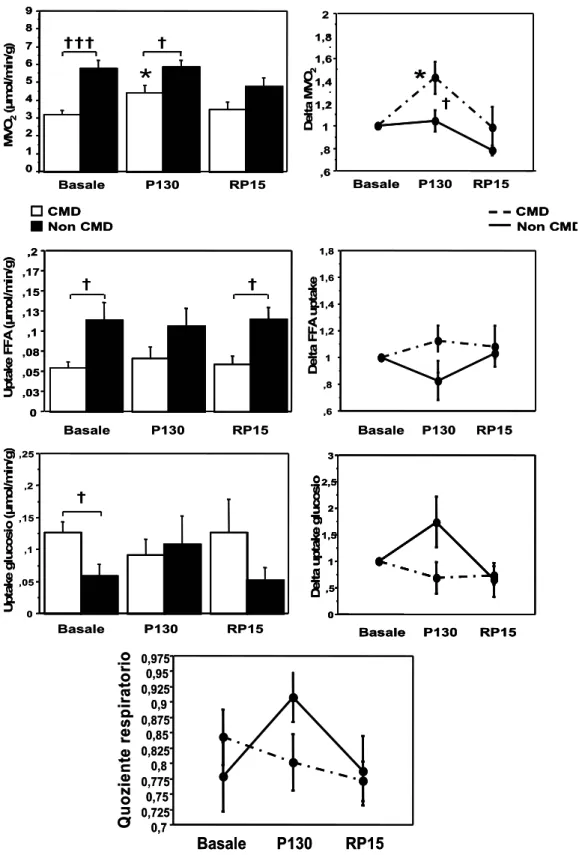
In condizioni di riposo i soggetti affetti da CMD mostravano un ridotto consumo di ossigeno (3,18±0,25 contro 5,79±0,47 μmol/min/g, p<0,001) e di acidi grassi (0,054±0,008 contro 0,113±0,022 μmol/min/g, p<0,05) rispetto ai soggetti con funzione contrattile conservata mentre era aumentata la captazione di glucosio (0,126±0,018 contro 0,059±0,044 μmol/min/g, p<0,05). In accordo con questi dati, il quoziente respiratorio calcolato dalla gas analisi risultava più elevato nei CMD sebbene non significativamente (0,84±0,04 contro 0,78±0,06).
Durante la fase di pacing a 130 bpm, il consumo di ossigeno aumentava in modo significativo nei CMD (aumento del 43%, p<0,05), mentre non mostrava praticamente alcuna variazione nei paziento con funzione contrattile normale (4%). In questi ultimi, come già noto dalla letteratura, si verificava una riduzione, seppur modesta (4%) della captazione di FFA e un aumento del 54% di quella di glucosio, con aumento dei valori di quoziente respiratorio (da 0,78±0,06 a 0,91±0,04) durante lo stress. Al contrario nei CMD la captazione di glucosio, elevata basalmente, si riduceva del 32% durante pacing a 130 bpm, mentre la captazione degli FFA aumentava del 13%, consistentemente con una riduzione del quoziente respiratorio (da 0,84±0,04 a 0,80±0,05) (figura 5.3).
,6 ,8 1 1,2 1,4 1,6 1,8 2
*
0 1 2 3 4 5 6 7 8 9 Basale P130 RP15 Basale P130 RP15 De lt a M V O2 MV O2 (μ mo l/m in /g ) CMD Non CMD CMD Non CMD*
† † † † † ,6 ,8 1 1,2 1,4 1,6 1,8 2*
0 1 2 3 4 5 6 7 8 9 0 1 2 3 4 5 6 7 8 9 Basale P130 RP15 Basale P130 RP15 De lt a M V O2 MV O2 (μ mo l/m in /g ) CMD Non CMD CMD Non CMD CMD Non CMD CMD Non CMD*
† † † † †† † † ,6 ,8 1 1,2 1,4 1,6 1,8 0 ,03 ,05 ,08 ,1 ,13 ,15 ,17 ,2 U p take F F A ( μ mo l/ mi n /g ) De lt a F F A u p ta ke Basale P130 RP15 Basale P130 RP15 † † ,6 ,8 1 1,2 1,4 1,6 1,8 0 ,03 ,05 ,08 ,1 ,13 ,15 ,17 ,2 0 ,03 ,05 ,08 ,1 ,13 ,15 ,17 ,2 U p take F F A ( μ mo l/ mi n /g ) De lt a F F A u p ta ke Basale P130 RP15 Basale P130 RP15 † † 0 ,05 ,1 ,15 ,2 ,25 U p ta ke gl u cosi o ( μ mo l/m in /g ) Basale P130 RP15 0 ,5 1 1,5 2 2,5 3 D el ta up tak e g luco si o Basale P130 RP15 † 0 ,05 ,1 ,15 ,2 ,25 U p ta ke gl u cosi o ( μ mo l/m in /g ) Basale P130 RP15 0 ,5 1 1,5 2 2,5 3 D el ta up tak e g luco si o Basale P130 RP15 0 ,5 1 1,5 2 2,5 3 0 ,5 1 1,5 2 2,5 3 D el ta up tak e g luco si o Basale P130 RP15 † 0,7 0,725 0,75 0,775 0,8 0,825 0,85 0,875 0,9 0,925 0,95 0,975 Q u oz ie nt e r es p ir at o ri o Basale P130 RP15 0,7 0,725 0,75 0,775 0,8 0,825 0,85 0,875 0,9 0,925 0,95 0,975 Q u oz ie nt e r es p ir at o ri o Basale P130 RP15Figura 5.3. A sinistra sono rappresentati, dall’alto verso il basso, i valori assoluti di consumo di ossigeno (MVO2), captazione di FFA e captazione di glucosio. A destra, sono raffigurate le variazioni percentuali dopo normalizzazione ai valori basali. Il pannello in basso mostra le variazioni del quoziente respiratorio nelle fasi dello studio (†=p<0,05; †††=p<0,001; *=p0,05 vs basale)
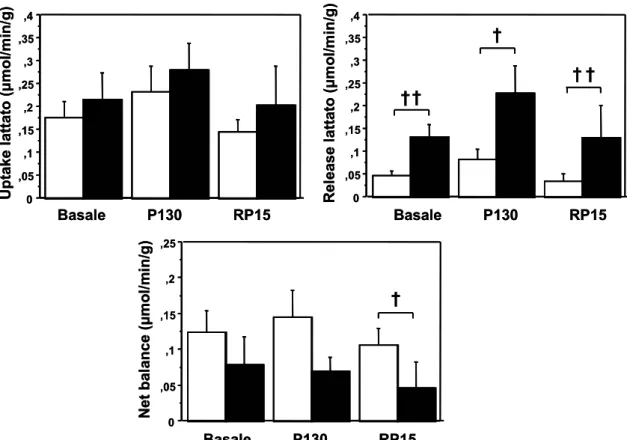
Sono state infine analizzate le variazioni del metabolismo del lattato nella condizioni di studio (figura 5.4). Durante pacing il rilascio di lattato in seno coronarico aumentava in entrambi i gruppi benché non significativamente rispetto al basale; comportamento simile era presente anche per la captazione di lattato. Tuttavia i pazienti con CMD mostravano valori di “net balance” (differenza artero-venosa per flusso) persistentemente piu’ alti nei pazienti con CMD rispetto ai pazienti normali a fronte di valori piu’ bassi di rilascio in seno coronarico. Questo dato è consistente con un maggior utilizzo di lattato dei pazienti con CMD in tutte le condizioni studio.
Infine la captazione di β-OH-butirrato risultava bassa, come del resto atteso, in tutte le condizioni dello studio (tabella 5.2)
0 ,05 ,1 ,15 ,2 ,25 ,3 ,35 ,4 Up take la ttato (μ mo l/mi n /g ) Basale P130 RP15 0 ,05 ,1 ,15 ,2 ,25 Net b al ance (μ mo l/m in /g) Basale P130 RP15 0 ,05 ,1 ,15 ,2 ,25 ,3 ,35 ,4 Rel ease lattato (μ mo l/min/ g ) Basale P130 RP15 † † † † † † 0 ,05 ,1 ,15 ,2 ,25 ,3 ,35 ,4 Up take la ttato (μ mo l/mi n /g ) Basale P130 RP15 0 ,05 ,1 ,15 ,2 ,25 Net b al ance (μ mo l/m in /g) Basale P130 RP15 0 ,05 ,1 ,15 ,2 ,25 ,3 ,35 ,4 Rel ease lattato (μ mo l/min/ g ) Basale P130 RP15 † † † † † †
Figura 5.4. Variazioni della captazione di lattato (in alto a destra), della sua liberazione in seno coronarico (in alto a sinistra) e del net-balance nelle tre condizioni dello studio.
Correlazioni tra diametro telediastolico, flusso coronarico e metabolismo miocardico in condizioni basali
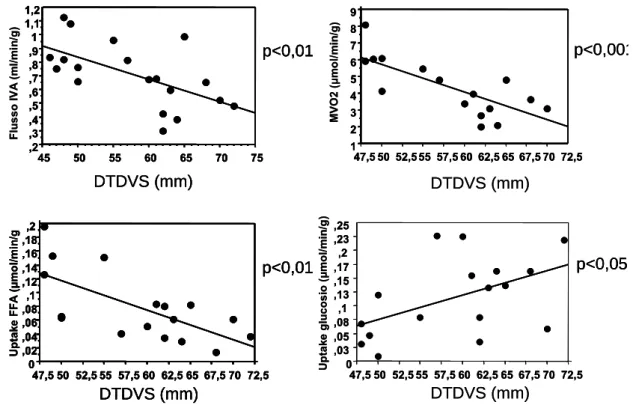
Nell’intera popolazione sono stati correlati con i valori di diametro ventricolare sinistro i dati relativi all’emodinamica coronarica, agli scambi di ossigeno ed all’uptake dei principali substrati in condizioni basali. Era presente significativa correlazione inversa tra diametro ventricolare e flusso coronarico, consumo di ossigeno, captazione di acidi grassi e correlazione diretta tra diametro telediastolico e consumo di glucosio (figura 5.5).
,2 ,3 ,4 ,5 ,6 ,7 ,8 ,9 1 1,1 1,2 45 50 55 60 65 70 75 p<0,01 DTDVS (mm) p<0,05 0 ,03 ,05 ,08 ,1 ,13 ,15 ,17 ,2 ,23 ,25 47,5 50 52,5 55 57,5 60 62,5 65 67,5 70 72,5 U ptak e gl u c osi o ( μ mo l/ m in /g ) 0 ,02 ,04 ,06 ,08 ,1 ,12 ,14 ,16 ,18 ,2 47,5 50 52,5 55 57,5 60 62,5 65 67,5 70 72,5 p<0,01 DTDVS (mm) U ptak e FFA ( μ m o l/min /g 1 2 3 4 5 6 7 8 9 47,5 50 52,5 55 57,5 60 62,5 65 67,5 70 72,5 p<0,001 DTDVS (mm) DTDVS (mm) F lu sso I V A (m l/ m in /g) MVO 2 ( μ mo l/ mi n/ g ) ,2 ,3 ,4 ,5 ,6 ,7 ,8 ,9 1 1,1 1,2 45 50 55 60 65 70 75 p<0,01 DTDVS (mm) ,2 ,3 ,4 ,5 ,6 ,7 ,8 ,9 1 1,1 1,2 45 50 55 60 65 70 75 p<0,01 ,2 ,3 ,4 ,5 ,6 ,7 ,8 ,9 1 1,1 1,2 45 50 55 60 65 70 75 p<0,01 DTDVS (mm) p<0,05 0 ,03 ,05 ,08 ,1 ,13 ,15 ,17 ,2 ,23 ,25 47,5 50 52,5 55 57,5 60 62,5 65 67,5 70 72,5 p<0,05 0 ,03 ,05 ,08 ,1 ,13 ,15 ,17 ,2 ,23 ,25 47,5 50 52,5 55 57,5 60 62,5 65 67,5 70 72,5 U ptak e gl u c osi o ( μ mo l/ m in /g ) 0 ,02 ,04 ,06 ,08 ,1 ,12 ,14 ,16 ,18 ,2 47,5 50 52,5 55 57,5 60 62,5 65 67,5 70 72,5 p<0,01 DTDVS (mm) U ptak e FFA ( μ m o l/min /g 0 ,02 ,04 ,06 ,08 ,1 ,12 ,14 ,16 ,18 ,2 47,5 50 52,5 55 57,5 60 62,5 65 67,5 70 72,5 p<0,01 DTDVS (mm) 0 ,02 ,04 ,06 ,08 ,1 ,12 ,14 ,16 ,18 ,2 47,5 50 52,5 55 57,5 60 62,5 65 67,5 70 72,5 p<0,01 0 ,02 ,04 ,06 ,08 ,1 ,12 ,14 ,16 ,18 ,2 47,5 50 52,5 55 57,5 60 62,5 65 67,5 70 72,5 p<0,01 DTDVS (mm) U ptak e FFA ( μ m o l/min /g 1 2 3 4 5 6 7 8 9 47,5 50 52,5 55 57,5 60 62,5 65 67,5 70 72,5 p<0,001 1 2 3 4 5 6 7 8 9 47,5 50 52,5 55 57,5 60 62,5 65 67,5 70 72,5 p<0,001 DTDVS (mm) DTDVS (mm) F lu sso I V A (m l/ m in /g) MVO 2 ( μ mo l/ mi n/ g )
Figura 5.5. Correlazioni tra diametro telediastolico e flusso miocardico specifico, consumo di ossigeno, captazione di acidi grassi e glucosio
P aram etro G ruppo B asale p P 130 p R P 15 p
Pre s sio ne ao rtica m ed ia CM D 89±3 91±4 90±4
(m m H G ) No rm ali 103±3 p <0,01 103±3 p <0,05 104±4 p< 0,01
F re q ue nza c ard iac a CM D 71±4 127±3 *** 71±4
(b a ttiti/m in) No rm ali 74±4 ns 131±3*** p= N S 78±5 n s
D o p p io p ro d o tto CM D 6325±411 11548±598 *** 6438±440
(m m H g x b attiti/m in) No rm ali 7692±515 ns 13685±587 *** p <0,05 7847±635 p< 0,05
Area IV A (cm 2) CM D 0,122±0,012 0,123±0,013 0,123±0,012
No rm ali 0,093±0,007 p <0,05 0,097±0,070 ns 0,097±0,009 n s
V e lo c ità d i fluss o (c m /se c ) CM D 16±5 22±3 15±3
No rm ali 16±1 ns 19±2 ns 14±3 n s F luss o (m l/m in/g ) CM D 0,58±0,06 0,81±0,06** 0,58±0,06 No rm ali 0,87±0,05 p <0,01 1,05±0,09** p <0,05 0,70±0,07 n s R es is tenze CM D 179±20 127±12 * 177±16 (m m H g /m l/m in/g ) No rm ali 121±5 p <0,05 115±14 ns 123±8 n s M V O 2 CM D 3,18±0,25 4,42±0,38 * 3,45±0,45 (μm o l/m in/g ) No rm ali 5,79±0,47 p<0,001 5,88±0,35 p <0,05 4,99±0,31 n s U p ta ke F F A CM D 0,054±0,008 0,066±0,014 0,058±0,011 (μm o l/m in/g ) No rm ali 0,122±0,024 p <0,05 0,108±0,026 ns 0,115±0,015 p< 0,05 U p ta ke g luco s io CM D 0,126±0,018 0,091±0,025 0,127±0,052 (μm o l/m in/g ) No rm ali 0,049±0,054 p <0,05 0,071±0,027 ns 0,052±0,020 n s
Q uo zie nte res p ira to rio (%) CM D 0,84±0,05 0,80±0,05 0,77±0,03
No rm ali 0,78±0,06 ns 0,91±0,04 ns 0,77±0,04 n s
U p ta ke la ttato CM D 0,175±0,036 0,231±0,057 0,145±0,025
(μm o l/m in/g ) No rm ali 0,215±0,058 ns 0,279±0,058 ns 0,201±0,087 n s
L ib era zio ne latta to CM D 0,047±0,010 0,082±0,023 0,034±0,017
(μm o l/m in/g ) No rm ali 0,132±0,027 p <0,01 0,205±0,056 p <0,05 0,130±0,070 p< 0,01
N et b alanc e latta to CM D 0,124±0,030 0,144±0,039 0,106±0,023
(μm o l/m in/g ) No rm ali 0,078±0,039 ns 0,065±0,017 ns 0,075±0,037 p< 0,05
U p ta ke b -O H -b utirrato CM D 0,083±0,030 0,110±0,050 0,111±0,048
(μm o l/m in/g ) No rm ali 0,120±0,038 ns 0,119±0,034 ns 0,133±0,042 p=N S
Tabella 5.2. Dati emodinamici e metabolici misurati invasivamente nelle tre condizioni dello studio (*=p<0,05 vs basale; **p<0,01 vs basale; ***p<0,01 vs basale)
Discussione
Il presente studio e’ il primo che abbia valutato mediante la misura diretta del flusso coronarico e dei gradienti transmiocardici dei principali substrati metabolici il rapporto tra flusso coronarico e metabolismo miocardico intermedio a riposo e durante stress cronotropo in pazienti con CMD in confronto a pazienti con funzione ventricolare e coronarie normali. I risultati ottenuti consentono una visione integrata delle alterazioni di flusso e metabolismo a riposo descritte nella CMD. Inoltre non erano mai state descritte le variazioni del metabolismo miocardico durante stress in questi pazienti.
Come primo risultato viene confermata la presenza di disfunzione microcircolatoria coronarica in pazienti con CMD, ma viene escluso che questa sia in grado di determinare ischemia miocardica durante stress cronotropo moderato. I valori assoluti di flusso coronarico corretti per la massa miocardica perfusa sono ridotti a riposo e tendenzialmente durante vasodilatazione farmacologica nei pazienti con CMD rispetto ai normali suggerendo la presenza nei primi di disfunzione microcircolatoria. Tale osservazione riproduce simili risultati ottenuti con metodiche diverse in analoghe popolazioni (Neglia et al, 1995 e 2002; Inoue et la, 1993). Durante stress cronotropo moderato, tuttavia, il flusso coronarico era in grado di aumentare e non veniva dimostrata evidenza metabolica di ischemia indotta da pacing in questi pazienti (rilascio di lattato in seno coronarico). Questi risultati non possono tuttavia escludere l’ipotesi di una risposta di tipo ischemico in pazienti con CMD in stadio più avanzato o in presenza di stress cronotropo piu’ marcato o di altro tipo.
L’analisi integrata dei dati di emodinamica coronarica e del metabolismo a riposo mostra come nei pazienti con disfunzione cardiaca primitiva, rispetto ai soggetti con capacità contrattile conservata, la riduzione del flusso coronarico specifico nel territorio dell’IVA, verosimilmente espressione di aumentato tono microvascolare, sia associata a riduzione del consumo di ossigeno e “switch
energeticamente piu’ efficienti (glucosio e lattato). I nostri risultati non chiariscono se sia un’alterazione microcircolatoria a determinare una compensazione metabolica, riconducibile pertanto ad ipoperfusione miocardica cronica come in pazienti con coronaropatia, o non piuttosto l’inverso. In ogni caso questi dati estendono precedenti osservazioni dimostrando una condizione miocardica flusso/metabolica molto simile a quella nota come “ibernazione” descritta nei cuori di pazienti con cardiopatia ischemica (Wijns et al, 2004, Camici et al, 2005).
Infine, durante stress cronotropo moderato, i pazienti con CMD mostrano uno “shift metabolico inverso”, caratterizzato dalla persistenza di un elevato utilizzo di glucosio ma dalla tendenza all’aumentato consumo di acidi grassi con un conseguente incremento del consumo di ossigeno rispetto alle condizioni di riposo. Tale comportamento è opposto a quello manifestato, coerentemente con i dati noti in letteratura, dai soggetti con normale funzione ventricolare sinistra. Apparentemente il miocardio disfunzionante fa fronte ad un pur modesto aumento di lavoro cardiaco riattivando l’utilizzo di acidi grassi in aggiunta alla già elevata captazione di substrati glucidici. L’incremento durante stress del metabolismo lipidico si associa ad un maggior consumo di ossigeno e ad un maggiore aumento di flusso rispetto ai soggetti non affetti da CDM. Questi risultati suggeriscono che un’aumentata captazione di acidi grassi durante stress possa contribuire, in presenza di disfunzione microcircolatoria, alla genesi di un danno transitorio o persistente della funzione ventricolare, nell’ottica di una possibile patogenesi “metabolica” della cardiomiopatia dilatativa. Tale osservazione è potenzialmente di grande rilievo clinico in quanto può aprire la strada a nuove terapie mirate a modificare l’assetto metabolico del miocardio. In accordo con questa possibilità, farmaci che inibiscono parzialmente l’ossidazione di acidi grassi si sono già dimostrati efficaci nel migliorare la funzione ventricolare in pazienti con CMD o con cardiomiopatia post-ischemica (Lee et al., 2005; Rupp et al., 2002; Belardinelli & Purcaro, 2001;Vitale et al., 2004).
Disfunzione microcircolatoria coronarica e metabolismo miocardico basale nella CMD
Il presente studio ha consentito di confermare, attraverso la misurazione invasiva del flusso coronarico dell’IVA mediante cateterismo coronarico, la severa riduzione della perfusione miocardica a riposo già documentata con metodica PET in pazienti con CMD (Neglia et al, 1995). Per esprimere il flusso misurato invasivamente in termini di flusso specifico per grammo di tessuto abbiamo corretto il valore misurato nell’IVA in ogni paziente per il 54% della massa totale del ventricolo sinistro misurata ecograficamente nello stesso paziente. Questa percentuale ci è sembrata ragionevole dal momento che uno studio scintigrafico recente, con iniezione del tracciante di flusso durante occlusione dell’IVA, aveva attribuito a questo vaso la perfusione di un numero di segmenti corrispondenti ad una percentuale variabile tra il 43% ed al 65% (media 54%) della massa totale del ventricolo sinistro, in accordo con precedenti studi autoptici (Peretzol-Valdes et al, 2005; Edwards et al, 1981). Tale correzione e’ stata validata nella nostra popolazione, confrontando il flusso miocardico specifico misurato alla PET con i valori misurati invasivamente e calcolati come sopra in un sottogruppo di 9 pazienti. Il fatto di non aver trovato differenze significative dei valori medi di flusso miocardico specifico tra le due metodiche ci conferma che la correzione era appropriata.
I valori di flusso miocardico specifico misurati basalmente nella nostra popolazione sono compatibili con i valori medi misurati mediante PET e riportati in letteratura sia in pazienti con CMD (0,5-0,6 ml/min/g) che in soggetti normali (0,9-1 ml/min/g) (Neglia et al, (0,9-1995 e 2002, Chareonthaitawee el al, 200(0,9-1). La riduzione del flusso miocardico a riposo dimostrata nei pazienti con CMD rispetto ai pazienti con funzione normale esprime quindi una condizione di disfunzione microcircolatoria coronarica caratterizzata dall’elevazione delle resistenze microvascolari basali. Tale dato è compatibile con un quadro di disfunzione
riposo. Nonostante questa evidente alterazione funzionale, la vasodilatazione coronarica non endotelio-mediata, quale quella ottenibile durante infusione e.v. di adenosina, risultava relativamente conservata nei pazienti con CMD rispetto ai soggetti con funzione normale. Infatti, durante adenosina, malgrado il flusso nell’IVA rimanesse inferiore e le resistenze aumentate nei CMD rispetto ai soggetti con funzione ventricolare sinistra conservata, i primi mantenevano una capacità vasodilatatoria comparabile con quella della popolazione di riferimento. La riserva coronarica da adenosina o dipiridamolo in pazienti con CMD è stata variabilmente descritta come conservata in precedenti studi invasivi o moderatamente depressa in studi condotti con PET (Inoue et al, 1993; Opherk et al; Neglia et al. 1995 e 2002). Una possibile spiegazione di tale discrepanza potrebbe risiedere nella differenza delle popolazioni di controllo. Infatti nel presente studio, e ovviamente in qualsiasi studio invasivo, i soggetti con funzione normale presentano indicazione allo studio coronarografico per il sospetto di cardiopatia ischemica, basato spesso sia sui sintomi sia sulla positivita’ di un test d’induzione d’ischemia. Tali soggetti potrebbero quindi in parte celare a loro volta una modesta disfunzione microcircolatoria attenuando la differenza di riserva coronarica con la popolazione in studio. Al di là di queste osservazioni, i nostri dati confermano che la disfunzione microcircolatoria si manifesta nella CMD prevalentemente attraverso la riduzione del flusso miocardico a riposo come espressione di disfunzione endoteliale.
Il mantenimento della capacità vasodilatatoria non endotelio-mediata è compatibile anche con quanto osservato durante stress cronotropo, dove il flusso aumentava nei CMD ed in modo significativamente maggiore rispetto ai normali (vedi dopo). Consistentemente, tale stress non ha provocato ischemia miocardica, come documentato dall’assenza di aumentato rilascio netto di lattato in seno coronarico. I nostri dati non ci consentono però di escludere che stimoli diversi o a maggior frequenza avrebbero potuto portare il miocardio dei soggetti con CMD all’ischemia, come precedentemente osservato in altri patologie caratterizzate dalla disfunzione del microcircolo coronarico come la sindrome X (Camici et al, 1996).
Per quanto riguarda il metabolismo miocardico a riposo, il presente studio costituisce la prima dimostrazione invasiva nell’uomo della presenza di uno “switch metabolico” in condizioni di riposo in pazienti con CMD. I pazienti con dilatazione ventricolare presentavano infatti una captazione ridotta di acidi grassi e aumentata di glucosio, associata ad un maggior consumo di lattato. Dati simili sono stati ottenuti mediante PET nell’uomo (Davila-Roman et al, 2002) e nel modello sperimentale di CMD indotta da pacing (Recchia et al, 1998, 1999 e 2001; Lionetti et al, 2004). Un dato completamente nuovo è la correlazione tra entità di dilatazione ventricolare, riduzione del flusso miocardico a riposo, riduzione del consumo di ossigeno e di acidi grassi ed aumentata captazione di glucosio. Questa osservazione rappresenta il primo approccio integrato alla comprensione delle alterazioni del metabolismo miocardico in relazione alla disfunzione del microcircolo coronarico a riposo nei pazienti con disfunzione ventricolare primitiva.
La spiegazione di tale fenomeno può esser duplice. Da un lato la condizione cronica di ridotta perfusione miocardica potrebbe indurre una modulazione del metabolismo miocardico verso una preferenziale ossidazione di substrati glucidici, più efficienti in termini di produzione energetica in relazione al consumo di ossigeno; questo potrebbe spiegare perché esso risulta basalmente ridotto nei CMD rispetto alla popolazione di pazienti con normale funzione del ventricolo sinistro. Dall’altro lato il cronico “switch metabolico”, caratterizzato da un basso consumo cellulare di acidi grassi, condizione poco dispendiosa in termini di consumo di ossigeno, potrebbe determinare la modulazione metabolica del flusso miocardico verso una sua riduzione cronica in condizioni basali. Indipendentemente dai rapporti con il flusso, il meccanismo dello “switch metabolico” sembra guidato dalla captazione di acidi grassi, che del resto rappresenta il fattore dominante nella regolazione del metabolismo miocardico. In condizioni di riposo, infatti, in presenza di minor attività della via ossidativa degli acidi grassi, si determina una riduzione della cronica inibizione sulla piruvato deidrogenasi da parte dell’enzima piruvato deidrogenasi chinasi (PDK). La rimozione di questo blocco molecolare consente al
mitocondrio e di procedere verso le vie ossidative a valle. I nostri dati non ci consentono di chiarire quale sia il meccanismo responsabile della primitiva riduzione di utilizzo di acidi grassi. Da un lato il primum movens potrebbe esser rappresentato dalla modulazione dell’espressione dei geni “metabolici” verso un fenotipo di tipo fetale (Razeghi et al, 1993), in direzione cioè di un assetto enzimatico predisposto alla preferenziale captazione e ossidazione di substrati glucidici, come avviene nella condizione di ipossia cronica della gestazione. Dall’altro lato, la riduzione della produzione endoteliale di ossido nitrico da parte della eNOS, condizione nota esser presente nell’insufficienza cardiaca e marker di disfunzione endoteliale, potrebbe rimuovere l’inibizione alla captazione di glucosio mediata dall’NO stesso (Recchia et al, 1998 e 1999).
Risposta metabolica miocardica allo stress nella CMD
Il presente studio ha consentito di studiare le variazioni indotte dall’aumento del lavoro cardiaco sul metabolismo miocardico intermedio in pazienti affetti da CMD, mai precedentemente esplorate in questo modello clinico di disfunzione ventricolare. Il pacing atriale a 130 bpm, utilizzato come stressor, determinava in questi pazienti un incremento di flusso miocardico specifico significativamente maggiore rispetto a quello dei pazienti con normale funzione ventricolare sinistra, parallelamente ad un maggiore incremento di consumo di ossigeno. In modo non atteso, i pazienti con CMD, al contrario dei soggetti con funzione normale, mostravano una tendenza all’aumento della captazione di acidi gassi ma non un ulteriore aumento di captazione di glucosio. L’incremento della captazione di FFA durante stress non è stato mai descritto in letteratura. Esso appare esattamente opposto a ciò che avviene nei soggetti con normale funzione ventricolare sinistra e con quanto noto da precedenti studi analoghi in individui normali (Gertz et al, 1988; Camici et al, 1989 e 1991; Barden et al, 2000), dove all’aumento del lavoro cardiaco il metabolismo miocardico risponde incrementando l’ossidazione di substrati glucidici, più “economici” in termini di consumo di ossigeno. Ciò non sarebbe
possibile nel cuore disfunzionante. In questo caso, infatti, l’ossidazione prevalente di glucosio e lattato potrebbe essere sufficiente alla produzione energetica richiesta dal miocardio solamente in condizioni basali, mentre verrebbe ad esser deficitaria in condizioni di aumentato lavoro cardiaco, andando il cuore, per così dire, a “corto di energia”. Che l’utilizzo di substrati glucidici sia elevato in tutte le condizioni dello studio nei pazienti con CMD e’ dimostrato dall’analisi dei dati di lattato, che mostrano come, a fronte di una captazione simile tra i due gruppi, i CMD presentavano costantemente un rilascio ridotto e, conseguentemente, un bilancio netto significativamente superiore rispetto ai soggetti con funzione cardiaca normale.
Si può tentare di dare una interpretazione di questo fenomeno che abbiamo definito “shift metabolico inverso”. E’ possibile che ad un medesimo aumento dei valori di doppio prodotto nei pazienti con CMD rispetto ai normali corrisponda un maggiore aumento di lavoro (maggiore stress di parete), oppure che, pur in presenza di un simile aumento di lavoro, il miocardio disfunzionante abbia una minore riserva energetica a causa di una riduzione basale delle scorte di substrati ad alta energia (Neubauer et al, 1997). In ogni caso l’aumento della captazione di substrati lipidici durante stress mostrato dai pazienti con CMD, se da un lato consente una maggior produzione di ATP per mole di substrato utilizzata, dall’altro determina un maggiore consumo di ossigeno per mole di ATP prodotta (Ingwall et al, 2001). Pertanto l’aumentato consumo di ossigeno durante stress richiede un parallelo aumenta del flusso miocardico, come osservato nel presente studio.
Il presente studio non consente di chiarire i meccanismi molecolari che regolano l’aumento della captazione di acidi grassi durante stress nella CMD. Una ipotesi possibile coinvolge il ruolo dell’NO nella modulazione acuta del metabolismo miocardico. Nel miocardio disfunzionante è dimostrata una aumentata espressione dell’ iNOS (Moncada et al, 1993) il che potrebbe determinare un’ aumentata produzione di NO durante stress. D’altra parte e’ ipotizzato da studi sperimentali che la ridotta disponibilita’ di NO a livello miocardico attivi il
conseguente riduzione dell’ossidazione glucidica determinerebbe una riattivazione della captazione cellulare di FFA, in parte per rimozione dell’inibizione mediata dal malonil CoA sulla CPT-1 (Saddik et al, 1993), in parte provocando una riduzione della concentrazione intracellulare di ATP e dell’aumento del rapporto ADP/ATP, indice dello stato energetico cellulare. In un sottogruppo di pazienti con CMD della popolazione in studio la misurazione transmiocardica dei metaboliti dell’NO ha consentito di mostrare una liberazione di questa molecola durante e dopo stress parallela all’aumentata captazione di acidi grassi (dati non mostrati, Vecoli et al, abs). E’ possibile quindi ipotizzare, qualora i dati preliminari descritti venissero confermati, che l’NO costituisca il “signaling” molecolare coinvolto nelle alterazioni croniche e nelle variazioni acute del metabolismo miocardico osservate nella CMD nel presente studio.
Implicazioni fisiopatologiche
Gli acidi grassi, a cui il miocardio si rivolge durante stress, rappresentano un substrato poco conveniente dal punto di vista del consumo di ossigeno, tanto più in presenza di disfunzione microcircolatoria come nella CMD. Inoltre, come già dimostrato da Buffon et al (2000) nella sindrome X, altra condizione caratterizzata dal ridotto flusso miocardico, lo stress cronotropo può indurre, in condizioni di ridotto apporto di ossigeno e aumentato stress ossidativo, la liberazione miocardica di lipoperossidi. La loro produzione potrebbe dunque provocare danno miocardico in situazioni acute di stress. Nel presente studio questa ipotesi non è stata verificata, ma in base ai nostri dati è immaginabile un possibile ruolo nella propagazione del danno miocardico da parte della perossidazione lipidica, tenendo presente che nella CMD è presente una riduzione dell’espressione degli enzimi della β-ossidazione (Sack at al, 1993; Davila-Roman et al, 1996) e che quindi non si può escludere che gli acidi grassi che entrano durante stress nella cellula, dal momento che non vengono ossidati, vadano a produrre un danno miocardico attraverso il meccanimo della perossidazione lipidica.
L’aumento della captazione di acidi grassi da noi osservato durante stress potrebbe infine condividere delle analogie con quanto avviene cronicamente nella cosiddetta “cardiomiopatia diabetica”, dove la condizione della disfunzione microcircolatoria, indotta dall’iperglicemia cronica, si associa ad aumentati livelli plasmatici di acidi grassi circolanti e ad una loro maggior captazione miocardica (Lopaschuk et al, 2002).
Limiti dello studio
Il presente studio presenta diversi limiti. Il primo di essi è caratterizzato dalle caratteristiche della popolazione dei “normali”. Tutti i pazienti appartenenti a tale gruppo presentavano infatti una sintomatologia anginosa e/o positivita’ ad un esame di induzione di ischemia, motivi per cui sono stati sottoposti all’esame coronarografico. Alcuni di essi mostravano poi un’elevazione degli indici di attivazione neuroormonale. Questa popolazione era perciò presumibilmente composta in buona parte da soggetti con disfunzione microcircolatoria e angina su base microvascolare. La procedura del cateterismo coronarico racchiude comunque in sé un rischio di fondo, per cui era ed è eticamente impossibile studiare una popolazione di veri normali.
Un secondo limite è rappresentato dalla bassa numerosità del campione che riduce la significatività statistica delle variazioni di alcuni parametri. Il ridotto numero di soggetti che è stato possibile studiare non consente poi di comprendere il ruolo che il diabete o la presenza di un’alterata curva da carico potrebbero giocare nella disfunzione microcircolatoria e nella modulazione del metabolismo miocardico. L’approccio migliore sarebbe stato quello di suddividere le due popolazioni in ulteriori due sottogruppi, caratterizzati da una risposta normale o patologica alla curva da carico glucidico. Inoltre, malgrado anche alcuni dei soggetti con normale funzione ventricolare sinistra assumessero farmaci coronaroattivi,
valori emodinamici e metabolici misurati siano del tutto esenti, soprattutto nella popolazione dei cardiomiopatici, dall’influenza della terapia di fondo.
Conclusioni
Questo studio costituisce la dimostrazione invasiva, ottenuta mediante cateterismo coronarico, di una condizione di disfunzione del microcircolo coronarico nella Cardiomiopatia Dilatativa. I risultati indicano che la manifestazione della disfunzione microvascolare si esplica, nei pazienti affetti da CMD, principalmente attraverso una riduzione del flusso miocardico specifico e un aumento delle resistenze in condizioni basali, in presenza di una capacità vasodilatatoria relativamente conservata.
Allo stesso tempo la misurazione della differenza artero-venosa transmiocardica dei principali substrati metabolici cellulari ha consentito la valutazione invasiva e diretta del metabolismo miocardico in condizioni basali e durante un modesto aumento del lavoro cardiaco. I dati ottenuti confermano nell’uomo la presenza, in condizioni di riposo, dell’attivazione cronica di uno “switch metabolico” verso la preferenziale ossidazione di substrati glucidici e una ridotta captazione di acidi grassi, che normalmente costituiscono il principale substrato del cuore. I risultati ottenuti escludono altresì che, almeno per lo stress da noi indotto, si verifichi una condizione di ischemia, sebbene non si possa escludere che in stadi più avanzati di malattia o in presenza di stimoli più efficaci il cuore vada incontro ad un vero e proprio “mismatch” tra domanda di ossigeno e nutrienti e il loro apporto. Il metabolismo miocardico durante stress mostra infine una tendenza alla riattivazione del metabolismo lipidico nei pazienti con CMD. I motivi per cui ciò avvenga non sono noti. Tuttavia è ipotizzabile che la captazione di acidi grassi, substrato efficiente dal punto di vista della resa energetica, ma poco “economico” in termini di consumo di ossigeno, possa esercitare effetti deleteri, acuti o persistenti, sulla funzione miocardica.
In tale ottica, l’ottimizzazione del metabolismo energetico miocardico, senza determinare alcun effetto negativo sull’emodinamica e l’inotropismo, potrebbe risultare particolarmente utile nella terapia dell’insufficienza cardiaca. Gli agenti farmacologici conosciuti come “modulatori metabolici” agiscono migliorando l’efficienza della traduzione dell’energia biochimica in lavoro contrattile. Attraverso l’inibizione del metabolismo lipidico la stimolazione di quello glucidico si sono già dimostrati efficaci nel trattamento dell’infarto miocardico acuto e dell’angina stabile (Stanley et al, 1997; McCormack et al, 1998). Si apre perciò la possibilità implementare l’attuale terapia dell’insufficienza cardiaca aggredendo un nuovo bersaglio, il metabolismo miocardico.