CAPITOLO 4:
RISULTATI
4.1 Preparazione del plasmide pVIVO esprimente i geni
env
e
fGM-CSF
Per il priming a DNA è stato scelto il plasmide pVIVO-2 mcs, che permette la contemporanea ed efficiente espressione in vivo di due geni posti sotto il controllo di promotori diversi. Al suo interno è stato clonato il gene env di FIV, con cui intendiamo effettuare l’immunizzazione degli animali, ottenuto da un isolato primario linfotropico e quindi simile a quella dei ceppi circolanti natura. Per consentire un’adeguata produzione di Env è stata clonata l’intera sequenza contenente, oltre ad env, anche il gene rev e l’RRE, essenziali per il corretto processamento ed il trasporto del messaggero dal nucleo al citoplasma.
Come immunostimolante è stato scelto il fGM-CSF, il quale è stato clonato all’interno dello stesso plasmide codificante per env. La sequenza codificante di questa citochina, ottenuta in lavori precedenti da macrofagi alveolari di un gatto FIV-infetto, è stata clonata preliminarmente nel plasmide pCR2.1-TOPO ed amplificata da quest’ultimo con due primer contenenti i siti di taglio degli enzimi di restrizione BspHI e XbaI. Per l’amplificazione è stata utilizzata la DNA polimerasi proof-reading PfuUltra con un massimo di 30 cicli di amplificazione, per evitare l’eventuale inserimento di mutazioni puntiformi nella sequenza codificante.
Il prodotto ottenuto è stato controllato mediante sequenziamento ed è stato effettuato un allineamento della sequenza aminoacidica ottenuta con quelle del GM-CSF umano e murino presenti in banca dati (Figura 4.1). Da questo confronto è risultata un’omologia di sequenza pari all’82% tra la sequenza felina e quella umana, di circa il 70% con quella murina. Questo risultato ci ha permesso di utilizzare un saggio per valutare l’attività biologica della citochina, simile a quello impiegato per il GM-CSF umano (hGM-GM-CSF).
10 20 30 40 50 60 70 80 . . . . | . . . . | . . . . | . . . . | . . . . | . . . . | . . . . | . . . . | . . . . | . . . . | . . . .| | | D E E E E E D EE E E . D E . . . . . E E . DD .E . E . | | . . . E E E E D D D . E . . . E E . D . D D D E . . . . | . . . | | . . . . felis MWLQNLLFLNTVV SISAPTSSPSSVTRPWQHV AMK ALSLLNNSS ITAVMN TV VVS MF P PK LQTHLKLY homo ....S..L.G..A .....AR...PS.Q.. ..N.IQ .RR...L.R TA. .. .. .I. .. LQ .T ...R. ..K mouse .........GI..Y.L....R..IT.....K.. .I. ..N.. MPVTLN--- . ...N .SFKKLT V..R..IF 90 100 110 120 130 140 . . . . | . . . . | . . . . | . . . . | . . . | . . . . | . . . | . . . . | . | . . . . felis QGLRGSLISLK PLRMMANHYKQH PLTP TP TQTITFKNFK KLK FLFNNPF WGP QK
homo .......TK..G..T...S... .P.. .S A..I... S.. N.. ..LVI.. . .V.
mouse .....NFTK..GA.N.T.SY.QTY .P.. . ..VT.YA .I S..T..T I.. KK.V..
. . . . C C . . . | C C C . . . . . .
Figura 4.1: Allineamento delle sequenze aminoacidiche del GM-CSF felino, umano, murino.
4.2 Valutazione attività biologica del fGM-CSF
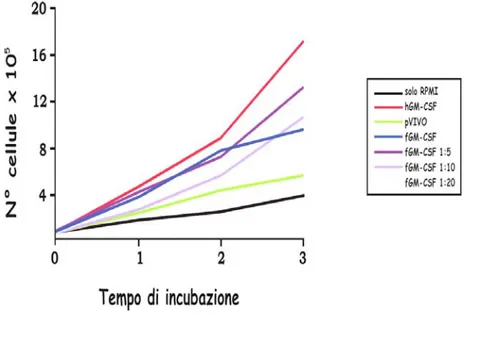
Al fine di valutare l’attività biologica del fGM-CSF è stata utilizzata la linea cellulare eritroblastoide umana, TF-1, costituita da cellule dipendenti per la crescita dal hGM-CSF. Il fGM-CSF è stato prodotto mediante trasfezione sulle CrFk del costrutto pVIVO/fGM-CSF. Sono state effettuate diverse prove preliminari: le CrFk sono state trasfettate in piastre da 6 pozzetti utilizzando quantità diverse di cellule, rispettivamente 1X10^6, 8X10^5, 5X10^5 cellule/pozzetto, per poter raccogliere il surnatante a tre tempi diversi. In parallelo è stato utilizzato anche il solo vettore pVIVO-2, come controllo negativo. Il surnatante delle cellule trasfettate è stato raccolto dopo 24 ore, 2 giorni e 3 giorni, ed è stato testato sulle TF-1, utilizzandolo in diverse diluizioni col terreno RPMI 1640 fresco (1:5, 1:10, 1:20, non diluito). Le TF-1 sono state poi incubate con la citochina, ogni diluizione è stata testata su tre pozzetti di cellule in modo da poter effettuare la lettura a tempi diversi di incubazione. Dopo l’incubazione le cellule sono state contate nella camera di Burker ed è stato comparato il numero di quelle incubate con il fGM-CSF con quello delle cellule cresciute in presenza del solo pVIVO e quelle incubate con il semplice terreno RPMI 1640, considerati controlli negativi. Come controllo positivo sono state utilizzate le cellule incubate con il hGM-CSF. I risultati del conteggio, riportati nella figura 4.2, si riferiscono al surnatante raccolto a 2 giorni dalla trasfezione. I prelievi eseguiti agli altri tempi hanno prodotto risultati simili (dati non mostrati). Dal grafico è possibile notare la progressiva crescita delle cellule che hanno ricevuto il surnatante contenente il fGM-CSF. Dopo 4 giorni di incubazione, pur essendo
leggermente inferiore alle cellule cresciute con il hGM-CSF, la diluizione 1:5 si è dimostrata essere più efficace nello stimolare la crescita delle TF-1.
Figura 4.2: Cinetica di crescita delle TF-1 in presenza del surnatante contenente fGM-CSF raccolto a 2 giorni dalla trasfezione.
Per un’ulteriore verifica dell’attività biologica del fGM-CSF è stato messo a punto un saggio di proliferazione con timidina triziata (3H-timidina). Il saggio è stato
effettuato incubando le TF-1 con il fGM-CSF prodotto nello stesso modo precedentemente descritto. In parallelo è stato testato anche il costrutto pVIVO/fGM-CSF/env-rev, che costituisce il costrutto finale di priming del protocollo di vaccinazione. Le cellule sono state seminate in quadruplicato in una piastra da 96 pozzetti ed incubate per due giorni senza aggiungere hGM-CSF al terreno di coltura. Al termine sono state aggiunte le diverse diluizioni del terreno contenente la citochina e l’incubazione e proseguita per ulteriori 48 ore. Sono state testate le diluizioni 1:5, 1:10, oltre al surnatante non diluito. Sono stati utilizzati come controlli negativi le cellule incubate con le stesse diluizioni del surnatante della trasfezione effettuata col solo pVIVO-2, con il surnatante delle CrFk non trasfettate, e le cellule cresciute nel solo terreno RPMI 1640. Il controllo positivo è stato realizzato con il hGM-CSF. Per misurare l’attività di proliferazione cellulare è
stata aggiunta timidina triziata e dopo 5 ore le cellule sono state raccolte su un filtro ed è stata analizzata la quantità di 3H-timidina incorporata nel DNA con un
contatore di particelle β. I risultati sono stati interpretati in funzione dell’indice di stimolazione (IS), come descritto nella sezione Materiali e Metodi. In particolare è stato calcolato il rapporto tra i cpm ottenuti dai campioni in esame ed i cpm delle cellule coltivate con il solo RPMI-1640 (controllo negativo). Dall’analisi dei risultati, presentati nel grafico in figura 4.3, è possibile osservare che la proliferazione è risultata al di sopra della soglia di significatività ogniqualvolta era presente GM-CSF (sia felino che umano) nel terreno di crescita. Per quanto riguarda il fGM-CSF le diluizioni 1:5 e 1:10 hanno mostrato i risultati migliori. È da notare infine che il surnatante delle CrFk trasfettate con pVIVO, anche alla più bassa diluizione, non ha indotto livelli di proliferazione paragonabili agli altri costrutti e che i cpm derivati dalle cellule trattate con il surnatante delle CrFk non trasfettate erano molto simili a quelli prodotti dalle cellule cresciute col solo RPMI-1640 (Dati non mostrati).
n il saggio di proliferazione con 3H-timidina (ND: non Figura 4.3: Risultati ottenuti co
4.3 Produzione del costrutto di
packaging
e dei costrutti vettore
Per la realizzazione della seconda fase del progetto di vaccinazione, è stato sviluppad
4.3.1 Produzione e caratterizzazione del costrutto di
packaging
Precedentemente a questo lavoro erano stati prodotti 4 costrutti di packag
(
to un vettore FIV-derivato veicolante sia il gene env sia quello che codifica per un secondo immunostimolante, l’fIFNγ. Per la produzione e caratterizzazione in vitro del vettore è stata inizialmente prevista una strategia a due plasmidi: uno dei ue costrutti, il packaging, serve per fornire le proteine strutturali del virus (Gag) e quelle enzimatiche necessarie per il ciclo replicativo (Pol e le altre proteine enzimatiche). L’altro costrutto, il vettore, contiene invece i geni da trasdurre, fornisce le proteine dell’involucro esterno ed è incapsidato nella particella progenie. Per testare la funzionalità dei costrutti vettore sono stati utilizzati dei costrutti prototipo che contengono la GFP come gene reporter al posto del fIFNγ, che verrà inserito una volta terminata la fase di ottimizzazione del sistema di trasduzione.
ing, a partire dal clone molecolare p34TF10 opportunamente ingegnerizzato Figura 3.1 sez. Materiali e Metodi). In tutti i costrutti prodotti la regione che comprende LTR al 5’ ed il segnale di incapsidamento (Ψ) di FIV era stata sostituita con il pCMV, mentre LTR al 3’ con il BGHpolyA. Su due dei costrutti inoltre erano state effettuate delezioni sul gene env, di 1 e 2 Kb rispettivamente, realizzate in modo tale da non intaccare la cornice di lettura di rev, né di rimuovere l’RRE. Entrambi questi elementi infatti sono sovrapposti ad env e necessari per l’espressione della poliproteina Gag-Pol. I due costrutti erano stati denominati p∆env1 e p∆env2, rispettivamente. Nell’altra coppia di costrutti di packaging precedentemente prodotta, erano state introdotte delezioni del genoma virale più estese per ridurre al minimo le omologie col vettore ed evitare il rischio di ricombinazione, fatto che potrebbe dar luogo a progenie infettante. Per questo
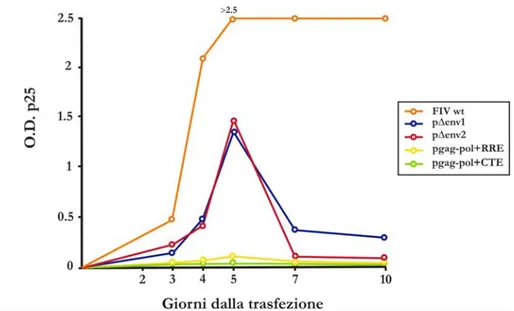
motivo in uno dei due costrutti (pGag-Pol +CTE) era stata inserita a valle di pol la sequenza CTE che rende l’espressione degli mRNA di FIV indipendente dal sistema rev/RRE. L’altro invece (pGag-Pol RRE) conteneva nella stessa posizione a valle di pol, la sola sequenza RRE di FIV e necessitava perciò di Rev da fornire in trans. I diversi costrutti di packaging sono stati valutati per funzionalità ed efficienza, attraverso l’analisi del rilascio della proteina p25 nel surnatante delle colture delle cellule trasfettate con ciascun prodotto di packaging. Dagli esperimenti effettuati sulle CrFk è possibile osservare che i livelli di p25 per i costrutti p∆env1 e p∆env2 sono già rilevabili a 3 giorni dalla trasfezione, raggiungono un picco a 5 giorni e declinano a 7 giorni (Figura 4.4). Per effettuare gli esperimenti successivi abbiamo scelto il costrutto p∆env2 che, a parità di efficienza di produzione di p25, è stato preferito a p∆env1 per la ridotta percentuale di omologia di sequenza col costrutto vettore che garantisce una minor probabilità di ricombinazione intermolecolare.
Figura 4.4: Valori di assorbanza (O.D.) per p25 dopo trasfezione dei costrut
4.3.2 Produzione dei costrutti vettore
(KKS), contenente il gene env clonato direttamente da un isolato primario
ti di packaging su CrFk.
linfotro
ano un’estesa delezione in gag-pol, al cui posto è stata inserita
del costrutto vCMV-GFP
è stata effettuata una cotrasfezione con il costrutto di packaging, p∆env2, su CrFk. La coespreito sulle MBM, una linea linfocitaria T felina che ha proprietà molto simili a quelle d
pico in grado di infettare e replicare efficientemente su linfociti primari e linee linfocitarie T feline.
I costrutti vettore, a differenza di quelli di packaging, mantengono infatti il gene env, mentre present
la cassetta di espressione pCMV-GFP (Figura 3.3 sez. Materiali e Metodi). Nel costrutto definitivo al posto della GFP, gene reporter utilizzato per valutare l’efficienza di trasduzione, verrà inserito l’fIFNγ.
4.4 Analisi dell’efficienza di trasduzione
Al fine di stabilire l’efficienza di trasduzione del costrutto vCMV-GFP,
ssione di packaging e vettore dovrebbe originare delle particelle virali complete, sebbene difettive nella replicazione, in grado di infettare cellule linfoidi e veicolare il gene di interesse al loro interno. In tutte le prove di trasfezione sono stati utilizzati controlli negativi, cellule mock trasfettate, e positivi, cellule trasfettate con un plasmide esprimente la sola GFP sotto il controllo del promotore pCMV.
A 3 giorni dalla trasfezione è stato prelevato il surnatante delle colture e trasfer
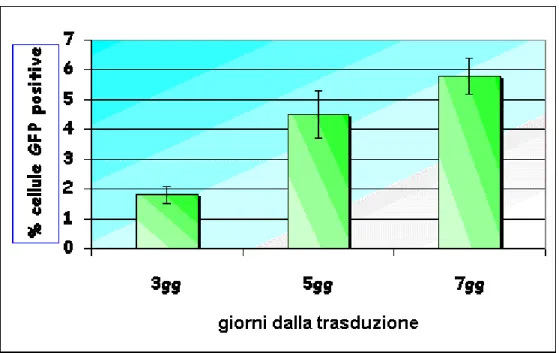
ei linfociti primari. Una parte è stata invece utilizzata per analizzare i livelli di p25, indice di liberazione delle particelle virali; i livelli della proteina sono risultati simili a quelli ottenuti col p∆env2. L’efficienza di trasduzione è stata calcolata analizzando al FACS i livelli di espressione di GFP a 3, 5, 7 giorni dall’infezione, e riportata in grafico come percentuale di cellule GFP-positive (Figura 4.5).
Figura 4.5: Livelli di trasduzione su MBM ottenuti con il vettore vCMV-GFP e analizzati a 3, 5, 7 giorni dalla traduzione. Le barre verticali indicano la
deviazione standard sulla media delle prove effettuate.
Come mostrato dal grafico la trasduzione ha prodotto solo una debole positività sulle MBM dopo 3 giorni dall’infezione, ma è visibile un progressivo aumento fino al settimo giorno. Per valutare l’infettività residua e verificare quindi che nelle cellule trasdotte non fosse presente virus infettante, è stata saggiata la presenza di p25 nel surnatante di queste ultime dopo 3 e 5 giorni; in caso di replicazione in atto si osserva positività per la p25, che aumenta col progredire della replicazione, mentre in questo caso la p25 è risultata negativa ad entrambi i tempi.
Vista la bassa efficienza di trasduzione ottenuta in questi esperimenti, abbiamo ipotizzato che questo fenomeno potrebbe essere dovuto alla non adeguata espressione di Env da parte del costrutto vettore. In base a questa ipotesi e con l’obiettivo di migliorare la produzione del vettore, abbiamo deciso quindi di utilizzare come target degli esperimenti di trasduzione anche un’altra linea cellulare, le CrFk. In questo caso poiché l’Env fornito dal vettore derivava da un ceppo linfotropico, quindi non in grado di infettare le CrFk, abbiamo fornito un Env appropriato mediante trasfezione di un terzo plasmide. Per questi esperimenti sono stati utilizzati due
diversi Env, uno fornito dal plasmide pcDNA3-L Env-CTE, che contiene l’Env del
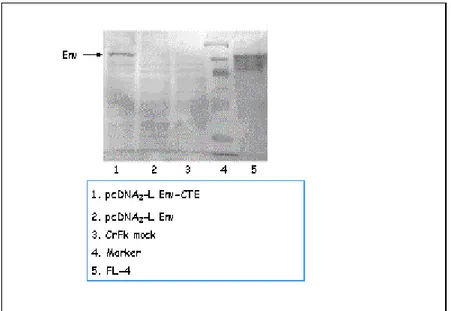
p34TF10 ed il CTE, l’altro che esprime la proteina G del virus della stomatite vescicolare (VSV-G). Per appurare l’effettiva espressione di Env da parte del plasmide pcDNA3-L Env-CTE, è stato preliminarmente effettuato un Western Blot su
cellule trasfettate, utilizzando come sistema di rivelazione un anticorpo monoclonale α-FIV Env. Per questa prova sono state impiegate le cellule trasfettate sia col costrutto pcDNA3-L Env-CTE, che cellule a cui è stato invece fornito il plasmide
pcDNA3-L Env senza CTE (Figura 4.6).
Figura 4.6: Western blot su CrFk trasfettate con la diversa combinazione di plasmidi pcDNA3-L Env-CTE/pcDNA3-L Env. Sono presenti cellule FL-4 cronicamente FIV infette come controllo positivo e CrFk mock trasfettate come
controllo negativo.
La trasfezione e la successiva trasduzione è stata effettuata sulle CrFk testando in parallelo le combinazioni p∆env2/vCMV-GFP e p∆env2/vCMV-GFP con pcDNA3-L Env-CTE o con il plasmide VSV-G. Mentre la combinazione del packaging
col solo vettore ha prodotto dei livelli di trasduzione basali, la somministrazione di Env in trans ha invece permesso di raggiungere una percentuale di cellule GFP positive maggiore, superiore al 12% con l’uso di Env di FIV, del 20% utilizzando il
VSV-G (Figura 4.7). Questi risultati ci fanno ragionevolmente supporre che la produzione di Env sul costrutto sia una condizione limitante l’efficienza di trasduzione.
Figura 4.7: Risultati trasduzione sulle CrFk con le diverse combinazioni di packaging e vettore ed Env fornito in trans.
4.5: Produzione e caratterizzazione di un vettore con LTR ibrida
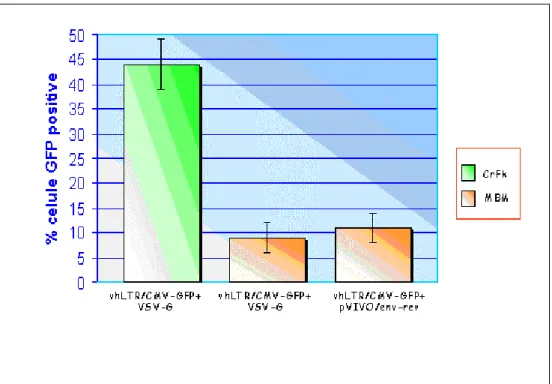
Il costrutto vCMV/GFP contiene entrambe le LTR di FIV. L’LTR al 5’ guida l’espressione sia del trascritto full length che del gene env, ma possiede una bassa efficienza trascrizionale che rende l’espressione di entrambi limitante. In base ai dati ottenuti nei precedenti esperimenti dove, fornendo Env in trans, si è assistito ad un miglioramento dell’efficienza di trasduzione, abbiamo pensato di aumentare i livelli del trascritto vettore incorporati nelle particelle virali e di migliorare l’espressionedi Env, attraverso la produzione di un vettore con LTR al 5’ ibrida. A partire dal vCMV/GFP è stato prodotto un costrutto in cui la regione U3 dell’LTR al 5’ è stata sostituita dal pCMV (vhLTR/GFP, Figura 3.3) ed è stato testato su CrFk ed MBM per valutarne l’efficienza di trasduzione.
Il vettore è stato prodotto sulle CrFk mediante cotrasfezione con il p∆env2, in combinazione con il VSV-G o con il costrutto pVIVO/env-rev, che esprime l’Env del clone linfotropico p34TF10(KKS). La combinazione comprendente il VSV-G è stata testata per efficienza di trasduzione sia su CrFk che MBM, mentre l’altra con il pVIVO/env-rev è stata utilizzata solo per trasdurre le MBM. A 5 giorni dalla trasduzione l’analisi al FACS ha mostrato un effettivo aumento della positività per GFP con il nuovo vettore: le CrFk trasdotte con il vettore ibrido hanno raggiunto valori di fluorescenza in media del 44%, rispetto al 20 % ottenuto con la versione precedente (Figura 4.8). Sulle MBM la combinazione col VSV-G e quella con il pVIVO/env-rev ha dato risultati invece sostanzialmente simili a quelli ottenuti con il costrutto vCMV-GFP (Figura 4.8).
Figura 4.8: Risultati della trasduzione con vhLTR/CMV-GFP in combinazione con VSV-G o pVIVO/env-rev, su MBM e CrFk.
Per valutare l’espressione di Env da parte di questo costrutto è stato effettuato un Western Blot sulle cellule trasdotte, utilizzando un anticorpo monoclonale contro Env. I risultati non hanno però evidenziato una produzione adeguata della proteina (dati non mostrati).
4.6 Produzione del costrutto vhLTR/PGK
Per incrementare l’espressione di Env abbiamo prodotto un’ulteriore versione del vettore contenente un promotore interno, pPGK, a monte del gene. Per inserire il promotore interno sono stati deletati i geni accessori vif ed ORF-A, riducendo quindi allo stesso tempo le sequenze virus-specifiche. Il costrutto finale, vhLTR/PGK (Figura 3.3), è stato accuratamente controllato mediante digestione e sequenziamento.
Il vettore è stato prodotto sulla linea di fibroblasti renali embrionali umani 293T, la linea cellulare maggiormente utilizzata per la produzione dei vettori lentivirali in generale. E’ stata effettuata una cotrasfezione del vettore con il p∆env2 in combinazione al VSV-G. Le cellule trasfettate con questa combinazione e con la combinazione comprendente il pVIVO/env-rev, sono state utilizzate per effettuare un Western Blot con il fine di valutare l’espressione di Env da parte del vettore. Per escludere un’eventuale interazione tra l’anticorpo anti-Env ed il VSV-G, sono state utilizzate come controllo negativo le 293T che hanno ricevuto il solo plasmide veicolante VSV-G. La reazione di rivelazione dell’anticorpo legato, che permette di visualizzare l’effettiva espressione di Env da parte di vhLTR/PGK, è più marcata in presenza del costrutto pVIVO/env-rev (Figura 4.9).
Figura 4.9: Espressione di Env su 293T trasfettate con vhLTR/PGK in combinazione con pVIVO/Env-rev (lane 3) e VSV-G (lane 4).
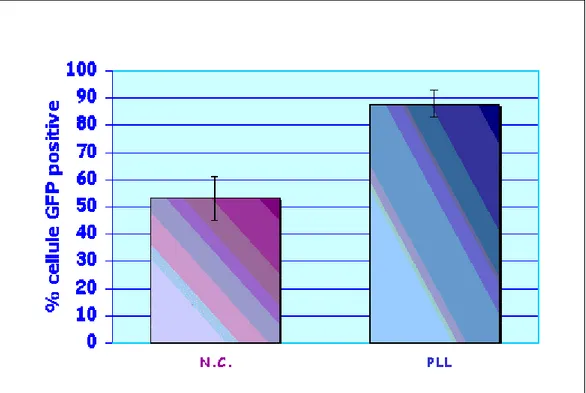
Per ottenere un’efficienza di trasduzione maggiore abbiamo deciso di concentrare le particelle virali prodotte dalle cellule trasfettate attraverso l’uso della poli-L-lisina (PLL) e dell’ultracentrifugazione, secondo i protocolli descritti nella sezione Materiali e Metodi.
A 3 giorni dalla trasduzione l’analisi al FACS ha mostrato per le CrFk trasdotte col surnatante non concentrato proveniente dalle 293T una media del 50% di cellule GFP positive, mentre per quelle che hanno ricevuto il surnatante trattato con PLL i valori di fluorescenza relativa sono saliti oltre l’87%. (Figura 4.10, 4.11)
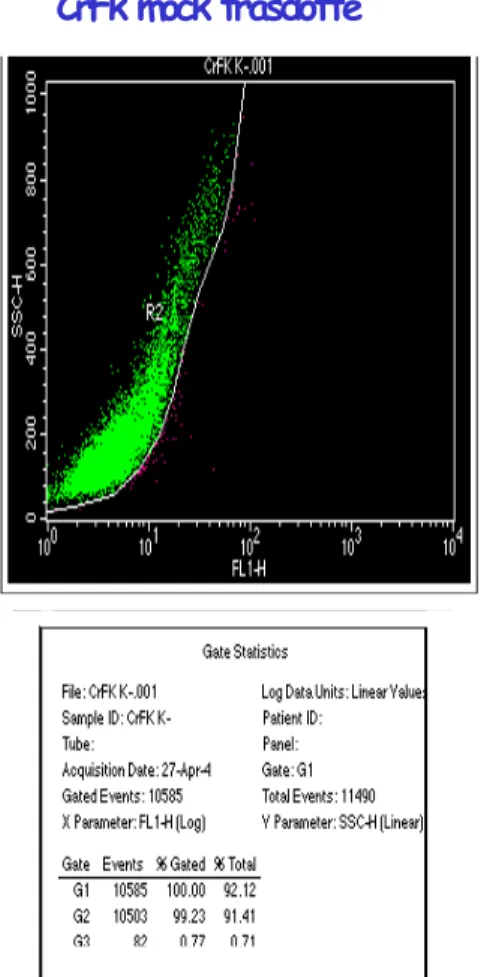
CrFk mock trasdotte
CrFk trasdotte: concentrazione con PLL
Figura 4.10: Analisi al FACS delle CrFk a 5 giorni dalla trasduzione. A sinistra è rappresentato il controllo negativo, CrFk mock trasdotte, a destra le cellule trasdotte con
Figura 4.11: Confronto dell’efficienza di trasduzione del surnatante non concentrato (NC) e concentrato con poli-lisina (PLL)
Sulle cellule trasdotte è stata valutata, mediante Western Blot, l’espressione di Env. Sono state utilizzate sia le cellule che hanno ricevuto il surnatante non concentrato che quelle inoculate con il surnatante concentrato con PLL, a 5 giorni dalla trasduzione. Anche in questo caso abbiamo potuto attestare che la produzione di Env da parte di questo costrutto vettore è adeguata, ed è maggiore, come logico attendersi, nelle cellule che sono state incubate col vettore concentrato (Figura 4.12).
Figura 4.12: Espressione di Env su CrFk trasdotte (5 giorni dalla trasduzione)
4.7 Comparazione dei sistemi di concentrazione del vettore ed
analisi della durata di espressione del transgene
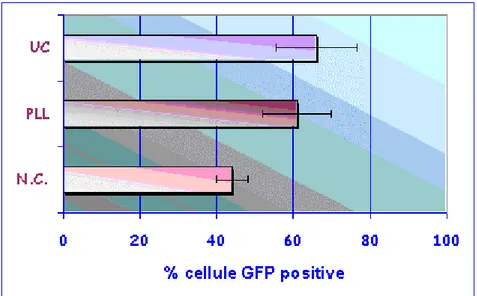
Nelle successive prove è stata testata la concentrazione del vettore mediante ultracentrifugazione(UC), testata in parallelo con il surnatante trattato con PLL e quello non concentrato. A 5 giorni dalla trasduzione i livelli di fluorescenza relativa monitorati al FACS sono risultati leggermente inferiori a quelli precedentemente ottenuti: per entrambi i protocolli di concentrazione i valori medi si sono assestati intorno al 60-65% di cellule GFP positive (Figura 4.13, 4.14).
Figura 4.13: Confronto dell’efficienza di trasduzione del surnatante concentrato con PLL, UC, non concentrato (NC).
Vettore concentrato con PLL
Vettore concentrato con U.C
CrFk mock trasdotte
Figura 4.14: Analisi al FACS delle CrFk a 5 giorni dalla trasduzione. Confronto dell’efficienza di traduzione del surnatante concentrato con poli-L-lisina (PLL) e concentrato mediante ultracentrifugazione (UC). A destra è
Per escludere l’ipotesi che la fluorescenza misurata fosse il risultato di una pseudotrasduzione, dovuta ad un trasporto passivo di GFP dalle cellule trasfettate, le cellule trasdotte sono state propagate per 30 giorni ed è stata periodicamente monitorata la percentuale di fluorescenza relativa al FACS. I risultati, mostrati nella figura 4.15, permettono di affermare che si tratta di una trasduzione stabile e l’espressione del transgene è a lungo termine.
Figura 4.15: Andamento della percentuale di fluorescenza a vari tempi dalla trasduzione.