1.1 LA TALIDOMIDE
1.1.1 Storia della talidomideLa talidomide (figura 1) fù sintetizzata per la prima volta da Kunz [1], chimico della ditta Grunenthal di Stolberg, nell’allora Germania Occidentale, partendo dal derivato dell'acido glutammico α-ftaloilisoglutamina, nel 1954.
N O O N O O
Figura 1. Struttura della talidomide.
A partire dal 1957 venne commercializzata come sedativo “sicuro” sia poiché risulta essere un analogo dei barbiturici, allora ampiamente usati, sia per la minore tossicità rispetto ad essi nell’indurre depressione respiratoria in seguito a iperdosaggio [2]. Nel 1960, grazie ad un intensa ed efficace campagna pubblicitaria, la distribuzione del farmaco ha interessato l’Europa, il Regno Unito, il Canada e l'Australia sotto i nomi di Contergan, Distaval, Talimol e Kevadon. La talidomide inoltre risultò essere un antiemetico efficace, e per questo fu ampiamente utilizzato nel trattamento dell’emesi mattutina del primo trimestre di gravidanza, tale da avere una diffusione eccezionale, infatti tra l’Ottobre del ’57 ed il Novembre del 1962, circa 5 milioni di pazienti assunsero oltre 300 milioni di dosi (100mg) al giorno di Talidomide.
All’inizio del 1961 furono segnalati i primi casi di tossicità principalmente con parestesie delle estremità tipo neuropatia periferica; nel Novembre dello stesso anno il Pediatra Wildukind Lenz espresse per la prima volta il sospetto che la Talidomide fosse responsabile dell’improvviso aumento di malformazioni neonatali registrate in quel periodo [3] e lavorando separatamente anche Mc Bride collegò il consumo di questo farmaco con la nascita dei bambini focomelici [4]. Tali studi evidenziarono che bambini focomelici vennero alla luce anche quando in gravidanza era stata assunta una singola pillola, per cui nel 1962 venne ritirato
dal commercio allorché ne furono dimostrate le proprietà teratogeniche ed in particolare [5-7].
Le stime effettuate nel 1962, quando il farmaco fu ritirato dal commercio, indicarono la nascita di circa 5000–12000 bambini deformi (e un numero imprecisato di aborti spontanei) nei 46 paesi in cui si faceva uso del farmaco [8]. Questi non comprendevano gli Stati Uniti, grazie alla straordinaria diligenza della dr.ssa Frances O. Kelsey, un funzionario della Food and Drug Administration, che indagando sulle possibili complicanze di natura neuropatica dell’uso cronico del farmaco [9], ritardò l’approvazione locale della talidomide.
Molti anni dopo venne alla luce che tutte le specie di mammiferi su cui era stata condotta la sperimentazione per verificare eventuali effetti malformativi dei farmaci non sono sensibili alla talidomide per cui i test sulla teratogenicità risultarono negativi e ne fu autorizzato l’uso alle donne in gravidanza. Successivamente, furono fatti molti studi e si scoprì che i feti di coniglio hanno la stessa vulnerabilità umana [10], e da allora il coniglio figura tra gli animali su cui si testano i possibili effetti malformativi per l’autorizzazione alla messa in commercio di un nuovo farmaco.
In realtà l’uso della talidomide non è mai del tutto cessato anche negli anni immediatamente successivi al suo ritiro formale: le prime segnalazioni ufficiali di un suo nuovo impiego terapeutico riguardano le ricerche condotte nel 1965 da Jacob Sheskin, un medico israeliano, che ne rilevò l’utilità per i suoi effetti benefici contro il dolore e l’insonnia riscontrati in un soggetto gravemente affetto da ENL [11], sino ad arrivare agli anni 90, quando il farmaco viene impiegato negli Stati Uniti per il trattamento di alcune complicanze ulcerative del cavo orale nei pazienti HIV positivi. Quest’ultimo impiego ha, di fatto, avviato il processo che ha portato nel 1998 l’FDA ad autorizzare l’impiego della talidomide (Thalomid), assegnandone la licenza per la distribuzione alla ditta Celgene, introducendo, contestualmente, l’obbligo di un sistema di Risk Management denominato “S.T.E.P.S.” (System for Thalidomide Education and Prescribing Safety) per i medici prescrittori, i farmacisti che dispensano il farmaco ed i pazienti in trattamento.
Ad oggi risultano trattati con Thalomid negli Stati Uniti oltre 100.000 pazienti e, grazie all’adozione dello “S.T.E.P.S.” sui pazienti in trattamento e relativi partners, non si è mai verificato alcun “contatto” tra una donna potenzialmente fertile e la talidomide in assenza delle più opportune misure di prevenzione della gravidanza, sensibilizzazione al rischio potenziale ed “educational”.
Il farmaco ha potuto così essere utilizzato e sperimentato anche nel trattamento di numerose forme di neoplasie, siano esse tumori solidi o di natura ematologica: in particolare, lo studio si è concentrato nel trattamento dei pazienti con diagnosi di mieloma multiplo sia in monoterapia [12-14] che in combinazione con desametasone [14, 15] o con altri chemioterapici [16-18]. Oggi le “linee guida” pubblicate sul “British Journal of Haematology” raccomandano definitivamente la talidomide nella terapia del mieloma multiplo recidivante e/o refrattario [19]. La talidomide ha manifestato significativi effetti collaterali (in particolare eventi tromboembolici e neuropatia periferica), ma è risultata, in generale, ben tollerata nella maggior parte dei pazienti [19].
Il potenziale teratogeno rimane, tuttavia, il più pericoloso “evento avverso” ed ogni sforzo deve essere comunque assicurato affinché il paziente sia pienamente consapevole di tale possibilità e la terapia non sia intrapresa in donne a rischio di gravidanza. In particolare per queste ultime, le linee guida pubblicate sul “British Journal of Haematology” prescrivono la necessità di ricorrere simultaneamente ad almeno due metodi di contraccezione oltre che a regolari test di gravidanza [19]. Da sottolineare inoltre, che, poiché la dose teratogena del farmaco non è mai stata determinata in modo definitivo, l’impiego di metodi di contraccezione di barriera deve essere adottato anche da pazienti di sesso maschile in trattamento con talidomide qualora la partner sia in età fertile, data la possibilità di determinare il farmaco nel liquido spermatico [20].
Purtroppo, la continua pericolosità del farmaco è ancora oggi evidenziata da recenti pubblicazioni relative alla segnalazione di nascite di “focomelici di seconda generazione” in Paesi (quali il Brasile) ove la talidomide è distribuita ancora senza le opportune misure di controllo [21].
1.1.2 Chimica della talidomide
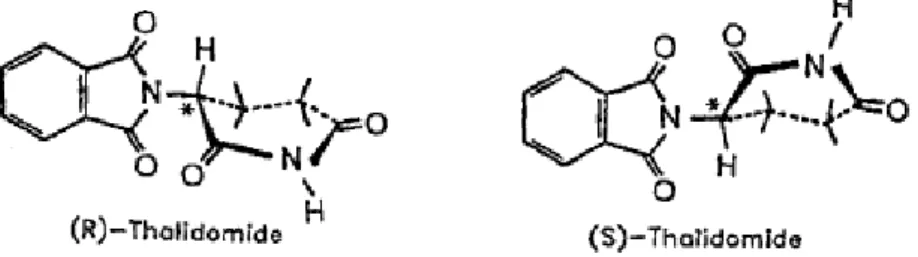
La Talidomide è un derivato dell’acido glutammico in cui la porzione glutarimidica contiene un singolo centro asimmetrico e pertanto, può esistere in due forme otticamente attive designate S-(-) e R-(+) (figura 2). Per quanto riguarda le proprietà farmacologiche l’isomero R è responsabile delle proprietà sedativo ipnotiche, mentre quello S delle proprietà immunomodulatorie ed è convertito, per idrolisi enzimatica in acido ftaloilglutamico, noto teratogeno.
Figura 2. Strutture dei sue enantiomeri
La solubilità in acqua del racemo risulta essere di circa 50 µg/ml, cinque volte maggiore di quella dei singoli enantiomeri [22-24]. La talidomide viene degradata velocemente tramite idrolisi spontanea nei mezzi acquosi a pH fisiologico [25-30]. Ogni legame ammidico sostituito è sensibile all’idrolisi ed è pH dipendente: a pH 7.4 si formano dodici prodotti di idrolisi in seguito alla rottura di tutti i legami, a pH 6-7 la rottura avviene soltanto a livello dell’anello ftalimmidico mentre solo a pH alcalino la glutarimmide subisce l'idrolisi [25]. Il tasso di inversione e di idrolisi degli enantiomeri aumenta nell'intervallo di pH tra 7.0-7.5 [31], ed è due volte maggiore nel sangue rispetto al plasma [27].
1.2 FARMACOCINETICA
1.2.1 Assorbimento orale9 Assorbimento orale del racemo
I parametri farmacocinetici riguardo all’assorbimento delle dosi orali di talidomide sono stati determinati in volontari sani [28,32-38], in pazienti affetti da
GVHD dopo aver subito un trapianto di midollo osseo [39], in pazienti con HIV [40, 41], in pazienti anziani con il cancro della prostata [42], in pazienti con lebbra [38], in pazienti con glioma [43], in pazienti con mieloma multiplo [44] e in pazienti con epatocarcinoma [45].
I risultati ottenuti da studi differenti sull’assorbimento orale di una bassa dose (in genere 100 mg) di talidomide somministrata a volontari sani danno risultati costanti. L'assorbimento è normalmente lento, con tempo di concentrazione massima nel plasma (tmax) a 2-4 h e di concentrazione massima del farmaco nel plasma (Cmax) intorno a 1 µg/ml. Con dosi maggiori, la scarsa solubilità della talidomide nei liquidi intestinali può far diminuire il tasso di assorbimento [38], pertanto esso risulta dose-dipendente. La somministrazione di talidomide in concomitanza con un pasto ad alta percentuale di grassi causa inoltre una diminuzione del 10 % della AUC e di Cmax, e un aumento del tmax a circa 6 h [37]. Nei pazienti affetti da GVHD è stata riscontrata una grande variazione interindividuale delle concentrazioni plasmatiche dopo somministrazione orale [39]. Due dei quattro pazienti affetti da HIV hanno mostrato differenze, dovute ad un lento tasso di assorbimento, rispetto a soggetti sani. Lo stesso modello è stato descritto in tre dei cinque pazienti affetti da GVHD e da sindrome cronica di malassorbimento [28]. Dieci ore dopo la somministrazione di una dose orale di 400 mg le concentrazioni della talidomide nel plasma variava tra 0.7 e 0.8 µg/ml. Le concentrazioni plasmatiche dei due pazienti con funzione gastrointestinale normale sono risultate essere 5.0 e 6.0 µg/ml. Contrariamente, nei pazienti affetti da lebbra è stato riscontrato un aumento nell’assorbimento rispetto agli individui sani [38]. Nei pazienti affetti da mieloma multiplo [44] la concentrazione massima di talidomide nel plasma, dopo la prima somministrazione di una dose orale di 200 mg, rilevata a 4,5±1 h risultava essere di 1,34±0,49 µg/ml. Non comparabile con gli altri risultati è lo studio effettuato su pazienti affetti da epatocarcinoma [45], in quanto effettuato dopo la quinta somministrazione (48-60 h dopo la prima dose) di una dose di 200 mg; i parametri ottenuti mostrano un tmax di 4,33±0,95 h, una Cmax di 2,24±0,44 µg/ml ed una AUC di 20,4±2,29 mg/lh.
Tutti questi studi sono stati condotti su un esiguo numero di soggetti ed alcuni dei risultati potrebbero essere falsati da problemi dovuti alla metodica. Tuttavia, tali
dati suggeriscono che in alcuni pazienti la talidomide può avere una minor biodisponibilità dovuta ad un malassorbimento generale, ad un assorbimento non lineare a dosi elevate e/o altri motivi.
9 Assorbimento orale dei singoli enantiomeri
In uno studio effettuato da Eriksson e colleghi, su sei volontari sani, viene messo a confronto l’assorbimento orale dei singoli enantiomeri e del racemo. Le dosi testate, 1.0 mg/kg di (R) o (S) talidomide e 1.5 mg/kg di racemo, sono somministrate sottoforma di capsule. L’assorbimento è risultato più veloce quando i due enantiomeri sono stati somministrati singolarmente rispetto al racemo. Ciò è probabilmente dovuto ad una dissoluzione più veloce degli enantiomeri in acqua. I valori dell’AUC ottenuti con questo studio sono poi stati confrontati con quelli ottenuti in uno studio simile in cui i due enantiomeri sono stati somministrati separatamente sottoforma di infusione endovenosa [24]. Da questo confronto è emerso che la biodisponibilità orale degli enanziomeri è alta, probabilmente intorno al 100 e 80% per (R) e (S)-talidomide, rispettivamente.
1.2.2 Metabolismo
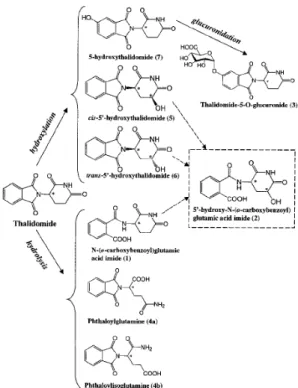
Il metabolismo della talidomide non è ancora del tutto chiaro, una sua ipotesi è stata determinata in uno studio effettuato su topi sani e in 6 pazienti affetti da mieloma multiplo [46]. I risultati ottenuti nei topi confermano la formazione di tre prodotti di idrolisi: acido N-(o-carbossibenzoil) glutammico ammidico, ftaloilisoglutammina e ftaloilglutammina; e tre prodotti di idrossilazione: 5-idrossi talidomide e cis- e trans-5’-idrossitalidomide. Inoltre, è stata evidenziata la formazione della talidomide-5-O-glucoronide a partire dalla 5-idrossitalidomide (fig. 3).
Nelle urine umane invece i profili UV hanno rilevato la presenza dei soli prodotti di idrolisi, in contrasto con studi precedenti in cui erano state ritrovate quantità esigue di 5- e 5’-idrossi talidomide [47-49] prodotte dall’attività del CYP2C19 contenuto nei microsomi epatici. Tale differenza può essere spiegata dall’ipotesi che tali metaboliti siano prodotti nel plasma e non compaiono nelle urine.
Comunque, in pazienti con la malattia di Hansen a cui è stata somministrata una dose orale di 400 mg, non sono stati rilevati metaboliti nel plasma, e i metaboliti idrossilati in posizione 5 ritrovati nelle urine sono al disotto dei limiti di quantificazione [37]. Comunque,
in uno studio effettuato su volontari maschi sani la concentrazione della 5’-idrossi talidomide è meno dello 0,1% della talidomide, mentre sia la 5 che la 5’-idrossi talidomide si sono formate in vitro in presenza della frazione epatica S9 [48]. Inoltre, l’esigua quantità dei prodotti di idrossilazione nei pazienti affetti da mieloma multiplo probabilmente deriva dalla soppressione di questa via metabolica in conseguenza alla malattia visto che in uno studio che coinvolge 16 soggetti con cancro in uno stadio avanzato è mostrata una riduzione dell’attività metabolica dei CYP2C19 rispetto a volontari sani [50].
Figura 3. probabili vie di biotrasformazione della talidomide nel topo. Le fasi o i metabolici non confermati sono mostrati con la linea tratteggiata.
1.2.3 Distribuzione ed eliminazione
9 Distribuzione ed eliminazione del racemo
I parametri farmacocinetici di distribuzione ed eliminazione sono rilevabili da diverse studi [34-38, 40-43]. Nella maggior parte di essi la talidomide mostra un volume di distribuzione di 1 l/Kg di peso corporeo. La talidomide in vivo è eliminata quasi esclusivamente tramite idrolisi enzimatica spontanea, mentre il metabolismo epatico (attraverso il citocromo P450) e l’eliminazione renale giocano ruoli meno importanti sia negli animali [51-55] che nell’uomo [34, 52, 58]. Gli esperimenti sugli animali mostrano che l’idrolisi ha luogo nel plasma e in tutti i tessuti esaminati [53-55]. Dalle ricerche in vivo è stato anche dimostrato che l’idrolisi avviene nell’intero compartimanto in cui il farmaco è distribuito [31]. Si
distribuisce estesamente nei tessuti e nei liquidi corporei ed è presente anche nello sperma. Non si sa se è presente nel latte materno. La quantità di talidomide escreta attraverso la via renale come farmaco immodificato è risulta essere dell’1, 2.2, e 1.8% rispettivamente in uomo, ratti e cani [52], tali quantità non sono più rilevabili dopo 48 ore dalla somministrazione di una singola dose. Il tempo di emivita si aggira intorno alle 5-7 ore [35-37, 41, 44], in accordo con quelli ottenuti con tre differenti dosaggi (50, 200 e 400 mg) riportato dalla monografia del Thalomid [38].
In uno studio che prevede la somministrazione di 200 mg di talidomide per 21 giorni a dieci donne sane i profili farmacocinetici sono risultati simili dal primo all’ultimo giorno, ciò indica che la talidomide non induce o inibisce il suo metabolismo [35]
9 Distribuzione ed eliminazione degli enantiomeri
È stato riscontrato che gli enantiomeri della talidomide non sono particolarmente legati ai componenti del sangue e del plasma [31]. La frazione legata alle proteine risulta del 55 e del 66% rispettivamente per (R) e (S) talidomide.
I parametri farmacocinetici di distribuzione ed eliminazione deli enantiomeri della talidomide sono forniti da due studi sull’uomo [24, 56]. L’enantiomero (R) predomina in uno pseudoequilibrio (R/S 1,7). Inoltre esiste un eccellente correlazione tra la somministrazione orale e intravenosa. Questo conferma inequivocabilmente che il tempo di emivita ritrovato dopo somministrazione per via orale rappresenta l’eliminazione e non l’assorbimento della talidomide. Il volume del compartimento centrale e la clearance sono significativamente più alti per l’enantiomero levogiro.
1.3. FARMACODINAMICA
Negli anni ’90, venne scoperto che il farmaco possiede un effetto antiangiogenico [57]. Poiché lo sviluppo degli arti del feto dipende strettamente dalla formazione di nuovi vasi sanguigni, questa scoperta non solo permette di spiegare perché il
farmaco possa indurre focomelia, ma apre anche nuove prospettive terapeutiche per la stessa patologia.
1.3.1. Effetti antiangiogenici
La crescita di un tumore e la diffusione metastatica dipendono dall’angiogenesi [58-60]. Le cellule cancerogene cominciano a promuovere l’angiogenesi già nelle prime fasi della malattia, quando inizia la fase pre-vascolare chiamata “angiogenic switch”. Questa fase prevede [61]:
• l’espressione di proteine pro-angiogeniche, stimolata dagli oncogeni tumorali; • l’attivazione, indotta dalle condizioni ipossiche del tumore, dell’HIF-1a
(Hypoxia-Inducible Factor- 1a) che, a sua volta, promuove la up-regulation di molti fattori angiogenici;
• la down-regulation delle proteine che sopprimono l’angiogenesi (es. trombospondina).
Gli inibitori dell’angiogenesi vengono divisi in:
• diretti: molecole (es. endostatina, trombospondina, angiostatina, etc.) che legandosi direttamente alle cellule endoteliali reclutate dal tumore, impediscono loro di rispondere ai vari stimoli mitogeni;
• indiretti: molecole (es. VEGF receptor, PDGF receptor, etc.), che prevengono l’espressione, o bloccano l’attività di una proteina tumorale (es. FGF-2, VEGF) che attiva l’angiogenesi.
Tra le molecole angiogeniche il VEGF sembra avere un ruolo centrale nel processo angiogenico normale e patologico. Ipossia, oncogeni, citochine, fattori di crescita ed ormoni sono stimoli importanti che possono incrementare la produzione di VEGF [62, 63]. Una volta formatosi il VEGF, agendo sui suoi recettori presenti sulle cellule endoteliali, stimola la proliferazione e la chemiotassi delle cellule endoteliali [64] con formazione di nuovi vasi sanguigni, che differiscono da quelli normali perché più tortuosi e fragili [65, 66]; assicura anche la pervietà degli stessi; contribuisce alla regolazione di altre molecole coinvolte nella proliferazione endoteliale.
Gupta e colleghi [67] hanno osservato che nel midollo osseo, a seguito dell’interazione tra cellule mielomatose e cellule dello stroma midollare, aumenta la secrezione del VEGF. Elevati livelli di VEGF tumorale si correlano con la densità vascolare della neoplasia, con un’aumentata probabilità di recidiva e con una peggiore prognosi quoad vitam [64]. Nel mieloma multiplo (MM), vi è un aumento significativo dei livelli di VEGF [67-71].
1.3.2. Altre azioni
La talidomide riduce l’espressione di VEGF e di altri potenti fattori angiogenici [67, 72-75] inoltre la sua attività antitumorale e dei suoi analoghi si concretizza, in particolare in diversi siti del midollo osseo [68, 71], anche attraverso altri meccanismi quali:
a) Azioni immunomodulatrici
o Inibendo l’espressione di IL-6 e TNF-a da parte delle cellule stromali del midollo osseo, con conseguente blocco della crescita delle cellule cancerose;
o Stimolando le cellule T. Infatti la talidomide agendo come costimolatore, aumenta la risposta di tali cellule determinando un incremento della proliferazione ed una maggiore produzione di IL-2, IL-10 ed IFN-g [76-78], fattori anti-infiammatori;
o Aumentando il numero delle cellule NK, che svolgono attività citotossica nei confronti delle cellule tumorali [69].
b) Downregulation delle molecole di adesione
Le molecole di adesione facilitano l’aderenza delle cellule tumorali all’endotelio e sono necessarie per lo sviluppo delle metastasi. È stato dimostrato che la talidomide determina una riduzione del contatto tra cellule leucemiche umane di tipo T e cellule endoteliali umane della vena ombelicale [79].
c) Apoptosi
La talidomide è capace di innescare il processo apoptotico delle cellule tumorali [71]. La combinazione di queste azioni si traduce in una significativa risposta antitumorale osservata in diversi pazienti con MM e che continua ad essere studiata in numerosi trial sia per il trattamento di altre neoplasie ematologiche che di tumori solidi [80].
1.4. IMPIEGHI CLINICI
1.4.1. La talidomide nel mieloma multiplo
Le prime evidenze sull’efficacia della talidomide nel mieloma multiplo derivano dallo studio di fase II di Singhal e collaboratori in 84 pazienti, refrattari alla chemioterapia convenzionale [81]. Alla dose di 200-800 mg/die, la talidomide ha indotto una risposta nel 32% dei pazienti, incluse 2 remissioni complete (CR). Gli effetti collaterali riscontrati sono stati lievi o moderati e includono stipsi, neuropatia periferica, astenia e sonnolenza. Dopo un follow-up mediano di un anno, la sopravvivenza libera da evento (EFS) era il 22% e la sopravvivenza globale (OS) il 58%, mentre il 44% dei pazienti è recidivato dopo circa 12 mesi di terapia.
Molti studi successivi hanno utilizzato talidomide da sola o in combinazione in pazienti in recidiva o refrattari [81-87]. L’introduzione dell’associazione talidomide e desametasone (TD) rappresenta un nuovo schema terapeutico particolarmente diffuso negli USA, ed ha indotto circa il 50% di risposte parziali in pazienti affetti da MM recidivato o refrattario con un tempo mediano di risposta di circa 1-3 mesi [88-90]. I principali effetti collaterali sono legati all’assunzione di talidomide che induce un discreto numero di neuropatie dipendenti dalla dose e dalla durata del trattamento. Nonostante non ci siano differenze in termini di risposte e di EFS rispetto alla chemioterapia convenzionale, i pazienti trattati con TD, sorprendentemente, vivono più a lungo rispetto a quelli trattati con chemioterapia convenzionale. Il meccanismo di tale vantaggio non è chiaro, l’unica spiegazione è che l’associazione TD, posticipando la chemioterapia
classica, ritarda anche la tossicità ad essa correlata che è la principale causa di morte.
Non possedendo virtualmente effetto mielosoppressivo, la talidomide è stata facilmente associata a chemioterapici, in particolare: melphalan, ciclofosfamide, etoposide, cisplatino e doxorubicina [17, 90-92]. Tuttavia non è ancora chiaro se questo tipo di associazione rappresenti un reale vantaggio rispetto all’associazione TD.
L’associazione TD induce risposta parziale in circa il 60% dei casi e circa il 10% di remissioni complete [69, 71, 93], tali percentuali aumentano con l’associazione della talidomide ai chemioterapici. In particolare, le associazioni Melphalan-Prednisone-Talidomide (MPT), Talidomide-Adriamicina-Desametasone (TAD), Talidomide-Epirubicina-Desametasone (T-VED) hanno evidenziato una probabilità di risposta parziale intorno all’80% e un’incidenza di risposte complete intorno al 10-30% [17, 94-96]. Tuttavia queste associazioni hanno anche evidenziato l’insorgenza di nuove tossicità, in particolare un’importante incidenza di trombosi venose profonde che richiede profilassi eparinica e che, per motivi ancora non chiari, risulta essere più frequente nei pazienti alla diagnosi rispetto a quelli in recidiva.
La dose ottimale di talidomide rimane da determinare., anche se la maggioranza degli studi che utilizzano la talidomide come singolo agente usano dosi variabili da 100 mg a 800 mg. Sembra esserci una relazione dose-risposta, ma dosi maggiori aumentano in modo propozionale la tossicità [82-87].
Concludendo, per i pazienti affetti da MM la probabilità di una vera guarigione, intesa come completa eradicazione della malattia, rimane scarsa. Tuttavia numerosi studi stanno valutando associazioni della talidomide a varie chemioterapie ed i risultati preliminari risultano essere promettenti. A breve i risultati di tali studi cambieranno le prospettive terapeutiche dei pazienti con Mieloma Multiplo.
1.4.2 La talidomide nel trattamento dell’Eritema Nodoso Leproso (ENL) Le evidenze di efficacia clinica della talidomide nel controllo della sintomatologia dell’Eritema Nodoso Leproso sono risultate talmente convincenti
che la Food and Drug Administration (FDA) ne ha ufficialmente approvato l’uso in tale indicazione nel 1998, inoltre la talidomide è considerata il farmaco di scelta per tale condizione dalla Organizzazione Mondiale della Sanità (WHO, 1998) [97].
Secondo i dati della Società Italiana di Hanseniologia (SIHAN), il numero dei nuovi casi di lebbra in Italia è stato di 102 nel decennio 1970-79, di 76 nel decennio 1980-89, di 112 nel decennio 1990-99, mentre nel periodo 2000-2003 sono stati identificati 35 nuovi casi [98].
La lebbra, o malattia di Hansen, è sostenuta da Mycobacterium leprae, un bacillo acido-resistente (BAR) diffuso ubiquitariamente nel mondo che si trasmette per via respiratoria (il bacillo è presente nel muco nasale) o tramite soluzioni di continuo cutanee (il bacillo è anche presente nelle lesioni cutanee ulcerate). La contagiosità è molto bassa e solitamente la trasmissione ad un soggetto indenne richiede il contatto stretto e prolungato. Il target principale della infezione leprosa è rappresentato dalla cute e dalle cellule di Schwann dei tronchi nervosi periferici, nel cui contesto i micobatteri crescono con estrema lentezza. Il periodo di incubazione della lebbra è protratto ma estremamente variabile, potendo variare da 6 mesi a molte decadi con una media di 3-5 anni. La risposta immunitaria cellulo-mediata dell’ospite gioca un ruolo essenziale nello sviluppo della sintomatologia clinica, che si posiziona tra due situazioni polari opposte di iperergia (forma Tubercoloide TT, caratterizzata da elevata reattività nei confronti del micobattere) o di anergia (forma Lepromatosa LL).
Le alterazioni sensitive indotte dall’infezione leprosa causano ipoestesia ed anestesia con depigmentazioni cutanee e insensibilità agli stimoli dolorosi che portano talora ad ampie mutilazioni.
Le lesioni cutanee possono essere di varia natura (macule, papule, noduli, infiltrati) ed il loro numero e la loro diffusione è naturalmente maggiore nelle forme lepromatose anergiche rispetto alle forme tubercoloidi iperergiche. Non rara è la depigmentazione cutanea che, su pelle scura, assume un caratteristico riflesso ramato.
L’interessamento nervoso periferico è costante, a carico sia della componente sensitiva che di quella motoria. Ai fenomeni dolorosi si associano aree di
ipo-anestesia e/o paralisi. I tronchi nervosi colpiti sono spesso ingrossati e palpabili anche superficialmente con una caratteristica sensazione di “corona di rosario”. Nel corso della storia naturale della infezione leprosa possono manifestarsi frequentemente fenomeni infiammatori acuti a genesi immunitaria, definiti “leproreazioni”. L’Eritema Nodoso Leproso (ENL) interessa circa il 20% dei pazienti lebbrosi in trattamento polichemioterapico, in circa metà dei quali l’ENL recidiva dopo interruzione del trattamento specifico.
Ad oggi vi è un opinione consolidata ed universalmente condivisa che il trattamento della infezione leprosa debba essere condotto in regime di polichemioterapia utilizzando schemi differenziati in rapporto al tipo di lebbra secondo la classificazione di Ridley-Jopling [99].
La talidomide esplica una rapida azione impiegata al dosaggio di 100-300 mg/die sino a risoluzione dei sintomi (in media circa 2-3 settimane) per poi essere scalata di 50 mg ogni 2-4 settimane [11, 100, 101]. In caso di ENL cronico, possono essere impiegati i minimi dosaggi efficaci per il controllo della sintomatologia. Il trattamento con talidomide previene i danni neuronali permanenti.
Il meccanismo di azione anti-ENL della talidomide si esplica verosimilmente mediante le sue proprietà immunomodulatorie [101].
1.4.3. La talidomide in oncologia
Numerosi studi di fase II indicano un possibile ruolo di questo farmaco in numerose neoplasie, che al momento attuale hanno scarsa prognosi e poche alternative terapeutiche, fra esse troviamo i tumori cerebrali [102], le neoplasie renali [103-107], le neoplasie alla prostata [108-115], il melanoma [116-120], l’epatocarcinoma [121-127], il carcinoma del colon, del pancreas [128], e della mammella [129].
(1) Tumori cerebrali
È noto che le neoplasie gliali siano neoplasie estremamente vascolarizzate con un’iperespressione di VEGF e fattori angiogenici. Questa osservazione ha fornito il razionale per l’utilizzo in vari studi dell’uso della talidomide. Il farmaco è stato studiato con dosi variabili da 100 mg-1200 mg al giorno in studi di fase due in
pazienti recidivati o in progressione affetti da glomi, astrocitomi, glioblastomi multiformi. Il numero dei pazienti arruolati in totale nei tre studi con la talidomide in monochemioterapia era di 96 pazienti e le risposte variavano dal 5-12% con invece un discreto numero di stabilizzazioni di malattia alla prima rivalutazione. Più promettente invece in uno studio di fine, sembra invece l’associazione alla BCNU (200 mg/mq gg1 ogni 6 settimane) e talidomide (800-1200mg/mq) con un tasso di risposta del 24% su 40 pazienti trattati sempre in seconda linea e 1 risposta completa con un tempo alla progressione di oltre 3mesi. Glass ha valutato l’associazione invece nei glomi con il carboplatino documentando un tasso di risposte nell’11% dei pazienti e una sopravvivenza mediana intorno a 40 settimane. La tossicità di questi trattamenti appariva accettabile, nel 30% dei pazienti trattati con BCNU+Thal si avevano trombosi venose profonde, ma nessuno di questi pazienti era stato sottoposto a profilassi antitrombotica.
Al momento attuale non sono state valutate associazioni con altre molecole quali la temozolomide o la fotemusina o altre metodiche. La prognosi di queste neoplasie alla recidiva o alla progressione resta pessima, pertanto lo studio di nuove associazioni con i nuovi farmaci o con le vecchie nitrosuree può rappresentare un’ulteriore possibilità di cura per queste patologie.
(2) Neoplasie renali
L’elevata vascolarizzazione del tumore renale e la sua chemioresistenza sono state il razionale per gli studi su questa neoplasia. Numerosi studi di fase II sono stati condotti in pazienti affetti da neoplasia renale avanzata. Le dosi utilizzate erano da 600-1200 mg e la maggior parte degli studi era fatta in monoterapia. La percentuale di risposte variava dal 5-30%, con numerose stabilizzazioni di malattia durature (17-64%). La tossicità che è stata maggiormente rappresentata è stata la neuropatia periferica.
Attualmente sono in corso studi di associazione tra talidomide IFN alfa e IL-2 i cui risultati non sono ancora noti, in particolare sono attesi i risultati dello studio randomizzato ECOG che paragona IFN con o senza talidomide. Attualmente attesi anche i dati dello studio randomizzato di IL-2 con o senza talidomide.
È stato invece verificato che i pazienti “responders” hanno una riduzione dei livelli di VEGF circolanti.
In conclusione la talidomide da sola appare un farmaco in mono con scarso livello di risposte, ma appaiono promettenti le associazioni con IFN alfa e IL-2. Sono attualmente necessari ulteriori studi per confermare il suo ruolo in associazione a queste molecole.
(3) Neoplasia della prostata
Anche nel tumore della prostata sono state numerose le segnalazioni che correlano l’angiogenesi alla metastatizzazione. La talidomide è stata testata in pazienti con carcinoma della prostata non ormonoresponsivo. Uno studio di fase II ha dimostrato che basse dosi di talidomide possono rappresentare un’alternativa nel paziente con aumento del PSA. Uno studio randomizzato di fase II ha evidenziato che basse dosi di talidomide sono in grado di ridurre il PSA nel 50% dei casi. La segnalazione che un carico tumorale non elevato risponda meglio a molecole con attività angiogenetica ha rappresentato il razionale per valutare studi di associazione con molecole citoriduttive quali il docetaxel, i cui primi risultati appaiono promettenti.
Altri studi randomizzati hanno valutato la capacità della talidomide di impedire l’aumento del PSA in pazienti con cancro della prostata non responsivi alla prima linea ormonale. In questo studio i pazienti ricevevano terapia ormonale intermittente ed erano randomizzati a ricevere nei periodi di intervallo placebo versus talidomide. I risultati di questi studi sono attualmente in corso, ma è possibile un ruolo citostatico di questa molecola in questa patologia. Sono infine necessari studi controllati per valutare un potere aggiuntivo di questo farmaco al docetaxel.
(4) Melanoma
In questa patologia la talidomide ha scarsi risultati in monoterapia, mentre sono interessanti le associazioni di questa molecola alla temozolomide. Hwo in uno studio su 38 pazienti ha riportato una percentuale di risposte in 5/12 pazienti metastatici in linee avanzate; un suo secondo studio di fase due ne confermava
l’attività. Danson in un grosso studio randomizzato su 181 pazienti che comparava temozolamide da sola verso temozolamide con talidomide e temozolamide verso IFN, evidenziava un tasso di risposte intorno al 25% e una sopravvivenza mediana di 7.3 mesi con una sopravvivenza libera ad un anno del 24%; infine il 16% dei pazienti era vivo ad un anno dalla randomizzazione.
Questa associazione appare una delle più promettenti nel trattamento del melanoma metastatico.
(5) Epatocarcinoma
Un’altra patologia su cui sono presenti alcuni studi di fase II è l’epatocarcinoma diffuso e non operabile.
In questa neoplasia si sono osservati tassi di risposta che variano dal 6 al 12% con percentuali più elevate di riduzione dei livelli serici di alfa fetoproteina. Apparentemente le segnalazioni di risposta erano correlate a livelli di dose di talidomide elevati.
Il carcinoma epatocellulare (HCC) è la malattia neoplastica più comune a livello mondiale. L’incidenza annuale globale e la mortalità sono stimate eccedere i 500000 casi. La più alta incidenza di HCC è nell’Africa SubSahariana e nel sud-est Asiatico. Sebbene il carcinoma epatocellulare sia meno frequente in Nord Europa e negli Stati Uniti, l’incidenza negli Stati Uniti ha avuto un incremento negli ultimi anni, generalmente come conseguenza dell’epatite C cronica (HCV) di cui si stimano circa 4 milioni di casi. L’HCC compare molto frequentemente in pazienti con cirrosi dovuta al virus dell’epatite B (HBV) e C (HCV) e in soggetti che abusano a lungo di alcool.
L’HCC fornisce prognosi limitata, molti pazienti si presentano in uno stadio in cui non è possibile effettuare operazioni chirurgiche o trapianti di fegato. Inoltre è frequente la ricomparsa del tumore dopo resezione chirurgica o trapianto; solo nel 30% dei casi non ricompare nei primi cinque anni. In pazienti in cui non è possibile effettuare la resezione del tumore, ma che preservano le funzioni del fegato, è la chemoembolizzazione arteriosa (TACE), una tecnica che mostra una sopravvivenza prolungata. La TACE raramente è curativa e la sopravvivenza dopo 24 mesi è rara. Per pazienti con la malattia avanzata la chemioterapia sistemica
offre benefici marginali e associati con tossicità significativa.L’angiogenesi del tumore presenta un obiettivo convincente dell’HCC, visto che è un neoplasma molto vascolare. Nelle cellule dell’HCC umane e sperimentali le citochine proangiogeniche, come i fattori di crescita endoteliali vascolari (VEGF) e fibroblastici (bFGF), sono sovraespresse. Tale caratteristica è associata con le caratteristiche più aggressive del tumore. L’alta densità dei microvasi è stata associata con il rapido progresso dopo la resezione chirurgica.
In uno studio effettuato da Schwartz e colleghi [130] su 38 pazienti con HCC non operabile, la somministrazione di 200 mg per un anno ha mostrato un tasso di risposta limitato (5%) e un modesto controllo della malattia (18%).
1.5. METODI DI ANALISI PER LA TALIDOMIDE
Visto l’ampio spettro di utilizzo della talidomide esistono in letteratura numerose metodiche per la sua determinazione in matrici quali: siero, plasma, urine di provenienza umana e di alcune specie animali quali topi o conigli, al fine di determinarne la permeabilità e il trasporto [131], la metabolizzazione [44, 46] e la farmacocinetica sia del racemo [44, 46, 132-134], che dei due enantiomeri [135]. L’analisi dalle matrici prevede una prima fase estrattiva, per minimizzare i vari interferenti, ed una successiva fase analitica.
Fra le varie procedure estrattive vi sono estrazioni liquido-liquido [135], estrazioni in fase solida [44, 46, 133, 136] o la semplice precipitazione delle proteine [131, 132, 134].
Tra le principali metodiche, in letteratura è descritta un estrazione in fase solida, messa a punto da Teo e colleghi [136], utilizzata per la determinazione della talidomide nel plasma di pazienti affetti da HIV, attraverso una colonnina Oasis HLB SPE. Gli analiti (talidomide e fenacetina) eluiti dalla colonna con metanolo, vengono evaporati a secco sotto flusso d’azoto, ricostituiti con la fase mobile (acqua/acetonitrile/acido acetico in rapporto 90:10:0,1) e iniettati nel sistema cromatografico fornendo recuperi che variano dal 69 all’ 83 %.
Simmons e colleghi [133] in uno studio farmacocinetico su siero umano, effettuarono un estrazione in fase solida utilizzando delle colonnine Bond Elute della Varian. Il campione, dopo acidificazione con H2SO4 al 10%, viene lavato
con due aliquote di acqua e metanolo, successivamente gli analiti vengono fatti eluire con 1 ml di acetonitrile. L’estratto viene portato a secco a 40°C e ripreso con una soluzione acquosa di acetonitrile al 30%. I recuperi ottenuti con questa metodica sono del 98%.
Lo stesso tipo di colonne è stato utilizzato in due studi condotti nel 2004 [44, 46] per determinare la farmacocinetica ed i metaboliti della talidomide in ratti, conigli e pazienti affetti da mieloma multiplo. In questo caso i campioni, dopo acidificazione con HCl 1N, vengono introdotti nelle colonne, lavati con due aliquote di acqua e metanolo ed eluiti con acetonitrile. Successivamente la fase organica viene portata a secco con un evaporatore e ricostituita con una soluzione di acetonitrile al 10% contenente l’1% di acido acetico.
La metodica sviluppata da Murphy-Pouton e colleghi [135], per quantificare la talidomide in soggetti affetti da mesotelioma o da roditori (nei quali sono stati inpiantati gliosarcomi nel cranio e sotto la cute), al fine di determinare l’efficacia del farmaco da solo e in associazione con chemioterapi, prevedeva un estrazione liquido-liquido con dietiletere. L’estratto organico viene evaporato sottovuoto a 40°C, e ricostituito con una soluzione al 50% di tampone citrato fosfato (20mM, pH2) e metanolo. I recuperi della talidomide ottenuti con questo processo estrattivo variano dal 54 all’81%.
Negli studi di Zhou e colleghi [131] l’estrazione da cellule Caco-2 (cellule di cancro al colon) si basa su una singola estrazione liquido-liquido, utilizzando una miscela di solventi organici. Tale miscela, costituita da acetonitrile/metanolo (50:50; v/v) contenente il 2 % di acido acetico glaciale, dopo l’estrazione viene evaporata a secco sotto flusso d’azoto e ripresa con la fase mobile (tampone ammonio acetato 10 mM, pH 5,5/acetonitrile; 76:24). I recuperi ottenuti per la talidomide, sono stati del 92 e 90% rispettivamente per campioni con concentrazioni di 1 e 10 µM.
La stessa miscela venne utilizzata da Yang e colleghi due anni più tardi [134] per determinare la farmacocinetica della talidomide nel plasma di ratto, tuttavia, date
le elevate dosi di farmaco somministrate agli animali, non fu necessario concentrare il campione. L’estrazione, così semplificata ha offerto anch’esso recuperi maggiori del 90% per la talidomide e per lo standard interno. In questo studio gli autori hanno dimostrato che il recupero è indipendente dalla concentrazione testata.
Un’estrazione ancora più semplice venne adottata da Toraňo e colleghi [132], durante il loro studio farmacocinetico su siero umano. Dal campione, dopo precipitazione con CH3COOH al 10%, il surnatante veniva iniettato direttamente
nel sistema cromatografico. I recuperi ottenuti con questa estrazione sono nel range del 78-81%.
Per quanto riguarda le metodiche analitiche, la maggior parte prevedono l’utilizzo della cromatografia liquida ad alte prestazioni (HPLC), accoppiata a spettrometri di massa (MS) [44, 46, 136] o rivelatori UV [45, 131-135, 137]. Altri metodi utilizzati sono la polarografia [138], la fosforimetria [139] e la spettrofluorimetria [140]. Quest’ultime, insieme alla cromatografia liquida accoppiata alla massa, forniscono limiti di determinazione nell’ordine dei ppb che sono cento volte minori rispetto a quelli ottenuti con le metodiche in HPLC accoppiate a rilevatori UV.
Queste metodiche prevedono sia l’uso di colonne cromatografiche a fase inversa C18 [45, 131-134] che di colonne stereoselettive che consentono la quantificazione dei due enantiomeri della talidomide [135, 137].
La metodica in HPLC-MS-MS messa a punto da Teo e colleghi [136] prevede l’utilizzo di un HPLC equipaggiato con una colonna a fase inversa (35 x 3,2 mm, 3µm) nella quale viene fatta fluire la miscela eluente costituita da acqua/acetonitrile/acido acetico (90:10:0,1; v/v/v) ad un flusso di 0,5 ml/min. Gli analiti in uscita dalla colonna vengono poi inviati tramite l’interfaccia APCI con modalità di ioni negativi ai due quadrupoli. Il limite di quantificazione per la talidomide nel sangue ottenuto con questa metodica risulta essere di 2 ng/ml, nettamente inferiore a quelli riportati dalle metodiche con rivelatore UV che si aggirano nell’ordine di 0,06-1 µg/ml.
Un metodo basato sulla polarografia [138], è stato sviluppato da Hetman e colleghi, grazie alla capacità dell’elettrodo a goccia di mercurio (DME) di ridurre la talidomide. Tuttavia le condizioni sperimentali non permettono l’accumulo di talidomide sulla superficie dell’elettrodo per cui il LOD risulta nell’ordine dei 2 µg/ml.
Nel 1994 Aucelio e colleghi [139], sfruttando le proprietà luminescenti della talidomide, svilupparono una metodica basata sulla tecnica analitica fosforimetrica per determinarne la quantità in preparazioni farmaceutiche. La fosforescenza della talidomide viene incrementata ulteriormente usando come atomo pesante intensificatore il mercurio (II). Sebbene sia molto sensibile (LOD assoluto 1,8 ng), questo metodo non è adatto per analisi di cinetiche visto che ogni singolo campione deve essere trattato pochi minuti prima della fase analitica rendendo così lungo e complesso lo studio cinetico.
Dieci anni più tardi gli stessi autori [140] hanno sviluppato una metodica in spettrofluorimetria per l’analisi di preparazioni farmaceutiche, urina e siero. Le misure di fluorescenza, effettuate alle lunghezze d’onda di 291 nm per l’eccitazione e 398 nm per l’emissione,vengono effettuate dopo aver esposto il campione per 45 min a radiazioni UV (λ max 353 nm). I campioni biologici, prima di essere solubilizzati nel solvente adatto alla lettura (acetonitrile/acqua; 80:20) vengono sottoposti ad un estrazione in fase solida che offre recuperi del 104 e del 96% rispettivamente per urine e sangue. Il metodo è molto sensibile, infatti fornisce un LOD di 1,2 ng/ml. Tuttavia se è presente la sulfanilamide, un farmaco utilizzato in associazione con la talidomide per controllare le infezioni batteriche, avendo proprietà fluorescenti, porta il limite di determinazione a 11 ng/ml.
Per quanto riguarda le analisi condotte in HPLC-UV sono state utilizzate eluizioni sia in modalità isocratica che in gradiente.
Un esempio di studio che utilizza un gradiente è stato quello di Simmons e colleghi [133] in cui le tre fasi mobili furono: acqua, acetonitrile e tampone fosfato biacido di sodio 0,5 M pH 3 ad un flusso di 1,0 ml/min. La lettura viene effettuata a 220 nm per la talidomide e 248 nm per la fenacetina. Il limite di quantificazione per questa metodica è di 0,05 µg/ml.
In un altro lavoro, sempre in HPLC-UV, altri autori [131] hanno utilizzato una fase mobile composta da acetonitrile e tampone ammonio acetato 10 mM pH 5,5 ad un flusso di 0,5 ml/min. La lettura, effettuata ad una singola lunghezza d’onda di 220 nm, fornisce un limite di quantificazione di 6,4 ng/ml. La stessa metodica è stata adottata recentemente da Kamikawa e colleghi in uno studio di farmacocinetica su pazienti con mieloma multiplo [141].
Un altro lavoro descrive una metodica per l’analisi da siero della quantità dei due enantiomeri della talidomide [135]. L’analisi è stata condotta attraverso una colonna chinale con una fase mobile formata da tampone ammonio formiato (20mM pH 5,4) e acetonitrile in rapporto 14:86 v/v, con un flusso di 1 ml/min. I tempi di ritenzione sono stati di 7,2, 8,6 e 15,0 min per la fenacetina, la (R)-talidomide e la (S)-(R)-talidomide rispettivamente. I LOQ ottenuti nei campioni di siero umano e di ratto sono di circa 0.025 µg/ml per entrambi gli enantiomeri. La separazione cromatografica, adottata da Toraňo e colleghi [132] ed effettuata attraverso una colonna a fase inversa Discovery (125 x 4,6 mm, 5 µm) utilizzava come fase mobile una miscela composta da metanolo e tampone fosfato 10 mM a pH 3,0 (25:75; v/v) ad un flusso di 1,5 ml/min. Il rivelatore UV, impostato alla lunghezza d’onda di 220 nm, forniva limiti di quantificazione di 0,222 µg/ml. Un altro lavoro del 2005 [134] in HPLC-UV prevedeva l’utilizzo come fase mobile di una miscela composta da tampone ammonio acetato 10 mM pH 5,5 e acetonitrile in rapporto 72:28, ad un flusso di 0,8 ml/min.
1.6. PARTE SPERIMENTALE
Nel dipartimento dove ho svolto il dottorato di ricerca, si è reso necessario mettere a punto una metodica mediate HPLC per la determinazione della Talidomide. Pertanto parte di questa tesi di dottorato è stata dedicata a tale scopo.
Tra le varie metodiche viste sopra, il metodo descritto da X. Yang et al [134], risulta essere tra i più semplici, veloce e preciso presenti in letteratura e per questo motivo è stato adottato come “metodo guida” nello sviluppo della nostra metodica.
Dalla letteratura è noto che la talidomide è insolubile in etere, cloroformio, benzene; poco solubile in acqua (circa 2x10-4 mol/l); moderatamente solubile in metanolo, etanolo, acetone, etil acetato, butil acetato, acido acetico glaciale; e molto solubile in diossano, DMF e piridina.
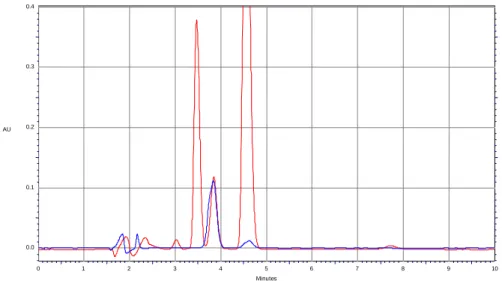
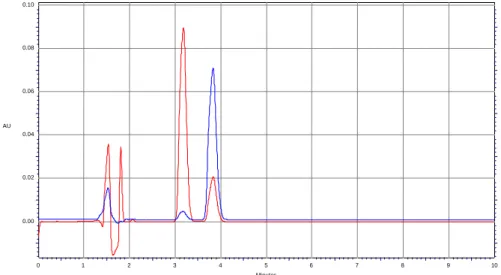
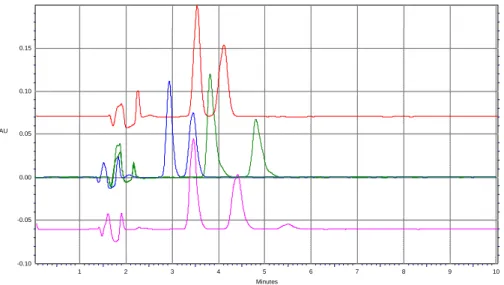
Per cui, per la messa a punto del metodo, è stato necessario effettuare uno studio per la preparazione delle soluzioni standard di talidomide e di fenacetina. Quindi sono state preparate le soluzioni a 1 mg/ml degli analiti in questione utilizzando diossano, DMF e una miscela di acetonitrile/metanolo. Sia la soluzione diossanica che quella in DMF non hanno dato buon esito all’analisi cromatografia poiché: per la prima il cromatogramma corrispondente mostra due picchi con tempi di ritenzione simili ai nostri anliti tali da rendere impossibile la determinazione (Fig. 4); mentre per la seconda a causa sia del cut off molto alto che dai tempi di ritenzione bassi il cromatogramma risulta di difficile interpretazione (Fig. 5).
Minutes 0 1 2 3 4 5 6 7 8 9 10 AU 0.0 0.1 0.2 0.3 0.4 AU 0.0 0.1 0.2 0.3 0.4
Figura 4. Cromatogramma ottenuto dall’analisi di una soluzione standard di fenacetina e talidomide in diossano (crom. rosso) e in acetonitrile/metanolo 50:50 (crom. blu).
Minutes 0 1 2 3 4 5 6 7 8 9 AU 0.0 0.5 1.0 1.5 2.0 2.5 3.0 AU 0.0 0.5 1.0 1.5 2.0 2.5 3.0
Figura 5. Cromatogramma ottenuto dall’analisi di una soluzione standard di fenacetina e talidomide in dimetil formammide.
Buoni risultati sono stati invece ottenuti con la miscela acetonitrile/metanolo e dopo diversi esperimenti, variando il rapporto fra i due solventi, il migliore è risultato quello di acetonitrile/metanolo 50:50 v/v che ha permesso una buona separazione dei degli analiti con tempi di ritenzione intorno a 3,8 e 4,6 minuti per la talidomide e la fenacetina rispettivamente (Fig. 6).
Minutes 0 1 2 3 4 5 6 7 8 9 AU 0.00 0.02 0.04 0.06 AU 0.00 0.02 0.04 0.06
Figura 6. Cromatogramma ottenuto dall’analisi di una soluzione standard di fenacetina e talidomide in acetonitrile/metanolo 50:50.
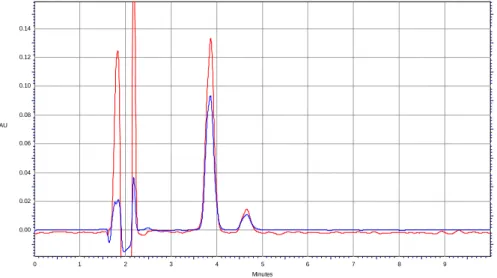
Le analisi precedentemente descritte sono state effettuate utilizzando come miscela eluente un tampone ammonio acetato 10 mM pH 5,5 (fase A) e acetonitrile (fase B), poiché il picco della fenacetina risultava leggermente slargato per migliorarne la risoluzione sono state effettuate diverse modifiche sia della miscela eluente che dei flussi di esercizio. Per quanto riguarda le fasi mobili sono stati condotti degli esperimenti mantenendo costanti il rapporto fra le due fasi a 70:30 e il flusso a 1,5 ml/min e variando il pH della fase acquosa:
• Metanolo (fase A) e tampone fosfato 10 mM pH 3,0 (fase B);
• Tampone ammonio acetato 10 mM pH 5,5 (fase A) e acetonitrile (fase B); • Tampone ammonio acetato 10 mM pH 4,5 (fase A) e acetonitrile (fase B). Oltre alla composizione della miscela eluente sono stati variati anche i flussi senza però ottenere significativi miglioramenti nei cromatogrammi. Alla luce di questi risultati pertanto abbiamo ritenuto opportuno utilizzare come miscela eluente il tampone ammonio acetato 10 mM pH 5,5 (fase A) e l’acetonitrile (fase B) in quanto presenta dei picchi più stretti come si può vedere dal confronto dei cromatogrammi ottenuti con questa miscela e con quella composta dal tampone ammonio acetato 10 mM pH 4,5 (fase A) e acetonitrile (fase B) (Fig. 7).
Minutes 0 1 2 3 4 5 6 7 8 9 10 U 0.00 0.02 0.04 0.06 0.08 0.10 AU 0.00 0.02 0.04 0.06 0.08 0.10 A
Figura 7. Cromatogrammi ottenuti dall’analisi di una soluzione standard di talidomide e S.I. utilizzando come fase A un tampone ammonio acetato a pH 4,5 (cromatogramma blu) e 5,5 (cromatogramma rosso).
Poiché l’assorbanza della fenacetina risulta bassa sono stati condotti esperimenti, per ottenere un miglior coefficiente di estinzione molare, anche a lunghezze
d’onda diverse da quella presente nell’articolo di riferimento, ma non abbiamo ottenuto il successo desiderato poiché si otteneva un miglioramento della risoluzione della fenacetina e parallelamente un peggioramento di quella della talidomide come si può vedere ad esempio dal confronto di due cromatogrammi ottenuti alla lunghezze d’onda di 220 nm e 248 nm (Fig. 8).
Minutes 0 1 2 3 4 5 6 7 8 9 AU 0.00 0.02 0.04 0.06 0.08 0.10 0.12 0.14 AU 0.00 0.02 0.04 0.06 0.08 0.10 0.12 0.14
Figura 8. Cromatogrammi ottenuti dall’analisi di una soluzione standard di talidomide e S.I. (1:2)effettuando la lettura a 220 (cromatogramma rosso) e 248 nm (cromatogramma blu).
Per questo motivo è stato preso in considerazione l’utilizzo di una nuova molecola. La ricerca di quest’ultima è stata fatta sulla base delle caratteristiche tipiche dello standard interno, quali: l’assenza nella matrice da analizzare, la capacità di fornire un picco ben distinto, il tempo di ritenzione simile a quello dell’analita e la scarsa attitudine a interagire con il campione. A tale scopo sono stati presi in considerazione tre prodotti commerciali quali:
• 3-nitro ftalimmide; • 5-fluoro isatina; • ftalimmide;
che risultano essere analoghi strutturali alla talidomide e inoltre dalla letteratura non risultano essere dei prodotti di metabolizzazione.
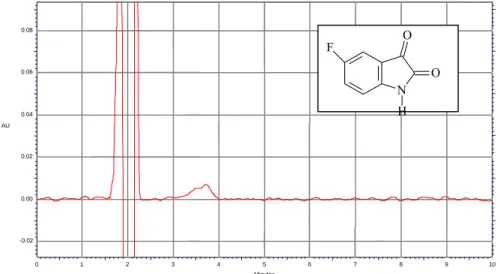
Per quanto riguarda la 3-nitro ftalimmide l’analisi di una soluzione standard ha evidenziato la presenza di tre picchi di cui uno avente tempo di ritenzione simile
alla talidomide (Fig. 9), mentre la 5-fluoro isatina non presentava un massimo di assorbimento alla lunghezza d’onda da noi utilizzata (Fig. 10).
Minutes 1 2 3 4 5 6 7 8 9 10 AU -0.02 0.00 0.02 0.04 0.06 0.08 0.10 AU -0.02 0.00 0.02 0.04 0.06 0.08 0.10 O O O O2N
Figura 9. Cromatogramma ottenuto dall’analisi di una soluzione standard di 3-nitro phtalimmide.
Minutes 0 1 2 3 4 5 6 7 8 9 10 AU -0.02 0.00 0.02 0.04 0.06 0.08 AU -0.02 0.00 0.02 0.04 0.06 0.08 N O F H O
Figura 10. Cromatogramma ottenuto dall’analisi di una soluzione standard di 5-fluoro isatina.
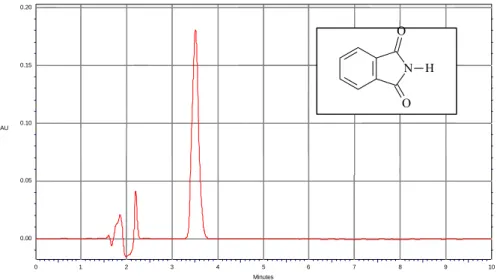
I Migliori risultati sono stati ottenuti utilizzando la ftalimmide, molecola che, risulta essere un precursore sintetico della talidomide, non è un prodotto di metabolizzazione, ha caratteristiche chimico-fisiche e un massimo di assorbimento analogo alla talidomide e inoltre, nelle nostre condizioni sperimentali, risulta avere un tempo di ritenzione di 3,5 minuti tale da renderlo un buon candidato per questo scopo (Fig. 11).
Minutes 0 1 2 3 4 5 6 7 8 9 10 AU 0.00 0.05 0.10 0.15 0.20 AU 0.00 0.05 0.10 0.15 0.20 N O O H
Figura 11. Cromatogramma ottenuto dall’analisi di una soluzione standard di ftalimmide.
Alla luce di questi risultati abbiamo cercato di ottimizzare la separazione tra i due analiti, quindi sono state fatte delle modifiche sia delle percentuali fra le fasi della miscela eluente che nel flusso di eluizione. A tal proposito sono stati utilizzati: • fase A 70%, fase B 30%; flusso 1,5 ml/min;
• fase A 70%, fase B 30%; flusso 1,8 ml/min; • fase A 75%, fase B 25%; flusso 1,5 ml/min; • fase A 75%, fase B 25%; flusso 1,8 ml/min.
Dal confronto fra i vari cromatogrammi ottenuti dall’analisi di soluzioni standard di talidomide e ftalimmide, i migliori risultati sono stati ottenuti con la miscela eluente composta da fase A 70% e fase B 30% e con il flusso di 1,5 ml/min (Fig. 12).
Minutes 1 2 3 4 5 6 7 8 9 10 AU -0.10 -0.05 0.00 0.05 0.10 0.15 AU -0.10 -0.05 0.00 0.05 0.10 0.15
Figura 12. Cromatogrammi ottenuti dall’analisi di una soluzione standard di talidomide e ftalimmide con faseA/faseB 70:30, flusso 1,5 ml/min (cromatogramma rosso); faseA/faseB 75:25, flusso 1,5 ml/min(cromatogramma verde); faseA/faseB 70:30, flusso 1,8 ml/min (cromatogramma blu); faseA/faseB 75:25, flusso 1,8 ml/min (cromatogramma fucsia).
Quindi le condizioni migliori risultano essere:
• Colonna analitica BDS HYPERSIL C18 5 µm (250 x 4,6 mm), preceduta da una precolonna, a temperatura di 23°C;
• FM composta da 30% ACN e 70% tampone ammonio acetato 10mM pH 5,5;
• Flusso 1,5 ml/min;
• Rilevatore UV settato alla lunghezza d’onda di 220 nm.
1.6.1 ANALISI QUANTITATIVA
Per l’analisi quantitativa sono state costruite curve di taratura della talidomide e della ftalimmide in acetonitrile/metanolo, per valutare il recupero percentuale del farmaco e dello S.I. dopo il processo estrattivo.
Ognuna delle concentrazioni è stata analizzata in triplo. Le iniezioni sono state fatte seguendo un ordine rigorosamente crescente (dalla concentrazione più bassa alla più alta), per evitare l’interferenza di eventuali prodotti rimasti in colonna. Le corse cromatografiche di ogni curva di taratura della talidomide e dello S.I. non
sono state intervallate ne da lavaggi di camera ne da lavaggi di colonna, mentre tra le curve dei due analiti sono stati effettuati entrambi i lavaggi.
Per l’elaborazione dei dati ottenuti dalle rette di taratura è stato utilizzato il programma Microsoft® Excel 2003 (Microsoft Corporation, USA).
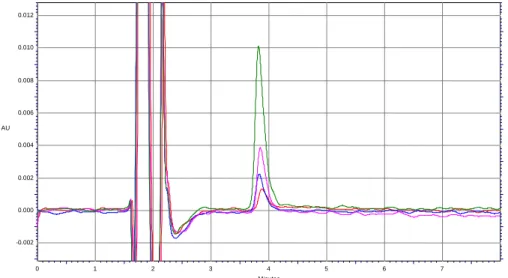
Da un’accurata osservazione dei dati ottenuti si possono trarre alcune significative informazioni: il metodo ha un ottima linearità ed una costante di precisione molto elevata evidenziata dai valori degli r2 che risultano essere 0,9992 per la talidomide e 0,9998 per la ftalimmide. Alcuni cromatogrammi delle rette di taratura sono mostrati qui di seguito (Fig 14 e 15).
Minutes 0 1 2 3 4 5 6 7 AU -0.002 0.000 0.002 0.004 0.006 0.008 0.010 0.012 AU -0.002 0.000 0.002 0.004 0.006 0.008 0.010 0.012
Figura 14. Cromatogrammi ottenuti dall’analisi di soluzioni standard di ftalimmide in concentrazioni di 0,05 (cromatogramma rosso), 0,1 (cromatogramma blu), 0,2 (cromatogramma fucsia) e 0,5 µg/ml (cromatogramma verde).
Minutes 0 1 2 3 4 5 6 7 8 9 10 AU 0.000 0.001 0.002 0.003 0.004 0.005 0.006 AU 0.000 0.001 0.002 0.003 0.004 0.005 0.006
Figura 15. Cromatogrammi ottenuti dall’analisi di soluzioni standard di talidomide in concentrazioni di 0,1 (cromatogramma rosso), 0,2 (cromatogramma blu) e 0,5 µg/ml (cromatogramma fucsia).
1.6.2. MATERIALI E METODI
Reagenti
• Talidomide, Sigma aldrich® ;
• Ftalimmide, Sigma aldrich® ;
• Acetonitrile per HPLC, Sigma aldrich®;
• Metanolo per HPLC, Sigma aldrich®;
• Ammonio acetato, Carlo Erba;
Strumentazione
Per le analisi è stato utilizzato un HPLC della Termo Finingam SCM 1000, con pompa
P 2000, detector UV UV 2000 e iniettore con loop da 20 µl. La colonna utilizzata è una BDS HYPERSIL C18 5 µm (250 x 4,6 mm) della Termo Finingam.
Preparazione delle soluzioni acquose
Tutte le soluzioni acquose sono state effettuate utilizzando acqua “bidistillata” (resistenza di 18,0 MΩ) con resine a scambio ionico, e successivamente passata attraverso l’apparecchio milliQ (Millipore Corporation, MA, USA).
Preparazione della fase mobile
9 Preparazione della fase APer ogni litro di soluzione vengono pesati esattamente 0,77 g di ammonio acetato (CH3COONH4, PM 77,08 g/mol) che vengono disciolti in 900 ml di acqua
bidistillata sotto agitazione magnetica. Il pH viene poi portato a 5,5 tramite l’aggiunta goccia a goccia di acido acetico (CH3COOH, 2M) utilizzando un
pHmetro con elettrodo a vetro. La soluzione viene poi portata a volume in un matraccio da un litro tarato e filtrata attraverso una membrana microporosa in polipropilene con diametro medio di 0,2 µm (PALL Corporation, Michigan, USA) tramite una pompa per il vuoto.
Durante il periodo di non utilizzo la soluzione è stata conservata a 4°C, e all’atto del riutilizzo è stata opportunamente stemperata in acqua tiepida (30°C) e agitata per permettere una completa solubilizzazione del sale eventualmente precipitato. 1.6.3 Rette di tartura
9 Preparazione delle soluzioni di talidomide e ftalimmide (1 mg/ml) 0,010 g di talidomide (PM 258,23 g/mol), vengono disciolti con 2 ml di metanolo/acetonitrile (50:50) e dopo aver sonicato per 5 min il tutto viene portato a volume in un matraccio da 10 ml con la stessa miscela. La stessa procedura viene effettuata per la ftalimmide (PM 147,13). Le soluzioni vengono stoccate a 4°C e ripreparate settimanalmente.
9 Preparazione delle diluizioni e curve di taratura della talidomide Dalla soluzione madre di talidomide (1 mg/ml) sono stati prelevati 500 µl e portati a volume di 5 ml con la miscela acetonitrile/metanolo (soluzione A, per ottenere una soluzione con concentrazione 100 µg/ml). Da questa soluzione sono stati preparati gli standard intermedi (Tab. 1) utilizzati per la preparazione della curva di taratura.
Volume prelevato
(ml) Volume finale (ml) Concentrazione finale (µg/ml) Nome diluizione
0,12 da A 2,0 6,0 B 0,12 da A 4,0 3,0 C 0,5 da B 3,0 1,0 D 0,25 da B 3,0 0,5 E 0,20 da D 1,0 0,2 F 0,10 da D 1,0 0,1 G 0,10 da D 2,0 0,05 H Tabella 1. 9 Retta di taratura della talidomide
Gli standard intermedi sono stati poi iniettati per determinarne l’area. Visto che la soluzione 0,05 µg/ml non è stata quantificabile la curva è stata costruita su 6 punti (Tab. 2). Concentrazione (µg/ml) Area media A1 A2 A3 0,1 13483 13190 12532 14726 0,2 28862 30215 27690 28682 0,5 70725 71088 70504 70583 1,0 142656 144495 141494 141980 3,0 435854 454931 425460 427171 6,0 926252 943152 906355 929250 Tabella 2
Retta di taratura della talidomide
y = 154062x - 7673,6 R2 = 0,9992 0 100000 200000 300000 400000 500000 600000 700000 800000 900000 1000000 0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 concentrazione a rea m e d ia Serie1 Lineare (Serie1)
9 Preparazioni delle diluizioni e curve di taratura della ftalimmide Gli standard intermedi sono stati preparati come per la talidomide e iniettati nel. I risultati ottenuti sono riportati in tabella 3.
Concentrazione (µg/ml) Area media A1 A2 A3 0,05 9970 11354 9039 9517 0,1 23422 23050 23317 23899 0,2 46441 41724 47600 50000 0,5 110840 108053 112312 112156 1,0 226531 227533 225606 226453 3,0 666099 660280 671984 666032 6,0 1369528 1386553 1320752 1401279 Tabella 3
Retta di taratura della talidomide
y = 227494x - 2211 R2 = 0,9998 0 200000 400000 600000 800000 1000000 1200000 1400000 1600000 0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 concentrazione a rea m e d ia Serie1 Lineare (Serie1)
1.7. BIBLIOGRAFIA
[1] W. Kunz. N-Phtalyl gluytaminsäure-imid. Arzneimittelforschung, 6 (1956) 426-430.
[2] T. Stephens, R. Brynner. Dark Remedy. The Impact of Thalidomide and its Revival as a Vital Medicine. Perseus Publishing, 2001.
[3] W. Lenz, R.A. Pfeiffer, W. Kosenow, D.J. Hayman. Thalidomide and congenital abnormalities. The Lancet 279 (1962) 45-46.
[4] W.G. Mc Bride. Thalidomide and congenital abnormalities. The Lancet 278 (1961) 1358.
[5] G.W. Mellin, M. Katzenstein. The saga of thalidomide (concluded): neuropathy to embryopathy, with case reports of congenital anomalies. N Engl J Med, 267 (1962) 1238-1244.
[6] W. Lenz. A short history of thalidomide embryopathy. Teratology, 38 (1988) 203-215.
[7] W. Lenz. A personal perspective on the thalidomide tragedy. Teratology, 46 (1992) 417-418.
[8] G. Mellin, M. Katzenstein. The saga of thalidomide: neuropathy to embryopathy with case reports and congenital abnormalities. N Engl J Med, 267 (1962) 1184–1193.
[9] F. Kelsey. Thalidomide update: regulatory aspects. Teratology, 38 (1988) 221–226.
[10] H. Schumacher, et al. A comparison of the teratogenic activity of thalidomide in rabbits and rats. J Pharmacol Exp Ther, 160 (1968) 189-199.
[11] J. Sheskin. Thalidomide in the treatment of lepra reaction. Clin Pharmacol Therap, 6 (1965) 303–306.
[12] B. Barlogie, R. Desikan, P. Eddlemon, et al. Extended survival in advanced and refractory multiple myeloma after single-agent thalidomide: identification of prognostic factors in a phase 2 study of 169 patients. Blood, 98 (2001) 492-494.
[13] B. Barbogie, J. Shaughnessy, M. Zangari, G. Tricot. High-dose therapy and immunomodulatory drugs in multiple myeloma. Seminars in Oncology, 29 (2002) 26-33.
[14] D. Weber, K. Rankin, M. Gavino, et al. Thalidomide alone or with dexamethasone for previously untreated multiple myeloma. J Clin Oncol, 21 (2003) 16-19.
[15] S.V. Rajkumar, S. Hayman, M.A. Gertz, et al. Combination therapy with thalidomide plus dexamethasone for newly diagnosed myeloma. J Clin Oncol, 20 (2002) 4319-4323.
[16] M. H. Kropff, N. Lang, G. Bisping, N. Domine, G. Innig, M. Hentrich, M. Mitterer, T. Sudhoff, R. Fenk, C. Straka, A. Heinecke, O.M. Koch, H. Ostermann, W. Berdel, E. Wolfgang, J. Kienast. Hyperfractionated cyclophosphamide in combination with pulsed dexamethasone and thalidomide (HyperCDT) in primary refractory or relapsed multiple myeloma. British Journal of Haematology, 122 (2003) 607-616.
[17] T. Moehler, K. Kai Neben, A. Axel Benner, et al. Salvage therapy for multiple myeloma with thalidomide and CED chemotherapy. Blood 2001; 98 (2001) 3846-3848.
[18] M.A. Dimopoulos, G. Hamilos, A. Zomas, et al. Pulsed cyclophosphamide, thalidomide and dexamethasone: an oral regimen for previously treated patients with multiple mieloma. Hematol J, 5 (2004) 112-117. [11] J. Sheskin. Thalidomide in the treatment of lepra reaction. Clin Pharmacol Therap, 6 (1965) 303–306.
[12] B. Barlogie, R. Desikan, P. Eddlemon, et al. Extended survival in advanced and refractory multiple myeloma after single-agent thalidomide: identification of prognostic factors in a phase 2 study of 169 patients. Blood, 98 (2001) 492-494.
[13] B. Barbogie, J. Shaughnessy, M. Zangari, G. Tricot. High-dose therapy and immunomodulatory drugs in multiple myeloma. Seminars in Oncology, 29 (2002) 26-33.
[14] D. Weber, K. Rankin, M. Gavino, et al. Thalidomide alone or with dexamethasone for previously untreated multiple myeloma. J Clin Oncol, 21 (2003) 16-19.
[15] S.V. Rajkumar, S. Hayman, M.A. Gertz, et al. Combination therapy with thalidomide plus dexamethasone for newly diagnosed myeloma. J Clin Oncol, 20 (2002) 4319-4323.
[16] M. H. Kropff, N. Lang, G. Bisping, N. Domine, G. Innig, M. Hentrich, M. Mitterer, T. Sudhoff, R. Fenk, C. Straka, A. Heinecke, O.M. Koch, H. Ostermann, W. Berdel, E. Wolfgang, J. Kienast. Hyperfractionated cyclophosphamide in combination with pulsed dexamethasone and thalidomide (HyperCDT) in primary refractory or relapsed multiple myeloma. British Journal of Haematology, 122 (2003) 607-616.
[17] T. Moehler, K. Kai Neben, A. Axel Benner, et al. Salvage therapy for multiple myeloma with thalidomide and CED chemotherapy. Blood 2001; 98 (2001) 3846-3848.
[18] M.A. Dimopoulos, G. Hamilos, A. Zomas, et al. Pulsed cyclophosphamide, thalidomide and dexamethasone: an oral regimen for previously treated patients with multiple mieloma. Hematol J, 5 (2004) 112-117. [19] Cavenagh et al, per il BCSH e UK Mieloma Forum, 2003.
[20] C. Lutwak-Mann, K. Schmid, H. Keberle. Thalidomide in rabbit semen. Nature, 214 (1967) 1018-20.
[21] J. R. Paumgartten. Thalidomide embryopathy in Brazil after 1965. Reproductive Toxicology, 22 (2006) 1-2.
[22] D. Hague, R.L. Smith. Enigmatic properties of (±)-thalidomide: an example of a stable racemic compound. Br J Clin Pharmacol, 26 (1988) 623.
[23] M. Krenn, M.P. Gamcsik, G.B. Vogelsang, O.M. Colvin, K.W. Leong. Improvements in solubility and stability of thalidomide upon complexation with hydroxypropyl-β-cyclodextrin. J Pharm Sci, 81 (1965) 426-430.
[24] T. Eriksson, S. Björkman, B. Roth, P. Höglung. Intravenous formulations of the enantiomers of thalidomide: pharmacokinetic and initial
pharmacodynamic characterization in humans. J Pharm Pharmacol, 52 (2000) 807-817.
[25] H. Shumacher, R.L. Smith, R.T. Williams. The metabolism of thalidomide: the spontaneous hydrolysis of thalidomide in solution. Br J Pharmacol, 25 (1965) 324-337.
[26] T. Eriksson, S. Björkman, Å. Fyge, H. Ekberg. Determination of thalidomide in plasma and blood by high performance liquid chromatography: avoiding hydrolytic degradation. J Chromatogr B, 582 (1992) 211-216.
[27] T. Eriksson, S. Byörkman. Handlin of blood samples for determination of thalidomide. Clin Chem, 43 (1997) 1095-1096.
[28] B.J. Boughton, T.M.T. Sheehan, J. Wood, D. O’Brien, M. Buttler, A. Simpson, K.A. Hale. High performance liquid chomatography assay of plasma thalidomide: stabilization of speciments and detrmination of tentative terapeutic range for cronic graft-versus-houst disease. Ann Clin Biochem, 32 (1995) 79-83.
[29] R. Huupponen, K. Pyykkö. Stability of thalidomide in human plasma. Chem 41 (1995) 1199.
[30] A.W. Lyon, G. Duran, V.A. Raisys. Determination of thalidomide by high performance liquid chromatography: metodological strategy for clinical trials. Clin Biochem , 28 (1995) 467-470.
[31] T. Eriksoon, S. Byörkman, B. Rooth, Å. Fyge, P. Höglung. The enantiomers of thalidomide: blood distribution and the influence of serum albumin on chiral inversion and hydrolyisis. Chirality, 10 (1998) 223-228.
[32] R. Beckmann, H.H. Kampf. Zur quantitativen Bestimmung und zum quantitativen Nachweis von N-phthalyl-glutaminsäureimid. Arzneimittelforschung, 11 (1961) 185-190.
[33] J.N. Green, B.N. Benson. The spectrophotometric determination of thalidomide in body fluids. J Pharm Pharmacol, 13 (1991) 117-121. [34] T.L. Chen, G.B. Vogelsang, G.B. Petty, R.B. Brundrett, D.A. Noe, G.W.
of thalidomide after oral dosing in heartly male voluneers. Drug Metab Dispos, 17 (1989) 402-405.
[35] C.B. Trapnell, S.R. Donahue, J.M. Collins, D.A. Flockart, D.A. Thacker, D.R. Abernetky. Thalidomide dose not alter the parmacokinetics of ethinyl estradiol and norethindrone. Clin Pharmacol Ther, 64 (1999) 597-602.
[36] S.K. Teo, W.A. Colburn, S.D. Thomas. Singles-dose oral pharmacokinetics of three formulations of thalidomide in healthly male voluteers. J Clin Pharmacol, 39 (1999) 1162-1168.
[37] S.K. Teo, M.R. Scheffler, K.A. Kook, W.G. Tracewell, W.A. Colburn, D.I. Stirling, S.D. Thomas. Effect of a high-fat meal on thalidomide pharmacokinetics and the relative bioavailability of oral formulations in healtly man and woman. Biopharm Drug Dispos, 21 (2000) 33-40. [38] Celgene Corporation. Thalidomide product monograph. Physicians’desk
reference. J Medical Economics Company, Montvale (2000).
[39] D. Heney, D.R. Norfolk, J. Wheeldon, C.C. Bailey, I.J. Lewis, D.L. Barnard. Thalidomide treatment for chronic graft-versus-host disease. Br J Haematol, 78 (1991) 23-27.
[40] S.C. Piscitelli, W.F. Figg, B. Hahn, G. Kelly, S. Thomas, R. Walker. Single-dose pharmacokinetics of thalidomide in human immunodeficiency virus-infected patiens. Antimicrob Agents Chemother, 41 (1997) 2797-2799.
[41] F.D. Noormohamed, M.S. Youle, C.J. Higgs, K.A. Kook, D.A. Hawkins, A.F. Lant, S.D. Thomas. Pharmacokinetics and hemodynamic effects of single oral dose of thaliudomide in asymptomatic human immunodeficiency virus-infect subjects. AIDS Res Hum Retroviruses, 15 (1999) 1047-1052.
[42] W.D. Figg, S. Raje, K.S. Bauer, A. Tompkins, D. Venzon, R. Bergan, A. Chen, ed al. pharmacokinetics of thalidomide in an elderly prostate cancer population. J Pharm Sci, 88 (1999) 121-125.
[43] H.A. Fine, W.D. Figg, K.J. Haeckle, P.Y. Wen, A.P. Kyritsis, J.S. Loeffler, V.A. Levin, et al. Phase II trial of the antiangiogenic agent thalidomide
in patiens with recurrent high-grade gliomas. J Clin Oncol 18, (2000) 708-715.
[44] F. Chung, J. Lu, B. D. Palmer, P. Kastell, P. Browett, B. C. Baguley, M. Tingle, L. Ching. Thalidomide Pharmacokinetics and metabolite Formation in Mice, Rabbits, and Multiple Myeloma Patients. Clinical Cancer Research, 10 (2004) 5949-5956.
[45] H. Shiah, Y. Chao, L. Chen, T. Yao, J. Huang, J. Chang, P. Chen, T. Chuang, H. Chin, J. Whang-Peng, Tsang Liu. Phase I and pharmacokinetic study of oral thalidomide in patients with advanced hepatocellular carcinoma. Cancer Chemother Pharmacol, 58 (2006) 654-664.
[46] J. Lu, B. D. Palmer, P. Kastell, P. Browett, B. C. Baguley, G. Muller, L. Ching. Thalidomide Metabolites in Mice and Patients with Multiple Myeloma. Clinical Cancer Research, 9 (2003) 1680-1688.
[47] Y. Ando, E Fuse, W dd. Figg. Thalidomide by the CYP2C subfamily. Clin Cancer Res 8 (2002) 1973-2002
[48] T. Eriksson, S. Bjorkman, B. Roth, H. Bjork, P. Hoglund. Hydroxylated metatabolite of thalidomide: formation in-vitro end in-vivo in man. J.Pharm Pharmacol 50 (1998) 1409-1416
[49] M.Reisit, P.A. Carrupt, E. Francotte, B. Testa. Chiral inversion and hydrolysis of thalidomide: mechanisms and catalysis by bases and serum albumin, and chiral stability of teratogenic metabolites. Chem. Res. Toxicol, 11 (1998) 1521-1528
[50] M.L. Williams, P. Bhargava, I. Cherrouk, J.L. Marshall, D.A. Flockhart, I.W. Wainer. A Discordance of the cytochrome P4502C19 genotype and phenotype in patients white advanced cancer. Br.J Clin Pharmacol. 49 (2000) 485-488.
[51] R. Beckman. Über das Verhalten von thalidomide in Organismus. Orzneimittelforschung, 12 (1962) 1095-1098.
[52] R.T. Williams, H. Schumacher, S. Fabro, RL. Smith. The chemistry and metrabolism of thalidomide. In: Robson, et al (eds) Symposium on embryophathic activitivity of drugs. J. and A. Churchill, London, (1965) S167-S182