ISCHEMIA
Le malattie cardiocerebrovascolari sono la principale causa di morte nei paesi industrializzati. Secondo i dati dell’Organizzazione Mondiale della Sanità queste malattie causano 17 milioni di morti ogni anno.
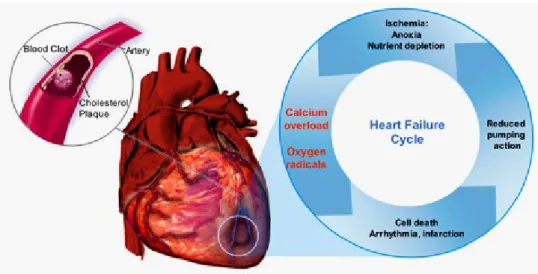
Queste malattie sono legate a una parziale o totale occlusione delle arterie, dovuta alla formazione di placche aterosclerotiche che ostruiscono i vasi, rallentando il flusso sanguigno.
Figura 1. Fenomeno dell’infarto del miocardio
Questo rallentamento o interruzione del flusso causa il fenomeno dell’ischemia e conseguente morte cellulare.
Se l’ischemia avviene a livello dei vasi coronarici si ha l’infarto del miocardio, per cui alcune parti del cuore non vengono alimentate dal sangue.
Quando l’apporto di sangue al cuore viene interrotto per 30-40 minuti la contrattilità dei miociti diminuisce, con conseguente morte cellulare.
Nelle fibre miocardiche ischemiche la concentrazione di ATP è ridotta, poiché in assenza di ossigeno solo una piccola percentuale di ADP viene trasformato in ATP dalla glicolisi anaerobica. Inoltre la quantità di ADP che non è convertita in ATP dà origine a prodotti come adenosina, inosina e xantine, responsabili dell’aumento di osmolarità intracellulare e del rigonfiamento delle fibre.
La ridotta attività della pompa ionica ATP-dipendente causa, inoltre, un aumento di Ca+ + intracellulare, che compromette l’integrità della membrana cellulare.
La riperfusione che segue un lungo periodo di ischemia può aumentare il danno tissutale, a causa dell’aumento del rigonfiamento cellulare e della distruzione del sarcolemma.
Nelle fibre cardiache l’aumento della concentrazione di ioni calcio porta all’attivazione di enzimi degradativi come proteasi, endonucleasi e fosfolipasi, le quali contribuiscono alla degradazione del sarcolemma idrolizzando i fosfolipidi di membrana. Infine la produzione di specie reattive dell’ossigeno riveste un ruolo fondamentale nell’induzione del danno tissutale.1
Questi fenomeni portano a morte cellulare e all’ampliamento dell’area necrotica.
IPC
Nel 1986 Murry et al. scoprirono un meccanismo di difesa fisiologico che denominarono IPC, precondizionamento ischemico.2
Essi dimostrarono che se ad un’occlusione prolungata del ramo coronarico precede un’occlusione breve, la lesione prodotta dall’ischemia si riduce e i miociti risultano più resistenti all’eventuale danneggiamento ischemico, con conseguente riduzione dell’area infartuata.
Il precondizionamento ischemico (IPC) è stato scoperto inizialmente nel cuore ma successivamente è stato descritto, in altre forme, in organi diversi e in diverse specie animali, tra cui l’uomo.
Questo fenomeno è stato osservato nei muscoli scheletrici, nell’intestino, nei reni e nel fegato, con il risultato di una rapida protezione dalla morte cellulare durante il danno ischemico.
Sebbene nell’insieme il meccanismo dell’IPC non sia stato ancora chiarito è possibile evidenziare alcuni processi molecolari coinvolti.
Il meccanismo generale di questo processo prevede inizialmente la liberazione di varie sostanze trigger, le quali iniziano una cascata di eventi che porta alla protezione della cellula.
Il fenomeno dell’IPC si articola secondo due fasi distinte: una prima fase che dura da 1 a 3 h dopo lo stimolo precondizionante e una fase tardiva che dura dalle 24 alle 96 h. La prima fase del precondizionamento ischemico vede coinvolti triggers recettore-dipendenti e triggers recettore-inrecettore-dipendenti, seguita dalla fase di ischemia prolungata in cui entrano in gioco altri mediatori e/o effettori.
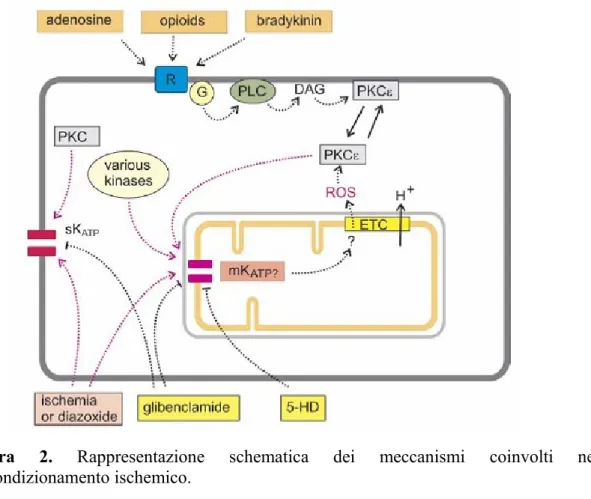
Figura 2. Rappresentazione schematica dei meccanismi coinvolti nel
precondizionamento ischemico.
Durante l’ischemia, si ha accumulo di adenosina, norepinefrina, bradichinina e oppiodi, che mostrano un’azione cardioprotettrice. Le interazioni di questi mediatori con il proprio recettore bersaglio portano all’attivazione della fosfolipasi C3-4 che catalizza l’idrolisi del fosfoinositolo 4,5-bifosfato (PIP2) in fosfoinositolo 1,3,4-trifosfato (IP3) e in diacilglicerolo (DAG). L’IP3 e il DAG stimolano la protein chinasi C (PKC) a traslocare dal citosol a proteine ancorate sulla membrana del citoscheletro5-10.
•
TRIGGERS RECETTORE-DIPENDENTI
L’adenosina è stato il primo attivatore dell’IPC ad essere identificato. I livelli cardiaci di adenosina aumentano durante brevi periodi di ischemia. I recettori coinvolti sono principalmente i sottotipi A1 e A 3, mentre è escluso il coinvolgimento del recettore A211. Anche i recettori δ degli oppioidi sono coinvolti nel meccanismo dell’IPC12, in particolare il sottotipo δ1 induce una cardioprotezione ritardata 24 h dopo la stimolazione del recettore.
Il ruolo dei recettori κ è invece ancora oggetto di controversie.
Sebbene l’adenosina sia il principale attivatore è stato osservato che anche la bradichinina gioca un ruolo importante in sinergia con l’adenosina.
Il ruolo di prostaglandine, norepinefrina, angiotensina e endotelina non è stato invece ancora chiarito.
•
TRIGGERS RECETTORE-INDIPENDENTI
NO è da sempre conosciuto come un fattore endogeno coinvolto nella cardioprotezione; infatti l’inibizione dell’ossido nitrico sintetasi porta a una diminuizione degli effetti dell’IPC13.
Al momento il ruolo dell’NO nella fase tardiva dell’IPC è noto, mentre il suo coinvolgimento nella prima fase non è ancora stato chiarito.
•
MEDIATORI ED EFFETTORI IN IPC
La PKC è uno dei principali mediatori intracellulari dell’IPC. Le proteine chinasi sono attivate dalla stimolazione di proteine G seguenti all’interazione dell’adenosina e altri mediatori con i propri recettori.
Il coinvolgimento della PKC in questo fenomeno è stato chiaramente dimostrato sia per mezzo di inibitori quali la staurosporina o il polimixin, che impediscono il fenomeno dell’IPC, sia attraverso l’uso di attivatori come il forbol estere, che invece ne simulano l’effetto14-16.
La cardioprotezione indotta dalla PKC procede attraverso il trasferimento di un gruppo fosfato a diverse proteine, tra cui i canali al potassio ATP-sensibili, i quali giocano un ruolo particolarmente rilevante nell’IPC, come è stato dimostrato attraverso l’uso di bloccanti KATP, come la glibenclamide e il 5-idrossidecanoato (5-HD)17.
Sebbene gli effettori finali coinvolti nel meccanismo di IPC non siano stati ancora chiaramente identificati, molti studi riportano che durante il fenomeno del precondizionamento ischemico si verifica un accumulo di cataboliti, come il lattato18. Inoltre durante il fenomeno dell’IPC si ha una riduzione dell’acidificazione intracellulare che indicherebbe una diminuizione della glicolisi anaerobica.
Altri mediatori finali sembrano essere: scambio Na+/H+, la down-regulation del TNF-α e l’attivazione dei canali mito-KATP19-20.
CANALI AL POTASSIO ATP-DIPENDENTI
I canali al potassio sono uno tra i più diversi gruppi di canali ionici esistenti nelle cellule eccitabili e non.
Essi svolgono importanti funzioni fisiologiche nei processi di comunicazione cellulare che regolano il battito cardiaco, la contrazione della muscolatura liscia, la secrezione di insulina e il rilascio di neurotrasmettitori.
Tra le varie tipologie di canali al potassio i canali KATP sensibili sono regolati dalla concentrazione intracellulare di ATP.
Questi canali sono stati identificati in molti tessuti tra cui il cuore, le cellule β-pancreatiche e quelle neuronali, renali e muscolari21-24.
Nel pancreas questa tipologia di canali al potassio permette la secrezione di insulina in risposta ad un aumento della concentrazione plasmatica di glucosio; nel cuore invece, svolgono una funzione protettiva in risposta a ipossia o ischemia e sembra che siano anche coinvolti in situazioni di stress metabolico.
Nel sistema nervoso centrale i canali KATP sembrano svolgere un ruolo simile a quello che svolgono nel cuore.
L’apertura dei canali KATP nelle cellule muscolari lisce provoca vasorilasciamento, inoltre essi contribuiscono al mantenimento del tono muscolare in molti tessuti.
Nei muscoli scheletrici questi canali svolgono un ruolo importante sia durante lo sforzo fisico che nell’uptake di glucosio.
I canali KATP sono stati chiaramente identificati inoltre sia a livello della membrana sarcolemmatica che a livello della membrana mitocondriale.
Per mezzo di studi di clonazione, sono state individuate le parti costituenti i canali sarc-KATP, quali la sottofamiglia Kir6.x (Kir 6.1 e Kir 6.2) e il recettore per le sulfaniluree (SUR1,SUR2A e SUR2B). Le subunità Kir presentano tutte la stessa struttura primaria ma si differenziano per il grado di omologia. Esse sono costituite da due segmenti transmembranali, M1 e M2, connessi da una regione denominata P, che presenta un residuo amminoacidico altamente conservato in tutte le sottofamiglie Kir, costituito dagli amminoacidi Gly-Tyr-Gly, ad eccezione della subunità Kir6.x (Gly-Phe-Gly). Mentre alla subunità SUR sono associati i siti di legame per l’ATP, e ogni subunità possiede 17 segmenti transmembranali (TMs), arrangiati in un dominio (TMD0) di cinque segmenti e due domini di sei segmenti (TMD1 e TMD2) che formano due larghi loops contenenti ciascuno un sito di legame per il nucleotide25 (Fig. 3).
Figura 3. Struttura secondaria e modello molecolare delle due subunità
di un canale K-ATP.
La composizione molecolare dei canali mito- KATP cardiaci invece non è stata ancora chiarita, sebbene una recente pubblicazione suggerisca che possano essere costituiti da
una combinazione di subunità Kir6.1, Kir6.2 e SUR2, mentre non è presente la subunità SUR126.
L’apertura dei canali KATP nelle cellule del miocardio è fortemente dipendente dalle condizioni metaboliche della cellula. L’adenosina trifosfato e i nucleotidi difosfato sono i due principali fattori in grado di regolare il flusso ionico attraverso questi canali: nello specifico l’ATP ne inibisce l’apertura mentre i nucleosidi difosfato ne causano l’apertura.
In condizioni fisiologiche i canali KATP sono chiusi e inattivi, mentre in una situazione di ischemia del miocardio o, più frequentemente in condizioni generali di stress metabolico, la loro apertura è attivata da una diminuzione della concentrazione intracellulare di ATP e da un accumulo di metaboliti derivanti dall’insulto ischemico. Quindi si può affermare che i canali KATP agiscono come sensori e modulatori del metabolismo energetico cellulare27-28.
I canali KATP giocano un ruolo centrale nella protezione del cuore dall’insulto ischemico e sono quindi coinvolti nel meccanismo dell’IPC.
L’apertura dei canali sarc-KATP, indotta da ipossia, ischemia o da farmaci agonisti, accelera la ripolarizzazione della membrana dei miocardiociti dopo la depolarizzazione, provocando una riduzione della durata del potenziale d’azione (APD) e impedendo lo scambio Na+/H+, con conseguente inibizione dell’entrata di Ca++ all’interno della cellula. Tutto ciò previene il sovraccarico di Ca++ e riequilibra il bilancio tra la richiesta e l’apporto di energia alla cellula21.
Tuttavia, recenti studi hanno dimostrato che i mito-KATP sono i principali effettori nella protezione anti-ischemica del cuore.
I mitocondri sono responsabili della sintesi dell’ATP nelle cellule, funzione che è indebolita in caso di crisi energetica. In questo tipo di situazione l’apertura dei mito-KATP ripristina parzialmente il potenziale di membrana, permettendo un’ulteriore estrusione degli ioni H+, e conseguente riduzione della concentrazione del Ca++ all’interno dei mitocondri, prevenendo la deplezione di fosfati ad alta energia. In questa situazione il gradiente elettrochimico risulta essere più favorevole per la sintesi di ATP29-31. Inoltre, è stato osservato che con l’uso di diazossido, un attivatore dei canali KATP, si ha una riduzione della concentrazione mitocondriale di Ca++ e l’inibizione del sovraccarico di questo ione nella matrice dei mitocondri32-33.
I CANALI SARC-KATP
L’aprikalim, agonista dei canali sarc-KATP, è in grado di mimare gli effetti dell’IPC in cani anestetizzati con barbiturici, producendo una significativa riduzione dell’area infartuata. Questo effetto protettivo viene annullato dalla glibenclamide, bloccante del canale KATP, che impedisce inoltre il recupero della funzione ventricolare durante il periodo di riperfusione34. Mentre il pre-trattamento con pinacidil, attivatore del KATP, promuove invece un’accelerazione della durata del potenziale d’azione (APD) e di conseguenza un miglioramento del recupero della funzione ventricolare35.
La possibilità che i canali sarc-KATP possano essere coinvolti nel fenomeno dell’IPC, fu suggerita attraverso l’utilizzo della sulfoniltiourea HMR 1883. Questo bloccante dei canali sarc-KATP, ritardava la caduta del potenziale d’azione e riduceva la cardioprotezione indotta dal diazossido36.
Tuttavia, la natura dei segnali che permettono l’attivazione dei canali sarc-KATP nell’IPC, e come questo canale produca cardioprotezione, è ancora motivo di dibattito. Studi eseguiti sui miociti ventricolari di coniglio, evidenziano che l’adenosina e l’attivazione di PKC aumentano il flusso attraverso il canale KATP durante un’inibizione metabolica, e questo effetto viene abolito dal trattamento con antagonisti selettivi dell’adenosina. Si ipotizza che l’apertura dei canali sarc-KATP sia dovuta a un sinergismo tra l’attivazione dei recettori dell’adenosina e la fosforilazione della PKC.
L’ossido d’azoto (NO) attiva i canali sarcolemmali sia in condizioni di ossigenazione normale che di ipossia37. In particolare molti studi hanno dimostrato che NO endogeno non è coinvolto nella prima fase dell’IPC, mentre la somministrazione esogena di NO innesca questo fenomeno38.
E’ inoltre possibile che ci sia un legame tra i canali sarc-KATP e mito-KATP. Infatti l’iperpolarizzazione, dovuta all’attivazione dei canali sarc-KATP, può condurre alla apertura dei mito-KATP , attraverso l’attivazione della fosfolipasi D che induce la traslocazione della PKC, responsabile dell’apertura di entrambi i canali. Altre teorie interessanti suggeriscono che l’attivazione dei sarc-KATP possa portare all’apertura dei canali KATP o viceversa39. A dimostrazione di ciò, prove effettuate con il 5-HD o con HMR 1098, bloccanti selettivi rispettivamente per i mito- KATP e per i sarc-KATP, hanno evidenziato che questi, da soli, non riuscivano ad abolire l’effetto protettivo stimolato
dall’ipossia cronica, ma solo la combinazione di entrambi annullava completamente la protezione40.
I CANALI MITO-K
ATPIl ruolo protettivo dei canali mito-KATP è stato per la prima volta ipotizzato nel 1980, quando si è osservato che il nicorandil era in grado di esercitare una azione protettiva contro il danno ischemico41. Ancora oggi il suo meccanismo non è stato del tutto compreso, ma questa ipotesi è stata confermata usando un agonista non selettivo dei canali KATP, il bimakalim. Questo farmaco esercitava un effetto cardioprotettivo sia a basse dosi, senza produrre una riduzione dell’APD, sia a dosi più elevate. Questi risultati suggeriscono la presenza di un sito intracellulare responsabile dell’azione cardioprotettrice, indipendentemente dalla riduzione dell’APD42. Risultati simili sono stati ottenuti anche con un altro agonista non selettivo, il cromakalim43-45.
N NH ONO2 O Nicorandil O NC N OH O Cromakalim Bimakalim O NC N O
In seguito alla scoperta dei canali mito-KATP, le ricerche in campo farmaceutico si sono indirizzate verso lo sviluppo di ligandi capaci di interagire con essi. Una conferma del ruolo svolto dai canali mito-KATP nella cardioprotezione, è stata fornita dallo studio del diazossido e del cromakalim, i quali hanno mostrato un’azione cardioprotettiva
attraverso l’apertura di tali canali a più basse concentrazioni di quelle necessarie per l’apertura dei canali sarcolemmatici. Questi effetti sono aboliti dalla glibenclamide e dal 5-HD, dimostrando quindi il maggior coinvolgimento dei canali mito-KATP nella cardioprotezione46.
Per l’apertura di questo tipo di canali, sembra essere necessaria l’attivazione e la traslocazione di una specifica isoforma della PKC. Infatti è stato dimostrato che gli antagonisti della PKC sono in grado di abolire gli effetti cardioprotettivi dovuti all’apertura dei canali mito-KATP, mentre i bloccanti dei mito-KATP inibiscono l’azione protettiva mediata dall’attivazione della PKC. Questi risultati suggeriscono che la PKC e i mito-KATP sono entrambi necessari e co-dipendenti per l’effetto cardioprotettivo47. Inoltre sembra vi sia una relazione tra NO e l’apertura dei canali KATP. Infatti, studi condotti in vivo su cuore di coniglio, hanno evidenziato che la cardioprotezione mediata dal diazossido è abolita sia dal trattamento con 5-HD che dal trattamento con inibitori dell’ossido nitrico sintetasi (NOS)48.
Risultati controversi sono stati ottenuti riguardo le specie reattive dell’ossigeno (ROS). Da un lato è evidente che la loro formazione sembra essere essenziale per la cardioprotezione, poiché attivano la cascata della PKC incrementando l’apertura dei canali KATP, dall’altro lato, il loro rilascio sembra favorire l’apertura del poro di transizione di permeabilità mitocondriale (MitoPTP) durante la riperfusione49, che se è prolungata rappresenta una delle principali cause di morte cellulare.
Nello stesso tempo il rilascio di ROS e l’apertura transitoria del MitoPTP sono stati indicati come i fattori responsabili della cardioprotezione. Infatti l’apertura transitoria del MitoPTP in uno stato di bassa conduzione, eviterebbe il sovraccarico di Ca++ , che previene la successiva prolungata apertura dei MitoPTP, dannosa per la cellula50.
MECCANISMO DI PROTEZIONE DEI CANALI MITO-K
ATPI canali mito-KATP sono presenti sulla membrana interna dei mitocondri e la loro apertura permette il flusso di ioni K+ nella matrice mitocondriale. Il flusso d’ingresso degli ioni è regolato dal potenziale di membrana interno, mentre la fuoriuscita è compensata dal rapporto K+/H+, che rimuove K+ utilizzando il gradiente dei protoni. In condizioni fisiologiche, il flusso d’entrata di K+ è molto basso e ha effetti marginali sul potenziale di membrana, mentre determina un rilevante aumento volumetrico della
matrice. Un’altra funzione fisiologica dei canali mito-KATP è la regolazione della ricaptazione del Ca++.
In condizioni di stress o d’ischemia, l’apertura dei canali mito-KATP provvede a mantenere l’omeostasi del volume della matrice, fattore fondamentale nella regolazione della permeabilità ai nucleotidi.
La permeabilità della membrana all’ADP e all’ATP in condizioni di ossigenazione normale è bassa, perché il trasferimento di energia tra i mitocondri e il citosol è mediato dai fosfati ad alta energia. In condizioni di ipossia invece la conduttanza della membrana esterna aumenta, e di conseguenza si ha espansione dello spazio intermembrana che determina la dissociazione della creatina chinasi dal canale e un aumento nella permeabilità della membrana esterna. In queste condizioni l’apertura dei mito-KATP induce un incremento dell’influsso di K+ accompagnato dalla diffusione di acqua e dalla captazione di anioni, causando quindi il rigonfiamento della matrice. Questo effetto mantiene bassa la permeabilità della membrana esterna ai nucleotidi, riduce l’idrolisi di ATP, creando cosi un gradiente favorevole per la sintesi di ATP. Inoltre l’apertura dei canali KATP , riducendo il periodo di plateau del potenziale di membrana, previene il sovraccarico di Ca++ a livello mitocondriale che è la principale causa di danno ischemico51-53.
K
ATPAGONISTI E BLOCCANTI
Il migliore modo per identificare la funzione dei canali cardiaci KATP e per distinguere il ruolo dei mito-KATP dai sarc-KATP nel meccanismo di precondizionamento ischemico è rappresentato dall’utilizzo di agonisti e bloccanti.
Nondimeno farmaci agonisti dei canali mito-KATP attivano anche i canali sarc-KATP nei miocardiociti e/o nelle cellule muscolari, causando una vasodilatazione periferica e un accorciamento del potenziale d’azione.
Molti studi hanno dimostrato che le proprietà cardioprotettive dei mito-KATP openers sono indipendenti dall’effetto vasorilasciante, per cui l’interesse dei ricercatori si è concentrato sulla sintesi di derivati privi dell’attività dei sarc-KATP.
AGONISTI SELETTIVI K
ATPDI PRIMA GENERAZIONE
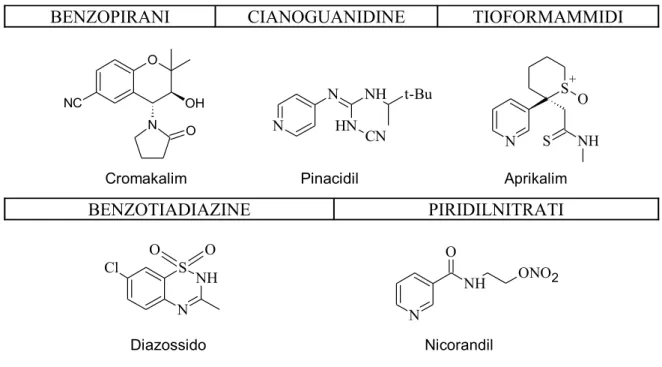
Gli agonisti dei canali KATP , detti KCO dall’inglese “Potassium channel openers”, presentano una pronunciata diversità chimica e appartengono a diverse classi strutturali, come i benzopirani, le cianoguanidine, le tioformamidi, le tiodiazine e i piridil-nitrati .
BENZOPIRANI CIANOGUANIDINE TIOFORMAMMIDI
O NC N OH O Cromakalim N N NH N H CN t-Bu Pinacidil N S NH S+ O Aprikalim BENZOTIADIAZINE PIRIDILNITRATI Cl NH S N O O Diazossido N NH ONO2 O Nicorandil
Figura 4.
KCOs di prima generazioneTra gli agonisti KATP di prima generazione il Cromakalim54 è il prototipo della classe dei benzopirani.
Questo composto, sintetizzato nel 1980 e sottoposto a molte modificazioni strutturali, è stato frequentemente usato in studi farmacologici, sebbene non fosse selettivo verso i canali mito-KATP e fosse quindi responsabile di una marcata vasodilatazione e di un accorciamento del potenziale d’azione.
Il cromakalim contiene due carboni chirali; il gruppo 3-OH e l’anello 4-pirrolidinone sono in posizione trans tra loro.
L’attività, come KCOs, risiede nell’enantiomero 3S,4R- levcromakalim.
Il prototipo dei KCOs appartenenti alla classe delle cianoguanidine è il pinacidil. E’ stato sviluppato da una serie di N-alchil-N-tiouree piridiniche con proprietà
Il più potente composto della serie delle cianoguanidine è P-1075, un derivato 3-piridilico, le cui proprietà farmacologiche sono state ampiamente studiate.
P-1075 lega con una alta affinità le subunità SUR2A e SUR2B ed è quindi considerato un agonista selettivo dei canali sarc-KATP.
Questa sua caratteristica ha permesso di usarlo in studi farmacologici allo scopo di evidenziare il coinvolgimento dei sarc-KATP rispetto ai mito-KATP nel fenomeno dell’IPC. Le cianoguanidine PNU-99963 e PNU-9470 meritano di essere menzionate in quanto presentano un’attività di tipo bloccante sui canali KATP. La modificazione chimica principale è la presenza di un anello fenilico nella catena laterale lipofila.
L’attività agonista di PNU-99963 ha permesso d’ipotizzare che questo composto sia in grado di modulare il legame dell’ATP e l’attività ATPasica della subunità SUR in modo tale da determinare il blocco56.
N NH N N H CN PNU-94750 N NH N N H CN P-1075 PNU-99963 N NH N H CN N Cl
Nella classe delle tioformammidi il prototipo è rappresentato dall’aprikalim, mentre nella classe dei piridilnitrati si ha il Nicorandil.
Le proprietà vasodilatatrici del nicorandil non sono dovute soltanto all’attivazione dei canali KATP, ma anche al fatto che il nicorandil stimola l’attività della guanilato ciclasi nella muscolatura liscia vascolare e agisce come donatore di NO.
Il prototipo dei KCOs a struttura tiadiazina è il diazossido , il quale si differenzia per molti aspetti dagli altri KCOs. Il sito di legame è posizionato in altre regioni della proteina SUR rispetto al sito di legame per i benzopirani e le cianoguanidine. Il diazossido è l’unico KCOs che si lega con affinità simile sia alla SUR1 che alla SUR2B, rilascia la muscolatura vascolare liscia e inibisce la secrezione di insulina in modo equivalente.
Il diazossido ha mostrato di avere una buona selettività verso i canali mito-KATP, in quanto in condizioni normali non agisce sui canali cardiaci sarc-KATP.
In verità è usato di frequente a basse dosi negli studi in vitro sul coinvolgimento dei canali mito-KATP nel precondizionamento ischemico, mentre in vivo il diazossido agisce anche sui canali KATP delle cellule muscolari e endoteliali ed è anche un debole attivatore dei canali sarc-KATP.
ANTAGONISTI DEI CANALI K-
ATPTra gli antagonisti dei canali al potassio i più noti sono la glibenclamide e il 5-idrossidecanoato.
La glibenclamide è una sulfanilurea che svolge la sua azione bloccante agendo sulle subunità SUR1 e SUR2A/2B, espresse rispettivamente a livello delle cellule cardiache e vascolari; per tale motivo questo composto non può essere usato per descrivere il ruolo dei mito-KATP e dei sarc-KATP57.
Il 5-idrossidecanoato (5-HD) invece, è uno specifico inibitore dei canali mito-KATP ed è quindi utile per effettuare studi farmacologici su composti attivi a livello dei mito-KATP. E’ stato evidenziato che il 5-HD inibisce il flusso di ioni K+ indotto da diazossido.
La sulfaniltiourea HMR1098, ottenuta dalla glibenclamide, è un bloccante selettivo dei canali sarc-KATP; per questo è utilizzata in combinazione con un bloccante non selettivo per investigare sui meccanismi coinvolti nell’IPC.
NH O OMe Cl S NH NH O O O OMe HMR 1098 NH S NH NH O O OMe Cl O O Glibenclamide HOOC Me OH Acido 5-idrossidecanoico
AGONISTI SELETTIVI MITO-K
ATPConsiderando il ruolo chiave che i canali KATP svolgono nel mantenimento dell’omeostasi cellulare, e grazie al loro potenziale nel proteggere la cellula in stati di stress metabolici, i KCOs rappresentano potenziali farmaci che potrebbero essere presto inseriti nella pratica clinica in aggiunta alle terapie esistenti.
I KCOs possiedono infatti un vasto potenziale terapeutico per molte patologie, tra le quali l’asma, l’ischemia del miocardio e l’incontinenza urinaria ,anche se attualmente il loro utilizzo clinico è limitato a causa di una mancanza di selettività tissutale.
I KCOs che hanno trovato una applicazione in terapia sono: il nicorandil per l’angina, il minoxidil per l’alopecia, il diazossido e il pinacidil per l’ipertensione58.
I composti di seconda generazione invece hanno una maggiore selettività che li rende potenzialmente utilizzabili in terapia.
Alcuni tra i KCOs di seconda generazione hanno mostrato una buona selettività verso il tessuto cardiaco.
BENZOPIRANILCIANOGUANIDINE
Il primo KCO selettivo per i canali mito-KATP ad essere stato sintetizzato è stato BMS-180448 un ibrido tra la struttura benzopiranica del cromakalim e quella cianoguanidinica del pinacidil.
O NC N OH O Cromakalim N N NH N H CN t-Bu Pinacidil O NC N NH NC NH Cl OH BMS-180448
Partendo da questo composto sono stati condotti dettagliati studi di SAR allo scopo di ottimizzare le proprietà cardioselettive e antischemiche.
•
STUDI SULLA PORZIONE BENZOPIRANICA
O N H OH R NCN N H
anello arilico importante per la cardioselettività
piccoli gruppi elettronattrattori o ingombrante gruppo solfonammidico
gruppo lipofilo essenziale porzione cianoguanidinica sostituibile con porzione ureica
Per quanto riguarda le modifiche sull’anello benzopiranico, la presenza di un metile in posizione 1 è tollerata, mentre la sostituzione con isostero dell’ossigeno, quale l’azoto, porta a composti inattivi. I gruppi metili geminali sono essenziali ai fini dell’attività; gli analoghi demetilati sono infatti privi di attività. La presenza del gruppo –OH in posizione 3 non sembra essere necessaria ai fini dell’attività ma, se è presente, il trans-OH risulta essere più attivo del cis-trans-OH. L’introduzione di un doppio legame 3-4 abolisce l’attività antischemica suggerendo che un carbonio sp3 è preferibile in posizione C459. Anche la presenza di un gruppo elettronattrattore in posizione 6 dell’anello benzopiranico sembra indurre una maggiore efficacia; queste conclusioni sono supportate dalla sostituzione in posizione 6 con un gruppo nitro. La sua rimozione provoca infatti una diminuzione della sua potenza antischemica60.
Con l’intento di approfondire lo studio dei rapporti struttura attività di questi derivati benzopiranici, sono stati sintetizzati degli analoghi che presentano in posizione 4 un gruppo solfonamidico.
La disostituzione del raggruppamento solfonamidico sembra garantire una maggiore efficacia rispetto agli analoghi mono e disostituito61. In questa serie di composti il derivato diisobutilsolfonamidico ha dimostrato essere il più potente composto della
serie (Fig. 5). Questo derivato è circa 100 volte più selettivo per il tessuto cardiaco di BMS-180448. O N H N NC NH Cl OH S O O N Figura 5.
•
STUDI SULLA SOSTITUZIONE IN POSIZIONE 4
Per quanto riguarda le modifiche strutturali a carico della posizione 4 del nucleo benzopiranico è stato osservato che sostituenti fenilcianoguanidinici o fenilureici favoriscono fortemente la cardioselettività (fig. 6).
O N H NH OH NCN NC O N H NH OH O NC O N H Y OH X R NC Figura 6.
La sostituzione dell’azoto anilinico con bioisosteri come O, S o con un metilene porta a composti inattivi indicando che in questi derivati l’azoto anilinico è necessario ai fini dell’attività antischemica. L’inserimento di un gruppo etilenico o di un atomo di azoto tra l’anello fenilico e l’azoto della porzione cianoguanidinica ha portato a una diminuzione dell’attività, confermando che le porzioni fenilureica e/o fenilcianoguanidinica sono requisiti strutturali essenziali per garantire l’attività (fig. 6). Inoltre l’inserimento di piccoli gruppi elettronegativi sul fenile della porzione ureica o cianoguanidinica, come Cl, NO2, o CF3, e di piccoli gruppi alchilici è ben tollerata.
La sostituzione del fenile della porzione ureica o cianoguanidinica (fig. 6) con la 2-piridina o la 3-2-piridina è tollerata59.
•
BENZOPIRANI 4-(N-ARIL)-SOSTITUITI
BMS-180448 mostrò di avere una maggiore selettività cardiaca rispetto al cromakalim, ma manteneva una residua attività vasorilasciante. Nel tentativo di limitare gli effetti vasodilatatori di questo composto sono stati sintetizzati benzopirani 4-(N-aril)-sostituiti62, a partire dalla struttura del derivato 1 (Fig. 7).
O N OH NC EtOOC O OH NC N R 1 Figura 7.
Un confronto tra il derivato 1 (fig. 7) e l’analogo senza l’estere mostra che un secondo sostituente sull’azoto dell’anilina contribuisce poco all’attività antischemica sebbene migliori la selettività cardiaca attraverso una riduzione dell’attività vasorilasciante. L’analogo con l’acido carbossilico risulta privo di attività antischemica.
Gli analoghi 4-fluoro e 4-cloro, sostituiti sull’anello fenilico legato all’azoto in posizione 4, mantengono l’attività antischemica indicando che l’anello aromatico può essere sostituito60.
Considerando che gruppi esterei sono labili e possono essere dissociati, portando così all’acido carbossilico, risultato privo di attività, gli studi si sono concentrati nel sintetizzare analoghi con attività simile al gruppo estereo.
Il gruppo estereo è stato sostituito con un gruppo ammidico, etereo, e con un nitrile. Questi derivati hanno mostrato una diminuzione dell’attività.
L’analogo fosfonato ha mostrato una attività simile al derivato 1 (fig. 7) con l’estere etilico, mentre sia l’analogo solfonato, che quello n-acetilato hanno mostrato una diminuzione della potenza.
Questi risultati mostrano che esistono limitazioni per quanto riguarda la sostituzione su questa porzione.
L’estere etilico è stato infine sostituito con un eterociclo e, tra i vari derivati, quelli con l’anello imidazolico hanno mostrato una buona attività.
Il derivato BMS-191095 è il più potente composto della serie. BMS-191095 ha mostrato di possedere la più alta efficacia antischemica e la più alta selettività.
O N N NH Cl OH NC BMS-191095
Allo scopo di investigare la stereoselettività di questi composti riguardo alla attività antischemica sono stati sintetizzati i singoli enantiomeri (3S,4R) e (3R,4S) dei composti indagati e ne è stata valutata l’attività biologica60.
Riguardo alla potenza antischemica l’attività risiede nell’enantiomero 3R,4S. Non si evidenziano invece differenze sostanziali nell’attività vasorilasciante. Si può pertanto
concludere che esistono differenti relazioni struttura-attività in riferimento alla potenza antischemica e alla attività vasorilasciante.
Come per tutti i composti della serie anche per BMS-191095 la maggiore attività cardioprotettiva è dovuta all’enantiomero 3R,4S, mentre l’enantiomero 3S,4R mostra una leggera attività antischemica a concentrazioni maggiori di 10 µM 62.