30
Capitolo 2: Inibitori delle MMPs
Il primo approccio usato nella ricerca di inibitori sintetici delle MMPs è stato il design di composti peptidomimetici substrate-based, a partire cioè da informazioni sulla sequenza amminoacidica intorno al sito di idrolisi del substrato. Più recentemente sono stati sintetizzati anche inibitori non peptidici, grazie all’ottenimento di informazioni strutturali dettagliate dai complessi enzima-inibitore cristallizzati ed analizzati con la cristallografia a raggi X e con tecniche di NMR multidimensionale. La conoscenza delle strutture tridimensionali e delle interazioni enzima-inibitore ha reso poi possibile un design razionale di nuovi inibitori structure-based, assistito dal computer. Comunque la distinzione tra composti progettati con l’approccio substrate-based e quelli progettati secondo l’approccio structure-based è piuttosto artificiale: infatti, la maggior parte degli inibitori scoperti con il secondo metodo, sono analoghi dei composti scoperti nei primi anni ’90 con il primo metodo.
Uno dei problemi chiave nello sviluppo clinico degli inibitori delle MMPs riguardava l’identificazione della strategia ottimale per ottenere l’inibizione: se, cioè, fosse meglio sviluppare inibitori a largo spettro, attivi su un numero elevato di enzimi diversi, oppure se fosse più conveniente sviluppare inibitori selettivi verso un particolare gruppo di MMPs 19. Dati i risultati insoddisfacenti ottenuti in campo clinico dalle terapie che facevano uso di inibitori a largo spettro, attualmente la ricerca si è rivolta alla progettazione e sintesi di composti selettivi.
I requisiti necessari perché un composto possa essere un inibitore efficace delle MMPs sono:
• la presenza di un gruppo funzionale capace di chelare l’atomo di zinco catalitico presente nel sito attivo dell’enzima (detto zinc-binding-group o ZBG);
31
• la presenza di almeno un gruppo funzionale capace di formare legami a idrogeno con l’enzima;
• la presenza di una o più catene laterali in grado di stabilire interazioni di Van der Waals con i sottositi dell’enzima.
I primi inibitori delle MMPs furono progettati per omologia con la sequenza amminoacidica in corrispondenza della quale viene idrolizzato il collagene umano da parte della MMP-1 e in seguito utilizzando le informazioni derivanti da studi di specificità per il substrato.
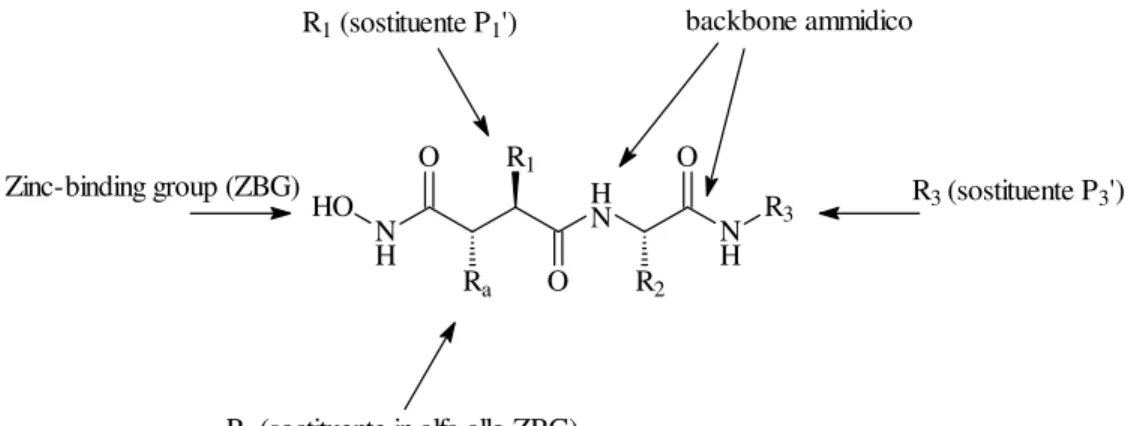
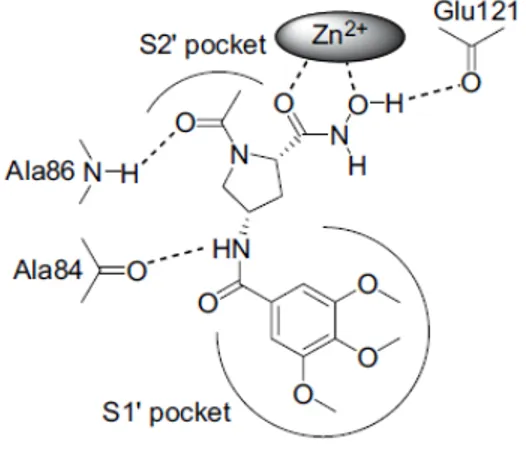
La sequenza amminoacidica presente nel sito di cleavage è glicina-isoleucina. La nomenclatura standard usata per le proteasi è S1, S2, S3, S1', S2', S3' per i sottositi dell’enzima, e P1, P2, P3, P1', P2', P3' per i corrispondenti gruppi presenti nel substrato o nell’inibitore, che interagiscono con tali siti a partire dal sito di idrolisi. Sono state sviluppate tre classi di composti: quelli in cui lo ZBG è circondato da residui amminoacidici da entrambi i lati, quelli in cui i residui sono presenti solo sul lato di sinistra e quelli in cui i residui sono presenti solo sul lato di destra dello ZBG (Fig.2.1). In generale, mostravano una maggiore attività quei composti che mimavano la sequenza amminoacidica presente alla destra del sito di idrolisi (P1' e P2') e che possedevano uno ZBG costituito da un acido idrossammico.
Paragonando, infatti, inibitori aventi ZBG diversi, ma con il resto della struttura uguale, emerse che l’attività inibitoria calava nell’ordine idrossammato > fosfinato >
amminocarbossilato > carbossilato. Il gruppo idrossammato agisce come un chelante bidentato, con ciascun atomo di ossigeno ad una distanza ottimale (1.9-2.3 A) dallo zinco catalitico; la posizione dell’azoto suggerisce che sia protonato e che formi un legame a idrogeno con un ossigeno carbonilico dello scheletro dell’enzima. I composti contenenti un gruppo idrossammato sono quindi gli inibitori più potenti, ma presentano
32
gli inconvenienti di una rapida escrezione per via biliare e della suscettibilità all’idrolisi al corrispondente acido carbossilico in vivo, fattori che possono limitare la loro utilità come agenti terapeutici. Un altro problema è rappresentato dalla tossicità degli idrossammati, dovuta alla degradazione metabolica ad idrossilammina. Tuttavia la sostituzione del gruppo idrossammato con altri gruppi (come tiolo o fosfonato), conduce a composti con gli stessi problemi farmacocinetici, mentre altri gruppi (come carbossilato) danno luogo a composti meno tossici, ma con un’affinità di legame per l’enzima significativamente ridotta 20. Uno dei problemi principali degli inibitori delle proteasi è la loro mancanza di selettività verso le differenti MMPs.
Tali enzimi sono classificati in due gruppi principali in base alle caratteristiche della tasca S1' (detta anche tasca di selettività):
• gli enzimi che possiedono una tasca S1' profonda (come MMP2, 3, 8, 9, -13);
• gli enzimi che possiedono una tasca di specificità più piccola (come MMP-1,-7, -11 tra gli altri) a causa della parziale occlusione da parte di residui amminoacidici più ingombranti, come quelli in posizione 193 (secondo la numerazione dell’MMP-8), che da una Leu nell’MMP-8 diviene Arg nell’MMP-1, Tyr nell’MMP-7 e Gln nell’MMP-11.
Così, introducendo nella struttura dell’inibitore gruppi P1' estesi (come un bifenile) sono stati ottenuti composti selettivi per gli enzimi a tasca profonda, mentre la presenza di gruppi P1' più piccoli conduce ad inibitori a largo spettro.
Il sottosito S2' è una fessura esposta al solvente con una preferenza per i residui P2' idrofobici, sia nel substrato che negli inibitori. Il sottosito S3' è una regione esposta al solvente, non molto ben definita. S2' e S3' non hanno un ruolo dominante nel legame all’inibitore ed è difficile utilizzarli per ottimizzare la selettività. Sostituzioni a livello di
33
questi sottositi hanno invece permesso di migliorare la biodisponibilità per via orale e la solubilità 21.
Ad oggi, dal punto di vista strutturale gli inibitori delle MMPs possono essere divisi in tre classi:
1. Inibitori chelanti lo Zinco catalitico mediante ZBG 2. Inibitori che non sfruttano il legame con lo Zinco 3. Inibitori Mechanism-based
34
2.1. Inibitori sintetici della MMP-2
2.1.1. Design e sintesi.
Studi di relazione struttura-attività (SAR) hanno dimostrato che i derivati succinici sono inibitori migliori rispetto a quelli malonici o glutarici.
N H H N N H R3 HO O Ra R1 O R2 O backbone ammidico R3 (sostituente P3')
Ra (sostituente in alfa allo ZBG)
Zinc-binding group (ZBG)
R1 (sostituente P1')
Fig. 2.1: Struttura dei derivati peptidici 3
Di questa classe fanno parte il Batimastat e il Marimastat, due inibitori ad ampio spettro che sono attualmente in fase III dello sviluppo clinico.
Possiedono un sostituente in α all’acido idrossammico, che nel caso del Batimastat è un tieniltiometilene, mentre nel caso del Marimastat è un ossidrile. La presenza dell’ossidrile aumenta l’idrosolubilità del Marimastat e fa si che questo composto possa essere assorbito per via orale, cosa che invece non è possibile per il Batimastat.
35 HO N H H N NHMe O S O O S HO N H H N NHMe O O O OH Batimastat Marimastat - Modificazioni in P1'
Il sottosito S1', è una tasca che penetra nella superficie dell’enzima e determina la selettività degli inibitori per una MMP invece che per un’altra, poiché esiste molta differenza tra i residui amminoacidici che formano questa tasca nelle varie matrixine. Incorporando nelle molecole gruppi P1' (che interagiscono con la tasca S1') molto estesi si ottengono composti selettivi per le gelatinasi, mentre gruppi P1' di piccole dimensioni forniscono inibitori ad ampio spettro. Ad esempio, la presenza di un gruppo 3-fenilpropilico in P1' ha permesso di ottenere inibitori selettivi per la MMP-2 sia nei succinilidrossammati, come il composto 1, che nei carbossilati e fosfonati. Una catena alchilica lunga in P1', come nel composto 2, in cui è presente un C9, dà una ridotta inibizione in vitro della MMP-1, mantenendo invece una potente attività nei confronti delle gelatinasi 22.
36 HO N H H N NHMe O Ph O O
HO N H H N NHMe O O O C9H19 Composto 1 Composto 2 - Modificazioni in P2'
L’analisi cristallografica a raggi X dei complessi MMPs-inibitori ha rivelato che il gruppo P2' nei peptidomimetici a struttura succinilidrossammica è diretto fuori dall’enzima e stabilisce pochi contatti con la fessura S2'. Inoltre l’analisi SAR ha indicato che una modificazione del gruppo P2' ha, in generale, un modesto effetto sull’attività in vitro. Un triptofano in P2', come nel composto 3, fornisce inibitori più potenti rispetto ad altri residui amminoacidici. Il gruppo P2' ha, però, un notevole effetto sulle proprietà farmacocinetiche dell’inibitore: ad esempio un gruppo
t-butilico in P2' fornisce composti attivi per via orale, come il Marimastat ed il composto 4, selettivo per le gelatinasi. Si ritiene che un gruppo ingombrante in questa posizione schermi il legame ammidico adiacente, riducendo l’idratazione e, di conseguenza, la barriera energetica rappresentata dalla desolvatazione, necessaria affinché il peptidomimetico passi da un ambiente acquoso a quello lipidico delle
37 HO N H H N NHMe O O NH HO H N H N NH 2 O O O Cl Composto 3 Composto 4 - Modificazioni in P3'
L’introduzione di diversi sostituenti in P3', in generale, ha solo un modesto effetto sull’attività inibitoria.
Tecniche di molecular modeling hanno dimostrato che nella MMP-9 il sottosito S1' è costituito da una tasca, mentre nella MMP-2 presenta una forma a canale senza fondo, perciò questo enzima è più tollerante ad aumenti nella lunghezza dei sostituenti solfonammidici. Così, mentre la sostituzione del metile terminale presente nel composto 5 con un gruppo n-butilico aveva poco effetto sull’attività nei confronti della MMP-2, diminuiva di 300 volte l’attività del composto nei confronti della MMP-9.
HO NH S O O O HN S CH3
Composto 5
L’acido carbossilico 6, derivato dalla D-valina, ha mostrato una inibizione selettiva della MMP-2 e della MMP-3; la sostituzione in para sull’anello del bifenile determinava un
38
aumento della potenza rispetto al composto non sostituito e migliorava anche il profilo farmacocinetico. Il carbossilato 6 si è dimostrato in grado di raggiungere alte concentrazioni plasmatiche con una emivita prolungata (38-48 ore).
Il composto 7 è stato inizialmente concepito come inibitore della MMP-3 contro l’osteoartrite, ma si è invece rivelato un potente inibitore delle gelatinasi. La sostituzione del bifenile con un fenile ha diminuito l’attività, mentre la sostituzione in 4' al bifenile con Cl o piccoli sostituenti alcossilici ha aumentato l’attività: questo a riprova del fatto che il gruppo bifenilico va ad occupare la tasca S1'. 3
HO N H S O O O Br
N O O HO O O Cl
Composto 6 Composto 7
E’ stata ideata anche una serie di succinilcarbossilati a partire dal composto 8 in cui il gruppo bifenilpropilico in P1' ha conferito selettività per gli enzimi a tasca profonda. Aggiungendo un gruppo ciano in 4' al bifenile è aumentata leggermente l’attività verso la MMP-2 e si è prevenuta una potenziale ossidazione enzimatica. Quando al posto del gruppo propilico in P1' è stato inserito un eterociclo a 5 termini, è stato ottenuto un incremento notevole dell’attività.Infine, con la sostituzione del frammento P2'-P3' con un amminopentalattone, per diminuire il carattere peptidico, e la riorientazione del pirrolo in P1', è stato ottenuto il composto attivo per via orale 9, che è attualmente in fase di indagine pre-clinica.3
39 HO2C HN N H O O CO2Me HO2C HN N CN O O O Composto 8 Composto 9
Il gruppo di Rossello ha sviluppato inibitori idrossammici selettivi verso l’MMP-2 come potenti agenti anti-angiogenici. L'aggiunta di sostituenti alchilici al carbonio adiacente all’idrossammato provvede ad effettuare interazioni lipofile con la tasca S1 del sito attivo e migliora la selettività verso l’MMP-2. L’inibitore 10 è uno dei più selettivi della serie verso l’MMP-2 (>18-volte rispetto a MMP-8, -9, e -14 e >500-volte rispetto a MMP-1, -3, e -7). HO N H O N O S O O
Composto 10
Il gruppo di Auge et al. 23 ha introdotto l’idrazide e la sulfonilidrazide come analoghi
dell’idrossammato Illomastat. L’idrazide come ZBG è isostero dell’acido idrossammico e chela lo zinco in modo bidentato, sebbene gli inibitori in questione risultino meno potenti dell’Illomastat. Di grande rilievo, tuttavia, risulta il fatto che entrambi i composti possono essere derivatizzati al fine di sondare entrambe le tasche laterali al
40
sito attivo. Il sulfonilidrazide 11 è un potente inibitore dell’MMP-1 (IC50=30 nM), MMP-2 (IC50=9.8 nM), e MMP-9 (IC50=3 nM). Il docking della molecola 11 nell’MMP-2 e nell'MMP-9 ha mostrato che lo ZBG può effettuare due legami a idrogeno con il backbone peptidico in modo molto simile agli inibitori idrossammici. Il modeling computazionale ha predetto, inoltre, che il backbone dell’inibitore mira alle tasche S2, S1' e S2'. B r S O O H N N H O O H NH NH O N H Composto 11
E' stata concepita anche una classe di composti a struttura N-formilidrossilamminica (retroidrossammati), in cui il tipico ZBG idrossammato è stato sostituito con un
retroidrossammato e il sostituente in α allo ZBG con una idantoina. Questi composti si sono rivelati potenti, a lunga emivita e biodisponibili per via orale, come il composto 12. Il composto 12 è un inibitore selettivo di MMP-2, solo moderatamente attivo nei confronti di MMP-9. La sostituzione del legame etereo di 12 con un gruppo solfonico ha condotto ad un sostanziale incremento dell’attività verso MMP-9. Lo studio su questa classe di composti è culminato con la scoperta del composto 13, un potente inibitore delle due gelatinasi, che grazie alle importanti caratteristiche farmacocinetiche, può essere somministrato una sola volta al giorno.
Questo composto ha mostrato una significativa riduzione della crescita tumorale in modelli animali ed è attualmente nella fase I dello sviluppo clinico 24.
41 N N H O O O N HO O H O F F F
O O S NOH H O O O O O F F F
Composto 12 Composto 13
Altra classe interessante di composti è rappresentata dagli inibitori ditiolici, composto 14 e composto 15. Si tratta di inibitori slow-binding selettivi per MMP-2 e MMP-9 con valori di Ki nell’ordine del nanomolare (46-260 nM). Questi composti inibiscono anche l’MMP-14 con affinità simile (~ 200nM), ma in questo caso per l’inibizione è stato osservato solo un meccanismo di tipo competitivo. La lunghezza della catena laterale del ditiolo (4 o 5 atomi di carbonio) praticamente non influenza il legame dell’inibitore all’enzima 25. O S SH O O SH
O S SH SH O O
Composto 14 Composto 15
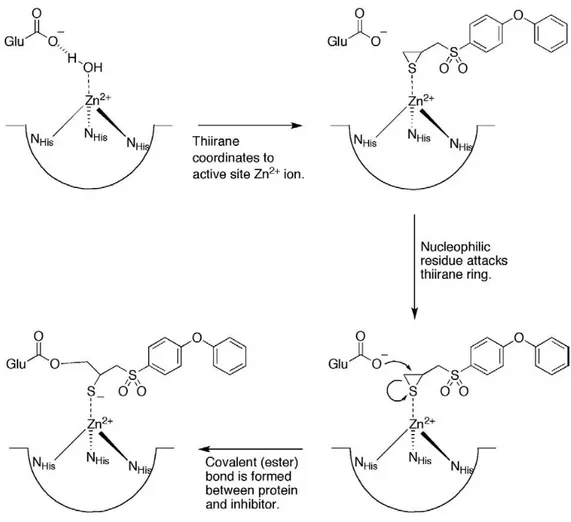
Il gruppo di Mobashery et al.23 ha introdotto la molecola 16 (SB-3CT), come primo
inibitore mechanism-based delle MMP. Tale composto si lega al sito attivo e forma un legame covalente con la proteina, in seguito a coordinazione con lo Zn2+. Ciò impedisce da una parte la dissociazione, caratteristica dei tradizionali inibitori chelanti competitivi, e dall’altra, assicurando un ridotto turnover catalitico, fa si che occorra meno inibitore per saturare il sito attivo dell’enzima. Il composto 16 è un inbitore selettivo di MMP-2 e MMP-9 e si è dimostrato promettente in studi preclinici come inibitore delle metastasi
42
alle ossa nel tumore alla prostata e nella prevenzione del danno causato da ischemia cerebrale. O S S O O Composto 16 (SB-3CT)
La sua struttura è relativamente semplice e ciò è rispecchiato dal suo peso molecolare. Il backbone è un difeniletere, motivo noto per il legame alla tasca S1' e presente in molti MMPi. La molecola coordina lo Zn2+ attraverso il solfuro dell’anello tiranico; questa coordinazione monodentata forma un Zn2+ tetraedrico, confermato anche da spettroscopia a raggi-X di assorbimento. Il backbone e il solfuro dell’anello tiranico sono connessi da un solfone e un linker metilenico. Gli atomi di ossigeno del solfone sono predisposti al legame a idrogeno con gli idrogeni dell’amide del backbone proteico tra Leu191 e Ala192 . Questo tipo di legame è stato osservato in altri inibitori solfonici. Composti, invece, con due o tre gruppi metilenici tra il solfone e l’anello tiranico risultano inattivi; questo perché l’anello tiranico non si posiziona in modo giusto dentro la sfera di coordinazione dello Zn2+. Il meccanismo di inibizione di 16 è molto simile a quello di un substrato suicida, nel quale un gruppo funzionale attivato porta ad una modifica covalente nel sito attivo dell’enzima. È stato suggerito che l’anello tiranico, attivato al momento del legame con lo zinco catalitico, porta all’apertura dell’anello stesso, grazie all’attacco nucleofilo del Glu404 del sito attivo; questo perché si viene a formare un legame estereo covalente tra il carbonio dell’anello tiranico e il Glu404. Questo legame ancora l’inibitore nel sito attivo, riducendo in modo sensibile la dissociazione del complesso.
43
Fig. 2.2: Schema del meccanismo d’azione di 16
Il legame di 16 è pressoché irreversibile; a seguito del 95% di inbizione, l’MMP-2 recupera il 50% di attività solo dopo 3 giorni di dialisi. D’altra parte questa molecola non è un inibitore suicida a tutti gli effetti, dal momento che, già dopo alcuni minuti, l’enzima tende a recuperare la sua attività, grazie a processi di idrolisi che liberano il sito catalitico. Si parla, tuttavia, di processi molto lenti.
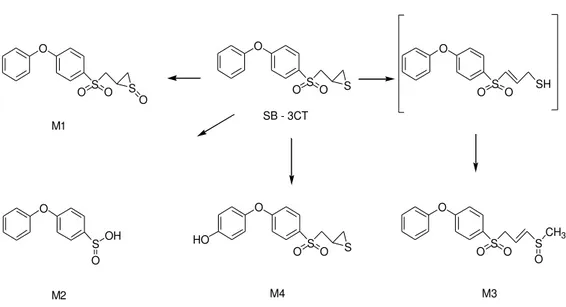
Il gruppo di Lee et al. 26 ha studiato i prodotti del metabolismo di 16; questo perchè il composto 16 è un potente inibitore della MMP-2 che viene rapidamente metabolizzato in vivo. Sulla base di questa osservazione è stato ipotizzato che affinché 16 potesse essere un potente inibitore, nonostante venisse rapidamente idrolizzato, i prodotti del metabolismo dovessero essere molecole ancora attive sulla MMP-2.
44
Fig. 2.3: Prodotti del metabolismo di SB-3CT
M4 si è dimostrato essere un potente inibitore della MMP-2, con profilo di inibizione molto simile a quello del composto 16.
Il gruppo di Zhang et al. 27 ha sintetizzato derivati dell'idrossiprolina, conteneti acido cinnamico e acido caffeico. L'acido cinnamico è stato scelto in quanto ha dimostrato di inibire il cancro al polmone, l'acido caffeico in quanto ha dimostrato di inibire la MMP-2 e la MMP-9. O S S O O O S S O O O S O O O SH O S S O O O S O S O O HO OH O S CH3 O SB - 3CT M1 M2 M4 M3
45 Composto R IC50 MMP-2 (nM) A0 H 11,2 A1 CH3CO 128,4 A2 CH3CH2CO 98,1 A3 CH3CH2CH2CO 85,6 A4 C6H5CO 52,4 A5 p-Cl-C6H5CO 31,8 A6 259,5 A7 C6H5CH2CH2CO 43,6 A8 C6H5CH=CHCO 5,2 A9 p-CH3O-C6H4CH=CHCO 12,3
A10 3,4-(OMe)2 C6H3CH=CHCO 13,1
Tab. 2.1: Inibitori Serie A
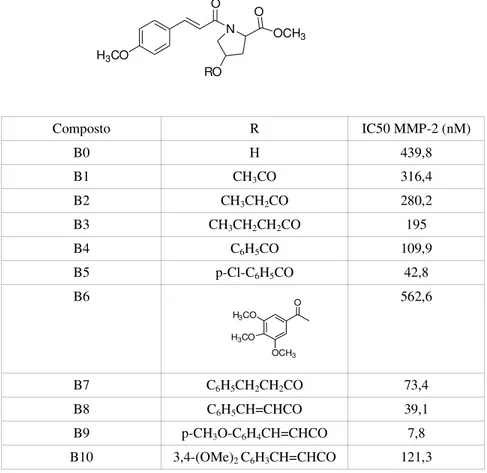
N O OCH3 RO O H3CO H3CO OCH3 O
46 Composto R IC50 MMP-2 (nM) B0 H 439,8 B1 CH3CO 316,4 B2 CH3CH2CO 280,2 B3 CH3CH2CH2CO 195 B4 C6H5CO 109,9 B5 p-Cl-C6H5CO 42,8 B6 562,6 B7 C6H5CH2CH2CO 73,4 B8 C6H5CH=CHCO 39,1 B9 p-CH3O-C6H4CH=CHCO 7,8 B10 3,4-(OMe)2 C6H3CH=CHCO 121,3
Tab. 2.1: Inibitori Serie B
N O OCH3 RO O H3CO H3CO H3CO OCH3 O
47 Composto R IC50 MMP-2 (nM) C1 CH3CO 320,1 C2 CH3CH2CO 293,4 C3 CH3CH2CH2CO 221,1 C4 C6H5CO 201,2 C5 p-Cl-C6H5CO 111,8 C6 - C7 C6H5CH2CH2CO 168,3 C8 C6H5CH=CHCO 86,5 C9 p-CH3O-C6H4CH=CHCO 28,7 C10 3,4-(OMe)2 C6H3CH=CHCO 9,7
Tab. 2.3: Inibitori Serie C
Con catena laterale R alifatica, lunga, e flessibile i composti hanno mostrato una migliore attività nei confronti delle gelatinasi.
Fig. 2.4: Docking del composto A8 nel dominio catalitico della MMP-2
N O OCH3 RO O H3CO H3CO H3CO H3CO OCH3 O
48
Fig. 2.5: Docking dei composti B9 e C10 nel dominio catalitico della MMP-2 Il gruppo estereo chela lo zinco catalitico (166).
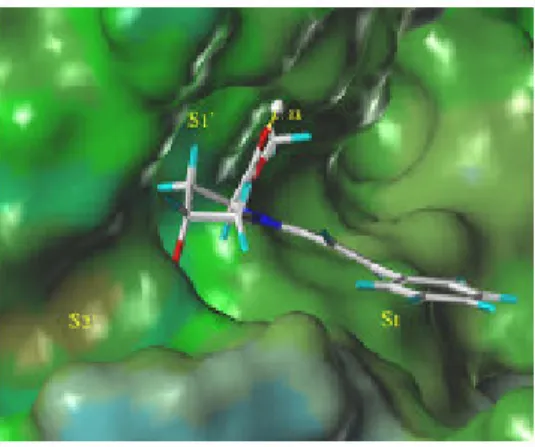
La catena laterale idrofoba C4 si estende nella tasca S1' dell'enzima, mentre la catena N1si inserisce nella tasca S1.
Il gruppo di Cheng at al. 28 ha sintetizzato analoghi del composto 17 (LY52).
Composto 17 (LY52)
Il composto 17 è un derivato pirrolidinico in grado di inibire l'attività proteolitica della MMP-2. O O O N O NHOH NH O N N R2 O R3 R1 O
49
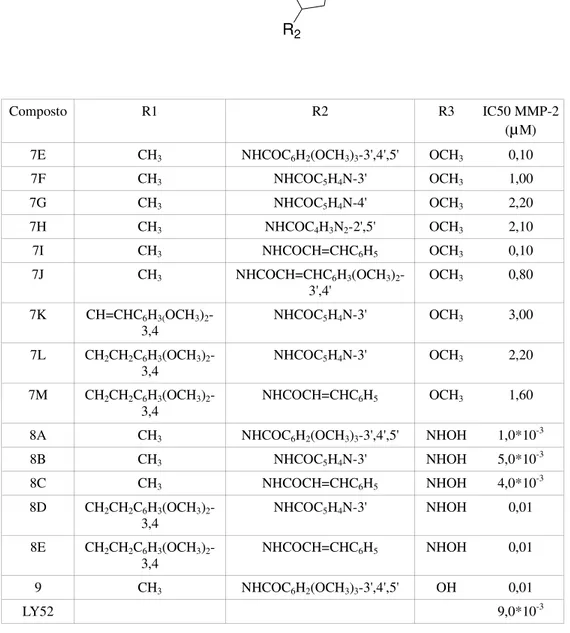
Composto R1 R2 R3 IC50 MMP-2
(µM) 7E CH3 NHCOC6H2(OCH3)3-3',4',5' OCH3 0,10
7F CH3 NHCOC5H4N-3' OCH3 1,00 7G CH3 NHCOC5H4N-4' OCH3 2,20 7H CH3 NHCOC4H3N2-2',5' OCH3 2,10 7I CH3 NHCOCH=CHC6H5 OCH3 0,10 7J CH3 NHCOCH=CHC6H3(OCH3)2 -3',4' OCH3 0,80 7K CH=CHC6H3(OCH3)2 -3,4 NHCOC5H4N-3' OCH3 3,00 7L CH2CH2C6H3(OCH3)2 -3,4 NHCOC5H4N-3' OCH3 2,20 7M CH2CH2C6H3(OCH3)2 -3,4 NHCOCH=CHC6H5 OCH3 1,60 8A CH3 NHCOC6H2(OCH3)3-3',4',5' NHOH 1,0*10-3
8B CH3 NHCOC5H4N-3' NHOH 5,0*10-3 8C CH3 NHCOCH=CHC6H5 NHOH 4,0*10-3 8D CH2CH2C6H3(OCH3)2 -3,4 NHCOC5H4N-3' NHOH 0,01 8E CH2CH2C6H3(OCH3)2 -3,4 NHCOCH=CHC6H5 NHOH 0,01 9 CH3 NHCOC6H2(OCH3)3-3',4',5' OH 0,01 LY52 9,0*10-3
Tab. 2.4: Attività inibitoria derivati pirrolidinici
I composti 8A-8E si sono dimostrati inibitori più potenti dei loro predecessori 7E-7M. Questa differente attività è dovuta al gruppo ZGB (COR3), carbossilato nella serie 7E-7M e idrossamato nella serie 8A-8E.
Il composto 9 è l'unico composto che pur contenendo il gruppo carbossilico come ZGB, mantiene la stessa potenza degli idrossammati.
N
R2
O
R3 R1 O
50
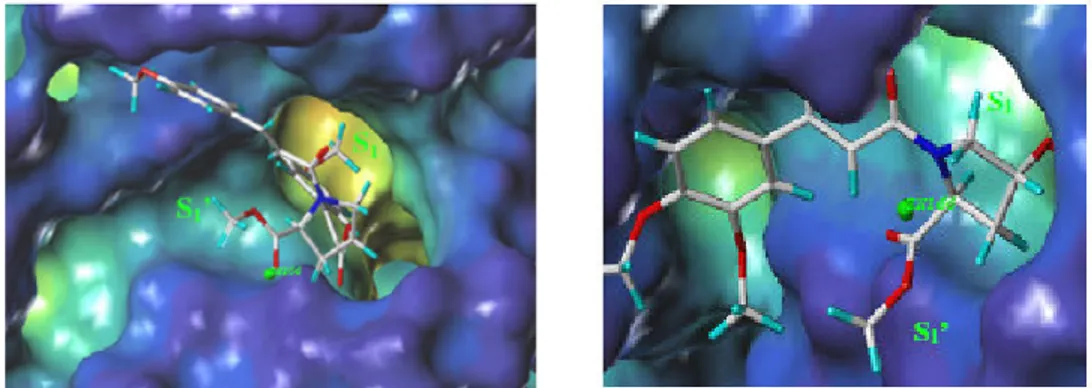
Il composto 8A è risultato essere il più potente inibitore della MMP-2 della serie.
Fig. 2.6: Docking composto 8A nel dominio ctalitico della MMP-2
51
2.2. Inibitori sintetici della MMP-12
2.2.1. Design e sintesi.
L’ottenimento della struttura a raggi X dell’enzima cristallizzato ha permesso di ottenere inibitori sintetici potenti nei confronti della MMP-12 come l’Ilomastat con IC50=1nM. Studi clinici tuttavia hanno dimostrato una mancanza di specificità d’azione, che si traduceva nella comparsa di effetti collaterali non accettabili, quali infiammazione articolare e dolori muscolo-scheletrici, attribuiti all’interazione di tali inibitori con diverse MMPs. Da tali studi si evince, dunque, che per aumentare la selettività ed evitare gli effetti indesiderati associati all’utilizzo di inibitori ad ampio spettro, è necessario che il design di nuovi inibitori si basi sull’utilizzo di strutture contenenti un debole gruppo chelante lo zinco e specifici gruppi (P1’) che interagiscono con la sottotasca S1’, specific loop, ovvero la regione del sito attivo con minore omologia strutturale tra le varie MMPs 29.
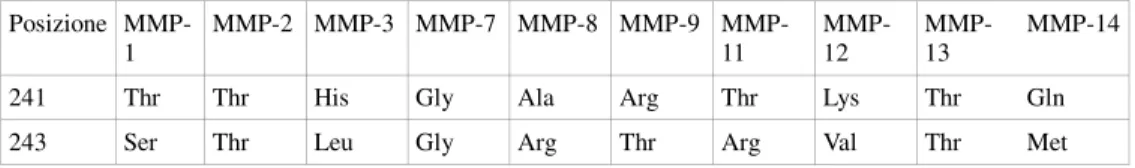
Ilomastat Posizione MMP-1 2 3 7 8 9 MMP-11 MMP-12 MMP-13 MMP-14 241 Thr Thr His Gly Ala Arg Thr Lys Thr Gln 243 Ser Thr Leu Gly Arg Thr Arg Val Thr Met
Tab. 2.5: Variabilità nella composizione amminoacidica a livello di due posizioni del loop S1' nelle varie MMPs 14 H N N H O H N H N HO O O
52
Per ottenere inibitori altamente selettivi della MMP-12, il gruppo di Devel et al.30 ha
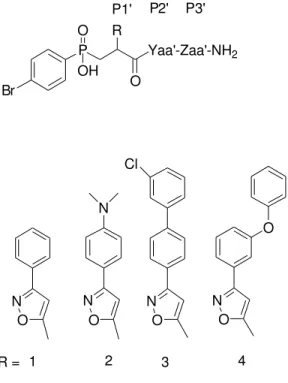
preparato una libreria di peptidi fosfinici con formula generale p-Br-Ph-(PO2-CH2)-Xaa’-Yaa’-Zaa’-NH2. I peptidi fosfinici sono capaci di mimare lo stato di transizione del substrato dell’enzima svolgendo una potente azione inibitoria verso varie zinco-proteasi. Per indirizzare tale attività verso la MMP-12, i peptidi preparati presentavano un sostituente R che si inseriva nella sottotasca S1’ del dominio catalitico della MMP-12 e due residui amminoacidi P1’ e P2’ che interagivano rispettivamente con le sottotasche S2’ e S3’. In particolare, il sostituente R presentava un anello isossazolico, fondamentale per orientare la porzione P1’ nella giusta posizione.
Fig. 2.8: Libreria di peptidi fosfinici con la formula generale p-Br-Ph-(PO2-CH2)-Xaa’-Yaa’-Zaa’-NH2
Ruolo della porzione P1’:
Tali composti avevano attività modesta nei confronti della MMP -1 e della MMP-7; questo era probabilmente dovuto alle ridotte dimensioni della sottotasca S1’ in tali
Br P Yaa'-Zaa'-NH2 O OH R O P1' P2' P3' R = 1 N 2 Cl 3 O 4 N O N O N O N O
53
enzimi, incapace di accogliere una lunga ed ingombrante catena. Per quanto riguardava l’attività inibitoria verso la MMP-12, gli inibitori con sostituente R3 erano più potenti, mentre quelli con sostituente R2 erano più selettivi.
Ruolo della porzione P2’:
La presenza in questa posizione di un residuo aminoacidico aromatico abbassava la selettività verso la MMP-12, mentre la presenza di una prolina aumentava la selettività e diminuiva la potenza dell’inibitore. La maggior selettività si è manifestata con la presenza di un glutammato nella porzione P2’.
Ruolo della porzione P3’:
Confrontando vari inibitori che presentavano nella porzione P1’ la catena R2, nella porzione P2’ un residuo di glutammato e nella porzione P3’ vari residui aminoacidici tra cui asparagina, glutammina, aspartato e glutammato, quello sostituito con glutammato (composto 2) mostrava la maggiore selettività verso la MMP-12 mentre la sostituzione con residui aminoacidici basici diminuiva marcatamente la selettività. L’inibitore contenente R3 nella posizione P1’ e due residui di glutammato nelle posizioni P2’ e P3’ (composto 1) mostrava la stessa selettività del composto 2 ma una potenza maggiore.
54
Attraverso uno studio di Molecular Modeling, è stato visto che nel composto 1 il residuo di glutammato in posizione P2’ si inseriva nella sottotasca S2’ in prossimità di un residuo di treonina (Thr239). Ad eccezione della MMP -1 e della MMP-7, le MMPs possiedono in tale posizione residui aminoacidici idrofobici. Inoltre il residuo di glutammato in posizione P3’ si inseriva nella sottotasca S3’ per trovarsi vicino ad un residuo di lisina (Lys177); la maggior parte delle MMPs presentano in tale posizione un residuo di prolina. Dunque, la selettività del composto 1 potrebbe essere dovuta all’interazione diretta del glutammato con tali residui nella MMP-12, oppure alla presenza, in queste posizioni, di residui idrofobi nelle altre MMPs che costituiscono a formare un ambiente sfavorevole per la catena laterale del glutammato.
Questi studi dimostrano che le dimensioni e la struttura della porzione P1’ contribuiscono significativamente alla potenza e alla selettività dell’inibitore verso la MMP-12, ma sono altrettanto importanti per la selettività le porzioni P2’ e P3’ dell’inibitore.
Il composto 18 (acido (S)-2-(8-(methoxycarbonylamino)dibenzo[b,d]furan-3-sulfonamido)-3-methylbutanoico), sintetizzato dal gruppo Mansour et al 31, mostrava in
vitro un’elevata potenza e selettività verso la MMP-12 e, testato su un modello di topo affetto da infiammazione polmonare MMP-12 indotta, dimostrava di essere efficace anche in vivo mantenendo un buon profilo di selettività verso le MMPs.
Composto 18 HOOC HN S O O O H N O O
55
IC50 (nM) MMP-12 in differenti specie
Uomo topo Ratto Pecora
2 160 320 22
IC50 (nM) per le altre MMPs
MMP-1 MMP3 MMP-9 MMP-12
>6 μM 351 1300 2
Tab. 2.7: Profilo di attività e selettività del composto 18.
Il carbossilato si comporta da ZBG, mentre la porzione bifenilica si inerisce nella tasca S1’ del sito attivo. L’anello furanico si trova a contatto con il solvente. La sostituzione in posizione 8 dell’anello fenilico con un carbammato e la presenza di un angolo diedro di 30° tra i due fenili rappresentavano dei fattori importanti per la selettività dell’inibitore, date le grandi dimensioni della tasca S1’ della MMP-12.
Mediante vari studi di metabolismo in vitro, è stato visto che il carbammato 18 risultava possedere un t1/2 > 60min e attualmente, esso è in fase preclinica di sviluppo.
Esistono anche inibitori delle MMPs non zinco chelanti, i cosiddetti “exosite-binders”. Si tratta di inibitori allosterici non competitivi che non presentano un ZBG.
Un studio effettuato daDublanchet et al32, descriveva una nuova classe di inibitori della MMP-12 capaci di inibire l’attività proteolitica dell’enzima senza interagire con lo zinco catalitico, ma legando siti distanti da quello attivo. Il legame dell’inibitore con l’enzima provocava un cambiamento della conformazione dell’enzima con conseguente riduzione del potere catalitico. La cristallografia a raggi X mostrava un’interazione di tipo idrofobico di tali inibitori con i residui aminoacidici presenti nella tasca S1’ della MMP-12. Il composto 19 rappresenta il lead di questa classe di inibitori e manifesta un
56 potere inibitorio a concentrazioni micromolari.
Composto 19
Fig. 2.9: Struttura a raggi X del dominio catalitico della MMP-12 complessato con il composto 11. Le regioni idrofobiche sono colorate in marrone, mentre quelle polari sono in blu.
Una nuova classe di inibitori non peptidici della MMP-12 , anch'essi capaci di inibire l’attività proteolitica dell’enzima senza interagire con lo zinco catalitico, è stata studiata dal gruppo di Morales et al.33
. Il gruppo di Morales ha studiato l'interazione di tre diversi inibitori non peptidici con il dominio catalitico della MMP-12.
HOOC HN O
S
57
Fig. 2.10: PF-00356231(20); CP-271484(21); PD-0359601(22)
Lo studio ha rivelato che tutti e tre i composti interagiscono con l'enzima a livello del loop S1', mostrando, tuttavia, diversi gradi di interazione con l'atomo di zinco catalitico.
La struttura del complesso enzima-inibitore, per i composti 20 e 21, ha rivelato che il nucleo morfolinico centrale, e l'anello tiofenico, rispettivamente, vanno a posizionarsi sopra l'atomo di zinco, ad una distanza di circa 5A °; in questo modo abbiamo che questi inibitori svolgono attività catalitica non per azione diretta sull'atomo di zinco, ma per interazione con punti distanti dallo zinco. Entrambi i composti sono risultati attivi, ma non selettivi, sulla MMP-12 nell'ordine del micromolare.
A differenza di 20 e 21, che sono risultati inibitori non chelanti dello zinco, la struttura del complesso enzima-inibitore per 22, ha mostrato che il composto circonda quasi
S HN OH O O PF- 00356231 N O O N S CH3 O O CP- 271485 N O O O O HO O PD- 359601
58
completamente l'atomo di zinco catalitico; in questo modo l'acido carbossilico della molecola chela l'atomo di zinco. Il composto 22 è inoltre stabilizzato da un maggior numero di legami ad idrogeno ed interazioni idrofobiche a livello della tasca S1', rispetto agli altri due composti; proprio per questo motivo, 22 risulta essere un potente inibitore della MMP-12.
Fig. 2.11: Legami ad idrogeno nel complesso MMP-12/composto 20
59