Xotx2 è in grado di attivare marcatori specifici della ghiandola del cemento
solo dopo lo stadio di gastrula precoce; a differenza di Xag1, l’attivazione di
XCG avviene anche in presenza di inibitori della sintesi proteica. Questo fa
supporre che XCG sia un bersaglio diretto di Xotx2 e che XAG sia a valle di
XCG.
1.5 La famiglia otd/otx e lo sviluppo dell’occhio
Successivamente alla gastrulazione e neurulazione, Xotx2 è espresso nella regione del prosencefalo e del mesencefalo, ad eccezione del recesso ottico e del chiasma ottico, e nelle strutture ependimali della regione parietale e nell’epitalamo (Pannese et al., 1995; Kablar et al., 1996). Xotx5b è molto simile a Xotx5 e ne differisce solo per 11 sostituzioni amminoacidiche. La profonda similarità del loro “pattern” di espressione ha suggerito che essi possano essere due copie dello stesso gene che hanno iniziato solo recentemente a divergere all’interno del genoma pseudotetraploide di Xenopus
laevis (v. oltre). Xotx5b è il gene più simile a Xotx2 di tutta la famiglia otd/otx
ed ha anche il 54% di identità a livello amminoacidico con Crx di topo. Durante lo sviluppo, il primo sito di espressione di Xotx5b, similmente a
Xotx2 è la regione dell’organizzatore. Poi l’espressione persiste nelle cellule
che si involvono intorno al labbro dorsale del blastoporo fino a stadio 11. A differenza di Xotx2 tuttavia, non è più rilevabile la presenza di trascritti di
Xotx5b nel mesendoderma precordale a partire dall’inizio della neurulazione
(stadio 12). Fin da stadio 10.5 si ha espressione di Xotx5b nel neurectoderma anteriore presuntivo. Successivamente, a stadio 13, similmente a quanto avviene per Xotx2, l’espressione scompare, probabilmente in coincidenza con
la definizione di un campo ottico centrale all’interno della piastra neurale anteriore (Andreazzoli et al., 1999). L’espressione più tardiva di Xotx5b è legata allo sviluppo di strutture contenenti fotorecettori, come la ghiandola pineale e la vescicola ottica, durante lo stadio di bottone caudale. Questo gene è uno di quelli più precocemente espressi in queste strutture, dal momento che è già rilevabile nei domini appaiati che si fonderanno insieme nell’epifisi, mentre altri geni espressi nell’epifisi sono rilevabili solo dopo la chiusura del tubo neurale.
Si è sempre intuito che questi geni dovessero avere una funzione nell’occhio, dal momento che Otx1 e Otx2 sono inizialmente espressi in tutta la vescicola ottica (Simeone et al., 1993). Successivamente Otx2 diviene specificamente ristretto alla porzione dorsale della vescicola, il territorio presuntivo dell’epitelio pigmentato della retina (Bovolenta et al., 1997). Dopo questa specificazione regionale, Otx2 si esprime nella retina neurale. In particolare la proteina è localizzata nei neuroblasti postmitotici indirizzati a diventare tipi cellulari neuronali e gliali (Bovolenta et al., 1997). A causa dei gravi disturbi alla gastrulazione indotti da Otx1 e Otx2, le informazioni sul loro ruolo nello sviluppo dell’occhio fornite dai mutanti nulli in topo sono molto limitate. Topi Otx1-/- perdono i processi ciliari e le ghiandole lacrimali
(Acampora et al., 1996) mentre topi Otx2+/- possono essere apparentemente normali (Acampora et al., 1995) o perdere la lente, la cornea e l’iride o addirittura mostrare microftalmia e anoftalmia (Matsuo et al., 1995), a seconda del loro background genetico. L’analisi di Otx2 nell’occhio è ostacolata dall’elevata letalità degli embrioni, dovuta ai difetti della gastrulazione e alla grave malformazione della testa presente in topi omozigoti nulli per Otx2 (Acampora et al., 1995; Matsuo et al., 1995; Ang et al., 1996).
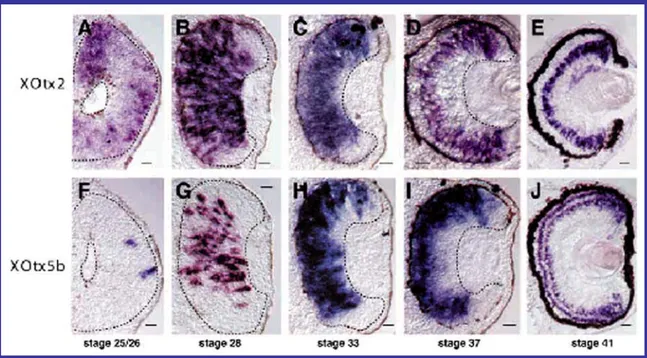
In Xenopus l’espressione di Xotx2 a stadio 20 è rilevata nei due primordi dell’occhio e nel prosencefalo, mentre l’espressione di Xotx5 si osserva solo
nell’epifisi e nella ghiandola del cemento (Viczian et al., 2003). Da stadio 25 l’espressione di Xotx2 rimane largamente inalterata, mentre Xotx5 non è più fortemente espresso nella ghiandola del cemento ma rimane nell’organo pineale presuntivo. Da stadio 31, quando avviene il differenziamento cellulare nell’occhio, l’espressione di Xotx2 e Xotx5 si sovrappone nella retina (Fig. 11; Viczian et al., 2003).
Figura 11: Espressione di Xotx2 e Xotx5 durante lo sviluppo dell’occhio in Xenopus rilevato tramite
ibridazione in situ. Si può osservare la progressiva restrizione dell’espressione di Xotx2 e Xotx5 a popolazioni specifiche di cellule della retina. Si può notare che nella retina differenziata Xotx2 è espresso nele cellule
ipolari mentre Xotx5 è espresso nei fotorecettori e nelle cellule bipolari. b
Analizzando più in particolare la retina, si osserva che l’espressione di
Xotx2 a stadio 25 è estesa a tutta la retina e all’epitelio pigmentato, mentre solo
poche cellule nella retina centrale esprimono Xotx5. A stadio 28 invece l’espressione di Xotx2 si è ristretta alla retina centrale, mentre l’espressione di
Xotx5 si è espansa. Da stadio 33 i “pattern” di espressione di Xotx2 e Xotx5
retina in via di sviluppo tranne che nelle regioni più periferiche, corrispondenti alla zona del margine ciliare (CMZ). A stadio 37 l’espressione di Xotx2 si rileva in tutto lo spessore della retina periferica, ma si restringe nella retina centrale al bordo esterno dello strato nucleare interno (INL). Similmente l’espressione di Xotx5 nella retina centrale è ristretta ai soli strati nucleare esterno (ONL) e interno (INL). Nella retina matura, a stadio 41, Xotx2 si ritrova esclusivamente nel bordo esterno dell’INL e nel bordo interno della CMZ, mentre Xotx5 è espresso nel bordo interno della CMZ, nel bordo esterno dell’INL e nell’ONL. Dalla morfologia cellulare si è in grado di notare che
Xotx5 è espresso nelle cellule bipolari e nei fotorecettori, mentre Xotx2 è
espresso unicamente nelle cellule bipolari (Viczian et al., 2003). Esperimenti di lipotransfezione di Xotx5 hanno mostrato che questo gene è in grado di aumentare il numero dei fotorecettori a discapito delle cellule gangliari, amacrine, di Müller e orizzontali, ma non delle cellule bipolari; inoltre i fotorecettori che aumentano sono sia coni che bastoncelli (Viczian et al., 2003). La sovraespressione di Xotx2 porta invece ad un aumento delle cellule bipolari, a discapito dei fotorecettori e delle cellule di Müller (Viczian et al., 2003).
Ulteriori studi hanno mostrato come sia la porzione C-terminale delle proteine Xotx2 e Xotx5 la responsabile della funzione svolta dalle due proteine. Infatti costrutti di fusione che presentano la porzione N-terminale (comprendente anche l’omeodominio) di Xotx2 e il C-terminale di Xotx5 sono in grado di indurre un aumento dei fotorecettori (come Xotx5 wild-type) costrutti speculari invece, che possiedono la regione N-terminale e l’omeodominio di Xotx5, ma il C-terminale di Xotx2 inducono un aumento di cellule bipolari (Viczian et al., 2003).
Questi esperimenti sono stati recentemente confermati osservando che costrutti chimerici di fusione che presentano la porzione N-terminale di otd
(omeodominio compreso) e il C-terminale di Xotx2 oppure di Xotx5, mimano perfettamente la funzione di Xotx5 e Xotx2 wild type. Al contrario, la sovraespressione di otd non ha alcun effetto (Onorati et al., osservazioni non pubblicate).
Da questi studi emerge che Xotx5 gioca un ruolo simile a Crx di mammifero. Crx è espresso nell’organo pineale, nei coni e nei bastoncelli della retina (Chen et al., 1997; Furukawa et al., 1997; Liu et al., 2001) e recentemente è stato localizzato anche nelle cellule bipolari del topo (Chen et al., 2000). È anche stato dimostrato che Crx è in grado di attivare molti geni specifici dei fotorecettori (Chen et al., 1997; Furukawa et al., 1997) e coinvolti nella specificazione delle cellule fotorecettrici (Morrow et al., 1998).
Xotx5 è altamente correlato a Crx di mammifero (Germot et al., 2001;
Sauka-Spengler et al., 2001) ed ha un “pattern” di espressione identico a Crx negli stadi tardivi dell’embriogenesi. Xotx5 è espresso nell’organo pineale (Sauka-Spengler et al., 2001; Vignali et al., 2000; Viczian et al., 2003) e nei coni, nei bastoncelli e nelle cellule bipolari. La sovraespressione di Xotx2 e
Xotx5 in vivo ha mostrato che sono coinvolti nella specificazione di cellule
bipolari e fotorecettori rispettivamente (Viczian et al., 2003). È noto che l’overespressione di Crx tramite infezione retrovirale di progenitori retinici di topo aumenta la percentuale di cloni che contengono solo bastoncelli, suggerendo che Crx influenzi il destino cellulare (Furukawa et al., 1997). Tuttavia topi knock-out per Crx riescono a sviluppare sia coni che bastoncelli, benché privi del segmento esterno (Furukawa et al., 1999), suggerendo che Crx da solo non sia un determinante chiave nella specificazione dei fotorecettori.
La retina di Xenopus contiene un ugual numero di coni e bastoncelli (Chang e Harris, 1998) a differenza della retina dei roditori che contiene soprattutto bastoncelli (Young, 1985). La sovraespressione di Xotx5 è in grado di indurre entrambi i tipi di fotorecettori e ciò non sorprende, dal momento che
è stato dimostrato che Xotx5 è espresso in entrambi i tipi di cellule sia in
Xenopus che in zebrafish (Liu et al., 2001).
Contrariamente agli studi su Crx in mammifero e in zebrafish (Chen et al., 1997; Furukawa et al., 1997; Liu et al., 2001) Xotx5 di Xenopus è espresso a stadi più precoci dello sviluppo e gioca un ruolo simile a Xotx2 nell’embriogenesi precoce (Vignali et al., 2000). Xotx5 è espresso nelle cellule retiniche che si dividono e in tutti gli strati della retina indifferenziata durante lo sviluppo; in ciò è simile a Crx di zebrafish, ma differisce da Crx di mammifero, che è invece espresso nelle cellule fotorecettrici dopo la loro formazione (Chen et al., 1997; Furukawa et al., 1997; Liu et al., 2001; Morrow et al., 1998). Recenti esperimenti di lipotransfezione in Xenopus con costrutti
Xotx5-EngR hanno portato ad una diminuzione di fotorecettori, diversamente
da costrutti Crx-EngR che, in topo, hanno comunque condotto allo sviluppo di bastoncelli, benché privi dei segmenti esterni (Furukawa et al., 1997). Questo suggerisce l’ipotesi che Xotx5 giochi un ruolo più precoce rispetto a Crx. Analisi filogenetiche sui due geni suggeriscono che Xotx5 e Crx possano essere ortologhi (Germot et al., 2001; Sauka-Spengler et al., 2001) incoraggiando una possibile ridenominazione di Xotx5 in Xcrx. Tuttavia le differenze di espressione dei due geni nello sviluppo precoce fanno considerare prematura una tale decisione. Allo stato attuale della ricerca, zebrafish è l’unica specie nota che possieda entrambi i geni Otx5 e Crx (Gamse et al., 2002). Sebbene Otx5 e Crx siano espressi allo stesso modo nella retina e nell’organo pineale, le loro sequenze proteiche sono identiche solo al 64% e regolano in modo differente l’espressione genica circadiana nell’organo pineale (Gamse et al., 2002). La questione di una loro possibile omologia non è quindi ancora risolta.