CAP.4.
Valutazione del rischio zootecnico e
sanitario legato alle endoparassitosi
Numerosi studi (McLeod, 1995; Perry e Randolph, 1999) evidenziano che negli animali da reddito le malattie parassitarie rappresentano uno dei principali motivi di perdite economiche, per le ridotte performances produttive dei soggetti parassitati con conseguente diminuzione della produttività in allevamento (Ambrosi, 1995; Cabaret, 2002). Inoltre, le endoparassitosi spesso determinano delle importanti ripercussioni negative sulla salute e sul benessere degli animali, soprattutto negli allevamenti biologici (Keatinge, 1996; Roderick e Hovi, 1999); ne deriva, quindi, la necessità di eseguire un attento monitoraggio ed una pianificazione altrettanto puntuale di strategie di controllo adeguate (Vercruysse e Claerebout, 2001).
Nei paesi sviluppati l’impiego di farmaci antiparassitari ad ampio spettro e a dosi ed intensità di trattamento elevati, ha reso meno frequente l’insorgenza di malattie clinicamente evidenti, dunque le maggiori perdite legate alle parassitosi sono spesso associate ad un quadro subclinico. Per quanto concerne l’allevamento convenzionale, sarà pertanto utile individuare dei valori predittivi che possano indirizzare ad un intervento di tipo preventivo, terapeutico e produttivo su cui basare eventuali trattamenti farmacologici (Vercruysse e Claerebout, 2001 ). Nelle produzioni biologiche, invece, come precedentemente illustrato, non potendo ricorrere così frequentemente ai farmaci allopatici, ci si basa su un complesso di metodiche e strategie che vanno sotto il nome di “controllo integrato” (Thamsborg, 1999). Rispetto agli allevamenti convenzionali, le malattie parassitarie hanno una più elevata importanza negli allevamenti biologici, in quanto le caratteristiche stesse del metodo biologico, espongono gli animali ad un maggior rischio di infezione. Infatti la possibilità di fruire di ampi pascoli, condizione che determina una più probabile possibilità di contatto tra animali e
parassiti, l’elevata fecalizzazione ambientale, per mancata rimozione degli escrementi, le limitazioni al ricorso di molecole di sintesi chimica, costituiscono fattori predisponenti per una più elevata incidenza delle parassitosi e per una maggior comparsa di forme cliniche. Da quanto osservato segue che l’incidenza delle perdite economiche legate alle malattie parassitarie possono costituire una minaccia consistente per tale sistema produttivo (Keatinge, 2001). A tal proposito negli allevamenti biologici è stato osservato un aumento dell'intensità, inteso come carica parassitaria, e della varietà dei parassiti presenti in azienda, in termini di numero di specie diverse concomitanti.
La normativa della zootecnica biologica (Reg. CE 1804/99 e D.M. 4 agosto 2000) è comunque consapevole dell’importanza delle parassitosi rendendo possibile due trattamenti antiparassitari l’anno; tuttavia, gli interventi consentiti risultano limitati per le reali esigenze e problematiche che si riscontrano nella realtà zootecnica e possono non essere sufficienti per il controllo di tutte le parassitosi presenti nell’allevamento (protozoi, elminti, artropodi) per le quali si rende necessario l’utilizzo di molecole diverse. Ciò può condurre alla comparsa di forme cliniche oppure a perdite di redditività aziendale in termini di calo delle produzioni e degli indici riproduttivi.
Spesso però, a differenza di altre malattie infettive che si manifestano generalmente con forme clinicamente evidenti, le malattie parassitarie hanno un decorso cronico o addirittura subclinico, consistendo l’azione patogena essenzialmente nel determinismo di alterazioni metaboliche che interferiscono tuttavia sensibilmente con lo stato di salute ed il benessere degli animali, provocando uno squilibrio organico anche non patente, soprattutto per quanto attiene alle funzioni nutrizionali, ma sempre estremamente dannoso. Da questo squilibrio derivano infatti “sindromi di sottoproduzione” che incidono gravemente sulle performance produttive degli animali (Ambrosi, 1995). Le conseguenze di tali disordini metabolici, rappresentate in primo luogo dal danno nutrizionale che si manifesta con stati di malnutrizione generale e quadri di “iporendimento” e presenti anche senza evidenti manifestazioni cliniche, possono essere la causa principale di sottoproduzione anche in correlazione ad una condizione di anoressia o disoressia dell’animale infestato (Ambrosi, 1995). Pertanto, in questi casi gli
animali parassitati sono in stato di malattia parassitaria, ovvero in una condizione in cui non sono in grado di trovarsi al massimo livello possibile di benessere e vitalità. Essi non sono altresì capaci di esprimere la massima potenzialità produttiva e possono provocare una identica situazione di compromissione nell’insieme degli animali allevati nelle medesime condizioni (Ambrosi, 1995). In molti casi però, le stesse malattie parassitarie responsabili dei quadri sopra descritti sono causa di forme clinicamente manifeste anche molto gravi e rapidamente mortali (Ambrosi, 1995). Tenendo conto di quanto detto sopra e considerando anche che in molti casi è utopistico pensare di eliminare gli agenti responsabili delle malattie parassitarie da un allevamento, in questi casi la finalità del controllo deve essere quella di abbassare la carica parassitaria degli animali da reddito a valori tali da consentire loro di mettere in atto una efficace risposta immunitaria, in modo da non avere ripercussioni cliniche evidenti e limitare il più possibile il danno produttivo dovuto ai parassiti (Ambrosi, 1995; Vercruysse e Claerebout, 2001).
Per questi motivi e per ridurre al minimo le perdite di redditività aziendale, negli allevamenti biologici è necessario operare un costante monitoraggio parassitologico al fine di:
-individuare le parassitosi presenti in allevamento;
-individuare le malattie parassitarie che incidono in maggior misura sulla salute e sulla produttività animale;
-valutare la necessità di un eventuale trattamento terapeutico;
-valutare l'efficacia delle misure di controllo già adottate nell’allevamento; -se necessario individuare ed adottare altre misure di controllo.
Nell’indagine parassitologia condotta all’interno di un allevamento sarà altresì fondamentale la conoscenza delle specie parassitarie presenti nell’azienda stessa. Infatti, se per alcune specie parassitarie è sufficiente la loro presenza per indicare un rischio produttivo elevato, per molte altre, invece, cariche parassitarie di bassa intensità non hanno ripercussioni cliniche evidenti e determinano un danno produttivo limitato (Ambrosi, 1995). Inoltre, considerando che la sensibilità a parassitosi diverse e la gravità di esse varia in base all'età, al momento produttivo e ad altri fattori legati al management aziendale (Colditz et al., 1996; Shaw et al.,
1998), nel monitoraggio delle parassitosi è necessario considerare tutte le classi di età presenti nell'allevamento.
Risulta pertanto indispensabile la valutazione e l'analisi contemporanea di diversi parametri, specifici per ciascuna parassitosi, che siano in grado di indicarne sia l'intensità dell’infestazione parassitaria, che il rischio zootecnico ad essa correlato. Tra questi possono essere inclusi i dati ottenuti con le tecniche coprodiagnostiche parassitologiche che permettono una valutazione qualitativa e quantitativa dei pa-rassiti presenti (Euzeby, 1981; Ambrosi, 1995; Permin e Hansen, 1998; Gibbons et al., 2005;) la percentuale di animali parassitati nell'allevamento, con la differen-ziazione secondo categorie fisiologiche ed eventualmente operando distinzioni di specie e razza, parametri ematologici ed ematochimici, gli indici produttivi degli animali e la presenza di forme cliniche riferibili alle parassitosi presenti in alleva-mento.
E' inoltre necessario ripetere periodicamente queste valutazioni nel corso dell'anno, in modo da individuare le variazioni stagionali riguardo la presenza e l'intensità di ciascuna parassitosi.
Una volta identificato il problema e stabilito il grado di rischio cui si incorre, è possibile ideare un eventuale piano terapeutico e, soprattutto, individuare le misure di controllo più adatte al caso (Rickard e Zimmermann, 1992; Couvillion et al., 1996).
La finalità stessa del controllo sarà quella di abbassare la carica parassitaria degli animali a valori tali da permettere una stimolazione immunitaria senza avere ripercussioni cliniche evidenti, tutelando quindi lo stato sanitario dell’intero allevamento e limitando il più possibile il danno produttivo dovuto ai parassiti. Per ottenere questo risultato esiste la necessità di utilizzare un approccio che prevede l’uso contemporaneo di diverse tipologie di intervento, da tali presupposti nasce quindi il controllo integrato (Thamsborg et al., 1999) per la cui trattazione si rimanda all’apposito capitolo. A tal proposito l’aspetto più complesso della lotta alle parassitosi risiede proprio nella ricerca di elementi valutativi per la condizione presente e predittivi per la condizione futura ( Ambrosi, 1995).
Funzionalmente ai principi del controllo integrato sarà allora utile definire un me-todo per individuare il rischio zootecnico e sanitario dell’allevamento studiato.
L’approccio fondamentale al problema consiste nello stabilire dei parametri ogget-tivi e misurabili; a tale scopo sarebbe quindi importante adottare dei dati facil-mente reperibili, capaci di riflettere lo stato di salute degli animali e l’andamento di un’eventuale parassitosi. Da tali presupposti ci si chiede se è possibile adottare come misurazione attendibile del rischio il numero di uova per grammo di feci dei parassiti gastrointestinali o del numero di larve (Gray, 2002). Sicuramente la dia-gnostica coprologica quantitativa costituisce un valido strumento che permette una valutazione dell’entità di una data parassitosi.(Euzeby, 1981, Ambrosi, 1995; Nahn, 1997) Le metodiche usate forniscono valori numerici che, pur mantenendo la loro proprietà intrinseca di dati oggettivi, non possono prescindere da interpreta-zioni da parte del clinico. Queste interpretainterpreta-zioni presentano notevoli difficoltà per una serie di fattori che possono far variare la carica parassitaria nelle feci, tra questi abbiamo le variazioni stagionali e climatiche, quelle legate ai ritmi diurni, le condizioni ambientali, l’età dei soggetti esposti al parassitismo, lo stato di salu-te complessivo degli animali. Infatti nei soggetti defedati è nosalu-tevolmensalu-te superio-re l’eliminazione fecale delle uova; quest’ultima risente poi della qualità fisica della razione alimentare e di quella delle feci. Euzeby (1981) sostiene, infatti, che per quanto riguarda la qualità fisica del cibo somministrato, la ricchezza del mate-riale fecale, in termini di strongili gastrointestinali, è inversamente proporzionale alla quantità di elementi grossolani della razione. Anche la consistenza delle feci influenza considerevolmente il numero di uova per grammo di feci (UPG), in merito a ciò sono stati stabiliti dei coefficienti di correzione che tengono in considerazio-ne questo fatto(si moltiplica per 2 per le feci semiliquide, per 3,5 se sono diarroi-che etc.). Tali valori hanno tuttavia un’importanza relativa, in quanto dovranno essere interpretati, sempre tenendo conto delle condizioni globali del soggetto e dei fattori di variabilità. Secondo alcuni autori (Hansen e Perry,1994; Vercruysse e Claerebout, 2001) il numero di UPG è influenzato dal numero di parassiti adulti co-lonizzanti il tratto intestinale, dal livello di immunità dell’ospite (Colditz et al., 1996; Shaw et al., 1997), dal sesso dell’ospite (Barger,1993), dalle variazioni di razza (Suarez et al., 1990; Suarez et al., 1995) riguardanti la resistenza e la cacità di recupero all’infezione, dalla specie dell’animale interessato e da quelle pa-rassitarie, dallo stadio di infezione e dall’esposizione ad eventuali infezioni
inter-correnti (Larsson et al., 2006), infine dalla correlazione con taluni eventi fisiologi-ci, quali il parto (peri-parturient rise), e ambientali (spring rise).
Inoltre si debbono considerare alcune caratteristiche proprie del parassita come la sua prolificità; infatti, più una specie elmintica è prolifica minore sarà il significato patologico delle UPG, questo perchè da un piccolo numero di individui adulti possono derivare quantità elevate di uova e viceversa. Tra le specie più prolifiche abbiamo Haemonchus placei, Cooperia sp., tra quelle meno produttive Fasciola
hepatica, Ostertagia sp., Dyctiocaulus viviparus, Nematodirus sp., Bunostomum phlebotomum (Euzeby, 1981).
Da quanto detto sopra risulta di fondamentale importanza nella valutazione del ri-schio zootecnico e sanitario integrare i dati numerici con una dettagliata analisi qualitativa delle parassitosi, per tali motivi nel presente lavoro è stata eseguita un’indagine quantitativa associata all’identificazione dei principali generi, e laddo-ve si è reso possibile delle specie di strongili gastrointestinali, e delle specie cocci-diche presenti in allevamento, cercando, qualora fosse realizzabile, di operare una distinzione in base all’età e alla razza d’appartenenza dei soggetti esaminati. Scopo finale dello studio è stabilire quindi dei valori soglia in base a cui intervenire per una corretta valutazione e gestione del rischio zootecnico e sanitario, e dei fattori che ne influenzano la comparsa e il livello di intensità; tale strategia mira a divenire un efficace strumento per lo sviluppo sostenibile di un sistema produttivo come quello di un ’azienda biologica.
In questa sede si rende necessario chiarire i concetti sopramenzionati, innanzitutto si deve sottolineare la forte correlazione tra i due tipi di rischio; infatti, è già stato evidenziato come le condizioni igienico-sanitarie di un dato allevamento influenzino direttamente l’andamento economico dell’azienda. Primariamente è importante sottolineare come il rischio sia parte integrante di qualsiasi attività imprenditoriale, costituendo quindi una componente intrinseca dell’impresa. Esso nasce dalla difficoltà di conoscere, o di prevedere con certezza, le probabilità con le quali si possono manifestare eventi ambientali di carattere naturale, tecnico, economico ed istituzionale che determinano cambiamenti sui risultati economici dell’azienda. Il rischio deriva quindi da un contrasto tra le condizioni ambientali in
cui opera una determinata attività ed i caratteri peculiari del sistema produttivo considerato.
All’interno del rischio economico generale, il fattore di rischio specifico e rilevante dell’impresa agro-zootecnica è rappresentato dalla componente biologica. Il rischio biologico è legato a tutte le attività in cui sono coinvolti organismi attaccabili da agenti patogeni (animali) ed è quindi presente in tutti i tipi di impresa agro-zootecnica, ma la sua incidenza si fa sentire particolarmente nel caso delle aziende che operano con il metodo biologico. Ne consegue che il rischio biologico agisce molto intensamente e costituisce una delle fonti di maggior debolezza di questo tipo di aziende. In questo metodo di produzione si assiste, infatti, ad un rafforzamento della relazione tra gli aspetti ecologici dell’azienda intesa come unità dell’agro-ecosistema e gli aspetti economico-organizzativi dell’azienda intesa come unità tecnico produttiva. Ne deriva che le caratteristiche del metodo biologico condizionano, più che nel sistema convenzionale, la realizzazione tecnico-produttiva, organizzativa e gestionale della produzione. Il rischio biologico può essere sia biotico che abiotico; il primo riguarda gli aspetti più propriamente legati all’azione degli organismi patogeni quali i virus, i batteri e, nel caso specifico del presente lavoro, i parassiti, mentre il secondo si riferisce agli aspetti inerenti l’azione di alcune condizioni ambientali e climatiche che possono far variare l’incidenza e l’intensità dell’azione di tali agenti patogeni. In questa sede sarà quindi sviluppata una stima predittiva dell’incidenza della componente biotica del rischio specifico sulla condizione sanitaria dell’intero allevamento e le possibili conseguenze a livello produttivo. La valutazione del rischio sanitario tende a identificare gli animali con segni clinici evidenti per cui si rende necessario un intervento immediato al fine di evitare la diffusione della patologia nell’intera mandria, tentando così di eliminare il fattore di stress e recuperare in tal modo un livello accettabile di salute e benessere degli animali. Inoltre, un approccio rapido al problema permette di evitare ulteriori perdite produttive. Quindi, al fine di realizzare una stima efficace si debbono correlare i livelli di infezione alla relativa comparsa dei segni clinici, come strumento di tale intento possiamo avvalerci dei risultati ottenuti in alcuni studi sperimentali presenti in letteratura. Gli stessi dati epidemiologici possono rappresentare una
fonte preziosa di informazioni, su cui basare un ‘analisi predittiva dell’esposizione al rischio delle parassitosi in un dato allevamento, consentendo così di attuare misure preventive. Per quanto riguarda l’aspetto più prettamente produttivo, lo scopo è quello di stimare l’entità delle possibili perdite economiche connesse ad un’intercorrente parassitosi. Si cerca quindi di correlare lo scadimento delle performances produttive come l’incremento ponderale, la produzione lattea, la conversione dell’alimento ai gradi di infezione parassitaria (Vercruysse e Claerebut, 2001). Nei paragrafi seguenti saranno esaminati i parametri ritenuti utili come principali indicatori di rischio zootecnico e sanitario relativi alle principali malattie parassitarie della specie bovina.
4.1. Coccidiosi
Questa malattia protozoaria è molto diffusa negli animali da reddito, in particolare nella specie bovina si riscontrano positività solitamente molto elevate, con valori medi del 75% per gli allevamenti, mentre, in un singolo allevamento, in media sono colpiti il 25% dei singoli capi fino al 50% rappresentando perciò un importante fonte di perdita economica (Svensson et al., 1994; Ambrosi, 1995, Svensson et al., 2000, Daugschies e Njdrowski, 2005).
E’ stata inoltre rilevata una significativa differenza di prevalenza in base all’età dei soggetti; infatti, negli animali giovani, al di sotto di un anno di età, si riscontrano positività del 20-75% , mentre negli adulti del 5-13/14%. Da altri studi sperimentali risultano i seguenti dati:
-14% nelle vacche, 29% nelle manze, 57-59% nei vitelli di 6-7 mesi;
-13% nelle vacche,40% nelle manze,75% nei vitelli di 7-8 mesi,43%nei vitelli sotto i 5 mesi.
Anche la tipologia di allevamento sembra influire molto sull’incidenza della malattia; infatti, nel caso della stabulazione fissa 1/3 dei capi risultano positivi, mentre laddove si adotta la stabulazione libera viene colpito fino al 75% degli animali. Tale dato mette quindi in evidenza la necessità di attuare una strategia di controllo particolarmente efficiente nel caso degli allevamenti estensivi, quali quelli biologici, in cui gli animali sono esposti ad un maggior rischio di infezione (Ambrosi, 1995; Roderick e Hovi, 1999).
Si ritiene che nelle forme con sintomatologia evidente il numero di oocisti per grammo di feci (opg) sia molto elevato, oltre 1000 opg ( Ambrosi, 1995; Puccini, 1992)
Secondo alcuni studi, il rilievo di 730 opg alla prima stagione di pascolo indica che l’ambiente è contaminato ( Svensson, 2000); pertanto tale situazione indica un possibile rischio zootecnico e soprattutto la possibilità di infezione e di allarme epidemiologico.
Le forme subcliniche interferiscono con la funzionalità gastrointestinale determinando un danno a livello delle cellule intestinali, andando a costituire una grave minaccia per l’omeostasi dell’animale ospite. Spesso, infatti, la coccidiosi anche in assenza di segni clinici rilevanti provoca effetti negativi sul benessere
animale e sulle performances produttive, da ciò deriva un’ingente perdita economica per l’allevamento bovino (Daugschies e Najdrowsski, 2005). Tale situazione è tanto più grave nelle forme acute della malattia, basti pensare che
Eimeria bovis ed Eimeria zuernii possono essere responsabili di una grave forma
clinica caratterizzata da una diarrea emorragica (Stockdale et al., 1981; Daugschies e Najdrowsski, 2005), correlata ad uno stato di anemia e progressivo scadimento delle condizioni fisiche fino a risultare fatale; anche Eimeria
alabamensis, seppur con ripercussioni meno gravi può causare una forma
clinicamente evidente. Molti studi hanno inoltre dimostrato la spiccata patogenicità di quest’ultima specie nei giovani animali, essendo una potenziale causa di forme diarroiche e di scarsi accrescimenti soprattutto per i vitelli alla prima stagione di pascolo (Svensson, 1993Svensson et al., 1994; Svensson et al., 2000, Daugschies e Najdrowsski, 2005).
Viste le differenze riportate nella determinazione della sintomatologia e nel livello di patogenicità, risulterà quindi funzionale alla valutazione del potenziale danno zootecnico e della salute degli animali attuare un’indagine parassitologia che consenta di compiere stime approfondite in base alle specie coccidiche presenti in azienda. Il potere patogeno delle diverse specie di Eimeria varia oltre che in relazione alla carica infestante, anche in base all’interazione di diversi fattori connessi alle caratteristiche proprie di ciascuna specie in termini di virulenza, capacità invasiva, tropismi elettivi, stadio di sviluppo ed entità della popolazione parassitaria prodotta (Ambrosi, 1995; Stromberg, 1997; Stromberg e Averbeck, 1999; Scatena e Perrucci, 2002). Esso dipende anche dalle caratteristiche degli animali infetti come sesso (Barger, 1993), età (Colditz et al., 1996), momento fisiologico (Colditz et al., 1996; Fox, 1997), condizioni di vita e di allevamento (Jager et al., 2004), eventuali patologie intercorrenti (Ambrosi, 1995; Cabaret et al., 2002; Larsson et al., 2006, grado di resistenza naturale o acquisita, alimentazione, oltre che dalle condizioni ambientali, quali temperatura e umidità (Casarosa, 1985; Ambrosi, 1995; Scatena e Perrucci, 2002). Il rapporto ruminanti/coccidi è tanto stretto da escludere l’esistenza di allevamenti completamente indenni (Ambrosi, 1995; Unberger, 1997; Scatena e Perrucci, 2002). Ciò dipende con molta probabilità dalla contemporanea presenza di diversi
fattori tra cui l’elevato numero di capi infetti che eliminano le oocisti con le feci e contaminano gli ambienti, l’elevata frequenza con cui questi animali pascolano nello stesso appezzamento, l’elevata presenza di oocisti nella stalla, la marcata resistenza delle oocisti nell’ambiente e nei pascoli (Ambrosi, 1995; Unberger, 1997; Scatena e Perrucci, 2002).
L’allevamento ad alto indice di affollamento, sia brado che in stalla, è esposto ad un rischio maggiore rispetto a quello in cui il carico di bestiame per unità di super-ficie è basso, considerando inoltre che l’allevamento a stabulazione libera rispetto a quella fissa crea problemi notevolmente maggiori (Ambrosi, 1995; Unberger, 1997; Scatena e Perrucci, 2002). Diversi fattori, tra cui quelli climatici, lo sviluppo della resistenza immunitaria, la stagione dei parti e le cattive condizioni igieniche, sono risultati significativamente correlati alle variazioni quantitative delle oocisti emesse (Ambrosi, 1995; Urquhart, 1998). Inoltre sia la prevalenza che il numero di oocisti risulta maggiore nei campioni fecali dei giovani animali rispetto agli adulti (Amarante e Barbosa, 1992; Ambrosi, 1995).
Per quanto spetta alle alterazioni metaboliche e fisiologiche esplicativo risulta uno studio condotto su vitelli infettati sperimentalmente con Eimeria zuernii (Stockda-le et al., 1981). Tra i cambiamenti patofisiologici troviamo una notevo(Stockda-le diminuzio-ne dell’ ematocrito, la diminuziodiminuzio-ne delle proteidiminuzio-ne plasmatiche, ipoalbumidiminuzio-nemia, marcato calo del numero di eritrociti ed emoglobina con conseguente anemia, de-cremento del tasso di sodio e cloro plasmatici e degli elettroliti in generale a causa della diarrea con conseguente emoconcentrazione e rischio di ipovolemia. Altre al-terazioni rilevabili sono la diminuzione del tasso di glucosio ematico, dei fosfati e della creatinina (Pellerdy, 1974; Stockdale et al., 1981; Ambrosi, 1995).
4.2. Strongilosi gastrointestinale
La strongilosi gastrointestinale è universalmente diffusa nell’allevamento bovino ed è riconosciuta come la causa principale di perdite produttive che si verificano frequentemente anche nel caso di una infezione subclinica (Vercruysse et al., 1986; Armour, 1989; Ambrosi, 1995; Rickard e Zimmermann, 1992; Sykes, 1994; Fox, 1997; Urquhart et al., 1998). Frequenti sono, infatti, le forme subcliniche che
si manifestano primariamente con una riduzione dell’utilizzazione della razione con conseguenze negative sul tasso di crescita dei vitelli, l’indice di conversione negativo determina una riduzione delle produzioni carnee e dei parametri ripro-duttivi (Forbes et al., 2000). In Italia sono presenti i diversi generi conosciuti con particolare prevalenza della tricostrongiloidosi e, soprattutto, di ostertagiosi e ne-matodiriasi (Ambrosi, 1995). A causa della presenza di diversi generi e specie, do-tati di peculiarità proprie e determinanti diverse conseguenze a livello patologico e produttivo, si rende necessario uno studio approfondito della loro incidenza al-l’interno dell’allevamento. Quindi,oltre a valutare la prevalenza della strongilosi gastrointestinale in generale, risulta utile eseguire un’identificazione dei generi presenti in azienda per ottenere una stima più accurata delle problematiche a cui lo stesso allevamento risulterà esposto e le perdite produttive cui potrà incorrere (vanWyk et al., 2004). Tale valutazione risulterà funzionale se messa in correlazio-ne ad una stima quantitativa dei parassiti (Euzeby, 1981; Ambrosi, 1995).
Nella valutazione del rischio zootecnico e sanitario della strongilosi gastrointesti-nale non si deve prescindere dal considerare l’influenza dei fattori concomitanti che possono influire sul determinismo delle conseguenze negative, quali scadenti condizioni generali, ipoalimentazione (Coopo e Holmes, 1996; Coop e Kyriazakis, 1999), squilibri nutrizionali, fattori stressanti (Fox, 1997), patologie intercorrenti, in particolare il poliparassitismo (Ambrosi, 1995; Jager et al., 2004; Larsson et al., 2006).
Molto complessa risulta anche l’analisi delle alterazioni metaboliche osservabili nel corso di questa malattia, le quali risultano in stretta correlazione con l’ l’entità delle perdite produttive e, quindi, con il rischio zootecnico (Parkins et al., 1990). In generale si riscontra una diminuzione dell’appetito, con conseguente riduzione dell’utilizzo della razione fino al 20%, determinando inoltre un’alterazione dell’in-dice di conversione degli alimenti (Ambrosi, 1995). Volendo quantificare le perdite di peso e la diminuzione del tasso di crescita degli animali parassitati, in base ad alcuni studi è stato possibile individuare cali del 5 % fino al 20-22% in particolar modo nei vitelli (Ambrosi, 1995). Da non sottovalutare la mortalità specifica che può essere rapida e molto elevata nelle forme acute (Ambrosi, 1995; Fox, 1997). Durante i primi anni ’90 sono stati stimati 300 milioni di bovini parassitati da
ne-matodi con una perdita annua di circa tre milioni di dollari (FAO, 1994). L’entità del danno quanti- qualitativo della produzione di carne è da mettere in correlazio-ne con la diminuziocorrelazio-ne della deposiziocorrelazio-ne di proteicorrelazio-ne a livello muscolare e con la di-minuzione delle sintesi proteiche (Parkins et al., 1990; Ambrosi, 1995;Agnessens, 2000; Mertz et al., 2005; Giannetto et al., 2006). Tra le alterazioni del profilo me-tabolico osservabili in corso di strongilosi gastro-enterica, infatti, quello proteico risulta maggiormente interessato. E’ stato osservato come gli elminti che hanno sede nell’abomaso determinano lesioni che alterano le cellule zimogene e le cellu-le parietali produttrici di acido cloridrico, portando, quindi ad una minor produzio-ne di pepsina e acido cloridrico e ad un conseguente innalzamento del pH da 2-2,5 a 6-7. Quest’ultimo cambiamento comporta una ridotta demolizione delle protei-ne; inoltre, a causa degli stimoli irritativi, si instaurano delle modificazioni a cari-co della mucari-cosa intestinale, quali atrofia dei villi, alterazione delle cripte ed una conseguente diminuzione delle superfici deputate all’assorbimento dei nutrienti (Casarosa, 1985; Parkins et al., 1990; Puccini, 1992; Ambrosi, 1995; Fox, 1997; Agnessens et al., 2000, Vercruysse e Claerebout, 2001). In generale avremo una ca-renza globale di proteine a eziologia multifattoriale, ovvero a causa della disappe-tenza, della diminuzione della superficie di assorbimento,come conseguenza di fe-nomeni infiammatori, dalle perdite ematiche, dalla perdita di sieroalbumine per perdita della tenuta stagna della mucosa, per l’eccessiva disepitelizzazione (Am-brosi, 1995).
La condizione di ipoalbuminemia può inoltre dipendere dalla diminuita funzionalità epatica instauratasi a seguito dell’endotossicosi provocata da un lato dal riassorbimento dei cataboliti elmintici, dall’altro dall’assorbimento di molecole proteiche non completamente demolite.
Si verifica inoltre l’inversione del rapporto albumina/globuline con alterazione del-la pressione oncotica e formazione di edemi (Ambrosi, 1995).
In alcune ricerche (Bremner, 1966; Casarosa, 1985; Parkins et al., 1990; Puccini, 1992; Ambrosi, 1995; Fox, 1997; Agnessens et al., 2000, Vercruysse e Claerebout, 2001) condotte su bovini parassitati da diverse specie di nematodi gastrointestinali, è stata evidenziata la loro influenza sulla concentrazione ematica di emoglobina e proteine totali, determinandone una diminuzione sensibile dei
valori normali. Da tali studi è emerso come tali parassiti inducano uno stato di anemia cronica dovuta alle emorragie. E’ stata inoltre dimostrata una correlazione tra le concentrazioni di emoglobina e quella delle sieroproteine che sembrano decrescere parallelamente. In particolare le linee di regressione di tale studio hanno mostrato che il livello di gravità con cui si verificano queste diminuzioni dipende, in ordine decrescente, dalle seguenti specie: Oesophagostomun
radiatum, Bunostomum phlebotomum ed Haemonchus placei (Bremner, 1966).
All’esame emocromocitometrico risulta poi un’anemia dovuta alle perdite ematiche causate dall’attività ematofagica dei parassiti adulti dei generi
Haemonchus e Bunostomum, o delle larve dei generi Chabertia ed Oesophagostomum (Ambrosi, 1995). Inoltre, l’anemia può dipendere anche dalla
diminuita funzionalità epatica.
Per quanto riguarda il metabolismo minerale risulta un’alterazione soprattutto dei livelli di calcio e fosforo con riduzione fino al 35 % e riscontro quindi di uno stato di ipocalcemia e di ipofosforemia; ciò determina una conseguente compromissione dello sviluppo scheletrico dei soggetti giovani (Ambrosi, 1995). La grave diarrea, che rappresenta il sintomo principale dell’interessamento gastrointestinale di questa malattia, determina perdite idriche ed elettrolitiche notevoli; in particolare si registra un aumento dell’eliminazione del potassio e diminuzione dell’eliminazione del sodio (Ambrosi, 1995).
Nel caso di Ostertagia, studi sperimentali hanno dimostrato la validità della valutazione dei valori della gastrina e del pepsinogeno ematici come indici della gravità della malattia (Xiao et al., 1991; Berghen et al., 1993; Ambrosi, 1995) E’ stato stimato che un valore medio di pepsinogeno superiore a 5 unità tiroxina rappresenta una soglia di allarme come rischio zootecnico. Le stesse considerazioni valgono nel caso di concentrazioni di gastrina superiori a 1000 pg/ml ( Vercruysse e Claerebout, 2001, Urquhart, 1998).
Il pepsinogeno viene valutato soprattutto nei vitelli, ma deve essere comunque considerato come fattore di rischio per l’allevamento, in quanto anche un solo gruppo colpito rappresenta una fonte di possibile diffusione della malattia in tutto l’allevamento.
Il grado di copropositività dei bovini alla strongilosi gastrointestinale e quindi la valutazione, in base a questo parametro, delle potenziali problematiche che si possono verificare in un allevamento è condizionato da diverse variabili.
Tra i fattori più rilevanti troviamo l’entità numerica della popolazione elmintica, intesa come quantità dei parassiti adulti e fertili e quindi le variazioni stagionali, climatiche e ambientali che ne determinano le variazioni (Ambrosi, 1995; Euzeby, 1981; Michel, 1978; Nansen et al. 1989); il ritmo di ricambio della popolazione elmintica, soprattutto in relazione alla capacità di reinfezione. Un fattore limitante è dato dalla resistenza acquisita dell’ospite, ciò influisce infatti sulla percentuale di larve che giungono a maturazione e sul loro grado di fecondità. Variazioni del numero di upg si registrano, inoltre, in relazione ad alcuni fenomeni di importanza biologica ed epidemiologica, quali l’ aumento della copropositività a seconda della stagionalità come nel periodo primaverile (“sping rise”) e di quello autunnale (“fall rise”); in corrispondenza di particolari condizioni fisiologiche come il parto (“ parturient rise”) e la lattazione (“lactation rise”) (Casarosa, 1985; Ambrosi, 1995; Urquhart et al. 1998; Cringoli, 2003) la cui associazione determina il fenomeno del “periparturient relaxation in immunity”(Coop e Kyriazakis, 2001) in cui si verifica una caduta della sorveglianza immunitaria dell’ospite. Anche il fenomeno del “self-cure” determina un aumento dell’emissione delle uova probabilmente in relazione ad un meccanismo immunitario in cui si ha un’autoliberazione degli strongili da parte degli ospiti come processo di autoregolazione (Ambrosi, 1995).
Altra difficoltà è la quantificazione in termini di upg individuali o medi di allevamento, se si vuole arrivare a valutare la consistenza delle popolazioni elmintiche. Questo si verifica a causa della polispecificità eziologica della strongilosi, infatti le femmine di generi diversi hanno un diverso grado di prolificità, eliminando nel tempo quantità di uova molto diverse, basti pensare al fatto che Trichostrongylus partorisce 100 uova al giorno, mentre Haemonchus è in grado di eliminarne 5000-10000 (Ambrosi, 1995). Un possibile accorgimento da adottare per limitare tale problematica prevede la comparazione tra i valori medi di upg dei campioni di un gruppo e le percentuali delle larve L3 dei vari generi nella coprocolture da pool degli stesi campioni (Ambrosi, 1995).
Secondo Ambrosi (1995), nelle infezioni miste si possono considerare i seguenti criteri di giudizio relativi a valori medi di allevamento:
-con valori inferiori alle 100 upg si ha un livello di infezione che necessita di controllo;
-in presenza di valori compresi tra 100 e 250 upg si ha una situazione di rischio zootecnico;
-oltre le 250-400 upg si una forma clinica evidente e si parlerà allora di infezione sensibile.
Il livello di infezione e la gravità dei segni clinici aumenta progressivamente oltre le 400-700 upg riscontrando così un’ infezione marcata; tale riscontro è indicativo di allarme epidemiologico, compromettendo sia l’andamento dello stato sanitario dell’allevamento che dell’aspetto produttivo. In presenza di oltre 700-800 upg si ha una infezione tanto più grave quanto più elevati sono i valori medi (Ambrosi, 1995).
Altri autori hanno cercato di mettere in relazione il numero di upg con il livello di stato patologico, tra di essi Shock (1976) ha compiuto una differenziazione in base alle varie specie di strongili gastrointestinali, il risultato degli studi compiuti è ri-portato nella Tabella n.9.
Tabella n.9
Parassita SGE Infezione leggera Infezione media Infezione grave
Haemoncus placei Ostertagia spp Trichostrongylus axei Cooperia spp Bunostomum phlebotomum 200 100 50 500 20 300-500 200 100-300 500-3000 50-100 > o = 1000 > o = 500 > o = 300 > o = 3000 > o = 100
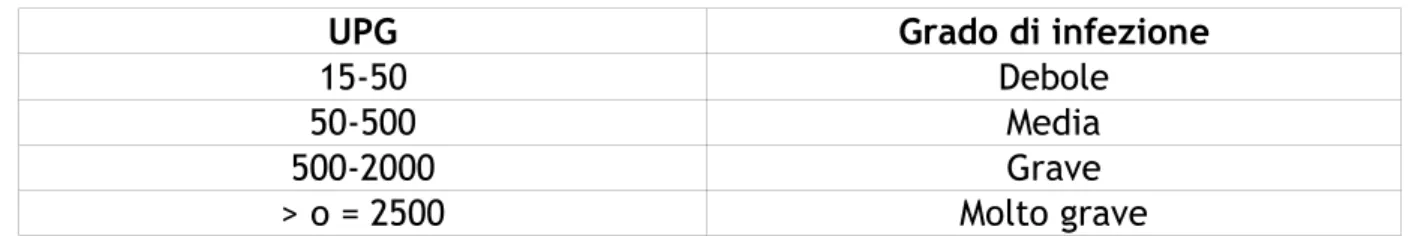
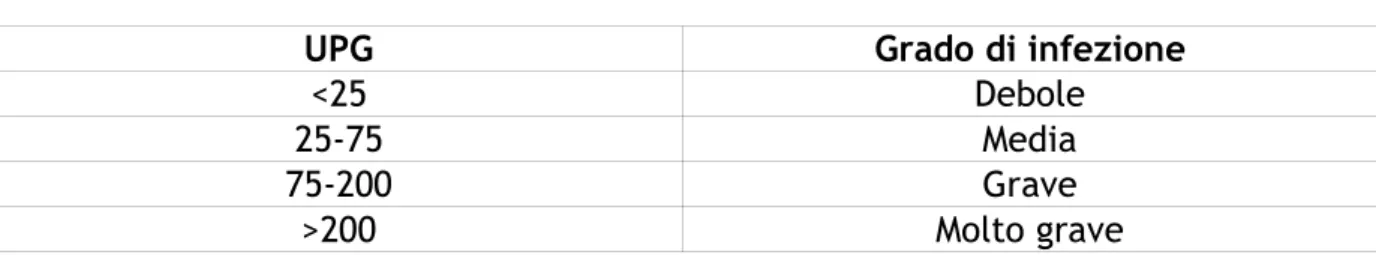
Raynaud (1974) ha invece effettuato una ricerca più mirata, elaborando una valutazione del grado di infestazione in relazione al tasso di UPG emesso in seguito ad una tricostrongiloidosi (Tab. n°10 ) ed alla nematodirosi (Tab. n°11).
Tabella n.10. Tricostrongiloidosi
UPG Grado di infezione
15-50 Debole
50-500 Media
500-2000 Grave
Tabella n.11 Nematodirosi
UPG Grado di infezione
<25 Debole
25-75 Media
75-200 Grave
>200 Molto grave
In generale, da quanto si evince dalle ricerche precedentemente illustrate a parti-re da 500 upg l’infestazione da strongili gastrointestinali, deve esseparti-re pparti-resa in con-siderazione, soprattutto per i soggetti giovani e in presenza di qualche segno clini-co.
Altri studi (Shock, 1976; Hansen e Perry, 1994) si propongono di stabilire una rela-zione tra il numero di parassiti adulti e fertili ed la quantità di upg emesse dagli animali parassitati, tenendo conto delle differenze in base alla specie parassitaria (Tab. n°12; Tab. n°13).
Tabella n.12 (Shock, 1976)
Parassita UPG N° di elminti adulti
Haemonchus placei 200 300-500 1000 1800 400-1000 Ostertagia spp. 100 200-300 500 1000 2000-3000 10000-25000 Trichostrongylus axei 50 100-300 300 1 –10000 10000-30000 30000 Cooperia spp. 500 500-3000 3000 1-5000 5000-10000 10000 Bunostomum phlebotomum 20 20-100 100 1-50 50-200 200
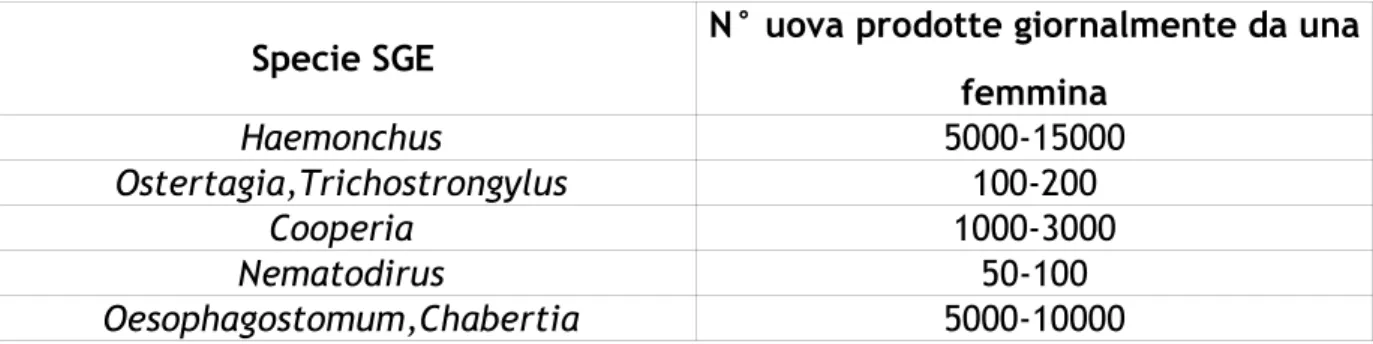
Tabella n.13. Produzione giornaliera di uova per femmina di alcuni generi di SGE (Hansen e Perry, 1994)
Specie SGE N° uova prodotte giornalmente da una femmina Haemonchus 5000-15000 Ostertagia,Trichostrongylus 100-200 Cooperia 1000-3000 Nematodirus 50-100 Oesophagostomum,Chabertia 5000-10000
Come appare dai valori riportati nella tabella n.13 è evidente che risulta molto dif-ficile stabilire una correlazione certa tra il numero di upg ed il numero di parassiti adulti presenti in dato soggetto (Euzeby, 1981). Più interessante e funzionale alla valutazione complessiva della mandria risulta l’approccio di Raynaud (1974) che tenta di stabilire una correlazione su un piano collettivo di una data popolazione animale. In particolare, l’autore concentrando il suo studio sui tricostrongilidi ha evidenziato che ad una copropositività debole, pari a 50-500 upg, corrisponde in genere una infezione debole sostenuta da 25 a 7000 parassiti. Con una copropositi-vità media di 500 upg risulterebbe invece un’infezione debole nel 55% dei casi, me-dia nel 35% con 7500-40000 parassiti adulti e grave nel 10% dei casi in presenza di 40000-80000 elminti. Alcuni autori segnalano, nel caso specifico di Ostertagia
ostertagi, la possibilità di infezioni massive già in presenza di 40000 parassiti adulti
(Armour et. Al., 2002). A valori più elevati di upg (500-2000 ) corrisponderebbe una infezione grave nel 37% dei casi e debole nel 26%.
Nel caso di Nematodirus, piccoli numeri di upg possono corrispondere a elevati numeri di adulti; infatti, 200 upg corrispondono a 40000 parassiti circa, 25 a 100 upg a 3000-5000 parassiti e con valori inferiori a 25 upg si contano meno di 2000 elminti.
Le valutazioni da compiere devono tener conto che le diverse specie di nematodi hanno differenti capacità di produzione di uova; inoltre, in base alla specie varia anche la patogenicità del parassita; ad esempio le femmine di Cooperia sp. producono un elevato quantitativo di uova ma non sono molto patogene,mentre
Trichostrongylus sp. risulta abbastanza patogeno ma produce poche uova. Il
confronti del parassita. L’escrezione delle uova aumenta in corrispondenza del parto. In base alla consistenza delle feci si ha una variazione delle upg,infatti in presenza di manifestazioni diarroiche spesso si hanno livelli più bassi di carica parassitaria, ciò si verifica soprattutto a causa di un fenomeno di diluizione (Tab. n.14, Hansen e Perry, 1994).
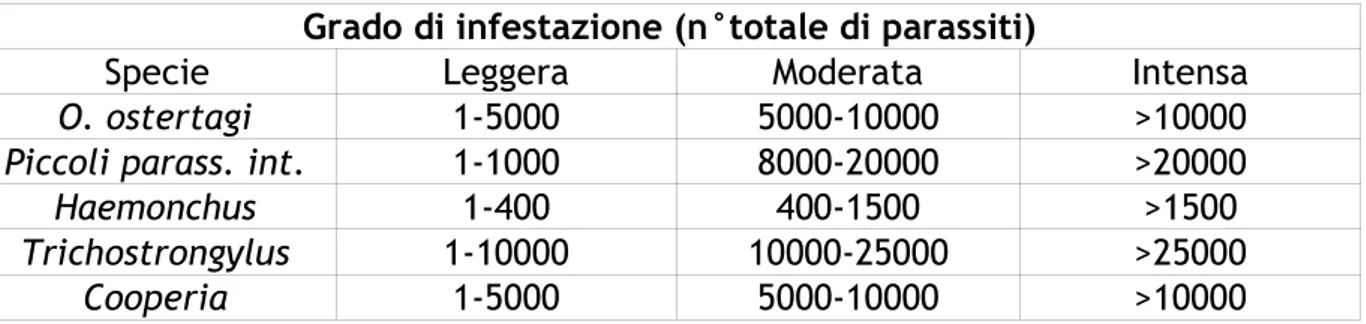
Tabella n.14. Linee guida all’interpretazione del numero di soggetti adulti degli
strongili gastrointestinali (Hansen e Perry, 1994).
Grado di infestazione (n°totale di parassiti)
Specie Leggera Moderata Intensa
O. ostertagi 1-5000 5000-10000 >10000
Piccoli parass. int. 1-1000 8000-20000 >20000
Haemonchus 1-400 400-1500 >1500
Trichostrongylus 1-10000 10000-25000 >25000
Cooperia 1-5000 5000-10000 >10000
In definitiva oltre all’azione sottrattiva, questi parassiti sono ingraddo di compromettere la digestione e l’assorbimento delle sostenze nutritive determinando un’alterazione del metabolismo proteico, idrico e salino(Ambrosi, 1995; Fox, 1997; Coop e Kyriazakis, 2001). Ciò interferisce negativamente con le produzioni per le quali gli animali sono allevati e può essere responsabile di fenomeni di ipofertilità nelle femmine e diminuita vitalità nei giovani animali (Ambrosi, 1995; Fox, 1997).
4.3. Strongiloidosi
Nei vitelli di solito si riscontrano valori inferiori a 150-200 upg (Ambrosi, 1995); pertanto, il riscontro di livelli più elevati di infestazione può essere usato come mi-sura di allerta di rischio sanitario poiché la malattia si manifesterà in vario grado a seconda della gravità dell’infezione e a causa delle perdite produttive conseguenti allo scadimento delle condizioni fisiche. Il valore di 150-200 upg può essere preso anche come soglia per un eventuale rischio zootecnico. In alcuni studi si è stimato un calo di profitto sino al 15% sul peso vivo dell’animale e fino al 25% sul peso della carcassa. Pur essendo frutto di dati sperimentali, tali rilevazioni costituiscono una stima indicativa del potenziale rischio della perdita produttiva legata all’elmintiasi in esame (Ambrosi, 1995).
Secondo alcuni autori (Ambrosi, 1995) la presenza di una positività, anche con va-lori inferiori a quelli precedentemente indicati, ma con ampia diffusione rappre-senta un importante indice di rischio zootecnico sia per gli animali stabulati che per quelli al pascolo; ciò risulta particolarmente rilevante tra il 1° ed il 4° mese di vita dei vitelli. Solitamente nei soggetti adulti, vacche e vitelloni , è raro il riscon-tro di prevalenze elevate (Ambrosi, 1995); pertanto, se l’infestazione si manifesta in tali gruppi della mandria, ciò costituisce un chiaro segno di allarme epidemiolo-gico per l’intero allevamento.
Fattori di rischio ambientali sono rappresentati da una elevata temperatura, da un alto tasso di umidità, da condizioni di sovraffollamento sia sul pascolo che in bulazione e da una abbondante presenza di materiale organico. Per gli animali sta-bulati, inoltre, un fattore determinante è l’irrazionalità del piano di stabulazione e la gestione della lettiera, oltre alla trasmissione della parassitosi col colostro ed il latte materno (Ambrosi, 1995).
Le maggiori perdite produttive sono legate allo stato di anemia, ai disturbi di assorbimento dei nutrienti con conseguente dimagrimento e ritardi della crescita (Ambrosi, 1995; Puccini, 1992, Casarosa, 1985; Urquhart, 2002; Perrucci et al., 1999).
4.4. Dictiocaulosi bovina
Nelle regioni a clima temperato Dictyocaulus viviparus è causa di considerevoli perdite economiche nell’allevamento bovino, tuttavia tale parassitosi non si riscontra in Italia fatta eccezione per delle positività riportate nelle zone alpine od in altre zone nel caso di importazioni dall’estero ed in particolare dalla Francia (Ambrosi, 1995). Stabilire la soglia per intraprendere un trattamento a fini terapeutici è abbastanza semplice, mentre definire il limite per identificare il rischio zootecnico è molto più complesso. Tale situazione si verifica fondamentalmente a causa della mancanza di dati sull’infezione naturale e delle ampie differenze individuali di suscettibilità alla malattia. Quindi, definire parametri utili per la soglia preventiva è impresa ardua a causa dell’imprevedibilità dell’insorgenza dei sintomi, per cui è importante valutare attentamente le condizioni che possono esporre ad un eventuale rischio epidemiologico (Eysker et al. , 1994; Ploeger e Eysker, 2000).
Nel caso della dictyocaulosi non si valutano le uova ma le larve di cui si stima la quantità nelle feci (Euzeby, 1981); infatti, nel ciclo biologico di questo parassita sono le larve di 1° stadio ad essere emesse all’esterno con le feci degli animali. Considerando l’esistenza di una certa proporzione tra il numero di larve per grammo di feci (lpg) e la popolazione elmintica adulta, ci è dato stabilire la probabilità della gravità della patologia e della insorgenza delle manifestazioni cliniche. Ambrosi (1995) individua tre range in cui inquadrare la gravità di questa malattia parassitaria: con un valore medio pari a 40-60 lpg l’infezione si considera di grado debole, caratterizzata da una sintomatologia scarsa o da un quadro subclinico; tale valore segna il limite oltre il quale la malattia si rende clinicamente evidente. Si definiscono gravi le infezioni con valori compresi tra 150 e 300 lpg, mentre con valori di 350-400 lpg o superiori si ha un’infezione molto grave(Tab. n.15).
Tabella n.15. Correlazione tra larve per grammo di feci (lpg) e gravità della
dictyocaulosi bovina (Ambrosi, 1995)
Gravità dell’infestazione lpg (valore medio) Debole o Subclinica ≤40-60
Moderata >40-60
Grave >150<300 Gravissima >350-400
Su base epidemiologica, considerando la percentuale di positività dei capi colpiti alle analisi coproscopiche, è possibile effettuare una stima del rischio zootecnico d’allevamento mettendolo in correlazione alla prevalenza (Tab. n.16).
Tabella n.16. Percentuale dei capi colpiti da Dictyocaulus viviparus in un
allevamento bovino e rischio zootecnico correlato (Ambrosi, 1995)
Prevalenza(% di positività coproscopica) Rischio zootecnico 15 Moderato 40 Marcato 60 Elevato 80 Elevatissimo
Alcuni autori (Jarrett et al., 1954), in studi su animali infestati sperimentalmente hanno osservato che l’azione patogena di Dictyocaulus viviparus si evidenzia con valori superiori a 50 lpg, mentre oltre 150 lpg si ha un’infezione grave. Altri studi sperimentali (Ploeger, 2000), invece, considerano come valore limite all’insorgenza di manifestazioni patenti una carica parassitaria di 300-500 L1; un tale livello di infezione, in base ad un fattore di correzione pari a 0,3 (Ploeger e Eysker, 2000), corrisponderebbe ad una popolazione di 90-150 elminti adulti.
4.5. Ascaridiosi
Data la capacità di Neoascaris vitulorum di sottrarre notevoli quantità di proteine e aminoacidi attraverso la mucosa intestinale, il profilo sieroproteico evidenzierà un’ipoproteinemia generale da denutrizione e una ipoalbuminemia (Ambrosi, 1995).
Oltre all’azione sottrattiva del parassita, tale condizione patologica è determinata dall’alterazione della funzionalità epatica per il riassorbimento di elevate quantità di cataboliti elmintici e a causa delle lesioni dirette al parenchima epatico, che risulta interessato dal passaggio delle larve nella prima fase del loro ciclo.
All’esame del quadro metabolico risulta inoltre una diminuzione nel tasso ematico di glucosio, correlato alla sottrazione di glucidi a livello intestinale; inoltre considerata l’utilizzazione del calcio da parte del parassita, sono frequenti anche quadri di ipocalcemia, in cui lo stato carenziale si manifesta con fenomeni di rachitismo e deperimento, anche in relazione all’alterazione relativa al metabolismo glucidico (Ambrosi, 1995).
A causa della compromessa funzionalità epatica ed in relazione a possibili quadri di ostruzione del coledoco, si possono registrare aumentati livelli di corpi chetonici che conferiscono all’alito degli animali un caratteristico odore “agliaceo” o “butir-rico”. Ciò rappresenta una eventualità determinante nella resa produttiva, in quanto tale odore permane nelle carni anche in seguito alla macellazione, con con-seguente possibilità di deprezzamento o sequestro della carcassa (Ambrosi, 1995; Puccini, 1992;Urquhart, 2002; Casarosa, 1985).
Il danno produttivo maggiore di questa parassitosi deriva quindi dagli scarsi incrementi ponderali dei soggetti giovani e dal mancato indice di conversione che per una produzione di vitelli da carne costituisce una grave problematica, determinando ingenti perdite economiche.
Le femmine di questo parassita sono molto prolifiche, infatti depongono centinaia di migliaia di uova al giorno per ogni esemplare (Ambrosi, 1995), ciò comporta valori molto elevati di upg. Una elevata positività, quindi, è data anche dalla presenza di un numero esiguo di femmine; ciononostante, il riscontro coprologico
positivo, anche se a bassi livelli alla flottazione, deve essere considerato un elemento di rischio zootecnico (Ambrosi, 1995).
In genere si registrano incidenze del 2-8% degli allevamenti di una data area, mentre nei singoli soggetti il riscontro è inferiore al 2%. Esiste una differenza significativa anche in base alla fascia d’età dell’ospite; infatti, nei vitelli di 3 mesi circa si registrano positività fino al 13%, del 10% in quelli di 5-6 mesi, la prevalenza scende all’1,5-2,5% nei soggetti di 8-10 mesi, mentre risulta pressoché raro trovare delle positività negli animali adulti (Ambrosi, 1995). Da tali dati epidemiologici risulta quindi evidente che il riscontro di positività elevate nei capi di età superiore ai 6-8 mesi costituisce un fattore di allarme per un eventuale rischio zootecnico; negli adulti la sola positività rappresenta un reale pericolo per lo stato sanitario dell’intero allevamento.
La presenza di questa malattia parassitaria in allevamento rappresenta una minac-cia al mantenimento di un adeguato livello dello stato di salute degli animali anche perché risulta frequentemente correlata all’insorgenza di complicanze batteriche, in particolare sostenute da colibacilli (Ambrosi, 1995), con aggravamento della sin-tomatologia gastroenterica, dimagrimento e scadimento progressivo delle condizio-ni dei capi. Inoltre è stato frequentemente osservato un quadro di poliparassitismo che vede la presenza concomitante dell’ascaridiosi con la coccidiosi e la strongiloi-dosi (Ambrosi, 1995). Infine, risulta possibile un’associazione tra ascaridiosi e suc-cessiva strongilosi, in cui si verifica una marcata sinergia nell’azione patogena e nel determinare danni produttivi (Ambrosi, 1995).
4.6. Cestodosi
Effettuare un’analisi quantitativa del rischio zootecnico e sanitario della bovina, sia in termini di upg sia cercando di stabilire un eventuale rapporto di quest’ultimo dato con il numero di elminti adulti, risulta scarsamente significativo; infatti le modalità in cui le uova si liberano dalle proglottidi hanno andamento e ritmi del tutto irregolari (Ambrosi, 1995).
Innanzitutto si rende necessario valutare le diverse situazioni di rischio in relazione alle differenti classi di età, considerando la biologia dell’ospite intermedio e dei
ritmi produttivi dell’allevamento estensivo con le mandrie al pascolo (Ambrosi, 1995).
Bisogna innanzitutto considerare che, nelle aree a clima temperato e mediterraneo, l’attività degli acari oribatidi ospiti intermedi si concentra tra marzo e giugno, diminuisce in estate per poi aumentare nuovamente in autunno ed avere un periodo di stasi da dicembre a febbraio. Inoltre, tenendo conto del fatto che le nascite dei vitelli si concentrano soprattutto in primavera si può affermare che non esiste rischio di infezione, se non minimo, per le vacche e le manze, in quanto dotate di resistenza naturale. Anche le manzette ed i vitelloni al secondo pascolo, risultano libere dal rischio di contrarre la parassitosi in esame; essi infatti risultano dotati di resistenza acquisita. Diversa, invece è la situazione per i vitelli di sei- sette mesi durante il periodo autunnale, per i quali esiste un ipotetico rischio, nel caso in cui le condizioni climatiche estive abbiano risparmiato gli Oribatidi (Ambrosi, 1995).
Frequente è l’infezione intercorrente con gli strongili gastrointestinali e con
Strongyloides papillosus., tra di essi si instaura una sinergia che determina una
sintomatologia più grave, talvolta mortale con amplificazione del danno produttivo la cui incidenza tende a raddoppiare o addirittura a triplicare. La capacità dell’anoplocephalidosi di potenziare i danni di altre elmintiasi concomitanti assume rilievo così elevato da rappresentare una fonte di rischio sia zootecnico che sanitario, anche in assenza di alte turbative produttive.
Indicativo risulterebbe eseguire gli esami su animali sintomatici e su un numero significativo di vitelli ed il riscontro di una condizione di poliparassitismo, in particolare con l’individuazione strongili gastrointestinali, Strongyloides, coccidi, cestodi, tricocefali e ascaridi, starebbe ad indicare un elevato rischio per l’allevamento.
Riguardo i cestodi, in genere nella specie bovina si ritrovano positività maggiori soprattutto nei vitelli da ristallo importati, con valori medi del 3-35% nei singoli capi e del 25% nei gruppi. Negli allevamenti locali si arriva a evidenziare fino al 40-50% di positività.
Indicativo ai fini della valutazione dello stato sanitario dell’allevamento è estrapolare il valore medio delle upg rilevate nei vitelli, infatti secondo alcune
ricerche la stima di oltre 200 upg di tale parametro statistico potrebbe configurarsi come valore predittivo di un potenziale rischio per la salute degli animali e le performances produttive dell’intero allevamento ( Ambrosi, 1995).
Dai rilievi emato-chimici si può invece evidenziare ipoproteinemia, ipocalcemia ed una diminuzione di glucosio poiché questi parassiti sottraggono aminoacidi, glucidi e calcio, sostanze che vengono assorbite tramite il tegumento esterno (Ambrosi, 1995); inoltre il soggetto colpito riporta uno stato di anemia e cachessia
4.7. Fasciolosi
Esiste un generale consenso sul fatto che la fasciolosi possa determinare gravi danni produttivi (Loyacano et al., 2002; Dosay-Akbulut et al., 2005) ma non è ancora stato stabilito con chiarezza come valutare la carica parassitaria e il metodo che permetta di stimarne gli effetti negativi in varie condizioni di management, di nutrizione e aree geografiche (Genicot et al., 1991; Vercruysse e Claerebout, 2001). Per quanto riguarda la fasciolosi, il problema dell’interpretazione del numero delle UPG è ulteriormente complicato per le metodiche di laboratorio che prevedono tempi lunghi, come la tecnica di sedimentazione rapida (Ambrosi, 1995; Gibbons et al., 2005) e le difficoltà tecniche. Inoltre, l’applicazione di modelli matematici allo studio di questa parassitosi è difficilmente attuabile a causa dei molteplici fattori di variabilità che influenzano il ciclo biologico e lo stesso sviluppo del parassita. Il rischio infatti risulta correlato alle condizioni climatiche, alla presenza del vettore, al management dei pascoli ed alle condizioni ambientali in genere (Euzeby, 1981; Ambrosi, 1995; Urquhart, 1998). Si deve poi considerare che la valutazione quantitativa della fasciolosi assume significato relativo dal momento che la sola copropositività deve essere presa in considerazione; infatti, dal punto di vista epidemiologico, l’eliminazione delle uova di Fasciola hepatica, anche quando non siamo in presenza di una malattia manifesta, assume importanza poiché sappiamo che da una sola di queste uova, in caso di condizioni ambientali favorevoli, possono originare parecchie centinaia di metacercarie infestanti. Secondo alcuni autori (Urquhart, 1998) oltre 2000 metacercarie sarebbero responsabili di una forma acuta e grave della malattia, la forma subacuta invece si esplicherebbe con 500-1500 metacercarie, mentre con un livello di 200-500 elminti si avrebbe la forma cronica.
Le perdite produttive sono interpretabili come sequestro dei fegati al macello (Frangipane di Regalbono, 2006) e dimagramento o mancato incremento ponderale (Loyacano et al., 2002); da alcuni studi si è stimata una perdita di 1,5-5 Kg al mese in presenza di 200 esemplari ed in media cali di peso di circa il 5-10% con 54
osservano un minor tasso di fecondazioni, di gravidanze e di parti, nonché un aumento degli aborti e della mortalità neonatale (Ambrosi, 1995; Loyacano et al., 2002). Tutto è però molto relativo, perché secondo altre ricerche animali parassitati da 400 forme adulte, stabulati e ben nutriti, hanno mostrato crescite giornaliere soddisfacenti. In condizioni di pascolo 30 parassiti sono considerati sufficienti a determinare perdite economiche sensibili. In termini di UPG questo numero di parassiti equivale a 5-10 unità. Le perdite diventano considerevoli da 10 a 40 UPG e le forme diventano clinicamente evidenti oltre 40 UPG stabilendo un segnale di allerta per lo stato sanitario dell’allevamento e di rischio epidemiologico (Ambrosi, 1995). Comunque, la valutazione delle UPG non è molto significativa in quanto nella maggior parte dei casi esse risultano molto basse, generalmente si registrano meno di 5 UPG anche negli allevamenti massivamente infestati. Ciò si può spiegare poichè esiste una marcata fluttuazione nell’emissione delle UPG nel corso della giornata e da tale fatto sorge la necessità di eseguire campionamenti multipli in considerazione di taluni aspetti del ciclo del parassita in esame e del fatto che la deposizione delle uova da parte degli adulti è irregolare così come è irregolare il loro transito lungo le vie biliari. Inoltre, è necessario tener presente che in un allevamento bovino la quantità di uova emesse variano moltissimo tra gli animali perché, come accade anche per molti altri parassiti, nell’azienda la maggior parte della popolazione parassitaria e, quindi delle UPG, è concentrata in pochi animali altamente sensibili e recettivi (Ambrosi, 1995; Colditz et al., 1996; Shaw et al., 1997). Il numero di uova prodotte diminuisce all'aumentare della carica e della resistenza dell’ospite (Colditz et al., 1996, Shaw et al., 1997). A tali aspetti si aggiunge il fatto che le tecniche diagnostiche coprologiche sono veramente poco sensibili, inoltre nelle forme acute o nelle prime fasi dell’infezione le uova mancano nelle feci, determinando un risultato falso negativo all’analisi coprodiagnostica. Proprio in questi casi un numero superiore a 1000 metacercarie è causa di sintomatologia clinica acuta. Dal punto di vista diagnostico e di valutazione del rischio, la fasciolosi acuta può essere valutata considerando il valore ematico delle transaminasi tra cui la Gamma-Glutamil-Transpeptidasi (gGT) ne rappresenta l’indicatore più sensibile, considerando che i valori normali di gGT nel bovino sono inferiori a 50 U/mL,
mentre in studi sperimentali è stato osservato che nei bovini infetti con 1000 metacercarie tale parametro aumenta fino a 317 U/mL (Vercruysse e Claerebout, 2001) ed a 150 U/mL in caso di infestazioni sostenute da 360 cercarie (Anderson et al., 1977).
Studi sperimentali hanno dimostrato che negli animali infettati con 1000 metacer-carie si possono ridurre del 28% le rese produttive previste (Hope Cawdery et al., 1977). In condizioni naturali si sono registrate significative perdite delle rese, con un carico di circa 30-80 parassiti adulti (Dargie, 1986). La maggior parte delle per-dite si verificano nelle prime sedici settimane di infezione, tale condizione perdura per tutta la fase cronica della malattia. Diversi autori (Koopman, 1969; Malone, 1986) hanno evidenziato come in un allevamento si verifichino significative perdite della produzione zootecnica con una prevalenza (n° animali parassitati/totale de-gli animali presenti nell’allevamento) di infezione maggiore al 25 %.
Pertanto, si può definire la soglia produttiva, intesa come valore che segna il limite tra la convenienza di trattare o meno gli animali parassitari, la presenza di un numero superiore ai 30 parassiti per ciascun animale, oppure una prevalenza nell’allevamento superiore al 25% (Vercruysse e Claerebout, 2001 ). Tuttavia in base ad un recente studio condotto nelle aziende svizzere è stato evidenziato come in presenza di prevalenze a livelli inferiori (16%) presenti in allevamento come forme subcliniche possono indurre significative perdite delle performances produttive nella specie bovina (Schweizer et al., 2005).
Considerando che una Fasciola adulta e fertile produce circa 25000 uova al giorno (Happich and Boray, 1969) Malone e Craig (1990) nei loro studi hanno elaborato una sintesi che permette una valutazione del livello di gravità di infestazione. Da tali ricerche emerge che il riscontro di un numero di UPG superiore a 5 definisce la possibilità del rischio produttivo, con valori di 10-40 si hanno evidenti perdite economiche ed oltre 40 UPg si ha un livello connesso ad una sintomatologia clinica evidente.
Secondo Ambrosi (1995) la soglia del rischio zootecnico sarebbe rappresentata dal rilievo di 50-60 UPG, mentre la copropositività nel 15-20 % dei capi costituirebbe un segnale di allarme epidemiologico. Le infezioni croniche gravi in genere sono
determinate da 200 elminti adulti e ad esse sono correlate perdite da 1,5 a 5 kg di peso al mese, in media si registrano perdite del 5-10 % (Ambrosi, 1995)
Oltre alle analisi coprologiche, a fini diagnostici, soprattutto nelle prime fasi dell’infezione, si possono utilizzare anche test immunologici (ELISA sia per la ricerca dell’antigene che per la ricerca degli anticorpi); tali test però sono solo qualitativi e non quantitativi , tuttavia nel caso di forme acute dei giovani animali, in cui le analisi coprologiche risultano negative, perchè ancora in fase prepatente, la positività dei test indica la necessità di un tempestivo trattamento. Nelle forme croniche, invece, maggiormente indicativo a tale scopo risulta la valutazione degli enzimi indice di danno epatico e più in generale i parametri metabolici (Ambrosi, 1995; Vercruysse e Claerebout, 2001).
Per quanto riguarda le alterazioni relative al profilo emato-chimico, indicative dei danni in corso di fasciolosi, è possibile osservare una marcata eosinofilia, legata ad una elevata risposta immunitaria cellulo-mediata. E’ inoltre possibile osservare anemia legata all’azione ematofagica del parassita (Ambrosi,1995), ai tragitti emorragico-necrotici a livello del parenchima dovuti alla migrazione delle forme giovanili (Puccini, 1992; Ambrosi, 1995) e, infine, alla depressione dell’attività eritropoietica legata a fatti tossici ed emolitici dovuti a processi autoimmuni (Ambrosi, 1995). Parallelamente, a livello del quadro sieroproteico, è possibile riscontrare ipoproteinemia per una diminuzione delle proteine totali, mentre mediante l’esecuzione di un protidogramma si evidenzia ipergammaglobulinemia, ipoalbuminemia e, più in generale, un’inversione del rapporto albumine/globuline (Ambrosi, 1995) e conseguenti alterazioni osmotiche per perdita della funzione stabilizzatrice sulla pressione colloido-osmotica svolta dall’albumina. Ciò si verifica soprattutto in relazione a processi infiammatori cronici a livello epatico che progressivamente esitano in una disorganizzazione strutturale e funzionale dell’organo; infatti, col sopraggiungere della cirrosi si ha un abbassamento del tasso proteico ematico con riduzione della pressione oncotica, passaggio di liquidi nei tessuti e comparsa di edemi discrasici (Puccini, 1992).
Le alterazioni del profilo biochimico-enzimatico si manifestano con un aumento del livello ematico di LDH, SDH, GOT, GPT,LAP, ALP e GGT. In merito a quest’ultimo enzima solitamente nelle forme cliniche supera le 50U/l, quindi è segno di un
avvenuto danno epatico da F.hepatica; nelle forme sintomatiche si può arrivare a 317 U/l. In generale valori medi di 150 unità segnalano un rischio produttivo e sanitario per l’intero allevamento (Anderson et al., 1977; Ambrosi, 1995; Vercruysse et Claerebout, 2001).
Si può inoltre registrare un’alterazione dell’equilibrio idrico-salino e la riduzione dei livelli minerali più importanti come il calcio ed il fosforo. Anche a carico del metabolismo azotato si notano modificazioni, con aumento dell’uremia e del tasso di azoto ureico (Ambrosi, 1995).
In definitiva le alterazioni metaboliche croniche e la sintomatologia correlata, portano ad uno stato di cosiddetta “cachessia parassitaria”, condizione per cui lo scadimento delle condizioni degli animali infetti diviene progressivo e può esitare nella morte del soggetto (Puccini, 1992).
Quindi pur essendo attenuati i sintomi nelle infestazioni di lieve entità, viste le conseguenze della malattia, essa risulta incidere notevolmente sulle produzioni zootecniche (Casarosa, 1985; Puccini, 1992; Ambrosi, 1995; Urquhart, 1998; Cringoli et al., 2002; Schweizer et al., 2005 ).
4.8. Dicroceliosi
Solitamente le prevalenze maggiori si hanno negli adulti, infatti le vacche sono po-sitive per il 45%, le manze al 2° pascolo per il 32%, mentre i vitelli da ristallo alla fine del primo pascolo per l’11 % (Ambrosi, 1995).
La stima quantitativa della carica parassitaria può essere un valido indicatore delle condizioni dell’allevamento stesso, in particolare è stato evidenziato che il rilievo di 3000 parassiti adulti rappresenta il limite oltre il quale compare un effetto negativo sulla produttività (Ambrosi, 1995).
Con valori di 3000-10000 adulti si ha una infezione grave, mentre il riscontro di oltre10000 elminti è correlabile alla comparsa di notevoli ripercussioni sullo stato di salute degli animali colpiti, oltre che ad un grave rischio epidemiologico, costituendo infatti un possibile serbatoio di diffusione per il resto della mandria. Altro parametro da valutare è l’entità numerica delle uova emesse, generalmente
con meno di 100 UPG si ha una carica trascurabile di elminti adulti e quindi ciò non costituisce segnale di potenziale rischio zootecnico. Positività di 150-250 UPG indicano cariche elmintiche di poco inferiori al limite di 3000 adulti.
Nei bovini di solito si hanno valori coproscopici bassi, spesso inferiori a 30 UPG ed anche la carica elmintica di solito si mantiene su valori bassi, infatti è piuttosto raro il riscontro di oltre 2000 parassiti adulti (Ambrosi, 1995).
Tuttavia nel caso di copropositività diffuse con valori medi inferiori a 100 UPG si identifica una condizione di allarme epidemiologico, mentre con valori di 200 UPG l’allevamento è sottoposto a rischio zootecnico. Raramente i valori individuali superano le 300 UPG, in tale caso viene compromesso lo stato sanitario della mandria poiché si tratta di infezioni gravi.
Le alterazioni del profilo emato-chimico si registrano soprattutto nelle forme cro-niche (Ambrosi, 1995), tra queste più frequentemente si riscontra anemia ipocro-mica normocitica (Ambrosi, 1995; Otranto e Traversa, 2003), eosinofila ed inversio-ne del rapporto linfociti/inversio-neutrofili.
Come nel caso della fasciolosi anche nella dicroceliosi l’intensa infiltrazione del tessuto epatico da parte di tessuto connettivo porta in esito finale ad un quadro di cirrosi con perdita della struttura e della funzionalità epatica (Puccini, 1992; Ambrosi, 1995). Poiché sede della biosintesi dell’albumina risulta essere il fegato, si registra un’ipoalbuminemia associata ad ipergammaglobulinemia con diminuzione del rapporto Albumine/Globuline (Ambrosi, 1995).
Si può verificare anche una diminuzione del tasso di glucosio ematico (Ambrosi, 1995), ciò si esplica soprattutto a causa della sottrazione di sostanze nutritive e per l’attività dismetabolica provocata dalle lesione epatiche (Puccini, 1992). Un ulteriore rilievo è rappresentato dall’aumento del tasso ematico di azoto ureico. Nelle forme acute e recenti si può registrare un’alterazione del profilo enzimatico (Ambrosi, 1992), in quanto i parametri che lo compongono sono soggetti ad una più rapida modificazione in caso di sofferenza epatocellulare e quindi assumono il ruolo di funzionalità epatica.
Solitamente in correlazione ad una dicroceliosi acuta si ha un aumento di enzimi come GLDH, GOT, LDH, SDH, GPT, AP, ALP, GGT (Ambrosi, 1995).
Per quanto concerne la perdita produttiva i dati a disposizione sono scarsi, tuttavia è stata stimata una perdita in termini di carne di circa 4 kg al mese oltre alla per-dita del fegato alla macellazione (Ambrosi, 1995) in caso di sequestri totali o par-ziali. Recenti acquisizioni sull’argomento hanno messo in evidenza che la percen-tuale di fegati soggetti a sequestro a causa dell’ infestazione massiva da
D.dendri-ticum è del 14,9% nei macelli del Veneto (Frangipane di Regalbono, 2006). Altri
au-tori quindi sottolineano l’importanza di tale endoparassitosi negli allevamenti ita-liani, identificandola come una fonte di grosse pardite economiche e di problemi sanitari (Veneziano et al., 2006).