3. Risultati
Premessa
Nel nostro laboratorio attualmente è in corso un progetto di ricerca volto a studiare il ruolo del recettore 5-HT2B durante lo sviluppo embrionale di Xenopus laevis. E’ stato clonato il gene X5-HT2B e ne è stato studiato il “pattern” di espressione spazio-temporale nel sistema nervoso centrale. Con esperimenti di RT- PCR è stato dimostrato che il gene X5-HT2B è trascritto a partire da stadio 35 ed a stadio 40 l’mRNA di X5-HT2B è visualizzabile, mediante ibridazione in situ, nel tubo neurale e nella retina. In entrambi i distretti, X5-HT2B raggiunge i livelli maggiori di espressione in corrispondenza dei precursori neurali in attiva proliferazione. (De Lucchini et al., 2003). I risultati ottenuti, supportati dai dati presenti in letteratura, hanno fatto ipotizzare un ruolo del recettore 5-HT2B in processi di proliferazione cellulare. Durante la mia tesi di laurea ho preso parte a questo progetto, effettuando lo studio funzionale di questo recettore.
3.1. Studio funzionale del recettore X5-HT2B
L’analisi funzionale del gene X5-HT2B è stata eseguita attraverso esperimenti di sovraespressione e perdita di funzione genica mediante microiniezioni rispettivamente di specifici mRNA e oligonucleotidi antisenso modificati (morpholino). In ogni esperimento di microiniezione, insieme al trascritto di interesse ho coiniettato il trascritto di un gene “reporter” per poterne visualizzare
la localizzazione. I geni “reporters” utilizzati sono il gene lacZ, che codifica per l’enzima batterico βgalattosidasi che è in grado di metabolizzare un substrato cromogenico colorando in rosso o in azzurro (a seconda del substrato usato) la porzione dell’embrione in cui si sono localizzati i trascritti, e il gene che codifica per la proteina fluorescente “green fluorescent protein” (GFP). Entrambi questi geni se microiniettati, non interferiscono con i normali processi di sviluppo di questo organismo. Le dosi con cui i trascritti sono iniettati sono state messe a punto per ogni singolo gene mediante esperimenti pilota in cui è stata verificata la dose massima iniettabile senza che si riscontrassero effetti tossici. In particolare ho microiniettato 500 pg/embrione circa di trascritto per il recettore X5-HT2B, 300 pg/embrione di trascritto per lacZ o GFP e 15 ng/embrione circa di oligonucleotidi antisenso morpholino.
3.1.1. Perdita di funzione di X5-HT2B
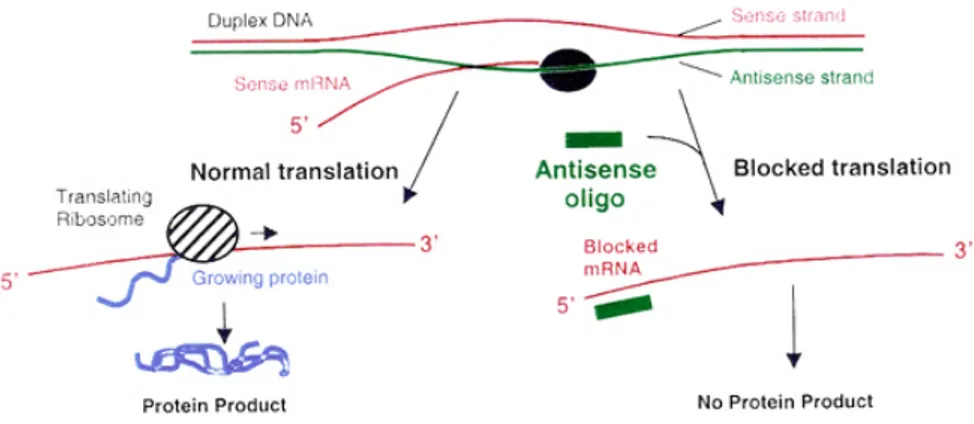
Per effettuare gli esperimenti di perdita di funzione ho microiniettato in un blastomero di embrioni di Xenopus allo stadio di due o quattro cellule un oligonucleotide antisenso, modificato per essere più stabile all’interno delle cellule, che è in grado di bloccare la traduzione della proteina 5-HT2B (figura 1).
Ho utilizzato due oligonucleotidi modificati (indicati come Mo_1 e Mo_2), complementari rispettivamente ai venticinque nucleotidi a valle e ai venticinque nucleotidi a monte del primo codone di inizio della traduzione dell’mRNA del recettore 5-HT2B. Ho microiniettato parallelamente due morpholinos diversi per poter confrontare i fenotipi che ne derivano. Come mostrano le figure 2A e 2C, i due morpholinos danno lo stesso fenotipo e questo mi ha permesso di confermare la specificità della loro azione. Inoltre studi su questa tecnica hanno dimostrato che sono sufficienti quattro mutazioni puntiformi nei venticinque nucleotidi della sequenza del morpholino per rendere il suo legame con l’mRNA instabile. Perciò, parallelamente, ho microiniettato in alcuni embrioni un oligonucleotide, uguale nella sequenza al morpholino 1 ma con quattro mutazioni puntiformi, che ho utilizzato come esperimento di controllo. In questo modo ho potuto dimostrare che la microiniezione di un oligonucleotide antisenso modificato non è di per sé tossica per l’embrione, nè riproduce effetti simili a quelli osservati con l’iniezione del morpholino sperimentale.
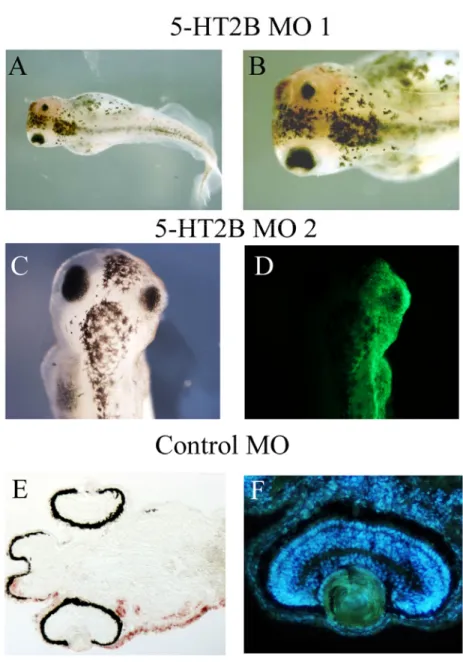
I riquadri A,B,C,D della figura 2, mostrano embrioni di Xenopus a stadio 42, iniettati col morpholino 1/2, in cui è possibile visualizzare la localizzazione dell’iniezione grazie alla presenza del cromogeno rosso della βgalattosidasi, in A e B, o della proteina verde fluorescente GFP, in C e D.
Una prima analisi morfologica di questi embrioni, mi ha permesso di osservare che l’occhio è una delle strutture maggiormente colpite perché non solo è ridotto in dimensioni ma presenta anche dei difetti nella chiusura della fessura ottica. Inoltre questi embrioni riportano anche delle malformazioni cardiache, che però non sono visibili dalle immagini mostrate, e ciò è in accordo con i dati presenti in letteratura derivati da studi sul topo (Choi et al., 1997, Nebigil and Maroteaux, 2001).
Parallelamente ho analizzato sezioni di embrioni a stadio 42, iniettati con il morpholino di controllo, contro colorate con l’hoechst, che è una colorazione fluorescente che permette di visualizzare i nuclei cellulari. Come è possibile vedere dal riquadro E della figura 2, immagine in campo chiaro di una sezione orizzontale di un embrione, iniettato con il Mo di controllo, a stadio 42, non ci sono differenze tra il lato iniettato e quello di controllo. Inoltre il riquadro F, in cui è raffigurato l’ingrandimento della sezione di una retina del lato iniettato mostra che il morpholino di controllo, non ha alcun effetto strutturale sulla retina.
Figura 2: Effetti dell’iniezione del Mo_1 (A, B) e del Mo_2 (C,D) del recettore 5-HT2B sullo sviluppo
embrionale. In A e B, embrioni di Xenopus a stadio 42, iniettati unilateralmente, allo stadio di due cellule, con il Mo_1 e l’mRNA per βgalattosidasi. In C immagine in campo chiaro di un embrione di Xenopus a stadio 42, iniettato con il Mo_2 e l’mRNA per GFP. In D, visione in campo scuro dell’embrione della figura C che permette di visualizzare il lato iniettato grazie alla fluorescenza della GFP. In E, sezione orizzontale di un embrione di
Xenopus a stadio 42, iniettato col Mo di controllo e l’mRNA di βgalattosidasi. In F, visione in campo scuro della
retina della sezione della figura E, colorata con l’hoechst.
Dato che lo sviluppo dell’occhio è fortemente alterato dal blocco della traduzione del recettore e dato che la retina, grazie alla sua struttura laminare ben determinata, si presta come un ottimo sistema modello per lo studio dello sviluppo del sistema nervoso, ho concentrato la mia attenzione sulla retina.
Per analizzare più dettagliatamente il fenotipo dell’occhio ho ottenuto sezioni al criostato degli embrioni iniettati con il morpholino per vedere se c’erano difetti strutturali ed ho processato le sezioni per immunoistochimica con un anticorpo contro tubulina e le ho contro colorate con l’hoechst. Sia l’N-tubulina, che è una proteina localizzata sugli assoni, che l’hoechst, che colora i nuclei cellulari, consentono di evidenziare eventuali variazioni della laminazione della retina.
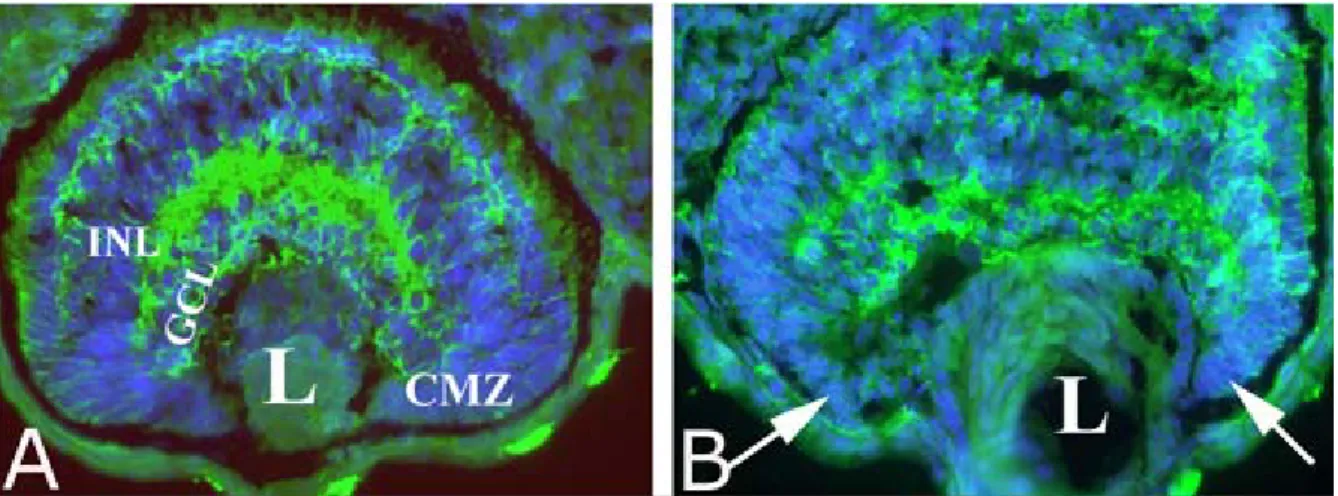
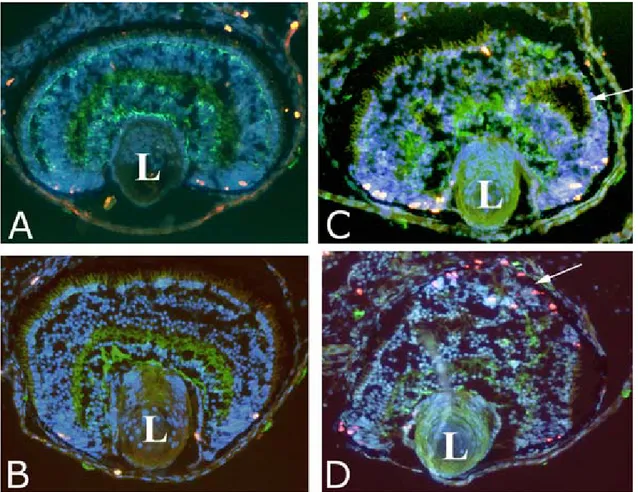
Nella retina “wild-type” (wt) (figura 3A) sia la fluorescenza verde che è l’N-tubulina, che quella blu, l’hoescht, mostrano chiaramente la tipica struttura laminare e finemente organizzata della retina. Invece, la retina del lato iniettato appare completamente disorganizzata e non vi si può distinguere la caratteristica alternanza di strati cellulari e plessiformi. Inoltre sembra che anche la zona del margine ciliare (CMZ), sede dei progenitori multipotenti delle cellule retiniche, che negli anfibi permane anche nella vita adulta, sia alterata nel lato iniettato (figura 3B).
Figura 3:Sezioni orizzontali di retine di embrioni a stadio 42, “wild type” (A) e iniettato col Mo del recettore
5-HT2B (B), processate per immunoistochimica con un anticorpo contro N-tubulina (fluorescenza verde) e colorate con l’hoechst (fluorescenza blu). La zona del margine ciliare (CMZ) risulta alterata nel lato iniettato come indicato dalle frecce.
Quest’ultimo dato ci è sembrato molto interessante in quanto lo studio del pattern di espressione di X5-HT2B aveva evidenziato una forte espressione dell’mRNA di questo gene nella CMZ. Per verificare se c’erano delle anomalie in questa zona, ho effettuato un esperimento di ibridazione in situ su sezioni di
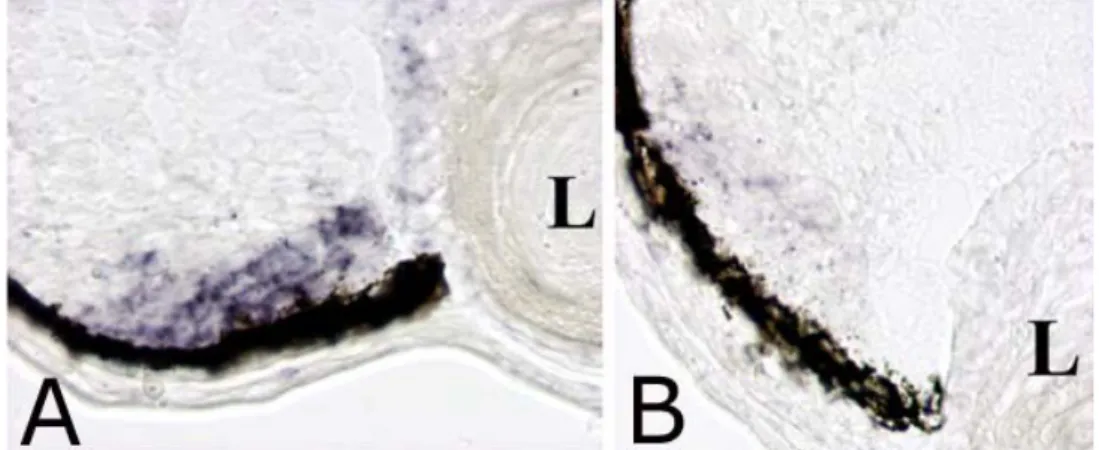
embrioni a stadio 42 usando la ciclina D1, proteina presente nelle cellule in attiva proliferazione, come marcatore della CMZ. La figura 4A mostra la sezione di una retina “wild-type” dove, nella CMZ, c’è una forte espressione dell’mRNA della ciclina D1. Nella retina degli embrioni iniettati, invece, l’espressione dell’mRNA della ciclina D1 è drasticamente ridotta (figura 4B).
Figura 4: Ibridazione in situ con il marcatore ciclina D1 su sezione orizzontali di embrioni di Xenopus a stadio
42, “wild-type” (A) e iniettato con il morpholino del recettore 5-HT2B (B). L’espressione dell’mRNA della ciclina
D1 è fortemente ridotta nella retina dell’embrione iniettato.
Per verificare se la disorganizzazione della struttura laminare della retina potesse essere dovuta ad un incremento della morte cellulare ho effettuato un saggio per visualizzare le cellule in apoptosi su sezioni di embrioni a stadio 42. La figura 5A mostra la sezione di una retina wt, dove le cellule in apoptosi, in arancio, sono sporadiche. Le figure 5B e 5C, invece, mostrano sezioni della retina di embrioni iniettati con il Mo, in cui il tasso di apoptosi è fortemente più alto rispetto ai controlli.
Figura 5: Apoptosi indotta dall’iniezione del morpholino del recettore 5-HT2B. “Tunel assay” su sezioni
orizzontali di embrioni di Xenopus a stadio 42, “wild-type” (A), e iniettati con il morpholino del recettore 5-HT2B (B, C). Il tasso di apoptosi aumenta notevolmente nelle retine degli embrioni iniettati.
Questo studio di perdita di funzione mi ha permesso di ipotizzare che il recettore 5-HT2B abbia un ruolo neurotrofico, prendendo parte a processi di proliferazione cellulare e citoprotezione.
Per avere ulteriori conferme, ho studiato gli effetti della sovraespressione genica di questo recettore.
3.1.2. Sovraespressione genica di X5-HT2B
Per effettuare esperimenti di guadagno di funzione ho microiniettato in un blastomero di un embrione di Xenopus allo stadio di due o quattro cellule, l’mRNA di X5-HT2B, reso più stabile dall’aggiunta di una coda di poliA all’estremità 3’ e da un “cap” all’estremità 5’. Anche in questo caso, è possibile visualizzare la localizzazione del trascritto, mediante la coiniezione del trascritto di un gene “reporter”.
Inoltre a partire da stadio 25, stadio in cui tutte le cellule della retina sono ancora in attiva proliferazione, ho somministrato 5-HT 50 µM nel mezzo di coltura agli embrioni iniettati con l’mRNA di X5-HT2B, per essere sicura che il recettore ectopico venisse attivato. Parallelamente ho somministrato 5-HT 50 µM anche ad alcuni embrioni wt, come controllo del fatto che la dose di 5-HT somministrata non fosse di per sé tossica.
Ho analizzato sezioni orizzontali di embrioni a stadio 42, wt, wt trattati con 5-HT, iniettati con il mRNA di X5-HT2B e trattati con 5-HT. Queste sezioni, rispettivamente nelle figure 6A, B, C, D, sono state processate con una doppia immunoistochimica con anticorpi contro l’N-tubulina e contro il fosfoistone H3 e sono state contro colorate con l’hoescht. L’N-tubulina, fluorescenza verde, e l’hoescht, fluorescenza blu, consentono di evidenziare eventuali difetti strutturali della retina, mentre il fosfoistone H3, fluorescenza rossa, mette in evidenza le cellule in attiva proliferazione.
Dal confronto tra la retina wt e la retina dell’embrione wt trattato con 5-HT, rispettivamente nelle figure 6A e 6B, emerge che tra le due, non ci sono
sostanziali differenze strutturali, in quanto in entrambe sono chiaramente distinguibili tutti gli strati tipici della retina. Se queste due figure si paragonano con le figure 6C e 6D, entrambe immagini di retine di embrioni iniettati con l’mRNA di X5-HT2B e trattati con 5-HT, emerge subito che negli embrioni in cui il recettore 5-HT2B è stato sovraespresso e attivato con 5-HT, la struttura della retina è profondamente alterata.
Figura 6: Effetti della sovraespressione genica del recettore 5-HT2B mediante microiniezione in un blastomero
di embrioni di Xenopus allo stadio di due cellule. Sezioni orizzontali di embrioni a stadio 42 processate con doppia immunoistochimica con anticorpi contro N-tubulina, fluorescenza verde, e fosfoistone H3, fluorescenza rossa e controcolorate con Hoechst, fluorescenza blu. Confronto tra retine di embrioni type” (A), “wild-type” trattati da stadio 25 con 5-HT (B), iniettati con l’mRNA di 5-HT2B e trattati da stadio 25 con 5-HT (C, D).
Non vi si può distinguere la caratteristica stratificazione e la struttura appare completamente disorganizzata e confusa. I difetti nella laminazione sono
anche evidenziati dalla comparsa di strutture particolari, chiamate “a rosetta”, indicate dalla freccia nella figura 6C.
Per quanto riguarda il tasso di proliferazione, tra la retina wt e la retina dell’embrione wt trattato con 5-HT, non ho riscontrato differenze e in entrambe, le cellule in proliferazione sono localizzate solamente nella CMZ. Invece tra queste due retine e quelle degli embrioni iniettati e trattati con 5-HT ho riscontrato forti differenze sia nel tasso di proliferazione che nella localizazione delle cellule in proliferazione. Infatti, non solo, le cellule in divisione sono molte di più ma sono anche presenti in regioni della retina dove normalmente si trovano solo cellule differenziate.
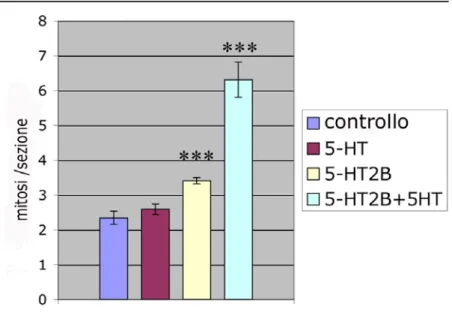
Questi dati, emersi da una prima osservazione morfologica, sono stati confermati dal conteggio delle cellule in proliferazione che è stato riportato nel grafico della figura 7. Infatti quello che emerge è che tra le retine degli embrioni wt e di quelli wt trattati con 5-HT non ci sono differenze sostanziali nel tasso di proliferazione. Invece, si può già notare un leggero aumento del tasso di proliferazione in retine di embrioni in cui è stato solamente sovraespresso il recettore, ma questo diventa drastico nelle retine di embrioni in cui il recettore non solo è stato sovraespresso, ma anche attivato con 5-HT.
Figura 7: Analisi statistica delle cellule immunoreattive per il fosfoistone H3 in sezioni orizzontali di retine di
embrioni di Xenopus a stadio 42. Sono state prese in considerazione retine di embrioni “wild-type” (controllo), “wild-type” trattati da stadio 25 con 5-HT (5-HT), solo iniettati con l’mRNA di 5-HT2B (5-HT2B), iniettati con l’mRNA di 5-HT2B e trattati da stadio 25 con (5-HT 5-HT2B+5-HT).
3.2. Presenza di serotonina nell’embrione di
Xenopus laevis
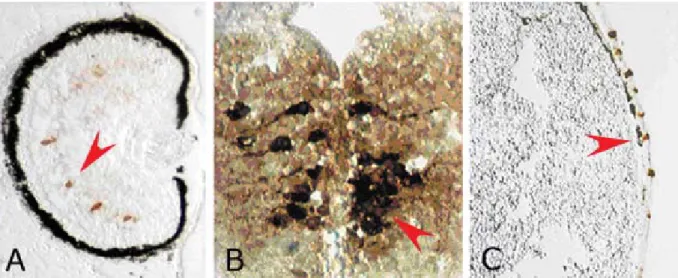
Per caratterizzare spazialmente e temporalmente la presenza di serotonina, nel sistema nervoso di Xenopus laevis, durante lo sviluppo, ho effettuato esperimenti di immunoistochimica con un anticorpo contro la 5-HT, su sezioni sagittali e orizzontali di embrioni a vari stadi. Con questa tecnica, il primo stadio in cui ho potuto riscontrare l’immunoreattività alla serotonina è stadio 35, come mostrato nella figura 8. I neuroni messi in evidenza in questa immagine, sono i neuroni serotoninergici dei nuclei del raphe, localizzati nel rombencefalo ventrale.
Effettuando esperimenti di immunoistochimica su sezioni di embrioni a stadio più tardivo, 42 (figura 9), e su sezioni di encefalo adulto (figura 10) ho messo in evidenza che la serotonina rimane presente nei neuroni del raphe e nei loro prolungamenti assonali per tutta la vita. Inoltre a stadio 42 è possibile vedere che c’è immunoreattività alla serotonina anche a livello dello strato nucleare interno della retina (figura 9A), in cellule che dalla letteratura si sa essere amacrine, e a livello di alcune cellule della pelle (figura 9C).
Figura8: In (A) disegno di un embrione di Xenopus in visione laterale a stadio 35. In (B), sezione sagittale di
un embrione di Xenopus a stadio 35, processata per immunoistochimica con un anticorpo contro la 5-HT. A questo stadio la serotonina è presente a livello dei nuclei del raphe, nel rombencefalo ventrale.
Figura 9: Immunoistochimica con un anticorpo contro la serotonina su sezioni orizzontali di embrioni di
Xenopus a stadio 42. A questo stadio l’immunoreattivà per la serotonina è riscontrabile a livello dello strato
nucleare interno della retina (A), dei nuclei del raphe (B), e dell’epidermide (C) come mostrato dalle frecce rosse.
Figura 10: in (A) e (B) sezioni sagittali di encefalo di Xenopus adulto processate per immunoistochimica con un
anticorpo contro la serotonina. Coma mostrato dalla marcatura la serotonina è presente a livello dei nuclei del raphe del rombencefalo ventrale e nei nuclei ipotalamici ventrali.
3.3. Studio del “pattern” di espressione di
X5-HTT (SERT)
Un approccio per studiare il ruolo della serotonina nello sviluppo è quello di modularne l’omeostasi, ad esempio interferendo sul suo “re-uptake” o sulla sua biosintesi, e verificarne successivamente gli effetti sullo sviluppo embrionale. A questo scopo è possibile alterare la funzionalità di geni come il trasportatore serotoninergico X5-HTT, proteina che media l’internalizzazione di 5-HT. Attualmente questo gene non risulta clonato in Xenopus laevis ma nel nostro laboratorio mediante una ricerca in banca dati abbiamo identificato un clone di cDNA in una banca di cloni EST (Expressed Sequence Tags) di Xenopus contenente un frammento lungo 1400 bp contenente una porzione del cDNA dell’omologo in Xenopus di 5HTT. Per verificare la distribuzione spazio-temporale dell’mRNA di X5-HTT ho effettuato esperimenti di ibridazione in situ sia su sezione che “whole mount”. Ho trascritto in vitro questo frammento, che era contenuto in un vettore Bluescript, e ho preparato una sonda a RNA antisenso marcata con digossigenina.
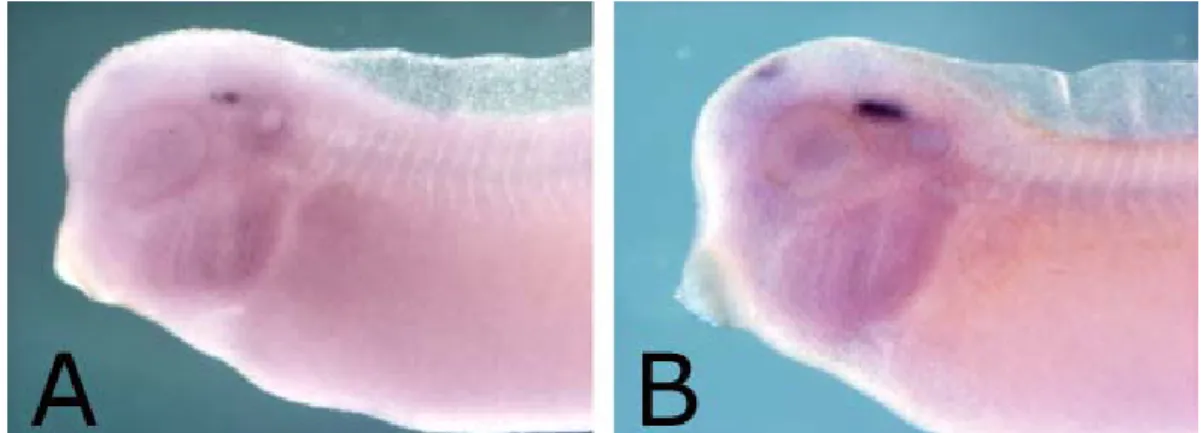
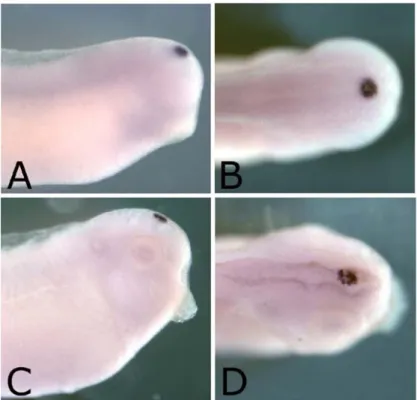
Dall’analisi dei risultati è emerso che nell’embrione di Xenopus, l’mRNA di XSERT compare per la prima volta a stadio 30 ed è localizzato nei neuroni del raphe, a livello del rombencefalo ventrale, come mostra la figura 11A.
Esperimenti di ibridazione in situ su stadi più tardivi, 33, 35, 42 e 45, e sull’encefalo adulto, hanno mostrato che l’mRNA di X5-HTT, rimane presente, nei nuclei del raphe di Xenopus, per tutto il ciclo vitale (figure 11, 12, 13, 14).
Inoltre, da questi esperimenti è emerso che l’RNA messaggero di XSERT si esprime transientemente, intorno a stadio 33, anche nella ghiandola pineale (figura 11), e che da stadio 45 si esprime in alcune cellule dello strato nucleare interno della retina (figura 13A).
Figura 11: ibridazione in situ “whole mount” di embrioni di Xenopus a stadio 30 (A) e 33 (B), con una sonda
antisenso per l’mRNA di X5-HTT. A questi stadi l’mRNA è espresso nella ghiandola pineale e nei nuclei del
raphe.
Figura 12: Ibridazione in situ su sezioni di embrioni di Xenopus per l’mRNA di X5-HTT. In (A) sezione sagittale
di un embrione a stadio 35; in (B) sezione orizzontale di un embrione a stadio 42. In entrambi l’espressione dell’mRNA di X5-HTT è localizzata a livello dei nuclei del raphe.
Figura 13: ibridazione in situ su sezioni di Xenopus per l’mRNA di X5-HTT. In (A), sezione orizzontale di una
retina di un embrione di Xenopus a stadio 45 in cui l’espressione dell’mRNA, mostrata dalla freccia, è localizzata in alcune cellule dello strato nucleare interno; in (B), sezione sagittale del rombencefalo di uno Xenopus adulto in cui l’espressione dell’mRNA di SERT è localizzata nei nuclei del raphe indicati dalla freccia.
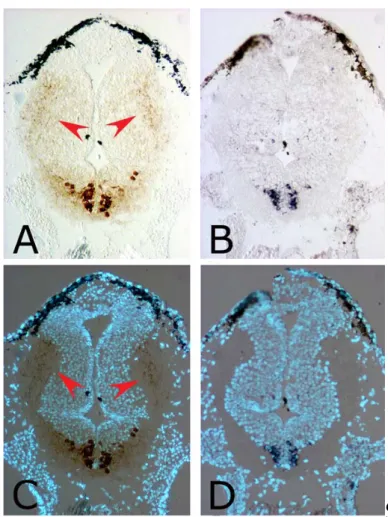
Per avere un ulteriore conferma del fatto che l’mRNA di XSERT, nel raphe, è localizzato nei neuroni serotoninergici ho confrontato sezioni adiacenti di embrioni a stadio 42, processate per immunoistochimica contro la 5-HT (figure 14 A, C) e per ibridazione in situ per X5-HTT (figura 14 B,D). Dopo entrambi gli esperimenti ho contro colorato le sezioni con l’hoescht; in questo modo sovrapponendo le immagini delle sezioni in campo chiaro a quelle rispettive in fluorescenza ho potuto confermare che sia la 5-HT che l’mRNA di X5-HTT, si trovano a livello degli stessi corpi cellulari (figura 14). Dal confronto delle sezioni processate per immunoistochimica con quelle processate per ibridazione in situ ho constatato che l’mRNA di X5-HTT è effettivamente espresso, a livello del raphe, in neuroni che sono positivi per l’immunoreattività alla serotonina.Inoltre dalle figure 14A e 14C si possono apprezzare, indicate dalle frecce, le proiezioni assonali dei neuroni serotoninergici del raphe ai distretti encefalici più anteriori.
Figura 14: Sezioni orizzontali adiacenti di embrioni di Xenopus a stadio 42, processate per immunoistochimica
fluorescente.
3.4. Studio del “pattern” di espressione di
XTph
Recentemente, è stato dimostrato che in zebrafish esistono 3 isoforme di Tph (Teraoka et al., 2004), mentre in topo, ratto e uomo (Patel et al., 2004;) esistono 2 isoforme di questo enzima: la Tph1, espressa prevalentemente nei distretti periferici, nella pineale e i fotorecettori retinici e la Tph2 espressa prevalentemente nei nuclei del raphe. In Xenopus è stato clonato un gene omologo nella sequenza alla triptofano idrossilasi ma non era possibile stabilire a quale delle due isoforme sopra descritte corrispondesse. Perciò, per chiarire l’identità del gene e per stabilire se fosse adatto per studi funzionali volti a perturbare l’omeostasi serotoninergica nel sistema nervoso, ho effettuato esperimenti di ibridazione in situ “whole mount” e su sezioni di embrioni di Xenopus a vari stadi. Per gli esperimenti di ibridazione in situ, ho utilizzato una sequenza contenuta in un clone di cDNA in una banca di cloni EST di Xenopus, che ho trascritto in vitro per ottenere una sonda a RNA antisenso marcata con digossigenina. Da questo studio è emerso che l’mRNA di XTph, comincia ad essere espresso, a livello della ghiandola pineale a partire da stadio 28 (figura 15) e continua ad essere espresso in queste cellule per tutto il ciclo vitale.
Da esperimenti di ibridazione in situ su sezioni orizzontali di embrioni di Xenopus a stadio 45, è emerso che a stadi più tardivi dello sviluppo, l’mRNA di XTph è espresso nei fotorecettori dell’occhio (figura 16A) e nella ghiandola pineale (figura 16B), dove la sintesi di serotonina è una tappa della biosintesi della melatonina, ma anche nell’encefalo (figura 16C), nell’intestino (figura 16D) e nel faringe (figura 16E).
Figura 15: ibridazione in situ “whole mount” per l’mRNA di XTph.. Embrioni di Xenopus a stadi 28 e 37 in
si ha espressione nei fotorecettori dell’occhio (A), nella ghiandola pineale (B), nell’encefalo (C), nell’intestino (D) e nel faringe (E) come mostrato dalle frecce rosse.
Per verificare se i nuclei encefalici messi in evidenza dall’ibridazione in situ erano quelli serotoninergici del raphe, ho processato, per ibridazione in situ per X5-HTT e per XTph, sezioni adiacenti di embrioni di Xenopus a stadio 45. Confrontando queste sezioni, rispettivamente nelle figure 17B, D e 17A, C , ho visto che questi due messaggeri non sono espressi negli stessi neuroni ma in zone diverse dell’encefalo. Infatti sezioni adiacenti mostrano che dove è espresso l’mRNA di XSERT, cioè nei nuclei del raphe, non c’è espressione dell’mRNA di XTph. Perciò il gene che possediamo in laboratorio è l’omologo, in Xenopus, della triptofano idrossilasi 1, in quanto non è espressa nei nuclei del raphe.
Figura 17: in (A) e (C), ibridazione in situ su sezioni orizzontali di Xenopus a stadio 45 per l’mRNA di X5-HTT.
In (B) e (D), ibridazione in situ su sezioni orizzontali di Xenopus a stadio 45 per l’mRNA di XTph.
Per avere un’ ulteriore conferma di questo dato ho processato sezioni sagittali di encefalo di Xenopus adulto per immunoistochimica con l’anticorpo contro la serotonina e per ibridazione in situ per X5-HTT e per XTph1.
L’immunoistochimica per la serotonina, mostrata nella figura 18A mette in evidenza i neuroni serotoninergici nel rombencefalo ventrale, che sono i nuclei del raphe, e dei neuroni più anteriori, probabilmente a livello dell’ipotalamo ventrale. Invece, l’esperimento di ibridazione in situ per il trasportatore, mostrato nella figura 18C, mette in evidenza solamente i nuclei serotoninergici rombencefalici, mentre quello per la XTph1, mostrato nelle figure 18B, mette in evidenza solo neuroni serotoninergici ipotalamici indipendenti dal sistema serotoninergico del raphe.
contro la serotonina (A) e per ibridazione in situ con una sonda a RNA antiusenso per l’mRNA di XTph (B) e