RISULTATI E DISCUSSIONE
Precedentemente nei nostri laboratori, la tecnica della suppression subtractive hybridisation (SSH) ha permesso la costruzione di due banche sottrattive di cDNA, forward e reverse, costituite rispettivamente dai trascritti dei geni la cui espressione è modulata positivamente o negativamente nel cervello di ratto, dopo trattamento cronico con ALC (Traina et al., 2004). Questa tecnica risulta particolarmente efficiente nell’isolamento di trascritti rari o poco espressi (Gurskaya et al., 1996), non evidenziabili con altre tecniche che analizzano pattern di espressione genica.
I cDNA delle due banche sono stati clonati e sottoposti a screening. I cloni ottenuti sono stati circa 1500.
Nel presente studio vengono riportati i dati relativi allo screening di circa 600 cloni.
L’utilizzo della tecnica della SSH permette di eliminare i trascritti comuni ai due campioni, selezionando solo i trascritti differenzialmente espressi. Tuttavia, le due banche sottrattive potrebbero ancora contenere trascritti comuni a entrambe i campioni tester e driver. Ciò vuol dire che, alcuni cloni nelle due banche sottrattive potrebbero non essere differenzialmente espressi. Lo screening primario permette di eliminare questi cloni, falsi positivi, utilizzando la tecnica degli Spot Blot (par. 6 “Materiali e Metodi”).
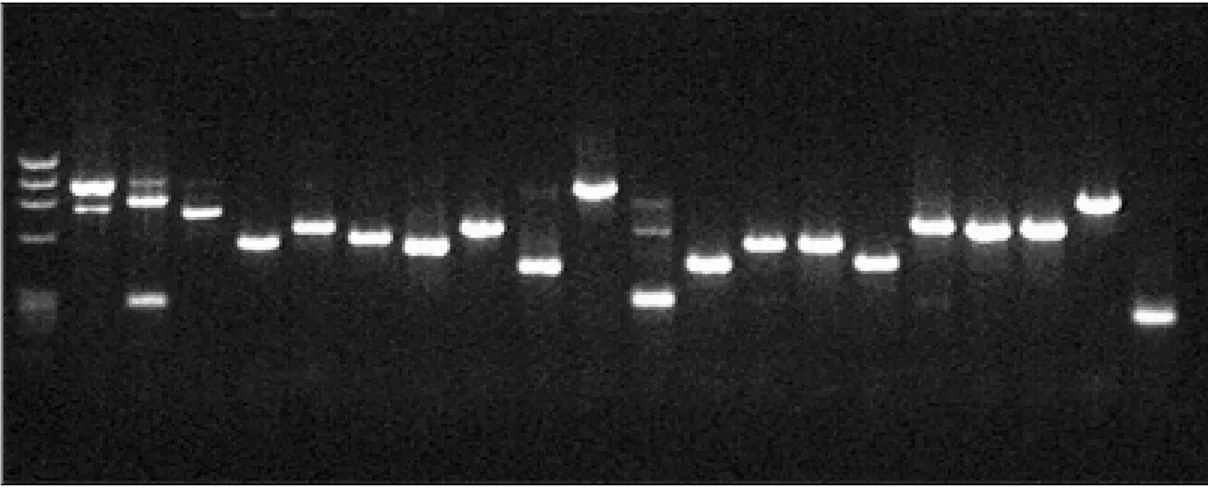
La colony PCR, effettuata con primers complementari alle regioni presenti ai due lati del sito di clonaggio, ha permesso di amplificare il nostro inserto. I trascritti amplificati sono stati analizzati in un gel di agarosio al 2%, consentendo di individuare i cloni non contaminati. Nella figura 3 è riportato un esempio di amplificazione dei cloni della banca forward.
Figura 5: COLONY PCR DI ALCUNI CLONI DELLA BANCA FORWARD, MARKER IX.
La diversità dei pesi molecolari dei prodotti di PCR indica che la maggior parte dei cloni cDNA non sono ridondanti. 1µl del prodotto di PCR è stato trasferito con pipettor su due membrane Hybond N+, dopo essere stato denaturato. Le due membrane sono state cross-ibridate utilizzando come sonde i cDNA che costituiscono le banche sottrattive, marcate con marcatura non radioattiva. Inoltre nella miscela di preibridazione e di ibridazione sono stati aggiunti come competitori gli stessi primers e le loro sequenze complementari precedentemente utilizzati per la costruzione delle banche, al fine di evitare ibridazioni aspecifiche. I cloni che presentano un
segnale positivo con una sonda ma non con l’altra, o comunque un segnale differente, rappresentano, con un’alta probabilità, cloni che contengono trascritti di geni espressi in maniera differenziale. Nella figura 4 sono mostrati i risultati da noi ottenuti.
A B
Figura 6: IBRIDAZIONE DEGLI SPOT BLOT.
Gli spot rappresentano il prodotto della PCR di cloni della banca forward. La membrana A è stata ibridata con la sonda T-C (forward); diversamente, la membrana B è stata ibridata con la sonda C-T (reverse).
I risultati sono stati interpretati secondo il protocollo descritto nel PCR-Select Differential Screening Kit User Manual (BD Biosciences).
Dopo aver isolato il DNA plasmidico, contenente l’inserto, da ciascun clone, le sequenze di interesse sono state sequenziate con sequenziatore automatico e sono state analizzate mediante comparazione con le sequenze depositate nelle banche dati GenBank, EMBL, utilizzando programmi come FASTA, BLASTX e BLASTN (par. 8, “Materiali e Metodi”).
ANALISI DELLE SEQUENZE
• CLONE 3BC9
La sequenza del clone 3BC9, ottenuta con sequenziatore automatico è:
AGCGTGGTCGCGGCCGAGGT CCTACGTCTATCTGTCCATGTCTTGTTATTTTGACCGGGATGATGTGGCCCTGAAGAACTTTGCCAAATACTT TCTCCATCAATCTCATGAAGAGAGGGAACATGCTGAGAAACTGATGAAGCTGCAGAACCAGCGAGGTGGACGA ATCTTCCTGCAGGATATAAAGAAACCTGACCGTGATGACTGGGAGAGCGGGCTGAATGCAATGGAGTGTGCAC TGCACTTGGAAAAGAGTGTGAATCAGTCACTACTGGAACTTCACAAACTGGCTACTGACAAGAATGATCCCCA CTTATGTGACTTCATTGAGACGCATTACCTGAATGAGCAGGTGAAATCCATTAAAGAACTGGGTGACCACGTG ACCAACTTACGCAAGATGGGAGCCCCTGAATCTGGCATGGCAGAATATCTCTTTGACAAGCACACCCTGGGAC ACGGTGATGAGAGCTAAGCTGACGTCCCCAAGGCCATGTGACTTTACTGGTCACTGAGGCAGTGCATGCATGT CAGGCTGCCTTTATCTTTTCTATAAGTTGCACCAAAACATCTGCTTAAAAGTTCTTTAATTTGTACCTGCCCC GGGCGGCCGCTC ACCTGCCCGGGCGGCCGCTCGA
La sequenza ottenuta è stata confrontata con le sequenze depositate nella banca dati GenBank, EMBL, utilizzando programmi come: FASTA, BLASTX, BLASTN.
Di seguito sono riportati i risultati ottenuti con il FASTA. Sono indicate le prime tre sequenze a più alta similarità nucleotidica con quella del clone. In blu si possono vedere i codici di accesso in banca dati, per ogni sequenza trovata.
EM_RO:RNU58829 U58829.1 Rattus norvegicus ferr(830)[f]2890 551.9 3.7e-156
EM_RO:CGFERR M99692.1 Hamster iron binding pro(843)[f]2366 453.4 1.7e-126
EM_RO:AB073371 AB073371.1Cavia porcellus mRNA(1053)[f]1753 338.2 8.2e-92
La sequenza del clone 3BC9 mostra una similarità del 100 % con la sequenza RNU58829. Di seguito si può vedere l’allineamento delle due sequenze nucleotidiche.
EM_RO:RNU58829 U58829.1 Rattus norvegicus ferritin-H s (830 nt)
initn: 2890 init1:2890 opt:2890 Z-score: 2926.1 bits:551.9 E():3.7e-156 banded Smith-Waterman score: 2890; 100.000% identity (100.000% ungapped) in 578 nt overlap (1-578:224-801) 10 20 30 3BC9 CCTACGTCTATCTGTCCATGTCTTGTTATT :::::::::::::::::::::::::::::: EM_RO: ACCGCCAGATCAACCTGGAGTTGTATGCCTCCTACGTCTATCTGTCCATGTCTTGTTATT 200 210 220 230 240 250 40 50 60 70 80 90 3BC9 TTGACCGGGATGATGTGGCCCTGAAGAACTTTGCCAAATACTTTCTCCATCAATCTCATG :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: TTGACCGGGATGATGTGGCCCTGAAGAACTTTGCCAAATACTTTCTCCATCAATCTCATG 260 270 280 290 300 310 100 110 120 130 140 150 3BC9 AAGAGAGGGAACATGCTGAGAAACTGATGAAGCTGCAGAACCAGCGAGGTGGACGAATCT :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: AAGAGAGGGAACATGCTGAGAAACTGATGAAGCTGCAGAACCAGCGAGGTGGACGAATCT 320 330 340 350 360 370 160 170 180 190 200 210 3BC9 TCCTGCAGGATATAAAGAAACCTGACCGTGATGACTGGGAGAGCGGGCTGAATGCAATGG :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: TCCTGCAGGATATAAAGAAACCTGACCGTGATGACTGGGAGAGCGGGCTGAATGCAATGG 380 390 400 410 420 430 220 230 240 250 260 270 3BC9 AGTGTGCACTGCACTTGGAAAAGAGTGTGAATCAGTCACTACTGGAACTTCACAAACTGG :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: AGTGTGCACTGCACTTGGAAAAGAGTGTGAATCAGTCACTACTGGAACTTCACAAACTGG 440 450 460 470 480 490 280 290 300 310 320 330 3BC9 CTACTGACAAGAATGATCCCCACTTATGTGACTTCATTGAGACGCATTACCTGAATGAGC :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: CTACTGACAAGAATGATCCCCACTTATGTGACTTCATTGAGACGCATTACCTGAATGAGC 500 510 520 530 540 550 340 350 360 370 380 390 3BC9 AGGTGAAATCCATTAAAGAACTGGGTGACCACGTGACCAACTTACGCAAGATGGGAGCCC :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: AGGTGAAATCCATTAAAGAACTGGGTGACCACGTGACCAACTTACGCAAGATGGGAGCCC 560 570 580 590 600 610 400 410 420 430 440 450 3BC9 CTGAATCTGGCATGGCAGAATATCTCTTTGACAAGCACACCCTGGGACACGGTGATGAGA :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: CTGAATCTGGCATGGCAGAATATCTCTTTGACAAGCACACCCTGGGACACGGTGATGAGA 620 630 640 650 660 670 460 470 480 490 500 510 3BC9 GCTAAGCTGACGTCCCCAAGGCCATGTGACTTTACTGGTCACTGAGGCAGTGCATGCATG :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: GCTAAGCTGACGTCCCCAAGGCCATGTGACTTTACTGGTCACTGAGGCAGTGCATGCATG 680 690 700 710 720 730
520 530 540 550 560 570 3BC9 TCAGGCTGCCTTTATCTTTTCTATAAGTTGCACCAAAACATCTGCTTAAAAGTTCTTTAA :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: TCAGGCTGCCTTTATCTTTTCTATAAGTTGCACCAAAACATCTGCTTAAAAGTTCTTTAA 740 750 760 770 780 790 580 590 3BC9 TTTGTACCTGCCCCGGGCGGCCGCTC :::::::: EM_RO: TTTGTACCATTTCTTCAAATAAAGAATTTTGGTACCC 800 810 820 830
La sequenza a più alta similarità nucleotidica con il nostro campione è rappresentata dalla parte codificante e dal 3’UTR dell’mRNA per la H- ferritina, subunità H. I nostri risultati mostrano che il trattamento cronico con ALC induce una down-regulation dell’mRNA della subunità H, della ferritina.
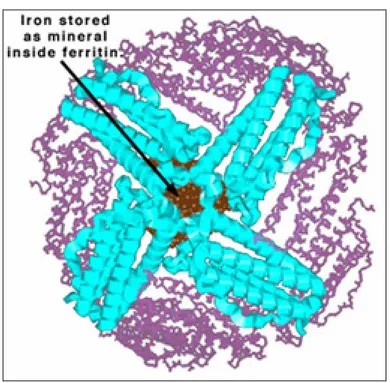
La ferritina è la proteina più importante coinvolta nell’immagazzinamento del ferro, nella maggior parte dei mammiferi. Essa è costituita da un involucro polipeptidico esterno e da un nucleo centrale contenente Fe 3+ -idrossido-fosfato. La ferritina è costituita da 24 subunità, rappresentate in rapporti diversi da catene H, pesanti e L, leggere, che generano le numerose isoforme (Fig. 5). Il rapporto ferro/polipeptide non è costante poiché la proteina può legare o rilasciare il ferro a seconda delle necessità fisiologiche. Pur avendo una capacità di 4500 atomi di ferro, una molecola di ferritina ne contiene normalmente meno di 3000. L’accumulo e il rilascio del ferro sono consentiti da canali in comunicazione con la superficie della proteina.
La subunità H lega e rilascia il ferro a seconda delle necessità fisiologiche della cellula, grazie alla capacità di ossidare gli ioni ferrosi a ioni ferrici. Si trova generalmente in tessuti con un’alta utilizzazione del ferro come il cuore e il cervello. Diversamente, la subunità L è responsabile dell’immagazzinamento a lungo termine del ferro e predomina nel fegato e nella milza. La ferritina può essere considerata contemporaneamente, un sito di immagazzinamento del ferro e un sito di detossificazione della cellula. Infatti, il ferro nella sua forma libera può legarsi a diverse macromolecole influenzandone struttura e funzione, con effetti dannosi per le cellule. La tossicità del ferro è anche attribuita alla sua capacità di partecipare alla
Figura 7: STRUTTURA DELLA FERRITINA.
formazione di specie reattive, come i radicali liberi dell’ossigeno nella reazione di Fenton (Halliwell and Gutteridge, 1989). La ferritina ha dunque il ruolo di catturare e “tamponare “ il pool di ferro nella cellula, giocando un ruolo chiave nel mantenimento dell’omeostasi di tale metallo (Kakhlon et al., 2001). Per questi motivi, il contenuto di ferritina nella cellula è finemente regolato, sia a livello trascrizionale che post-trascrizionale, dal pool intracellulare di ferro “chelabile” o ferro “labile” (Rogers and Munro, 1987). Quando la concentrazione di ferro nella cellula è bassa, la sintesi di ferritina diminuisce; viceversa, quando il livello del ferro è alto, la sintesi di ferritina aumenta. Sebbene in certe circostanze il ferro determini un incremento dell’mRNA della ferritina, agendo a livello trascrizionale (Cairo et al., 1985), la regolazione della ferritina avviene principalmente a livello post-trascrizionale (Zahringer et al., 1976).
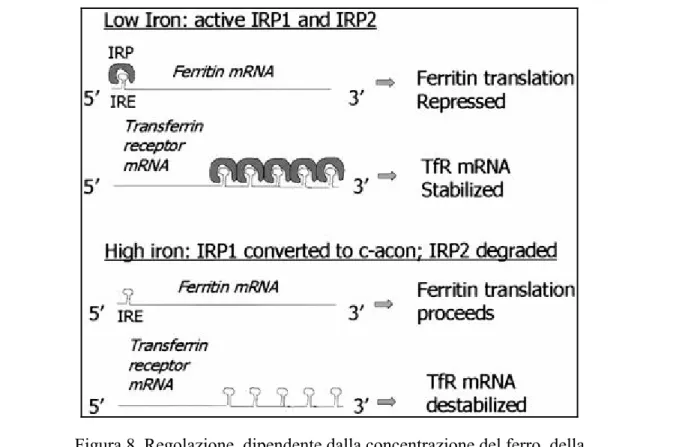
Nel citosol si trovano almeno due proteine che rispondono a cambiamenti della concentrazione del ferro. Esse agiscono da molecole effettrici che controllano la traduzione degli mRNA che codificano per la H-ferritina.
Queste proteine regolatrici del ferro (IRP), di cui la più nota è IRP1, si legano a specifiche strutture stelo-ansa presenti nella regione 5’ dell’mRNA, note come elementi di risposta al ferro (IRE), quando la concentrazione intracellulare del ferro è bassa (Fig. 6) (Rogers and Munro, 1987).
Il legame inibisce l’inizio della traduzione in quanto impedisce alla subunità ribosomale 40S di percorrere l’estremità 5’ dell’mRNA.
Una seconda proteina regolatrice, IRP2, risponde a variazioni dei livelli di ferro. Tuttavia, in questo caso, la proteina è regolata attraverso l’aumento della sua sintesi in condizioni di basse concentrazioni di ferro e della sua degradazione in presenza di elevate concentrazioni dell’elemento (Iwai et al., 1998). L’azione delle IRP è anche modulata attraverso l’attivazione di segnali trasduzionali a cascata, come l’attivazione di proteine chinasi C che fosforilano IRP1 permettendo il legame a IRE (Schalinske and Eisenstein, 1996).
Figura 8. Regolazione, dipendente dalla concentrazione del ferro, della traduzione dell’mRNA per la ferritina. A basse concentrazioni di ferro,
il legame delle proteine regolatrici del ferro (IRP) agli elementi di risposta del ferro (IRE) nell’estremita 5’ impedisce l’inizio della traduzione.
E’ stato visto che nel cervello di ratto, la concentrazione del ferro è alta alla nascita e decresce significativamente durante le prime due settimane di vita per poi salire e stabilizzarsi per il resto della vita (Roskams and Connor, 1994).
Invece, l’mRNA della H-ferritina diminuisce nella prima settimana di vita per poi aumentare e rimanere costante (Levenson and Fitch, 2000). In generale, il rapporto tra subunità H/L varia nelle diverse aree del cervello, nei diversi tipi cellulari e dipende dal loro stato fisiologico. Nei neuroni è predominante la H-ferritina, mentre la L-ferritina è espressa principalmente nella microglia. Solo gli oligodentrociti presentano un’elevata quantità di entrambe le isoforme, ma con un arricchimento della subunità H nella loro fase di sviluppo (Connor e Menzies, 1995). In queste cellule la sintesi della mielina, che è massima nei primi quindici giorni di vita, necessita del ferro direttamente, essendo un cofattore delle reazioni di biosintesi del colesterolo e dei lipidi, e indirettamente poiché il ferro è richiesto per il metabolismo ossidativo (Connor e Menzies, 1996).
L’utilizzo del ferro nel cervello è importante per il normale sviluppo, ma anche per il trasporto degli elettroni e per l’attività di numerosi enzimi responsabili della sintesi di neurotrasmettitori, come tirosina idrossilasi, triptofano idrossilasi e monoammina ossidasi (Rausch et al., 1988).
Numerosi studi hanno suggerito che esiste una relazione tra ferritina e cancro (Worwood, 1980). Elevati livelli di ferritina nel sangue, specialmente della
subunità H, accompagnano la fase di inizio e progressione di molti tumori (Wu et al., 1997). La trascrizione della H-ferritina aumenta in risposta a monochine, stress e fattori di crescita, così come il fattore di necrosi tumorale (TNF-α), l’interleuchina-1β, l’ormone tiroideo T4 (Levenson and Fitch, 2000) ed esteri del forbolo e in alcune condizioni come la denervazione muscolare o l’adesione degli oligodentrociti (Sanyal et al., 1996).
Inoltre, in diversi disordini neurodegenerativi come l’Alzheimer e il Parkinson l’espressione della H-ferritina e l’omeostasi del ferro possono essere alterate. Depositi di ferro nei vasi sanguigni si osservano frequentemente nel cervello di pazienti con Alzheimer (Connor and Menzies, 1995). In pazienti con il Parkinson, invece, l’accumulo di ferro è limitato alla substantia nigra ed è in parte responsabile della malattia (Sofic et al., 1988). Inoltre, la H-ferritina aumenta in tutti gli stadi della sclerosi multipla (Petzold et al., 2002).
Una delle più importanti funzioni della ferritina è di limitare il ferro disponibile per la generazione dei radicali liberi dell’ossigeno (ROS). Per questo motivo la sintesi di questa proteina è regolata a livello trascrizionale e post-trascrizionale dagli agenti ossidanti. Gli ossidanti determinano un aumento della trascrizione della ferritina, agendo direttamente in una regione conservata del gene della ferritina (Tsuji et al., 2000). Lo stress ossidativo può anche contribuire ad aumentare la sintesi della ferritina inattivando IRP1 attraverso l’ossidazione reversibile di residui di cisteina. Tuttavia,
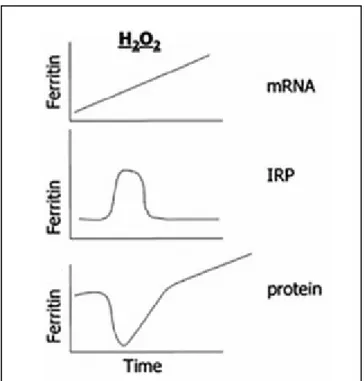
l’inattivazione di IRP1 mediata dagli ossidanti non è sempre vera. Infatti, è stato osservato che il perossido di idrogeno attiva IRP1, probabilmente attraverso la mobilizzazione del ferro dal gruppo prostetico attivando IRP1 (Pantopoulos and Hentze., 1998). Recenti lavori hanno chiarito la regolazione della ferritina da parte degli agenti ossidanti (Orino et al., 2001). In colture BNLCL2 di epatociti di topo, sottoposti a un forte stress ossidativo, IRP1 è attivato solo transitoriamente; dunque, anche la traduzione della ferritina è solo momentaneamente inibita. Allo stesso tempo, però si assiste ad un aumento dell’mRNA della ferritina (Fig. 7).
Figura 9. Regolazione della H-ferritina. Cambiamento temporale della trascrizione e traduzione della ferritina in risposta al perossido di idrogeno.
Immagine tratta da: Torti and Torti, 2002.
L’ischemia tissutale e l’ipossia cellulare alterano la sintesi di ferritina. In particolare, l’H-ferritina aumenta in oligodentrociti di ratto in seguito ad ipossia (Qi et al., 1995). Un simile aumento della ferritina è stato osservato in diverse aree del cervello di ratto, dopo un breve periodo di ipossia-ischemia (Cheepsunthorn et al., 2001). Il cambiamento della sintesi di ferritina è mediato da un’alterazione delle IRP1, che presentano una ridotta capacità di legare l’mRNA dell’H-ferritina. Nel periodo di ossigenazione post-ischemia lo stress ossidativo è alto in diversi tessuti, come il cuore, fegato e cervello. E’ stato visto che durante questa fase, nel fegato di ratto, la concentrazione della ferritina tende a diminuire, poiché viene aumentata la sintesi del suo mRNA seguita da una down-regulation da parte delle IRP1. Sembra che questo controllo sia necessario per ristabilire i livelli di ferritina e per ridurre il danno dovuto all’ossigenazione (Tacchini et al., 1997).
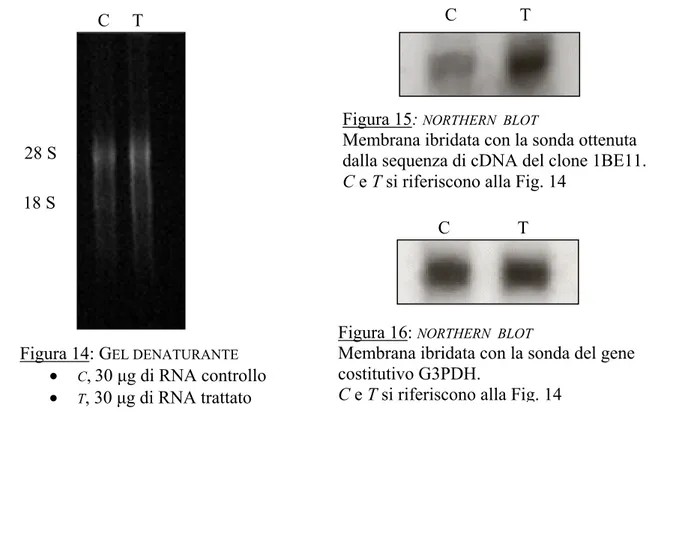
Nei nostri esperimenti per analizzare i livelli dei trascritti della ferritina nel trattato e nel controllo è stato effettuato un Northern Blot (vedi paragrafo. 9.1. “Materiali e Metodi”).
Dopo la corsa elettroforetica, l’RNA è stato trasferito sulla membrana e ibridato con la sonda specifica del clone 3BC9. Successivamente la membrana è stata ibridata con la sonda del gene costitutivo G3PDH, al fine di verificare che la quantità dell’RNA del trattato e del controllo sia la stessa.
Figura 10: GEL DENATURANTE
• C,30 µg di RNA controllo
• T,30 µg di RNA trattato
In questo studio è stato visto che il trattamento cronico con ALC induce una modulazione negativa dell’mRNA della ferritina.
Numerosi studi hanno dimostrato che il trattamento con ALC determina una riduzione dei radicali liberi, aumentando in particolare la sintesi degli enzimi della catena respiratoria. Tali enzimi contengono sia dei centri Ferro-Zolfo che citocromi (ferroproteine eminiche). Data la regolazione trascrizionale dell’H-ferritina è presumibile che l’ALC determini una riduzione della trascrizione della ferritina poiché crea uno stato “destressante”.
Figura 11: NORTHERN BLOT
Membrana ibridata con la sonda ottenuta dalla sequenza di cDNA del clone 3BC9.
C e T si riferiscono alla Fig. 10
Figura 12: NORTHERN BLOT
Membrana ibridata con la sonda del gene costitutivo G3PDH.
C e T si riferiscono alla Fig. 10
C T
28 S 18 S
C T
Inoltre, come si è descritto durante lo sviluppo del SNC la modulazione della H-ferritina è legata ai processi di mielinizzazione che necessitano di ferro. L’ALC potrebbe quindi controllare questo evento agendo sulla H-ferritina. Tutto ciò fa si che l’ALC potrebbe avere un importante ruolo terapeutico nel trattamento di alcune patologie che sono accompagnate da un aumento della H-ferritina.
• CLONE 1BE11
La sequenza del clone 1BE11, ottenuta con sequenziatore automatico è:
AGCGTGGTCGCGGCCGAGGT
ACTCCCATGAGGACAAATATCATTCTGAGGAGCTACAGTAATTACAAACCTATTATCAGCTATCCCTTACATT GGGACTACCCTAGTCGAATGAATCTGAGGAGGCTTCTCAGTAGACAAAGCAACCCTAACACGCTTCTTCGCAT TCCACTTCATCCTCCCATTCATTATCGCCGCCCTTGCAATTGT
ACCTGCCCGGGCGGCCGCTCGA
La sequenza ottenuta è stata confrontata con le sequenze depositate nella banca dati GenBank, EMBL, utilizzando programmi come: FASTA, BLASTX, BLASTN.
Di seguito sono riportati i risultati ottenuti con il FASTA. Sono indicate le prime tre sequenze a più alta similarità nucleotidica con quella del clone. In blu si possono vedere i codici di accesso in banca dati, per ogni sequenza trovata.
EM_RO:RNY17319Y17319.1Rattus norvegicus CDK1(1081)[f]945 200.1 8.9e-51
EM_RO:MMZ96069Z96069.1Mus musculoides DNA fo(1141)[f]652 140.4 8.1e-33
La sequenza del clone 1BE11 mostra una similarità del 100 % con la sequenza RNY17319. Di seguito si può vedere l’allineamento delle due sequenze nucleotidiche.
EM_RO:RNY17319 Y17319.1 Rattus norvegicus CDK110 mRNA (1081 nt)
initn: 945 init1: 945 opt: 945 Z-score: 1031.5 bits: 200.1 E(): 8.9e-51 banded Smith-Waterman score: 945; 100.000% identity (100.000% ungapped) in 189 nt overlap (1-189:310-498) 10 20 30 1BE11 ACTCCCATGAGGACAAATATCATTCTGAGG :::::::::::::::::::::::::::::: EM_RO: AGTCATAGCAACTGCATTCATGGGCTATGTACTCCCATGAGGACAAATATCATTCTGAGG 280 290 300 310 320 330 40 50 60 70 80 90 1BE11 AGCTACAGTAATTACAAACCTATTATCAGCTATCCCTTACATTGGGACTACCCTAGTCGA :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: AGCTACAGTAATTACAAACCTATTATCAGCTATCCCTTACATTGGGACTACCCTAGTCGA 340 350 360 370 380 390 100 110 120 130 140 150 1BE11 ATGAATCTGAGGAGGCTTCTCAGTAGACAAAGCAACCCTAACACGCTTCTTCGCATTCCA :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: ATGAATCTGAGGAGGCTTCTCAGTAGACAAAGCAACCCTAACACGCTTCTTCGCATTCCA 400 410 420 430 440 450 160 170 180 1BE11 CTTCATCCTCCCATTCATTATCGCCGCCCTTGCAATTGT ::::::::::::::::::::::::::::::::::::::: EM_RO: CTTCATCCTCCCATTCATTATCGCCGCCCTTGCAATTGTACATCTTCTTTTCCTCCACGA 460 470 480 490 500 510
La sequenza a più alta similarità nucleotidica con il nostro campione è rappresentata da un mRNA codificante per la citocromo b ossidasi, complesso bc1. I nostri esperimenti hanno dimostrato che l’ALC induce un aumento dell’mtRNA per questa citocromo b ossidasi
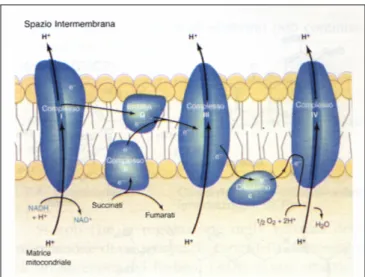
Il citocromo b fa parte del complesso bc1 della citocromo reduttasi o Complesso III, della catena mitocondriale di trasporto degli elettroni. Attraverso tale catena, gli equivalenti riducenti provenienti dai substrati del ciclo di Krebs, dalla β-ossidazione degli acidi grassi e indirettamente dalla
glicolisi, sono trasportati sequenzialmente fino all’ossigeno molecolare; contemporaneamente, il trasferimento di protoni al di fuori della matrice mitocondriale, genera un potenziale di membrana necessario per la sintesi di ATP. I quattro complessi di trasporto degli elettroni sono localizzati asimmetricamente nella membrana mitocondriale (Fig. 11).
La reazione iniziale è catalizzata dal complesso della NADH deidrogenasi (Complesso I), che accetta protoni ed elettroni dal NADH/H+ per trasferirli al coenzima Q. L’ubichinolo (QH2) attraversa la membrana mitocondriale per il
trasferimento degli elettroni ai citocromi bc1 del Complesso III. Gli elettroni passano quindi dal Complesso III al citocromo c che, a sua volta, li trasferisce alla citocromo ossidasi (Complesso IV), e in fine all’ossigeno molecolare.
Figura 13. I quattro complessi dei trasportatori degli elettroni nella sequenza di trasporto degli elettroni nella catena respiratoria mitocondriale.
Il 90% dell’ossigeno cellulare è utilizzato come accettore finale di elettroni durante la fosforilazione ossidativa, responsabile della sintesi dell’ATP. Una piccola parte dell’ossigeno (circa il 2%), è inevitabilmente convertito in composti reattivi dell’ossigeno (ROS), come l’anione superossido (O2-), il
perossido di idrogeno (H2O2) e il radicale idroperossido (HO2.). Sistemi
enzimatici e non enzimatici possono annullare l’azione dei composti reattivi dell’ossigeno e dei radicali liberi. Tuttavia, durante la fase di invecchiamento le difese della cellula tendono a diminuire, divenendo a volte insufficienti (Ozawa, 1997; Wei, 1998). Secondo la teoria dello stress ossidativo, l’accumulo nelle cellule di macromolecole, come DNA, proteine e lipidi, danneggiate dall’azione dei radicali liberi, è responsabile dell’invecchiamento (Harman, 1972).
I radicali liberi, sono delle molecole altamente reattive e possono attaccare rapidamente il DNA mitocondriale (mtDNA), sia perché si trova vicino al sito di produzione dei ROS, sia perché il mtDNA non è legato agli istoni e manca di sistemi di riparazione.
Molte subunità proteiche dei complessi della catena di trasporto degli elettroni sono codificate dal mtDNA, che codifica anche per l’apoproteina del citocromo b. Dunque, mutazioni del mtDNA potrebbero causare disfunzioni mitocondriali responsabili di un aumento dei radicali liberi. Un accumulo di mutazioni a livello del genoma mitocondriale in tessuti anziani, sembra che sia una delle causa del processo di invecchiamento (Linnane et al., 1989).
Mutazioni del mtDNA sono anche responsabili dell’alterazione della funzione mitocondriale, che si osserva in molte miopatie. In alcune miopatie dovute ad una disfunzione del citocromo b, del complesso bc1, si assiste ad un aumento della produzione di radicali liberi, in particolare dell’anione superossido, nel sito di ossidazione dell’ubichinolo (Crofts, 2004).
E’ stato dimostrato che, nel cuore e nel cervello di ratti anziani i livelli dei trascritti mitocondriali, venivano ripristinati dalla somministrazione acuta dell’ALC (Gadaleta et al., 1994). E’ stato ipotizzato che la ridotta trascrizione del mtDNA sia dovuta ad alterazioni bioenergetiche cellulari, in particolare una ridotta disponibilità di ATP. Questa ipotesi è stata avvalorata da studi condotti sul cuore di ratti anziani, in cui è stato dimostrato un ridotto contenuto di cardiolipina nelle membrane mitocondriali, una ridotta attività delle traslocasi degli adenin nucleotidi, della carnitina e una ridotta attività citocromoossidasica, tutte attività ripristinate dal trattamento acuto con ALC (Paradies et al., 1994).
Per analizzare l’espressione dell’mtRNA della citocromo b nei nostri campioni, è stato effettuato un Northern Blot (vedi paragrafo 9.1. “Materiali e Metodi”) e la membrana è stata ibridata con la sequenza di DNA del clone 1BE11 marcata. I risultati ottenuti sono mostrati nelle figure seguenti.
Figura 15: NORTHERN BLOT
Membrana ibridata con la sonda ottenuta dalla sequenza di cDNA del clone 1BE11.
C e T si riferiscono alla Fig. 14
I dati da noi ottenuti hanno mostrato che l’ALC determina un aumento del mtRNA per la citocromo b, a livello cerebrale. Questo dato conferma in ratti giovani l’azione protettiva dell’ALC sulla funzione e struttura mitocondriale, già accertata nei ratti anziani, inoltre attribuisce all’ALC un’azione preventiva nei confronti dello stress ossidativo.
18 S
C T
28 S
Figura 16: NORTHERN BLOT
Membrana ibridata con la sonda del gene costitutivo G3PDH.
C e T si riferiscono alla Fig. 14
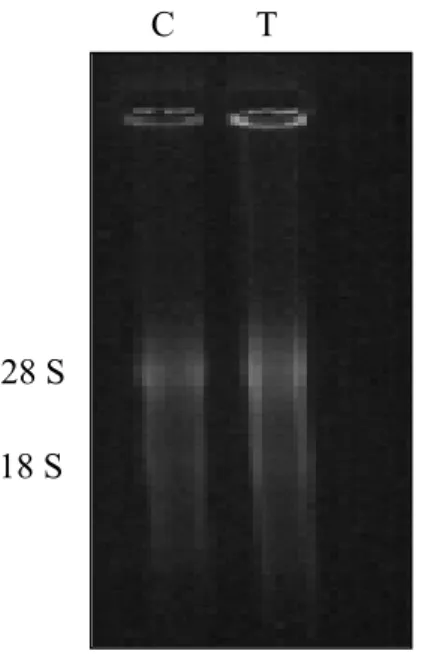
Figura 14: GEL DENATURANTE
• C,30 µg di RNA controllo
• T, 30 µg di RNA trattato
C T
• CLONE 3BC5
La sequenza del clone 3BC5, ottenuta con sequenziatore automatico è:
AGCGTGGTCGCGGCCGAGGT ACCCATTAAACTGCTAAAAATAGTGGTGCGGCTACAAGAGGAGTCCGTTGAGATCCCTAGTGTTGTCAGGGTG TGACCACAATCACCCGCCCAGCTCTGAGCCGGAGAACCTGGAAGCTATTTCATACTCTGGTGCAATGGCAAAA AAAAAGGAATTAAAAAAAAAAAACAGAAGAAAGGAAGAAAACCACACCACAACACAAGGAAGAATTAAGTCCT GAATGACTGGCTTCATCATGCCCACCCTCTCCACCCTAAAATGGCACAAAAGAAATTGCTAACTACACCCTAA AGACTACTTTTGGTGTAAAACAGGTAACTGATGGGCTAGGATGGGAACAGGGCACGATGGGAACAGGGCGTGA CCATCCGATAAAAAAAAAAAAAAACCGTCCCTTTCACGTAGGTGTGT ACCTGCCCGGGCGGCCGCTCGA
La sequenza ottenuta è stata confrontata con le sequenze depositate nella banca dati GenBank, EMBL, utilizzando programmi come: FASTA, BLASTX, BLASTN.
Di seguito sono riportati i risultati ottenuti con il FASTA. Sono indicate le prime tre sequenze a più alta similarità nucleotidica con quella del clone. In blu si possono vedere i codici di accesso in banca dati, per ogni sequenza trovata.
EM_RO:AB039662AB039662.1 Rattus norvegicus VD(1818)[r] 1988 222.7 3e-57
EM_RO:AC095787AC095787.7 Rattus norvegicus 14(242500)[r] 201 35.2 0.8
EM_RO:AC112001AC112001.6 Rattus norvegicus 2 (225052)[f] 198 34.9 1
La sequenza del clone 3BC5 mostra una similarità del 98.795% con la sequenza AbO39662. Di seguito si può vedere l’allineamento delle due sequenze nucleotidiche.
EM_RO:AB039662 AB039662.1 Rattus norvegicus VDAC1 mRNA (1818 nt) rev-comp initn:1190 init1:1190 opt:1988 Z-score:1143.5 bits:222.7 E(: 3e-57
banded Smith-Waterman score: 1988; 98.795% identity (99.515% ungapped) in 415 nt overlap (412-1:1288-1702) 410 400 390 3BC5 ACACACCTACGTGAAAGGGACGG-TTTTTT ::::::::::::::::::::::: :::::: EM_RO: TGTCCCGATCCTGTCTGCTCGGAAGCATGTACACACCTACGTGAAAGGGACGGTTTTTTT 1260 1270 1280 1290 1300 1310 380 370 360 350 340 330 3BC5 TTTTTTTTTATCGGATGGTCACGCCCTGTTCCCATCGTGCCCTGTTCCCATCCTAGCCCA :::::::::::::::::::::::::: ::::::::::::::::::::::::::::::::: EM_RO: TTTTTTTTTATCGGATGGTCACGCCCGGTTCCCATCGTGCCCTGTTCCCATCCTAGCCCA 1320 1330 1340 1350 1360 1370 320 310 300 290 280 270 3BC5 TCAGTTACCTGTTTTACACCAAAAGTAGTCTTTAGGGTGTAGTTAGCAATTTCTTTTGTG :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: TCAGTTACCTGTTTTACACCAAAAGTAGTCTTTAGGGTGTAGTTAGCAATTTCTTTTGTG 1380 1390 1400 1410 1420 1430 260 250 240 230 220 210 3BC5 CCATTTTAGGGTGGAGAGGGTGGGCATGATGAAGCCAGTCATTCAGGACTTAATTCTTCC :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: CCATTTTAGGGTGGAGAGGGTGGGCATGATGAAGCCAGTCATTCAGGACTTAATTCTTCC 1440 1450 1460 1470 1480 1490 200 190 180 170 160 150 3BC5 TTGTGTTGTGGTGTGGTTTTCTTCCTTTCTTCTG-TTTTTTTTTTTTAATTCC-TTTTTT :::::::::::::::::::::::::::::::::: :::::::::::::::::: :::::: EM_RO: TTGTGTTGTGGTGTGGTTTTCTTCCTTTCTTCTGTTTTTTTTTTTTTAATTCCTTTTTTT 1500 1510 1520 1530 1540 1550 140 130 120 110 100 90 3BC5 TTTGCCATTGCACCAGAGTATGAAATAGCTTCCAGGTTCTCCGGCTCAGAGCTGGGCGGG :::::::::::::::::::::::::::::::::::::: ::::::::::::::::::::: EM_RO: TTTGCCATTGCACCAGAGTATGAAATAGCTTCCAGGTTGTCCGGCTCAGAGCTGGGCGGG 1560 1570 1580 1590 1600 1610 80 70 60 50 40 30 3BC5 TGATTGTGGTCACACCCTGACAACACTAGGGATCTCAACGGACTCCTCTTGTAGCCGCAC :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: TGATTGTGGTCACACCCTGACAACACTAGGGATCTCAACGGACTCCTCTTGTAGCCGCAC 1620 1630 1640 1650 1660 1670 20 10 3BC5 CACTATTTTTAGCAGTTTAATGGGT ::::::::::::::::::::::::: EM_RO: CACTATTTTTAGCAGTTTAATGGGTACATTATAGAGTCTTCCATTTTGTGTGGAATTAGC 1680 1690 1700 1710 1720 1730
La sequenza a più alta similarità nucleotidica con il clone in esame è rappresentata dal 3’ UTR dell’mRNA codificante per il canale anionico mitocondriale voltaggio-dipendente, VDAC1. L’ALC modula positivamente la trascrizione del gene per VDAC1.
Il canale anionico mitocondriale voltaggio-dipendente (VDAC), conosciuto anche come “porina”, è localizzato a livello della membrana mitocondriale esterna di tutti gli eucarioti (Colombini et al., 1996) e nelle membrane postsinaptiche. E’ una proteina transmembrana che forma un grande canale, detto poro del diametro di circa 3 nm nel suo stato aperto e di 1.8 nm nel suo stato chiuso. Esso permette il passaggio di ioni e metaboliti di peso molecolare inferiore a 5000 Da nel suo stato di pervietà, invece è permeabile a piccoli ioni nel suo stato chiuso (Rostovtseva et al., 2002). E’ un canale voltaggio sensibile (Song et al., 1998). Nello stato aperto la “porzione mobile” della proteina, carica positivamente, è localizzata nello spazio transmembrana. Un aumento del potenziale di membrana determina lo spostamento del sensore sulla superficie della membrana, con la conseguente chiusura del canale.
VDAC è anche coinvolto nella regolazione del passaggio di metaboliti come ADP, ATP, NAD, piruvato, gli intermedi del ciclo dell’acido citrico che influenzano la funzionalità mitocondriale (Vander Heiden et al., 2000,2001). Inoltre il canale VDAC ha un ruolo rilevante nell’omeostasi del calcio, in particolare è responsabile dell’accumulo di calcio all’interno del mitocondrio
(Rapizzi et al., 2002). I meccanismi molecolari di tale regolazione devono essere ancora chiariti, ma studi condotti su cellule HeLa e miotubuli indicano che la sovraespressione del VDAC influisce sulla permeabilità del calcio a livello delle giunzioni reticolo endoplasmatico-mitocondrio (Rapizzi et al., 2002). Anche l’aumento della permeabilità mitocondriale, che porta ai processi di iniziazione dell’apoptosi, sembra dipendere anche dal canale VDAC (Rapizzi et al., 2002). L’interazione tra i fattori antiapoptotici della famiglia Bcl2 determina la chiusura del canale, mentre, alcuni fattori pro-apoptotici della stessa famiglia, quali Bax e Bak, interagiscono con VDAC aumentando la permeabilità della membrana mitocondriale e causano il rilascio del citocromo c, che costituisce il segnale biochimico per l’attivazione delle caspasi (Tsujimoto and Shimizu, 2001; Vander Heiden et al., 2001). Esistono tre isoforme del VDAC, VDACS 1-3, codificate da tre geni. Sono
state individuate differenze nella modalità di apertura del canale e di altre proprietà delle tre isoforme (Xu et al., 1999), ma il diverso ruolo fisiologico rimane ancora da definire. Recenti studi hanno mostrato che la corretta funzionalità della membrana mitocondriale è essenziale per alcune forme di apprendimento e per la plasticità sinaptica (Weeber et al., 2002).Gli effetti di deficit selettivi di una o dell’altra isoforma non sono uguali, suggerendo che VDAC1 e VDAC3 giochino un diverso ruolo in queste funzioni cerebrali. Per esaminare il ruolo delle VDACS, nelle forme di apprendimento e
VDAC1/3, sottoposti a condizionamento alla paura e comparati con topi sani. I dati ottenuti indicano che VDAC3 e VDAC1 sono necessari per l’apprendimento. Per valutare la capacità di apprendimento spaziale, topi knockout per gli stessi geni, sono stati sottoposti al test di Morris. Anche in questo caso la corretta funzionalità del VDAC1 e VDAC3 è necessaria per l’apprendimento spaziale. Dunque, la normale permeabilità della membrana mitocondriale, controllata dalle porine, è essenziale per l’apprendimento e la memoria, come è stato anche confermato da studi sulla plasticità sinaptica ippocampale. Effettivamente le sinapsi dell’ippocampo presentano alcune caratteristiche plastiche, che sono alla base dell’apprendimento. Il meccanismo alla base di queste modificazioni è il potenziamento a lungo termine (LTP, long term potentiation). Studi condotti su sezioni cerebrali di ippocampo, di topi knockout-VDAC1, hanno evidenziato che l’LTP è significativamente ridotto in questi topi (Weeber et al., 2002). Una delle forme di LTP maggiormente studiata è quella che si osserva a livello delle connessioni sinaptiche tra le fibre che originano dai neuroni piramidali della regione CA3 (le collaterali di Schaffer) e le cellule postsinaptiche situate nell’area CA1 dell’ippocampo. In queste cellule, i mitocondri sono localizzati (anche) a livello delle terminazioni presinaptiche delle CA3 e nei dentriti delle CA1. E’ stato dimostrato che l’LTP nelle vie delle collaterali di Schaffer CA3-CA1 è sensibile ad alterazioni della regolazione mitocondriale del calcio. Infatti, registrazioni in preparati ippocampali, esposti a basse dosi di
ciclosporina A (CsA), che inibisce la permeabilità mitocondriale (MPT) (Brustovetsky and Dubinsky, 2000), mostrano significative riduzioni dell’LTP, indotto da una serie di stimoli a 100Hz (Levy et al., 2003). Tramite la metodica del calcio imaging, utilizzando l’indicatore fluorescente del calcio, Fura-2, ha evidenziato che la CsA determina un incremento del tempo di permanenza del calcio nelle terminazioni presinaptiche. Un saggio in vitro, condotto su mitocondri cerebrali isolati, ha permesso di interpretare il ruolo della MPT e dei VDACS sul flusso del calcio dal/al mitocondrio e il
conseguente accumulo di calcio nelle terminazioni presinaptiche (Levy et al., 2003). Questa regolazione può essere divisa in due stadi: la fase di uptake e la fase di rilascio. La fase di uptake è caratterizzata dall’ingresso del calcio nel mitocondrio, che aumenta quando viene somministrata la CsA. Sono state proposte due ipotesi per spiegare questo effetto della CsA. La prima ipotesi è che la CsA, iperpolarizzando la membrana mitocondriale, determina un aumento dell’entrata del calcio nel mitocondrio. E’ stata anche proposta l’ipotesi che la normale funzionalità della MPT determina un rilascio del calcio. Viceversa si ha un’entrata di calcio se invece viene bloccata la permeabilità con CsA. In entrambi i casi, l’aumento della concentrazione del calcio nel mitocondrio causa la depolarizzazione della membrana e il rapido rilascio di calcio, che comporta un accumulo di calcio nella terminazione presinaptica. Mitocondri privi del canale VDAC1 presentano un’elevata depolarizzazione della membrana e dunque un elevato rilascio di calcio. Ecco
perché, gli effetti della CsA riproducono il fenotipo di topi VDAC1-deficit. I canali VDACs sono gli unici sistemi per il trasporto del calcio dal citosol allo spazio transmembrana (Gincel et al., 2001). Questi dati sono in accordo con risultati che vedono la regolazione mitocondriale del calcio come un importante regolatore della funzionalità sinaptica (Tang and Zucker, 1997; Billups and Forsythe, 2002).
I risultati da noi ottenuti hanno dimostrato che il trattamento cronico con ALC determina una modulazione positiva della trascrizione del gene per il canale VDAC1. Studi condotti su preparati ippocampali di ratti anziani, hanno dimostrato che si assiste ad un aumento della trasmissione sinaptica eccitatoria, se 30 min prima della stimolazione tetanica, a questi preparati, viene somministrata ALC (Castorina et al.,1993). L’ALC, modulando positivamente l’espressione del VDAC1, potrebbe indirettamente avere un’azione sull’omeostasi del calcio a livello presinaptico, che determinerebbe un aumento della liberazione del neurotrasmettitore.
E’ stato osservato che VDAC1 ha un ruolo importante nel legare le esochinasi I (HK I), enzimi noti catalizzare la fosforilazione del glucosio, alla membrana mitocondriale esterna, anche se non è escluso che le altre isoforme abbiano la stessa capacità. Le cellule tumorali sono caratterizzate da un incremento dell’azione degli enzimi coinvolti nella glicolisi (Pedersen, 1978; Nakashima et al., 1986). In particolare, le cellule tumorali presentano alti livelli dell’esochinasi II (Mathupala et al., 1995). Oltre all’abbondante
espressione, le HK in genere si legano alla membrana mitocondriale. Questo legame è stato interpretato come una utilizzazione preferenziale dell’ATP mitocondriale da parte delle HK (Shinohara et al., 1997). I livelli dei trascritti delle tre isoforme del canale VDACs nelle cellule tumorali AH130 sono stati comparati con quelli presenti in tessuti sani di ratto come il fegato, il rene, il cuore e il cervello. Dall’analisi dei dati è emerso che i livelli dei trascritti del VDAC1 nel cervello sono inferiori ai livelli delle cellule tumorali (Shinohara et al., 2000).
Recenti studi (Steiber et al., 2004) hanno evidenziato l’importante ruolo del VDAC1 nel metabolismo degli acidi grassi a lunga catena. Gli acidi grassi vengono trasferiti all’interno del mitocondrio, per la β-ossidazione attraverso il “sistema della carnitina”. Il primo step è la formazione degli Acil-CoA, nel versante citosolico della membrana mitocondriale esterna, che viene successivamente trasportato nello spazio transmembrana dal VDAC1 (Steiber et al., 2004).
Per analizzare l’espressione del mRNA del VDAC1 abbiamo utilizzato la tecnica della RT-PCR relativa che presenta una maggiore sensibilità nell’individuare trascritti rari, poco evidenziabili con il Northern blot (vedi paragrafo 9.2. “Materiali e Metodi”). C: amplificazione del cDNA del controllo, T: amplificazione del cDNA del trattato, IX: marker IX, (ROCHE).
Dai nostri risultati è emerso che l’ALC modula positivamente la trascrizione del gene per VDAC1.
• CLONE 3BE3
La sequenza del clone 3BE3, ottenuta con sequenziatore automatico è:
AGCGTGGTCGCGGCCGAGGT TTCAGGCTGAGCATCATTTAACTCAGTGTGCAGGTTCGGTATGTGCAGGTATTTATTTTGGCAGAAGAGTTCA TCTGGCTGTAAGATTTATCAGAATGCTGTGTGAGACCATTTTTCCTGCATCATAATTCAGCAACCTGAGATTT GTAAAACCCACCCAGCACTTACAGAATCTCCCCAGTGAAAGAGTCATACCATCCTATTTACACTAGTTTGACT GATGTGTTTAAAACTTTAGGAAATACTTACTATAAACATTCATGGTCTCAGGCAAATGCTGAGCAGCCTTCCT TCCTACCCACTTGTAAACCTTGGCACTGTTGTCTGAGGCTGTGCAGCCATTGTGTTACTGTGGACTCAACTCT ATGCCTACTTTTCTTTGCACGATGTGTCTGTGTGTAATGGAAGTGGTTCTGCCCATTTAAATATGACTCATGA ACAGAGTAAAATGATTTAAAAAGCCAAAAAAAAAAAAAAAAAAAAAAAAAAAAAACTTGT ACCTGCCCGGGCGGCCGCTCGA G3PDH VDAC1 603 pb 310 pb C T IX Figura 17: RT-PCR relativa
La sequenza ottenuta è stata confrontata con le sequenze depositate nella banca dati GenBank, EMBL, utilizzando programmi come: FASTA, BLASTX, BLASTN.
Di seguito sono riportati i risultati ottenuti con il FASTA. Sono indicate le prime due sequenze a più alta similarità nucleotidica con quella del clone. In blu si possono vedere i codici di accesso in banca dati, per ogni sequenza trovata.
EM_RO:BC063177 BC063177.1Rattus norvegicus AT(1332) [r]2438 198.3 1.1e-49
EM_RO:AC111647 AC111647.10Rattus norvegicus4(232538)[r]221 33.2 5.4
La sequenza del clone 3BE3 mostra una similarità del 99.391% con la sequenza BC063177. Di seguito si può vedere l’allineamento delle due sequenze nucleotidiche.
>>EM_RO:BC063177 BC063177.1 Rattus norvegicus ATPase, H+ (1332 nt) rev-comp initn: 2438 init1: 2438 opt: 2438 Z-score: 1012.4 bits: 198.3 E(): 1.1e-49
banded Smith-Waterman score: 2438; 99.391% identity (99.391% ungapped) in 493 nt overlap (498-6:840-1332) 490 480 470 3BE3 TTCAGGCTGAGCATCATTTAACTCAGTGTG :::::::::::::::::::::::::::::: EM_RO: CTGCTGTTCGAGTAGCTGCCCGCTGCTCCCTTCAGGCTGAGCATCATTTAACTCAGTGTG 810 820 830 840 850 860 460 450 440 430 420 410 3BE3 CAGGTTCGGTATGTGCAGGTATTTATTTTGGCAGAAGAGTTCATCTGGCTGTAAGATTTA :::::::::::::::: ::::::::::::::::::::::::::::::::::::::::::: EM_RO: CAGGTTCGGTATGTGCGGGTATTTATTTTGGCAGAAGAGTTCATCTGGCTGTAAGATTTA 870 880 890 900 910 920
400 390 380 370 360 350 3BE3 TCAGAATGCTGTGTGAGACCATTTTTCCTGCATCATAATTCAGCAACCTGAGATTTGTAA :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: TCAGAATGCTGTGTGAGACCATTTTTCCTGCATCATAATTCAGCAACCTGAGATTTGTAA 930 940 950 960 970 980 340 330 320 310 300 290 3BE3 AACCCACCCAGCACTTACAGAATCTCCCCAGTGAAAGAGTCATACCATCCTATTTACACT :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: AACCCACCCAGCACTTACAGAATCTCCCCAGTGAAAGAGTCATACCATCCTATTTACACT 990 1000 1010 1020 1030 1040 280 270 260 250 240 230 3BE3 AGTTTGACTGATGTGTTTAAAACTTTAGGAAATACTTACTATAAACATTCATGGTCTCAG :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: AGTTTGACTGATGTGTTTAAAACTTTAGGAAATACTTACTATAAACATTCATGGTCTCAG 1050 1060 1070 1080 1090 1100 220 210 200 190 180 170 3BE3 GCAAATGCTGAGCAGCCTTCCTTCCTACCCACTTGTAAACCTTGGCACTGTTGTCTGAGG :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: GCAAATGCTGAGCAGCCTTCCTTCCTACCCACTTGTAAACCTTGGCACTGTTGTCTGAGG 1110 1120 1130 1140 1150 1160 160 150 140 130 120 110 3BE3 CTGTGCAGCCATTGTGTTACTGTGGACTCAACTCTATGCCTACTTTTCTTTGCACGATGT :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: EM_RO: CTGTGCAGCCATTGTGTTACTGTGGACTCAACTCTATGCCTACTTTTCTTTGCACGATGT 1170 1180 1190 1200 1210 1220 100 90 80 70 60 50 3BE3 GTCTGTGTGTAATGGAAGTGGTTCTGCCCATTTAAATATGACTCATGAACAGAGTAAAAT ::::::::::::::::::::::::::::::::::::::::::: :::::::::::::::: EM_RO: GTCTGTGTGTAATGGAAGTGGTTCTGCCCATTTAAATATGACTTATGAACAGAGTAAAAT 1230 1240 1250 1260 1270 1280 40 30 20 10 3BE3 GATTTAAAAAGCCAAAAAAAAAAAAAAAAAAAAAAAAAAAAAACTTGT :::::::::: :::::::::::::::::::::::::::::::: EM_RO: GATTTAAAAAACCAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA
La sequenza a più alta similarità nucleotidica con il clone in esame è rappresentata dal 3’ UTR dell’mRNA codificante per la pompa H+ -ATPasica lisosomiale, subunità D del settore V1. Dai nostri studi è emerso che l’ALC
modula positivamente la trascrizione della subunità D del settore V1.
L’ambiente acido dei lisosomi è mantenuto dall’attività della pompa H+-ATPasica (vacuolar-type proton ATPase, V-ATPase), localizzata nella
indispensabile per la funzionalità degli enzimi idrolitici, capaci di demolire la maggior parte delle sostanze organiche, proteine, glucidi, lipidi, anche in forma di macromolecole o corpuscoli organizzati.
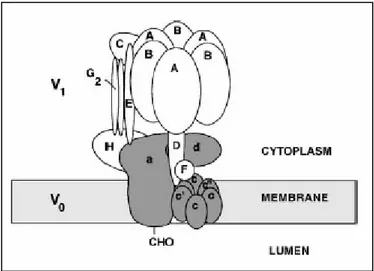
Strutturalmente la V-ATPase è costituita da due settori funzionali, noti come V1 e V0 (Fig. 16). V1 è il settore catalitico responsabile dell’idrolisi dell’ATP,
ed è costituito da otto differenti subunità (A-H). Diversamente, V0 è
responsabile della traslocazione dei protoni dal citosol al lume lisosomico, ed è costituito da cinque subunità (a, c, c’, c”, d) (Anraku, 1996).
Le sostanze prodotte dai normali processi digestivi dei lisosomi possono diffondere attraverso la membrana lisosomiale ed essere nuovamente utilizzate dalla cellula, mentre il materiale non digeribile si accumula in vescicole indicate come corpi residui per essere successivamente espulsi dalla
Figura 18: struttura della pompa H+/ATPase lisosomiale. E’ composta da due domini. Il dominio periferico V1 (in bianco) è responsabile dell’idrolisi dell’ATP mentre il dominio transmembrana V0 (in grigio) è responsabile della traslocazione dei protoni. Immagine tratta da: Arata et al., 2002.
cellula per esocitosi. Talvolta i corpi residui, che contengono molto materiale lipidico, rimangono a lungo nella cellula e l’ossidazione delle sostanze in essi contenute porta all’accumulo, intracellulare, di pigmenti eterogenei dal punto di vista chimico ma contenenti acidi grassi polinsaturi e materiale proteico. Questo materiale indicato come lipofuscina, è noto anche come “pigmento della vecchiaia” poiché si accumula nelle cellule in età adulta, in particolare in quelle nervose e muscolari, e si pensa sia implicato nel processo dell’invecchiamento (Sohal and Brunk, 1996).
Un gruppo di patologie neurodegenerative progressive infantili, sono caratterizzate dall’accumulo di proteine idrofobiche (lipofuscine ceroidi) nei lisosomi, sopratttutto dei neuroni. Esistono diversi tipi di lipofuscinosi ceroidi causate dalla mutazione di otto diversi geni, tutti denominati CLN (CLN1-CLN8). La lipofuscinosi ceroide giovanile (sindrome di Batten) è causata da una mutazione del gene CLN3, che codifica per una proteina della membrana lisosomiale (Ezaki and Kominami, 2004).
In generale, le lipofuscinosi ceroidi sono patologie caratterizzate dall’accumulo di materiale nei lisosomi dovuto ad una disfunzione di questi organuli. Inoltre, tali depositi sono costituiti principalmente dalla subunità c dell’ATPasi mitocondriale. In particolare, nella sindrome di Batten la proteina codificata dal gene CLN3 (proteina della membrana lisosomiale, Battenina) è implicata nell’omeostasi del pH e nel trasporto degli amminoacidi ed è essenziale per il traffico vescicolare nelle membrane intracellulari e per la
funzionalità dei mitocondri. Tuttavia non è ancora chiaro il collegamento tra deficienza nella funzionalità lisosomiale e l’accumulo della subunità c, ma l’osservazione è che si verifica un turnover non corretto della subunità c, che quindi si accumula (Fossale et al., 2004). Studi condotti su individui affetti dalla lipofuscinosi ceroide hanno dimostrato che la subunità c dell’ATPasi, che si accumula nei lisosomi, contiene una trimetilisina (TML) in posizione 43 (Katz et al., 1996). La (TML) può essere un segnale per l’inizio della degradazione della subunità c, dato che è trimetilata solo nei lisosomi e non nel mitocondrio. Probabilmente l’accumulo è dovuto ad un difetto nella risposta a questo segnale nei lisosomi. Inoltre, in questi pazienti si hanno bassi livelli ematici della trimetilisina e della carnitina. Questo può dipendere dal fatto che la trimetilisina deriva dalla metilazione di residui di lisina nelle proteine; quando queste proteine sono degradate, la TML è rilasciata, e rappresenta il primo intermedio nella biosintesi della carnitina (Katz et al., 1996).
Gli effetti della somministrazione della carnitina sono stati valutati in topi mnd, con una mutazione in un gene che probabilmente è diverso da CLN3 ma che presentano accumuli lisosomiali della subunità c simili a quelli osservati nella sindrome di Batten. Il trattamento con L-carnitina, anche se non allevia i sintomi della sindrome, determina una diminuizione dell’accumulo nei lisosomi e un aumento della carnitina nel cervello (Katz et al., 1997).
Alla luce dei risultati ottenuti in questi studi si può ipotizzare che esiste una correlazione tra biosintesi della carnitina e l’accumulo della subunità c nei lisosomi nella sindrome di Batten. Un particolare interessante è che dalla stessa libreria è stato isolato il trascritto del gene per la subunità c della proteina ATP sintasi legante-lipidi, che viene modulato negativamente dal trattamento con ALC (Traina et al., 2004). Dall’analisi di espressione, tramite la RT-PCR relativa del clone 3BE3 (Figura 19), è emerso che L’ALC modula positivamente l’espressione della subunità D della pompa protonica lisosomiale, che è indispensabile per il mantenimento dell’omeostasi del pH e per la funzionalità del lisosoma stesso.
L’ALC potrebbe dunque avere un impiego terapeutico nel trattamento della sindrome di Batten. C T IX G3PDH 603 pb 310 pb V-ATPase Figura 19: RT-PCR relativa