3. MATERIALI E MEDODI
3.1 Screening germinativo di 47 specie e varietà del genere Salvia
Il seme delle specie in esame è stato raccolto nell’anno 2007 su piante coltivate presso l’azienda del CRA-FSO (Unità di ricerca per la Floricoltura e le Specie Ornamentali). Il seme, raccolto a completa maturità, è stato lasciato essiccare all’aria, pulito dalle impurità con l’ausilio di setacci e conservato in sacchetti di carta in ambiente refrigerato a 6°C; nel marzo 2008 sono state preparate 4 ripetizioni da 50 semi per ogni specie, che sono state pesate singolarmente; il peso è stato poi rapportato a 1000 semi. E’ stata determinata la forma del seme, riconducibile, secondo la specie, a tre tipologie: tonda, ellittica e lanceolata, come rappresentato in fig. 5.
Su di un campione significativo è stata misurata la lunghezza dell’asse maggiore. Per ogni specie sono stati inoltre preparati 100 semi random suddivisi in 4 ripetizioni da 25 ciascuna; i semi sono stati posti a germinare in capsule Petri da 9 cm di diametro contenenti carta da filtro sterile. La carta da filtro è stata mantenuta sempre umida aggiungendo all’occorrenza acqua distillata. I semi sono stati posti al buio in ambiente a temperatura costante di 24±1°C. Periodicamente è stata rilevata la germinazione considerando germinato il seme al momento in cui era visibile la radichetta fuoriuscita dal tegumento. I rilievi sono stati effettuati inizialmente con cadenza giornaliera e successivamente ogni 2 o 3 giorni e si sono protratti fino al quarantacinquesimo giorno. Per ogni specie è stata valutata la germinabilità (percentuale), e il Tempo Medio di Germinazione (T.M.G. = ∑(t x n)/∑n, dove n rappresenta il numero di semi germinati e t il tempo espresso in giorni dall’inizio della prova). I dati raccolti sono stati elaborati come media ed errore standard.
Fig. 5 - Forme del seme. A: tonda (S. repens), B: ellittica (S. scabra), C: lanceolata (S. coccinea “Lady in Red”
3.2 Analisi della germinabilità di quattro specie del genere salvia
Dallo screening iniziale sono state individuate alcune salvie che hanno mostrato bassa germinabilità. Di queste salvie sono state scelte 4 su cui sono state condotte diverse prove per cercare di migliorare la loro germinabilità; oggetto di queste prove sono: S. pratensis “Mixed colours”, S. virgata, S. haematodes e S. roemeriana. Le prove affrontate sono le seguenti.
3.2.1 Prova di della vernalizzazione
Il seme di S. pratensis “Mixed colours”, S. virgata, S. haematodes è stato prelevato da piante adulte presenti in azienda CRA-FSO (Unità di ricerca per la Floricoltura e le Specie Ornamentali). Nel periodo di febbraio sono stati prelevati circa 200 semi per specie e sono stati divisi in 4 ripetizioni da 50 semi ciascuna per trattamento. I 50 semi sono posti in piastre Petri con uno strato di carta bibula sterile al di sopra e di sotto di essi; la carta bibula è stata inumidita con H2O sterile prima di
essere posta in frigo. La prova è stata impostata su tre tempi diversi di vernalizzazione: t0 (controllo non vernalizzato), t15 (15gg di vernalizzazione), t30 (30gg di vernalizzazione) e t60 (60 gg di vernalizzazione). Per tutti i tre tempi di vernalizzazione le piastre sono tenute in frigo a 4°C costanti. Trascorso il periodo di vernalizzazione i campioni sono posti a germinare in camera di crescita a 23°C±1°C costanti. Periodicamente a giorni alterni sono stati conteggiati i semi germinati e inumidita la carta bibula qualora ci fosse bisogno. Alla fine della prova di durata di circa 1 mese è stata valutata la germinabilità (percentuale) ed il Tempo Medio di Germinazione (T.M.G.). I dati raccolti sono stati elaborati come media ed errore standard.
3.2.2 Prova con acido 3-gibberellico
Questa prova è stata effettuata su 2 specie di salvie: S. virgata e S. pratensis mixed colours; per ciascuna specie sono stati prelevati 200 semi poi divisi in 50 semi per 4 repliche.
Le dosi ormonali sono state preparate diluendo l’ormone in polvere in 50 ml di acqua distillata sterile. I semi sono stati immersi per 24 h in acqua sterile distillata prima del trattamento ormonale; i semi per il controllo senza ormone sono stati tenuti in acqua per 48 h.
Sono stati utilizzati 3 dosi di ormone: 250 ppm (parti per milione), 500 ppm e 750 ppm.
Dopo 24 h di immersione nelle soluzioni ormonali i semi sono posti in piastre Petri con carta bibula inumidita con circa 3 ml di acqua sterile e posti a germinare in camera di crescita.
I semi di S. virgata e S. pratensis mixed colour sono posti a germinare al buio, coperti da carta argentata. Periodicamente a giorni alterni sono stati conteggiati i semi germinati e inumidita la carta bibula qualora ci fosse bisogno. Alla fine della prova di durata di circa 1 mese è stata valutata la
germinabilità (percentuale), e il Tempo Medio di Germinazione (T.M.G.). I dati raccolti sono stati elaborati come media ed errore standard.
3.2.3 Prova di germinazione alla luce ed al buio
Sono stati prelevati sempre 200 semi di S. haematodes, di S. virgata e di S. pratensis mixed colours e divisi in 50 semi per 4 repliche per entrambi i trattamenti. I semi sono posti a germinare in piastre Petri con dischetti di carta bibula sterili imbibiti con 3 ml di acqua distillata sterile. Le piastre sono messe in camera di crescita a 23°C±1 costanti; per il trattamento al buio le Petri sono state coperte con carta argentata, mentre quelle alla luce sono lasciate sotto l’illuminazione artificiale dei tubi fluorescenti della camera di crescita da 40W Osram Lumilux white (3600 Lux) ed P.F.D.D. 30 µM ∙ m-2 ∙ s-1. Ogni 2 giorni è stato fatto il conteggio dei semi germinati per la durata di 1 mese ed inumidita la carta bibula se necessario. Come per le altre prove è stata calcolata la % di germinabilità ed il TMG.
3.2.4 Prova a diverse temperature
Anche in questa prova sono state utilizzate le stesse salvie della prova luce/buio. Sono state preparate 4 repliche da 25 semi ciascuno per ogni temperatura di trattamento. Per ogni temperatura è stato utilizzato un termo-frigo precedentemente tarato sulla temperatura desiderata e verificato, con termometri portatili, il mantenimento della temperatura costante con una variazione tollerata di ±1°C. I semi sono stati seminati su piastre Petri con dischi di carta bibula sterili ed inumiditi con acqua distillata sterile. Le piastre sono tenute nei termo-frigo per circa un mese al buio avvolti con carta argentata; ad intervalli di 2 giorni è stato fatto il conteggio dei semi germinati ed inumidita la carta bibula. Anche per questa prova sono stati calcolati % di germinabilità e TMG.
3.2.5 Effetto del substrato terriccio/carta bibula e della conservazione
In questa prova si è voluto verificare se esiste una diversa germinabilità tra seme seminato “in vivo” su terriccio e seminato “in vitro in carta bibula. Le salvie oggetto di questa prova sono state: S.
virata, S. haematodes e S. roemeriana. Sono stati presi 200 semi per la semina “in vivo” e altri 200
per quella “in vitro”. Questi sono stati divisi in 4 repliche da 50 semi ciascuna. I semi “in vitro” sono stati seminati su piastre Petri in dischi di carta bibula sterili ed inumiditi con acqua distillata sterile e messi a germinare in camera di crescita a 23°C±1 costanti. I semi in vivo sono stati anch’essi divisi in 4 repliche da 50 semi e coltivati in serra di ambientamento in platoau di plastica
su substrato di torba: sabbia 30:70 (V/V), alla temperatura media di 18°C sotto spruzzatura mist ed umidità del 60%. A tempi alterni è stato fatto il conteggio dei semi germinati ed aggiunta acqua qualora ci fosse bisogno; alla fine della prova di durata di un mese è stata calcolata la percentuale di germinabilità ed il TMG.
Per quanto riguarda la conservazione del seme questa prova è stata effettuata su S. roemeriana. Sono stati presi 200 semi del 2006 e altrettanti del 2005: sono stati divisi in 4 repliche da 50 semi ciascuna e posti a germinare in piastre Petri in dischi di carta filtro sterile inumiditi con 3 mL di H2O distillata sterile in camera di crescita alla temperatura di 23°C±1 sotto la luce artificiale delle
luci della camera da 40W Osram Lumilux white (3600 Lux) ed P.F.D.D. 30 µM ∙ m-2 ∙ s-. I semi sono stati tenuti in coltura per circa 15 giorni in cui a tempi alterni sono stati conteggiati i semi germinati ed inumidita la carta qualora ci fosse bisogno. Alla fine della prova sono stati calcolati la % di germinabilità ed il TMG.
Fig.6 Esempi di foto di semi germinati di S. virgata, S. roemerina e S. pratensis in dischi di carta filtro sterile. Foto Carlo Mascarello
3.3 Prova con brachizzanti in 23 specie e varietà del genere Salvia .
La prova con brachizzanti è stata svolta presso il C.E.R.S.A.A (Centro Regionale di Sperimentazione e Assistenza Agricola “Franco Ugo” di Albenga - SV).
Sono state utilizzate 23 tra specie e varietà di Salvia: S. cacaliifolia (S3), S. buchananii (S4), S.
corrugata (S6), S. discolor (S8), S. haenkei (S9), S. wagneriana (S10), S. greggii alba (S12), S. greggii peach (S15), S. chamaedryoides Silver (S16), S. chamaedryoides (S 17), S. cinnabarina
(S19), S. chamaedryoides "silver leaves“ (S23), S. miniata (S26), S. scabra (S28), S. jamensis la
siesta (S33), S. leucantha purple velvet (S34), S. microphylla neurepia (S35), S. coahuliensis– hybrid (S81), S. disermas white (S86), S. namaensis (S97), S. adenophora (S115), S. chiapensis
(S119), S. fallax (S140). Queste salvie sono state selezionate perché presentano infiorescenze non compatte o portate su steli eccessivamente allungati, rendendo la pianta esteticamente non gradevole nella forma, anche se caratterizzata da forme e colori del fogliame e dei fiori molto interessanti.
Per tale motivo sono state realizzate prove sperimentali finalizzate alla verifica dell’effetto di alcuni brachizzanti sull’architettura di diverse specie di Salvia già selezionate quali specie di potenziale interesse ornamentale.
I prodotto brachizzanti utilizzati sono: 1. Cycocel 5 (CLORMEQUAT 41,2 %) 2. Alar 85 (DAMINOZIDE 85 %) 3. Topflor (FLURPRIMIDOL 1,48 %)
4. Regalis (PROHEXADIONE CALCIUM 10 %)
Le piante sono state allevate in serra tipo “campata larga” di ferro e vetro su bancale sopraelevato, alle codizioni di T° media di 19,5°C (T° max 33°C – T° min 11°C, 85% di U.R. e 27000 Lux di illuminazione. Sono state propagate per talea e, dopo radicate, trapiantate (circa 1 mese dal taleaggio) in vasi del Ø 14 in plastica. Il substrato utilizzato è stato il TS2, terreno torboso costituito da torba di sfagno bianca, pomice, corteccia di pino pinaster, argilla e NPK (9-11-14) (2 Kg/m2 ) + un concime a lenta cessione 2Kg/180 kg di terriccio. Il terreno torboso è un terreno che assorbe molta umidità e questo porta ad un aumento dell’incidenza dell’ infestazione da parte di aleurodidi e tripidi. Durante la coltivazione tali infestazioni sono state contenute con esche biologiche sistemate sulle piante (Kopper Biological System).
È stata fatta una sola cimatura, 15 giorni dalla messa a dimora. I prodotti sono stati distribuiti seguendo le indicazioni d’uso riportati in etichetta; sono stati fatti trattamenti fogliari e nel substrato
di coltura; la modalità di distribuzione è per irrorazione fogliare con sistema ad alto volume (1000 l/ha) e per bagnatura del substrato di coltivazione (200 ml per vaso).
Sono state predisposte 9 tesi, con tre repliche per ciascuna tesi con 10 piante per replica.
La prova è stata svolta tra dal 01/03/08 al 31/05/08. Sono stati fatti 3 interventi: 03/04/08, 14/04/08; 24/04/08.
Sono stati fatti 4 rilievi in data 03/04/08 (controllo), 21/04/08, 06/05/08 e 22/05/08, il rilievo è stato fatto su 5 piante scelte casualmente per ogni tesi, di cui è stata rilevata l’altezza ed il diametro maggiore della pianta.
Tabella 3. Schema generale dei prodotti e delle dosi utilizzate. Trattamento Prodotto commerciale DOSE prodotto
commerciale g/ha 1 Testimone 2 Cycocel 5C 2800 3 Cycocel 5C radicale 3350 4 Alar 85 2500 5 Topflor 510 6 Topflor 1020 7 Topflor radicale 510 8 Regalis 1250 9 Regalis 2500
3.4 Prove di fotoperiodo su tre specie del genere Salvia
Le prove di fotoperiodo sono state condotte in due periodi distinti: la 1° prova condotto da ottobbre 2007 a gennaio 2008 e la 2° prova condotta da marzo a maggio 2008. Le prove sono state fatte su tre specie del genere Salvia: S. gesneriflora, S. wagneriana e S. iodantha.
Le piante sono state propagate per talea poste a radicare sotto tunnel in film plastico con spruzzatura mist 5’’ ogni 15 min. Le talee hanno impiegato mediamente 20 -25 giorni per radicare. Dopo la formazione delle radici le talee sono state trapiantate in vasi di platica del Ø 14 in terriccio senza pomice (vigor plant growing medium) + agriperlite (50:50 v/v) con ammendante a lenta cessione Osmocote (NPK 16-9-12 + 2,5 MgO) 4g/m3.
Le piante sono lasciate crecsere per circa 15 gioni poi sono state spuntate ed etichettate nel germoglio poi preso in esame per la prova di fotoperiodo.
Nella 1° prova sono stati testati due fotoperiodi: un fotoperiodo naturale ed uno di 16 h di luce costituito da illuminazione naturale + illuminazione artificiale fornita da lampadine ad incandescenza opache (Philips superlux 7 L 230 v – 40 W – 7,1 µE s-1 m-2 150 LUX).
Le salvie sono state allevate in serra fredda con mantenimento di una T° minima di 7°C, nei periodi di ottobbre – novembre – dicembre – gennaio. Le piante sono state allevate in due ambienti preparati nella stessa serra: 6 piante per specie a fotoperiodo naturale e altre 6 piante per specie sotto illuminazione supplementare. L’illuminazione supplementare è stata effettuata in modo da fornire illuminazione alla pianta per 16 h continuative, questo è stato possibile attraverso un timer programmato a due intervalli di tempo dalle 5 alle 9 del mattino e dalle 16 alle 21 della sera. Durante le oltre ore la pianta riceveva illuminazione naturale. Alle 16 h di illuminazione seguivano 8 h di buio continuativo.
Ogni due settimane sono stati fatti dei rilievi in cui sono stati presi in seguenti parametri: altezza della pianta, numero di nodi del getti etichettato, numero di rami laterali nel getto etichettato, lunghezza del getto, presenza dell’infiorescenza in boccioli e lunghezza dell’infiorescenza.
Tutte le piante sono state poste sotto impianto di irrigazione a goccia dalla portata di 2 l/h con funzionamento di 5 minuti al giorno.
Nella 2° prova di foroperiodo sono utilizzate altre piante selezionate delle tre specie è propagate per talea come nella 1° prova. Sono stati confrontati due fotoperiodi: un fotoperiodo di 12 h di luce ed uno di 16 h di luce in due ambienti artificiali (fitotrone) entrambi alla temperatura costante di 18°C. L’illuminazione è stata ottenuta con lampade fluorescenti (Philips Master TDL 58 W/865 Recyclabile – 30 µE s-1 m-2 – 3240 LUX). Le piante sono state irrigate manualmente 3 volte a settimana.
Nel graf ico sott osta nte (Gr afic o 1) viene riportato l’andamento delle ore di alba e tramonto della provincia di Imperia, alla latitudine compresa tra 44° 3′ 0′′ N e 43°37',98 N e longitudine conpresa tra 8° 13′ 0′′ E e 07°08',43 E ().
Durata del giorno
7.00 8.12 9.24 10.36 11.48 13.00 14.12 15.24 16.36 1 -g e n 1 6 -g e n 3 1 -g e n 1 5 -f e b 1 -m a r 1 6 -m a r 3 1 -m a r 1 5 -a p r 3 0 -a p r 1 5 -m a g 3 0 -m a g 1 4 -g iu 2 9 -g iu 1 4 -l u g 2 9 -l u g 1 3 -a g o 2 8 -a g o 1 2 -s e t 2 7 -s e t 1 2 -o tt 2 7 -o tt 1 1 -n o v 2 6 -n o v 1 1 -d ic 2 6 -d ic O re d i s o le
Grafico 1. Andamento annuale delle ore di luce durante il giorno nella provincia di Imperia (Liguria).
3.5 Coltura in vitro - Preparazione del mezzo di coltura e condizioni colturali
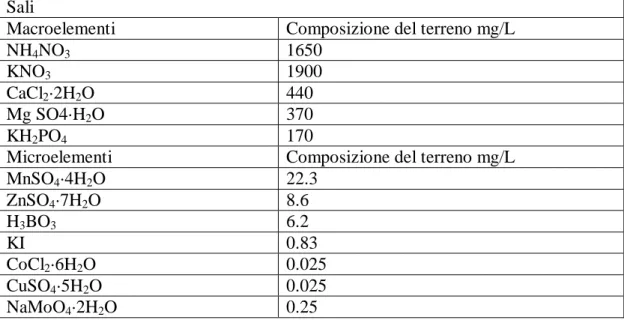
Il mezzo di coltura è stato preparato prendendo quantità note di soluzioni stock contenenti sali di macroelementi e microelementi (Tab. 4) e vitamine (Tab. 5), preventivamente preparate secondo la formula di Murashige & Skoog (1962), più saccarosio.
Infine si aggiungono i regolatori della crescita, anch’essi preventivamente preparati da soluzioni stock, in concentrazioni e combinazioni diverse in base al tipo di esperimento che si vuole
Fig. 7 Particolari delle prove di fotoperiodo: fitotrone, impiatto di illuminazione supplementare ed impianto di irrigazione (da sinistra a destra).
effettuare. Dopo la misurazione del pH s’immette agar tecnico, un agente solidificante che serve a dare consistenza al mezzo. Questa soluzione così preparata è messa nei barattoli di vetro da 500 cc con tappi di plastica trasparenti ed il tutto è autoclavato a 120°C±1 per 20’ ad 1 atm. I contenitori sono mantenuti in camera di coltura a 23°C±1°C con un fotoperiodo di 16 h di luce con tubi fluorescenti da 40W Osram Lumilux white (3600 Lux) e intensità luminosa di 30 µE ∙ s-1 ∙ m-2 . Gli espianti sopravvissuti sono stati propagati su terreno fresco appropriato e successivamente subcoltivati mensilmente.
Tab. 4 Composizione dei macroelementi e microelementi secondo Murashige & Skoog (1962) Sali
Macroelementi Composizione del terreno mg/L
NH4NO3 1650
KNO3 1900
CaCl2·2H2O 440
Mg SO4·H2O 370
KH2PO4 170
Microelementi Composizione del terreno mg/L
MnSO4·4H2O 22.3 ZnSO4·7H2O 8.6 H3BO3 6.2 KI 0.83 CoCl2·6H2O 0.025 CuSO4·5H2O 0.025 NaMoO4·2H2O 0.25
Tab. 5 Vitamine e aminoacidi presenti nel terreno Murashige e Skoog (1992).
Vitamine ed Amminoacidi Quantitativo in mg/L
Mio-inositolo 100
Tiamina 0.1
Acido nicotinico 0.5
Piridossina – HCl 0.5
3.5.1 Materiale vegetale di partenza prove di sterilizzazione
Germogli ascellari, apicali, nodi e fiori immaturi sono stati prelevati da piante madri allevate presso il CRA-FSO (Unità di ricerca per la Floricoltura e le Specie Ornamentali), le quali sono state radicate per talea in serra cooling e tenute a condizioni di temperatura ed umidità controllate. Sono state fatte diverse prove di sterilizzazione al fine di individuare un protocollo ottimale per avviare la propagazione in vitro dei cloni.
Per tale scopo sono stati provati diversi mix di sterilizzazione: 2 soluzioni di etanolo al 50% e al 70% per 30 secondi entrambi, soluzioni di ipoclorito di sodio NaOCl a concentrazioni di 1,67% e 2,5% in rapporti, con acqua distillata sterile, di 1:1, 2:1 e 1:2 per 10, 15 e 20 minuti. In comune per tutte le mix sono state aggiunte alcune gocce di Tween 20, un tensioattivo che permette alla soluzione di penetrare più in profondità e due risciacqui in acqua distillata sterile per 10 minuti ognuno.
Gli espianti sono stati propagati in barattoli di vetro da 500 cc in diversi terreni di coltura.
I terreni utilizzati sono stati: terreno base MS, privo di ormoni (Murashige e Skoog, 1962) (Tab. 6), MS-BA0,3 mg/L e 0,5 mg/L e MS-GA 0,6 e 0,3.
Tab. 6 Composizione del substrato MSO, utilizzando preparati commerciali
Gli espianti prelevati dalle salvie utilizzate per la prova di organogenesi (S. mellifera, S. coccinea,
S. cinnabarina, S. jamensis cv. la siesta (S33) e S. sinaloensis (S29) sono stati sterilizzati in una
soluzione al 70% di etanolo per 30’’, poi passati in una soluzione NaOCl (soluzione commerciale all’1,5% di cloro attivo) in rapporto 4:1 per 20 minuti; alla soluzione sono state aggiunte alcune gocce di Tween 20, un tensioattivo che permette alla soluzione di penetrare più in profondità, infine sono stati fatti due risciacqui in H2O distillata sterile per 10’ ciascuno.
Invece gli espianti delle otto selezioni per arredo urbano (S. nemorosa Select Rose (Clone 1) 1° lotto, S. nemorosa Select Rose (Clone 2) 2° lotto, S. nemorosa Select Blue (Clone 3), S. x Superba
Violet (clone 4), S. superba Merleau (clone 7) 1° lotto e S. x superba Merleau (clone 8) 2° lotto
Sali ( DUCHEFA N° codice M 0221) 1000 mL Vitamine ( DUCHEFA N° codice M 0409) 1 mL
Saccarosio 30 g/L
pH 5.7±0.1
sono stati prelevati da piante madri coltivate in cella fitotrone a 18°C costanti con fotoperiodo di 16 h di luce e intensità luminosa di circa 27 µE×s-1×m-2.
Sono state fatte 2 prove di sterilizzazione una con etanolo al 50% a concentrazione di NaOCl di 1,67% e 2,5%, per tutti i cloni (Tab.16) ed una con etanolo al 70% con NaOCl alle concentrazioni di 1,67% e 2,5%, sui cloni 3, 4 e 5 (Tab.17). Gli espianti sterilizzati sono coltivati su terreno MS senza ormone o in presenza di GA 03 o 0,6 mg/l o in presenza di BA 0,3 o 0,5 mg/L; periodicamente sono state fatte delle subcolture. A distanza di circa una settimana dalla sterilizzazione è stato eseguito un rilievo per verificare lo stato dell’espianto è sono stati rilevati: la mortalità, gli espianti inquinati e gli espianti sterili. A distanza di una settimana dal primo rilievo è stato un secondo per verificare l’effettiva sterilità degli espianti.
Foto 8. S. nemorosa Select Bue (Clone 3), S. x superba Merleau (clone 7) 1° lotto, S. x superba
Merleau (clone 8) 2° lotto, S. x superba Violet (clone 4), in ordine da sinistra a destra, dopo la
3.5.2 Prova di moltiplicazione
Le cinque salvie utilizzate nella prova di organogenesi (S. mellifera, S. coccinea, S. cinnabarina, S.
jamensis cv. la siesta (S33) e S. sinaloensis (S29), sono state moltiplicate senza problemi su BA 0,3
mg/L.
Il BA nel terreno permette di ottenere espianti di buon aspetto con un buon tasso di moltiplicazione, non solo per le cinque specie di salvie, ma anche per un’ampia gamma di salvie riportate in letteratura (Grafico 37).
3.5.3 Prova di radicazione
Le otto selezioni sono state radicate solo su terreno MS + IAA alla concentrazione di 0,5 mg/L. Sono state fatte 7 prove di radicazione: 4 nel periodo di marzo-aprile e 3 nel periodo di maggio-giugno. Gli espianti sono stati coltivati in barattoli da 500 cc, sono state fatte 3 repliche con 10 espianti ciascuno per ogni clone. I barattoli sono coltivati in camera di crescita alle stesse condizione citate sopra. A distanza di 1 mese è stato fatto il rilievo prendendo come parametri: il n° di piantine radicati ed il n° piantine morte.
Foto 9. Foto S. x superba merleau (S8) nella fase di radicazione in MS+IAA 0,5 mg/L
3.5.4 Prova di ambientamento
La prova di ambientamento è stata fatta sulle otto selezioni, questi sono stati trapiantati in contenitori alveolati in terriccio di semina Klasmann e agriperlite in rapporto 50:50 (V/V) e posti in serra di ambientamento alla temperatura media di 18,7°C (Tmax 28°C Tmin 12,8°C), umidità del 60,3%, sotto spruzzatura mist 10’’ ogni 30 minuti.
Le piante sono posizionate sotto rete ombreggiante nera, che si stende in automatico quando l’intensità luminosa supera i 25000 LUX, riportandola intorno ai 10000 LUX.
3.5.5 Prova di organogenesi
La prova di organogenesi è condotta su 5 specie di salvie (S. mellifera, S. coccinea, S. cinnabarina,
S. jamensis cv. la siesta (S33) e S. sinaloensis (S29), il cui materiale è moltiplicato in vitro su
terreno MS + BA 0,3 mg/L.
Sono stati preparati 6 terreni con diverse concentrazioni di auxine/citochinine: MSO, MS+BA 0,5 mg/L, MS+BA 1 mg/L, MS+BA 2 mg/L, MS+BA 1 mg/L+ NAA 0,5 mg/L, MS+BA 1 mg/L+ NAA 1 mg/L.
Per ognuna specie sono state fatte tre repliche e come materiale di partenza sono stati utilizzati frammenti di foglie, provenienti dagli espianti moltiplicati in vitro. I pezzi di foglie sono posti in piastre Petri, 6 per ciascuna replica per ciascun terreno e posti in coltura in camera di crescita. Dopo trenta giorni è stato fatto il rilievo, raccogliendo dati inerenti la sopravvivenza dei frammenti (Grafico 38), la percentuale di callogenesi (Grafico 39) e la percentuale di rigenerazione e la radicazione (Grafico 40).
Con i dati sono state calcolate le percentuali, che sono state, poi, sottoposte ad analisi statistica previa trasformazione in valori angolari.