Capitolo 2
La fisiologia del microcircolo coronarico
Il cuore necessita per la sua incessante attività di un grosso quantitativo di ossigeno e substrati metabolici. Dal momento che la differenza artero-venosa di ossigeno a riposo è pressoché massimale (60-70%), e che non varia in modo rilevante quando il miocardio aumenta il proprio carico di lavoro, l’apporto di ossigeno alle singole cellule dipende fondamentalmente dalle variazioni del flusso coronarico. I cambiamenti dinamici dello stato metabolico miocardico, inoltre, richiedono un rapido ed elaborato sistema che regoli tali variazioni, in modo che la quantità di ossigeno e nutrienti fornita ai tessuti corrisponda sempre alla loro domanda.
Dal momento che le arterie coronarie di diametro superiore ai 300 μm non offrono un’apprezzabile resistenza al flusso ematico, la maggior parte delle resistenze della circolazione coronarica risiede a livello dei piccoli vasi (Chilian et al, 1986). E’ perciò il cosiddetto “sistema microcircolatorio” il responsabile delle variazioni di conduttanza di flusso e dell’accoppiamento tra domanda ed apporto di ossigeno e nutrienti alle cellule.
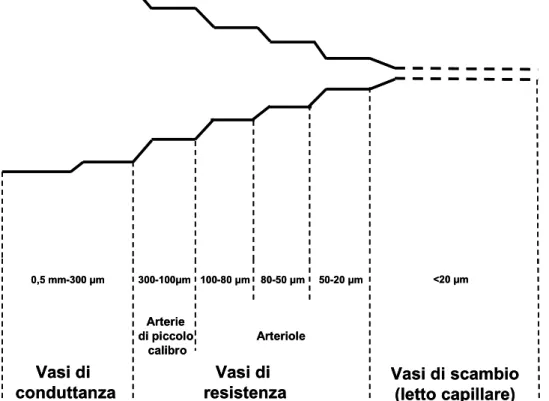
Didatticamente il letto vascolare coronarico è suddivisibile nelle classiche tre componenti dell’albero arterioso, ovvero vasi di conduttanza, vasi di resistenza e
vasi di scambio (figura 2.1). I vasi di resistenza vengono tradizionalmente considerati i segmenti vascolari che determinano la conduttanza coronarica. Tuttavia, osservazioni dirette dei microvasi coronarici in vivo ed in vitro hanno chiaramente dimostrato che i diversi fattori regolatori del flusso coronarico agiscono su specifici siti a livello microvascolare, e che le risposte dei piccoli vasi sono troppo eterogenee e complicate da poter considerare l’intero distretto microcircolatorio come un unico blocco (Marcus et al, 1990). Questa eterogeneità delle risposte microvascolari, che varia a seconda del diametro del vaso, rende possibile la regolazione fine ed efficiente della conduttanza di flusso e della distribuzione delle resistenze.
Definizione e classificazione dei microvasi
Dovendo dare precise definizioni anatomiche per indicare specifici segmenti vascolari ci si trova di fronte ad una mancanza di uniformità terminologica. Questa difformità è favorita, tra le altre cose, dal fatto che la transizione da un’arteria di piccolo calibro ad un’arteriola è graduale, non essendoci una netta demarcazione tra di loro; la classificazione dei microvasi basata su caratteristiche strutturali, poi, non può aiutare, essendo fondamentalemte arbitraria; deve esser infine tenuto a mente che il ruolo fisiologico di un vaso di particolari dimensioni può differire tra animali di piccola e grossa taglia.
La definizione più diffusamente accettata in letteratura è quella che indica il microcircolo come il sistema arterioso composto da vasi di diametro interno inferiore ai 300 μm. Il distretto attraverso il quale il sangue raggiunge i capillari (i vasi arteriosi di dimensioni minori, composti solamente da cellule endoteliali) è quello dei “microvasi arteriosi”, mentre quello che prosegue il letto capillare è individuato dalle “venule” o “microvasi venosi”.
I microvasi arteriosi sono costituiti da tre strati, ovvero: • una sottile tunica intima;
• una tunica media relativamente spessa, composta di uno o più strati di cellule muscolari lisce disposte circonferenzialmente;
• una tunica adventitia, costituita di elementi fibrosi e fibroblasti.
A dispetto della loro somiglianza strutturale, ci sono evidenti differenze dal punto di vista fisiologico e farmacologico tra i microvasi di diametro superiore e quelli di diametro inferiore ai 100 μm. I primi sono detti convenzionalmente “grossi microvasi arteriosi” o “arterie di piccolo calibro”, e presentano un numero di strati di cellule muscolari lisce variabile da 4 a 6, mentre gli altri sono definiti “piccoli microvasi arteriosi” o “arteriole” e sono caratterizzati dal possedere da 1 a 4 strati di cellule muscolari lisce. A loro volta questi ultimi si possono suddividere in arteriole di grande, intermedio e piccolo calibro, come schematizzato in figura 2.1.
Vasi di conduttanza
Vasi di
resistenza Vasi di scambio(letto capillare)
Arterie di piccolo calibro Arteriole 0,5 mm-300 μm 300-100μm 100-80 μm 80-50 μm 50-20 μm <20 μm Vasi di conduttanza Vasi di
resistenza Vasi di scambio(letto capillare)
Arterie di piccolo
calibro
Arteriole
0,5 mm-300 μm 300-100μm 100-80 μm 80-50 μm 50-20 μm <20 μm
Figura 2.1 . Schematizzazione anatomica della circolazione coronarica. I vasi di resistenza si dividono in due distretti, quello delle arterie di piccolo calibro e quello delle arteriole, a loro volta suddivise in arteriole di grandi, intermedie e piccole dimensioni.
La misurazione diretta delle pressioni microvascolari coronariche attraverso un metodo di micropuntura dei microvasi epicardici su cuore felino ha consentito di chiarire la distribuzione delle resistenze coronariche (Chilian et al, 1986). Circa il 25% delle resistenze coronariche totali è localizzato nei vasi arteriosi di diametro maggiore di 200 μm, il 20% in quelli tra 100 e 200 μm, il resto nei vasi di diametro inferiore ai 100 μm, ovvero le arteriole. In altre parole, le resistenze vascolari coronariche sono regolate in un ampio range di dimensioni dei microvasi coronarici e le loro variazioni determinano una significativa redistribuzione delle resistenze. Le sostanze che hanno un effetto dilatatorio sulle arterie di piccolo calibro spostano a valle le resistenze, mentre quelle, come il dipiridamolo, che preferenzialmente dilatano le arteriole, le dirottano a livello dei grossi vasi e, più a valle, a livello venulare. L’eterogenea capacità vasodilatatoria dei microvasi coronarici perciò influisce enormemente sui profili della distribuzione delle resistenze e delle pressioni microvascolari.
Quando si parla di microcircolo coronarico si fa dunque riferimento ad un sistema di vasi, di diametro inferiore ai 300 μm, che è responsabile della maggior parte delle resistenze della circolazione coronarica, e le cui caratteristiche strutturali, fisiologiche e farmacologiche variano in modo significativo a seconda del diametro del vaso.
Regolazione del tono vascolare a livello microcircolatorio
La conduttanza del flusso coronario è determinata da fattori intrinseci alla parete vascolare (controllo miogenico e cambiamenti di diametro indotti dal flusso), fattori neuroumorali e fattori metabolici locali. Analizziamoli separatamente.
Controllo intrinseco alla parete vascolare
Due stress meccanici agiscono continuamente sulle pareti vascolari. Uno è lo stress perpendicolare dovuto alla pressione arteriosa, che determina lo stiramento della parete vascolare. L’altro è lo “shear stress”, ovvero la frizione, che agisce lungo la direzione longitudinale del vaso, esercitata dal torrente ematico sulle cellule endoteliali. In risposta a questi due tipi di stress i tessuti vascolari possiedono meccanismi di controllo intrinseci per mantenere l’omeostasi del microambiente locale:
• la risposta miogenica, di fronte a cambiamenti nella pressione intravascolare (Bayliss,1992)
• la dilatazione flusso-mediata, per gli aumenti dello shear stress (Rubanyi, 1986)
Questi due meccanismi di controllo intrinseco alla parete arteriosa determinano il tono vascolare nelle diverse condizioni emodinamiche in modo additivo o competitivo, a seconda della direzione dei cambiamenti di pressione e flusso a livello microvascolare (Kuo et al, 1991).
Controllo miogenico
Il controllo miogenico del calibro vascolare è stato analizzato a livello microvascolare coronarico del modello suino e nell’uomo.
L’applicazione di una pressione luminale in un cuore isolato determina a livello microcircolatorio lo sviluppo di un tono vascolare intrinseco che è definito “tono miogenico”, così come il suo aumento o la sua diminuzione determina rispettivamente una contrazione o una dilatazione vascolare, fenomeno detto “risposta miogenica”.
Il controllo miogenico microvascolare è fondamentalmente endotelio-indipendente, e gioca un ruolo critico nel determinare il tono basale e nel mantenere la pressione
intraluminale entro un range fisiologico, dal momento che essa rappresenta uno dei fattori determinanti per lo scambio di substrati metabolici e di acqua tra distretto vascolare e miocardio a livello capillare (Davis et al, 1999).
La risposta miogenica è inoltre importante per la regolazione locale della meccanica della parete vascolare in termini di mantenimento della fisiologica tensione parietale in risposta a rapidi cambiamenti della pressione intraluminale. La vasocostrizione che deriva dallo stiramento meccanico determina, secondo la legge di Laplace, una riduzione della tensione di parete e può proteggere il microvaso da un danno acuto. Per contro, la dilatazione in risposta ad una diminuzione della pressione intraluminale evita che il vaso collabisca.
L’entità della risposta miogenica varia in relazione al diametro vascolare, essendo stata dimostrata nel modello suino nelle arteriole (<100 μm) e non nei vasi di calibro maggiore di 150 μm (Kuo et al, 1988). In particolare pare che la risposta più ampia si abbia a livello delle arteriole di dimensioni intermedie (50-80 μm) (Liao et al, 1997), e un simile quadro è dimostrato a livello di altre reti vascolari. Queste osservazioni potrebbero indicare che le arteriole di dimensioni intermedie esercitano un ruolo primario nella regolazione della pressione a livello dei vasi di scambio e che potrebbero costituire un’importante riserva anche per stimoli dilatatori di tipo metabolico o neuroumorale.
Il sensore della pressione intravascolare, responsabile dell’attivazione del controllo miogenico, non è ancora stato precisamente determinato. Pare tuttavia che un canale ionico non selettivo, sensibile allo stretch e localizzato a livello delle cellule muscolari lisce, determini, quando attivato, un influsso cationico e la depolarizzazione delle cellule muscolari lisce, attivando così un canale del K+ voltaggio sensibile, l’ingresso di Ca++ e la sua conseguente liberazione dai depositi intracellulare, portando dunque alla definitiva contrazione della cellula (Davis et al, 1992).
Dilatazione flusso-indotta
La dilatazione flusso-indotta è un fenomeno ubiquitario dei vasi arteriosi in vari organi ed animali (Pohl et al, 1986) Tale meccanismo autoregolatorio è importante per i seguenti ruoli fisiologici:
• protegge i vasi arteriosi da lesioni indotte dal contatto col sangue;
• previene il fenomeno del “furto vascolare”, dilatando i vasi a monte in caso di locale iperemia;
• riduce l’eterogeneità della distribuzione del flusso coronarico;
• agisce da tampone della pressione arteriosa in risposta ad un suo rapido aumento
Questo fenomeno è stato osservato a livello dei grossi vasi coronarici epicardici, delle arteriole e delle venule (Hintze et al, 1984, Kuo et al, 1993)); tuttavia, il cambiamento di diametro in risposta al flusso è molto più rapido e più efficace a livello microarteriolare rispetto a quello dei vasi coronarici epicardici (Kuo et al, 1990). Inoltre, l’entità della dilatazione flusso-indotta è eterogenea all’interno del distretto microcircolatorio: le grosse arteriole (80-130μm) ne sono molto più sensibili rispetto a quelle di dimensioni intermedie (50-80 μm). Questa diversità potrebbe riflettere l’implicazione fisiologica che la dilatazione flusso-indotta esercita un effetto tampone della pressione di perfusione in risposta ai suoi rapidi aumenti (Jones et al, 1995).
Il controllo del tono vascolare mediato dal flusso regola il diametro del vaso in modo che lo shear stress, determinato dalla velocità di flusso in condizioni di normale viscosità ematica, sia sempre mantenuto ad un certo set point (Kuo et al, 1990) e la dilatazione flusso-indotta protegge l’endotelio vascolare da possibile danni indotti dall’eccessiva frizione col sangue.
In contrasto alla risposta miogenica, l’endotelio ha un ruolo primario per la dilatazione flusso-indotta, ed i principali mediatori coinvolti in questo fenomeno sono di diretta derivazione endoteliale, in particolare l’ossido nitrico (lo shear stress è uno dei principali stimoli alla sua produzione), l’EDHF e i prostanoidi (Kuo et al, 1991; Jimenez et al,1996). L’ipotesi è che il flusso sia avvertito da meccanocettori
endoteliali capaci di alterare il potenziale di membrana e attivare un meccanismo di meccanotransduzione che porterebbe alla liberazione di vasodilatatori ad azione paracrina (Davies et al, 1996).
Fattori neuroumorali
Il sistema arterioso coronarico è densamente innervato dai sistemi nervosi simpatico e parasimpatico e da nervi non adrenergici/non colinergici. I neurotrasmettitori liberati dai tessuti nervosi, insieme ad una varietà di sostanze umorali, concorrono alla regolazione del tono microvascolare. Tra di essi si annoverano fattori derivati dall’endotelio, neurotrasmettitori/co-trasmettitori, ormoni circolatori e sostanze correlate alla trombosi e all’attivazione della coagulazione. Questi fattori neuroumorali, in aggiunta ai controlli miogenico, flusso-indotto e metabolico locale, collaborano alla regolazione delle resistenze coronariche per determinare il rifornimento di ossigeno e nutrienti al miocardio.
Fattori endotelio-derivati
E’ormai ampiamente accettato che l’endotelio esercita una funzione chiave nella fisiopatologia cardiovascolare e che la disfunzione endoteliale abbia un ruolo centrale in ogni malattia che colpisce tale sistema, in primis l’aterosclerosi.
Altrettanto riconosciuto è che l’endotelio rappresenta un componente di primaria importanza nella vasomozione, secernendo fattori sia vasodilatori che vasocostrittori.
I tre principali mediatori della vasodilatazione mediata dall’endotelio sono l’ossido nitrico (NO), la prostaciclina (PGI2) e il fattore depolarizzante di derivazione endoteliale (endothelial-derived hyperpolarizing factor, EDHF).
L’ossido nitrico è sintetizzato a partire dall’L-arginina dall’enzima costitutivo NO sintasi endoteliale (endothelial nitric oxide synthase, eNOS), un enzima
Ca++/calmodulina dipendente (Palmer et al, 1988). L’NO diffonde all’interno delle cellule muscolari lisce dove attiva la guanilato ciclasi intracellulare. L’aumentata produzione di cGMP determina la riduzione delle concentrazioni di Ca++ intracellulari e, conseguentemente, vasodilatazione. L’attivazione della eNOS è favorita da prodotti della trombosi (trombina), piastrine (serotonina, ADP), vari altri stimoli chimici (istamina, bradichinina) e dallo shear stress.
La prostaciclina viene sintetizzata sia nelle cellule endoteliali sia nelle cellule muscolari lisce da parte dell’enzima ciclossigenasi a partire dall’acido arachidonico. Una volta prodotta, essa si lega a specifici recettori accoppiati a proteine GS sulle cellule muscolari lisce stimolando l’adenilato ciclasi (Haluschka et al, 1989). Il conseguente aumento di AMP ciclico (cAMP), induce rilassamento cellulare attraverso la via della protein chinasi A (PKA) e facilitando la liberazione di NO. Tuttavia la dilatazione endotelio-dipendente a livello microcircolatorio appare di scarso rilievo (Myers et al, 1989).
Sebbene esista ancora una controversia riguardo all’identità dell’EDHF, è ormai certo che esso eserciti un ruolo di primo piano nella modulazione del tono microvascolare. La maggior parte dei dati sembrano attribuire la sua identità alla molecola 11,12-acido epossieicosatrienoico, un derivato dell’acido arachidonico attraverso il citocromo P-450 (Mombouli et al, 1997). Dal momento che più metaboliti dell’acido arachidonico derivati dal citocromo P-450 esercitano la stessa azione, la denominazione EDHF potrebbe in realtà racchiudere più molecole. La sua importanza sembra molto più rilevante a livello arteriolare rispetto alle arterie di maggiori dimensioni sia nei modelli animali che nell’uomo (Bauersachs et al 1996). L’EDHF attiva i canali del K+Ca++ delle cellule muscolari lisce, iperpolarizzandole. Condivide con l’NO gli stessi stimoli alla sua liberazione, come l’acetilcolina, la bradichinina, la sostanza P e lo shear stress, mentre l’NO ha un ruolo inibitorio sulla sua produzione (Bauersachs et al, 1996).
Oltre a NO, PGI2 ed EDHF esistino altre sostanze derivate dall’endotelio che esercitano un’attività vasoattiva. La bradichinina e il chininogeno, due prodotti della via delle chinine, hanno un potente effetto vasodilatatorio indiretto attraverso la liberazione di NO, PGI2 (Cherry et al, 1982) ed EDHF (Nakashima et al,1993). La
bradichinina dilata sia le arterie di conduttanza sia dei vasi di calibro ridotto ed il blocco selettivo dei suoi recettori B2-BK (Groves et al, 1995) riduce il flusso coronarico. Altri fattori di derivazione endoteliale sembrano essere i cosiddetti gas primordiali, come il CO e l’H2S, ed è molto probabile che in un prossimo futuro sarà chiarito con precisione il loro ruolo nella fisiologia della vasomozione
L’endotelio secerne anche fattori ad azione vasocostrittrice, tra cui la principale è sicuramente l’endotelina-1, un peptide di 21 aminoacidi chiamato così perché ne esistono altre due forme, l’ET-2 e l’ET-3, non prodotte dall’endotelio. Le sue concentrazioni sono aumentate in diverse malattie cardiovascolari come l’ipertensione, lo scompenso cardiaco e l’infarto miocardico acuto (Myiauchi et al, 1991; McMurray et al, 1992). Esistono due tipi di recettori, gli ET-A, localizzati soprattutto nelle arterie di maggior calibro, e gli ET-B, la cui densità aumenta man mano che il diametro vascolare si riduce. L’infusione intracoronarica di concentrazioni fisiologiche di ET-1 determina una netta diminuzione del flusso coronarico e del diametro delle grosse arterie, processi principalmente mediati dai recettori ET-A (Cannan et al, 1995). In contrasto, i recettori ET-B mediano risposte vascolari opposte, vasocostrizione diretta indotta dall’attivazione di quelli localizzati sulle cellule muscolari lisce e vasodilatazione mediata dall’NO da parte di quelli endoteliali (Rigel et al, 1993, Cannan et al, 1995). Al contrario dell’NO, la cui emivita è brevissima (circa 10 secondi) e che perciò ha un’azione di breve durata, l’ET-1 esercita un’azione prolungata. La trombina, l’angiotensina II, la noradrenalina e la vasopressina, i più comuni stimoli alla sua produzione, agiscono mediante la stimolazione de novo della trascrizione del suo RNA messaggero.
Controllo nervoso
Lo studio della localizzazione dei recettori α a livello del microcircolo coronarico ha dimostrato che mentre gli α1 sono uniformemente distribuiti lungo tutto l’albero coronarico, gli α2 sono preferenzialmente localizzati a livello arteriolare. In condizioni di normale pressione di perfusione l’effetto di stimolazione selettiva dei recettori α1 determina vasocostrizione nei microvasi di diametro superiore ai 100 μm
e nessun effetto su quelli di minor calibro, mentre non si registrano modificazioni di flusso o resistenze con l’uso di agonisti selettivi α2; tuttavia riducendo la pressione di perfusione in modo da abolire il controllo intrinseco alla parete vascolare, gli agonisti α1 determinano vasocostrizione anche sui vasi di calibro inferiore ai 100 μm, mentre gli agonisti α2 vasocostringono solamente a livello arteriolare e non nei vasi di maggiori dimensioni (Chilian et al, 1991). Ciò implica che il controllo intrinseco alla parete vascolare minimizza la vasocostrizione α-mediata in condizioni normali e conferma che il controllo α2 avviene esclusivamente a livello arteriolare. Si spiega anche così la presenza di un aumentato tono α a livello microvascolare in presenza di una stenosi coronarica emodinamicamente significativa (Baumgart et al, 1999). La stimolazione β-adrenergica determina una vasodilatazione coronarica sia in modo diretto sul tessuto vascolare sia in modo indiretto aumentando il lavoro cardiaco e di conseguenza la richiesta metabolica del miocardio. Studi attraverso radioligandi hanno dimostrato che le arteriole coronariche presentano esclusivamente recettori del sottotipo β2, mentre le grosse arterie di conduttanza contengono anche il sottotipo β1 (Vatner et al, 1986). A supporto di tali dati, studi in vitro su microvasi di modello suino (diametro 80-130 μm) hanno dimostrato che la dilatazione indotta dall’agonista isoproterenolo è quasi totalmente inibita da un antaagonista β2-selettivo, mentre l’atenololo, antagonista-β1 selettivo, riduce solo blandamente la risposta (Wang et al, 1994). Probabilmente sia l’attivazione dei canali K+ATP che la liberazione di NO sono coinvolte nella dilatazione dei vasi coronarici di resistenza indotta dai recettori β.
L’effetto diretto della stimolazione vagale e dell’acetilcolina (Ach) esogena aumentano la conduttanza del flusso coronarico (Lamping et al, 1992). L’aumento del flusso determinato dall’Ach è stato osservato in vari modelli animali e nell’uomo (Myers et al, 1989; Drexler, 1991). Osservazioni dirette in vivo dei microvasi coronarici ha dimostrato che sia la stimolazione vagale sia la somministrazione di Ach (intracoronarica, intraatriale e l’applicazione topica) dilatano i microvasi di ogni dimensione in modelli in vivo di gatto e cane, con un effetto che è via via maggiore nei vasi di minor calibro (Komaru et al, 1991; Lamping et al, 1992). L’NO sembra essere il principale della dilatazione Ach-mediata, ma in realtà altri meccanismi
sembrano essere coinvolti. Mentre gli effetti inibitori degli analoghi dell’L-arginina sulla dilatazione indotta dall’Ach si esercitano in modo evidente a livello dei vasi di diametro superiore ai 120 μm, essa è solo modesta in quelli di diametro inferiore (Komaru at al, 1991), il che indica che altri meccanismi diversi dalla via dell’ossido nitrico sono responsabili della dilatazione a livello arteriolare. Il fatto che inibitori del citocromo P450, in combinazione con analoghi dell’L-arginina, impediscano la vasodilatazione arteriolare prefigura un ruolo importante dell’EDHF a tale livello. Tra gli altri neurotrasmettitori vanno annoverati il neuropeptide Y (NPY), il peptide correlato al gene della calcitonina (CGRP) e la sostanza P.
Il neuropeptide Y, un peptide di 26 aminoacidi, viene principalmente liberato con la noradrenalina come cotrasmettitore dai nervi simpatici postgangliari. La sua applicazione intracoronarica riduce significativamente il flusso coronarico, determinando ischemia miocardica senza costrizione dei grossi vasi coronarici (Clarke et al, 1987). La vasocostrizione microcircolatoria indotta da questo agonista è così potente che supera il controllo microcircolatorio intriseco alla pareta vascolare..
Il CGRP è un peptide di 37 aminoacidi, principalmente contenuto a livello delle fibre nervose nonadrenergiche/noncolinergiche. Il suo effetto vasodilatatorio sui microvasi coronarici è particolare, in quanto è attivo su microvasi di diametro superiore ai 100 μm, mentre è trascurabile a livello arteriolare. Coupe et al (1990) hanno confermato che la distribuzione dei suoi recettori è prevalente nelle grosse arterie. Questo effetto dilatatorio a livello microvascolare è simile a quello dell’NO, per cui potrebbe agire come un nitrato endogeno.
La sostanza P, contenuta nelle fibre nervose perivascolari e nei gangli sensori, è un potente vasodilatatore che agisce con un meccanismo endotelio-dipendente. Il suo potente effetto vasodilatatorio è stato dimostrato in numerosi modelli animali e anche nell’uomo, e, al contrario del CGRP, è prevalente sui microvasi di piccole dimensioni, ossia a livello arteriolare (Kuo el al, 1995). La sua azione è totalmente dipendente dalla liberazione endoteliale di NO, probabilmente grazie alla iperpolarizzazione a livello delle membrane delle cellule muscolari lisce che determina l’ingresso di Ca++ e l’attivazione della eNOS.
Ormoni circolanti
Tra gli ormoni circolatori non adrenergici che influenzano la funzione microvascolare un ruolo importante hanno l’angiotensina II (AGII), la vasopressina (ADH), gli ormoni sessuali e fattori di crescita.
L’angiotensina II viene generata dal clivaggio proteico dell’angiotensina I (a sua volta formata a partire dall’angiotensinogeno) da parte dell’enzima di conversione ACE. Tale processo è noto avvenire a livello del letto vascolare polmonare e nella circolazione sistemica. Numerose evidenze indicano che la produzione di renina, angiotensinogeno ed angiotensina, oltre nelle classiche sedi, avviene anche a livello di vari tessuti, tra cui quello vascolare, e l’AGII sintetizzata localmente esercita un controllo del tono e della crescita vascolare in modo autocrino e paracrino (Lee et al, 1993). Le arteriole coronariche possiedono un maggior numero di recettori rispetto ai vasi di maggior calibro nel modello suino, mentre non si apprezzano differenze nei cani. Nell’uomo la densità dei recettori dell’AGII a livello vascolare è piuttosto bassa se confrontata con quella miocardica. In contrasto con il potente effetto vasocostrittorio sui letti vascolari periferici, nel maiale e nel cane è stato dimostrato che essa esercita un modesto effetto vasocostrittore su coronarie precedentemente dilatate e addirittura un effetto vasodilatatorio su arterie in stato di vasocostrizione (Myers et al, 1994). Si prefigura perciò un ruolo limitato per l’angiotensina II nella modulazione acuta del tono microcircolatorio coronarico, sebbene l’effetto cronico di questo ormone o l’interazione con altre sostanze come l’ET-1 rivestano un ruolo importante nella modulazione del flusso coronarico (Luscher et al, 1992).
La vasopressina è un ormone peptidico secreto dall’ipofisi posteriore che determina un significativo aumento delle resistenze coronariche (Heyndrick et al, 1976). Questo peptide ha un’azione così potente sul microcircolo da ridurre il flusso coronarico determinando ischemia senza alterare in modo apprezzabile il calibro delle grosse arterie coronariche (Maturi et al, 1991). Tuttavia è stata scoperta da Hupf et al (1999) la sintesi de novo di vasopressina a livello miocardico e studi di immunoistochimica indicano che la sua espressione avviene principalmente a livello
delle cellule endoteliali e muscolari lisce delle pareti arteriolari e dell’interstizio perivascolare. Agisce sui microvasi coronarici attraverso un meccanismo di tipo autocrino/paracrino, ed è coinvolto nella patogenesi di alcune condizioni patologiche come ipertensione e scompenso cardiaco. Gli effetti dell’ADH sui microvasi coronarici è molto eterogeneo in vivo (Lamping et al, 1989). Ha un effetto vasocostrittorio a livello arteriolare (<90 μm), mentre dilata i vasi di maggiori dimensioni nel gatto. Tale effetto vasodilatatorio è mediato dall’ossido nitrico (Myers et al, 1989).
Gli ormoni sessuali hanno un effetto vasoattivo sui vasi coronarici di conduttanza e di resistenza. Gli estrogeni, e in particolare il 17-β estradiolo, vasodilata le arterie coronariche epicardiche canine (Sudhir et al, 1995) e i microvasi coronarici di diametro compreso tra i 100 e i 200 μm (Lamping et al, 1996), e tale dilatazione è inibita dalla combinazione di indometacina e L-NNA (inibitore della eNOS), indicando il ruolo combinato e compensatorio della prostaciclina e dell’ossido nitrico. Gli estrogeni inoltre inibiscono la costrizione microvascolare indotta dall’ET-1. Testosterone e progesterone hanno un effetto vasodilatatorio, ma non inibiscono la vasocostrizione mediata dall’endotelina, il che fa ipotizzare un ruolo protettivo degli estrogeni in quelle condizioni, come l’infarto miocardico acuto, caratterizzate da un importante liberazione endoteliale di ET-1.
Gli ormoni della crescita giocano un ruolo cruciale nella formazione del circolo collaterale attraverso i loro effetti angiogenici e mitogenici. Il basic fibroblast growth factors (bFGF), il vascular endothelial growth factor (VEGF) e l’hepatocite growth factor (HGF) esercitano anche un’azione vasodilatatoria attraverso la liberazione di NO da parte dell’endotelio dei microvasi. In aggiunta all’effetto vasodilatorio diretto, la somministrazione cronica di bFGF normalizza la funzione endoteliale a livello arteriolare nel miocardio ischemico (Sellke et al, 1994). Questo concetto si pone nell’ottica che la dilatazione endotelio-dipendente in risposta a fattori di crescita nelle aree ischemiche sia finalizzata alla formazione del circolo collaterale per la protezione del miocardio dall’ischemia.
Sostanze di origine trombotica
La formazione del trombo è uno degli eventi chiave nella patogenesi delle sindromi coronariche acute. Le sostanze liberate nel processo trombotico possiedono caratteristiche vasoattive, e tra di esse si possono individuare la 5-idrossitriptamina (o serotonina), l’ADP, il trombossano A2 (TXA2), e anche prodotti della cascata della coagulazione come la trombina. Queste molecole si formano nello sviluppo del processo acuto e possono aver rilevanza nella fisiopatologia delle malattie cardiovascolari.
Nell’uomo, la 5-HT nei soggetti normali determina un aumento del flusso, mentre nei pazienti affetti da aterosclerosi avviene esattamente l’opposto (Golino et al, 1991). Studi effettuati sulla circolazione coronaria di gatti hanno dimostrato che le arteriole di diametro inferiore ai 90 μm si dilatano in modo dose-dipendente, mentre i vasi di diametro superiore si costringono. L’effetto a livello microvascolare è quasi totalmente mediato dalla liberazione endoteliale di NO attraverso la stimolazione dei recettori 5-HT1, mentre la vasocostrizione delle arterie di piccolo calibro è mediata dai recettori 5-HT2 (Lamping et al, 1997).
L’ADP, un altro prodotto di derivazione piastrinica, è stato da ormai lungo tempo dimostrato essere un potente dilatatore vascolare a livello microcircolatorio in diversi modelli animali (Osborne et al, 1989; Kuo et al, 1992); l’effetto indotto è endotelio-dipendente ed è ridotto o totalmente abolito nelle condizioni di ipercolesterolemia e aterosclerosi.
Quillen et al (1991) hanno dimostrato che la trombina dilata le arteriole coronariche con meccanismo endotelio-dipendente nella scimmia, mentre nei cani sembra avere un effetto vasocostrittore attraverso la liberazione di prostanoidi (Myers et al, 1989).
Il TXA2, che viene liberato durante il processo dell’aggregazione piastrinica, ha un potente effetto vasocostrittore sui microvasi coronarici, tant’è che un suo analogo, l’ U46619, viene usato sperimentalmente per indurre vasocostrizione microcircolatoria su coronarie isolate (Sellke et al, 1990).
Queste sostanze, liberate dal trombo a livello delle arterie coronarie epicardiche, si formano durante eventi coronarici acuti ed esercitano un effetto, di tipo vasodilatatorio o vasocostrittorio, sui microvasi a valle. Dal momento che la maggior parte delle loro azioni è endotelio-dipendente, l’integrità funzionale dell’endotelio esercita un ruolo critico nell’ambito dei meccanismi di difesa in queste condizioni.
Controllo metabolico
Il flusso coronarico è strettamente correlato allo stato metabolico del cuore, definito come l’equilibrio tra l’apporto di ossigeno e di nutrienti e le richieste miocardiche di ossigeno (Feigl, 1983). Osservazioni in vivo hanno dimostrato che tutti vasi di dimensioni inferiori ai 300 μm si dilatano in risposta ad un aumento della richiesta metabolica, e che l’entità della dilatazione è inversamente correlata con il diametro basale (Kanatsuka et al, 1989). Sebbene alcuni mediatori non siano ancora stati identificati, il contributo dell’adenosina, dei canali del K+ATP e dell’ossido nitrico è stato studiato con numerosi approcci sperimentali.
L’adenosina è il mediatore che storicamente è stato a lungo ritenuto il principale responsabile del controllo metabolico del flusso coronarico (Berne et al, 1979). Infatti è noto che l’incremento del lavoro cardiaco determina un parallelo aumento delle sue concentrazione nell’interstizio cardiaco (De Witt et al, 1983) e sia la somministrazione esterna sia la sua produzione intrinseca hanno effetto dilatatorio solamente sui microvasi di diametro inferiore ai 150 μm. In letteratura tuttavia esistono sia pareri positivi che negativi sul suo effettivo ruolo fisiologico nel controllo del flusso coronarico. Ciò che pare probabile è che alcuni mediatori diversi dall’adenosina siano primariamente responsabili dell’incremento di flusso indotto da aumentate richieste metaboliche e che quest’ultima possa giocare un ruolo nella riduzione delle resistenze coronariche solamente in condizioni di vera e propria ischemia, essendo proprio lo squilibrio tra apporto e richiesta di ossigeno, e non
solo la maggior spesa metabolica miocardica, a determinarne la liberazione (Bardenheuer et al, 1986).
Un ruolo di primo piano negli ultimi anni ha acquisito lo studio dei canali K+ATP. La loro attivazione avviene ad opera di stimoli quali il lattato, l’acidosi, l’adenosina stessa e il peptide correlato al gene della calcitonina La glibenclamide, farmaco promotore della secrezione dell’insulina a livello delle isole di Langerhans, agisce come inibitore selettivo di tali canali; la sua applicazione topica sulla superficie cardiaca determina la riduzione dei diametri delle arterie di piccolo calibro (Embrey et al, 1997), così come è stato dimostrato che essa inibisce l’incremento di flusso secondario ad aumentate richieste metaboliche (Katsuda et al, 1994; Duncker et al, 1995). Al contrario, un attivatore selettivo di tali canali, la levcromakalima, determina la dilatazione dei microvasi di ogni diametro, e l’entità dell’effetto appare inversamente proporzionale al diametro basale (Sato et al, 1994). Duncker et al (1996) hanno inoltre definito il loro ruolo primario nel controllo metabolico del flusso dimostrando che l’adenosina fisiologicamente ha effetto solo quando tali canali sono bloccati o quando la loro attività è già massimale. Ciò è anche in accordo con il ruolo riconosciuto dall’adenosina quale mediatore del dolore ischemico (Crea et al, 1995), riconoscendo per essa la funzione di meccanismo di allarme (l’angina) e di incremento del flusso locale nel momento in cui lo squilibrio tra apporto e richiesta di ossigeno si è ormai già verificato.
Nell’ambito della modulazione metabolica del flusso coronarico è da tempo sotto osservazione è anche l’ossido nitrico, considerando che la sua liberazione cresce all’aumentare del metabolismo miocardico (Bernstein et al, 1996). Jones et al (1995) hanno studiato nel modello canino gli effetti dell’inibizione dell’ossido nitrico sulla risposta microcircolatoria in condizioni di riposo e di pacing. Tutti i microvasi si dilatavano in risposta ad un rapido pacing, in modo inversamente proporzionale ad diametro del vaso. La somministrazione intracoronarica di N-nitro-L-arginina metilestere (L-NAME), inibitore nella NO sintasi, riduceva in condizioni basali il diametro delle arterie di piccolo calibro (>100 μm) dilatando invece le arteriole (<100 μm), ma senza alterare la velocità di flusso coronarico. Durante pacing, la dilatazione microvascolare indotta dalle aumentate richieste metaboliche era
totalmente abolita, in presenza tuttavia di un aumento del 34% della velocità di flusso. Tale risultato suggerisce che l’NO giochi un ruolo importante nella regolazione della distribuzione delle resistenze e nell’aumento del flusso in condizioni di aumentato lavoro cardiaco. L’’NO liberato in risposta alle aumentate richieste metaboliche esercita un effetto dilatatorio sui vasi di diametro compreso tra i 50 e i 300 μm, ma tuttavia sembra non agire, o quantomeno altri mediatori sarebbero ancora più efficaci, a livello delle arteriole di diametro inferiore ai 50 μm.. Un altro aspetto delle azioni dell’NO è rappresentato infine dal suo effetto diretto sul consumo miocardico di ossigeno. Shen et al (1994) hanno proposto che l’ossido nitrico liberato dall’endotelio moduli tonicamente il metabolismo miocardico in condizioni di riposo e durante esercizio. Tali dati sono in accordo con l’interpretazione che l’NO abbia un ruolo primario nella modulazione del metabolismo miocardico, in particolare inibendo la captazione miocardica dei substrati glucidici (Recchia et al, 1998 e 1999).
Concludendo, possiamo dire che alcuni segnali liberati dal miocardio che riflettono lo stato metabolico potrebbero agire sulle arteriole di piccolo calibro, dal momento che esse sono strutturalmente vicine alle cellule miocardiche rispetto a quelle di maggiori dimensioni; i principali meccanismi della diminuzione delle resistenze sembrano essere l’iperpolarizzazione del canali K+ATP, e l’attivazione della via dell’ossido nitrico; la modulazione metabolica del flusso ad opera dell’adenosina sembra avvenire invece solamente in condizioni di ischemia.
Nel prossimo capitolo affronteremo il problema della disfunzione del microcircolo coronarico, così come è definita e quali sono le condizioni patologiche in cui il controllo delle resistenze a livello microvascolare risulta alterato.
Vedremo poi quali sono le evidenze che illustrano la presenza di disfunzione microcircolatoria nella Cardiomiopatia Dilatativa e suggeriscono un suo ruolo patogenetico e prognostico in questa malattia.