1. L’Eutrofizzazione
I fiumi sono in genere caratterizzati da fenomeni di inquinamento acuto, a causa dell’alta concentrazione di inquinanti determinata dalla limitata capacità defluente. Viceversa i laghi sono maggiormente caratterizzati da forme di inquinamento cronico, giacché il volume dell’invaso determina la lenta ma progressiva crescita delle concentrazioni di inquinanti, trattenuti per effetti chimici, fisici e biologici.
Tuttavia, mentre l’inquinamento di un fiume regredisce rapidamente una volta realizzate le opere di depurazione degli scarichi, l’inquinamento di un lago richiede invece tempi molto più lunghi, dello stesso ordine di grandezza dei tempi occorsi per il manifestarsi dell’inquinamento.
Il fenomeno dell’eutrofizzazione è una tipica manifestazione di inquinamento cronico dei bacini lacustri. Tuttavia nella stessa identica forma interessa qualsiasi bacino idrico a debole ricambio, tra cui si identificano, oltre ai laghi, bacini di mare, specie se relativamente chiusi, lagune e anche fiumi.
La causa di questo fenomeno è la super-concimazione delle acque del bacino ad opera di sostanze nutritive con conseguente crescita anomala delle alghe.
1.1 Generalità e definizioni
Come avviene nell’ambiente terrestre, anche in acqua la vita si organizza sulla base dei rapporti che si stabiliscono tra alcuni organismi chiamati Produttori primari e altri (erbivori e carnivori) detti Consumatori, tra i quali si collocano quelli chiamati Degradatori o Decompositori.
Dal punto di vista dell’eutrofizzazione il massimo interesse rivestono i produttori primari, organismi vegetali che, con il processo della fotosintesi, possono utilizzare in presenza di luce la materia inorganica per formare materia organica.
Fig.1.1 Nella figura i percorsi A e B costituiscono, nel ciclo alimentare, la così detta “catena del pascolo” in alternativa alla “catena del detrito” che è indicata con C, D ed E.
Con elaborazioni successive e l’assunzione di altri composti minerali i produttori primari possono sintetizzare ulteriori composti organici di grande interesse come grassi, proteine, vitamine, ormoni. Essi utilizzano come fonte di energia per questa sintesi gli zuccheri da essi stessi prodotti.
In ambiente acquatico i Produttori primari sono rappresentati da piante o macrofite sommerse, da piante emerse con radici acquatiche e da alghe microscopiche. Nelle acque lentiche, ed anche in mare, il gruppo vegetale che svolge il maggior ruolo ai fini della produzione primaria di sostanza organica vivente è quello delle alghe microscopiche che stanno in sospensione nell’acqua, denominate fitoplancton, le cui dimensioni sono, di norma, dell’ordine del micron.
Appartiene al fitoplancton di acqua dolce (Fig. 1.2) un numero elevatissimo di organismi tra i quali si possono citare la Clorella, un’alga verde presente in acqua con varie specie, quali sono la C. vulgaris e la C. ellipsoidea; la Tabellaria e l’Asterionella, appartenenti al gruppo delle Diatomee; l’Oscillatoria e l’Anabena appartenenti al gruppo delle Cianoficee o alghe azzurre.
Fig. 1.2 Alghe d’acqua dolce: A) Clorella vulgaris; B) Tabellaria fenestrata; C) Asterionella formosa; D) Navicula radiosa; E) Cyclotella meneghiniana; F) Oscillatoria rubescens;
G) Anabaena circinalis; H) Microcystis aeruginosa.
In mare, tutti i gruppi citati per le acque dolci ed altri ancora qui non ricordati sono rappresentati da un rilevante numero di specie (Fig. 1.3). Al gruppo delle Crisoficee appartengono le Coccolitoforidee che in Mediterraneo possono arrivare a costituire il 90% della popolazione algale. Molto importanti nel fitoplancton del Mediterraneo sono anche le alghe appartenenti al gruppo dei Dinoflagellati. Alcune specie di questo ultimo gruppo presentano il fenomeno della luminescenza che si ripete con una certa frequenza in acque adriatiche. Ai Dinoflagellati appartiene inoltre la maggior parte delle alghe tossiche e la specie di acqua dolce Glenodinum, responsabile del fenomeno dell’arrossamento delle acque, verificatosi anche in Italia.
Fig. 1.3 Organismi planctonici marini e d’acqua dolce: A) Coccolitoforidea; B) Ceratium tripos;C) Gonialuax polyedra; D) Prorocentrum micans; E) Noctiluca miliaris;
F) Glenodinium sanguineum.
Anche le macrofite in acque lentiche e soprattutto in mare possono assumere un ruolo di grande rilievo ma, esigendo un substrato di appoggio per la loro crescita e non potendo svilupparsi in assenza di luce, sono di solito confinate nelle zone litorali.
Esempi di macrofite marine (Fig. 1.4) si possono trovare sia tra le cosiddette alghe brune, sia tra le alghe verdi, sia infine tra le piante superiori con radici ben sviluppate quali sono le Posidonie e le Zoostere.
Fig. 1.4 Macrofite marine: A) Laminaria; B) Fucus; C) Ulva lactuca; D) Caulerpaprolifera; E) Zoostera marina; F) Posidonia oceanica.
Tra le specie caratteristiche degli ambienti di acqua dolce si possono citare quelle sommerse, tra le quali sono tipiche il Potamogenton, la Sagittaria, nonché quelle emerse e litorali, tra cui la Tifa e il Fragmite sono i più noti (Fig. 1.5).
Fig. 1.5 Macrofite d’acqua dolce: A) Typha; B) Phragmites communis; D) Nymphaea alba; E) Potamogenton lucens; F) Potamogenton perfoliatus; G) Myriophyllum; H) Ceratopyllum;
I) Helodea.
La produzione primaria nelle acque lotiche ha luogo di norma nelle zone collaterali e marginali, quali sono le lanche e le anse a scarso ricambio di acqua, o nei laghi nel caso di corsi d’acqua emissari. Anche nell’alveo principale, se sono disponibili substrati duri quali le ghiaie sommerse o massi di roccia o manufatti in cemento e se la velocità della corrente lo consente, può svilupparsi una vegetazione. Tipica è quella costituita dalle alghe verdi filamentose del genere Cladophora, la cui presenza dà ai fondi dei fiumi la colorazione verdastra. La proliferazione di queste alghe può portare alla formazione di una sorta di tessuto che si allunga in acqua nel senso della corrente anche per metri e che costituisce il riparo e il supporto per vari animali e per altre alghe. Questa vegetazione che cresce sui substrati duri viene denominata perifiton e viene di norma strappata e trascinata in acqua dalla corrente, andando a costituire una frazione rilevante del plancton del fiume o del torrente.
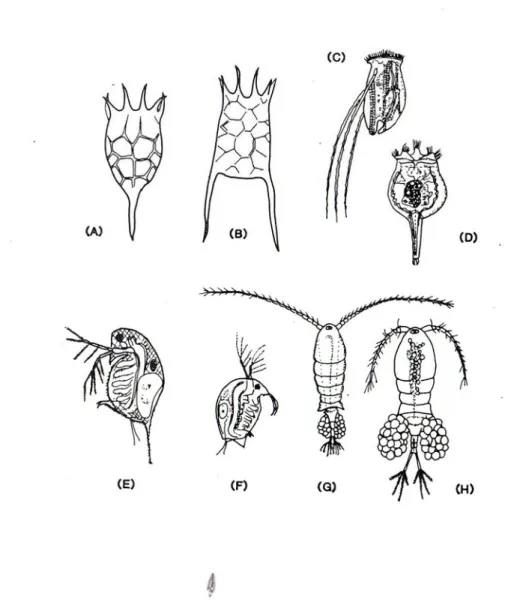
Gli organismi Consumatori propriamente detti, nel plancton delle acque dolci, sono rappresentati da animali appartenenti a pochi gruppi zoologici riconducibili a quelli principali dei Rotiferi e dei Crostacei (Fig. 1.6). I Rotiferi sono degli invertebrati di dimensioni microscopiche che, insieme ai Crostacei dei gruppi
Copepodi e Cladoceri (correntemente detti pulci d’acqua) costituiscono la componente dominante del plancton animale.
Questa situazione si riscontra anche nelle acque dolci correnti, nelle quali però la componente citata in genere si limita a transitare, nel senso che si genera altrove: nei laghi, nelle zone collaterali, negli spazi ripararti rispetto alla corrente dalla quale viene continuamente esportata. Nonostante ciò, Rotiferi e Crostacei rappresentano un elemento fondamentale anche della comunità lotica: essi si nutrono direttamente del fitoplancton e per questo motivo vengono denominati consumatori Primari. Questi organismi costituiscono una base significativa dell’alimentazione dei consumatori successivi o Secondari, tra cui si collocano i pesci.
Gli animali acquatici predatori dei pesci, che più comunemente sono altri pesci quali il luccio o il persico trota, vengono denominati Consumatori terziari per questa loro posizione nella catena alimentare. Bisogna ricordare che esistono però anche pesci la cui dieta è esclusivamente erbivora e che, di conseguenza, si collocano al livello trofico dei consumatori primari.
Fig. 1.6 Zooplancton d’acqua dolce: A-D) Rotiferi; E-H) Crostacei.
In acqua di mare la situazione è estremamente più ricca di specie. In mare frequente è anche il caso di animali con stadi larvali planctonici, e quindi liberi, e stadi adulti fissi, qual è il corallo rosso. I gruppi più rappresentativi dello zooplancton marino sono quelli dei Protozoi, organismi unicellulari con scheletri a base di silice detti Radiolari, di calcio detti Foraminiferi, di stronzio detti Acantari o privi di scheletro; dei Rotiferi; dei vermi; dei Crostacei; dei Molluschi e di altri gruppi meno conosciuti quali quello dei Chetognati e dei Tunicati. Tra tutti quello dei Crostacei è quello che nello zooplancton marino compare con la maggiore ricchezza di specie.
L’ultima componente del sistema, che si alimenta con le deiezioni e le spoglie degli animali e dei vegetali, è quella denominata dei Demolitori o dei Decompositori che si nutrono di sostanza organica morta. Quelli che svolgono il
ruolo fondamentale nel processo di demolizione della sostanza organica, riportandola allo stato minerale e chiudendo così il ciclo della materia, sono rappresentati dai funghi microscopici e da una grande quantità di specie di microrganismi batterici. [1]
Da quanto esposto emerge chiaramente che il meccanismo iniziale di mantenimento della vita in acqua è quello della trasformazione fotosintetica della sostanza minerale in sostanza organica e che la sostanza organica così prodotta costituisce un serbatoio di energia chimica derivata dalla luce solare, che i vari organismi si trasferiscono in successione via via esaurendolo per le varie esigenze vitali.
Prima di passare dall’inquadramento generale dei processi con cui si organizza la vita nelle acque al problema dell’eutrofizzazione, è opportuno anticipare ancora alcuni elementi relativi ai fattori dai quali dipende la variazione della massa degli organismi vegetali nel tempo.
Tali fattori sono schematicamente riconducibili ai seguenti: 1. La velocità con cui la biomassa si riproduce;
2. la quantità di alghe neoformate che viene esportata dall’ambiente; 3. l’entità della biomassa alloctona che affluisce a quell’ambiente;
4. la rapidità con la quale la biomassa algale presente viene utilizzata dai consumatori primari;
5. la velocità con cui la biomassa muore.
Questi cinque fattori, di solito, agiscono in contemporaneità dando luogo, con il prevalere dell’uno sull’altro, a condizioni ambientali anche assai diversificate. Tali condizioni sono in genere accettabili quando la biomassa alloctona e quella che si riproduce all’interno dell’ambiente in esame si mantengono quantitativamente inferiori a quella che viene usata dallo zooplancton come alimento o persa con le acque emissarie o decomposta all’interno dell’ambiente in esame, senza che quest’ultimo processo avvenga con una velocità tale da consumare più ossigeno di quanto ne possa affluire alle acque. Altrimenti vengono ad instaurarsi condizioni anossiche che sono da considerare come la principale conseguenza negativa dell’intero processo di eutrofizzazione.
Benché tutti i cinque fattori elencati concorrano a determinare la dimensione della biomassa, il ruolo prioritario che ciascuno di essi assume dipende dalle caratteristiche fisiografiche dell’ambiente in esame.
E’ intuitivo che negli ambienti lentici e in mare, se esistono condizioni di scarso ricambio idrico, la produzione di biomassa algale dipenderà soprattutto dalla attività autoctona che aumenta o diminuisce principalmente in funzione della disponibilità di composti minerali. Per questo motivo i composti minerali quali il carbonio, l’azoto e il fosforo vengono denominati sali nutrienti o, più in generale,fattori trofici.
Quando questi sono in difetto la produzione di nuova biomassa rallenta fino a cessare; mentre, se la disponibilità di sali aumenta, anche la biomassa che si forma è maggiore e talvolta la crescita algale può assumere un andamento esplosivo e dare luogo alla formazione di masse enormi di materiale vivente, la cui presenza innesca tutta la serie dei fenomeni degenerativi che verranno descritti nel seguito.
Appare evidente che, a parità di altre condizioni, la chiave di volta del processo risiede nella quantità di sali presenti in acqua di cui la biomassa iniziale può disporre.
E’ infine opportuno ricordare che un processo trofico può avere luogo anche in assenza di influenze umane, per semplice intervento di fattori naturali che, per esempio, favoriscano l’aumento del dilavamento di sali presenti nel bacino di un lago. Nei casi di eutrofizzazione dovuta all’intervento dell’uomo si usano gli aggettivi di antropica o culturale. Inoltre i due tipi di processo si diversificano per la velocità con cui gli eventi hanno luogo: poco elevata nel caso di eutrofizzazione naturale, riconducibile a pochissimi anni in quello culturale.
1.2 Conseguenze dell’Eutrofizzazione
Abbiamo chiarito al paragrafo precedente come l’apporto di nutrienti dall’esterno possa incidere sull’equilibrio di un sistema acquatico, incrementando la produttività algale e di conseguenza quella di tutte le varie specie concatenate.
Ma quando il fenomeno diventa troppo intenso si generano effetti indesiderati e squilibri che nella loro progressione possono essere così riassunti:
b) diminuzione del contenuto di ossigeno disciolto nelle acque principalmente per opera della flora batterica bentonica, con interessamento parziale delle zone profonde ed estensione progressiva all’intera colonna d’acqua;
c) scomparsa progressiva delle specie ittiche più pregiate come conseguenza del peggioramento della qualità delle acque (carenza di ossigeno, intorbidimento). Nel contempo si assiste all’incremento della popolazione ittica più resistente alle nuove condizioni;
d) formazione di zone anossiche negli strati più profondi con conseguente sviluppo di processi anaerobici e di sottoprodotti tossici del metabolismo batterico. A questo stadio corrisponde il peggior livello di qualità delle acque con scomparsa delle specie ittiche.
Illustriamo con precisione l’evoluzione del fenomeno degenerativo della acque e la manifestazione degli effetti sopra elencati.
Come già detto, la crescita algale, quando non è più controllata dalla riduzione dei sali nutritivi o da altri fattori, può dar luogo alla formazione di una biomassa sempre più consistente il cui destino è generalmente quello di prendere direttamente la via della degradazione. Questa via viene denominata “via del detrito”, in contrapposizione alla catena del pascolo.
La catena di detrito è mantenuta attiva da funghi microscopici e batteri e può procedere nella mineralizzazione della sostanza organica di cui è formata la biomassa senza creare particolari problemi, a condizione che in acqua sia presente una sufficiente quantità di ossigeno disciolto, necessario alla respirazione degli organismi citati, operanti in aereobiosi.
L’ossigeno presente in acqua, utile ai fini della respirazione, è quello disciolto. Secondo ben note leggi della fisica, come tutti i gas, l’ossigeno si discioglie in acqua fino a raggiungere una data concentrazione che rappresenta il livello di saturazione. Questo livello può variare in funzione di tre fattori che sono la temperatura, la pressione e la salinità. Secondo questa legge la quantità di ossigeno che si scioglie nelle acque fredde è maggiore che nelle calde; è inoltre maggiore in pianura che in montagna ed è più elevata nelle acque dolci che in quelle di mare. Quando non subentrano altri fattori, un liquido esposto
all’atmosfera tende a raggiungere il livello di concentrazione consentito dalla temperatura, dalla pressione e dalla salinità esistenti in quel momento. Si ha un passaggio di ossigeno dall’atmosfera all’acqua se l’acqua è sottosatura o, viceversa, se quest’ultima presenta un contenuto di ossigeno più elevato della concentrazione di saturazione.
Questo passaggio di gas o diffusione può in altre parole assumere segno positivo o negativo a seconda che vada dall’aria all’acqua o viceversa. Le variazioni di concentrazione di ossigeno in acqua che più interessano in relazione all’eutrofizzazione sono quelle che dipendono da influenze biologiche. La biomassa algale, infatti, produce ossigeno durante la fotosintesi, che avviene durante le ore di luce, e lo consuma con la respirazione, che ha luogo sia di giorno che di notte.
A parità di condizioni fisiche, in un ambiente acquatico la biomassa algale può dar luogo all’instaurarsi di condizioni di deficit o di supersaturazione di ossigeno, con il prevalere della respirazione sulla fotosintesi o viceversa. In entrambi i casi la diffusione agisce riportando le acque al valore di saturazione, favorita in ciò dalla turbolenza. Se quest’ultima è elevata, come avviene in acque correnti, allora la diffusione è rapida. Se invece è modesta o praticamente nulla, come nelle acque profonde dei laghi in periodo di stratificazione termica, allora l’ossigeno presente in acqua stenta a rimettersi in equilibrio con quello dell’atmosfera e a riportarsi al livello di saturazione.
I problemi si possono manifestare nel caso in cui si instaurino processi di demolizione della biomassa che si realizzano con un consumo eccessivo di ossigeno. Questo consumo può avere luogo con velocità diversa a seconda di vari fattori e, in primo luogo, della quantità di biomassa presente e della temperatura dell'ambiente. Se questa velocità è superiore a quella con cui l’ossigeno viene rigenerato per diffusione o per fotosintesi, allora il deficit si accumula e, quando tutto l’ossigeno normalmente presente nelle acque è scomparso, si instaura una condizione anaerobica o anossica.
Condizioni anossiche, precedute da periodi più o meno lunghi di bassa concentrazione di ossigeno (ipossia), sono tipiche delle acque profonde dei laghi eutrofici, nelle quali il massimo deficit si raggiunge al termine del periodo estivo. Condizioni analoghe possono instaurarsi in mare e anche nelle acque correnti, anche se con frequenza minore.
Quando si raggiunge la condizione di anossia, agli organismi aerobi subentrano gli organismi degradatori anaerobi. Questi compiono il processo di demolizione della biomassa liberando composti che, nella loro gran parte, sono tossici. In altre parole, mentre i microrganismi della catena del detrito operanti in presenza di ossigeno danno luogo alla formazione di composti minerali di norma non tossici quali i nitrati, i solfati, i fosfati, quelli anaerobi producono composti dotati di caratteristiche tossiche nei riguardi degli animali acquatici e, per altri versi, dannosi anche per l’uomo.
Tra questi composti si possono ricordare i più comuni che sono l’ammoniaca e l’idrogeno solforato, nonché diversi composti organici derivanti dalla fermentazione e dai processi di putrefazione delle sostanze proteiche.
Un ultimo importante meccanismo innescato dalla mancanza di ossigeno e per molti aspetti negativo è anche quello che porta alla risolubilizzazione e alla rimessa in circolazione del fosforo presente nella biomassa morta o sedimentata, denominata “bentos”.
In base agli elementi esposti appare chiaro che le conseguenze dell’eutrofizzazione potranno essere risentite a livelli diversi di gravità nei vari ambienti quali le acque correnti, i laghi e il mare, e saranno massime dove la circolazione verticale, che favorisce il rimescolamento degli strati profondi ed il ricambio dell’acqua, è limitata, come avviene in zone confinate di mare e, tipicamente, nei laghi naturali e in quelli artificiali denominati serbatoi. Sono questi gli ambienti in cui l’aumento della produzione di macrofite litorali può assumere aspetti invasivi e in cui le alghe planctoniche possono svilupparsi e formare dense biomasse che, nei casi estremi, ricoprono come una coltre la superficie dell’acqua. Questa coltre può diminuire la trasparenza fino a pochi decimetri impedendo così la penetrazione della luce solare e la produzione fotosintetica dell’ossigeno. Logica conseguenza di questi processi è l’instaurarsi di condizioni anaerobiche con gli effetti negativi già descritti.
Particolare attenzione verrà in seguito rivolta ai laghi polimittici, nei quali il fenomeno dell’eutrofizzazione risulta particolarmente difficile da combattere. Essi, a differenza dei laghi dimittici, generalmente non stratificano nei periodi estivi; se ciò comporta da un lato una migliore diffusione dell’ossigeno, dall’altro lato consente al fosforo, rilasciato attraverso il processo di mineralizzazione al
fondo, di raggiungere la superficie ed alimentare ulteriormente la crescita fitoplantonica. Inoltre la temperatura relativamente alta dei sedimenti in estate incrementa l’attività bentonica e contribuisce ad un ulteriore aumento delle quantità di fosforo rilasciate.
Il riferimento all’esistenza durante taluni periodi dell’anno, in genere coincidenti con i mesi estivi e invernali, di condizioni particolarmente critiche per gli ambienti lentici ed il mare richiede ancora alcune precisazioni preliminari che riguardano i movimenti verticali delle acque. Il fattore principale che condiziona questi movimenti in acque dolci è la temperatura mentre in mare, specie nelle zone che ricevono consistenti apporti di acque dolci da terra, anche la salinità svolge un ruolo di rilievo. A diverse temperature o salinità l’acqua assume una diversa densità e tende a stratificare: quella più leggera, perché più calda o meno salata, si dispone in superficie e quella più fredda o più salata, e quindi più pesante, negli strati sottostanti.
La stratificazione non è una condizione stabile nel tempo ma dipende dalle variazioni termiche e da altre caratteristiche del clima locale, come ad esempio il regime dei venti. In periodi caldi le acque si riscaldano e l’ambiente si stratifica in una lamina superficiale, detta epilimnio, che si sovrappone alla massa di acqua fredda sottostante, detta ipolimnio. Tra le due si inserisce una zona intermedia di transizione detta metalimnio, caratterizzata da un ripido gradiente di temperatura o termoclinio. In periodo autunnale, con il raffreddamento della acque superficiali, il divario di temperatura e quindi di densità tra gli strati si riduce, il mescolamento delle acque diventa possibile e l’intera massa assume o tende ad assumere la stessa temperatura, condizione questa detta di isotermia. Appare con ciò evidente che, durante il periodo di mescolamento, le possibilità di scambio di gas con l’atmosfera sono massime, mentre in periodo di stratificazione queste possibilità sono praticamente precluse. [2]
Fig. 1.7 Profilo di temperatura nei laghi nelle diverse stagioni
La descrizione dei movimenti verticali delle acque dovrebbe bastare per una migliore comprensione dei processi che verranno esaminati nel seguito e delle conseguenze negative che un fattore eutrofico può avere sui diversi ambienti. Tali conseguenze possono essere però risentite dai vari ambienti con modalità, intensità e durata molto diverse, schematizzabili come segue:
a) un corpo idrico ad elevato volume d’acqua potrà rispondere meglio all’apporto di sali nutritivi che non un corpo idrico di modesto volume, essendo da un lato maggiore la capacità diluente e, dall’altro, più elevata la riserva di ossigeno;
b) analogo comportamento potrà presentare un ambiente a veloce ricambio di acqua, prevalendo in esso l’esportazione sulla produzione di materiale organico;
c) più fragile può considerarsi un lago di bassa profondità nei confronti di uno profondo, essendo nel primo caso facilitati i processi di riciclo dei nutrienti e minore la riserva di ossigeno;
d) avvantaggiato infine potrà ritenersi quel corpo idrico in cui la rimozione dei sedimenti sia facilitata dall’esistenza di un trasporto di fondo.
Tutto ciò sta ad indicare che la possibile combinazione di più fattori (climatici, morfologici, fisici, chimici, biologici) produce una serie di condizioni che vanno da quella meno favorevole all’instaurarsi di un fatto eutrofico (acque a forte corrente) a quella più critica, rappresentata dai piccoli laghi piatti, a debole ricambio e situati in zone calde e poco ventose.
1.3 Il Controllo dell’Eutrofizzazione
La velocità con cui, in assenza di limitazioni di altro tipo come la temperatura, la biomassa algale si accresce è essenzialmente dipendente dalla concentrazione dei sali nutritivi, e cioè, più sali sono presenti in diluizione e più biomassa si forma. Oltre una certa concentrazione di sali nutritivi la crescita algale si arresta, raggiungendo un valore limite determinato anche dalla mancanza di luce, la cui intensità va riducendosi con l’aumento della torbidità che la crescita delle alghe stesse causa. Il motivo più ricorrente del rallentamento della crescita algale nelle acque dei laghi e del mare è però quello della mancanza di qualche componente essenziale per la costituzione della biomassa algale. In acqua il ruolo di elemento limitante è generalmente svolto dal fosforo o dall’azoto.
Alla prima legge dei “fattori limitanti”, tra i quali si collocano anche temperatura e luce, si affianca una seconda legge, detta “dell’optimum ecologico”. Ogni organismo vivente presenta infatti dei limiti per diversi fattori ambientali entro i quali si collocano le condizioni ottimali per lo svolgimento delle attività vitali. Ritornando allo specifico problema dei nutrienti come “fattori limitanti”, è già stato più volte ricordato che gli elementi di maggiore interesse, dal punto di vista della produttività algale in ambiente acquatico, sono di fatto rappresentati dall’azoto e dal fosforo. Nella costituzione della biomassa algale questi elementi sono tra loro in un rapporto P:N che varia da 1:7 a 1:16, a seconda
della composizione della comunità fitoplanctonica. Se si considera anche il carbonio, il rapporto P:N:C assume i seguenti valori 1:16:106, indicativi mediamente dell’intera comunità fitoplanctonica costituita da diverse specie. Oltre ai nutrienti azoto e fosforo, anche altri elementi esercitano in determinate circostanze un ruolo di fattore limitante. E’ questo il caso di una serie di metalli richiesti in minima quantità, detti microelementi, quali:
a) il ferro, che entra nella costituzione di enzimi, citocromi, la cui carenza provoca, come primo sintomo, un ritardo nella crescita dovuto soprattutto a una riduzione del contenuto di clorofilla;
b) il manganese, che assicura crescita più rapida a specie algali di acqua dolce e marina provocando, in caso di assenza, una maggiore sensibilità della clorofilla alla fotodecomposizione da parte della radiazione solare; c) il potassio, indispensabile per la crescita;
d) il molibdeno, richiesto dalle alghe per il metabolismo dell’azoto; e) il vanadio, indispensabile per la crescita;
f) il cobalto, costituente della vitamina B12;
g) lo zinco, che entra nella fase di fissazione dell’anidride carbonica nel processo fotosintetico;
h) il rame, presente nella molecola di taluni enzimi; i) il boro.
E’ opportuno ricordare che tali elementi metallici assumono di norma un ruolo del tutto secondario come fattori limitanti, rivestendo una certa importanza solo in ambiente fortemente oligotrofico.
Particolare interesse per lo sviluppo della biomassa algale presenta il gruppo dei micronutrienti organici, tra i quali assumono la maggiore importanza la vitamina B12, la tiamina, la biotina, i fito-ormoni. Tuttavia, se è indubbio che le
vitamine possono intervenire come stimolanti la crescita di molte specie algali, il loro effetto tuttavia si può esplicare essenzialmente nel determinare le successioni specifiche dei popolamenti , ma la produzione di biomassa dipende comunque e fondamentalmente dalla disponibilità di sostanze nutrienti.
Da quanto esposto emerge che i fattori che hanno un reale effetto di regolamentazione dell’insorgenza e nello sviluppo di episodi di eutrofizzazione sono da identificare nell’azoto e nel fosforo.
In definitiva, l’eutrofizzazione viene controllata in via preventiva rimuovendo i nutrienti dalle acque di rifiuto addotte nel bacino idrico.
In relazione al criterio del fattore limitante, è sufficiente rimuovere un singolo nutiente.
Tra azoto e fosforo appare decisamente più utile intervenire sul secondo, per i seguenti motivi:
- il carico del fosforo associato alle acque di rifiuto è una quota rilevante del carico di fosforo totale addotto al bacino idrico. Viceversa la percentuale di azoto associata agli scarichi non raggiunge di regola il 50%. Ne consegue che un intervento sugli scarichi per limitare l’apporto di nutrienti è assai più efficace se indirizzato al fosforo.
- Il fosforo, salvo eccezioni, è il vero fattore limitante per la crescita algale nel corpo idrico.
1.4 Il Bilancio dei Carichi di Fosforo
Al carico totale di fosforo alle acque lacustri contribuiscono:
1) Carichi localizzati
- Liquami domestici
I liquami grezzi contribuivano in passato al carico di fosforo nella misura di circa 1.28 Kg / ab. anno. A seguito dei provvedimenti legislativi che dal ’92 limitano la presenza di P nei detersivi ad un massimo dell’1%, si valuta che questo carico sia attualmente attestato sul valore di 0.657 Kg / ab. anno. Nei classici impianti di depurazione meccanico - biologici per il trattamento dei reflui civili si realizzano le seguenti rese di rimozione del fosforo:
- dopo sedimentazione primaria 5-7% circa - dopo trattamenti meccanici e biologici 16-22% circa Nei liquami domestici grezzi il fosforo totale è costituito da fosforo organico, ortofosfati e polifosfati. Nel corso dei processi biologici di depurazione, per effetto dei processi biodegradativi e di idrolisi, si ha una trasformazione quasi completa delle forme indicate in ortofosfati.
Solo completando i classici processi di depurazione meccanici – biologici con processi specifici di rimozione del fosforo si conseguono rese superiori (fino a concentrazioni residue di 0.1-0.5 mg/l).
- Liquami zootecnici
I carichi di fosforo associati ai liquami domestici sono così stimabili:
- allevamento equini 11.8 Kg P/capo anno - allevamento bovini 9.1 Kg P/capo anno - allevamento suini 5.6 Kg P/capo anno - allevamento ovini 1.5 Kg P/capo anno - allevamento polli 0.06 Kg P/capo anno La stima del carico di fosforo effettivamente destinato al corpo idrico dipende poi dal quantitativo di deiezioni riutilizzato in agricoltura e dall’efficienza dei sistemi di depurazione dei reflui. In ogni caso la legislazione italiana impone il rispetto del limite di 0.5 mg/l sullo scarico recapitato direttamente o indirettamente nel lago.
- Liquami industriali
L’apporto di P da parte degli scarichi industriali va valutato caso per caso, data l’ampia casistica che può presentarsi. Il più delle volte si ha a che fare con concentrazioni limitate (in rapporto ai liquami domestici), salvo particolari esempi, quali gli scarichi di molte industrie agro-alimentari, gli scarichi di distilleria, alcuni scarichi del trattamento superficiale dei metalli. Per lo scarico nel lago anche per questi va rispettato il citato limite di legge di 0.5 mg/l.
2) Carichi diffusi - Pioggia
Ha un ruolo generalmente scarso. La presenza di fosforo è connessa al dilavamento atmosferico del pulviscolo naturale e gas di origine industriale.
- Residui organici naturali
Hanno un ruolo generalmente scarso e difficilmente quantificabile. Si tratta di vegetali in decadimento e di deiezioni della fauna selvatica.
- Drenaggio di suolo non coltivato
Il fosforo è contenuto nei terreni naturali come P-organico e come apatite. Le cessioni alle acque di pioggia sono minime.
Si stimano le seguenti concentrazioni:
- Aree boschive 0.047-0.117 Kg/ha anno - Aree miste 0.059-0.370 Kg/ha anno In media in Italia si ha il valore di 0.1 Kg/ha anno.
- Drenaggio di suolo coltivato
Si stima un rapporto di P del 1.5% rispetto a quello applicato al suolo per fertilizzazione. In media in Italia vengono applicati 20.05 Kg P/ha anno. Risulta pertanto un carico medio di 0.4 Kg/ha anno.
- Drenaggio di aree urbanizzate
Anche questo carico è di scarso peso. E’ determinato dal trasporto del fosforo depositato sul suolo urbano. Si tratta essenzialmente di P-organico dovuto a residui organici vegetali ed animali, e fosforo contenuto in additivi utilizzati in alcune benzine.
Il carico è stimato di 1-2 Kg P/ha anno
Sono di seguito indicate le linee di lavoro intraprese per limitare i carichi di fosforo:
a) Limitazione della presenza nei detersivi
Il problema della sostituzione dei tripolifosfati, usati nella formulazione commerciale dei detersivi per il loro potere sequestrante della durezza, ha portato l’attenzione verso i seguenti prodotti alternativi: zeoliti artificiali, citrato di sodio, NTA
Le zeoliti sono considerate sostituti solo parziali per la scarsa efficienza nei confronti della durezza magnesiaca.
Il citrato di sodio è interessante per le caratteristiche di completa biodegradabilità. Però ha una capacità chelante che decresce fortemente con l’aumento della temperatura di lavaggio.
L’NTA dimostra ottime capacità complessanti e chelanti a qualsiasi temperatura di lavaggio. Però il suo uso presenta dei rischi ambientali a causa della sua alta capacità di complessare i metalli pesanti, con conseguente possibilità di mobilizzare gli stessi dai sedimenti dei fondali. Questo aspetto associato a inconvenienti di carattere più tecnico (corrosione lavatrici, decolorazione dei tessuti tinti con lacche metalliche) ne limita fortemente la possibilità di impiego come sostituto dei TPF.
Il problema della limitazione del fosforo nei detersivi è imposto da molti Paesi anche a livello legislativo. In Italia già dal 1981 sono adottati provvedimenti limitativi, mentre in alcuni Paesi è fatto divieto assoluto di uso del fosforo nei detersivi.
b) Razionalizzazione delle tecniche agricole
Questa linea di intervento comprende in particolare l’uso dei fertilizzanti a lento rilascio, l’uso integrale delle deiezioni animali, programmazione corretta delle concimazioni.
c) Pratiche alternative in zootecnica
Consistono in pratiche avanzate degli allevamenti che impiegano quantitativi ridotti di acqua e quindi consentono di limitare fortemente la produzione di acque di rifiuto.
1.5 Le Tecniche di Risanamento
Il risanamento di un bacino idrico a debole ricambio si fonda innanzitutto sulle tecniche di prevenzione. Nei casi in cui il fenomeno dell’eutrofizzazione si sia già manifestato con una certa intensità, possono inoltre essere presi in considerazione numerosi interventi rivolti alle acque del bacino (che potremo definire interventi curativi) al fine di accelerare il recupero dell’equilibrio naturale.
Esaminiamo in maggior dettaglio le due possibilità:
1) Tecniche di prevenzione
Sono rappresentate principalmente da interventi tecnici, ma anche urbanistici e legislativi.
- Riduzione del suolo coltivato; cambio di tipologia di coltivazione; limitazione delle concimazioni.
- Intercettazione e trattamento delle prime acque di pioggia.
b) Tecniche di prevenzione applicate ai carichi localizzati
A chi studia il risanamento di un lago o di un bacino a debole ricambio si presenta sempre un problema di scelta tra due ipotesi alternative:
- Attuazione di processi di depurazione sugli scarichi dei singoli insediamenti. Il problema è affrontato con maggiore tempestività attraverso la graduale realizzazione degli impianti.
- Realizzazione di collettori circumlacuali in grado di raccogliere tutti gli scarichi e recapitarli in un depuratore centralizzato ubicato in prossimità dell’emissario.
Per conseguire i primi risultati con tale soluzione occorrono investimenti massicci e quindi la sua risposta al problema è più lenta.
Ha però il grande pregio di sottrarre integralmente non solo i carichi localizzati di fosforo ma l’intero carico inquinante associato agli scarichi, offrendo così una garanzia di tutela completa ambientale del sistema lacustre.
Questa soluzione è inoltre l’unica possibile quando il carico di fosforo è troppo elevato. Inoltre la centralizzazione della soluzione impiantistica consente maggiori benefici sui costi complessivi di esercizio e sull’affidabilità dei controlli.
In genere una valutazione tecnico - impiantistica porta a risultati di maggior convenienza per la soluzione con collettore circumlacuale nel caso di piccoli laghi e per la soluzione multi impianto nel caso dei laghi di rilevante estensione.
Le due soluzioni possono però essere concepite in subordine, per una soluzione intermedia di miglior convenienza:
- Soluzione mista, composta di tratti di collettore circumlacuale e da impianti di depurazione isolati recapitanti nel lago.
2) Tecniche di cura
Si è già osservato che i laghi, una volta entrati nello stato eutrofico, richiedono tempi lunghi per ripristinare l’equilibrio iniziale, anche dopo aver effettuato tutte le idonee tecniche di prevenzione, questo a causa del tempo di naturale ricambio delle acque e del rilascio del fosforo da parte dei sedimenti.
Quest’ultimo fenomeno merita particolare attenzione specie per i laghi in avanzato stato di eutrofizzazione. In questi laghi, a causa del forte arricchimento della catena alimentare, si determinano consistenti depositi bentonici che, soprattutto nelle stagioni calde, rilasciano consistenti carichi di azoto e fosforo. Questi carichi interni, nei periodi di circolazione idrica, vanno ad alimentare il fitoplancton che si moltiplica per poi restituire la propria biomassa al bentos una volta esaurito il proprio ciclo vitale.
Si ha dunque una sorta di vizio interno, un ciclo che tende a perpetuarsi allontanando a dismisura i tempi naturali di recupero.
Nei casi in cui si voglia accelerare il tempo di recupero, possono essere attuate diverse tecniche curative che qui illustriamo brevemente.
- Sifonamento ipolimnico
Consiste nel drenaggio delle acque ipolimniche, in quanto più ricche essendo a diretto contatto con la fonte di rilascio.
Nel periodo di maggior rilascio (estate) la concentrazione di fosforo nelle acque ipolimniche può raggiungere valori di 700-1000 microgr/mc contro concentrazioni medie dell’intera colonna d’acqua di 380 microgr/mc.
Il drenaggio viene attuato con condotte ubicate lungo i fondali e dotate di terminali forati e mobili.
L’acqua drenata viene recapitata direttamente nell’emissario tramite un sifone che, una volta attivato, si autoalimenta a causa della differenza di livello esistente tra la superficie lacustre ed il pelo libero dell’emissario.
A svantaggio del sifonamento si citano l’alto costo di investimento e la alterazione del bilancio idraulico del loco.
- Dragaggio dei sedimenti di fondo
Rappresenta l’intervento più energico in quanto va ad incidere sulla causa prima del fenomeno. Oltre tutto i sedimenti hanno concentrazioni di fosforo nettamente superiori alla massima concentrazione delle acque ipolimniche, e da ciò si comprende l’efficacia del metodo.
Il dragaggio richiede un intervento specializzato sia per l’impiego di zattere draganti, sia per la necessità di trasporto a riva dei sedimenti, della necessaria disidratazione e smaltimento.
E’ di norma sufficiente l’asportazione dei primi centimetri di sedimento.
La maggiore efficacia del dragaggio si ha nei mesi freddi e non è una tecnica necessariamente alternativa al sifonamento, ma può svolgere un’azione complementare.
A svantaggio del dragaggio si citano la complessità gestionale e il rischio di alterazione degli equilibri di vita nelle zone di fondo.
- Ossigenazione delle acque
Questa tecnica non agisce sulle cause dell’eutrofizzazione bensì sulle conseguenze, dunque non si configura come vera alternativa alle due precedenti tecniche.
L’ossigenazione delle acque dimostra tuttavia una certa efficacia per ripristinare la carenza del gas laddove l’eutrofizzazione ha portato conseguenze negative. Essa acquista dunque valore come tecnica complementare alle precedenti, da utilizzare a valle delle stesse per accelerare il ripristino delle condizioni di vita naturale.
Di norma l’ossigenazione viene attuata mediante insufflazione d’aria; esiste però anche qualche esempio di impiego di ossigeno puro.
Esistono diverse tecniche per trasferire l’ossigeno. Le più note si basano sull’insufflazione nel fondo del lago, distribuendo i punti di diffusione con uniformità.
Altre tecniche prevedono l’aspirazione di acqua dal fondo, la sua saturazione con ossigeno e la reimmissione delle acque ossigenate nell’ipolimnio.
A completamento di queste tecniche di cura, si citano anche alcune basate sul dosaggio di reagenti:
- Precipitazione del fosforo mediante addizione alle acque lacustri di precipitanti (sali di ferro o di allumino, oppure carbonato di calcio, che danno luogo alla precipitazione dei rispettivi ortofosfati di ferro, alluminio o calcio).
- Addizione alle acque lacustri di algicidi atti ad inibire la crescita algale, che spesso risultano però avere una componente tossica e quindi inutilizzabili. [2]
1.6 Criteri di Valutazione dello stato Trofico dei Laghi
A seconda dell’arricchimento in nutrienti, i laghi possono essere così classificati:
- lago ultraoligotrofico;
- lago oligotrofico, ovvero povero di nutrienti e quindi con basso livello di produttività algale;
- lago mesotrofico, ovvero con presenza equilibrata dei nutrienti (né ricco, né povero);
- lago distrofico, ovvero ricco di un nutriente e povero di un altro;
- lago eutrofico, ovvero ricco di nutrienti e quindi con alta produttività algale; - lago ipertrofico.
Da quanto esposto nei paragrafi precedenti, risulta che per lo studio dei vari problemi che l’eutrofizzazione delle acque solleva sono necessarie informazioni di diversa natura consistenti in dati chimici, fisici, biologici, economici, demografici.
Al fine di indirizzarsi nel senso della standardizzazione dei sistemi usati per il prelievo e per le analisi, l’OCSE ha definito da tempo i dati di base e le variabili limnologiche legate al manifestarsi del fenomeno eutofico.
Prendiamo in esame quei fattori che permettono di individuare lo stato trofico di un lago sulla base di opportune tabelle di riferimento.
1) Trasparenza
La trasparenza delle acque si misura con il disco di Secchi, che ha trovato larghissima applicazione in tutti gli studi sulle acque dolci e marine in quanto fornisce dati ad alto contenuto informativo ricavabili con una metodologia semplice e con uno strumento di costo trascurabile.
La conoscenza della profondità di penetrazione della luce costituisce un dato di grande utilità dal punto di vista diagnostico, per la definizione, cioè, del grado di trofia dell’ambiente nel momento della misura.
In base ai valori del disco di Secchi, è stata proposta una classificazione delle acque in termini assoluti, con raggruppamenti in varie categorie trofiche.
L’EPA in proposito ha assunto il seguente criterio: i laghi oligotrofi sono quelli che hanno una trasparenza superiore ai 3.7m; i laghi mesotrofi hanno una trasparenza che va da 3.7 a 2m; in quelli eutrofi si scende sotto i 2m.
L’OCSE, accanto ad un metodo analogo a quello dell’EPA basato su valori limite rigidi, ne ha proposto un altro di tipo probabilistico, in base al quale per esempio un ambiente con trasparenza media annua sui 2 metri ha il massimo di probabilità (50% circa) di trovarsi in condizioni eutrofiche, ma vi è un 30% di probabilità che esso sia da classificare come ipertrofico. Se la trasparenza sale a 5 metri si ha la massima probabilità che quell’ambiente sia in condizioni mesotrofiche.
Fig. 1.8 Distribuzione probabile delle classi di trofia in base alla trasparenza media annua.
2) Fosforo
Si parla di fosforo totale in base alla totalità del fosforo presente in acqua, sia che questo si trovi come composto organico, sia che si presenti in forma minerale particellata, oppure disciolta. Questa ultima frazione è costituita da varie forme chimiche, quali i polifosfati dei detersivi, gli ortofosfati naturali, le forme organiche solubili.
L’OCSE ha dato indicazioni, come per la trasparenza, sia rigide che basate su determinati margini di probabilità. Nel primo caso l’OCSE fa corrispondere a concentrazioni di fosforo totale inferiori a 4 mg/mc ambienti in condizioni ultraoligotrofe e a concentrazioni inferiori a 10 ambienti in condizioni oligotrofe. Tra 10 e 35 si colloca l’ambito della mesotrofia e tra 35 e 100 quello dell’eutrofia. Per valori oltre i 100 mg/mc si hanno condizioni di ipereutrofia. In chiave probabilistica l’OCSE riporta invece un grafico, illustrato in figura 1.9, analogo a quello descritto per la trasparenza.
Fig. 1.9 Distribuzione probabile delle classi di trofia in base alla concentrazione media annua del fosforo totale.
3) Clorofilla
La concentrazione della clorofilla costituisce uno dei principali indici per la valutazione della biomassa algale.
Con gli stessi criteri adottati per la trasparenza e per il fosforo, l’OCSE utilizza il valore della clorofilla per classificare gli ambienti studiati, dando da un lato valori numerici rigidi e dall’altro limiti probabilistici.
Sulla base dei criteri rigidi, l’OCSE ritiene di poter definire ultraoligotrofo un ambiente quando la concentrazione media della clorofilla misurata in un anno sia inferiore a 1 mg/mc, oligotrofo se inferiore 2.5. Tra 2.5 e 8 mg/mc le acque entrano nella categoria delle mesotrofe; tra 8 e 25 delle eutrofe e, oltre 25 mg/mc delle ipereutrofe.
Passando alla classificazione su base probabilistica, l’OCSE riporta un grafico per la clorofilla media annua (fig. 1.10) e uno per la clorofilla massima registrata nel ciclo di un anno, in base ai quali è possibile valutare la probabilità che ad
una data concentrazione corrisponda un ambiente di categoria trofica determinata. [1]
Fig. 1.10 Distribuzione probabile delle classi di trofia in base alla concentrazione media annua di clorofilla.
CARICHI CRITICI DI FOSFORO –MODELLO DI VOLLENWEIDER
E’ interessante la possibilità di valutare se il carico di fosforo che giunge ad un lago o che potrebbe giungervi dal bacino in seguito allo sviluppo di determinati programmi è accettabile o meno, dal punto di vista della possibilità di comparsa di eventi eutrofici. Questo tipo di elaborazione presenta un rilevante interesse soprattutto nel momento della programmazione delle azioni di risanamento, poiché, consentendo di stimare il carico pericoloso, permette di dimensionare correttamente gli interventi necessari per ridurre il medesimo fino al livello accettabile.
Questa valutazione è stata condotta con modalità diverse nel tempo e con successivi affinamenti a partire dagli anni 1975-76. In quegli anni il limnologo canadese R. Vollenweider propose una formulazione semplificata per valutare, sulla base della profondità media e del tempo di ricambio, quale fosse il carico
corrispondente alle tre situazioni trofiche tipiche: oligotrofia, mesotrofia ed eutrofia. Di seguito sono illustrate le equazioni che stanno alla base della formulazione.
Il bilancio del fosforo relativo ad un lago può essere così descritto:
dove:
Acc = accumulo interno = (dP/dt)*V
C1 = carico alimentato (carico localizzato + carico di base) = Σ(qiPi)
C2 = carico uscente con gli emissari = ΣqeP = QeP
C3 = carico rimosso per sedimentazione (e sintesi biologiche)
P = concentrazione media di fosforo nel lago
dove:
qi = portate immissari
Pi = concentrazione di P nei singoli immissari
qe = portata emissari
Qe = Σqe
V = volume di invaso.
Rapportando tutti i termini alla superficie S d’invaso otteniamo:
dove:
L = è il carico specifico di fosforo in alimentazione (g*P / m^2 anno) Z = altezza media delle acque del lago = V/S (m)
In regime stazionario, ovvero raggiunta la concentrazione P di equilibrio caratterizzante lo stato trofico del lago, si ha dP/dt = 0 e quindi l’equazione di bilancio diventa:
poiché S = V/Z si ha:
con Tw = tempo di ricambio delle acque (anni) = V/Qe
L’esperienza limnologia suggerisce un limite inferiore della concentrazione P di fosforo per realizzare condizioni eutrofiche (condizione di incipiente eutrofizzazione) pari a 10 mg/m^3, ed un limite superiore doppio pari a 20 mg/m^3; per cui:
con:
Lc = carico critico (mg/m^2*anno)
Risultati sperimentali dimostrano una correlazione tra σp ed il tempo di ricambio
Tw, del tipo:
con qs = carico idraulico superficiale (m^3/m^2 anno) = Z/Tw.
Pertanto il carico critico risulta così espresso:
Le due equazioni, corrispondenti alle due concentrazioni di P di 10 mg/m^3 e 20 mg/m^3, correlano pertanto il carico critico Lc (o meglio il range di carico
Nel range di qs di interesse pratico le due curve (rappresentate in figura 1.11)
risultano pressoché rettilinee e delimitano la zona caratterizzata da stato eutrofico (a nord) dalla zona caratterizzata da stato oligotrofico (a sud).
L’importanza della conoscenza delle curve dei carichi critici di Vollenweider è facilmente comprensibile. In pratica, note le caratteristiche del lago (Z e Tw) ed i
carichi di P alimentati, consente di stimare in via preventiva gli effetti di eventuali interventi volti alla rimozione di P dagli scarichi. [2]
Fig 1.11 Curve di Vollenweider per la determinazione dei carichi critici Lcin funzione del carico idraulico specifico qs (diagramma bilogaritmico).
Però il modello non consente di calcolare con quale ritardo si raggiungono le nuove condizioni di equilibrio all’interno del lago; esso dipende, oltre che dal tempo di ricambio delle acque, dall’accumulo di fosforo nei sedimenti, ma tale fattore, di difficile determinazione, non è contemplato.
1.7 L’eutrofizzazione nei laghi poco profondi
1.7.1 La luce sotto la superficie
La torbidità dell’acqua è un argomento cruciale nei riguardi dell’evoluzione delle caratteristiche dell’ambiente acquatico nei laghi poco profondi. La perdita di limpidezza causata dalla crescita algale e dalle particelle in sospensione compromette sia l’aspetto estetico del lago che i suoi meccanismi biologici. Due sono i fenomeni che interessano un fotone sott’acqua: l’assorbimento e la dispersione. Anche se l’acqua stessa contribuisce all’assorbimento e alla dispersione della luce, le caratteristiche estetiche di un lago torbido dipendono in larga misura dalle particelle in sospensione e dalle sostanze disciolte. Tutto il materiale colorato è responsabile dell’assorbimento. In molti laghi caratterizzati dalla presenza di sedimenti torbosi, la materia organica disciolta può rivestire un ruolo importante, colorando le acque di marrone, ma generalmente nei laghi poco profondi la luce è prevalentemente assorbita dalla materia particolata, come le cellule fitoplantoniche, i detriti e i solidi sospesi. La dispersione della luce dipende invece principalmente dal colore della luce stessa. In generale si può affermare che i solidi sospesi inorganici sono i principali responsabili del fenomeno della dispersione; la materia organica disciolta influenza esclusivamente l’assorbimento, mentre il fitoplancton è responsabile di entrambi i fenomeni. Nella pratica i limnologi sono però maggiormente interessati alle caratteristiche visive dei laghi, come l’attenuazione della luce e la trasparenza. Così in letteratura è stato grande l’impegno nel trovare una relazione matematica tra caratteristiche reali (diffusione e assorbimento) e apparenti (trasparenza) della luce sott’acqua. Malgrado la loro semplicità, le equazioni empiriche trovate possono fornire un’indicazione a riguardo del contributo offerto alla torbidità in un lago specifico da alghe, detriti e solidi sospesi inorganici. Dall’applicazione di tale formulazione a laghi reali emerge che i solidi sospesi influenzano maggiormente la profondità misurata con il disco Secchi rispetto al grado di attenuazione della luce; i sedimenti risospesi influenzano maggiormente la trasparenza mentre la biomassa algale è la responsabile maggiore dell’attenuazione della luce sott’acqua. Concludendo gli aspetti maggiormente evidenti della torbidità sono causati da solidi sospesi e risospensione dei sedimenti; ma gli effetti che la torbidità induce sui
meccanismi dell’ecosistema acquatico sono per la maggior parte riconducibili alla biomassa algale presente.
Sedimentazione e risospensione del materiale sedimentato
In molti laghi poco profondi i sedimenti organici particolati e le cellule algali attraversano costantemente un rapido ciclo di sedimentazione e risospensione. Spesso la risospensione è originata dall’azione delle onde, ma anche i pesci in cerca di cibo sul fondo possono risollevare considerevoli quantità di sedimenti. Come illustrato al precedente paragrafo, la biomassa algale e i solidi sospesi sono la principale causa di torbidità nei laghi. Nei laghi profondi la materia particolata, una volta raggiunto l’ipolimnio, attraverso il passaggio nel metalimnio, non può ritornare nello strato superficiale caratterizzato da elevata turbolenza. Nei laghi poco profondi la stratificazione può avvenire nei giorni di sole; comunque durante la notte le microstratificazioni vengono rotte e non si verifica mai una stratificazione stabile. Di conseguenza nei laghi shallow non c’è un termoclinio che rappresenti un punto di non ritorno per le particelle sedimentate. Comunque il moto acquatico si riduce fortemente nel piccolo strato al confine con la superficie dei sedimenti. Come risultato il fondo del lago può comunque intrappolare le particelle sedimentate, in misura più o meno grande rispetto al termoclinio. La differenza sta nel fatto che le particelle possono comunque ritornare nella colonna d’acqua quando il movimento dell’acqua, all’interfaccia con la superficie del materiale sedimentato, è sufficientemente forte. Nei laghi poco profondi la concentrazione di particelle in sospensione nella colonna d’acqua dipende quindi in gran misura dai continui processi di sedimentazione e risospensione sopra descritti. Ovviamente altri fattori possono causare la comparsa o la scomparsa dei solidi sospesi dall’ambiente lacustre: per esempio le celle algali nella colonna d’acqua, derivanti dalla divisione cellulare, e molte particelle risospese dagli invertebrati attraverso il loro meccanismo di alimentazione e filtrazione branchiale. La perdita di particelle dalla colonna d’acqua dovuta alla sedimentazione è uguale al rapporto tra la velocità di caduta s (m/day) e la profondità D (m). La variazione della concentrazione dei solidi sospesi può essere scritta come una funzione di tale perdita e dell’indice di ritorno attraverso la risospensione Г:
dS/dt = Г/D – s/D*S (1)
Come risultato della proporzionalità inversa con la profondità, le componenti di questo processo possono diventare molto elevate nelle acque poco profonde. La concentrazione di equilibrio dei solidi sospesi nella colonna d’acqua è raggiunta quando la sedimentazione eguaglia la risospensione. Dall’equazione precedente:
S’ = Г/s
La predisposizione alla risospensione dei sedimenti nei laghi poco profondi dipende dal tipo di sedimenti e dalla forma e dalla profondità del lago. In particolare le caratteristiche fisiche del lago che maggiormente influenzano il fenomeno sono la grandezza e, soprattutto, la profondità. Un abbassamento del livello dell’acqua può infatti causare un incremento considerevole della risospensione dei sedimenti e conseguentemente della torbidità del lago. Anche se, oltre al vento, il fenomeno di sedimentazione e risospensione è fortemente legato alle caratteristiche fisiche del lago e dei sedimenti, per un preciso lago può comunque essere ricavata una relazione semplificata tra solidi sospesi e velocità del vento. Indicando con W la velocità del vento, con s una precisa concentrazione di solidi sospesi presente nella colonna d’acqua anche in assenza del vento, la concentrazione di equilibrio risulta:
S’ = Sb + a(W)^b
Nei laghi poco profondi gran parte della comunità ittica si alimenta solitamente di invertebrati presenti nello strato superficiale dei sedimenti, come le larve di moscerino, i molluschi e i vermi. L’Abramis brama è un noto bentivoro tipico dei laghi europei; esso si alimenta con i sedimenti, dai quali le particelle dei nutrienti sono opportunamente filtrate e trattenute attraverso il sistema branchiale. Come risultato le particelle fini dei sedimenti che non vengono assimilate dal pesce tornano in sospensione nell’acqua; piccole buche di 2-4 cm di profondità sono lasciate sulla superficie da ogni operazione di approvvigionamento. L’effetto esercitato sulla torbidità dalla continua
risospensione dei sedimenti esercitata dalla presenza del pesce in questione può essere molto rilevante. Teoricamente, se la quantità di materiale che giornalmente viene risospesa è supposta proporzionale alla biomassa del pesce bentivoro B, l’equazione 1 diventa:
dS/dt = qB/D – s/D*(S-So)
e la concentrazione di equilibrio nella colonna d’acqua incrementerà con la bioamassa stessa:
S’ = So + q/s*B
dove q è la quantità di sedimenti per unità di biomassa ittica per giorno.
Gli effetti della vegetazione sulla risospensione sono investigati da lungo tempo, e i risultati mostrano che la torbidità è generalmente più elevata in inverno, quando le onde generate dal vento possono sollevare con maggiore facilità i sedimenti privi di protezione. In estate, al contrario, la vegetazione ricopre il fondo dei laghi e il vento ha effetti minori o nulli sulla torbidità, Gli effetti della vegetazione sono stati realmente dimostrati dal fatto che la risospensione è diventata la maggiore conseguenza della torbidità in diversi laghi poco profondi, che avevano invece acque limpide prima della perdita della vegetazione stessa. La riduzione della risospensione dei sedimenti azionata dal vento nei laghi poco profondi è attribuibile non solo ai letti di piante sommerse ma anche alle zone con una vegetazione emergente. Ovviamente gli effetti della vegetazione sommersa dipendono dalla densità e dalla struttura delle piante. Per esempio la Charophite può raggiungere una elevata biomassa e molte specie possono concentrare la loro biomassa vicino ai sedimenti, ricoprendoli con una sorta di tappeto verde. Tutto ciò riduce il movimento dell’acqua in prossimità della superficie dei sedimenti e ne impedisce inoltre l’accesso dei pesci bentivori. Così il processo di risospensione è in gran parte arrestato. La stagnazione del rimescolamento verticale è inoltre amplificata nei giorni di sole dai gradienti di temperatura, instaurando lo stesso meccanismo che si verifica nei laghi profondi grazie alla presenza del metalimnio.
La dinamica dei nutrienti
Nei laghi profondi la variazione stagionale della disponibilità dei nutrienti si differenzia molto dall’andamento tipico osservato nei laghi poco profondi. Infatti una parte della materia particolata dell’epilimnio sedimenta inevitabilmente attraverso il termoclinio verso il fondo e viene definitivamente persa. A causa di questo fenomeno, in estate l’epilmnio di un lago stratificato perde circa la metà del suo fosforo totale. I nutrienti, che ritornano nella colonna d’acqua attraverso la mineralizzazione della materia organica nell’ipolimnio, possono ritornare nello strato superficiale solo dopo il periodo autunnale, quando le acque del lago tornano ad essere completamente mescolate. Al contrario, le acque dei laghi shallow non presentano questa sistematica perdita di nutrienti durante l’estate. L’intenso e continuo contatto tra sedimenti e acqua assicura una rapida restituzione alla colonna d’acqua della maggior parte del materiale sedimentato. Inoltre la temperatura relativamente alta dei sedimenti in estate produce un incremento del coefficiente di mineralizzazione. Quindi la concentrazione dei nutrienti nei laghi poco profondi segue sostanzialmente un andamento opposto rispetto a quello osservato generalmente nei laghi stratificati. I limnologi hanno da sempre rivolto maggior attenzione al fosforo rispetto agli altri nutrienti; esso, in parte assorbito dai sedimenti, viene rilasciato nella colonna d’acqua quando si raggiunge uno stato eutrofico. Questo carico interno può causare un ritardo di vari anni nella risposta della concentrazione nell’acqua del lago in seguito ad una riduzione dei carichi esterni. Per l’azoto l’effetto di accumulo e rilascio è meno rilevante. Tuttavia è stato dimostrato che una cospicua parte di azoto può scomparire dai laghi shallow come risultato del processo di denitrificazione. Quindi, anche se con minor frequenza l’azoto è il fattore limitante, la sua dinamica è stata studiata accuratamente.
Per comprendere la dinamica del fosforo nei laghi poco profondi è fondamentale indagare l’interazione acqua – sedimenti in tutti i suoi aspetti. Nel caso in cui l’apporto dall’esterno venga ridotto, i sedimenti iniziano ad agire da sorgente del nutriente e non più da pozzo. Inoltre è interesse pratico predire per quanti anni il fenomeno descritto ritarda il recupero della qualità del lago. Poiché il fosforo rilasciato dai sedimenti deve essere trasportato fuori dal sistema acquatico dalle portate in uscita, appare chiaro che i laghi con un
tempo di ricambio minore si ristoreranno più velocemente. In realtà questo non sempre accade nella realtà. Infatti i laghi che hanno un tempo di ricambio minore sono caratterizzati da inflows più cospicue che hanno prodotto un accumulo maggiore di fosforo nei sedimenti nel periodo che ha preceduto la riduzione del carico esterno. Molte sono le relazioni empiriche trovate per correlare concentrazioni, carichi esterni e caratteristiche dei sedimenti, ma il fenomeno nel suo complesso non è ancora stato giustificato. Molti risultati dimostrano comunque che un ruolo importante nella velocità di rilascio di fosforo dai sedimenti è rivestito da turbolenza, presenza di animali e crescita di piante. Indaghiamo con accuratezza questi fenomeni.
A causa della respirazione batterica, c’è carenza di ossigeno al fondo di un lago, dove avviene la decomposizione della sostanza organica accumulata. Spesso nei laghi stratificati i sedimenti sono in regime anossico. Al contrario, nei laghi poco profondi, il continuo mescolamento delle acque garantisce quantità di ossigeno sufficiente a mantenere un regime aerobico alla superficie dei sedimenti. In condizioni aerobiche il ferro bivalente è ossidato nella forma trivalente e precipita con il fosforo. Conseguentemente a questo meccanismo di immobilizzazione del nutriente, la quantità che può essere rilasciata dai sedimenti nella colonna d’acqua si riduce notevolmente quando al fondo si hanno condizioni aerobiche. Oltre a questo fenomeno, anche turbolenza e decomposizione dei sedimenti rivestono un ruolo chiave nel ciclo interno del fosforo dei laghi shallow. La risospensione dei sedimenti e l’ossigenazione delle acque del lago sono legate alla turbolenza in prossimità della superficie dei sedimenti stessi; di conseguenza anche il rilascio del fosforo precipitato con il ferro in condizioni aerobiche è legato alla grandezza del corpo acquatico e alla sua profondità. La relazione completa tra turbolenza e rilascio del fosforo è complessa, ma di fatto la turbolenza esercita due effetti opposti: previene la manifestazione delle condizioni anossiche ossigenando la superficie dei sedimenti, ma promuove la diffusione del fosforo dal fondo verso la colonna d’acqua. Quando la turbolenza è elevata, il materiale sedimentato viene risospeso; se la concentrazione di fosforo nelle particelle in sospensione è maggiore di quella della colonna d’acqua, esse rilasciano il nutriente. Quindi i due opposti fenomeni possono bilanciarsi o l’uno prevalere sull’altro in relazione all’entità della turbolenza.
Per quanto concerne l’azoto, la sua dinamica differisce da quella del fosforo in tre aspetti: non si accumula nei sedimenti in quantità tanto cospicue; può scomparire verso l’atmosfera sotto la forma di gas; alcuni cianobatteri possono utilizzare direttamente come nutriente l’azoto atmosferico.
Il carbonio come fattore limitante ha ricevuto ben poca attenzione. Infatti il suo apporto può provenire anche dall’atmosfera oltre che dalla mineralizzazione della sostanza organica contenuta nei sedimenti. Tuttavia alcuni esperti hanno dimostrato che nei laghi poco profondi con vegetazione sommersa queste fonti di carbonio possono risultare insufficienti ad evitare le condizioni in cui è il carbonio il fattore limitante.
Diversi sono i meccanismi con i quali il fitoplancton contribuisce ad aumentare la concentrazione totale dei nutrienti nella colonna d’acqua. Come detto precedentemente, la capacità dei cianobatteri di fissare l’azoto atmosferico alimenta l’ingresso del componente nelle acque del lago. Ma gli effetti più rilevanti riguardano il rilascio del fosforo dai sedimenti. Nel periodo estivo, le alghe sedimentate vengono rapidamente mineralizzate attraverso l’attività batterica al fondo; inoltre l’intensa attività algale può stimolare anche il rilascio del fosforo fissato dal ferro: infatti l’attività fotosintetica innalza il PH e conseguentemente la capacità del ferro di trattenere il nutriente decresce. La cospicua presenza algale produce anche una diminuzione di ortofosfati nella colonna d’acqua; accresce quindi la possibilità che le particelle risospese dal fondo ricche di fosforo rilascino il nutriente nella colonna d’acqua. Da tutto ciò emerge che, contrariamente a quanto comunemente affermato, la concentrazione di TP nella colonna d’acqua è determinata dalla concentrazione algale e non viceversa.
La vegetazione acquatica influenza la dinamica dei nutrienti in un modo ancor più complesso rispetto al fitoplancton. Come le alghe, le macrofite producono detriti che, sottoposti alla mineralizzazione al fondo, rilasciano fosforo e favoriscono lo sviluppo delle condizioni anossiche. Invece, differentemente dalle alghe, le macrofite riducono la turbolenza, sfavorendo la possibilità di ossigenazione della superficie dei sedimenti, ma ostacolando la risospensione e la diffusione di fosforo nella colonna d’acqua. Inoltre le macrofite possono assimilare i nutrienti direttamente dai sedimenti e questo comporta un trasferimento di costituenti dai sedimenti alla colonna d’acqua.
La superficie dei sedimenti è spesso luogo di intensa attività batterica. Inoltre se la risospensione dei sedimenti non si verifica frequentemente, nei laghi poco profondi la radiazione solare può raggiungere la loro superficie, dove si sviluppano le alghe bentoniche. La componente batterica e algale risultante può formare una sottile crosta che riduce la probabilità di risospensione e forma una barriera alla diffusione tra sedimenti e colonna d’acqua. Inoltre le alghe bentoniche contribuiscono all’ossigenazione dello strato di fondo.
Il ruolo che gli animali esercitano nel ciclo dei nutrienti è stato a lungo indagato. Principalmente la maggior parte dei nutrienti contenuti nel cibo da essi assimilato ritorna nella colonna d’acqua attraverso l’escrezione e quindi contribuisce ad incrementarne la concentrazione. Un ruolo particolare è rivestito dal pesce bentivoro, che si alimenta di invertebrati che vivono nei sedimenti, favorendone la risospensione. Inoltre, attraverso l’escrezione, rifornisce la colonna d’acqua di nutrienti, originati dalla decomposizione del benthos ingerito. [3]
1.7.2 Fitoplancton
Molti fattori quali la profondità, la risospensione e l’approvvigionamento dei pesci interagiscono con gli effetti dei nutrienti nello sviluppo della biomassa algale. Come illustrato precedentemente, nei laghi poco profondi le particelle dello strato superficiale dei sedimenti attraversano un ciclo continuo di sedimentazione e risospensione. Nei laghi maggiormente esposti la risospensione esercitata dalle onde può presentarsi giornalmente, e, anche in assenza dell’azione del vento, l’attività dei pesci bentivori può alimentare il fenomeno intensamente. Dall’altro lato nei laghi shallow è elevato l’indice di perdita delle particelle in sospensione dalla colonna d’acqua. Infatti la perdita dovuta alla sedimentazione (k) è proporzionale alla velocità di caduta (s) e inversamente proporzionale alla profondità (D).
K = s/D
Una caratteristica che permette alle alghe di contrastare la perdita per sedimentazione è la capacità di riproduzione. Anche per le specie che non possono nuotare o galleggiare, la riproduzione può parzialmente bilanciare la
perdita per sedimentazione. Comunque, anche per le alghe più piccole, s non scende mai al di sotto di 0.25 m/day ed è necessaria una profondità di almeno 0.5 m per prevenire l’estinzione algale in acque completamente stagnanti. Ovviamente la sopravvivenza delle specie che non nuotano e che hanno elevati coefficienti di sedimentazione dipende molto dal grado di turbolenza nella colonna d’acqua del lago shallow. La frequenza di risospensione dipende soprattutto dalla profondità e dalla grandezza del lago. I laghi più grandi e maggiormente esposti possono garantire la sopravvivenza delle specie con coefficiente di sedimentazione maggiore. Tali specie sono molto favorite dai periodi ventosi. La variazione del vento influenza la dinamica stagionale della popolazione algale. La torbidità influenza la dinamica, non solo perché riporta in sospensione nella colonna d’acqua le alghe precedentemente sedimentate, ma anche indirettamente attraverso gli impatti che produce sulla radiazione solare ed i nutrienti.
Una perdita di biomassa algale è inoltre prodotta dal ricambio delle acque. Generalmente le perdite determinate da ricambio e sedimentazione si manifestano con maggiore intensità sulle specie che hanno una cinetica di respirazione più bassa, offrendo condizioni vantaggiose per le altre specie. In particolare in condizioni di veloce ricambio idrico si verifica frequentemente la predominanza dei cianobatteri sulle altre alghe. Occorre sottolineare che nei laghi poco profondi la risospensione dei sedimenti genera torbidità nelle acque e influenza la penetrazione della luce. Di conseguenza trovano maggior sviluppo le specie che sono meno sensibili all’ombreggiatura.
Competizione tra alghe e cianobatteri
La caratteristica principale che può designare la comunità fitoplantonica in laghi poco profondi è la concentrazione di clorofilla; ma altrettanto significativa risulta la percentuale di cianobatteri, che spesso dominano la comunità in laghi shallow in condizioni di ipereutrofia. E’ dimostrato che la predominanza dei cianobatteri può essere una condizione stabile della comunità algale in questo tipo di corpi acquatici. I cianobatteri, spesso anche chiamati alghe verdi - azzurre, differiscono in vari aspetti dal resto del fitoplancton. Sono alghe perché sono organismi fototrofi, ma sono procarioti e sotto vari aspetti più simili ai batteri che non alle alghe stesse. Molte specie possono formare grandi colonie