46 POLI(ε-CAPROLATTONE) A STELLA
Il poli(ε-caprolattone) a stella (*PCL), oggetto del presente studio sperimentale, è un polimero biodegradabile con struttura molecolare a stella costituita da tre catene polimeriche lineari legate a un atomo centrale di alluminio. Il polimero *PCL con peso molecolare 189000 g/mol è stato fornito dal prof. Ramani Narayan del Michigan Biotechnlogy Institute (Lansing, MI, USA).
Figura IV.1 – Struttura chimica del poli(ε-caprolattone) a stella.
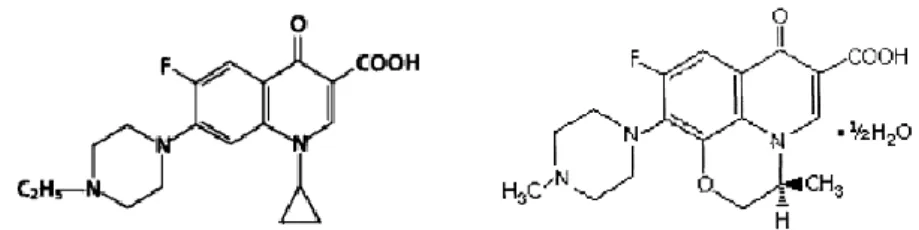
ENROFLOXACINA
L’Enrofloxacina (EF) (Figura IV.2) utilizzata per questo studio nella formulazione in polvere è stata fornita da Sigma-Aldrich. Il farmaco per la sua fotosensibilità è stato conservato e maneggiato al buio.
LEVOFLOXACINA
La Levofloxacina (LF) (Figura IV.2), ovvero l’isomero otticamente attivo della Ofloxacina ((-)-Ofloxacina), nella formulazione in polvere è stata fornita da Sigma-Aldrich. Come la Enrofloxacina si presenta fotosensibile per cui anch’essa è stato conservata e maneggiata al buio.
47 IDROSSIAPATITE
Per questo studio abbiamo impiegato nanoparticelle di Idrossiapatite (HA) (Sigma-Aldrich, diametro <200nm).
WET-SPINNING e ALLESTIMENTO DEGLI SCAFFOLDS
La tecnica di wet-spinning, o filatura ad umido, è una tecnica ad inversione di fase indotta impiegata per la produzione di fibre polimeriche.
Essa consiste nel passaggio forzato attraverso un ago sottile immerso in un bagno di coagulazione (costituito da un non-solvente) di una soluzione polimerica viscosa. Il contatto della soluzione col non-solvente determina la coagulazione del polimero a formare una fibra solida continua che può essere depositata sul fondo del recipiente contenente il bagno di coagulazione per formare strutture fibrose bi- o tri-dimensionali (Puppi et al., 2011).
Più dettagliatamente, una volta che il filamento della soluzione polimerica è estruso nel bagno di coagulazione, il non-solvente diffonde nella soluzione polimerica, mentre il solvente diffonde nel bagno di coagulazione. Questo interscambio diffusivo diminuisce la solubilità del polimero inducendo così una separazione di fase.
ALLESTIMENTO DEGLI SCAFFOLDS
Per l’allestimento degli scaffolds in bianco e caricati con antibiotici (EF e LF), sottoposti a studi di caratterizzazione fisico-chimica, analisi morfologica e biocompatibilità in vitro, è stata utilizzata una tecnica di wet-spinning che prevede il movimento manuale del recipiente contenente il bagno di coagulazione (Figura IV.3a). La siringa contenente la soluzione polimerica è stata montata su una pompa (NE-1000, New Era – Pump Systems Inc., Wantagh, NY, USA), e il suo ago immerso in un non-solvente contenuto in un beaker che è stato traslato in maniera continua e con direzione casuale durante la fase di produzione dello scaffold, in modo da ottenere la deposizione della fibra sul fondo e l’allestimento di una struttura tridimensionale fibrosa (Figura IV.3b).
48
Figura IV.3 – Apparato per la tecnica di Wet-spinning (a) e scaffold tridimensionale (b).
Gli scaffolds in bianco e caricati con HA, progettati con geometria e dimensioni anatomiche idonee a studi in vivo di rigenerazione ossea, sono stati allestiti mediante tecnica di wet-spinning automatizzata per mezzo di un sistema di Prototipazione Rapida che permette di ottenere strutture tridimensionali microfibrose con un principio strato-su-strato (Figura IV.4). Impiegando un sistema computerizzato sviluppato ad hoc, è stato possibile controllare il movimento sui tre assi (X, Y, Z) del beaker contenente il non solvente e dell’ago da cui esce la soluzione polimerica, in modo da ottenere scaffolds con controllo micrometrico sulla geometria esterna del campione e sull’allineamento delle fibre.
Figura IV.4 – Rappresentazione schematica della tecnica Wet spinning automatizzata (a sinistra) e immagini degli scaffolds in *PCL e *PCL-HA ottenuti.
a
49 Scaffold in *PCL mediante wet-spinning
Gli scaffolds in bianco sono stati allestiti tramite tecnica di wet-spinning. La soluzione polimerica di partenza al 15% w/v è stata ottenuta solubilizzando in agitazione 1.5g di *PCL in 10ml di acetone ad una temperatura di 40°C per 90min circa. Successivamente 2.5ml della soluzione polimerica sono stati caricati in una siringa da 5ml su cui è stato montato un ago con diametro interno di 0,51mm. La siringa è stata dunque montata su una pompa (NE-1000, New Era – Pump Systems Inc., Wantagh, NY, USA) con l’ago immerso in un beaker da 15ml contenente il bagno di coagulazione costituito da 14ml di etanolo.
Le condizioni ottimali per la preparazione sono risultate essere le seguenti: flusso di alimentazione della soluzione (2.25ml/h); distanza tra ago e fondo del beaker intorno ai 25mm circa.
Al termine del processo di filatura, lo scaffold prodotto è stato rimosso dal bagno di coagulazione e lasciato essiccare per 24h sotto cappa chimica e per 8h mediante pompa a vuoto.
Scaffold in *PCL ed Enrofloxacina mediante wet-spinning
Per la realizzazione degli scaffolds caricati con antibiotico, dopo che il *PCLè stato completamente solubilizzato (1,5g di *PCL in 10ml di acetone ad un
temperatura di 40° C, in agitazione per circa 90 min), è stata aggiunta l’Enrofloxacina in concentrazione pari allo 0.2 o 0.1% w/v (20 o 10 mg in 10ml di soluzione contenente *PCL e acetone) e lasciata solubilizzare per circa 1 ora. In seguito 2.5ml della soluzione di polimero e antibiotico sono stati caricati in una siringa da 5ml per essere poi estrusi nel bagno coagulante di etanolo come descritto per gli scaffolds in bianco.
Le condizioni ottimali di estrusione per la preparazione di uno scaffold caricato con l’antibiotico Enrofloxacina sono risultate essere le seguenti: flusso di alimentazione della soluzione 2.25 ml/h; distanza tra ago e fondo del beaker intorno ai 25 mm circa.
50 Al termine del processo di filatura, lo scaffold prodotto è stato rimosso dal bagno di coagulazione ed è stato lasciato a essiccare per le successive prove di caratterizzazione.
Scaffold in *PCL e Levofloxacina mediante wet-spinning
L’allestimento degli scaffolds caricati con l’antibiotico Levofloxacina ha visto l’impiego della medesima procedura sopradescritta per il caricamento con Enrofloxacina.
Alla soluzione polimerica con concentrazione pari al 15%w/v è stata aggiunta la Levofloxacina in concentrazione pari allo 0.2% o 0.1%w/v (20 o 10 mg in 10ml di soluzione contenente *PCL e acetone) e lasciata solubilizzare per circa 1 ora. In seguito 2.5ml della soluzione di polimero e antibiotico sono stati caricati in una siringa da 5ml per essere poi estrusi nel bagno di coaugulazione di etanolo.
Le condizioni ottimali di estrusione per la preparazione di uno scaffold caricato con l’antibiotico Levofloxacina sono risultate essere le seguenti: flusso di alimentazione della soluzione (2.25ml/h); distanza tra ago e fondo del beaker di circa 2.5 cm.
Al termine del processo di filatura, lo scaffold prodotto è stato rimosso dal bagno di coagulazione e lasciato essiccare per le successive prove di caratterizzazione.
Scaffold in *PCL e Idrossiapatite mediante wet-spinning automatizzato Le nanoparticelle di HA sono state aggiunte alla soluzione di *PCL, ottenuta con la procedura descritta precedentemente, con un rapporto in peso del 20% (HA/*PCL). La soluzione è stata mantenuta in agitazione costante a 35°C per circa un’ora, in modo da ottenere una sospensione omogenea delle nanoparticelle.
51 CARATTERIZZAZIONE FISICO-CHIMICA DEGLI SCAFFOLDS
ANALISI DIMENSIONALE E MORFOLOGICA
Gli scaffolds preparati (sia bianchi, sia caricati con antibiotici), sono stati tagliati in tre zone casuali (300 × 400 μm) e rivestiti tramite metallizzazione con oro 24 Kt in camera sottovuoto a 15mA per 20 minuti (backscattering imaging). I campioni sono stati osservati ad un microscopio elettronico a scansione (SEM) (LSM5600LV - Jeol, USA). La superficie e il diametro medio delle fibre sono stati valutati mediante il software per SEM 1.36b su micrografie a diversi ingrandimenti (da 50X a 1500X) effettuando più di 30 misurazioni per campione in maniera random. Le immagini a ingrandimenti maggiori (1500X) sono state effettuate per evidenziare la struttura macro e microporosa generatasi.
VALUTAZIONE DEL CARICAMENTO DEGLI ANTIBIOTICI IN SCAFFOLDS POLIMERICI Per determinare il caricamento effettivo degli antibiotici (Enrofloxacina e Levofloxacina) negli scaffolds a base di *PCL, si è proceduto alla quantificazione dell’antibiotico nel bagno di coagulazione e nelle fibre polimeriche tramite Cromatografia Liquida ad Alta Prestazione (HPLC) mediante sistema HPLC Waters composto da pompe Waters mod.600, rivelatore UV-VIS 486 Waters, controllo remoto da programma Millennium Chromatography Manager. Il sistema è equipaggiato con una colonna c18 (25cm, 4,6mm, 5μm) precolonna SuperguardTM Discovery R (2cmx4.0, 5μm) dotata di rilevatore UV-VIS. La fase mobile utilizzata è stata preparata con il 49.95% di acqua, il 49.95% di acetonitrile e lo 0.1% di acido trifluoroacetico .
La Enrofloxacina è stata determinata misurando l’Assorbanza ad una lunghezza d’onda di 295 nm, mentre la Levofloxacina è stata determinata misurando l’Assorbanza a 278 nm.
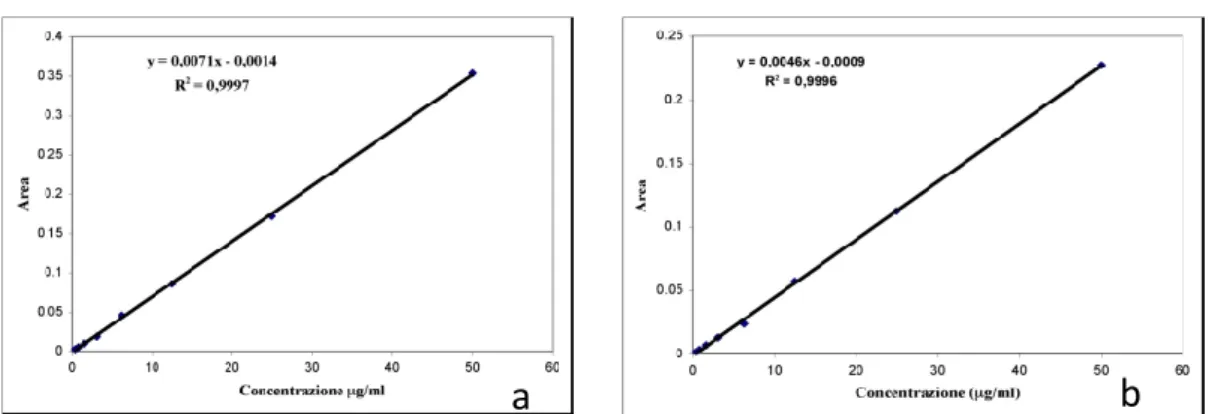
Per la valutazione quantitativa di Enrofloxacina e Levofloxacina presente all’interno delle fibre e nel bagno di coagulazione sono state preparate due curve di taratura mediante l’analisi cromatografica HPLC in fase mobile di soluzioni a concentrazione nota, sia di Enrofloxacina sia di Levofloxacina, comprese tra 0,40 e
52 50 μg/ml. I dati ottenuti sono stati elaborati con l’ausilio di software specifici per ottenere la retta di taratura e la relativa equazione (Figura IV.5).
Figura IV.5 - Retta di taratura degli antibiotici in fase mobile a) per EF e b )per LF.
QUANTIFICAZIONE DEL CARICAMENTO DEGLI ANTIBIOTICI ENROFLOXACINA E LEVOFLOXACINA NELLE FIBRE POLIMERICHE
Per la valutazione del caricamento di antibiotico nelle fibre polimeriche, uno scaffold caricato (con una concentrazione pari allo 0.2% o 0.1%w/v) è stato essiccato utilizzando una pompa meccanica (modello RV8 - Edwards) fino a peso costante e disciolto in 10ml di acetone per HPLC per circa 4 ore in agitazione. La soluzione ottenuta è stata essiccata mediante evaporatore rotante (modello R-114 - Buchi) e trattamento alla pompa meccanica, e il solido ottenuto è stato risospeso in 10ml di fase mobile per circa 4 ore in agitazione. Dopo 1 e 4 ore di agitazione, sono stati prelevati campioni di 1ml, filtrati su filtri di Nylon con cut-off di 0,2 μm e analizzati tramite HPLC.
QUANTIFICAZIONE DEGLI ANTIBIOTICI ENROFLOXACINA E LEVOFLOXACINA NEL BAGNO DI COAGULAZIONE
La quantità di antibiotico presente nel bagno di coagulazione è stata recuperata mediante essiccamento con rotavapor (modello R-114 - Buchi) e pompa meccanica (modello RV8 – Edwards). Al residuo secco sono stati aggiunti 10ml di fase mobile per HPLC e la soluzione ottenuta è stata lasciata in agitazione per 4 ore circa. Dopo 1 e 4 ore di agitazione, sono stati prelevati campioni di 1ml, filtrati su filtri di Nylon con cut-off di 0,2 μm e analizzati tramite HPLC.
53 Le concentrazioni effettive dell’antibiotico nel bagno di coagulazione sono state determinate tramite l’equazione della retta di taratura.
VALUTAZIONE DELL’EFFICIENZA DI CARICAMENTO NEGLI SCAFFOLDS
La quantificazione dell’antibiotico caricato nello scaffold, ottenuta mediante analisi HPLC, ha permesso la valutazione dell’efficienza di caricamento di farmaco nelle fibre. Le concentrazioni effettive dell’antibiotico caricato nello scaffold sono state calcolate come segue:
Dove:
• “Quantità farmaco effettivamente caricato nelle fibre” rappresenta i milligrammi di farmaco ritrovati all’interno delle fibre tridimensionali; • “Quantità farmaco utilizzato nella soluzione di partenza” rappresenta i
milligrammi di farmaco aggiunti alla soluzione polimerica.
VALUTAZIONE DELLA CINETICA DI RILASCIO DI ANTIBIOTICI DA SCAFFOLDS IN *PCL Per esaminare la cinetica di rilascio degli antibiotici (Enrofloxacina e Levofloxacina) dagli scaffolds polimerici a base di *PCL, si è proceduto alla quantificazione dell’antibiotico rilasciato in PBS 1X. Le analisi sono state effettuate mediante Cromatografia Liquida ad Alta Prestazione (HPLC), equipaggiata con una colonna c18 (25 cm, 4,6 mm, 5μm), dotata di rilevatore UV-VIS. La fase mobile utilizzata è stata preparata con il 49.95% di acqua, il 49.95% di acetonitrile e con lo 0.1% di acido trifluoroacetico.
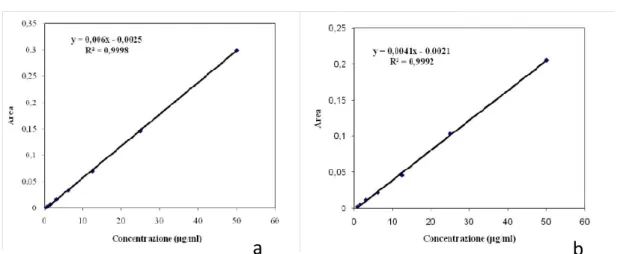
Per la valutazione quantitativa dell’antibiotico rilasciato in PBS sono state preparate due curve di taratura, una per Enrofloxacina e una per Levofloxacina, mediante l’analisi cromatografica HPLC di soluzioni a concentrazione nota compresa tra 0,40 e 50 μg/ml in tampone fosfato a pH 7.3 (PBS 1X).
54 I dati ottenuti sono stati elaborati con l’ausilio di software specifici per ottenere la retta di taratura e relativa equazione (Figura IV.6).
Figura IV.6 - Retta di taratura in PBS 1X di EF (a) e LF (b).
Analisi della Cinetica di Rilascio In Vitro
Due scaffolds di peso noto, caricati rispettivamente con Enrofloxacina e Levofloxacina (in concentrazione pari allo 0,2% w/v), sono stati immersi in falcon contenenti 10ml di PBS 1X, ad una temperatura di 37°C, in agitazione, per circa 50 giorni. Nelle prime 24 ore sono state prelevate aliquote da 1ml ogni ora, sostituite con 1ml di PBS fresco. Successivamente sono stati effettuati prelievi regolari ogni 24 ore e tutti i campioni sono stati analizzati mediante HPLC.
Le concentrazioni effettive dell’antibiotico rilasciato dagli scaffolds sono state determinate tramite l’equazione della retta di taratura.
55 PROVE BIOCOMPATIBILITA’ IN VITRO
Le valutazioni biologiche della citotossicità e della bioattività degli scaffolds preparati sono state condotte utilizzando la linea cellulare di pre-osteoblasti murini MC-3T3-E1 ottenuti dall’American Type Colture Collection (ATCC-2593).
Per la crioconservazione le cellule sono state sospese in aliquote da 1ml di siero bovino fetale (FBS – Sigma-Aldrich) contenente il 10% di DMSO (Baker), mantenute a -20°C per 24 ore, poi a -80° C per altre 24 ore, quindi conservate in azoto liquido.
Quando necessario le cellule sono state scongelate secondo la seguente procedura: le vials contenenti le cellule sono state tolte dall’azoto liquido e immerse tempestivamente in un bagno ad acqua a 37° C per alcuni minuti, successivamente 1ml di cellule è stato trasferito in un microtubo da centrifuga (Falcon) contenente 9ml di Alpha Minimum Essential Medium (αMEM) completo (preparato aggiungendo 2mM L-glutammina, 10% di siero bovino fetale, penicillina (100U/ml) (Gibco), streptomicina (100μg/ml) (Gibco) e plasmocil (0,5μg/ml) (Invivogen) conservato a 4°C), e centrifugata a 1000 g per 10 minuti a 10°C, utilizzando una centrifuga PK 121R (PBI International). Il centrifugato è stato risospeso in un volume appropriato di αMEM completo a 37°C. Le cellule sono state seminate in una fiasca da 25 cm2 e mantenute a 37°C, in atmosfera arricchita di 5% di CO2.
Una fiasca da 75 cm2 contenente cellule MC-3T3-E1, cresciute esponenzialmente, è stata osservata con un microscopio rovesciato per verificare il raggiungimento della confluenza cellulare. Dalla fiasca è stato quindi allontanato il terreno αMEM completo e sostituito con Tampone fosfato salino 0.01M (PBS 1X) per rimuovere il siero residuo. Dopo alcuni minuti, la soluzione è stata rimossa e le cellule sono state incubate con 300μl di tripsina (Gibco) a 37°C e 5% di CO2 per 5
minuti, per permettere alle stesse di staccarsi dalla superficie della fiasca. Le cellule sono state risospese in 10ml di αMEM completo e piastrate utilizzando le diluizioni opportune.
56 PROVE DI ADESIONE E PROLIFERAZIONE CELLULARE
Sterilizzazione e Condizionamento degli Scaffolds
In 2 piastre di polistirene da 12 pozzetti ciascuna, sono stati disposti 12 scaffolds bianchi per condurre le valutazioni biologiche sia a 7 che a 14 giorni. Gli scaffolds sono stati sottoposti a una serie di trattamenti chimici e fisici al fine di ottenere un’efficace sterilizzazione. Le strutture polimeriche sono state, quindi, immerse in una miscela di etanolo/acqua (70%/30%) per 24 ore, e sottoposte a 3 lavaggi con PBS 1X (il primo ed il secondo lavaggio di circa 2-3 minuti, mentre il terzo per 20 minuti). La sterilizzazione fisica è stata effettuata esponendo gli scaffolds (immersi in PBS1X) ad una sorgente di raggi ultravioletti per 30 minuti sotto cappa a flusso laminare (Hera Safe HS12 - Heraeus Instrument S.p.A, Germania). Successivamente il PBS 1X è stato allontanato dagli scaffolds e il loro condizionamentoe’ stato completato immergendoli in terreno fresco αMEM completo a 37°C (Figura IV.7) per 12 ore prima della semina dei pre-osteoblasti murini.
Figura IV.7 - Piastra di polistirene contenente 6 scaffolds bianchi in terreno αMEM completo.
Semina delle Cellule sugli Scaffolds
Il terreno precedentemente addizionato agli scaffolds per il loro condizionamento è stato rimosso e sostituito con 1ml di sospensione cellulare contenente 1x104cellule per pozzetto e incubate a 37°C, al 5% CO2. Dopo 2 ore ogni
57 sono state incubate rispettivamente per 7 e 14 giorni, cambiando il terreno ogni 2-3 giorni. Al termine dell’ incubazione a 7 e a 14 giorni il terreno di coltura è stato allontanato dagli scaffolds e sostituito con αMEM fresco. I campioni sono stati quindi analizzati da un punto di vista sia quantitativo sia qualitativo.
Analisi Qualitative
Per la valutazione qualitativa della adesione e della proliferazione cellulare gli scaffolds precedentemente incubati con le cellule (sia a 7 che a 14 giorni), questi sono stati lavati per tre volte con PBS 1Xe quindi trattati con diverse colorazioni.
1. Colorazione Blu di Toluidina
Gli scaffolds sono stati incubati per 2 ore a temperatura ambiente in 3ml di soluzione di paraformaldeide (3,7%) in PBS 1X, preparata disciogliendo 7.4 grammi di paraformaldeide in 180ml di acqua distillata, aggiungendo 20μl di NaOH 10 N e scaldando a 56°C. Alla soluzione limpida sono stati aggiunti 20ml di PBS 10X. Successivamente al suo raffreddamento, la soluzione è stata filtrata e mantenuta a 4°C fino al momento del suo utilizzo.
Dopo la fase di incubazione i campioni sono stati colorati con una soluzione acquosa di blu di toluidina (1%) (Fluka) precedentemente filtrata, lasciati a temperatura ambiente per 20 minuti, lavati per 3 volte con PBS 1X, tagliati in sezione e montati su un vetrino portaoggetti per l’osservazione al microscopio ottico (Nikon Eclipse TE 2000-U Nikon, Japan)).
Il blu di toluidina è un colorante tiazinico che si lega al DNA e ai gruppi solfato dei polisaccaridi conferendo alle cellule una colorazione blu-viola.
2. Colorazione DAPI e Falloidina-Alexa 488
Gli scaffolds sono stati incubati per 2 ore a temperatura ambiente in 3ml di soluzione di paraformaldeide (3,7%) (Carlo Erba) in PBS 1X per la fissazione delle cellule, e successivamente permeabilizzati con PBS 1X/ Triton X-100 (0,3%) (Sigma-Aldrich) per 15 minuti. Gli scaffolds sono stati quindi incubati in una soluzione
58 contenente 5μl di soluzione madre di DAPI (Invitrogen) e 3μl di falloidina-Alexa 488 (Invitrogen) in 1ml di PBS 1X a temperatura ambiente per 1 ora. Alla scadenza del tempo di incubazione i campioni sono stati lavati con PBS 1X, tagliati in sezione e montati su un vetrino portaoggetti per l’osservazione al microscopio confocale a scansione laser (CLSM) (Modello Eclipse TE 2000-U equipaggiato di lampada per fluorescenza e di sistema confocale Nikon D Eclipse C1).
I saggi con colorazione DAPI/Falloidina-Alexa 488 consentono una miglior valutazione della citomorfologia di nucleo e citoscheletro in quanto il DAPI crea un legame con il DNA nel nucleo conferendogli una colorazione blu, mentre la Fallidina/Alexa 488 si lega con F-actina del citoscheletro conferendogli una colorazione fluorescente verde.
3. Metodo Live/Dead
Gli scaffolds sono stati incubati in una soluzione contenente 2μl di soluzione madre di Omodimero di Etidio (Invitrogen) e 5μl di soluzione madre di Calceina-AM (Invitrogen) in 1ml di PBS 1X a temperatura ambiente, in assenza di luce per 30 minuti, dopodiché sono stati tagliati in sezioni ed esaminati al microscopio confocale a scansione laser. Le analisi sono state condotte su entrambe le superfici (superiore e inferiore) della struttura e su sezioni random della stessa.
Il test colorimetrico permette un’agevole valutazione della quantità di cellule vitali e non in quanto l’Omodimero di Etidio, grossa molecola intercalante degli acidi nucleici, può solamente diffondere attraverso le membrane danneggiate delle cellule morte donando loro una colorazione rossa, mentre la Calceina AM viene convertita in Calceina fluorescente ad opera di esterasi cellulari attive solo nelle cellule vitali conferendo loro una colorazione verde fluorescente.
Valutazione della Citotossicità degli Scaffolds mediante Saggio WST-1
Gli scaffolds seminati con le cellule MC-3T3 e mantenuti in coltura per 7 e 14 giorni, sono stati esaminati per valutare l’eventuale citotossicità dei sistemi preparati La vitalità cellulare è stata analizzata da un punto di vista quantitativo
59 mediante il saggio del sale di tetrazolio WST-1 (Roche Molecular Biochemicals), sia per contatto diretto, sia tramite adesione e proliferazione cellulare sullo scaffold (per entrambi i tempi di incubazione).
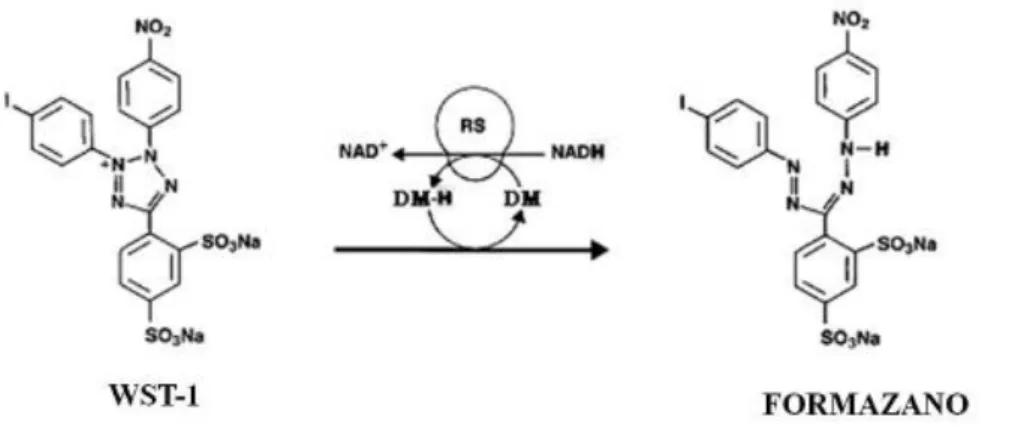
Il test di citotossicità basato sui Sali di tetrazolio (WST-1) permette di valutare la vitalità e la proliferazione cellulare per via colorimetrica ed è basato sulla capacità di un enzima cellulare, una deidrogenasi mitocondriale, di convertire il sale di tetrazolio (WST-1) in formazano attraverso una scissione enzimatica (Figura IV.8).
Figura IV.8 - Reazione di riduzione del sale di tetrazolio WST-1 in Formazano.
L’attività enzimatica mitocondriale porta alla formazione di formazano solubile, che si correla direttamente con il numero di cellule metabolicamente attive in coltura, presentando un massimo di assorbimento ad una specifica lunghezza d’onda (450 nm), rivelato tramite lettura spettrofotometrica a 450nm.
1. Valutazione della Citotossicità per Contatto Diretto (CD)
Sono stati addizionati 300μl di reagente WST-1 (10% del volume del pozzetto) al pozzetto contenente uno scaffold dove sono state seminate le cellule e mantenute in incubazione sia a 7, sia a 14 giorni. Dopo l’aggiunta del reagente la piastra è stata incubata per 4 ore a 37°C. Allo scadere del tempo d’incubazione i 3ml di terreno αMEM completo sono stati aliquotati nei pozzetti delle colonne 3, 4 e 5 in una piastra di polistirene da 96 pozzetti (Figura IV.9). La quantità di formazano prodotto è stata valutata misurando l’Assorbanza ad una lunghezza d’onda di 450 nm con un lettore per micropiastre (Benchmark Microplate Reader - Bio-rad, USA -
60 collegato con un computer Machintosh Power Mac) I dati sono stati elaborati mediante software Microplate Manager III (Bio-rad) ed Igor Pro (Wave-metrics)) utilizzando 620nm come lunghezza d’onda di riferimento.
2. Valutazione dell’Adesione e Proliferazione Cellulare sullo Scaffold (AP)
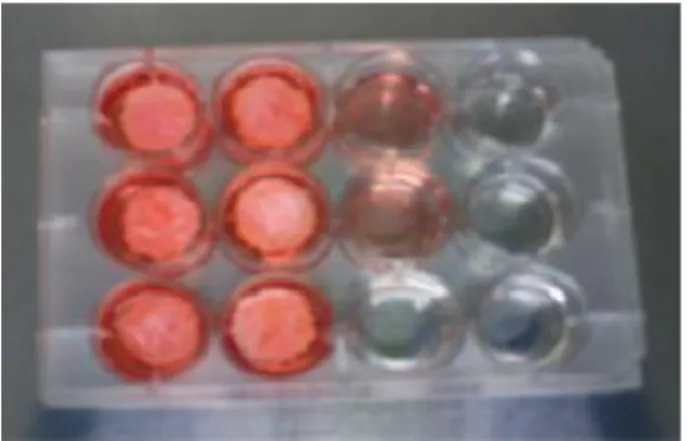
Ciascun scaffold, dove sono state seminate le cellule e mantenute in incubazione a 7 o a 14 giorni, è stato trasferito su una piastra di polistirene nuova, per saggiare l’effettiva crescita delle cellule solo sullo scaffold. Al pozzetto della piastra, contenente lo scaffold e 3ml di terreno sono stati aggiunti 300μl di reagente WST-1, e la piastra è stata incubata per 4 ore a 37°C. Dopo l’incubazione il terreno è stato aliquotato nei pozzetti delle colonne 6,7 e 8 (Figura IV.9) di una piastra da 96 pozzetti. Come riferimento nelle colonne 9 e 10 (Figura IV.9) e’ stato aliquotato terreno ottenuto da cellule cresciute su polistirene da coltura cellulare (controllo di proliferazione, C), nelle colonne 11 e 12 (Figura IV.9) e’ stato aliquotato solo terreno (bianco,T), nelle colonne 1 e 2 e stato messo solo PBS (Figura IV.9).
1 2 3 4 5 6 7 8 9 10 11 12 PBS CD AP C T
Figura IV.9 - Piastra per coltura cellulare da 96 pozzetti utilizzata per le prove di citotossicita’ degli scaffolds: colonne 1 e 2 pozzetti contenenti solo PBS; colonne 3, 4 e 5 pozzetti contenenti terreno per la valutazione della citotossicità per contatto diretto (CD); colonne 6, 7 e 8 pozzetti contenenti terreno per la valutazione di adesione e proliferazione cellulare sullo scaffold (AP); colonne 9 e 10 pozzetti contenenti cellule e terreno come controllo (C); colonne 11 e 12 pozzetti contenenti solo terreno (T).
61 TEST IN VIVO
Lo studio in vivo è stato eseguito previa approvazione da parte del Comitato Etico “Massimo Ermini” dell’Ateneo pisano (D.Lgs.vo 116/92, prot. rettorale n° 15014). La scelta del modello animale e della tecnica di impianto degli scaffolds è stata condotta in accordo con le vigenti normative in tema di benessere animale.
È stato dunque scelto il modello cunicolo, e fissando a 20mm la perdita di sostanza ossea da ricreare, abbiamo scelto come sede di intervento la diafisi radiale con mantenimento dell’integrità anatomica dell’ulna.
Per standardizzare la tecnica chirurgica tutti gli interventi sono stati condotti sull’arto anteriore destro e, sempre, dallo stesso chirurgo.
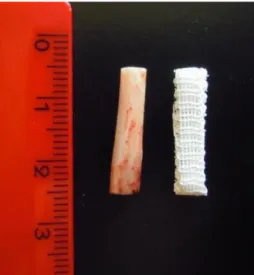
Per lo studio sono stati allestiti due tipi di scaffolds , in *PCL e *PCL-HA, con tecnica Wet-spinning automatizzata in modo da ottenere strutture tridimensionali che presentassero dimensioni (larghezza, spessore e lunghezza) simili al segmento osseo da trattare (Figura IV.10).
Figura IV.10 – Immagine dello scaffold creato.
ANIMALI
Sono stati selezionati 36 conigli di razza New Zealand White, omogenei per sesso (maschi), e di circa 4 mesi di età.
Dopo un periodo di circa 7 giorni di adattamento alle condizioni di stabulazione, i conigli sono stati suddivisi con modalità random, in 6 gruppi, di 6 animali ciascuno, identificati dal tipo di impianto e dal periodo di osservazione cui
62 sono stati sottoposti (*PCL4w, *PCL8w, *PCL12w, HA4w, HA8w, *PCL-HA12w).
Tutti gli animali sono stati mantenuti in regime di stabulazione controllata per temperatura, umidità, ventilazione e illuminazione e sono stati sottoposti al medesimo piano terapeutico post-chirurgico e alimentare.
TECNICA CHIRURGICA Impianti
Dopo circa 7 giorni dal loro ingresso in stabulazione ogni soggetto è stato pesato e preparato per l’intervento chirurgico.
A livello della vena auricolare laterale è stata applicata una crema anestetica locale, per desensibilizzare la parte prima dell’inserimento dei cateteri necessari per la somministrazione dei farmaci e della terapia reidrantante. Ogni animale è stato, quindi, sottoposto a premedicazione con medetomidina (20 µg/kg), ketamina (5 mg/kg) e fentanyl (0,1mg/2ml, 10 µg/kg) per via intramuscolare. Il cateteri venoso per la somministrazione dei farmaci per l’induzione è stato inserito a soggetto sedato. L’induzione è stata effettuata con propofol (4-6 mg/Kg) per via endovenosa lenta seguita immediatamente da infusione continua di propofol (0,7-0,9 mg/kg/min). Tutti i conigli sono stati mantenuti con ossigeno in maschera. Una volta anestetizzati, ad ogni animale, è stato inserito un catetere arterioso nell’arteria auricolare maggiore necessario per misurare la pressione arteriosa sistemica. Successivamente, con i soggetti in decubito dorsale ed arto destro in abduzione, è stata eseguita una anestesia loco-regionale a livello delle radici nervose di C6, C7, C8 e T1 mediante accesso ascellare ecoguidato. Il blocco del plesso brachiale è stato eseguito con ropivacaina allo 0,5% alla dose di 1 mg/kg, impiegando un ago isolato connesso ad un neurostimolatore impostato ad una frequenza di 100 Hrz e 0,8 mA. Una volta individuate vena e arteria ascellare, per mezzo del neurostimolatore è stata identificata la radice nervosa di C7 cercando la risposta muscolare di flessione del radio. Prima di inoculare il farmaco è stata verificata l’assenza di movimento a
63 0,2mA e l’assenza di sangue all’aspirazione. Il corretto posizionamento del farmaco a livello perineurale è stato ulteriormente controllato ecograficamente.
Durante la procedura chirurgica sono state monitorate frequenza cardiaca, frequenza respiratoria, pressione arteriosa sistemica, saturazione parziale di ossigeno e temperatura. Intervenendo a ripristinare i valori alterati con opportuna terapia farmacologica.
Ogni soggetto è stato sottoposto ad ampia tricotomia a livello dell’arto anteriore destro, e posizionato in decubito laterale destro in modo da consentire un accesso mediale alla diafisi dell’osso radiale.
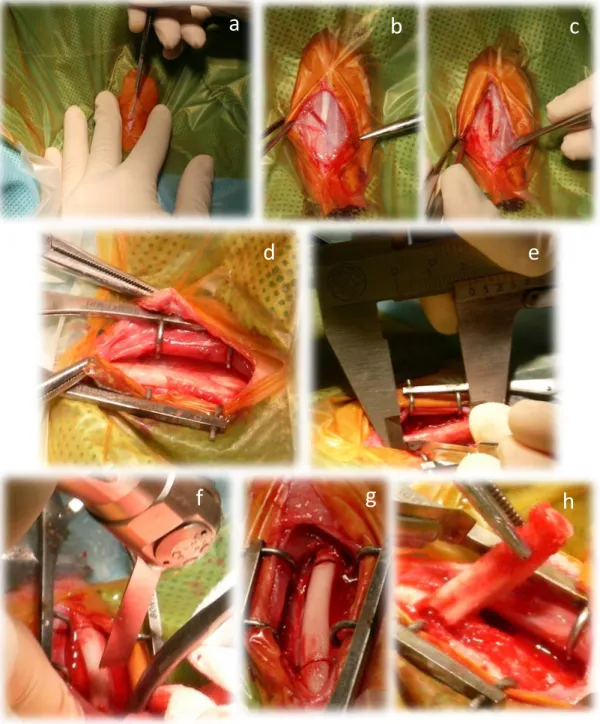
È stata eseguita un’incisione della cute di circa 40mm a livello mediale (Figura IV.11a). Previa incisione del sottocute e della fascia muscolare, i muscoli estensore radiale, grande palmare e flessore superficiale delle dita sono stati retratti fino a esteriorizzare al diafisi del radio (Figura IV.11b e IV.11c). La diramazione distale della vena cefalica è stata sottoposta ad elettro-cauterizzazione e, allo scopo di ottenere una miglior visualizzazione della porzione diafisaria, anche il tendine del muscolo pronatore rotondo è stato disinserito dal margine cranio mediale della diafisi radiale. Dopo attenta dissezione dei tessuti si è proceduto all’incisione del periostio e alla sua retrazione (Figura IV.11d). Una volta scheletrizzata la diafisi radiale, mediante un calibro ventesimale è stata identificata la linea di incisione, sia prossimale, sia distale per eseguire un osteotomia di circa 20mm (Figura IV.11e). Proteggendo l’ulna con un retrattore di Hohmann, con una sega oscillante ortopedica (Figura IV.11f e IV.11g) sono state eseguite le due incisioni bicorticali che hanno reso possibile la rimozione del frammento osteotomizzato (Figura IV.11h).
64
Figura IV.11 – Immagini intervento chirurgico. a-c) dissezione dei tessuti molli, d) dissezione del periostio, e) Misurazione con calibro centesimale della distanza delle 2 incisioni bicorticali, f) osteotomia
diafisi radiale, g) particolare delle incisioni bicorticali, h) rimozione del segmento ostoetomizzato.
a
b
c
d
e
65 Tale frammento è stato ulteriormente misurato con calibro ventesimale e le misure (larghezza, spessore e lunghezza) sono state utilizzate per scegliere lo scaffold da impiantare con caratteristiche il più possibili simili a quelle del frammento rimosso.
Nei casi in cui la lunghezza dell’impianto non consentisse un agevole inserimento a compressione sui due monconi, per mezzo di una lama di bisturi è stata rimossa la parte eccedente.
L’impianto è stato inserito a lieve pressione tra i due monconi osteotomizzati ed è stato mantenuto in sede ricostruendo i piani muscolari sovrastanti, senza ulteriore impiego di mezzi di osteosintesi (Figura IV.13a e IV.13b).
a
b
c
Figura IV.12 - Immagini delle misurazione delle dimensioni del frammento osseo.
a
b
66 I muscoli, la fascia e la cute sono stati suturati in piani separati mediante Polydiossanone 4-0 con punti nodosi staccati semplici (Figura IV.14a e IV.14b).
A tutti i soggetti nell’immediato periodo post-operatorio è stata applicato un bendaggio rigido con stecca che consentisse l’appoggio della mano e diminuisse il disagio post-operatorio degli animali.
Tutti i soggetti sono stati sottoposti a un protocollo terapeutico standardizzato per i 7 giorni successivi la data di impianto comprendente:
Antibiotico: enrofloxacina a 10 mg/kg q24h per 7 giorni; Analgesia: buprenorfina a 30 µg/kg q8h per 2 giorni; Antidolorifico: carprofen a 4 mg/kg q24h per 4 giorni; Procinetico: metoclopramide a 0,2 mg/kg q8h per 2 giorni.
Tutti gli animali trattati sono stati monitorati quotidianamente per: consumo di acqua e cibo, produzione e qualità di feci e urina, recupero della stazione quadrupedale e uso dell’arto trattato, presenza o assenza di segni di welfare (grooming, incremento ponderale e altro).
In caso si presentassero segni di sofferenza o alterazioni dei segni di benessere sopradescritti opportuni provvedimenti, anche terapeutici, sono stati messi in atto e valutati caso per caso.
a
b
67 Espianti
Gli espianti degli scaffolds sono stati condotti per ogni gruppo allo scadere del periodo di osservazione di 4, 8 o 12 settimane. Parte degli animali sono stati sottoposti aeutanasia, parte sono stati sottoposti ad amputazione dell’arto anteriore oggetto dello studio.
Tutti gli arti sono stati comunque sottoposti a tricotomia e incisione della cute sul versante medio-craniale dell’arto. Si è proceduto con un’ampia dissezione dei tessuti molli fino a scheletrizzare il radio ed evidenziare l’impianto inserito (Figura IV.15).
Una volta evidenziati i margini prossimale e distale di quest’ultimo, una fiches in acciaio di diametro opportuno è stata infissa nell’epifisi distale di radio e ulna a circa 7mm dal limite distale dell’impianto al fine di mantenere strettamente vincolati i due segmenti ossei durante l’osteotomia (Figura IV.16a). Successivamente, per mezzo di una sega oscillante ortopedica sono state eseguite 2 incisioni bicorticali di radio e ulna posizionate prossimalmente e distalmente a 10mm dai margini, rispettivamente, prossimale e distale dello scaffold.
b
a
Figura IV.15 – Particolare della dissezione dei tessuti molli durante la fase di espianto con scheletrizzazione della sede di inserimento dello scaffold.
68 Il frammento osseo di circa 40mm (Figura IV.17a e IV.17b) ottenuto è stato, quindi, sottoposto a valutazioni macroscopiche e, poi, inserito in formalina tamponata al 4% per l’invio per gli studi istologici.
a
b
Figura IV.16 – Particolare di inserimento distale di chiodo in acciaio a stabilizzare radio e ulna (a) e particolare dell’osteotomia di espianto (b).
a
b
40mm
69 VALUTAZIONI IN VIVO: ESAMI RADIOGRAFICI
Per ogni soggetto sottoposto a trattamento è stata condotta un’attenta indagine radiografica mediante esecuzione di radiografie nelle due proiezioni ortogonali standard (antero-posteriore AP e medio-laterale ML) per valutare il progredire del processo di rigenerazione ossea. Un primo esame è stato condotto immediatamente dopo l’inserimento degli impianti per verificare la radio-trasparenza dello scaffold e la correttezza dell’osteotomia eseguita (Figura IV.18). Le misurazioni della lunghezza del difetto creato sono state rilevate dall’analisi delle immagini radiografiche mediante software MicroDicom- free DICOM viewer (versione 0.5.4).
Ulteriori immagini radiografiche sono state acquisite a 4, 8 e 12 settimane dall’inserimento degli impianti e comunque prima di ogni espianto.
Per ogni immagine radiografica acquisita nelle due proiezioni standard è stata valutata l’entità del processo di rigenerazione mediante impiego di un sistema a punti già impiegato e validato in numerosi studi riguardanti la rigenerazione di difetti ossei (An & Friedman, 1999b; Hedberg et al., 2005; Bodde et al., 2007) (Figura IV.19a e IV.19b). Dai lavori dei sopraindicati autori è stata rielaborata la tabella di valutazione riportata in Tabella IV.1.
a
b
70
Tabella IV.1 – Tabella di valutazione radiografica di rigenerazione ossea rielaborata da Lane&Sandhu, 1987 e Bodde et al., 2007.
Categorie punti
Unione dell’osteotomia prossimale e distale (valutate separatamente) Unione 100% 4 Unione 75% 3 Unione 50% 2 Unione 25% 1 Non unione 0
Copertura dello scaffold
Totale 100% 4 Copertura del 75% 3 Copertura del <50% 2 Copertura del 25% 1 Nessuna copertura 0 Rimodellamento osseo
Completo rimodellamento della corticale 4
Canale midollare 2
Nessun rimodellamento 0
Punteggio totale 16
a
b
Figura IV.19 – Schemi di valutazione radiografica elaborati da Lane & Sandhu, 1987 (a) e da Hedberg et al., 2005 Bodde et al., 2007 (b).
71 ESPIANTI: VALUTAZIONI MORFOLOGICHE MACROSCOPICHE
Le procedure di espianto sono state condotte sempre dal medesimo medico che durante la procedura ha rilevato:
la presenza o meno di segni macroscopicamente evidenti di reazione infiammatoria peri-implantare indicanti l’eventuale rigetto dell’impianto;
il grado di integrazione dell’impianto coi tessuti molli circostanti;
la visibilità o meno delle fibre costituenti l’impianto e indicanti il grado di copertura delle guide;
la cedevolezza o meno dell’impianto al tatto a conferma della presenza di tessuto con consistenza simile a quella dell’osso.
Come per le valutazioni radiografiche, anche per le caratteristiche macroscopiche degli impianti è stata elaborata una tabella a punteggi per ognuno dei parametri considerati come riportato in Tabella IV.2.
Tabella IV.2 – Sistema di valutazione a punti elaborato per le valutazioni macroscopiche dell’espianto.
Categorie punteggio
Presenza di reazione infiammatoria
Assente 3
lieve <50% 2
moderata >50% 1
abbondante 100% 0
Aderenza dei tessuti molli
Assente 3
lieve <50% 2
moderata >50% 1
abbondante 100% 0
Esposizione delle fibre
Copertura totale 100% 3 Copertura moderata >50 % 2 Copertura lieve <50% 1 Copertura assente 0 Cedevolezza al tatto Solido 3 Lievemente cedevole 2 Moderatamente cedevole 1 cedevole 0 Punteggio totale 12
72 VALUTAZIONI ISTOPATOLOGICHE
Tutti i campioni espiantati, una volta fissati i formali al 4% sono stati sottoposti ad indagini istopatologiche per valutare la qualità del tessuto rigenerato ed effettivamente presente negli scaffolds .
Tutti i preparati sono stati sottoposti a procedura standard di demineralizzazione dell’osso, mediante immersione della durata di 10-15 giorni (in funzione del campione) in una soluzione decalcificante presente in commercio ad azione medio-lenta.
Successivamente i preparati sono stati sezionati in frammenti di 3 mm di spessore secondo tagli sotto schematizzati.
Ogni sezione è stata, quindi, inclusa in paraffina e ogni blocchetto è stato tagliato con microtomo in sezioni di 4-6 µm di spessore che sono state, successivamente montate su vetrino e sottoposte a varie tecniche colorimetriche.
1. Emallume-Eosina (EE)
È la colorazione di base nello studio microscopico dei tessuti. Colora in blu violaceo, grazie all'emallume, i componenti cellulari basofili (acidi nucleici, membrane cellulari, elastina) ed in rosso rosato, tramite l'eosina, i componenti acidofili (proteine cellulari, le proteine mitocondriali, le fibre collagene).
B
A
C
Figura IV.11 – Immagini schematiche delle sezioni allestite da ogni preparato. È stata eseguita una prima sezione trasversale (A) centrale al campione; sui due monconi ottenuti sono state eseguite altre due sezioni: parallela all’asse maggiore dell’osso (B) e trasversale in prossimità del margine vicino al radio osteotomizzato.
73 2. Tricromica di Mallory
Tecnica colorimetrica per il connettivo collageno ma anche per preparati d'insieme. Prevede l’impiego di tre coloranti: la fucsina acida, che colora in rosso i nuclei, l'azzurro di anilina o il blu di metilene, che conferisce al connettivo collageno una tonalità azzurra, e l'orange G (acido, basofilo) che colora i citoplasmi in arancione. La fissazione dell'azzurro di anilina o del blu di metilene al collageno si effettua a mezzo dell'azione mordenzante esercitata dall'acido fosfomolibdico.
3. Blu di toluidina
Il Blu di toluidina è un colorante basofilo. Si può comportare come colorante ortocromatico (dando un colore azzurro) o metacromatico (dando un colore rosso-violetto) in dipendenza del pH e della natura chimica della sostanza da colorare. La metacromasia è caratterizzata dal viraggio del colorante originario a contatto con sostanze polianioniche (delle metacromatiche). Il blu di toluidina colora metacromaticamente (in violetto) le strutture ricche di proteoglicani solfatati (per esempio la cartilagine).
4. Emallume-Rosso Congo
Questo è il metodo di elezione per la colorazione del tessuto osteoide. I nuclei delle cellule si colorano in blu con emallume, l’osso calcificato in rosa, il tessuto osteoide non calcificato in rosso mattone.
Di ogni preparato istologico è stato valutato:
la presenza di tessuto osseo neoformato e la sua disposizione tra le fibre;
il grado di rimodellamento osseo con formazione del canale midollare;
la presenza di reazione infiammatoria intorno alle fibre dello scaffold;
tipo di tessuto presente tra le fibre degli scaffold con scoring radiologico medio-basso;
presenza o meno di vasi sanguinei e/o altri tessuti eventualmente presenti (muscolo, grasso, cartilagine o altro).
74 ANALISI STATISTICA
I dati quantitativi sono stati presentati come media ± la deviazione standard (SD).
I dati riguardanti il diametro medio delle fibre, l’efficacia di caricamento, la valutazione radiologica della rigenerazione sono stati valutati con il test ANOVA a una via e il Tukey test è stato impiegato per le analisi post hoc. La significatività è stata definita per p<0,05.
Per il confronto tra i 2 gruppi (*PCL e *PCL-HA) ai vari intervalli di tempo si è ricorsi al test t di Student per dati non appaiati prendendo come significativi i valori di p<0,05.