D
ISCUSSIONE5.1 – Ruolo del corpo calloso nella binocularità
Il lavoro sperimentale di questo studio è partito dalla considerazione che il corpo calloso, composto nell’uomo da oltre 200 milioni di fibre, media processi interemisferici di varia natura. Interconnette aree sensoriali e associative, trasportando una informazione di natura inibitoria o eccitatoria a seconda dei distretti (Bloom and Hynd, 2005). Realizza il passaggio di informazioni sensoriali dall’emisfero presso cui sono state raccolte all’emisfero controlaterale, consentendo coordinazione dell’elaborazione e un comportamento cognitivo e motorio percepito ed effettuato come unitario. Interconnette dunque anche le cortecce visive dove partecipa, collegando le aree corrispondenti al meridiano verticale, alla fusione delle rappresentazioni dei due emicampi visivi nei due emisferi.
In questo ambito, la prima parte degli esperimenti condotti ha dimostrato che il corpo calloso ha un ruolo importante nella binoculatirà, trasportando informazioni preminentemente relative all’occhio ipsilaterale.
5.1.1 – Protocollo sperimentale
Per stabilire il ruolo del corpo calloso nella binocularità, si è reso necessario isolare il suo contributo dal resto delle afferenze confluenti sui neuroni piramidali della corteccia visiva primaria.
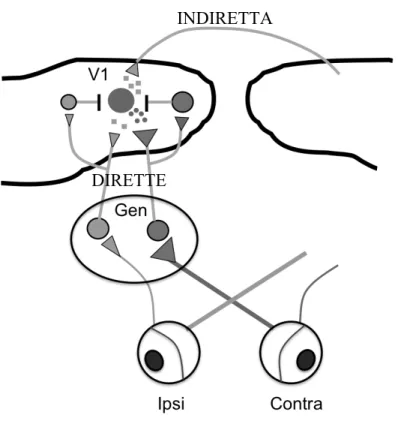
Vi confluiscono idealmente 3 vie diverse, ciascuna affiancata dalla sua componente inibitoria (figura 5.1).
Le due vie dirette sono costituite dalle afferenze talamo-corticali. Assoni provenienti dalla parte dorsale del corpo genicolato laterale (dLGN) si proiettano sui neuroni piramidali corticali.
Fig. 5.1: vie afferenti sul neurone piramidale corticale. È mostrato uno schema
semplificato delle vie visive. Dal nucleo genicolato laterale dorsale (Gen) si dipartono le due vie dirette al neurone piramidale. La via indiretta è quella callosale, che fornisce informazioni provenienti dalla corteccia controlaterale, dove è dominante l’occhio ipsilaterale.
DIRETTE
È stato possibile elidere questo contributo inattivando il nucleo talamico per mezzo di microiniezioni di tetrodotossina (TTX).
I potenziali visivi evocati (VEP) registrati in corteccia visiva sono indice dell’attività elettrica dei neuroni piramidali in risposta a un opportuno stimolo presentato. Tali segnali sono stati registrati prima di ogni trattamento, per misurare la binocularità dell’area raggiunta dal microelettrodo. Una volta sincerati di sondare una zona effettivamente binoculare in situazione di risposta ideale, ovvero da entrambi gli occhi, si è provveduto a inattivare il corpo genicolato laterale.
L’iniezione di tetrodotossina (TTX) ha fatto calare significativamente la risposta visiva. Rimane tuttavia una attività residua, che continua ad essere correlata alla presentazione degli stimoli visivi all’animale. Si tratta della componente callosale, unica ancora rimasta attiva e in grado di attivare i neuroni piramidali corticali.
Una volta isolata la componente callosale si è, per controprova, provato ad eliderla, verificando che il segnale registrato fosse dovuto proprio al suo contributo. Si è per questo microiniettata una soluzione di muscimolo nella corteccia controlaterale, per inibirne ogni attività elettrica e quindi anche la trasmissione di ingressi sensoriali alla corteccia ipsilaterale.
Così operando, scompariva – nei VEP registrati in corteccia ipsilaterale – ogni residuo di attività correlabile agli stimoli visivi presentati.
È dunque dimostrato che l’attività residua dopo l’iniezione di TTX nel genicolato risulta esclusivamente dalla componente callosale proveniente dalla corteccia controlaterale.
5.1.2 – Efficacia della TTX nell’inibire l’attività del nucleo genicolato laterale
Resta tuttavia da verificare che le microiniezioni effettuate nel genicolato siano in grado di bloccarne ogni attività. E che quindi il protocollo sperimentale appena descritto sia validabile.
Per questa occorrenza, si è preliminarmente sondata l’attività del nucleo talamico, tracciando una mappa dei campi recettoriali.
Con un’opportuna stimolazione visiva all’animale anestetizzato, si è provveduto ad affondare con l’elettrodo, in step di 60 – 100 µm, e di tracciare sullo schermo posto nel campo visivo dell’animale le aree di responsività di ogni unita di risposta vagliata. Si assume, per la distanza tra un sito e l’altro, per le caratteristiche proprie della pipetta di vetro che costituisce l’elettrodo e le proprietà dell’amplificazione e filtraggio del segnale, di registrare da cellule diverse, o quantomeno da unità di risposta diverse.
Così facendo è stata tracciata una mappa recettoriale che collima con le aspettative, realizzando uno shift di 10° in senso latero-mediale di campo visivo per ogni 100 µm di profondità in senso dorso-ventrale nel nucleo talamico.
A questo punto, si sono effettuate registrazioni prima e dopo la microiniezione di TTX nel nucleo genicolato laterale.
Una risposta tipo trovata e scelta come esempio, quella illustrata in figura 4.4, rappresenta la risposta classica di una cellula del genicolato di tipo ON / OFF, ovvero che presenti due picchi di massima attività: uno nel momento di massima intensità luminosa, l’altro in quello di minima luminosità. Per valori intermedi, la risposta è nulla.
In ogni caso la risposta risulta del tutto assente a seguito della inattivazione. Ciò conferma la validità della microiniezione di TTX come bloccante dell’attività elettrica del corpo genicolato laterale.
5.1.3 – Corpo calloso e sistema visivo: dati contrastanti in letteratura
Il ruolo delle connessioni callosali nella corteccia visiva primaria e, con esse, nella bibocularità, è controverso. I primi esperimenti sono stati condotti su modelli felini e murini, e consistevano in lesioni alla commissura callosale: ciò riduceva la binocularità secondo alcuni autori (Yinon et al., 1992), ma non secondo altri (Minciacchi and Antonini, 1984). Un risultato di riduzione della binocularità si ha inattivando inattivando l’emisfero controlaterale farmacologicamente o per raffreddamento (Blakemore et al., 1983).
Sono stati condotti studi sul gatto, consistenti in lesioni precoci del corpo calloso, a seguito delle quali la binocularità veniva alterata; l’effetto era assente se la lesione era condotta nell’adulto (Elberger and Smith, 1985). Quindi, i risultati mostrano in generale esiti contrastanti, e le differenze potrebbero essere dovute all’età a cui è condotta la lesione, al tempo da questa trascorso prima delle misurazioni elettrofisiologiche, e al modello animale utilizzato.
Per tempi relativamente lunghi (mesi) è possibile ipotizzare fenomeni di plasticità e riarrangiamento, così come lo sviluppo di esiti cicatriziali indotti dalle lesioni callosali, che possono compromettere la funzionalità del tessuto nervoso circostante.
5.1.4 – Spostamento della dominanza oculare a seguito della inattivazione del genicolato, e della corteccia controlaterale
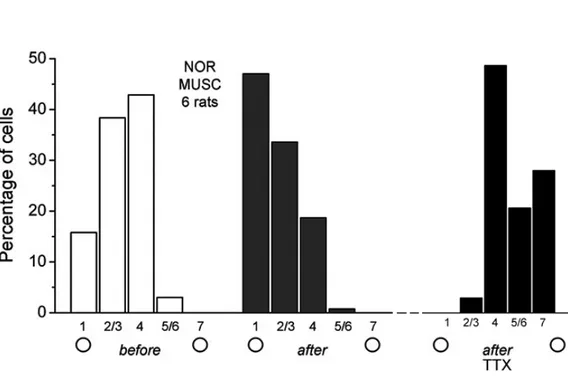
È stata già evidenziata l’utilità dello studio delle classi di dominanza oculare e della loro variazione per l’interpretazione dei fenomeni di plasticità del sistema visivo. A questo proposito, per questo studio, è stato tracciato un grafico di distribuzione della OD per animali normali. Il risultato ottenuto, illustrato in figura 4.5, collima con le aspettative: la distribuzione risulta sensibilmente spostata verso l’occhio controlaterale. Circa il 55% delle cellule si trova nelle prime due classi di dominanza, il 40% è binoculare, e solo il 5% appartiene alla classe 5/6. Nessuna cellula trovata è di classe 7 (risponde solo all’occhio ipsilaterale).
È interessante ora notare l’alterazione della distribuzione a seguito dell’inattivazione del nucleo genicolato laterale dorsale (dLGN) mediante microiniezione di TTX: il 50% delle cellule è binoculare, il 2-3% è nelle prime due classi e la restante parte, quasi un 45%, nelle ultime due. È avvenuto un notevole shift a favore dell’occhio ispilaterale, laddove le cellule erano rimaste isolate dal contributo afferente diretto – controlaterale per il 95% – .
Ancora una volta è confermata la funzione del corpo calloso nella binocularità, con un contributo sensoriale proveniente dall’occhio ipsilaterale. Le fibre callosali, d’altronde, provengono da una corteccia, quella controlaterale, in cui l’occhio ipsilaterale è dominante.
Sono stati condotti studi volti a individuare la distribuzione delle classi di dominanza oculare a seguito dell’inattivazione della corteccia controlaterale con iniezioni di muscimolo (Restani et al., 2009). L’iniezione della tossina modifica profondamente l’aspetto della distribuzione (figura 5.3).
La quasi totalità delle cellule risponde esclusivamente all’occhio controlaterale ed è situata nelle prime due classi, circa il 20% risulta binoculare, e una percentuale esigua risponde anche all’occhio ipsilaterale.
In questo caso, venendo meno il contributo callosale, le cellule piramidali della corteccia visiva primaria sono isolate dagli ingressi provenienti dall’occhio ipsilaterale e quindi ancora meno binoculari rispetto al normale.
Fig. 5.3: shift delle classi OD a seguito di iniezione di MUSC e TTX.
L’istogramma mostra, a sinistra, una distribuzione normale di classi di dominanza oculare, con una preminenza di cellule binoculari e responsive all’occhio controlaterale.
Al centro, invece, la stessa a seguito di inattivazione della corteccia controlaterale mediante iniezione di muscimolo. Si nota un notevole spostamento delle colonne verso le prime classi e la sensibile diminuzione delle cellule binoculari.
A destra, la distribuzione delle classi di dominanza laddove il nucleo genicolato laterale sia stato inibito con TTX. Lo spostamento è speculare al precedente: scomparsa delle cellule che rispondono maggiormente all’occhio controlaterale, abbondanza di cellule binoculari e di cellule delle categorie 5/6 e 7, rispondenti maggiormente agli stimoli provenienti dall’occhio ipsilaterale.
5.1.5 – Il contributo del corpo calloso nella binocularità è ristretto al meridiano verticale
Sono stati effettuati studi che correlano la distribuzione delle classi di dominanza oculare (OD) con la posizione dei loro campi recettivi rispetto al meridiano verticale (RF), ovvero il segmento medio di sovrapposizione dei campi visivi dei due occhi. (Restani et al., 2009, Caleo et al., 1999, Gordon and Stryker, 1996).
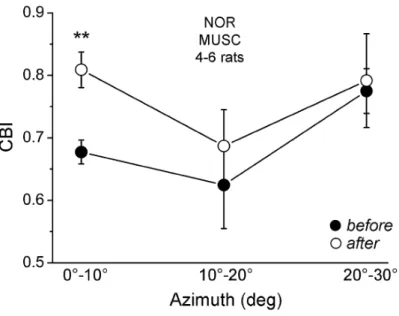
La binocularità risulta massima nei 20° di distanza dal meridiano verticale per ciascun emicampo visivo, e la predominanza dell’occhio controlaterale aumenta all’aumentare della distanza dal meridiano, verso la periferia del campo visivo (figura 5.2, cerchietti neri, da Restani et al., 2009).
Il confronto di questi dati con quelli relativi alla stessa distribuzione a seguito della iniezione di muscimolo in corteccia controlaterale (inibizione delle fibre callosali, cerchietti bianchi in figura 5.2), hanno portato a dimostrare che il ruolo del corpo calloso nella binocularità è ristretto alla porzione corticale il cui campo recettoriale si estende in corrispondenza del meridiano verticale, e nelle sue immediate vicinanze (fino a 20° per ciascun lato).
Fig. 5.2: relazione fra OD e posizione del campo recettivo, pre e post muscimolo. Il grafico illustra la relazione fra CBI (contralateral bias index), indice della
supremazia dell’occhio controlaterale su quello ipsilaterale, in funzione della distanza in gradi dal meridiano verticale. Nell’animale normale, cerchietto nero, si nota che tale indice è minimo, ovvero la corteccia è più binoculare, nell’intorno dei 20°. Cresce rapidamente dopo i 20° verso la periferia dove, nella emicorteccia visiva primaria, diventa preminente l’occhio controlaterale. Il grafico mostra la stessa distribuzione a seguito dell’iniezione di muscimolo nella corteccia controlaterale.
In questo caso, cerchietto bianco, l’indice è significativamente più elevato anche nelle zone intorno e precedenti ai 20° di distanza dal meridiano verticale. Ciò indica, ancora una volta, l’importanza nelle afferenze callosali - input ipsilaterali – nella realizzazione della binocularità. Da Restani et al., 2009.
5.2 – Soppressione interoculare nella corteccia visiva
La prima parte del lavoro sperimentale si è concentrata sullo studio del contributo callosale alla realizzazione della binocularità in corteccia visiva primaria. È stato qui dimostrato che il calloso vi contribuisce apportando prevalentemente input provenienti dall’occhio ipsilaterale.
A questo punto, nella seconda parte, si è indagato il rapporto interoculare, partendo da due presupposti.
Il primo riguarda la composizione dei tratti ottici e, di conseguenza, delle afferenze talamo-corticali. Come è stato già osservato, il 95% degli assoni del nervo ottico decussa al livello del chiasma. La maggior parte della componente retinica, ben oltre la sola componente nasale, si fa controlaterale associandosi alla componente temporale degli assoni del nervo ottico dell’altro occhio.
Per ogni tratto ottico diretto al talamo, e per ogni fascio talamo-corticale diretto alla corteccia visiva, si avrà dunque un forte sbilanciamento a favore dell’occhio controlaterale.
La seconda considerazione riguarda la natura delle afferenze talamo-corticali. È noto da tempo che tale via non veicola solo segnali di natura eccitatoria. Registrazioni intracellulari rivelano un segnale composto da due componenti: la prima eccitatoria (EPSP) seguita da una inibitoria (IPSP). Il talamo dunque proietta sui neuroni piramidali corticali direttamente, e indirettamente attraverso interneuroni inibitori. Queste cellule, come già enunciato nel caso della corteccia visiva, sono interneuroni parvalbuminergici, e somatostatinergici, di natura GABAergica. La figura 4.8 illustra a tal proposito una circuiteria esemplificativa.
Integrando i due concetti abbiamo formulato una previsione: che le afferenze dell’occhio controlaterale, in netta maggioranza, esercitino altresì una inibizione altrettanto forte sui neuroni piramidali.
Si è proceduto col registrare in corteccia i potenziali visivi evocati (VEP) nella zona binoculare. Successivamente, si è operato registrando i potenziali visivi dopo inibizione dell’attività di un occhio con tetrodotossina.
Così facendo, i risultati hanno mostrato che inibendo l’occhio controlaterale, i VEP registrati dall’occhio ipsilaterale aumentavano significativamente di ampiezza.
Non accadeva il viceversa, ovvero i potenziali relativi all’occhio controlaterale non si modificavano a seguito dell’inattivazione dell’occhio ipsilaterale. I dati confermano quanto previsto, e sono corroborati da esperimenti di controllo che prevedono l’iniezione intraoculare di soluzione salina in sostituzione della tossina: in nessuno di questi casi si registravano variazioni significative dell’ampiezza dei VEP in corteccia.
5.2.1 – Efficacia del trattamento con TTX per l’inattivazione dell’occhio
Le iniezioni di tetrodotossina sono state effettuate direttamente nel bulbo oculare, con una pipetta di vetro, anteriormente all’ora serrata. L’efficacia del trattamento è stata verificata con due tipi di osservazioni diverse, preliminari agli studi appena descritti.
In primo luogo, localmente è possibile assistere alla inibizione dell’attività oculare che si palesa con un riflesso di midriasi.
L’inibizione delle cellule ganglionari della retina, da parte della tossina, toglie anche l’innervazione dei centri del collicolo superiore che si occupano del controllo del diametro pupillare.
La dilatazione della pupilla occorre nei minuti successivi all’inoculazione della tossina, ed è indice della scomparsa dell’attività elettrica retinica.
Il secondo tipo di osservazioni si effettua in corteccia visiva, ove si assiste alla scomparsa di potenziali visivi evocati (VEP) guidati dall’occhio iniettato, rispetto alla situazione prima del trattamento.
5.2.2 – Soppressione interoculare e strabismo: implicazioni cliniche
Lo strabismo, o disallineamento degli assi dei due occhi, è un disordine visivo comune nella specie umana ed stato osservato anche in scimmie allevate in cattività (Kiorpes and Boothe, 1981). Degli occhi in posizione frontale, come quelli dei primati, che consentono un’ampia visione stereoscopica con una notevole sovrapposizione dei due campi visivi, esigono dei movimenti di coordinazione estremamente fini che consentano il loro allineamento ad ogni distanza focale, e il puntamento di oggetti in movimento. La coordinazione dei due assi è fondamentale per produrre due immagini geometricamente sovrapponibili.
Tuttavia, in molti casi umani di strabismo sopraggiunto in età puerile, o congenito, non si assiste alla diplopia (visione doppia) nonostante le immagini prodotte da ciascuna retina siano non sovrapponibili.
Questo notevole fenomeno di adattamento è attribuibile in parte a casi di Corrispondenza Retinica Anomala (ARC), in cui la superficie retinica è funzionalmente spostata per compensare l’angolo dello strabismo: le due immagini prodotte danno all’individuo una sensazione di direzione visuale unica, nonostante il disallineamento, e consentono una visione stereoscopica rudimentale (Schor, 1991).
Tuttavia, la situazione di gran lunga più comune è la soppressione dell’informazione da un occhio.
Questa occorrenza è stata ampiamente studiata, a partire dagli studi pionieristici di Hubel e Wiesel del 1965, in modelli di strabismo indotto chirurgicamente o otticamente con lenti devianti. In tutti i casi è stato rilevato che lo strabismo, sia convergente (esotropico), sia divergente (exotropico), conduca a una perdita di acuità visiva dell’occhio coinvolto (ambliopia, Hubel and Wiesel,1965; Yinon et al., 1975; Blakemore, 1976; Singer et al., 1980; Van Sluyters and Levitt, 1980; Mower et al., 1982; Tremain and Ikeda, 1982; Crewther and Crewther, 1990). Questa perdita di acuità evita i difetti della sommazione di immagini e della stereoscopia.
L’occhio dominante è l’occhio utilizzato abitualmente dai soggetti per la fissazione di immagini. Ci sono anche casi di occhio dominante oscillante, in cui la fissazione può essere effettuata con uno o l’altro occhio alternativamente. In questi casi, l’immagine proveniente dall’altro occhio è riferita come assente. Poco è noto sui siti e la natura di questi meccanismi soppressivi oscillanti, che si risolvono in una cecità virtuale dell’occhio non impegnato nella fissazione. I dati raccolti in soggetti umani, di natura psicologica, fanno derivare il fenomeno direttamente in corteccia (Blake and Lehmkuhle, 1976; Hess, 1991).
Altra osservazione interessante, riguarda il fatto che nella maggior parte dei casi di strabismo umano, la diplopia e la confusione sono evitate mediante la soppressione del campo visivo di un occhio, in particolare nei primi gradi del campo a partire dal meridiano centrale (Siretenau and Fronius, 1981; Siretenau, 1982).
Questa considerazione, unita al fatto che la soppressione avviene ad opera di una inibizione dalla corteccia, potrebbero collimare (nei limiti delle corrispondenze anatomiche e funzionali fra sistemi visivi di mammiferi diversi) con gli studi qui proposti sulla soppressione interoculare contrastata dagli ingressi callosali provenienti dalla corteccia controlaterale.
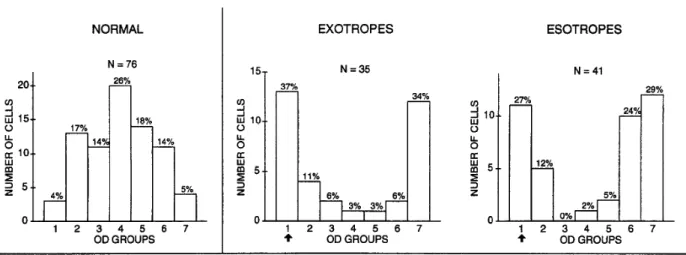
È stata indagata, da Sengpiel e collaboratori in uno studio del 1994, la distribuzione delle classi di dominanza oculare (OD) in gatti resi strabici chirurgicamente. I felini hanno una distribuzione delle classi di dominanza oculare diversa dai roditori, e più simile a quella umana. Presentano, infatti, una distribuzione normale di tipo gaussiano con una maggioranza di cellule binoculari e una distribuzione degradante simmetrica per ciascun lato verso le classi monoculari 1 e 7, mostrata in figura 5.4.
Poche cellule rispondono esclusivamente all’uno o all’altro occhio (circa il 10% del totale) e la restante parte è più o meno binoculare.
La distribuzione è profondamente alterata in caso di strabismo, sia convergente sia divergente, a favore delle classi 1 e 7. Negli animali trattati, le cellule in classe 4 (perfettamente binoculari) scompaiono quasi del tutto, mostrando una prevalenza di risposta all’uno o l’altro occhio (controlaterale, classe 1 o ipsilaterale, classe 7).
Fig. 5.4: shift delle classi OD in modelli di strabismo indotto chirurgicamente.
Gli istogrammi mostrano la distribuzione (secondo il modello a 7 classi di Hubel e Wiesel) normale – a sinistra – e alterata in seguito a strabismo divergente e convergente indotto chirurgicamente – al centro e a destra – su modello di gatto.
Modificato da Sengpiel et al., 1994.
La soppressione interoculare in cortecce di animali strabici è risultata essere indipendente dal reticolo di stimolo proposto, e stimoli presentati all’occhio non dominante sono in grado di esercitare una significativa soppressione degli stimoli presentati all’occhio dominante, solo se i neuroni registrati rispondevano già in maniera ottimale a stimoli provenienti da questo. La intersoppressione non si verifica per stimoli presentati contemporaneamente ai due occhi (Sengpiel et al., 1994).
La soppressione in questi modelli felini, è stato proposto, può dipendere da interazioni inibitorie fra colonne di dominanza oculare vicine, combinata con la perdita delle normali interazioni binoculari (Sengpiel et al., 1994).
La somiglianza trovata fra la soppressione in gatti strabici e la normale rivalità dei due occhi in cortecce binoculari, suggerisce che la soppressione dell’occhio dominante nello strabismo e la normale rivalità binoculare dipendano da meccanismi neuronali perlomeno simili (Sengpiel et al., 1994; Sengpiel and Blakemore, 1994).
5.2.3 – Modello sperimentale di aumento della pressione intraoculare
I risultati presentati sulla soppressione interoculare hanno dimostrato che l’occhio controlaterale esercita una forte inibizione funzionale sulle afferenze dell’occhio ipsilaterale sui neuroni piramidali della corteccia visiva primaria. Tali dati sono stati ottenuti mediante l’inibizione dell’occhio con microiniezioni di tetrodotossina (TTX). La sua efficacia nella inattivazione dell’occhio è comprovata, così come discusso in precedenza. La metodica, rivelatasi utile e duttile, presenta tuttavia delle limitazioni.
Si tratta di una procedura irreversibile, almeno nei tempi sperimentali utili. La tossina inibisce l’attività elettrica della retina in maniera non acuta ma cronica, impedendo di sondare la plasticità del sistema in tempi brevi e con impossibilità di un recupero. Dunque non è ripetibile su uno stesso animale.
Per questi motivi, ci si è rivolti ad un’altra procedura sperimentale, consistente nella inattivazione transiente dell’occhio mediante l’aumento di pressione intraoculare.
L’occhio dell’animale confinato entro apparato stereotassico è incannulato con un ago ipodermico, e l’umor vitreo messo in comunicazione con un circuito riempito di soluzione cefalorachidiana artificiale (ACSF). L’utilizzo di liquor artificiale si è reso indispensabile per non alterare il potenziale elettrochimico dell’ambiente intraoculare (Resta et al., 2007).
La pressione necessaria e sufficiente a ottenere un effetto stabile ma reversibile, ovvero che non danneggi le strutture oculari, è riportato in letteratura essere di 90 mm Hg.
Tenendo conto di questo dato, è stata calcolata l’altezza alla quale collocare un recipiente di soluzione ACSF, per ottenere nella parte finale del circuito la pressione desiderata.
Tenendo conto che una colonna d’acqua di 10 m esercita una pressione (a livello del mare) di 760 mm Hg, si imposti la seguente proporzione:
10 m : 760 mm Hg = h : 90 mm Hg; ove h = 1,18 m
Il contenitore (il livello del liquido al suo interno) è dunque collocato a 1,18 m d’altezza rispetto all’asse orizzontale dell’occhio incannulato dell’animale.
Una piccola saracinesca è inserita nel circuito, subito prima dell’ago cannula. Azionandola, si può aprire o chiudere il circuito, aumentando o diminuendo così la pressione intraoculare. La pressione, al momento della chiusura del rubinetto, cala per fenomeni di microdispersione del fluido dai tessuti lesionati nell’intorno della perforazione, e probabilmente per fenomeni di riassorbimento e omeostasi interni all’occhio.
5.2.4 – Effetto dell’aumento della pressione intraoculare
L’aumento della pressione distende immediatamente le pareti del bulbo oculare determinando un aumento di dimensioni dell’intero occhio percepibile allo stereomicroscopio. Ciò accade solo se la perforazione è avvenuta correttamente, senza danneggiare eccessivamente i tessuti.
Particolare cura si è avuta nel gestire l’ago cannula, che è applicato subito prima dell’ora serrata, struttura altamente vascolarizzata, avendo cura di evitare il cristallino.
Il fenomeno della distensione è accompagnato dal riflesso di midriasi, meno pronunciato rispetto alla inattivazione per mezzo di tetrodotossina. Conferma dell’avvenuta inattivazione è la registrazione in corteccia dei potenziali visivi evocati (VEP) prima e dopo il trattamento.
Come mostrato nei risultati (figura 4.12) l’ampiezza del tracciato cala sensibilmente già dopo un minuto dall’apertura del rubinetto, e il segnale scompare dal secondo minuto in poi. Al quinto minuto il rubinetto viene chiuso e la pressione si assesta lentamente sui suoi valori fisiologici tanto da far riapparire, al decimo minuto, dei potenziali visivi evocati paragonabili a quelli riscontrati prima del trattamento.
L’aumento di pressione intraoculare determina una compressione dei capillari che vascolarizzano la retina, inducendo una sofferenza generalizzata che inibisce l’attività neuronale di scarica. Per compressioni non troppo intense e tempi ischemici sperimentalmente verificati, il sistema è in grado di ripristinare una corretta attività una volta cessato il trattamento.
Ci riserviamo, in futuro, di applicare questo protocollo agli esperimenti di soppressione interoculare descritti in questo studio.
Ci proponiamo altresì di applicarlo ad esperimenti riguardanti la Deprivazione Monoculare (MD): dati preliminari suggeriscono che l’occhio controlaterale deprivato perda il controllo dell’inibizione in corteccia visiva primaria e che la via diretta dell’occhio ipsilaterale, e soprattutto le afferenze callosali, acquisiscano maggiori territori corticali (Restani et al., 2009).