33
INTRODUZIONE ALLA
PARTE SPERIMENTALE
34
Lo scopo di questa tesi sperimentale è quello di individuare nuovi ligandi piridin-‐3-‐ carbossiammidici selettivi per il recettore cannabinoide CB2.
In seguito alla scoperta del sistema endocannabinoide, la ricerca in questo ambito finalizzata per eventuali applicazioni terapeutiche, è divenuta sempre più rilevante. Sono stati attualmente identificati e clonati due sottotipi recettoriali cannabinoidi, denominati rispettivamente CB1 e CB2.
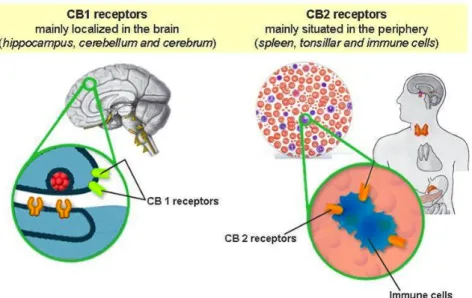
Il recettore CB1 è principalmente espresso nei neuroni del sistema nervoso centrale133 con densità più elevate nell’ippocampo, cervelletto e nello striato (Figura 20); queste aree controllano l’apprendimento, la memoria, la percezione sensoriale, la coordinazione e il movimento, i ricordi e le emozioni, la funzione ormonale e la temperatura corporea. Evidenze sperimentali hanno dimostrato la presenza del recettore CB1 anche in tessuti non-‐neuronali134 quali il tessuto adiposo, fegato, tratto gastrointestinale, pancreas, vescica, polmone, cuore, ecc.
Da studi iniziali sembrava che il recettore CB2 fosse espresso eclusivamente nelle cellule e nei tessuti del sistema immunitario come milza, timo e tonsille (Figura 20).135, 136 Recentemente, è stato evidenziato che il recettore CB2 potrebbe svolgere un rilevante ruolo funzionale nel sistema nervoso centrale, mediato primariamente dalle cellule della microglia; vari studi infatti hanno evidenziato che la stimolazione del recettore CB2 blocca l'attivazione delle cellule della microglia, senza interferire significativamente con il normale funzionamento dei neuroni centrali.
35
Figura 20. Principale localizzazione dei recettori CB1 e CB2.
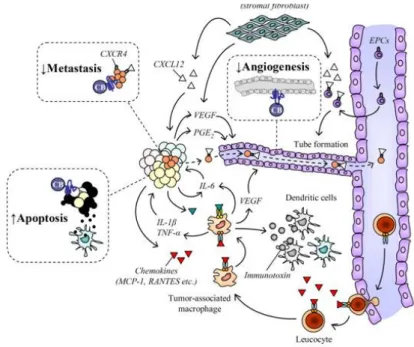
Per questo motivo negli ultimi anni, il recettore CB2 ha guadagnato l’attenzione come potenziale bersaglio per i suoi effetti immunomodulanti; è emerso infatti come target terapeutico per il trattamento di particolari condizioni infiammatorie e neurodegenerative come morbo di Parkinson, morbo di Alzheimer, morbo di Huntington, sclerosi multipla, sclerosi laterale amiotrofica (SLA) ma anche infarto, aterosclerosi, stati infiammatori gastrointestinali cronici e disturbi epatici. Inoltre è stato evidenziato un importante ruolo del recettore CB2 in tumori di diversa origine; studi in vitro e in modelli animali hanno mostrato che l'attivazione del recettore CB2 induce apoptosi, inibisce la crescita tumorale e inibisce la neo-‐angiogenesi;137 il meccanismo di tale azione potrebbe includere un effetto citotossico o citostatico (Figura 21).
36
Figura 21. Azione dei cannabinoidi su una cellula eteropatica tumorale.
Vari gruppi di ricerca che si occupano di "drug design and discovery" hanno mostrato, per questo motivo, un interesse sempre crescente verso lo sviluppo di potenti e selettivi CB2-‐agonisti privi degli effetti psicotropici centrali mediati dal sottotipo CB1.
All'interno di un programma di ricerca svolto nel laboratorio dove ho condotto la mia tesi, era stata precedentemente sviluppata una serie di derivati 1,8-‐naftiridin-‐4(1H)-‐ on-‐3-‐carbossammidici aventi struttura generale A (Figura 22).138-140
Figura 22. Struttura generale dei derivati 1,8-naftiridin-4(1H)-on-3-carbossammidici.
! !
""!
expressions remained unaffected.34 Therefore cannabinoids prevent blood vessel formation by inhibition vascular endothelial cell migration and survival. Cannabinoids induce apoptosis of tumor cells and suppress proangiogenic factor and MMP production, further blocking tumor growth and angiogenesis.!
Figure 14 Cannabinoid action and the heterotypic cell biology view of cancer.
Inflammatory cytokines, chemokines and lymphocytes represent critical elements of autocrine and paracrine signaling networks involved in tumor growth and metastasis. Tumor-derived chemokines, such as MCP-1 and RANTES, induce leukocyte cell migration into the tumor from the circulation, thus establishing the population of tumor-associated macrophages (TAMs). TAMs respond to the tumor by secreting various inflammatory cytokines including IL-1!, IL-6, and tumor necrosis factor-(TNF)-" which, in turn, promote proliferation of tumor cells, up-regulation of the VEGF gene, induction of COX-2 and prostaglandin E2 (PGE2). VEGF and PGE2 released from tumor cells can then act on endothelial cells causing angiogenesis. TAM may also favor tumor escape from immune surveillance by producing immunotoxin molecules that induce dendritic cell inactivation. Stromal fibroblast fractions, named carcinoma-associated fibroblasts (CAFs), secrete elevated levels of stromal cell-derived factor 1 (SDF-1, also called CXCL12). This cytokine enhances CXCR4 receptor-mediated tumor progression trough recruitment of circulating endothelial progenitor cells (EPCs) into the tumor mass,
selettivi CB2-agonisti, privi quindi degli effetti psicotropici centrali mediati dal sottotipo
CB1, ha suscitato un interesse sempre crescente presso i gruppi di ricerca che si
occupano di "drug design and discovery".
Nel laboratorio in cui ho svolto la mia tesi sperimentale di laurea, era stata precedentemente sviluppata una serie di derivati
1,8-naftiridin-4(1H)-on-3-carbossammidici aventi struttura generale A (Figura 15).123-125
N N NH R2 O R1 O R3 A
Figura 15. Struttura generale dei derivati 1,8-naftiridin-4(1H)-on-3-carbossammidici.
Questi composti avevano mostrato in generale una significativa affinità per il sottotipo recettoriale CB2 con, in alcuni casi, valori di Ki dell'ordine del
sub-nanomolare. Tale affinità era accompagnata da un elevato grado di selettività rispetto al recettore CB1.
Uno studio di "molecular modeling" (a partire dalla struttura a raggi X della rodopsina bovina come "template" iniziale) accompagnato da uno studio di "docking" (che ha incluso ligandi cannabinoidi quali: WIN55212-2, anandamide e altri svariati ligandi cannabinoidi scelti in letteratura, tra cui una prima serie dei suddetti derivati
1,8-naftiridin-4(1H)-on-3-carbossammidici123 ed alcuni derivati indolici) aveva inoltre permesso di costruire modelli tridimensionali dei recettori cannabinoidi CB1 e CB2 e di
evidenziare le interazioni ligando-recettore determinanti per l'incremento della CB2
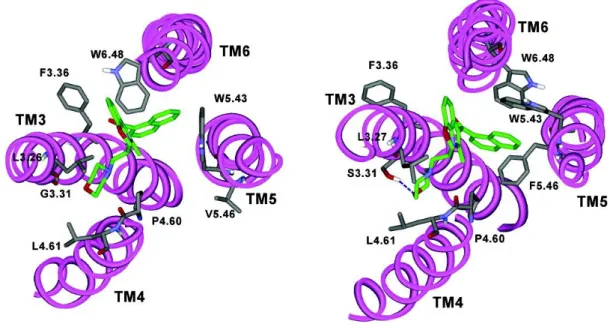
-affinità/selettività (Figure 16, 17 e 18).126 In base a questi modelli, le cavità di "binding" di entrambi i recettori sono risultate caratterizzate dalla presenza di una grande tasca lipofila (TM5 e TM6, Figura 17), corrispondente allo spazio occupato dagli anelli naftilico e indolico di WIN55212-2 (Figura 16) e da una tasca lipofila secondaria (TM3 e TM4, Figura 17), corrispondente alla posizione occupata dall'anello morfolinico (Figura 16). Inoltre, è stata evidenziata, nella cavità di "binding" del recettore CB2,
"#!$!! %&'()*+,*('-./!0%-1'(%/!!2,(3*+*0%-1'(%/!"203&'(%!
!
"4!$!! 5'5(*%6'(%/! 72)%&'(5'5(*%6'(%/! 5'5(*%8&'(%/! ! ,%-%&'(%/!!2,(3*+*,%-%&'(%!
"9!$!! )%&'(%!
R1 = etilmorfolina, benzile, p-‐fluorobenzile, n-‐ butile
R2 = cicloesile, 4-‐metilcicloesile, cicloeptile, fenetile, p-‐fluorofenetile
37
In generale questi composti avevano mostrato una significativa affinità per il sottotipo recettoriale CB2 accompagnata da un elevato grado di selettività verso lo stesso recettore.
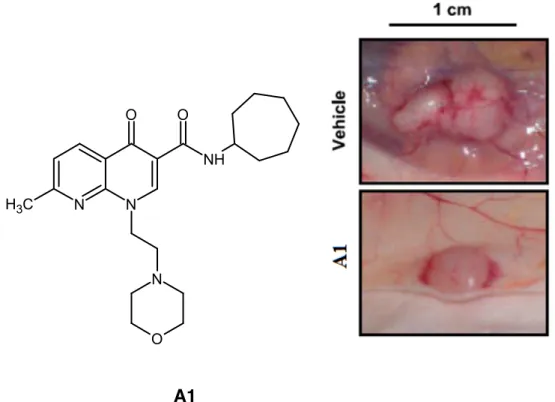
Saggi di binding utilizzando il GTPγS [35S] e studi funzionali sui basofili umani avevano dimostrato che questi derivati si comportavano come agonisti nei confronti dei recettori CB1 e CB2.141, 142 Inoltre uno di questi composti, che possedeva un’elevata affinità per il recettore CB2 e un buon grado di selettività per il recettore CB1, ha mostrato di possedere effetti antinocicettivi in vivo.142 Di maggiore importanza è stata l’evidenza di attività antitumorale del composto A1 (figura 23) in modelli sperimentali di cancro al colon; il tumore è stato generato in topi immunodeficienti mediante iniezione sottocutanea di cellule DLD-‐1, caratterizzate da una elevata espressione del recettore CB2. Come si può osservare dalla figura 23, il trattamento peritumorale con il derivato A1 ha ridotto significativamente la crescita del tumore del colon.143
A1
Figura 23. Struttura del derivato 1,8-naftiridin-4(1H)-on-3-carbossammidico e i suoi effetti sulla crescita del tumore del colon.
N N O O NH N N C H3 O O NH N O N H O O NH R N O R3 O NH R
38
Uno studio di "molecular modeling" (a partire dalla struttura a raggi X della rodopsina bovina come "template" iniziale) accompagnato da uno studio di "docking" (che ha incluso ligandi cannabinoidi quali: WIN55212-‐2, anandamide e altri svariati ligandi cannabinoidi riportati in letteratura)123 aveva permesso di costruire modelli tridimensionali dei recettori cannabinoidi CB1 e CB2 e di evidenziare le interazioni ligando-recettore determinanti per l'incremento della CB2- affinità/selettività (Figure 24).144In base a questi modelli, le cavità di "binding" di entrambi i recettori sono risultate caratterizzate dalla presenza di una grande tasca lipofila (TM5 e TM6, Figura 24) e da una tasca lipofila secondaria (TM3 e TM4, Figura 24) dove per il recettore CB2 è stata evidenziata una ulteriore possibile interazione dovuta alla presenza di una serina (S3.31), non presente nel recettore CB1 (Figura 24).
Figura 24. Docking di WIN55212-‐2 nel recettore CB1 (sinistra) e CB2 (destra).126
Allo scopo di incrementare la selettività e l’affinità per il recettore CB2, successivamente, sono state apportate modifiche strutturali a livello del nucleo centrale dei derivati a struttura generale A.
! !
26 un'area di interazione favorevole nell spazio occupato dal gruppo morfolinico (Figure 16 e 17).
Figura 16. Docking di WIN55212-2 nel recettore CB1 (sinistra) e CB2 (destra).126
Figura 17. Cavità di "binding" del recettore CB1 (sinistra) e CB2 (destra).126
In particolare, per quanto riguarda i derivati 1,8-naftiridin-4(1H)-on-3-carbossammidici, questo studio aveva suggerito che per preservare una buona CB2
39
A tal fine, inizialmente, il nucleo 1,8-‐naftiridin-‐4(1H)-‐one è stato sostituito con quello 1,8-‐naftiridin-‐2(1H)-‐one sviluppando perciò una serie di derivati 1,8-‐naftiridin-‐2(1H)-‐ on-‐3-‐carbossammidici aventi struttura generale B (Figura 25).
Figura 25. Struttura generale dei derivati 1,8-naftiridin-2(1H)-on-3-carbossammidici.
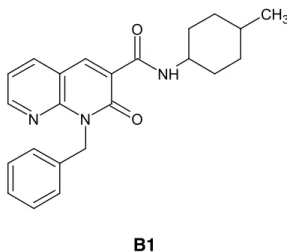
Questi composti hanno mostrato valori di affinità e selettività per il recettore CB2 migliori rispetto ai derivati precedentemente studiati. In particolare, uno di questi composti (B1, Figura 26) ha evidenziato una attività antiproliferativa nei confronti delle cellule Jurkat (linfoblasti T usati per studire la leucemia acuta dei linfociti T) con EC50=5.98 μM127 e in misura minore nei confronti della linea cellulare umana gliobastoma U87MG.
B1
Figura 26. Struttura del derivato 1,8-naftiridin-2(1H)-on-3-carbossammidico con attività antiproliferativa sulle cellule jurkat. ! ! 28
naftiridinico è stato rimpiazzato da un nucleo monociclico, ovvero è stata sviluppata una
serie di derivati 1,2-diidro-2-oxo-piridin-3-carbossammidici, aventi struttura generale C (Figura 21).128 N N NH O O N O 1 !!!!!! N N NH O N O O 2 Figura 19. L'N-cicloesil-1-(2-morfolino-4-il-etil)-1,8-naftiridin-4(1H)-on-3-carbossammide 1 (precedentmente pubblicato) è stato scelto come "lead" per lo sviluppo dei nuovi derivati. La sovrapposizione tra il composto di riferimento e l'analogo 1,8-naftiridin-2-(1H)-on-3-carbossammidico 2 (parte destra della figura) evidenzia un soddisfacente "overlap" delle caratteristiche strutturali ritenute importanti per la CB2-affinità, cioè il nucleo centrale lipofilo ed i sostituenti cicloesilico e morfolinico.127
N N O NH R2 O R1 B
Figura 20. Struttura generale dei derivati 1,8-naftiridin-2(1H)-on-3-carbossammidici.
C N O NH R2 O R1
Figura 21. Struttura generale dei derivati 1,2-diidro-2-oxo-piridin-3-carbossammidici.
"#!$!! %&'()*+,*('-./!0%-1'(%/!!2,(3*+*0%-1'(%/!"203&'(%! ! "4!$!! 5'5(*%6'(%/!72)%&'(5'5(*%6'(%/!5'5(*%8&'(%! "#!$!! %&'()*+,*('-./!0%-1'(%/!!2,(3*+*0%-1'(%/!"203&'(%! ! "4!$!! 5'5(*%6'(%/! 72)%&'(5'5(*%6'(%/! 5'5(*%8&'(%/! ! ,%-%&'(%/!!2,(3*+*,%-%&'(%! N N O O NH CH3 N N O N O O NH N N O N O O NH N O NH O R2 R C H3 N O O NH H R N O R2 O NH R
40
Inoltre studi funzionali sui basofili umani avevano evidenziato che i composti di tipo B si comportavano come agonisti dei recettori CB2.
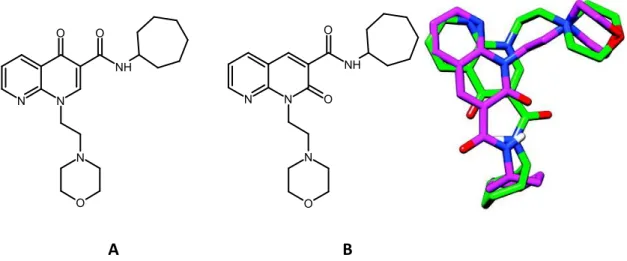
Infine, uno studio computazionale ha dimostrato che la sovrapposizione delle due strutture A e B presenta un soddisfacente “overlap” delle caratteristiche strutturali ritenute importanti per l’affinità nei confronti del recettore CB2 e cioè il nucleo centrale lipofilo, il sostituente carbossiammidico in posizione 3 e il sostituente in posizione 1 (Figura 27).
A B
Figura 27. La sovrapposizione di un composto a struttura generale A con l'analogo corrispondente a struttuta generale B evidenzia un soddisfacente "overlap" delle caratteristiche strutturali ritenute importanti per la CB2
-affinità, cioè il nucleo centrale lipofilo, il sostituente carbossiammidico in posizione 3 e il sostituente in posizione 1.
Come ulteriore sviluppo di questo lavoro di ricerca, recentemente, è stato ritenuto interessante verificare se la presenza di entrambi gli anelli aromatici del "core" centrale fosse essenziale per il legame di questi composti al recettore CB2. A tale scopo, il nucleo 1,8-‐naftiridin-‐2-‐one dei derivati a struttura generale B, è stato sostituito con un nucleo piridin-‐2-‐one; sono stati perciò sintetizzati derivati 1,2-‐diidro-‐ 2-‐oxo-‐piridin-‐3-‐carbossammidici, aventi struttura generale C (Figura 28).145
N N O O NH CH3 N N O N O O NH N N O N O O NH N O NH O R2 R C H3 N O O NH H R N O R2 O NH R ! !
28
naftiridinico è stato rimpiazzato da un nucleo monociclico, ovvero è stata sviluppata una
serie di derivati 1,2-diidro-2-oxo-piridin-3-carbossammidici, aventi struttura generale C
(Figura 21).
128 N N NH O O N O 1 !!!!!! N N NH O N O O 2 Figura 19. L'N-cicloesil-1-(2-morfolino-4-il-etil)-1,8-naftiridin-4(1H)-on-3-carbossammide 1(precedentmente pubblicato) è stato scelto come "lead" per lo sviluppo dei nuovi derivati. La sovrapposizione tra il composto di riferimento e l'analogo 1,8-naftiridin-2-(1H)-on-3-carbossammidico 2 (parte destra della figura) evidenzia un soddisfacente "overlap" delle caratteristiche strutturali ritenute importanti per la CB2-affinità, cioè il nucleo centrale lipofilo ed i sostituenti cicloesilico e morfolinico.127
N
N
O
NH
R
2O
R
1B
Figura 20. Struttura generale dei derivati 1,8-naftiridin-2(1H)-on-3-carbossammidici.
C
N
O
NH
R
2O
R
1Figura 21. Struttura generale dei derivati 1,2-diidro-2-oxo-piridin-3-carbossammidici.
"#!$!! %&'()*+,*('-./!0%-1'(%/!!2,(3*+*0%-1'(%/!"203&'(%! ! "4!$!! 5'5(*%6'(%/!72)%&'(5'5(*%6'(%/!5'5(*%8&'(%! "#!$!! %&'()*+,*('-./!0%-1'(%/!!2,(3*+*0%-1'(%/!"203&'(%! ! "4!$!! 5'5(*%6'(%/! 72)%&'(5'5(*%6'(%/! 5'5(*%8&'(%/! ! ,%-%&'(%/!!2,(3*+*,%-%&'(%!
41
Figura 28. Struttura generale dei derivati 1,2-diidro-2-oxo-piridin-3-carbossammidici.
Lo "scaffold" monociclico permette la corretta orientazione del sostituente carbossammidico non aromatico in posizione 3 e del sostituente lipofilo in posizione 1 per l’interazione con il recettore CB2. La figura 29 mostra, per i due tipi di composti B e C, la corrispondenza spaziale dei gruppi ritenuti importanti per l’affinità verso il recettore CB2.
Figura 29. Corrispondenza dei gruppi farmacoforici dei derivati 1,8-naftiridin-2(1H)-onici (sinistra) e piridin- 2(1H)-onici (destra).128
I derivati monociclici hanno mostrato valori di binding piuttosto variabili, sia per quanto riguarda il recettore CB1 (valori di Ki da > 10000 nM fino a 43 nM) che per quanto riguarda il recettore CB2 (valori di Ki da 7900 nM fino a 7.8 nM) con valori di selettività in alcuni casi significativi. ! ! 28
naftiridinico è stato rimpiazzato da un nucleo monociclico, ovvero è stata sviluppata una
serie di derivati 1,2-diidro-2-oxo-piridin-3-carbossammidici, aventi struttura generale C (Figura 21).128 N N NH O O N O 1 !!!!!! N N NH O N O O 2 Figura 19. L'N-cicloesil-1-(2-morfolino-4-il-etil)-1,8-naftiridin-4(1H)-on-3-carbossammide 1 (precedentmente pubblicato) è stato scelto come "lead" per lo sviluppo dei nuovi derivati. La sovrapposizione tra il composto di riferimento e l'analogo 1,8-naftiridin-2-(1H)-on-3-carbossammidico 2 (parte destra della figura) evidenzia un soddisfacente "overlap" delle caratteristiche strutturali ritenute importanti per la CB2-affinità, cioè il nucleo centrale lipofilo ed i sostituenti cicloesilico e morfolinico.127
N N O NH R2 O R1 B
Figura 20. Struttura generale dei derivati 1,8-naftiridin-2(1H)-on-3-carbossammidici.
C N O NH R2 O R1
Figura 21. Struttura generale dei derivati 1,2-diidro-2-oxo-piridin-3-carbossammidici.
"#!$!! %&'()*+,*('-./!0%-1'(%/!!2,(3*+*0%-1'(%/!"203&'(%! ! "4!$!! 5'5(*%6'(%/!72)%&'(5'5(*%6'(%/!5'5(*%8&'(%! "#!$!! %&'()*+,*('-./!0%-1'(%/!!2,(3*+*0%-1'(%/!"203&'(%! ! "4!$!! 5'5(*%6'(%/! 72)%&'(5'5(*%6'(%/! 5'5(*%8&'(%/! ! ,%-%&'(%/!!2,(3*+*,%-%&'(%! ! ! 29 Sulla base dei modelli recettoriali sopra descritti, lo "scaffold" monociclico avrebbe dovuto permettere la corretta orientazione del sostituente carbossammidico non aromatico in posizione 3, in grado di interagire con il residuo non conservato F5.46(197) e del sostituente lipofilo in posizione 1, recante l'accettore di legami a idrogeno, in grado di interagire con il residuo S3.31(112). La sovrapposizione farmacoforica mostrata in Figura 22 (derivati 1,8-naftiridin-2(1H)-onici e derivati
piridin-2(1H)-onici) conferma l'orientazione dei due sostituenti nel modo ipotizzato.128
Figura 22. Sovrapposizione farmacoforica dei derivati 1,8-naftiridin-2(1H)-onici (sinistra) e piridin-2(1H)-onici (destra).128
I derivati monociclici hanno mostrato dei dati di binding piuttosto variabili, sia per quanto riguarda il recettore CB1 (valori di Ki da > 10000 nM fino a 43 nM) che per
quanto riguarda il recettore CB2 (valori di Ki da 7900 nM fino a 7.8 nM). L'affinità e la
selettività di questi composti per il recettore CB2 sono risultate comunque significative,
sebbene inferiori rispetto a quelle dei derivati precedentemente studiati. Il nuovo "scaffold" piridin-2-onico ha conferito però migliori caratteristiche di solubilità a questo tipo di composti, dimostrandosi sicuramente utile per la progettazione e lo sviluppo di CB2-ligandi caratterizzati da una incrementata biodisponibilità.
Studi di "molecular modeling" riguardanti i derivati monociclici a struttra C, hanno rivelato la possibilità di inserire sostituenti in posizione 5 del nucleo piridin-2(1H)-onico. Infatti, come mostrato in Figura 23, proprio in questa zona del sito di binding del recettore CB2, è presente una regione "libera" in grado di accomodare sostituenti più o
meno ingombranti.
R1 = etilmorfolina, benzile, p-‐fluorobenzile, n-‐butile
42
In seguito, introducendo sostituenti di varia natura in posizione 5 del nucleo piridinico e ottenendo quindi i derivati aventi struttura generale D (Figura 30), è stato possibile ottenere maggiori informazioni circa le relazioni struttura-‐attività di questo tipo di composti.
Figura 30. Struttura generale dei derivati 1,2-diidro-2-oxo-piridin-3-carbossammidici sostituiti in posizione 5.
Nella Tabella 1 sono riportati i risultati di binding del composto di riferimento C1 e dei composti D più significativi; dai risultati ottenuti è evidente che la presenza del sostituente in posizione 5 determina in generale un aumento di affinità e in qualche caso di selettività verso il recettore CB2.
! ! 31 Pertanto, è stata progettata e sintetizzata una serie di derivati monociclici sostituiti in posizione 5 con gruppi più o meno ingombranti e dotati di diverse caratteristiche di lipofilicità (Strutture di tipo D, Figura 25).
D N O NH O R1 R3 R2
Figura 25. Struttura generale dei derivati 1,2-diidro-2-oxo-piridin-3-carbossammidici sostituiti in posizione 5.
Nei saggi di binding, i derivati di tipo D hanno mostrato dei buoni valori di affinità per il recettore CB2, in particolare nei casi in cui in posizione 5 era presente un
p-metossifenile (Ki = 1.03 nM), un fenile (Ki = 1.22 nM) o un p-fluorofenile (Ki = 2.85
nM). Tali derivati hanno mostrato inoltre degli apprezzabili livelli di CB2-selettività.
RAZI ONALE E SI NTESI CHI M I CA
Sulla base dei risultati precedentemente ottenuti, in particolare per quanto riguarda i derivati aventi struttura di tipo D, è stato ritenuto interessante intraprendere un progetto volto allo sviluppo di una serie di ligandi per i recettori cannabinoidi che presentassero una struttura nuova, ma comunque correlata a quella dei derivati monociclici 5-sostituiti. Tutto ciò, allo scopo di aumentare la diversità chimica delle molecole affini ai recettori cannabinoidi sintetizzate nel nostro laboratorio ed eventualmente di migliorare ancora i livelli di affinità e di CB2-selettività. Il lavoro di questa tesi sperimentale di
laurea è stato dedicato proprio al suddetto progetto.
La "scaffold" di base preso in considerazione è stato quello bifenilico, opportunamente sostituito con appropriati raggruppamenti, in modo tale da "ricalcare" la struttura chimica dei derivati monociclici 5-sostituiti. Sono stati pertanto progettati i nuovi derivati aventi struttura generale E (Figura 26).
"#!$!! !%&'()*)+,-./',0!,1/'2)*&)'/-3"! !
"4!$!! 5/5'),61/',0!7%2,1/'5/5'),8/',! !
"9!$!! &,-/',0! !%2,1)88/&,-/',0! !%&'()*)&,-/',0!
43 Tabella 1. Ki(nM) R1 R2 CB1 CB2 SI C1 p-‐fluorobenzile H 43 7.8 5.5 D1 p-‐fluorobenzile fenile 35 1.2 29 D2 p-‐fluorobenzile p-‐metossifenile 63 1.0 63 D3 p-‐fluorobenzile Br 8.8 2.2 4 D4 etilmorfolina Br 243 65 3.7 D5 n-‐Bu Br 23 5.1 4.5 D6 p-‐fluorobenzile p-‐fluorofenile 24 2.8 8.6 D7 etilmorfolina p-‐fluorofenile 2734 63 43.4 D8 p-‐fluorobenzile Trans-‐fenilvinile 24 7.9 3.0 D9 p-‐fluorobenzile etilacrilato 24.8 13.7 1.8 N R1 O N H O R2
44
Di particolare importanza con saggi di binding che utilizzano GTPγS [35S], è stato dimostrato che i composti D1 e D2 analoghi del derivato C1 precedentemente studiato e caratterizzati in posizione 5 del nucleo piridinico, dalla presenza di un fenile (D1) o di un p-‐metossifenile (D2), possiedono rispettivamente attività agonista inversa e antagonista neutrale (Figura 31).
D1 C1 D2
CB2 agonista inverso CB2 agonista CB2 antagonista neutrale
Figura 31.
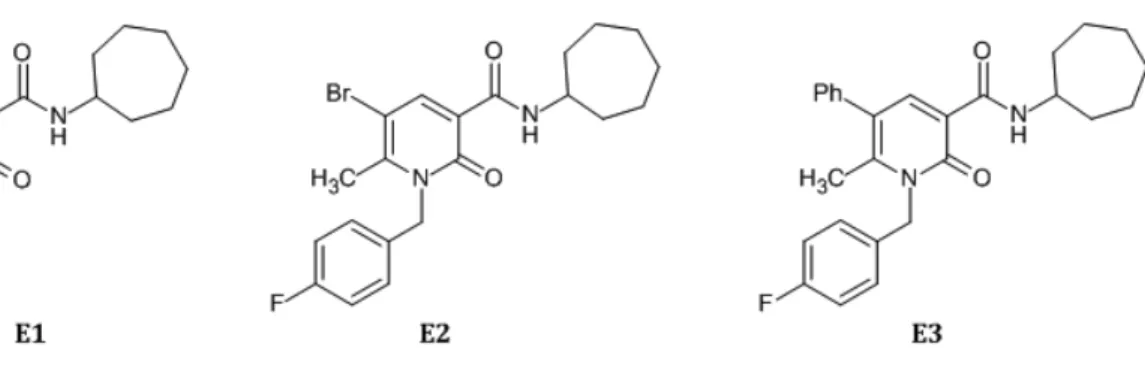
Lo scopo della mia tesi è stato quello di investigare l’effetto di un metile in posizione 6 nei composti D ai fini della affinità, selettività ed attività sui recettori CB2. In particolare durante la mia tesi sperimentale ho sintetizzato i composti E1, E2 ed E3 (Figura 32) caratterizzati da un metile in posizione 6 e in posizione 5 da un bromo o da un fenile che nei derivati D erano risultati significativi per l’affinità verso il recettore CB2.
45
I sostituenti in posizione 1 (etilmorfolina e p-‐fluorobenzile) sono stati scelti sulla base dei risultati ottenuti con i derivati precedentemente studiati di formula generale A, B, C e D.
I composti di tipo E sono stati da me sintetizzati secondo le vie sintetiche riportate negli Schemi 1 -‐ 4.
L’acido 2-‐idrossi-‐6-‐metilpiridin-‐3-‐carbossilico commerciale è stato convertito, come riportato nello Schema 1, per riscaldamento a 80 °C con metanolo e acido solforico, per 24 h, nel corrispondente metil-‐estere 1; in alternativa il prodotto è stato ottenuto anche dalla stessa reazione condotta in microonde a 90 °C per 60 minuti (potenza 200W, pressione 100 psi, senza agitazione).
Il trattamento dell’estere 1 con cicloeptilammina e riscaldamento a 150 °C per 48 h ha fornito l’ammide 2. L’ammide 2 trattata con Bromo a temperatura ambiente sotto agitazione per una notte, ha portato al corrispondente composto 3 bromurato in posizione 5, con resa dell’83 % (Schema 1).
Come mostrato nello Schema 2, il trattamento del derivato 3 in DMF anidro con Cs2CO3 sotto agitazione per 1 h a temperatura ambiente e successivamente con 4-‐(2-‐ cloroetil)-‐morfolina cloridrato a 50° C per 48 h, ha portato ad un grezzo di reazione che per purificazione mediante cromatografia su colonna di gel di silice, usando come miscela eluente esano/acetato di etile 7:3, ha fornito il derivato desiderato E1 insieme al composto 4 sostituito in posizione 2. La struttura dei composti E1 e 4 è stata determinata sulla base dei dati degli spettri 1H-‐NMR nei quali il multipletto del – CH2 legato all’azoto viene a cadere a campi più alti (ppm più bassi) nel composto E1 rispetto al segnale del multipletto del –CH2 legato all’ossigeno nel composto 4 (Figure 33, 34).
46 E1 Figura 33. 1H-NMR di E1: (CDCl3) δ (ppm): 9.61 (bd, 1H, NH), 8.58, (s, 1H, H4), 4.37-4.01 (m, 3H, CH2/NCH), 3.80-3.55 (m, 4H, morfolina), 2.75-2.41 (m, 4H, CH2/morfolina), 2.18 (s, 3H, CH3), 2.01-1.18 (m, 12H, cicloeptile). ! ! ! ! ! ! ! ! ! ! Reagenti e Condizioni:
(i): DMF, Cs2CO3, 4-(2-cloroetil)-morfolina cloridrato, 50°C, 48 h.
Reagenti e Condizioni:
(i): DMF, Cs2CO3, 4-(2-cloroetil)-morfolina cloridrato, 50°C, 48h. SCHEMA 2 N H C H3 O Br O NH N Br C H3 O O NH N O N Br C H3 O O NH N O + 3 E1 4 i
47 4 Figura 34. 1H-NMR di 4: (CDCl3) δ (ppm): 8.54, (s, 1H, H4), 8.00 (bd, 1H, NH), 4.61-4.48 (m, 2H, CH2), 4.28-4.09 (m, 1H, NCH), 3.81-2.69 (m, 4H, morfolina), 2.84-2.75 (m, 2H, CH2), 2.65-2.43 (m, 7H, CH3/morfolina), 2.15-1.18 (m, 12H, cicloeptile).
Il composto E2 p-‐fluorobenzilsostituito è stato ottenuto come riportato nello Schema 3, secondo una via di sintesi analoga a quella utilizzata per ottenere il composto E1; anche in questo caso dal grezzo di reazione purificato mediante cromatografia su
! ! ! ! ! ! ! ! ! ! Reagenti e Condizioni:
(i): DMF, Cs2CO3, 4-(2-cloroetil)-morfolina cloridrato, 50°C, 48 h. Reagenti e Condizioni:
(i): DMF, Cs2CO3, 4-(2-cloroetil)-morfolina cloridrato, 50°C, 48h. SCHEMA 2 N H C H3 O Br O NH N Br C H3 O O NH N O N Br C H3 O O NH N O + 3 E1 4 i
48
colonna di gel di silice, usando come miscela eluente esano/acetato di etile 7:3, è stato isolato il derivato 5 sostituito in posizione 2.
Per ottenere i derivati 5-‐fenilsostituiti, il derivato 3, come riportato nello Schema 4, è stato sottoposto ad una reazione di cross-‐coupling; la reazione è stata condotta sotto azoto impiegando acido fenilboronico secondo le condizioni di Suzuki, usando trifenilfosfina come catalizzatore ed una soluzione acquosa di Na2CO3 2M come base; il Tetrakis D-‐trifenilfosfinopalladio (0) è stato preparato in situ usando trifenilfosfina e palladio acetato. La miscela è stata fatta reagire in microonde (CEM) a 110 °C per 60 minuti (potenza 200 W, pressione 100 psi, solvente n-‐butanolo, sotto agitazione) per ottenere il derivato 5-‐fenilsostituito 6.
Infine, il derivato 6 in DMF anidro, trattato con Cs2CO3 sotto agitazione per 1h a temperatura ambiente e poi con 4-‐fluorobenzilcloruro, a 50 °C per 48 h, ha fornito un grezzo di reazione dal quale, per purificazione mediante cromatografia su colonna di gel di silice usando come miscela eluente esano/acetato di etile 7:3, sono stati ottenuti il derivato N-‐sostituito desiderato E3 e il corrispondente derivato 7 sostituito in posizione 2.