CAP. 3 RISULTATI E DISCUSSIONE
3.1 DETERMINAZIONE DEI METALLI PESANTI
L’elutriato, o fase acquosa estraibile, è una matrice ambientale in grado di replicare i fenomeni di mobilizzazione del sedimento e quindi di rilasciare, in condizioni particolari, dei contaminanti dal sedimento verso la colonna d’acqua.
Generalmente, la metodica di preparazione degli elutriati prevede un rapporto sedimenti:acqua di mare 1:4 (w:v) (Miniero et al., 2005), mentre per quanto riguarda i tempi di elutriazione non vi è una procedura standardizzata; alcuni autori riportano 30 minuti, altri 1 ora, altri ancora 8 o 24 ore (Arizzi Novelli et al., 2006). L’effetto del tempo di elutriazione sul rilascio dei metalli da parte del sedimento è stato quindi valutato nell’arco di 24 ore utilizzando il sedimento della stazione 1. Al termine delle 24 h la fase acquosa è stata separata dai sedimenti attraverso una prima fase di decantazione (30 minuti), seguita da una fase di centrifugazione (7000 rpm;15 min) e successiva filtrazione del sopranatante con filtri da 0,2 µm (Millipore).
Per la determinazione della concentrazione dei metalli in tracce negli elutriati è stata utilizzata la voltammetria di ridissoluzione anodica (AVS) con elettrodo (catodo) a film di mercurio. Sono state determinate, in ciascuno degli elutriati, le concentrazioni di tre metalli pesanti: Cadmio (Cd), Piombo (Pb), Rame (Cu).
I risultati, mostrati in figura 3.1, indicano che il rilascio di Cd e Pb si mantiene sempre a livelli piuttosto bassi nell’arco di tutto l’esperimento, mentre il Cu viene rilasciato piuttosto velocemente nel corso delle prime ore, poi la velocità di rilascio rallenta fino a raggiungere un plateau dopo la ventesima ora. Questo andamento del rilascio del Cu indica che per raggiungere un equilibrio fra fase solida e fase acquosa è necessario un tempo di agitazione superiore alle 20 ore. Per questo motivo sono state scelte le 24 ore come tempo di elutriazione per i nostri esperimenti.
tempo (h) 0 5 10 15 20 25 30 C u, Cd , P b (n M ) 0 20 40 60 80 Cu Cd Pb
Nella tabella seguente, sono riportate le concentrazioni dei metalli pesanti misurate per ciascuna delle stazioni campionate. Le concentrazioni sono espresse in nM.
Stazioni [Cd] [Pb] [Cu] nM nM nM 1 27 ± 6 b.d. 13 ± 6 2 40 ± 4 b.d. 12 ± 1 3 37 ± 3 0,3 ± 0,1 16 ± 2 4 49 ± 5 0,3 ± 0,1 10 ± 2 5 40 ± 12 1 ± 0,5 12 ± 4 6 48 ± 5 0,5 ± 0,3 8 ± 1 7 47 ± 7 0,5 ± 0,2 7 ± 0,5 8 38 ± 8 1,5 ± 0,5 17 ± 5 9 167 ± 15 0,6 ± 0,2 53 ± 5 10 153 ± 12 0,3 ± 0,2 24 ± 6 11 59 ± 6 1 ± 0,2 11 ± 2 12 230 ± 26 0,6 ± 0,2 57 ± 7
Tabella 3.1: concentrazioni (nM) di Cd, Pb, Cu, nelle dodici stazioni campionate. Le concentrazioni dei metalli sono valori medi di tre repliche ± S.D.
I risultati mostrano moderate concentrazioni di questi metalli nelle prime stazioni, mentre elevata concentrazione si è riscontrata nelle stazioni St 9, St 10, St 12, soprattutto per quanto riguarda la presenza di Cadmio.
3.2 CEPPO D7
GENOTOSSICITA’
Per l’esecuzione degli esperimenti di citotossicità e genotossicità è stato utilizzato il ceppo D7 di lievito Saccharomyces cerevisiae sul quale è stato valutato l’effetto dell’elutriato, ottenuto dal trattamento dei sedimenti marini presi in esame. Le prove sono state eseguite a differenti fasi di crescita cellulare del lievito.
Sono state allestite prove preliminari in fase di crescita stazionaria (dati non mostrati). Successivamente sono state effettuate prove in fase di crescita a due ore e in fase di crescita logaritmica.
La sopravvivenza (Sop %) è stata stimata come numero di colonie cresciute su terreno completo (A). E’ stata determinata la media e la relativa deviazione standard per ciascuno dei campioni analizzati, con un n° dati = 18. L’effetto degli elutriati dei campioni sulla sopravvivenza del lievito, è stato confrontato con il controllo.
Le frequenza di Conversione e Reversione sono state stimate come numero di colonie cresciute su terreni minimi (B,C). Sono state determinate, sia per la conversione genica (CG) che per la mutazione puntiforme (MP), le medie con le relative deviazioni standard per ciascuno dei campioni analizzati, con un n° dati = 18. Le frequenze di conversione e reversione dei trattati sono state confrontate con il controllo.
Per l’analisi statistica dei dati, per tutti gli esperimenti effettuati, è stato utilizzato il test “t” di student per il confronto di due campioni indipendenti ( trattato e controllo). Si è valutato come livello di significatività (*) un p ≤ 0,05. (Camussi et al, 1986).
I risultati degli esperimenti in fase di crescita a 2 ore sono stati valutati anche mediante l’analisi delle rette di regressione e del coefficiente di correlazione lineare “r”.
3.3 Esperimenti in crescita
3.3.1 Fase in crescita a 2 ore
Nella tabella 3.2 sono mostrati i risultati dei saggi di genotossicità, eseguiti in cellule del ceppo D7 di Saccharomyces cerevisiae in fase precoce di crescita (2 ore) in presenza di elutriato ottenuto per ciascuna delle dodici stazioni campionate e somministrato
singolarmente alla dose di 500 μl.
Riepilogo risultati su sedimenti marini. Prove in crescita a 2 ore. TESI [Cd] nM [Pb] nM [Cu] nM SOP % CG MP
CONTROLLO 100 ± 0 0,66 ± 0,12 0,64 ± 0,11 CONTR s.w. 100 ± 0 0,69 ± 0,12 0,65 ± 0,11 ST 1 27 ± 6 n.d. 13 ± 6 97,36 ± 5,99 0,72 ± 0,12 0,86 ± 0,14 ST 2 40 ± 4 n.d. 12 ± 1 94,5 ± 7,67 0,65 ± 0,15 0,65 ± 0,13 ST 3 37 ± 3 0,3 ± 0,1 16 ± 2 99,73 ± 0,90 0.77 ± 0,11 0,33 ± 0,08 ST 4 49 ± 5 0,3 ± 0,1 10 ± 2 94,73 ± 6,60 0,42 ± 0,10 0,67 ± 0,15 ST 5 40 ± 12 1 ± 0,5 12 ± 4 98 ± 1,90 0,61 ± 0,13 0,75 ± 0,10 ST 6 48 ± 5 0,5 ± 0,3 8 ± 1 97,91 ± 4,70 0,80 ± 0,12 0,83 ± 0,15 ST 7 47 ± 7 0,5 ± 0,2 7 ± 0,5 92,29 ± 8,58 0,66 ± 0,15 0,63 ± 0,17 ST 8 38 ± 8 1,5 ± 0,5 17 ± 5 96,80 ± 6,41 0,86 ± 0,14 0,79 ± 0,16 ST 9 167 ± 15 0,6 ± 0,2 53 ± 5 63,50 * ± 8,28 1,07 * ± 0,15 1,02 * ± 0,17 ST 10 153 ± 12 0,3 ± 0,2 24 ± 6 74,87 * ± 7,32 0,98 * ± 0,13 1,00 * ± 0,18 ST 11 59 ± 6 1 ± 0,2 11 ± 2 91,30 ± 9,99 0,74 ± 0,17 0,73 ± 0,15 ST 12 230 ± 26 0,6 ± 0,2 57 ± 7 64,10 * ± 7,26 1,26 * ± 0,17 1,17 * ± 0,19
Negli istogrammi che seguono sono state messe in evidenza la sopravvivenza (SOP %), la conversione genica (CG) e la mutazione puntiforme (MP). Le stazioni sono state divise in due gruppi in modo da evidenziare quelle in cui non è stato osservato alcun effetto o comunque effetti non significativi, da quelle con effetti maggiormente evidenti e significativi.
CEPPO D7 ( crescita a 2 ore )
0 20 40 60 80 100 120 Controllo St 1 St 2 St 3 St 4 St 5 St 6 Stazioni ( St ) S o p ravvi ve n za ( % ) Sopravvivenza
Fig. 3.2: Effetto degli elutriati delle stazioni 1-6, sulla sopravvivenza del CEPPO D7 in fase di crescita a 2 ore.
CEPPO D7 ( crescita a 2 ore )
0 20 40 60 80 100 120 Controllo St 7 St 8 St 9 St 10 St 11 St 12 Stazioni ( St ) S o p ravvi ven za ( % ) Sopravvivenza
*
*
*
Fig. 3.3: Effetto degli elutriati delle stazioni 7-12, sulla sopravvivenza del CEPPO D7 in fase di crescita a 2 ore.
CEPPO D7 ( crescita a 2 ore )
0 0,2 0,4 0,6 0,8 1 Controllo St 1 St 2 St 3 St 4 St 5 St 6 Stazioni ( St ) C o nv er ta nt i/ 10 5 S o p rav v. Conversione Genica
Fig. 3.4: Effetto degli elutriati delle stazioni 1-6, sulla conversione genica del CEPPO D7 in fase di crescita a 2 ore.
CEPPO D7 ( crescita a 2 ore )
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 Controllo St 7 St 8 St 9 St 10 St 11 St 12 Stazioni ( St ) C o n ver ta n ti /10 5 S o p ravv . Conversione Genica
*
*
*
Fig. 3.5: Effetto degli elutriati delle stazioni 7-12, sulla conversione genica del CEPPO D7 in fase di crescita a 2 ore.
CEPPO D7 ( crescita a 2 ore )
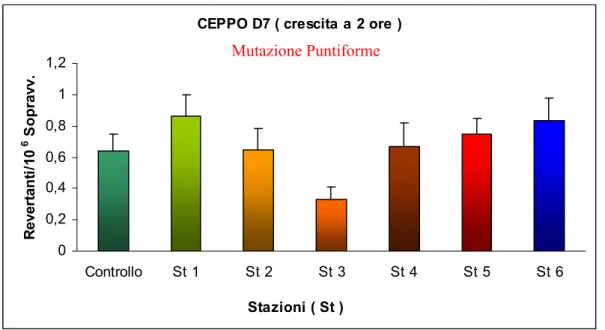
0 0,2 0,4 0,6 0,8 1 1,2 Controllo St 1 St 2 St 3 St 4 St 5 St 6 Stazioni ( St ) R ev er ta n ti/1 0 6 S o p rav v. Mutazione Puntiforme
Fig. 3.6: Effetto degli elutriati delle stazioni 1-6, sulla mutazione puntiforme del CEPPO D7 in fase di crescita a 2 ore.
CEPPO D7 ( crescita a 2 ore )
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 Controllo St 7 St 8 St 9 St 10 St 11 St 12 Stazioni ( St ) R ever ta n ti /1 0 6 S o p ravv. Mutazione Puntiforme
*
*
*
Fig. 3.7: Effetto degli elutriati delle stazioni 7-12, sulla mutazione puntiforme del CEPPO D7 in fase di crescita a 2 ore.
In base ai risultati ottenuti in laboratorio, relativamente alle prove in fase di crescita a 2 ore, sono stati riscontrati effetti significativi, sia citotossici che genotossici, per quanto riguarda gli elutriati estratti da tre delle dodici stazioni analizzate. In particolare si è osservata una diminuzione significativa della sopravvivenza (Sop %), rispetto al controllo, nei campioni delle stazioni 9, 10 e 12. E’ stato inoltre evidenziato un aumento significativo della conversione genica (CG)e della mutazione puntiforme (MP) nelle colture di lievito S. cerevisiae, inoculate con gli elutriati dei medesimi campioni.
Questo tipo di prove fornisce informazioni utili per valutare l’influenza degli xenobiotici durante le prime fasi di crescita cellulare, in quanto esistono alcune sostanze che agiscono quasi esclusivamente durante questa fase.
Per quanto concerne l’elutriato ottenuto dagli altri sedimenti, non sono stati riscontrati effetti significativi rispetto al controllo.
3.3.2 Rette di regressione
Al fine di valutare il legame di dipendenza di una variabile all’altra, sono state realizzate tre rette di regressione (Sop %, CG, MP), per esprimere la forza di tale legame in termini di correlazione. La costruzione delle tre rette è stata effettuata mediante la sommatoria (Σ) dei metalli pesanti delle dodici stazioni analizzate ed i rispettivi valori della sopravvivenza (Sop %), della conversione genica (CG)e della mutazione puntiforme (MP) ottenuti da ogni stazione.
La forza di questo legame è stata misurata determinando il coefficiente di correlazione
lineare “r”
Il valore di r varia tra -1 e 1:
Se r = ± 1 la correlazione è perfetta; Se r = 0 non esiste correlazione.
Le figure che seguono mostrano le tre rette di regressione. In ordinate sono riportati rispettivamente i valori della Sop (%), della CG e della MP del lievito S. cerevisiae, in fase di crescita a due ore, per le stazioni campionate; in ascisse è riportata la sommatoria del contenuto di metalli pesanti in ciascuna delle stazioni.
0 50 100 150 200 250 300
Sopr
av
vi
venza %
50 60 70 80 90 100 110 y = - 0,11x + 92,58 r = - 0,822 P = 0,00056* r2 = 0,675S[Me]
Σ [Me]
Fig. 3.8: retta di regressione per la Sop (%) del lievito D7 in fase di crescita a 2ore.
0 50 100 150 200 250 300 C o nv. / 10 5 sopr. 0.8 1.0 1.2 1.4 y = 0,94x + 1,20 r = 0,895 P = 0,0022* r2 = 0,80
Σ [Me]
0 50 100 150 200 250 300
Rev. / 10
6 s
opr.
0.8 0.9 1.0 1.1 1.2 1.3 1.4 y = 0,84x + 1,19 r = 0,94 P = 0,0001* r2 = 0,89Σ [Me]
Fig. 3.10: retta di regressione per la MP del lievito D7 in fase di crescita a 2ore.
Dai risultati ottenuti si è osservato un valore del coefficiente di correlazione “r” molto vicino all’unità. Ciò implica una correlazione tra contenuto di metalli pesanti ed effetto genotossico indotto sulle cellule di lievito S. cerevisiae.
Questa correlazione causa-effetto si è manifestata sia per quanto riguarda la sopravvivenza (Sop %) che per quanto concerne la conversione genica (CG) e la mutazione puntiforme (MP).
Avendo considerato un livello di significatività (*) p ≤ 0,005, si è visto come i risultati abbiano assunto, per tutte le rette di regressione, valori significativi.
3.3.3 Curve dose effetto
Per stabilire la quantità di elutriato da inoculare e per evidenziare l’influenza dei campioni somministrati sulla crescita del ceppo D7 di lievito S. cerevisiae, sono state realizzate delle prove in crescita a 2 ore utilizzando dosi crescenti di elutriato e andando a valutarne il possibile effetto citotossico. I risultati ottenuti sono mostrati nella tabella 3.3.
Prove in crescita a 2 ore. Sopravvivenza a diverse dosi di elutriato ( SOP % ) N=18 TESI 100 μl 250 µl 400 µl 500 µl 700 µl Controllo 100 ± 0 100 ± 0 100 ± 0 100 ± 0 100 ± 0 St 1 100 ± 0 100 ± 0 100 ± 0 97,36 ± 5,99 88.67 ± 2,06 St 2 100 ± 0 100 ± 0 93 ± 2.16 94,5 ± 7,67 83.80 ± 4.13 St 3 100 ± 0 100 ± 0 99,8 ± 0.18 99,73 ± 0,90 92.69 ± 4,46 St 4 100 ± 0 100 ± 0 92 ± 4,06 94.73 ± 6,60 86 ± 3,19 St 5 100 ± 0 100 ± 0 100 ± 0 98 ± 1,90 82 ± 2,80 St 6 100 ± 0 100 ± 0 100 ± 0 97,91 ± 4,70 98 ± 1,30 St 7 100 ± 0 100 ± 0 91.12 ± 3.27 92,29 ± 8,58 88.33 ± 3,53 St 8 100 ± 0 100 ± 0 100 ± 0 96,8 ± 6,41 92 ± 5,80 St 9 79 ± 3,60 78 ± 2.52 75 ± 3,45 63,50* ± 5,28 65.30* ± 2,75 St 10 86 ± 4,77 82 ± 3,57 81 ± 2,75 74,87* ± 7,32 68* ± 2,51 St 11 100 ± 0 100 ± 0 95.33 ± 4,08 91,30 ± 9,99 84.50 ± 3,57 St 12 79 ± 2.65 77.33 ± 3.60 77 ± 0.58 64,10* ± 7,26 64* ± 1,24 Tabella 3.3: Riepilogo dati SOP (%) a diverse dosi di elutriato. Rispettivamente medie e
Queste prove hanno evidenziato che fino alla dose di 400 μl i dodici elutriati saggiati
non hanno un potenziale citotossico. Alle dosi di 500 e 700 μl di elutriato sono stati
rilevati effetti significativi sulla sopravvivenza (Sop %) del ceppo D7, nelle colture cellulari inoculate con i campioni delle stazioni 9, 10, 12, peraltro già osservati negli esperimenti precedenti. Non sono state utilizzate dosi superiori di elutriato, per evitare una eccessiva diluizione delle cellule di lievito rispetto al volume complessivo del mezzo di coltura, e quindi per non allontanarsi da quelle che sono le condizioni sperimentali ottimali per questi saggi.
Le seguenti tabelle con i relativi grafici mostrano i risultati significativi ottenuti per le stazioni 9, 10, 12.
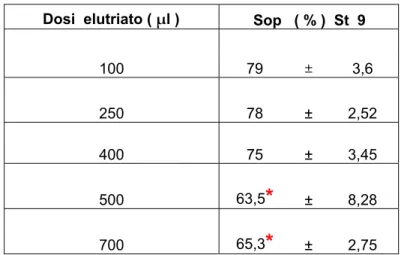
Dosi elutriato ( μl ) Sop ( % ) St 9
100 79 ± 3,6 250 78 ± 2,52 400 75 ± 3,45 500 63,5
*
± 8,28 700 65,3*
± 2,75Tabella 3.4: Sopravvivenza del ceppo D7 a diverse dosi di elutriato dalla stazione 9. Rispettivamente medie e deviazioni standard.
*
diminuzione significativa della sopravvivenza rispetto al controllo.Curva dose-effetto Stazione 9
50 55 60 65 70 75 80 85 90 95 100 100 250 400 500 700 Dosi Elutriato S o p ravvi ven za % ( µl )
*
*
Fig. 3.11: Curva dose-effetto sulla sopravvivenza del ceppo D7 inoculando l’elutriato della stazione 9.
*
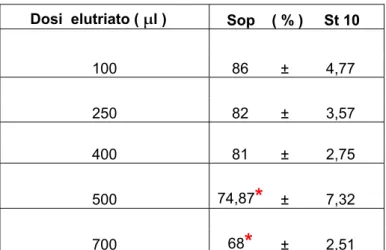
diminuzione significativa della sopravvivenza rispetto al controllo.Dosi elutriato ( μl ) Sop ( % ) St 10 100 86 ± 4,77 250 82 ± 3,57 400 81 ± 2,75 500 74,87
*
± 7,32 700 68*
± 2,51Tabella 3.5: Sopravvivenza del ceppo D7 a diverse dosi di elutriato dalla stazione 10. Rispettivamente medie e deviazioni standard.
*
diminuzione significativa della sopravvivenza rispetto al controllo.Curva dose-effetto Stazione 10
50 55 60 65 70 75 80 85 90 95 100 100 250 400 500 700 Dosi Elutriato S o p ravvi ven za % ( µl )
*
*
Fig. 3.12: Curva dose-effetto sulla sopravvivenza del ceppo D7 inoculando l’elutriato della stazione 10.
*
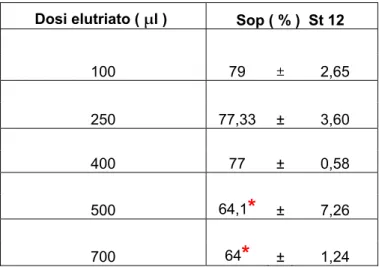
diminuzione significativa della sopravvivenza rispetto al controllo.Dosi elutriato ( μl ) Sop ( % ) St 12 100 79 ± 2,65 250 77,33 ± 3,60 400 77 ± 0,58 500 64,1
*
± 7,26 700 64*
± 1,24Tabella 3.6: Sopravvivenza del ceppo D7 a diverse dosi di elutriato dalla stazione 12. Rispettivamente medie e deviazioni standard.
*
diminuzione significativa della sopravvivenza rispetto al controllo.Curva dose-effetto Stazione 12
50 55 60 65 70 75 80 85 90 95 100 100 250 400 500 700 Dosi Elutriato S o p ravvi ven za %
*
*
( µl )Fig. 3.13: Curva dose-effetto sulla sopravvivenza del ceppo D7 inoculando l’elutriato della stazione 12.
*
diminuzione significativa della sopravvivenza rispetto al controllo.3.3.4 Crescita in fase logaritmica
Nella tabella 3.7, sono mostrati i risultati delle prove di genotossicità, eseguite su cellule del ceppo D7 di Saccharomyces cerevisiae in fase di crescita logaritmica (6 ore), in presenza di elutriato ottenuto per ciascuna delle dodici stazioni campionate e
somministrato singolarmente alla dose di 500 μl.
Riepilogo risultati su elutriato sedimenti. Prove in crescita a 6 ore. TESI [Cd] nM [Pb] nM [Cu] nM SOP % CG MP
CONTROLLO 100 ± 0 0,89 ± 0,08 0,74 ± 0,05 CONTR s.w. 100 ± 0 0,9 ± 0,10 0,78 ± 0,07 ST 1 27 ± 6 n.d. 13 ± 6 100 ± 0 0,97 ± 0,08 0,34 ± 0,04 ST 2 40 ± 4 n.d. 12 ± 1 92,33 ± 8,82 1,1 ± 0,15 0,66 ± 0,1 ST 3 37 ± 3 0,3 ± 0,1 16 ± 2 93,80 ± 9 0,94 ± 0,16 0,71 ± 0,09 ST 4 49 ± 5 0,3 ± 0,1 10 ± 2 87,50 ± 8,50 0,92 ± 0,12 0,71 ± 0,1 ST 5 40 ± 12 1 ± 0,5 12 ± 4 93 ± 7,98 1,1 ± 0,14 0,78 ± 0,08 ST 6 48 ± 5 0,5 ± 0,3 8 ± 1 98 ± 2,83 1,09 ± 0,15 0,74 ± 0,1 ST 7 47 ± 7 0,5 ± 0,2 7 ± 0,5 78 ± 4,58 1,21 * ± 0,12 0,87 ± 0,18 ST 8 38 ± 8 1,5 ± 0,5 17 ± 5 95,75 ± 6,65 0,86 ± 0,14 0,6 ± 0,18 ST 9 167 ± 15 0,6 ± 0,2 53 ± 5 67,67 * ± 9,12 1,12 * ± 0,14 2,15 * ± 0,22 ST 10 153 ± 12 0,3 ± 0,2 24 ± 6 71 * ± 8,04 1,29 * ± 0,15 2,28 * ± 0,24 ST 11 59 ± 6 1 ± 0,2 11 ± 2 93,20 ± 8,68 1,13 * ± 0,16 1,13 * ± 0,15 ST 12 230 ± 26 0,6 ± 0,2 57 ± 7 65 * ± 7,54 1,30 * ± 0,17 2,01 * ± 0,27
Negli istogrammi che seguono sono state messe in evidenza la sopravvivenza (SOP %), la conversione genica (CG) e la mutazione puntiforme (MP). Le stazioni sono state divise in due gruppi in modo da evidenziare quelle in cui non è stato osservato alcun effetto o comunque effetti non significativi, da quelle con effetti maggiormente evidenti e significativi.
CEPPO D7 ( crescita in fase log. )
0 20 40 60 80 100 120 Controllo St 1 St 2 St 3 St 4 St 5 St 6 Stazioni ( St ) S o p rav vi ve n za ( % ) Sopravvivenza
Fig. 3.14: Effetto degli elutriati delle stazioni 1-6 sulla sopravvivenza del CEPPO D7 in crescita in fase logaritmica.
CEPPO D7 ( crescita in fase log. )
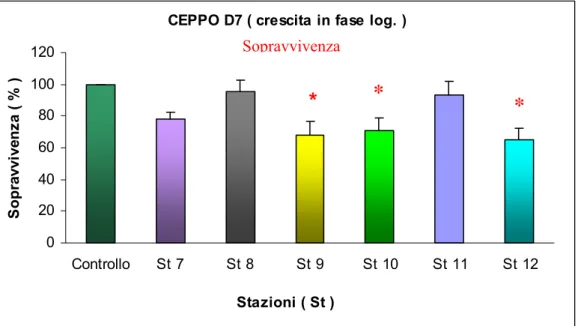
0 20 40 60 80 100 120 Controllo St 7 St 8 St 9 St 10 St 11 St 12 Stazioni ( St ) S o p ravvi ve n za ( % ) Sopravvivenza
*
*
*
Fig. 3.15: Effetto degli elutriati delle stazioni 7-12 sulla sopravvivenza del CEPPO D7 in crescita in fase logaritmica.
CEPPO D7 ( crescita in crescita log. )
0 0,2 0,4 0,6 0,8 1 1,2 1,4 Controllo St 1 St 2 St 3 St 4 St 5 St 6 Stazioni ( St ) C onv er ta nt i/ 10 5 S opr av v. Conversione Genica
Fig. 3.16: Effetto degli elutriati delle stazioni 1-6 sulla conversione genica del CEPPO D7 in fase di crescita a 2 ore.
CEPPO D7 ( crescita in fase log. )
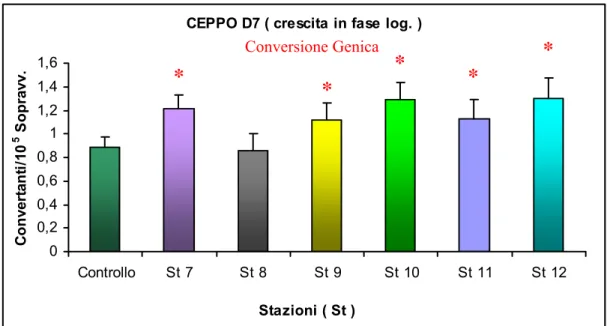
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 Controllo St 7 St 8 St 9 St 10 St 11 St 12 Stazioni ( St ) C onv er ta nt i/ 10 5 S opr av v.
*
Conversione Genica*
*
*
*
Fig. 3.17: Effetto degli elutriati delle stazioni 7-12 sulla conversione genica del CEPPO D7 in crescita in fase logaritmica.
CEPPO D7 ( crescita in fase log. )
0 0,2 0,4 0,6 0,8 1 Controllo St 1 St 2 St 3 St 4 St 5 St 6 Stazioni ( St ) R ever tan ti /1 0 6 S o p rav v. Mutazione Puntiforme
Fig. 3.18: Effetto degli elutriati delle stazioni 1-6 sulla mutazione puntiforme del CEPPO D7 in fase di crescita a 2 ore.
CEPPO D7 ( crescita in fase in log. )
0 0,4 0,8 1,2 1,6 2 2,4 2,8 Controllo St 7 St 8 St 9 St 10 St 11 St 12 Stazioni ( St ) R eve rt an ti /1 0 6 S o p ra vv.
*
*
Mutazione Puntiforme*
*
Fig. 3.19: Effetto degli elutriati delle stazioni 7-12 sulla sulla mutazione puntiforme del CEPPO D7 in fase di crescita a 2 ore.
I risultati ottenuti da queste ultime prove, hanno evidenziato effetti citotossici significativi per gli elutriati estratti da tre delle dodici stazioni analizzate. In particolare si è osservata una diminuzione significativa della sopravvivenza (Sop %) causata dall’inoculo dei campioni delle stazioni 9, 10 e 12. Si è osservato inoltre un aumento aumento significativo della conversione genica (CG) e della mutazione puntiforme (MP), nelle colture di lievito S. cerevisiae, inoculate con i campioni ottenuti dalle stazioni 9, 10, 11, 12. E’ stato riscontrato inoltre un aumento significativo della sola conversione genica nel caso della coltura in presenza dell’elutriato della stazione 7. Inoculando le colture cellulari con i campioni provenienti dalle stazioni 7 e 11, si sono riscontrati danni genotossici e non citotossici, con aumenti significativi della conversione genica e non della mutazione puntiforme per la stazione 7. Ciò è spiegabile per il fatto che i due fenomeni sono tra loro indipendenti, e che i due eventi genotossici si presentano con frequenze diverse. In particolar modo, la mutazione puntiforme risulta essere un evento ancor più raro della conversione genica.
I dati complessivi delle prove di crescita in fase logaritmica hanno confermato i risultati delle prove condotte in crescita a 2 ore, e hanno rivelato un potenziale genotossico anche per gli elutriati estratti da altre due stazioni. Ciò deriva dal fatto che durante questa fase di crescita le cellule del lievito sono più attive metabolicamente e più permeabili, rispetto alla fase di crescita a due ore; ciò consente un incremento della diffusione delle sostanze. Quindi nell’arco di sei ore (tempo necessario per il raggiungimento della fase logaritmica) le sostanze saggiate, compresi gli xenobiotici, possono penetrare più facilmente nelle cellule ed hanno più tempo per interferire con le attività cellulari ed in fluenzare il metabolismo.
Per quanto concerne l’elutriato ottenuto dai sedimenti delle stazioni 1-6, seppure siano state osservate delle variazioni relativamente alla citotossicità ed alla genotossicità non sono stati riscontrati effetti significativi e correlabili al contenuto di metalli pesanti.
Gli effetti di genotossicità maggiormente significativi rispetto al controllo, sono stati evidenziati nelle stazioni 9, 10, 12, nelle quali sono stati riscontrati i valori più alti del contenuto di metalli pesanti, in particolare quello del cadmio.
3.4 LEPIDIUM SATIVUM
FITOTOSSICITA’
Per l’esecuzione degli esperimenti di fitotossicità, sono stati utilizzati semi di Lepidium
sativum con i quali è stato valutato l’effetto dell’elutriato, ottenuto dal trattamento dei
sedimenti marini presi in esame, saggiato a differenti diluizioni.
- Sono stati calcolati il numero dei semi germinati e misurata la lunghezza media radicale;
- i risultati sono stati espressi come Indice di Germinazione Ig, ricavato dal prodotto relativo (controllo = 100) della germinazione per la lunghezza radicale:
Ig = Rt x Lt x 100
Rc x Lc
Dove Rt e Rc rappresentano rispettivamente la radicazione media nel trattamento e nel
controllo, e Lt e Lc le relative lunghezze medie radicali (Zucconi e De Bertoldi, 1983).
E’ stato calcolato l’ Indice di Tossicità (It):
It = 100 – Ig
Dove per 100 si considera l’ indice di germinazione del controllo e con Ig quello del trattamento.
Nella tabella 3.8, sono mostrati i risultati dei saggi di fitotossicità, eseguiti su semi di
Lepidium sativum. Ai semi (6-8 per piastra) è stato aggiunto 1ml di elutriato, ottenuto
per ciascuna delle dodici stazioni, tal quale (t.q.) e alle seguenti diluizioni: 1:5, 1:10, 1:20; (le diluizioni sono state effettuate con acqua distillata).
Il periodo di incubazione è stato di 24-36 ore alla temperatura di circa 27 °C.
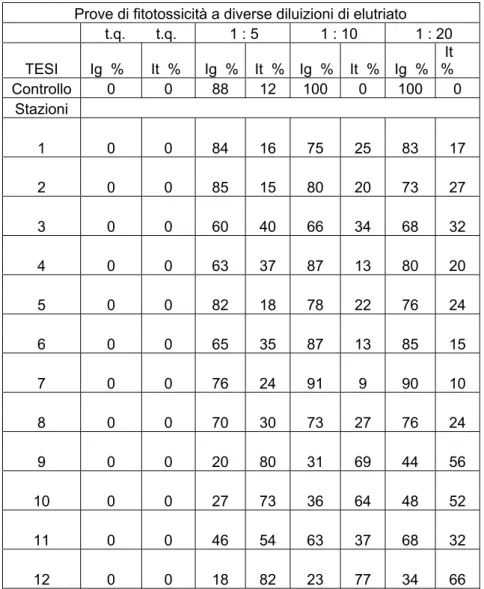
Prove di fitotossicità a diverse diluizioni di elutriato t.q. t.q. 1 : 5 1 : 10 1 : 20 TESI Ig % It % Ig % It % Ig % It % Ig % It % Controllo 0 0 88 12 100 0 100 0 Stazioni 1 0 0 84 16 75 25 83 17 2 0 0 85 15 80 20 73 27 3 0 0 60 40 66 34 68 32 4 0 0 63 37 87 13 80 20 5 0 0 82 18 78 22 76 24 6 0 0 65 35 87 13 85 15 7 0 0 76 24 91 9 90 10 8 0 0 70 30 73 27 76 24 9 0 0 20 80 31 69 44 56 10 0 0 27 73 36 64 48 52 11 0 0 46 54 63 37 68 32 12 0 0 18 82 23 77 34 66
Tabella 3.8: Indici di Germinazione e Indici di Tossicità ottenuti somministrando, ai semi di Lepidium sativum, l’elutriato di ciascuna delle dodici stazioni a diverse diluizioni.
3.4.1 Indice di Germinazione
Con un Ig superiore al 60-70 %, non si evidenziano effetti sul Lepidium sativum; con un Ig compreso tra il 40-60 %, si osservano effetti reversibili, non letali come il ritardo nello sviluppo e/o nella crescita; con un Ig inferiore al 40%, si riscontrano danni irreversibili, subletali e letali (Devesa-Rey et al., 2008).
Negli istogrammi che seguono sono stati riportati gli Indici di Germinazione (Ig), determinati alle diverse diluizioni di elutriato delle stazioni esaminate.
Le stazioni sono state divise in due gruppi, in modo da evidenziare quelle in cui non è stato osservato alcun effetto o comunque effetti non significativi, da quelle con effetti maggiormente evidenti e significativi.
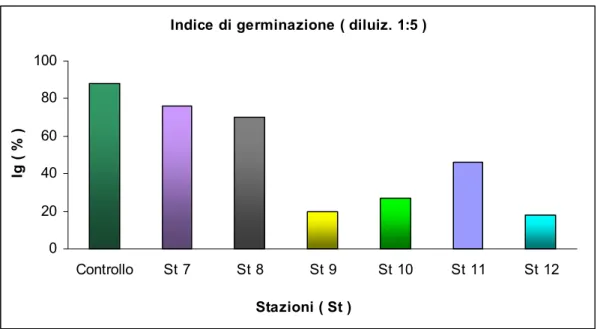
Indice di germinazione ( diluiz. 1:5 )
0 20 40 60 80 100 Controllo St 1 St 2 St 3 St 4 St 5 St 6 Stazioni ( St ) Ig ( % )
Fig. 3.20: Effetto degli elutriati delle stazioni 1-6 sulla germinazione dei semi di L. sativum (diluizione 1:5).
Indice di germinazione ( diluiz. 1:5 )
0 20 40 60 80 100 Controllo St 7 St 8 St 9 St 10 St 11 St 12 Stazioni ( St ) Ig ( % )
Fig. 3.21: Effetto degli elutriati delle stazioni 7-12 sulla germinazione dei semi di L. sativum (diluizione 1:5).
In base ai risultati ottenuti in laboratorio, relativamente alle prove di fitotossicità, è stata riscontrata una diminuzione dell’Indice di Germinazione, aggiungendo ai semi gli elutriati, alla diluizione 1:5, estratti dalle dodici stazioni analizzate.
In particolare si è osservata una diminuzione significativa dell’Ig in seguito all’aggiunta dei campioni delle stazioni 9, 10 e 12, con un Ig inferiore al 40%. Inoltre si è osservato un Ig compreso tra il 40-60% per quanto riguarda la somministrazione dell’elutriato ottenuto dalla stazione 11 e un Ig intorno al 60% saggiando i campioni delle stazioni 3, 4, 6. Per ciò che riguarda le altre stazioni saggiate, non è stata osservata nessuna significativa diminuzione dell’ Indice di Germinazione, tale da poter essere attribuita alla presenza di contaminanti nei campioni.
Indice di germinazione ( diluiz. 1:10 )
0 20 40 60 80 100 120 Controllo St 1 St 2 St 3 St 4 St 5 St 6 Stazioni ( St ) Ig ( % )
Fig. 3.22: Effetto degli elutriati delle stazioni 1-6 sulla germinazione dei semi di L. sativum (diluizione 1:10).
Indice di germinazione ( diluiz. 1:10 )
0 20 40 60 80 100 120 Controllo St 7 St 8 St 9 St 10 St 11 St 12 Stazioni ( St ) Ig ( % )
Fig. 3.23: Effetto degli elutriati delle stazioni 7-12 sulla germinazione dei semi di L. sativum (diluizione 1:10).
Utilizzando gli elutriati alla diluizione 1:10, è stata evidenziata una diminuzione significativa dell’ Ig, inferiore al 40%, sui semi di L. sativum saggiando i campioni delle stazioni 9, 10, 12. Per ciò che riguarda le altre stazioni saggiate, non è stata osservata nessuna significativa diminuzione dell’ Indice di Germinazione, tale da poter essere attribuita alla presenza di contaminanti nei campioni.
Indice di germinazione ( diluiz. 1:20 )
0 20 40 60 80 100 120 Controllo St 1 St 2 St 3 St 4 St 5 St 6 Stazioni ( St ) Ig ( % )
Fig. 3.24: Effetto degli elutriati delle stazioni 1-6 sulla germinazione dei semi di L. sativum (diluizione 1:20).
Indice di germinazione ( diluiz. 1:20 )
0 20 40 60 80 100 120 Controllo St 7 St 8 St 9 St 10 St 11 St 12 Stazioni ( St ) Ig ( % )
Fig. 3.25: Effetto degli elutriati delle stazioni 7-12 sulla germinazione dei semi di L. sativum (diluizione 1:20).
Anche per quanto riguarda gli elutriati alla diluizione 1:20, è stata evidenziata una diminuzione significativa dell’ Ig, inferiore al 40%, sui semi di L. sativum saggiando i campioni delle stazioni 9, 10, 12. E’ stato inoltre osservato un Indice di Germinazione intorno al 60% in seguito all’utilizzo degli elutriati delle stazioni 3 e 11.
Per ciò che riguarda le altre stazioni saggiate, non è stata osservata nessuna significativa diminuzione dell’ Indice di Germinazione, tale da poter essere attribuita alla presenza di contaminanti nei campioni.
Riassumendo, con l’aumentare della diluizione, si è osservato un incremento generale dell’Indice di Germinazione, saggiando tutti gli elutriati estratti dalle dodici stazioni prese in esame.
Nell’istogramma che segue è riportato l’aumento dell’ Indice di Germinazione alle diverse diluizioni, per le stazioni che meglio rappresentano questo fenomeno.
Indici di germinazione 0 20 40 60 80 100 120 1:5 1:10 1:20 Diluizioni Ig ( % ) Controllo St 8 St 9 St 10 St 12
3.4.2 Indice di Tossicità
Nella tabella 3.9 sono riportati gli Indici di Tossicità (It) riscontrati sui semi di Lepidium
sativum aggiungendo 1ml di elutriato, ottenuto per ciascuna delle dodici stazioni, tal
quale (t.q.) e alle seguenti diluizioni: 1:5, 1:10, 1:20.
Prove di fitotossicità a diverse diluizioni di elutriato
t.q. 1:5 1:10 1:20 TESI It % It % It % It % Controllo 0 12 0 0 Stazioni 1 0 16 25 17 2 0 15 20 27 3 0 40 46 32 4 0 37 13 20 5 0 18 22 24 6 0 35 13 15 7 0 24 9 10 8 0 30 27 24 9 0 80 69 56 10 0 73 64 52 11 0 54 37 32 12 0 82 77 66 > del 60 % no effetto 40 ≤ % ≤ 60 effetto rev. < 40 effetto irrev.,letale
Tabella 3.9: Indici di Tossicità ottenuti addizionando, ai semi di Lepidium sativum, l’elutriato di ciascuna delle dodici stazioni a diverse diluizioni.
Negli istogrammi che seguono sono stati riportati gli Indici di Tossicità (It), determinati alle diverse diluizioni di elutriato. Le stazioni sono state divise in due gruppi in modo da evidenziare quelle in cui non è stato osservato alcun effetto o comunque effetti non significativi, da quelle con effetti maggiormente evidenti e significativi.
L’Indice di Tossicità rappresenta il complementare dell’ Indice di Germinazione precedentemente analizzato.
Indice di tossicità ( diluiz. 1:5 )
0 10 20 30 40 50 60 Controllo St 1 St 2 St 3 St 4 St 5 St 6 Stazioni ( St ) It ( % )
Fig. 3.27: Indice di Tossicità degli elutriati delle stazioni 1-6 sui semi di L. sativum (diluizione 1:5).
Indice di tossicità ( diluiz.1:5 )
0 10 20 30 40 50 60 70 80 90 Controllo St 7 St 8 St 9 St 10 St 11 St 12 Stazioni ( St ) Ig ( % )
Fig. 3.28: Indice di Tossicità degli elutriati delle stazioni 7-12 sui semi di L. sativum (diluizione 1:5).
Indice di tossicità ( diluiz. 1:10 )
0 10 20 30 40 50 60 St 1 St 2 St 3 St 4 St 5 St 6 Stazioni ( St ) It ( % )
Fig. 3.29: Indice di Tossicità degli elutriati delle stazioni 1-6 sui semi di L. sativum (diluizione 1:10).
Indice di tossicità ( diluiz. 1:10 )
0 10 20 30 40 50 60 70 80 90 St 7 St 8 St 9 St 10 St 11 St 12 Stazioni ( St ) It ( % )
Fig. 3.30: Indice di Tossicità degli elutriati delle stazioni 7-12 sui semi di L. sativum (diluizione 1:10).
Indice di tossicità ( diluiz. 1:20 )
0 10 20 30 40 50 St 1 St 2 St 3 St 4 St 5 St 6 Stazioni ( St ) It ( % )
Fig. 3.31: Indice di Tossicità degli elutriati delle stazioni 1-6 sui semi di L. sativum (diluizione 1:20).
Indice di tossicità ( diluiz. 1:20 )
0 10 20 30 40 50 60 70 St 7 St 8 St 9 St 10 St 11 St 12 Stazioni ( St ) It ( % )
Fig. 3.32: Indice di Tossicità degli elutriati delle stazioni 7-12 sui semi di L. sativum (diluizione 1:20).
Come visto precedentemente per l’Indice di Germinazione, gli elutriati che provocano effetti significativi sui semi di L. sativum, alle diverse diluizioni, sono quelli estratti dalle stazioni 9, 10, 12.