CAPITOLO 4
WGSR (STATO DELL’ARTE)
4.1 Caratteristiche della WGSR
La WGSR è una reazione mediamente esotermica e viene commercialmente condotta mediante l’uso di catalizzatori Fe-Cr o Zn-Cu. E’ una reazione reversibile per la quale la costante di equilibrio può essere valutata usando la seguente equazione:
Keq = exp [(4577,8/T) – 4,33] (con T in K)
Questa equazione mostra che le basse T sono le più favorevoli per l’equilibrio TD della WGSR finalizzata alla produzione di idrogeno (per questa ragione sono di notevole interesse i catalizzatori con elevate attività che operano a basse T).
Le reazioni che portano alla produzione di idrogeno presentano spesso CO come co-prodotto e la WGSR è la reazione usata industrialmente per ridurre il livello di CO e per arrivare ad una corrente gassosa più ricca in idrogeno.
Il nostro lavoro si focalizza, quindi, sulla produzione di idrogeno mediante la Water Gas Shift Reaction:
CO + H20 = CO2 + H2 (ΔH°298 = -41,2 kj/mole a 300k)
perchè vogliamo ottenere una corrente gassosa di idrogeno il più pura possibile, da utilizzare come alimentazione nei processi successivi.
4.2 Processo attualmente più utilizzato per la produzione
industriale di Idrogeno mediante WGSR
[0, 17, 20, 22, 23, 25, 33]
Attualmente i principali processi di produzione dell’idrogeno mediante Water Gas Shift Reaction (WGSR) si basano sull’utilizzo di gas di sintesi (Syngas) ottenuti dallo Steam Reforming del carbone, del metano o di altri idrocarburi leggeri.
Generalmente viene condotta in reattori tubolari all’interno dei quali si mette un letto fisso catalitico al fine di spostare la reazione verso la produzione di idrogeno.
Sono in fase di studio anche membrane selettive, poste all’interno dei reattori, che hanno il compito di allontanare l’idrogeno dalla zona di reazione al fine di promuoverne la formazione, spostando l’equilibrio della reazione verso la formazione del prodotto desiderato. Ciò che ci proponiamo di ottenere è una corrente gassosa di idrogeno col maggior tasso di purezza possibile al fine del suo miglior utilizzo nelle fasi successive.
Per raggiungere tale obiettivo ci siamo riproposti di analizzare gli attuali sistemi di produzione in vigore, o in fase di studio, al fine di poter individuare un processo produttivo che consenta una produzione di idrogeno su scala industriale e con un tasso di purezza il più elevato possibile.
Uno dei principali utilizzi che si prospetta per l’idrogeno prodotto è quello di usare tale corrente gassosa come alimentazione per le celle a combustibile, le quali risultano essere sensibili all’avvelenamento da CO; bisogna, quindi, cercare di rimuovere questa sostanza ed ottenere una corrente gassosa di idrogeno quanto più pura possibile.
La Water Gas Shift Reaction è la reazione preferita per la rimozione del CO.
La conversione del CO mediante WGSR aumenta la produzione di idrogeno riducendo la concentrazione del CO dal 10% all’1% circa.
Vi sono due tipi di catalizzatori commercialmente usati per la WGSR:
- Catalizzatori di shift ad alta T: sono a base di ossidi di Ferro (Fe2O3) e Cromo
(Cr2O3); usati in un range di T che va dai 350 ai 500°C e che riducono la
concentrazione del CO al 2-5% circa. Alle alte T la WGSR risulta essere limitata termodinamicamente
- Catalizzatori di shift a bassa T: a base di ossidi di Zinco (ZnO) e Rame (CuO), che operano solitamente in presenza di Allumina (Al2O3), per T che vanno dai 150 ai
350°C e che riducono la concentrazione del CO a circa lo 0,5-1%.
La WGSR risulta essere limitata; termodinamicamente alle alte T e cineticamente alle basse T. Solitamente la reazione viene condotta in due stadi catalitici per aumentare la conversione del CO:
- 1° Stadio: WGSR condotta ad alta T con catalizzatori a base di ossidi di Ferro (Fe2O3)
e Cromo (Cr2O3); in questa fase, dove si predilige la cinetica, avviene la maggior parte
soddisfacente per il successivo utilizzo della corrente gassoso (vi è ancora la presenza di una quantità troppo elevata di CO).
- 2° Stadio: WGSR condotta a bassa T con catalizzatori a base di ossidi di Zinco (ZnO) e Rame (CuO) in presenza di Allumina (Al2O3): I catalizzatori CuO/ZnO/Al2O3 usati
nel secondo stadio devono essere più attivi di quelli usati nel primo perché a basse T la cinetica della WGSR risulta più sfavorita. In questo stadio viene completata la conversione del CO e si raggiunge una buona conversione di equilibrio.
Si effettua un raffreddamento intermedio fra i due stadi catalitici. Uno svantaggio dei catalizzatori a base di Rame è la loro natura “pyrophoric” e la loro disattivazione in presenza di aria, ed acqua condensata, che si forma durante le fasi di shut-down. Per quanto detto sopra aumenta, in questi anni, l’interesse verso i catalizzatori a base di ossidi di metalli nobili che risultano essere “non- pyrophoric” e più attivi dei catalizzatori tradizionali.
I catalizzatori tradizionali sono anche sensibili all’avvelenamento da Zolfo (S) e da Cloro (Cl) per questo motivo gli studi su nuovi sistemi catalitici per la WGSR è mirata anche al mantenimento di elevate attività nel tempo, ed alla resistenza all’avvelenamento.
Questo tipo di catalizzatori (ossidi di Zn-Cu) è stato utilizzato universalmente nelle passate tre decadi per la produzione di idrogeno mediante Steam Reforming del metanolo:
CH3OH + H2O (eccesso) = CO2 + 3H2 + (tracce di CO)
reazione condotta in un range di T che va dai 180 ai 280°C. La quantità di H2O presente nel
sistema catalitico di reazione influenza molto la conversione del CO per questo si sceglie di operare con un eccesso di H2O per spostare la reazione stessa verso i prodotti desiderati.
Per quanto riguarda l’attività catalitica dei catalizzatori CuO/ZnO (ed eventuale Al2O3) per la
WGSR a bassa T, la superficie del Rame assume un ruolo importante, in quanto è proprio su tale superficie che avviene la trasformazione del CO in CO2.
- Meccanismo Associativo: i due reagenti CO e H2O vengono prima adsorbiti sulla
superficie del Rame poi reagiscono per formare H2 e CO2 attraverso la formazione di
una serie di prodotti intermedi quali i formiati (HCOO-).
- Meccanismo Rigenerativo: sulla superficie del Rame avviene l’adsorbimento e la separazione della molecola di H2O per formare H2 ed atomi di ossigeno, ed in un
secondo momento gli atomi di ossigeno adsorbiti sui siti del Rame reagiscono con il CO per dare la CO2.
Per entrambi i meccanismi, le dimensioni delle particelle e la distribuzione dei cristalliti di Rame (che contengono i siti attivi all’interno della struttura del catalizzatore) sono due parametri pertinenti per la determinazione del tasso di reazione della WGSR.
La WGSR a basse T catalizzata da CuO/ZnO (ed eventuale Al2O3) viene condotta in reattori
tubolari a letto fisso il cui catalizzatore è presente sottoforma di particelle di dimensioni che vanno dai 0,8 ai 2 mm.
L’area superficiale dei catalizzatori utilizzati diminuisce all’aumentare della T di calcinazione con la quale vengono preparati i catalizzatori stessi. All’aumentare della T di calcinazione aumentano le dimensioni delle particelle dei cristalliti di Rame ed aumenta l’attività catalitica (misurata come mmol di idrogeno prodotto, per ora, per unità di area superficiale di rame). La distribuzione delle dimensioni delle particelle dei cristalliti di Rame deve rientrare nel range di 10-20 nm.
4.3 Studi ed approfondimenti finalizzati all’aumento della resa in
Idrogeno nei Processi che fanno uso della WGSR
L’ottimizzazione della resa in idrogeno mediante WGSR, si inquadra all’interno di un processo di gasificazione di combustibili solidi con produzione di syngas, occorre pertanto reperire dati e informazioni su una vasta gamma di apparecchiature convenzionali ed innovative che consentano di valutare diverse configurazioni all’interno del processo globale. Occorre inoltre fornire correlazioni fra i parametri operativi per ottimizzare la sezione di WGSR. Buona parte del lavoro svolto è stato improntato sul reperimento di materiale, fornito da studi di letteratura, che ci permetta di acquisire le conoscenze adeguate al miglior conseguimento degli obiettivi che ci siamo riproposti. Di seguito sono riportati alcuni articoli
di particolare interesse suddivisi in 4 categorie a seconda della centralità dell’argomento trattato:
1 Lavori su Reattori ed apparecchiature per lo studio della WGSR su scala di laboratorio o su scala pilota
2 Produzione di idrogeno mediante processi comprendenti la WGSR 3 Membrane Catalitiche applicate alla WGSR
4 Studi focalizzati sull’attività catalitica di Catalizzatori tradizionali e non
Di seguito riportiamo un resoconto di questi lavori per quanto concerne gli argomenti di interesse inerenti all’argomento trattato. I lavori descritti di seguito sono schematicamente riportati in fondo al capitolo, in una tabella nella quale si mettono in evidenza:
• Contesto Generale all’interno del quale si opera • Condizioni operative
• Caratteristiche di Catalizzatori e loro Rese • Caratteristiche delle Membrane e loro Selettività
• Vantaggi e Svantaggi del processo studiato e sue eventuali Particolarità
4.3.1 Lavori su Reattori ed apparecchiature per lo studio della WGSR su
scala di laboratorio o su scala pilota
A1)
Tonkovich et al. “Chemical Engineering Scienze” (1999) [1] Lo scopo di questo studio è quello di vedere se la cinetica delle reazioni relative ad un“automotive fuel processor” è sufficientemente veloce da suggerire ulteriori studi e
miniaturizzazioni nei “microchannel reactors”. La WGSR è una componente essenziale nei sistemi multi-reattore per il trattamento di combustibile finalizzato alla produzione di energia attraverso l’uso di celle a combustibile. Il processo di lavorazione che porta alla produzione di una corrente ricca di idrogeno a partire da idrocarburi consta di: un vaporizzatore del combustibile, un reattore di prima conversione per la produzione di gas di sintesi, un reattore per la WGSR ed un reattore per l’eliminazione del CO residuo.
Figura A1.1: Esempio di uno schema di processo del combustibile
La tecnologia convenzionale per il trattamento dei combustibili si basa sull’utilizzo di reattori a letto fisso. Si è studiato l’uso di “microchannel reactors” (piccoli, efficienti, modulari, leggeri ed economici) i quali riducono le dimensioni dei reattori convenzionali senza dover ridurre l’alimentazione in ingresso. Le limitazioni che rallentano la velocità di reazione nei reattori tradizionali (trasferimenti di massa e di calore) risultano essere ridotte nei
“microchannel reactors”. Questi reattori sono costituiti da piccoli canali di flusso paralleli di
larghezza 100-1000*10-6 m con rapporto altezza/larghezza che va da 1/1 a 100/1 e lunghezza 1-10 cm e riducono la distanza fra la sorgente e la camera di calore. Al diminuire di questa distanza diminuiscono le limitazioni dovute al trasferimento di massa e di calore. Un rapido trasferimento di massa e di calore aumenta l’efficienza del processo e questo permette la miniaturizzazione del processo senza che venga sacrificata la produttività.
La WGSR è esotermica e termodinamicamente favorita alle basse T, quindi una rimozione di calore è necessaria per operare in condizioni isoterme e quindi aumentarne la conversione. Le T tipiche utilizzate nei processi industriali per la WGSR in un reattore a letto fisso su catalizzatori a base di ossidi di Fe e Cu promossi su Cr e Zn, rispettivamente, variano dai 330 ai 530°C. Il tempo di contatto superficiale su base di gas umido varia da 3 a 9 sec.
Sistemi microchimici sono adatti per l’applicazione nei reattori compatti dove si riscontrano tempi di contatto dell’ordine dei milli-secondi dovuti al rapido trasferimento di calore. Il calore prodotto dalla reazione esotermica è rapidamente rimosso attraverso un efficiente
“microchannel heat exchanger”. Per questo tipo di reattori sono richiesti catalizzatori solidi
compatti (Engineered-Monolithic Catalysts).
I test sui catalizzatori in polvere sono eseguiti su un catalizzatore al 5% in peso di Ru/ZrO2
precedentemente ridotto e stabilizzato. Tali prove sono effettuate sullo stesso reattore a letto fisso ed i tempi di contatto variano da 10 ms. ad 1 sec.
Figura A1.2: Polvere di Catalizzatore per la WGSR con lunghi tempi di contatto
A 300°C e con una frazione vapore/carbonio di 3/1, con un tempo di contatto di 25 ms, su un catalizzatore a base di Ru, si ottiene una conversione del 98% del CO in CO2 + H2.
Per tempi di contatto di 50 ms si ottiene una conversione del CO del 99,8% con una selettività verso i prodotti desiderati (CO2 e H2) del 100%.
A 300°C, con un’alimentazione al 5% di CO e con un rapporto vapore/carbonio di 3/1 la conversione di equilibrio del CO è del 99,93%. Non si osserva deposizione di carbonio.
Nei test con tempi di contatto > 100 ms si ha formazione di metano con selettività di equilibrio del 22,82%: all’aumentare dei tempi di contatto aumenta la formazione di metano. L’utilizzo di reattori per la WGSR in un processore a combustibile in “microchannel
reactors” richiede lo sviluppo di una struttura catalitica compatta che mantenga l’alta attività
del catalizzatore in polvere ma includa strutture con basse cadute di P. I catalizzatori compatti fanno uso di schiume metalliche altamente porose che facilitano un rapido trasferimento di massa e di calore e forniscono un numero sufficiente di siti catalitici attivi sulla superficie del supporto della schiuma stessa.
Figura A1.4: Risultati della WGSR utilizzando un “Engineered-Monolithic Catalysts”
A 300°C la conversione del CO è < del 10%.
A 500°C e con rapporto vapore/carbonio di 3/1 la conversione del CO è del 94% con un tempo di contatto di 50 ms. (la conversione di equilibrio a queste condizioni è del 94,53%).
Con tempi di contatto di 10 ms la conversione del CO supera il 90%. La selettività verso CO2
ed H2 è del 100%. Per tempi di contatto che vanno dai 10 ai 100 ms la selettività rimane circa
al 100% con tracce di metano.
I catalizzatori compatti, rispetto ai catalizzatori in polvere, hanno una > T di attivazione ed un < peso sul supporto (del 10% circa).
Dall’osservazione di veloci cinetiche di reazione per la WGSR in reattori di dimensioni di 10 o 100 volte più piccoli dei normali reattori utilizzati, si può concludere che reattori piccoli, modulari, economici e con portate in ingresso considerevoli, possono essere impiegati nei processi di lavorazione del combustibile.
A2)
Goerke et al. “Applied Catalysis A” (2004) [2]Lo scopo di questo studio è quello di ridurre la quantità di CO nei gas da inviare alle celle a combustibile PEM (Polymer Electrolyte Membrane), usate per la produzione di energia elettrica, mediante Steam Reforming seguito da WGSR e dalla ossidazione selettiva del CO, in micro-reattori.
Le celle a combustibile PEM per la produzione di idrogeno stanno riscontrando sempre > interesse per la fornitura di energia elettrica in maniera compatibile con l’ambiente. Il solo prodotto di reazione ottenuto mediante reazione elettrochimica nelle celle a combustibile è l’acqua. Un metodo per superare il problema dello stoccaggio e della distribuzione dell’idrogeno per gli autoveicoli è quello di produrre l’idrogeno a bordo mediante la conversione di combustibili tradizionali quali Petrolio, Gas Naturale e Metanolo. A questo scopo è già stato studiato l’uso di micro-reattori che presentano il vantaggio di una buona dinamica di reazione ed un buon controllo della T di reazione. Solitamente si usano reazioni di steam reforming o reforming autotermico ed in entrambi i casi la miscela di gas risultante contiene grandi quantità di CO che viene poi in parte convertito in un reattore di shift. La concentrazione di CO scende a circa l’1% vol. La miscela gassosa risulta composta da: 45-75% vol H2, 15-25% vol CO2, 0,5-2% vol CO più tracce di H2O ed N2. Sfortunatamente le
celle a combustibile PEM non tollerano così alte concentrazioni di CO, che, quindi, deve essere ridotto a meno di 100 ppm. Per fare questo si effettua un altro stadio di WGS in combinazione con un’ossidazione selettiva (selox) del CO.
La WGSR è una reazione debolmente esotermica e reversibile: H2O + CO = H2 + CO2 ΔHR (T=573K) = -41.3 kJ/mol
A seconda della T di reazione si possono usare diversi catalizzatori ma quelli a bassa T di shift (250-400°C) sono i preferiti in molti casi. Nei micro-reattori si usano catalizzatori a base di ossidi di Zr (ZrO2) rivestiti di Ru (Ru/ZrO2) per i loro bassi tempi di residenza (circa
50ms).
L’Ossidazione Selettiva del CO è una reazione esotermica:
0,5O2 + CO = CO2 ΔHR (T=393K) = -287,6 kJ/mol
“selettiva” vuol dire che prende luogo in presenza di una grande quantità di idrogeno che non viene ossidato ad acqua. L’ossidazione selettiva viene condotta solitamente a T < 150°C. Altri catalizzatori compatibili con le microstrutture sono: Au/CeO2, Au/alfa-Fe2O3 e
CuO/CeO2. I catalizzatori conosciuti per l’ossidazione selettiva del CO quali: Pt/Al2O3 e
Ru/Al2O3 non sono adatti per i micro-reattori a causa degli elevati tempi di residenza
necessari (> 1sec).
In questo caso sono stati studiati 2 catalizzatori; Au/CeO2 e Ru/ZrO2 applicati a lamine
metalliche. Queste lamine rivestite sono compattate (raggruppate e bloccate) e testate sotto le stesse condizioni di reazione.
Il catalizzatore Ru/ZrO2 mostra una buona adesione alla superficie del substrato, migliore di
quella degli altri catalizzatori.
Figura A2.2: Schema del Processo
La caduta di P del micro-reattore è trascurabile. Si usano le seguenti condizioni sperimentali per eseguire i test sulla WGSR: una miscela composta da 1-25% vol. H2O, 1-25% vol. CO e
50-98% vol. N2 viene applicata al catalizzatore per tre diversi tempi di contatto (10, 20 e 27
ms a 250°C) della miscela gassosa nel volume del micro-reattore (233 mm3) per T che vanno
dai 100 ai 300°C.
Si usano le seguenti condizioni sperimentali per eseguire i test sulla reazione di ossidazione selettiva: una miscela composta da 46-53% vol. N2, 1-8% vol. CO, 6% vol. O2 e 40% vol. H2
viene applicata al catalizzatore per tempi di contatto della miscela gassosa nel micro-reattore di 14 ms (150°C) per T che vanno dai 100 ai 250°C.
Fra i catalizzatori analizzati quello a base di Ru/ZrO2 con substrato in “Fecralloy” risulta
avere maggiore attività per la WGSR: a 310°C ed un tempo di residenza di 20 ms la conversione del CO raggiunge il valore massimo del 96% con un tasso di CO residuo < di 600 ppm.
Di seguito sono riportati i diagrammi con i risultati delle conversioni del CO, ottenuti mediante WGSR su tre diversi catalizzatori, al variare della T, dei tempi di residenza e delle concentrazioni in ingresso.
Figura A2.3: Conversione del CO di tre diversi Catalizzatori in funzione della T
Figura A2.4: Conversione del CO di tre diversi Catalizzatori in funzione dei tempi di residenza
Figura A2.5:Conversione del CO di tre diversi Catalizzatori in funzione delle concentrazioni in ingresso
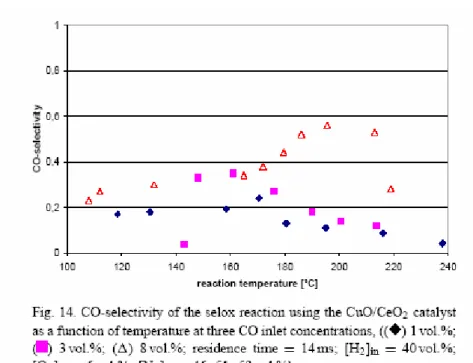
Fra i catalizzatori analizzati quello a base di CuO/CeO2 con substrato in acciaio inox risulta
avere l’attività maggiore per l’ossidazione selettiva: a 200°C la conversione del CO raggiunge il valore massimo del 79%.
Di seguito sono riportati i diagrammi con i risultati dell’Ossidazione Selettiva del CO (conversione del CO e selettività nei confronti del CO), ottenuti su tre diversi catalizzatori, al variare della T, dei tempi di residenza e delle concentrazioni in ingresso.
Figura A2.7: Selettività nei confronti del CO dell’ Ossidazione Selettiva, in funzione della T
Figura A2.8: Conversione del CO, nell’Ossidazione Selettiva, del catalizzatore CuO/CeO2 in
Figura A2.9: Selettività del CO, nell’Ossidazione Selettiva, del catalizzatore CuO/CeO2 in
funzione della T, a tre diverse composizioni in ingresso
Possono essere applicati con successo catalizzatori in micro-reattori per la riduzione del contenuto di CO delle miscele gassose provenienti dallo steam reforming del petrolio, del gas naturale e del metanolo.
4.3.2 Produzione di idrogeno mediante processi comprendenti la WGSR
B1)
Brevetto: WO2004013040 [3]Per ridurre il contenuto di CO ed ottenere una corrente gassosa ricca di H2 da inviare alle celle
a combustibile si effettua prima uno steam reforming e/o parziale ossidazione di sostanze carboniose (gas naturale, nafta, metanolo…) poi si effettua la WGSR e l’ossidazione selettiva del CO residuo, dopodiché si invia il prodotto gassoso alle celle a combustibile (se necessario, prima di inviare il gas alle celle a combustibile, si effettua una metanazione per rimuovere la CO2).
Si usano prevalentemente catalizzatori a base di ossidi di Zn/Cu più Al2O3.
Per evitare che durante le fasi di start-up e shut-down entri ossigeno nel reattore dove avviene la WGSR, si mette a monte del catalizzatore di shift, un letto per la rimozione dell’ossigeno che potrebbe entrare. Questo letto catalitico è formato da un miscuglio di Fe e Cu ed ossidi di
Fe che si ossidano sottraendo l’ossigeno dalla corrente gassosa (questo letto catalitico funge anche come primo catalizzatore di shift). Segue una classica reazione di shift a bassa T.
B2)
Chun et al. “Chemical Engineering Scienze” (1994) [4]Si studiano gli eventuali vantaggi dell’utilizzo di un processo in cui avviene contemporaneamente la reazione di shift e la rimozione della CO2 (lo studio è effettuato in un
reattore a letto fisso in scala).
Solitamente la produzione di una corrente pura di idrogeno richiede un sistema composto da più reattori operanti a diverse T e con diversi catalizzatori, seguita da una rimozione della CO2. In questo caso si studia la fattibilità di un processo in un singolo stadio dove assieme
alla WGSR:
CO(g) + H2O(g) = CO2(g) + H2(g)
avviene la reazione di Carbonatazione: CaO(s) + CO2(g) = CaCO3(s)
Le due reazioni avvengono nello stesso recipiente in un range di T che va dai 500 ai 600°C ed in assenza di catalizzatori, e questo porta notevoli vantaggi quali:
- riduzione del numero di reattori
- riduzione del numero di scambiatori di calore - eliminazione dei processi di separazione della CO2
- eliminazione di costosi catalizzatori sensibili allo S - riduzione della quantità di vapore usata per la WGSR
La reazione di Carbonatazione rimuove la CO2 gassosa spostando verso destra l’equilibrio
della WGSR, e la termodinamica favorevole, dovuta all’alta T a cui si opera, fa si che si possa utilizzare una < quantità di vapore con notevole risparmio sui processi di vaporizzazione dell’acqua.
Il fatto di non dover usare catalizzatori sensibili allo S può essere di particolare interesse per lo sviluppo di processi per la produzione di gas di sintesi a partire da basi più pesanti contenenti > quantità di S al loro interno.
Si studiano le caratteristiche delle due reazioni combinate in funzione della P e della T, della composizione del gas di sintesi alimentato, della velocità spaziale e della composizione e proprietà del materiale assorbente usato.
A 550°C (vicino l’optimum per le due reazioni combinate) con la sola WGSR si ha una conversione del CO del 56%, mentre combinata con la reazione di carbonatazione (ad 1 bar) si arriva al 99,5% e se il processo combinato viene condotto a 25 bar è possibile una conversione del CO praticamente del 100% (80 ppm di CO e 50 ppm CO2).
Figura B2.1: Analisi della Termodinamica di equilibrio
I gas sono alimentati al reattore, separatamente, da serbatoi a P e vengono pre-riscaldati per favorire il mescolamento fra gas e vapore acqueo. Il reattore ha una capacità di 10-15 gr di sorbente diviso in 4 sezioni assiali da dischi porosi in acciaio inox.
Questa configurazione permette ad ogni sezione di essere rimossa separatamente così che le proprietà del sorbente possano essere studiate in funzione della posizione assiale in cui si trovano.
Figura B2.2: Schema della configurazione con Reattore a letto fisso
Il materiale sorbente consta di un letto fisso di dolomite (TAB B2.1) che viene calcinato a 750°C e 3,3 atm (prima di inviarvi l’alimentazione gassosa) formando CaO(s) che poi reagisce con la CO2(g) per dare il CaCO3(s) che favorisce la reazione di shift.
La scelta della T (fra i 500 e i 600°C) è un compromesso fra l’equilibrio termodinamico, i fattori cinetici delle due reazioni (shift e carbonatazione) ed il desiderato limite di rimozione dell’ossido di C; T superiori hanno un effetto negativo sull’equilibrio delle reazioni perché queste ultime sono esotermiche.
Ci si avvicina molto all’equilibrio, per le reazioni di WGS e di Carbonatazione, per 500°C < T < 600°C e P = 15 atm alla velocità spaziale di 3400/hr. A queste condizioni si ottiene, nel prodotto di reazione, una concentrazione TOT degli ossidi del C di 300 ppm su base secca che corrisponde ad una conversione di tali ossidi del 99,5%.
Questo processo fornisce le basi per un possibile e più semplice processo di produzione di idrogeno dai gas di sintesi, ma sebbene la dolomite (usata come precursore del sorbente della CO2) ha un basso costo, affinché il processo sia conveniente, tale sorbente deve mantenere
l’attività e l’integrità strutturale attraverso i numerosi cicli di Calcinazione/Carbonatazione. Test multi-ciclici per valutare la durata di tali sorbenti sono attualmente in corso.
B3)
Wang et al. Patent application 20020114762 (2002) [5]La costante di equilibrio della WGSR aumenta al diminuire della T quindi si preferisce condurre tale reazione a basse T con vantaggi di tipo anche economico.
Lo scopo è quello di aumentare la produzione di idrogeno mediante WGSR a basse T applicata ai gas di sintesi ottenuti dallo steam reforming, dal reforming autotermico e dalla parziale ossidazione di idrocarburi.
Utilizzando un catalizzatore Ru/ZrO2 (0,2-3% di Ru disperso su uno strato poroso di ZrO2)
sottoforma di pellets o di polvere si riducono i tempi di contatto fra gas e catalizzatore (rispetto ai tradizionali catalizzatori per la WGSR: a base di Fe ad alta T e di Cu a bassa T) quindi si può operare utilizzando un letto catalitico con volume inferiore e T più basse (250°C < T < 350°C). La conversione del CO così ottenuta è del 50-80%, la selettività dell’80-100% ed i tempi di contatto sono dell’ordine di 3-100 ms.
B4)
Mahajan et al.U.S. Patent application 20020197205 (2002) [6]Si fornisce un processo per la produzione catalitica di idrogeno mediante l’esposizione di una corrente gassosa (ottenuta dallo steam reforming, dall’ossidazione di metanolo, metano o biomassa, dalla gasificazione di carbone o materiali carboniosi) ad un catalizzatore che promuove la WGSR in fase liquida: è un processo per la riduzione del contenuto di CO da una corrente di H2 che poi viene utilizzata nelle celle a combustibile con membrane a scambio
Le celle a combustibile PEM combinano l’idrogeno e l’ossigeno (in assenza di combustione) per formare acqua (elettrolisi inversa) e produrre direttamente potenza elettrica. Possono essere utilizzate come sorgenti di potenza per i veicoli di trasporto grazie alla loro alta efficienza energetica ed alle loro basse emissioni, ma la loro applicabilità su larga scala è legata alla risoluzione dei problemi di: fabbricazione, contenimento dei costi, durata. Le celle a combustibile PEM utilizzano un anodo elettrocatalizzatore a base di Pt su un supporto di C ed operano ad 80°C circa. Il difetto principale di tali catalizzatori è l’avvelenamento dell’anodo ad opera del CO; nasce da quì l’esigenza di utilizzare una corrente gassosa di idrogeno priva di CO.
Questo tipo di celle a combustibile sono le più promettenti (per un uso diffuso nei trasporti), fra quelle che lavorano a basse T e con velocità di reazione elevate, ed hanno una densità di energia elevata rispetto alle altre celle a combustibile. Il catalizzatore in fase liquida è un complesso omogeneo di metalli di transizione preferibilmente dell’8° gruppo (Ru, Ni, Pd, Fe, Co, Pt, Cu…) (in un solvente di CH3OH/H2O) accoppiati ad almeno un legante donatore di N.
Il processo di WGSR in fase liquida comprende la produzione di formiati [( )HCOO: dall’acido formico HCOOH; con ( ) = Li, Na, K...] da CO ed H2O e la sua decomposizione,
in presenza di H2O, per formare H2 e CO2 (si opera per 80°C<T<150°C). La fase liquida è
altamente basica (PH>=8) per promuovere la formazione del formiato, ed è resa tale dall’aggiunta di acqua, metanolo, alcol (C2-C10), eteri (C2-C10) e loro miscugli.
Il sistema operante a bassa T consiste in una decomposizione, catalizzata, del CH3OH a T <=
150°C per produrre 1 mole di CO e 2 moli di H2, seguita da una veloce e completa
conversione del CO in CO2 con produzione di un’altra mole di H2; a queste condizioni
operative il sistema produce 3 moli di H2 per ogni mole di CH3OH.
La WGSR in fase liquida è termodinamicamente più favorevole di quella in fase gassosa: H2O(l) + CO = H2 + CO2 ΔHR (T=<150°C) = 2,8 kJ/mol
La reazione in fase gassosa, come risultato del ΔHR < 0, tende a decorrere verso sinistra
producendo grandi quantità di CO mentre la reazione in fase liquida decorre solo verso destra perchè in fase liquida il catalizzatore omogeneo reagisce col CO, che poi a contatto con l’acqua, reagisce subito per formare CO2 (quasi il 100% del CO è convertito in CO2).
Il processo catalitico migliore contiene Ru e leganti N donatori ed applicando questo processo catalitico ad una corrente gassosa contenente CO, H2O, H2 e CH3OH si può raggiungere nel
gas prodotto un tasso di CO < 20-50 ppm.
B5)
Callaghan et al. “Surface Scienze” 2003 [7]Si sviluppa un modello microcinetico per la WGSR con lo scopo di esplorare ogni ulteriore, e più efficiente, percorso di reazione plausibile per la WGSR stessa.
Si utilizza un catalizzatore in Cu/ZnO/Al2O3.
B6)
Maranowski Patent 4,810,485 (1989) [8]Lo scopo di questo lavoro è quello di fornire grandi produzioni di idrogeno ad elevata purezza, integrando alle conosciute reazioni di produzione di idrogeno, lamine metalliche selettive per il solo passaggio di ioni idrogeno. Si studia l’effetto (sul rendimento della produzione di idrogeno) di lamine metalliche porose permselettive all’idrogeno ionico, situate nella zona di reazione nella quale si conduce il reforming del metano o la WGSR.
Si integra una lamina metallica selettiva, nei confronti degli ioni idrogeno, in un sistema di reazione di formazione dell’idrogeno, per allontanare l’idrogeno puro dal suo sito di reazione e favorire, quindi, l’evolversi della reazione verso la produzione di Idrogeno.
Si ottiene il duplice vantaggio di:
una corrente di idrogeno puro che non richieda ulteriori fasi di purificazione (anche se l’idrogeno è prodotto da combustibili naturali contaminati da solfuri).
far decorrere, le reazioni di formazione dell’idrogeno, verso la formazione del prodotto desiderato.
La lamina metallica (permselettiva nei confronti degli ioni idrogeno) deve avere preferibilmente forma tubolare, un supporto poroso interno, e passare direttamente attraverso la zona di reazione di formazione dell’idrogeno per fornire direttamente l’allontanamento dell’idrogeno in sito.
Per aumentare la produzione di idrogeno puro si può:
operare con una molteplicità di lamine metalliche tubolari
operare con una differenza di P (con P + basse all’esterno di tali lamine tubolari per favorire la fuoriuscita dell’idrogeno prodotto)
far passare gas inerti, a bassa P, all’esterno di tali lamine per favorire l’allontanamento dell’idrogeno prodotto.
Sistemi di reazione di formazione di idrogeno, adatti a questi metodi sono:
Steam Reforming del; metano (1000-1800°F), propano, etano, metanolo, gas naturale, gas di raffineria.
WGSR (750°F)
Gasificazione di materiali carboniosi quali: carbone, torba e distillato bituminoso. Le reazioni di formazione dell’idrogeno sono ad equilibrio limitato; il grado di conversione è limitato dalla chimica del sistema, dalla T di reazione ed in caso di reazione di reforming dalla P del sistema stesso. Tramite il continuo allontanamento dell’idrogeno dal suo sito di produzione, l’equilibrio è continuamente spostato verso destra favorendo la produzione dell’idrogeno stesso.
Le lamine metalliche (che costituiscono struttura a compartimento anodico) trasferiscono l’idrogeno tramite le seguenti fasi:
formazione di protoni idrogeno
passaggio di questi ioni attraverso la lamina metallica
ricombinazione degli ioni per riformare l’idrogeno molecolare.
Le lamine metalliche in questione sono composte da metalli che non interferiscono con le reazioni di formazione dell’idrogeno e forniscono una sufficiente diffusione degli ioni idrogeno attraverso le lamine stesse. Sono preferite membrane in Ni (e Cu e/o loro leghe) per la loro alta stabilità meccanica ed il loro basso costo. Lo spessore ideale delle lamine è compreso fra 0,0001 e 0,001 pollici (per avere una > diffusione si usano lamine sottili su supporti meccanici porosi in metallo o ceramica).
B7)
Mondal (2005) [9]Il principale processo di produzione di H2, attualmente in uso, è quello dovuto alla
conversione di gas naturale ed altri idrocarburi leggeri. Lo scopo di questo studio è quello di ottenere una produzione di idrogeno ad elevata purezza mediante gasificazione del carbone, successivo reforming di idrocarburi leggeri (CH4) e WGSR, il tutto in un unico passaggio (in
separazione della CO2 mediante adatti agenti rimuoventi (CaO e Ca(OH)2). Un sistema per la
“cattura” della CO2 non solo è utile ai fini dell’abbattimento dei gas serra ma migliora anche
la resa e la purezza dell’H2 (aumenta l’efficacia della WGSR) rimuovendo le limitazioni
termodinamiche alle condizioni date.
Le reazioni di reforming sono fortemente endotermiche e termodinamicamente favorite ad alte T e basse P, mentre la WGSR è favorita a basse T e non dipende dalla P. L’uso di catalizzatori a base di Ca, nella fase di gasificazione del carbone, permette di operare a T più basse e con rese in H2 più elevate. E’ stato riscontrato che l’uso di catalizzatori al NiO/Al2O3
e CaO permette di raggiungere condizioni vicine all’equilibrio per il reforming del CH4, la
WGSR e la separazione della CO2 simultaneamente, in un singolo reattore a 550°C.
L’idea di base è quella di un uso simultaneo di:
un agente ossidante (Fe2O3) che riducendosi favorisca la conversione del CO in CO2 un agente rimuovente, per la rimozione della CO2 (CaO: che assorbe la CO2
trasformandosi in
calce idrata, [Ca(OH)2] e CaCO3).
In seguito l’agente ossidante ridotto viene rigenerato (ossidato) in presenza di aria/ossigeno ed il calore liberato dalla reazione esotermica viene utilizzato per rigenerare l’agente per la rimozione della CO2.
Da questo processo si può ottenere:
H2 puro da utilizzare nelle celle a combustibile
sequestro della CO2
aria priva di O2, ad alta P e T, da utilizzare nelle turbine a gas
Le reazioni che avvengono nel reattore, ad 800°C circa, sono le seguenti:
Fase di arricchimento dell’idrogeno:
(1) C + H2O = CO + H2 steam reforming del carbone (+135.74 kJ/mol)
(2) CH4 + H2O = CO + 3H2 steam reforming del metano (+206 kJ/mol)
(3) CO + H2O = CO2 + H2 WGSR (-33.07 kJ/mol)
(4) 2CO = CO2 + C “Boudouard reaction” (-169.44 kJ/mol)
(5) CO + Fe2O3 = 2FeO + CO2 ossidazione del CO (-4.75 kJ/mol)
(7) CaO + H2O = Ca(OH)2 idratazione del CaO (-94.05 kJ/mol)
(8) Ca(OH)2 + CO2 = CaCO3 +H2O (-74.67 kJ/mol)
(9) CH4 + CO2 = CO + 3H2 reforming secco del metano (+260.76 kJ/mol)
(10) C + 2H2 = CH4 metanazione (-21.657 kJ/mol)
(11) H2 + Fe2O3 = 2FeO + H2O ossidazione dell’H2 (+28.97 kJ/mol)
(12) C + Fe2O3 = CO + 2FeO ossidazione catalizzata del C solido (+9.39 kJ/mol)
Fase di rigenerazione
(13) FeO + O2 = Fe2O3 rigenerazione dell’agente ossidante (-281.4 kJ/mol)
(14) CaCO3 = CaO + CO2 rigenerazione del materiale che assorbe la CO2 (+167.6
kJ/mol)
Siccome 1 mole di C richiede 2 moli di acqua per la completa conversione a CO2 il rapporto
C/H2O deve essere di 0,5 e visto che 1 mole di C produce 1 mole di CO o 1 mole di CO2, i
rapporti C/CaO e C/Fe2O3 sono uguali ad 1.
All’aumentare della T: la quantità del CO aumenta, quella della CO2 diminuisce (perché la
WGSR è esotermica) e quella del CH4 diminuisce (perché aumenta il reforming del CH4 e
diminuisce il livello di metanazione).
L’uso combinato di CaO e di Fe2O3 durante la gasificazione del C fornisce un prodotto
gassoso col più alto contenuto di H2 (98,3-99,4%) con una resa in H2 che varia da 1,15 a 1,7
Figura B7.1: Diagrammi di Equilibrio per quattro diversi sistemi di reazione
Sono stati condotti esperimenti su un reattore a letto fluido ed uno a letto fisso e si è visto che si ottiene la > conversione del carbone e la > purezza della corrente di idrogeno con il reattore a letto fluido per T di 800-870°C con l’85% di vapore con frazioni Fe2O3/carbone = 2,5-5 e
CaO/carbone = 50 circa. I risultati di tali esperimenti sono riportati nella figura B7.2.
B8)
Lin et al. “Energy & Fuels“ (2001) [10]In questo studio viene proposto un metodo per la produzione di idrogeno da residui organici. Si studia l’integrazione, in un singolo reattore, delle reazioni: acqua-idrocarburo, WGSR ed assorbimento della CO2 al fine di ottimizzare la resa in H2. Si effettuano test nel range di P
che va da 10 a 100 MPa e nel range di T che va dagli 873K ai 973K su una micro-autoclave usata come micro-reattore pressurizzato.
Le reazioni che entrano in gioco nel sistema sono:
Steam reforming dei residui organici:
(1) C + H2O = CO + H2 con ΔHR298K 132 kJ/mol
WGSR:
(2) H2O + CO = CO2 + H2 con ΔHR298K -41.5 kJ/mol
Assorbimento della CO2 mediante calce:
(3) CaO + CO2 = CaCO3 con ΔHR298K -178 kJ/mol
Espressione risultante delle 3 reazioni precedenti che avvengono nel reattore unico:
(4) C + 2H2O + CaO = CaCO3 + 2H2 con ΔHR298K -87.5 kJ/mol
Si usa NaOH come catalizzatore. Ca(OH)2 usato come assorbente della CO2 funge anche da
catalizzatore per la produzione di H2. L’utilizzo di entrambi i prodotti fa aumentare
notevolmente la produzione di H2 e riduce praticamente a zero la quantità di CO2 nel gas
prodotto (poche ppm). I gas prodotti non contengono solfuri o cloruri (entrambi estremamente dannosi e presenti nei materiali grezzi di partenza) perché vengono catturati e fissati in sali dall’NaOH e dalla Ca(OH)2 mentre si riscontra una non trascurabile quantità di metano:
(5) 2NaOH + H2S = Na2S + 2H2O
(6) 2HCl + Ca(OH)2 = CaCl2 + 2H2O
Ca ed Na sono buoni catalizzatori per la reazione aqcua-idrocarburo. La produzione di metano è significativa alle basse T, mentre alle T più elevate viene convertito in idrogeno più CO2
secondo la reazione:
(8) CH4 + 2H2O = CO2 + 4H2
All’aumentare della P si riscontra un aumento della produzione di metano e di idrogeno, ma l’effetto più rimarcato si verifica all’aumentare della T dove si riscontra un aumento di idrogeno ed una riduzione del metano.
I risultati degli studi effettuati sono riportati nelle figure seguenti:
Figura B8.1: Effetto dell’addizione del Sorbente del CO2 e del Catalizzatore, sui gas prodotti
Figura B8.3: Effetto della P sui gas prodotti
B9)
Anderson et al. “Applied catalysis A” (2000) [11]In questo lavoro si vuole ottimizzare la produzione di idrogeno combinando una parziale ossidazione del metano con una successiva WGSR:
1) Reattore per la Parziale Ossidazione del Metano:
si utilizza un primo reattore a membrana ceramica di forma tubolare, esclusivamente per il trasporto dell’ossigeno finalizzato all’ossidazione del metano in gas di sintesi (CO ed H2). Nel
reattore a membrana ceramica l’ossigeno viene separato dall’aria mediante una diffusione indotta da un gradiente di ossigeno, e si utilizza una membrana ceramica densa, a base di Sr-Fe-Co-O, che possiede: un’elevata conduzione elettrica, un’elevata conduzione ionica ed un’elevata permeabilità all’ossigeno. Queste membrane devono avere stabilità chimica e resistenza meccanica ad elevate T.
La reazione di parziale ossidazione del metano è la seguente: CH4 + 1/2O2 = CO + 2H2
ed avviene in presenza di un catalizzatore (a base di Rh e supportato da lana di quarzo) situato all’interno della membrana di forma tubolare. Si opera a T di 850-900°C. Il gas alimentato al primo reattore consiste in una miscela al 10% di metano più Ar. All’aumentare della P parziale (concentrazione) del metano, nel gas alimentato al primo reattore, la permeabilità
dell’ossigeno attraverso la membrana aumenta, ed anche se si ha una lieve riduzione del tasso di conversione del metano l’effetto globale è quello di un aumento della produzione del gas di sintesi. Più del 90% del metano viene convertito dopo il passaggio dal primo reattore. Nel gas di uscita da tale reattore non si trova N2 perché la membrana ceramica permselettiva non lo
lascia passare.
2) Reattore per la WGSR:
successivamente si aumenta la produzione di H2, in un secondo reattore catalitico, mediante
WGSR catalizzata da Cu/ZnO/Al2O3. La costante di equilibrio della WGSR aumenta al
diminuire della T quindi tale reazione risulta TD favorita alla basse T, raggiungendo l’optimum a circa 400°C e con un rapporto vapore/CO circa = 2.
Figura B9.1: Effetto della T sulla produzione di Idrogeno nella WGSR condotta con un rapporto H2O/CO = 2
Nel complesso circa 3 moli di idrogeno sono prodotte per ogni mole di metano convertita in gas di sintesi. Un diagramma schematico dell’intero sistema è rappresentato nella figura seguente:
Figura B9.2: Diagramma schematico dei due Reattori in serie per la massimizzazione della produzione di Idrogeno
4.3.3 Membrane Catalitiche applicate alla WGSR
C1)
Tosti et al. “International Journal of Hydrogen Energy” (2000) [12]Si studiano membrane sottili tubolari in Pd e in leghe Pd-Ag con spessore di 50*10-6 m, situate all’interno di reattori catalitici tubolari a membrana a letto fisso, per la WGSR. Queste membrane sono più sottili di quelle commerciali (100-150*10-6 m) quindi il flusso di idrogeno attraverso la membrana e la conversione nel reattore catalitico aumentano, hanno completa selettività verso l’idrogeno e buona durata. Si riesce a separare e recuperare idrogeno ad elevata purezza utilizzabile poi nelle celle a combustibile. All’interno della cavità della membrana si usa un catalizzatore per la WGSR e l’idrogeno prodotto viene rimosso attraverso la membrana durante la reazione, spostando l’equilibrio del sistema verso i prodotti. Si utilizza un tubo poroso ceramico all’interno della membrana per evitare il contatto fra la membrana stessa ed il letto catalitico per la WGSR. Si opera per T dell’ordine di 300-350°C e con P dell’ordine di pochi MPa onde evitare la rottura della membrana. Queste membrane sono ottenute arrotolando a freddo sottili lamine in Pd e Pd-Ag (per ottenere le desiderate proprietà di resistenza meccanica e di finitura superficiale) ed unendole mediante saldatura formando tubi di 10 mm di diametro.
Figura C1.1: Schema di un Reattore Catalittico a Membrana per la WGSR
Rispetto alle membrane commerciali composite, sono più sottili, quindi si riduce il costo ed aumenta il flusso permeante. Inoltre hanno > durata e > permeabilità dovuta ai < micro-difetti superficiali. Il tutto si traduce in una > purezza dell’H2 prodotto. Nonostante tutto, il costo del
Pd limita l’uso di questa tecnologia ad impianti di piccole e medie dimensioni. Per ridurre i costi si è provato a realizzare membrane più sottili (10*10-6 m) ma si ottenevano risultati poco soddisfacenti dal punto di vista della durata e della selettività verso l’idrogeno, a causa dei micro-difetti superficiali.
C2)
Damle et al. “Gas separation & purification“ (1994) [13]Si sviluppa un modello di processo semplificato che simula un reattore catalitico a membrana per la WGSR. Si conducono una serie di simulazioni al computer per determinare il potenziale aumento della conversione del CO, nella WGSR, dovuto alla simultanea separazione dell’idrogeno prodotto nella miscela gassosa. In questa simulazione si usano fattori di separazione del gas basati sulla diffusione di Knudsen per valutare l’efficacia di membrane ceramiche ed inorganiche nella gasificazione del carbone ad alta P ed alta T.
Si è visto che aumentando la P dell’alimentazione aumenta anche la conversione del CO e la concentrazione dell’idrogeno prodotto. La conversione del CO mediante WGSR è limitata dall’equilibrio chimico. Mediante la continua separazione dell’idrogeno nel reattore, le limitazioni cinetiche e termodinamiche della WGSR sono ridotte, aumentando la produzione di idrogeno.
Il reattore a membrana catalitica riesce a combinare la reazione con la separazione del prodotto, in una singola fase. Le membrane forniscono una rimozione selettiva di uno o più prodotti spostando l’equilibrio della reazione verso la formazione di questi ultimi. Si opera a
P > 20 atm e per T che vanno dai 300 ai 500°C. Le membrane utilizzate devono essere tolleranti ai vari agenti contaminanti fra i quali i solfuri di idrogeno. Si usano membrane microporose inorganiche (ceramiche ed al carbone) con uno strato permselettivo con pori di dimensioni dell’ordine di 10-20A, perché consentono il passaggio selettivo delle molecole di H2, di peso molecolare inferiore rispetto a quelle di CO ed N2. La conversione del CO
aumenta in maniera significativa per P parziali di 10-20.
Nei diagrammi che seguono vengono riportati i risultati delle simulazioni effettuate:
Figura C2.1: Effetto dello “stage cut” e della P parziale sulla conversione del CO con un rapporto di alimentazione: H2O/CO = 2
Figura C2.2: Effetto dello “stage cut” e della P parziale sulla conversione del CO con un rapporto di alimentazione: H2O/CO = 3
Figura C2.3: Effetto dello “stage cut” e della P parziale sulla conversione del CO con un rapporto di alimentazione: H2O/CO = 4
Figura C2.4: Effetto dello “stage cut” e della P parziale sulla concentrazione dell’H2
I risultati di queste simulazioni mostrano che sarà necessario più di uno stadio, con alte P parziali e separazione ideale di Knudsen, per raggiungere una concentrazione di idrogeno > 90% ed un ragionevole recupero dell’idrogeno stesso.
Con una configurazione di flusso controcorrente, fra l’alimentazione ed i gas permeati, si ottiene una > conversione del CO rispetto alla configurazione di flusso equicorrente, alle stesse condizioni operative.
Figura C2.5: Effetto dello schema di flusso sulla conversione del CO con un rapporto di alimentazione: H2O/CO = 3
Figura C2.6: Effetto dello schema di flusso sulla concentrazione dell’Idrogeno prodotto con un rapporto di alimentazione: H2O/CO = 3
All’aumentare del numero di stadi aumenta la concentrazione dell’idrogeno prodotto. La simulazione indica che sebbene la conversione del CO e la concentrazione dell’idrogeno prodotto aumentino in maniera significativa utilizzando un singolo reattore a membrana, per ottenere correnti gassose con concentrazioni di idrogeno > del 90% è necessario un sistema di separazione a membrana multistadio, con almeno 3 stadi separati (solo il primo stadio può essere considerato un reattore a membrana gli altri 2 sono solo membrane di separazione. Questo perché se la corrente gassosa arricchita in idrogeno viene sottoposta ad un’ulteriore WGSR alle stesse T del primo stadio, subisce la reazione inversa).
Figura C2.7: Concentrazione dell’Idrogeno prodotto, al variare del numero di stadi, con un rapporto nel gas in alimentazione: H2O/CO = 3; e con la separazione dell’idrogeno regolata
dal meccanismo di diffusione di Knudsen
All’aumentare della P del gas alimentato, per separare i gas, mediante il meccanismo di diffusione di Knudsen, ci vogliono pori di dimensioni + piccole. Per una buona separazione ad elevate P e T sono necessari pori dell’ordine di 1 nm (non ci sono ancora membrane, inorganiche o ceramiche, commercialmente disponibili con dimensioni dei pori di queste dell’ordine di 1 nm).
C3)
Giessler et al. “Separation and Purification Technology” (2003) [14]In questo studio si applica la WGSR a bassa T a reattori a letto fisso con membrane siliciche a setaccio molecolare all’interno delle quali si usa CuO/ZnO/Al2O3 come catalizzatore della
WGSR. Queste membrane mostrano una buona stabilità idrotermica. Si vuole indagare sull’influenza delle caratteristiche delle membrane, (in termini della loro idrofobicità, selettività e permeabilità) sulla performance del reattore per la WGSR. I migliori risultati ottenuti sono: permeabilità dell’H2 di 1,5*10-6 moli/sec*m2*Pa; selettività H2/CO2 = 8;
selettività H2/N2 = 18. Inoltre, con un flusso gassoso di N2 (gas di trasporto) di 80 cm3/min,
una velocità di alimentazione di 50 cm3/min ed una frazione molare H2O/CO2 = 1, a 280°C e
Patm, si raggiunge una conversione del CO pari al 99%.
Figura C3.1: Sistema schematico per il Reattore a Membrana
Le membrane idrofile mostrano una buona permeabilità nei confronti dell’Idrogeno, ma subiscono un allargamento dei pori durante la reazione e questo porta ad una riduzione della selettività nei confronti dello stesso Idrogeno.
Figura C3.2: Dipendenza della T sulla performance della membrana Idrofila
Le membrane idrofobe, invece, non mostrano questo tipo di comportamento e presentano un aumento della permeabilità dell’H2 all’aumentare della T (caratteristica del trasporto attivo:
aumento della permeabilità all’aumentare della T).
Figura C3.3: Dipendenza della T sulla performance della membrana Idrofoba
Per entrambe le membrane si riscontra un aumento della permeabilità dell’idrogeno all’aumentare della T.
Figura C3.4: Dipendenza della T sulla conversione del CO
La conversione del CO diminuisce all’aumentare della velocità dell’alimentazione.
Figura C3.5: Dipendenza della composizione dell’alimentazione sulla conversione del CO
L’invio di un flusso rapido di N2 nel gas permeato porta ad un aumento della conversione del
CO fino ad un valore massimo, per poi diminuire all’aumentare della velocità di tale flusso (effetto più marcato per le membrane idrofobe). Per maggiori conversioni del CO tale flusso deve avere velocità di circa la metà del flusso di alimentazione per le membrane idrofile. Per
quanto riguarda le membrane idrofobe può variare da metà della velocità del flusso di alimentazione fino alle stesse velocità circa del flusso di alimentazione stesso.
Figura C3.6: Effetto della velocità del flusso gassoso sulla conversione del CO a 250°C
Per quanto riguarda la composizione dell’alimentazione si ottengono i risultati migliori ( > conversioni del CO) per rapporti H2O/CO che vanno da 0,9 a 2,5.
Figura C3.8: Effetto della frazione molare sulla conversione del CO a 250°C
Le membrane studiate si dimostrano migliori (a parità di condizioni) di quelle composite a base di Pd, nei sistemi di reattori a membrana a letto fisso per la WGSR. Non si trova CH4 nel
gas permeato e, nell’arco di una settimana di esperimenti, non si riscontra disattivazione della membrana. In definitiva, si ottengono > conversioni usando membrane idrofobe.
C4)
Tosti et al. “Chemical Engineering Journal” (2003) [15]Lo scopo di questo lavoro è quello di ottenere una corrente gassosa di idrogeno di elevata purezza da utilizzare come corrente di alimentazione in quei processi che richiedono, appunto, un’elevata purezza dell’idrogeno (celle a combustibile…). Si studia il comportamento delle membrane in Pd-Ag all’interno di un reattore catalitico a membrana. Le membrane al Pd, ed alle leghe di Pd, mostrano buone performance in termini di permeabilità all’idrogeno, a causa dell’alta solubilità e dell’alta diffusività dell’idrogeno nelle loro matrici. Con l’aggiunta di Ag al Pd possiamo osservare un minore infragilimento del metallo, ed aumenta anche la permeabilità dell’idrogeno, quindi si usano leghe Pd-Ag per preparare tubi commerciali permeanti di spessore 100-150*10-6 m per la purificazione e la separazione dell’idrogeno. Tali membrane devono avere una buona stabilità termica, chimica e meccanica e vengono ottenute
rivestendo i tubi ceramici porosi con una sottile lamina metallica in Pd-Ag di spessore 50*10
-6m circa, al fine di evitare il contatto diretto della lamina metallica con il catalizzatore della
WGSR, e l’indebolimento in compressione del sottile tubo metallico.
Figura C4.1: Schema di un Reattore a Membrana
L’H2O ed il CO sono alimentati, all’interno del tubo a membrana, sul letto catalitico. L’H2
prodotto permea attraverso la membrana e viene recuperato nel reattore, dove viene rimosso mediante l’invio di una corrente di gas inerte (N2). La reazione di conversione del CO, nella
WGSR, si avvicina al 100% e all’aumentare della T aumenta la permeabilità dell’H2
attraverso la membrana. Inoltre all’aumentare della velocità di flusso del CO alimentato, diminuisce la conversione del CO e la permeabilità dell’H2 attraverso la membrana. Rispetto
ai reattori convenzionali per la WGSR questi reattori a membrana hanno la capacità di raggiungere alte conversioni con un basso rapporto H2O/CO.
Un risultato generale della membrana al Pd e della tecnologia del reattore a membrana è il raggiungimento di elevate permeabilità e selettività, entrambe proprietà che contribuiscono a ridurre dimensioni e costi.
C5)
Donghao et al. (2003) [16]Si prende in considerazione un modello micro-cinetico a due stadi per la WGSR ad elevata T. Questo modello redox a due stadi usa solo 3 parametri ed è in grado di predire l’effetto inibitorio della CO2 sulla cinetica di reazione. Viene usato per simulare le prestazioni di un
reattore adiabatico a membrana per la WGSR. In questo contesto un processo con reattore a membrana offre la possibilità di generare idrogeno puro al 100% ed una corrente composta per lo più da CO2 che può, quindi, essere sequestrato mitigando l’effetto del riscaldamento
atmosferico. Si esaminano i risultati ottenuti utilizzando catalizzatori commerciali per la WGSR ad alta T in un reattore a membrana a letto fisso con membrana in Pd. La reazione è condotta in stadi adiabatici con raffreddamento intermedio e con un eccesso di vapore nell’alimentazione. Il primo stadio opera con un catalizzatore Fe-Cr per 600 K < T < 750 K. Il secondo stadio opera con un catalizzatore Zn-Cu per 530 K < T < 560 K. Fra il 1° ed il 2° stadio si raffredda il flusso gassoso a 600 K.
Molti fattori contribuiscono all’adozione di tale processo:
quello principale è l’alternanza fra velocità di reazione e conversione di equilibrio: la WGSR è una reazione esotermica e reversibile, quindi, alte T portano ad elevate velocità di reazione ma basse conversioni di equilibrio. La > parte della conversione ha luogo nel primo reattore dove le velocità sono >; nel secondo reattore si ottengono conversioni elevate.
spesso l’alimentazione a tale processo (per la WGSR) proviene dallo steam reformer dove le T in uscita sono già alte e questo si integra bene col tipo di processo trattato.
L’uso di un eccesso di vapore favorisce una > conversione di equilibrio, riduce le T adiabatiche raggiunte nel reattore ed aiuta a prevenire la formazione di depositi di carbonio nella zona di ingresso del reattore. Il reattore opera adiabaticamente ad alte P e T. L’alta P fornisce la forza motrice per far permeare l’idrogeno prodotto attraverso la membrana al Pd (non è necessario fornire una corrente di gas inerte all’esterno della membrana).
Si vogliono valutare le prestazioni di un reattore a membrana, come quello descritto, attraverso una simulazione matematica.
A secondo del rapporto H2O/CO dell’alimentazione, può risultare più o meno conveniente
operare con un diverso numero di stadi. Nella figura seguente è riportato l’effetto di tale rapporto sulla produzione di Idrogeno e sul numero di stadi da adottare, più conveniente per la massimizzazione della produzione di Idrogeno.
Figura C5.1: Effetto del rapporto H2O/CO dell’alimentazione sull’Idrogeno prodotto e sul
numero di stadi da adottare per ottimizzare la produzione di Idrogeno
Nel caso trattato (2 stadi) risulta conveniente utilizzare un’alimentazione con un rapporto H2O/CO = 3, che fa anche si che si raggiunga l’equilibrio della reazione con una < quantità di
catalizzatore.
All’aumentare della quantità di catalizzatore usato aumentano: la produzione di idrogeno
l’equilibrio della reazione l’equilibrio della permeazione.
Figura C5.2: Variazione dell’equilibrio di reazione e di permeazione di un Reattore adiabatico a membrana
Per produzioni di H2 del 90%: trovare una membrana perfetta ridurrebbe le dimensioni del
reattore del 12%, eliminare l’effetto inibitorio della CO2 (sulla cinetica di reazione della
WGSR) le ridurrebbe del 76%. La velocità di reazione è il principale fattore limitante del processo nei reattori a membrana, non la permeazione dell’H2 attraverso la membrana stessa.
4.3.4 Studi focalizzati sull’attività catalitica di catalizzatori tradizionali e
non
D1)
Osuwan et al. “Catalysis Communications” (2003) [17]In questo articolo si riportano i risultati dello studio dell’attività catalitica di catalizzatori al Pt/CeO2, Au/CeO2 e Au/Fe2O3 per la WGSR a bassa T (120-360°C) e Patm. Si effettuano
questi test per una corrente con composizione: 4% CO, 2,6-20% H2O ed He. La
concentrazione del CO e dell’H2O nell’alimentazione ha un effetto significativo sull’attività
dei catalizzatori. Quello all’1% di Pt/CeO2 risulta essere il più attivo in presenza del 20% di
H2O.
L’idrogeno prodotto dallo steam reforming del gas contiene circa il 10% di CO e la WGSR è la reazione preferita per la conversione di tale sostanza (in H2 + CO2), infatti aumenta la
produzione di H2 e riduce la concentrazione del CO dal 10% allo 0,5-1%.
Ci sono 2 tipi di catalizzatori commercialmente usati per la WGSR:
uno ad alte T (400-500°C) a base di ossidi di Fe e Cr che riduce il CO al 2-5%
un altro a basse T (200-400°C) a base di ossidi di Cu/Zn più allumina, che riduce il CO all’1% circa.
La WGSR è limitata termodinamicamente alle alte T e cineticamente alle basse T. Commercialmente si usa una combinazione dei 2 catalizzatori con raffreddamento intermedio. In questo studio si cerca di vedere se è possibile trovare un catalizzatore più attivo, rispetto a quelli commerciali attualmente in uso, per la WGSR a bassa T per avvicinarci di più alle condizioni di equilibrio della reazione in questione.
Il CeO2 può esistere in più stati di ossidazione grazie alla facilità con cui cambia il suo stato di ossidazione fra +3 e +4, inoltre:
promuove l’attività della WGSR
favorisce la dispersione dei metalli catalitici stabilizza l’area superficiale del supporto
promuove catalizzatori ai metalli preziosi per la WGSR.
Per queste sue caratteristiche è stato scelto come supporto per i catalizzatori al Pt e all’Au. I catalizzatori a base di Au stanno suscitando interesse grazie:
alla loro attività catalitica per l’ossidazione del CO a bassa T alla buona attività verso la combustione catalitica di idrocarburi alla loro elevata attività quando supportati su Fe2O3.
Il catalizzatore Au/Fe2O3 è un buon catalizzatore per la WGSR a bassa T, grazie alla specifica
interazione fra l’Au ed il supporto in ossido di Fe. I catalizzatori Pt/CeO2 (ottenuti come
sol-gel) e Au/CeO2 (ottenuti mediante co-precipitazione) mostrano elevata attività e selettività
verso l’ossidazione selettiva del CO in presenza di idrogeno. Se è vero che i metalli preziosi come Pt, Rh e Pd non sono buoni catalizzatori di shift perché non si ossidano facilmente con l’acqua è anche vero che l’ossidazione del Ce2O3 con l’acqua per dare H2 è
termodinamicamente favorita.
Lo scopo di questo studio è quello di confrontare i suddetti catalizzatori che esibiscono alta attività per l’ossidazione selettiva del CO e per la WGSR.
I catalizzatori commerciali sono anche sensibili all’avvelenamento da S e Cl e questo ha condotto allo sviluppo di elevate attività e di resistenza all’avvelenamento nel lungo periodo. Si nota, dai test effettuati, che non c’è una relazione fra l’area superficiale e l’attività del catalizzatore, che invece è legata al tipo di supporto usato
Nella tabella D1.1 sono riportate le aree superficiali di alcuni catalizzatori trattati:
Nelle figure seguenti sono riportati gli andamenti della conversione del CO, al variare della T e della percentuale di vapore acqueo, nella corrente di alimentazione, per alcuni catalizzatori a base di Au e Pt ottenuti con diversi metodi di preparazione:
Figura D1.1: Conversione del CO in funzione della T per alcuni catalizzatori trattati
La WGSR è sfavorita ad alte T e per raggiungere elevate conversioni del CO si usa un eccesso di vapore per spostare la reazione verso i prodotti. Il > effetto del contenuto di acqua nell’alimentazione sull’attività catalitica si riscontra col catalizzatore al Pt/CeO2.
Figura D1.2: Conversione del CO in funzione della T e della quantità di acqua nell’alimentazione
L’effetto che ha la quantità di vapore nell’alimentazione, sulla conversione del CO, si può spiegare con l’ossidazione del supporto (CeO2), dovuto all’acqua stessa alimentata al reattore.
La conversione del CO aumenta all’aumentare della T ed al diminuire della concentrazione del CO nella corrente di alimentazione (avvelenamento da CO nei siti di Pt ed Au).
Figura D1.3: Effetto della T e della % di CO nell’alimentazione, sulla conversione del CO
Il catalizzatore che mostra > stabilità col tempo è quello a base di Pt/CeO2 (come mostrato in
figura D1.4).
La cristallinità del supporto (ossido riducibile) ha un effetto negativo sull’attività del catalizzatore. L’attività dei catalizzatori metallo/ossido di Ce dipende molto dal tipo di metallo usato (il Pt risulta più attivo dell’Au). L’acqua ha un effetto positivo sui catalizzatori Pt/CeO2 e moderatamente positivo sugli altri 2 catalizzatori esaminati. I test condotti sui
sistemi catalitici a base di Au mostrano che il Fe2O3 non è il supporto più adatto per la
WGSR. L’attività e la stabilità catalitica dei catalizzatori contenenti Au diminuisce rapidamente col tempo mentre diminuisce molto meno se si usano catalizzatori al Pt/CeO2 che
sembrano essere i più appropriati per la WGSR in condizioni di reazione moderate, con elevati rapporti H2O/CO ed in presenza di H2.
D2)
Sakurai et al. “Applied Catalysis“ (2005) [18]L’attività dei catalizzatori Au/CeO2 per la WGSR a bassa T è confrontata con quella dei
catalizzatori Pt/CeO2, Au/TiO2 e Cu/ZnO/Al2O3 alle stesse condizioni operative, a partire da
miscele gassose contenenti CO, CO2, H2, H2O ed He. Si confrontano questi catalizzatori in un
range di T che va dai 373K ai 623K. L’Au/CeO2 si è dimostrato essere il più attivo in questo intervallo di T, nel quale non si riscontra neanche produzione di metano. Si è dedotto che la WGSR procede sull’interfaccia perimetrica di piccole particelle di Au su una superficie di ossido di Ce ridotto. La reazione procede mediante formazione di intermedi di reazione (probabilmente un formiato) a partire da CO e gruppi OH. Segue la decomposizione degli intermedi, ad opera dell’H2O, in CO2 ed H2. L’idrogeno presente nell’alimentazione facilita la
formazione di più superfici attive ridotte da parte del CeO2. Nei processi standard dopo lo
steam reforming di idrocarburi leggeri si ricorre alla WGSR per eliminare il CO residuo nel gas riformato.
Negli studi effettuati in questi anni si cerca di trovare nuovi catalizzatori con le seguenti caratteristiche:
elevate velocità di reazione: per ridurre il volume del catalizzatore, quindi, utilizzare reattori più compatti
elevata selettività: per evitare di produrre metano e per ottenere elevate produzioni di H2 ad elevata purezza
elevata tolleranza all’ossidazione atmosferica: che può riscontrarsi in quei processi con ripetute operazioni di start and stop
Nei processi che richiedono ripetute operazioni di start e stop, che usano i tradizionali catalizzatori Zn/Cu, questi vengono inevitabilmente in contatto con l’aria e si riscontra
un’ossidazione del Cu che porta ad una graduale riduzione dell’attività catalitica. I catalizzatori a base di metalli nobili, invece, risultano essere i candidati ideali per questo tipo di processi perché presentano una > tolleranza alle atmosfere ossidanti. I metalli preziosi (Pt, Pd, Rh…) depositati su CeO2 mostrano > attività del solo CeO2 o degli stessi metalli
depositati su silice o allumina.
L’attività del catalizzatore Au/CeO2 è > di quella del Au/TiO2 e suscita interesse per la sua
elevata attività a basse T.
Il catalizzatore Au/CeO2 è il più attivo alle basse T con conversioni del CO: > rispetto al Au/TiO2 per ogni T;
> rispetto al Cu/ZnO/Al2O3 per T < 623 K
> rispetto al Pt/CeO2 per T < 523 K.
Figura D2.1: Conversione del CO, in funzione della T, per tre diversi catalizzatori, fissata la composizione del gas in ingresso al Reattore catalitico
Affinché il catalizzatore Au/TiO2 fornisca un’attività paragonabile a quella del Cu/ZnO/Al2O3
deve avere un’elevata quantità di Au (5-10% peso) mentre per quanto riguarda l’Au/CeO2
fornisce un’elevata attività anche con il 3-4% peso di Au. La conversione del CO sul Pt/CeO2
per T < 423 K è molto inferiore rispetto a quella sull’Au/CeO2 mentre entrambi i catalizzatori
raggiungono quasi l’equilibrio termodinamico per T > 523 K. Questa differenza di attività a basse T fra i 2 catalizzatori può essere dovuta alla forza di adsorbimento delle molecole di CO
sulla superficie metallica. Aggiungendo H2 alla miscela gassosa reagente si riscontra un
aumento della conversione del CO.
Figura D2.2: Conversione del CO, sul catalizzatore Au/CeO2, al variare della T e della
composizione in ingresso al Reattore catalitico
L’elevata attività del catalizzatore Au/CeO2, per la WGSR a bassa T, è legata alla natura del
CeO2 il quale viene facilmente ridotto a basse T attraverso l’azione delle nano-particelle di
Au. Esperimenti mostrano che l’Au promuove la riduzione del supporto in CeO2 a T anche <
di 423K. La presenza di idrogeno nel gas reagente promuove la riduzione del CeO2 mediante
il consumo del CO. L’attivazione riduttiva del catalizzatore Au/CeO2 a basse T necessita del
CO e dell’H2.
Per i campioni di Au/CeO2, preparati in questo lavoro, le frazioni delle particelle di Au più
piccole di 2 e 3 nm sono del 72 e del 97,5% rispettivamente ed il diametro medio è di 1,9 nm. L’attività del catalizzatore cosi preparato risulta > di quella del catalizzatore commerciale Cu/ZnO/Al2O3.
Le caratteristiche principali del catalizzatore Au/CeO2 sono: la sua attività alle basse T e la
mancanza di produzione di metano, mediante idrogenazione di CO e/o CO2, anche ad elevate
T. L’uso di CeO2 al posto di Al2O3 riduce la produzione di metano anche nei catalizzatori con
elementi dell’8° gruppo come il Pt, ma a queste condizioni operative una quantità significativa di metano viene prodotta sul Pt/CeO2. L’attività del Pt/CeO2 per T < 523 K è