UNIVERSITA’ DI PISA
Corso di Laurea Magistrale in Medicina Veterinaria
S
S
T
T
A
A
T
T
O
O
O
O
S
S
S
S
I
I
D
D
A
A
T
T
I
I
V
V
O
O
N
N
E
E
L
L
P
P
A
A
Z
Z
I
I
E
E
N
N
T
T
E
E
C
C
A
A
N
N
I
I
N
N
O
O
N
N
E
E
O
O
P
P
L
L
A
A
S
S
T
T
I
I
C
C
O
O
Candidato: Alice Rosi Relatori: Dott. Veronica Marchetti
“buoni compagni di viaggio non dovrebbero
lasciarsi mai, sceglieranno imbarcazioni diverse, restano sempre dei marinai…”
De Gregori
SOMMARIO
R
R
IA
I
AS
SS
SU
U
NT
N
TO
O
..
.
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
.
5
5
I
IN
N
TR
T
RO
OD
D
U
U
ZI
Z
IO
ON
N
E
E
..
.
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
.
6
6
L
L
O
O
S
ST
TA
A
TO
T
O
O
O
S
S
S
S
ID
I
D
AT
A
TI
IV
VO
O
..
.
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
.
7
7
1.1 RADICALI LIBERI... 71.1.1 Le specie reattive di maggiore interesse biologico ... 9
1.1.2 Processi chimici e biologici che danno origine ai radicali liberi ... 12
1.1.3 Siti fisiologici di formazione delle specie radicaliche... 18
1.1.4 Sintesi di radicali liberi nei processi reattivi ... 21
1.1.5... 23
Fattori esterni nella genesi dei radicali liberi ... 23
1.2 AGENTI ANTIOSSIDANTI ... 25
1.2.1 Antiossidanti preventivi... 26
1.2.2 Antiossidanti che agiscono inattivando specie reattive già formate... 30
1.2.3 Antiossidanti che agiscono dopo che il danno da radicale si è instaurato ... 32
1.2.4 Agenti di adattamento ... 32
1.3 EQUILIBRIO OSSIDANTI-ANTIOSSIDANTI: LO STRESS OSSIDATIVO ... 34
1.3.1 Effetti dello stress ossidativo sulle malattie organiche ... 36
S
S
T
T
R
R
ES
E
SS
S
O
OS
SS
SI
ID
D
A
A
T
T
IV
I
V
O
O
E
E
O
ON
N
C
C
OG
O
GE
EN
N
E
E
S
S
I
I
..
.
..
..
..
..
..
..
..
..
..
..
..
.
42
4
2
2.1 RUOLO DELLE SPECIE REATTIVE NELL’INCIDENZA DELL’ONCOGENESI... 422.1.1 Meccanismi di sviluppo del tumore ... 45
2.1.2 Stadi dell’oncogenesi e influenza dei radicali liberi... 47
2.1.3 Trasmissione dei segnali cellulari, stress ossidativo e tumore ... 54
2.2 MECCANISMI DI DIFESA ANTIOSSIDANTE NELLO SVILUPPO DI NEOPLASIE... 69
S
ST
TA
A
TO
T
O
O
OS
SS
SI
ID
D
AT
A
TI
IV
VO
O
E
E
P
PR
R
OG
O
G
R
R
ES
E
SS
SI
IO
ON
NE
E
D
D
E
E
L
L
T
T
U
U
M
M
O
O
R
R
E
E
..
.
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
.
79
7
9
3.1 VALUTAZIONE DELLO STRESS OSSIDATIVO NELLA PROGRESSIONE DEGLI STATI NEOPLASTICI... 793.2 CHEMIOTERAPICI E INCREMENTO DELLO STRESS OSSIDATIVO.. 90
3.3 STRESS OSSIDATIVO COME TERAPIA DEL TUMORE ... 95
L
LO
O
S
S
TA
T
AT
TO
O
O
OS
SS
SI
ID
D
AT
A
TI
IV
V
O
O
N
N
EL
E
L
C
C
A
A
N
N
E
E
O
O
N
N
C
C
OL
O
L
O
O
G
G
IC
I
C
O
O
..
.
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
.
97
9
7
4.1 STRESS OSSIDATIVO E NEOPLASIA NEL CANE ... 97P
P
A
A
R
R
TE
T
E
S
SP
PE
EC
C
IA
I
A
LE
L
E
..
.
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
.
10
1
06
6
5.1. MATERIALI E METODI... 107
5.1.1 Criteri di inclusione dei pazienti: ... 107
5.1.2 Valutazione dello stato ossidativo... 114
5.2. RISULTATI ... 121
5.3 DISCUSSIONE... 128
5.4 CONCLUSIONI... 139
B
R
RI
IA
AS
SS
SU
U
NT
N
TO
O
Parole chiave:ROMs, antiossidanti, tumore nel cane, d-ROMs test, BAP test. L’aumento dello stress ossidativo dovuto ad una sovrapproduzione di specie reattive dell’ossigeno e ad una alterata capacità antiossidante, risulta implicato nella patogenesi di tutti i tipi di tumore. L’obiettivo del presente studio è stato quello di comparare la capacità ossidoriduttiva del plasma di cani affetti da tumore con quella di un gruppo di cani di controllo senza alcuna patologia e, se possibile, di individuare una eventuale correlazione tra lo stato ossidativo e la condizione clinica del paziente. Il profilo ossidoriduttivo di 58 cani affetti da diversi tipi di tumore è stato valutato utilizzando il d-ROMS test e il BAP test, due metodi di determinazione colorimetrica dei metaboliti reattivi dell’ossigeno (ROMs) e dei componenti antiossidanti del plasma. Dallo studio è emerso che i radicali liberi aumentano in modo significativo nei soggetti affetti da neoplasia e la loro concentrazione può essere correlata con la sindrome di anoressia/cachessia che è una delle più importanti caratteristiche della progressione del tumore.
ABSTRACT
Keywords: ROMs, antioxidants, canine tumours, d-ROMs test, BAP test. Oxidative stress arising due to overproduction of reactive oxygen species, cuopled with alterated antioxidant capacities has been implicated in the pathogenesis of all types of cancer. The aim of the present study was to compare the redox properties of the blood plasma of dogs with tumours and a control group of healty dogs and, in case, to find out whether there is a correlation between oxidative status and clinical condition of patient.Oxidant-antioxidant profile in 58 dogs affected by different type of neoplasia was estimated using d-ROMs test and BAP test, two colorimetric determination of reactive oxygen metabolites (ROMs) and antioxidant components in blood plasma. We found that free radicals arise significantly in subjects with tumor and their concentration can be correlated with anorexia/cachexia syndrome wich is one of the most important features of
I
IN
NT
TR
R
OD
O
DU
U
ZI
Z
IO
ON
N
E
E
Numerosi studi, negli ultimi anni, hanno confermato il ruolo eziopatogenico dei radicali liberi in corso di diverse patologie.
In medicina veterinaria sono pochi i dati riguardanti lo studio dello stato ossidativo nel cane affetto da neoplasia; essi dimostrano, comunque, che anche nel cane, come nell’uomo, sono presenti alterazioni sia della componente ossidante che della componente antiossidante del plasma e che la somministrazione esogena di antiossidanti può influenzare favorevolmente il decorso della patologia (Valko M. et al, 2004; Weijl N.I. et al, 1997; Kumaraguruparan R. et
al, 2005).
Con il presente studio si è voluto valutare, con l’ausilio del ROMs test e del BAP test, lo stato ossidativo plasmatico in un gruppo di cani affetti da tumori di tipologia e stadio diverso. Inoltre si è tentato di identificare un’eventuale relazione tra lo stato ossidativo dei singoli individui e le caratteristiche della neoplasia da cui erano affetti, le loro condizioni cliniche e l’alimentazione a cui i soggetti erano sottoposti. Lo scopo del nostro lavoro è stato quello di confermare quanto già in parte dimostrato in medicina umana circa il ruolo centrale dei radicali liberi nell’eziopatogenesi e nella progressione del tumore nel cane e da qui ipotizzare un utilizzo della valutazione dello stress ossidativo nell’inquadramento clinico e prognostico del paziente neoplastico.
L
LO
O
S
ST
TA
AT
TO
O
O
OS
SS
SI
ID
D
A
A
T
T
IV
I
V
O
O
1.1 RADICALI LIBERI
I radicali liberi, come più comunemente sono conosciute le specie chimiche reattive, sono definiti come atomi o raggruppamenti di atomi aventi, negli orbitali esterni, uno o più elettroni spaiati, indipendentemente dalla carica elettrica espressa. La natura dell’atomo al quale appartiene l’orbitale con l’elettrone spaiato costituisce uno dei criteri di classificazione delle specie reattive.
La capacità delle specie chimiche reattive di ossidare, cioè di sottrarre uno o più equivalenti riducenti (elettroni o atomi di idrogeno) ad un gran numero di atomi o molecole organiche (Iorio E.L., 2004), spiega l’attitudine di tali agenti ad indurre un danno ossidativo a carico di componenti strutturali e/o funzionali degli organismi viventi.
In ambito biologico esiste un gran numero di specie reattive che derivano dal metabolismo cellulare a vari livelli, ma senza dubbio quelle di maggior interesse sono quelle contenenti ossigeno, conosciute come ROS (reactive oxygen specie). L’ossigeno, infatti, è uno degli elementi quantitativamente e qualitativamente più importanti della materia vivente ed è direttamente coinvolto nei meccanismi di sintesi energetica che stanno alla base della sopravvivenza degli organismi aerobi. Le cellule eucariote aerobie utilizzano l’ossigeno molecolare come accettore finale di elettroni nella catena respiratoria mitocondriale; in questo processo circa il 5% (Ogino T. et al., 1999) dell’ossigeno viene convertito in radicali liberi. Quando la quantità di radicali liberi aumenta, essi,
interagendo con DNA, lipidi e proteine determinano mutazioni, trasformazioni neoplastiche, perdita della funzionalità e morte cellulare (Langhseth L. et al. 1995). Le specie reattive, oltre che esito fisiologico di alcuni processi metabolici cellulari, sono anche il risultato di stimoli esterni quali radiazioni ionizzanti, elevate tensioni di ossigeno, sostanze chimiche di varia natura.
Oltre ai ROS si conoscono anche altri radicali liberi di interesse biologico tra cui quelli incentrati sul carbonio, sull’azoto (RNS), sul cloro e sullo zolfo. Inoltre, questa definizione di radicale include l’atomo di idrogeno, considerato un monoradicale, molti metalli di transizione e l’ossigeno molecolare che, contenendo due elettroni disaccoppiati, è un diradicale.
La tossicità dei radicali liberi è legata alla loro reattività, dovuta alla tendenza spontanea ad esistere come entità aventi tutti gli elettroni disposti in coppie, alla loro emivita brevissima (10-9 secondi) (Klaassen C.D. et al., 2000) (Campus G. et al., 2005) e alla diffusione a breve distanza nell’ambiente circostante. Ne deriva che, tanto più un radicale è reattivo, tanto più tenderà a raggiungere la propria stabilità strappando elettroni a qualsiasi specie chimica con la quale verrà a contatto, ossidandola. Questo può innescare reazioni a catena che determinano la formazione di altri radicali liberi che possono danneggiare irreversibilmente le diverse strutture cellulari (Krhre J. et al., 1993).
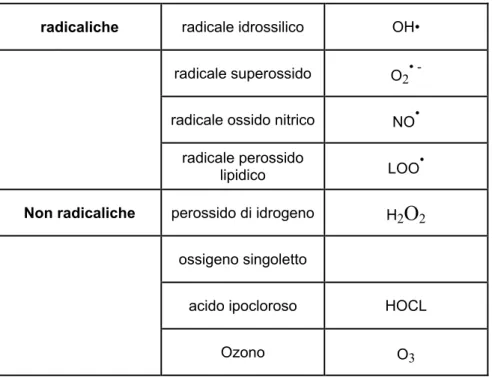
1.1.1 Le specie reattive di maggiore interesse biologico
SPECIE REATTIVE DELL’OSSIGENO:
radicaliche radicale idrossilico OH•
radicale superossido O2
•
radicale ossido nitrico NO
•
radicale perossido
lipidico LOO•
Non radicaliche perossido di idrogeno H2O2
ossigeno singoletto
acido ipocloroso HOCL
Ozono O3
Tabella 1.1- Forme dell’ossigeno presenti negli organismi viventi (23)
Tra le specie reattive dell’ossigeno, l’ossigeno singoletto rappresenta una varietà radicalica che può originare dall’eccitazione dell’ossigeno molecolare per assorbimento di una certa quota di energia, che determina una transizione all’orbitale più esterno degli elettroni o una loro inversione di spin. Questo nuovo stato dell’ossigeno si comporta come un radicale libero estremamente reattivo, in grado di attaccare e danneggiare molecole ad alta densità elettronica, quali gli
acidi grassi poliinsaturi (come il linoleato), e le LDL (perossidazione lipidica).
L’anione perossido, risulta invece dall’addizione, ad una molecola di ossigeno, di un elettrone, il quale può provenire da diverse vie metaboliche. Tra queste assumono rilevante importanza la catena respiratoria, il “respiratory burst” e, in condizione di ischemia-riperfusione, il catabolismo dei nucleotidi purinici. Una volta generatosi, l’anione superossido, può andare incontro alla reazione di Fenton, generando il radicale altamente istolesivo idroperossido, oppure dismutare a perossido di idrogeno, meno tossico.
Il radicale idrossile, molto istolesivo, può derivare da numerose reazioni, tra le quali la catena respiratoria, la fotolisi dell’acqua, la decomposizione del perossido di idrogeno e la reazione dell’ozono con i nitriti. Infine il perossido di idrogeno viene generato prevalentemente attraverso meccanismi di tipo enzimatico, e per via enzimatica è generalmente inattivato o dà luogo alla formazione di specie chimiche più ossidanti.
Le specie reattive dell’ossigeno possono attaccare qualsiasi substrato organico, generando specie reattive secondarie (metaboliti reattivi dell’ossigeno).
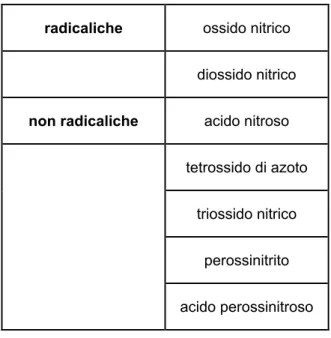
SPECIE REATTIVE DELL’AZOTO:
radicaliche ossido nitrico
diossido nitrico
non radicaliche acido nitroso
tetrossido di azoto
triossido nitrico
perossinitrito
acido perossinitroso
Tabella 1.2- forme dell’azoto reattivo presenti negli organismi viventi.
L’ossido nitrico viene prodotto a partire dall’aminoacido L-arginina, in una reazione catalizzata dall’enzima ossido nitrico sintetasi (NOS) il quale ha 2 domini ad azione catalitica, uno reduttasico e uno ossigenasico, e richiede come cofattore NADPH e pteridina ridotta. La NOS inoltre esiste in almeno 2 isoforme, una costitutiva (cell. endoteliali, piastrine, neuroni) e una inducibile (cell infiammatorie).
L’ossido nitrico agisce come importante messaggero intra e inter cellulare regolando molte funzioni e gioca un ruolo determinante nella difesa dalle infezioni batteriche e nella prevenzione dei tumori. Tuttavia, se generato in quantità abnormi esso è anche un potente killer cellulare.
L’NO infatti possiede elettroni spaiati nel livello energetico più esterno che ne fanno quindi una specie chimica radicalica.
In quanto radicale libero, l’ossido nitrico, reagisce rapidamente con altre specie aventi elettroni spaiati. Di particolare importanza ai fini della patogenesi dello stress ossidativo, è la reazione dell’ossido nitrico con l’anione superossido, dalla quale viene generato l’anione altamente reattivo perossinitrito. Quindi quando la produzione di anione superossido aumenta, questo reagisce massivamente con l’ossido nitrico, trasformandolo in perossinitrito. Ciò determina riduzione della biodisponibilità dell’NO e innesco di effetti tossici, con alterazioni cellulari funzionali e/o strutturali.
Tuttavia, in quanto radicale libero, l’NO può anche svolgere un’attività antiossidante, e la prevalenza dell’una o dell’altra azione dipende dalle concentrazioni relative delle singole specie reattive implicate.
1.1.2 Processi chimici e biologici che danno origine ai radicali
liberi
Le specie chimiche reattive possono essere generate attraverso meccanismi enzimatici e non enzimatici. Una volta formatesi, queste possono dare inizio ad un processo propagativo caratterizzato da una serie di reazioni a catena nel corso delle quali il sito radicalico può essere trasferito o eventualmente inattivato.
1. Origine delle specie radicaliche:
L’origine dei radicali liberi può avvenire o per scissione omolitica o per interazione con metalli di transizione.
Scissione omolitica: Si assiste alla divisione di una molecola, a
livello di uno dei suoi legami covalenti, per effetto della somministrazione di energia, con la generazione di due nuove specie chimiche, ciascuna con un elettrone spaiato tipico dei radicali.
Un esempio di scissione omolitica è la radiolisi o la fotolisi dell’acqua che genera un atomo di idrogeno e un radicale idrossile. biblio
Interazione con metalli di transizione: Il secondo meccanismo con
cui si ottengono radicali liberi è l’interazione di molecole con metalli di transizione (Fe2+, Fe3+, Cu2+, Zn2+, Mn2+…) . E’ necessario ricordare che quasi tutti gli enzimi conosciuti richiedono la presenza di ioni metallici per esprimere la propria attività catalitica. Gli ioni metallici partecipano infatti a reazioni di ossido-riduzione modificando in modo reversibile il loro numero di ossidazione. In questo modo si ottengono elettroni in grado di spezzare il legame covalente di una molecola bersaglio che si separa in un radicale libero e in un anione.
Alternativamente il metallo di transizione può ridursi in forma ionica, richiedendo un elettrone che viene estratto dal legame covalente di una molecola che si separa in un radicale libero e in un catione.
Tra i metalli di transizione, ricopre notevole rilevanza biologica il ferro. Un esempio di questo meccanismo, si osserva nella reazione di
Haber Weiss, attraverso la quale, a partire da un radicale perossido e dal perossido di idrogeno, derivato dalla propria dismutazione (reazione intramolecolare nella quale avviene un’ossido-riduzione interna, con la formazione interna di due distinti prodotti da un unico substrato) si ottiene una molecola di radicale idrossilico (HO●) ad alto potere ossidante.
H2O2
+ O
2•-HO
●-= OH
●+ OH
-+ O2
Fortunatamente la velocità di questa reazione è molto scarsa, tale da precludere una rilevanza biologica. A questo punto entra in gioco il ferro, che è in grado di catalizzare la reazione con un meccanismo che fu descritto per la prima volta da Fenton. Lo ione ferroso (Fe2+), ossidandosi a ione ferrico (Fe3+), cede il suo elettrone ad una molecola di perossido di idrogeno (H2O2) e ne scinde uno dei legami covalenti,
generando un radicale libero (il radicale idrossilico, HO●) e un anione, ione ossidrile (Verna F. et al., 2005). A sua volta lo ione ferrico si riduce, rigenerandosi come qualsiasi catalizzatore, a ione ferroso, strappando un elettrone da una seconda molecola di perossido di idrogeno, che è scissa in un radicale libero (un radicale peridrossile HOO●) e un catione (uno ione idrogeno).
O
2•-+ Fe
3+= Fe
2++ O
2Il ferro, negli organismi superiori in buona salute, non è mai ferro libero o debolmente legato. Esso viene trasportato nello stato ferrico dalla transferrina, in un complesso difficilissimo da ridurre. Allo stesso modo viene depositato nello stato ferrico mediante la ferritina, una proteina ubiquitaria nei tessuti e nel plasma. Il radicale superossido è in grado di ridurre allo stato ferroso il ferro legato alla ferritina, che viene così rilasciato. E’ questo ferro liberato dalla produzione patologica di superossido, che è ora in grado di catalizzare la reazione di Haber Weiss. Il radicale idrossilico così prodotto può iniziare la perossidazione lipidica, che porta alla modificazione strutturale e funzionale delle membrane o può attaccare macromolecole e causare rotture del DNA.(vedi figura 1.3) . Se il ferro liberato può esacerbare la parte di danno tissutale dovuta alla produzione di radicali liberi, ha senso chiedersi se lo stato nutrizionale del ferro corporeo possa essere un fattore predisponente nelle patologie legate allo stress ossidativo (Flora S.J. et al., 2007) (Okada S., 1996).
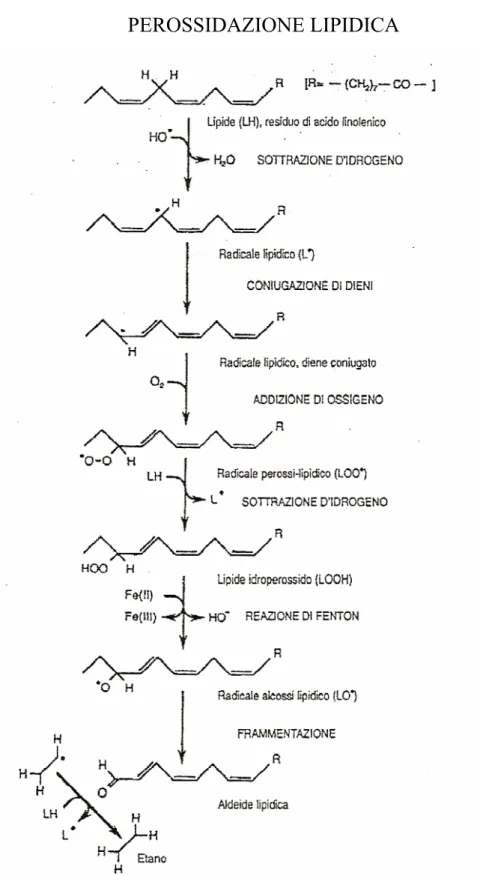
PEROSSIDAZIONE LIPIDICA
2. Propagazione della specie radicalica:
Una volta innescata una reazione radicalica a catena questa tende a propagarsi attraverso alcuni meccanismi fondamentali. Di questi, quello più comune, è caratterizzato dal trasferimento del sito radicalico ad una molecola alla quale viene sottratto uno dei suoi atomi. Con questo meccanismo, ad esempio, il radicale ossidrile (HO●) attaccando una molecola organica (R-H), strappa a questa un atomo di idrogeno, generando, accanto ad una molecola d’acqua, un radicale alchilico (R●) (Iorio E.L., 2004).
HO
●+ R-H = H2O + R
●3. Interruzione della propagazione radicalica:
Infine una reazione a catena può arrestarsi per disproporzione o per combinazione in cui si assiste alla reazione tra due radicali liberi che, interagendo, danno origine ad una molecola non più reattiva. In questo modo il primo radicale agisce da ossidante, mentre il secondo da antiossidante.
Nei comuni processi metabolici cellulari vengono continuamente generate specie chimiche reattive ma la loro sintesi può essere incrementata da numerosi fattori esogeni di varia natura.
1.1.3 Siti fisiologici di formazione delle specie radicaliche Andiamo adesso ad esaminare più nel dettaglio i diversi comparti cellulari che rappresentano siti di sintesi dei radicali liberi.
- I mitocondri rappresentano la fonte metabolica primaria di ROS perché, sulle loro creste, sono localizzati i complessi enzimatici della catena respiratoria deputati alla fosforilazione ossidativa. Negli organismi aerobi gli elettroni provenienti da molecole energetiche ridotte vengono trasferiti all’ossigeno molecolare. Il flusso di elettroni che se ne genera rappresenta energia libera la quale viene conservata e utilizzata per sintetizzare ATP. In particolare gli elettroni che vengono rilasciati dall’ossidazione del glucosio vengono trasferiti a coenzimi NAD+ (nicotinamide adenin dinucleotide) e FAD (flavin adenin dinucleotide) (sono trasportatori di elettroni) e, da questi, passano successivamente ad una catena di trasporto di elettroni attraverso una serie di ossido-riduzioni. Infine, per azione del citocromo C ossidasi, si ha l’ossidazione di quattro molecole di citocromo C e la riduzione di una molecola di O2
con produzione di ATP e H2O.
Questo processo, per quanto sofisticato, non è perfetto e presenta una certa percentuale di errore in seguito alla quale una quota di elettroni (1-2 %) sfugge al sistema di trasporto dei coenzimi e reagisce direttamente con l’ossigeno molecolare, generando così anione superossido (nel caso di trasferimento all’ossigeno molecolare di un solo elettrone) e/o perossido di idrogeno (nel caso di aggiunta di un altro elettrone). La produzione di radicali liberi in corso di fosforilazione
ossidativa avviene senza l’intervento di enzimi. Questi metaboliti dell’ossigeno particolarmente reattivi hanno un ruolo importante nel determinare il danno tissutale nel corso di numerose situazioni patologiche o in corso di esercizio fisico eccessivo, come trattato meglio in seguito (Van Holde M., 1998).
La quantità di superossido prodotta dai mitocondri aumenta con la concentrazione di ossigeno all’interno dell’organismo (come nell’iperventilazione), in caso di ridotta efficienza della catena respiratoria in cui il flusso elettronico è limitato dalla mancanza di substrato da fosforilare (assenza di ADP e presenza di substrato e ossigeno) o per azione di tossici e agenti disaccoppianti la fosforilazione ossidativa che riducono l’utilizzo dell’ossigeno.
- Anche la membrana plasmatica rappresenta una fonte molto importante di ROS, soprattutto a livello dei leucociti polimorfonucleati (PMN). Quando questi ultimi incontrano e uccidono i microrganismi, mostrano una vera e propria esplosione del consumo di ossigeno non mitocondriale, dovuta alla produzione di perossido di idrogeno. Infatti nella membrana di queste cellule sono localizzati diversi enzimi, quali la NADPH ossidasi e le lipossigenasi, la cui attivazione si accompagna alla produzione, rispettivamente, di anione superossido e di intermedi metabolici con caratteristiche simili ai perossidi. Il ruolo battericida dei radicali e dei loro metaboliti (H2O2 e HOCL) si basa su di una NADPH
ossidasi (l’unico enzima dell’organismo a produrre superossido in modo non casuale ma programmato), che catalizza la formazione di anione superossido da NADPH(H+) e ossigeno molecolare, in seguito a
stimolazione specifica dei polimorfonucleati da parte di endotossine, batteri, anticorpi, ecc.
La produzione di ROS a livello della plasmamembrana dei PMN avviene tipicamente in corso di processi reattivi (infezioni, immunoreazioni patogene, infiammazioni, allergie) ed i segni tipici della flogosi sono in parte il risultato dell’attivazione radicalica dei neutrofili richiamati in situ.
Tale meccanismo di azione è tanto importante che, l’incapacità genetica a produrre superossidi causa la condizione nota come malattia granulomatosa cronica, nella quale i neutrofili hanno grosse difficoltà a uccidere i microrganismi fagocitati, con il risultato di infezioni ricorrenti e spesso setticemie.
- Oltre alla membrana plasmatica e ai mitocondri, anche i
perossisomi rappresentano una fonte importante di ROS. In questi
organuli cellulari, infatti, avviene un particolare processo di β-ossidazione degli acidi grassi in cui una flavoproteina estrae una coppia di atomi di idrogeno da una molecola di acido grasso attivato (acetil-CoA) trasferendola direttamente all’ossigeno molecolare, con formazione di perossido di idrogeno.
- Nel reticolo endoplasmatico la produzione di specie reattive passa attraverso il citocromo P450 il quale agisce come donatore immediato di
elettroni in molte reazioni di idrossilazione, in particolare quelle che avvengono all’interno degli epatociti e che sono finalizzate
all’inattivazione di ormoni e composti non fisiologici come gli xenobiotici. .
1.1.4 Sintesi di radicali liberi nei processi reattivi
Da quanto detto fin ora sembra chiaro che i ROS rappresentano intermedi obbligati del metabolismo cellulare e che, in alcuni casi, la loro produzione rappresenta un passaggio essenziale per l’esplicazione di importanti meccanismi fisiologici.
Produzione di radicali liberi in corso di flogosi:
In ciascun comparto cellulare la produzione di specie reattive ha una sua specifica funzione non solo nel fisiologico metabolismo, ma anche nei processi reattivi, quali infezioni e infiammazioni, soprattutto per quanto riguarda i radicali liberi prodotti a livello della membrana dei PMN. Queste “attività immunologiche” si estrinsecano non solo nei confronti di componenti estranei, ma anche contro componenti self quali tessuti o organi trapiantati (reazioni di rigetto), e nei processi di guarigione di organi e tessuti soggetti a traumi. Infatti i leucociti migrano in ogni area lesa, si attivano, iniziano a bombardare le cellule danneggiate con i radicali liberi i quali accelerano la loro distruzione, l’allontanamento dei prodotti di lisi e il corrispondente recupero.
Quindi, poichè i PMN sono coinvolti in pressoché tutti i processi patologici, indipendentemente dal meccanismo patogenetico alla base, e
poiché i PMN rappresentano la fonte quantitativamente maggiore di produzione dei radicali liberi, quest’ultimi sono comuni ad un gran numero di patologie.
Produzione di radicali liberi nei processi di ischemia-riperfusione: Nella cellula le reazioni biochimiche che si verificano nelle fasi finali del catabolismo dei nucleotidi purinici danno origine a radicali liberi. Infatti sia l’ossidazione dell’ipoxantina a xantina che della xantina a acido urico, sono catalizzate dalla xantina deidrogenasi che usa NAD+ come accettore di elettroni. Nei tessuti che contengono abbondante xantina deidrogenasi, questo enzima diventa una importante fonte di superossido durante la riossigenazione del tessuto conseguente all’ischemia o dopo estrema ipotensione, come nello shock emorragico. Durante l’ischemia si verifica una massiva demolizione del pool dei nucleotidi adenilici a causa del basso stato di energia dei tessuti; l’adenosina viene convertita ad inosina e quindi a ipoxantina, che si accumula in abbondanza. Quindi, in seguito al successivo danno da ischemia–riperfusione in cui la xantina deidrogenasi è convertita a xantina ossidasi, quest’ultima, utilizzando come accettore finale di elettroni direttamente l’ossigeno, genera una notevole quantità di perossido di idrogeno e anione perossido, a partire rispettivamente da xantina e ipoxantina.
In realtà, piccole quantità di O2• - vengono prodotte nel tessuto
riperfuso da parte della xantina ossidasi. La quantità in sé di questo superossido non è sufficiente a causare un massiccio danno tissutale ma può iniziare un’infiltrazione di neutrofili per l’attivazione di citochine
superossido-dipendenti. L’attivazione viene ad essere amplificata dalla prima ondata di neutrofili che generano altro superossido. Il fattore perciò serve ad amplificare e mantenere il processo di chemiotassi, e la maggior parte del danno tissutale deriva dagli ossidanti generati dai neutrofili che invadono il tessuto (Verna F. et al., 2005).
1.1.5 Fattori esterni nella genesi dei radicali liberi
La produzione di radicali liberi è influenzata anche da fattori esterni quali agenti fisichi, chimici e biologici, da soli o in combinazione tra loro. Questi possono indurre direttamente la generazione di ROS o aumentarne la fisiologica produzione attraverso una specifica stimolazione metabolica.
Tra gli agenti fisici, sono da segnalare: - le radiazioni ionizzanti
- raggi UV
Entrambi possono indurre il fenomeno della scissione omolitica dell’acqua nella quale l’acqua assorbe energia e la utilizza per scindere uno dei suoi legami covalenti con l’idrogeno: i prodotti saranno due radicali liberi, il radicale idrossile e l’atomo di idrogeno. Considerando che gli esseri viventi sono costituiti per la maggior parte di acqua, e che sono costantemente esposti ai raggi solari, si capisce come questa fonte di produzione di radicali liberi sia determinante.
- l’ozono, che genera direttamente radicali perossilici per interazione con composti fenolici
- gli idrocarburi aromatici policiclici che attivano il sistema del citocromo P450 e quindi la produzione di radicali.
Agenti biologici che tipicamente aumentano la produzione di radicali sono :
- i batteri, nell’ambito del fisiologico processo di difesa dalle infezioni
- taluni anticorpi, nell’ambito di alcune reazioni immunopatogene (in questi casi sono chiamati in causa i PMN). Infine è necessario tener presente che si ha aumento dei ROS anche in corso delle seguenti situazioni:
- intenso sforzo muscolare - in corso di flogosi
- in corso di ischemia/riperfusione - in corso di numerose malattie.
1.2 AGENTI ANTIOSSIDANTI
Gli organismi viventi hanno sviluppato, nel corso dell’evoluzione, un insieme di meccanismi di difesa nei confronti delle specie reattive ossidanti. Si tratta di agenti antiossidanti chimicamente eterogenei (enzimi, vitamine, oligoelementi…) in grado di prevenire o annullare l’azione ossidante delle specie chimiche reattive.
Il sistema di difesa antiossidante è regolarmente distribuito nell’organismo, sia a livello extracellulare che intracellulare.
Nel plasma si trova la cosiddetta barriera antiossidante rappresentata dall’insieme delle sostanze potenzialmente in grado di cedere equivalenti riducenti così da stabilizzare i radicali liberi. Ne fanno parte tutte le proteine e, in particolar modo, l’albumina, la bilirubina, l’acido urico, il colesterolo, e i vari antiossidanti esogeni introdotti con l’alimentazione. Molto importanti, in questo contesto, sono i gruppi tiolici.
Un antiossidante ideale dovrebbe:
• legare i radicali liberi in modo specifico; • chelare metalli riducenti;
• interagire con altri antiossidanti: alcuni antiossidanti sono capaci di rigenerare altri antiossidanti recuperandone la funzione originale. Questo processo è chiamato: “antioxidant network” (H. Sies et al., 2005);
• avere un effetto positivo sull’espressione genica;
• essere presente nei tessuti e nei fluidi biologici in concentrazioni fisiologicamente rilevanti;
• essere efficace sia in ambiente acquoso che a livello delle membrane.
E’ importante sottolineare che gli antiossidanti di tipo enzimatico sono presenti prevalentemente a livello extracellulare. Qui gli agenti liposolubili (come i tocoferoli), entrando nella compagine delle biomembrane, costituiscono la prima linea di difesa contro l’attacco dei radicali liberi, mentre quelli idrosolubili (ascorbato) intervengono soprattutto nel contesto della matrice solubile del citoplasma e degli organuli cellulari.
A seconda del meccanismo d’azione con cui esercitano la loro funzione vengono distinti in quattro classi.
1.2.1 Antiossidanti preventivi
Ne fanno parte gli antiossidanti che agiscono in modo diretto impedendo la generazione stessa dei radicali liberi.
Tra questi esistono:
1. antiossidanti che sequestrano i metalli di transizione: Come spiegato precedentemente questi metalli agiscono da catalizzatori nella scissione dei perossidi portando alla formazione di radicali liberi estremamente reattivi e istolesivi, quali l’idrossile, l’alcossile, il percossile, secondo la reazione di Fenton.
Quindi, uno dei meccanismi di difesa dell’organismo consiste nella presenza di una serie di proteine aventi la capacità, più o meno specifica, di complessare i metalli di transizione, ed impedire a questi ultimi di esistere in forma libera e quindi di esercitare la loro azione istolesiva. Tra le varie proteine che svolgono questa funzione ricordiamo la
ferritina, che forma un complesso con il ferro all’interno delle cellule, e la transferrina e la lattoferrina che formano complessi con il ferro nei liquidi extracellulari, nel sangue circolante e nelle secrezioni. Il ferro, liberatosi da eventuali processi emolitici sottoforma di eme, e che risulta cataliticamente attivo secondo la reazione di Fenton, viene bloccato da altre proteine specifiche quali l’aptoglobina (che veicola l’emoglobina) e l’emopessina (che stabilizza l’eme). Allo stesso modo la ceruloplasmina, in modo specifico, e in parte l’albumina, hanno il compito di chelare il rame circolante.
Alcune condizioni, come l’acidosi, possono determinare una modifica conformazionale delle proteine plasmatiche chelanti, provocando il rilascio dei metalli di transizione in forma libera. Una volta liberi, il ferro e il rame innescheranno la reazione di Fenton, determinando la formazione dei radicali liberi, quali i radicali alcossilici e perossilici, estremamente reattivi.
2. quencher: Gli antiossidanti preventivi che agiscono limitando l’azione dei radicali dell’ossigeno singoletto sono detti “quencher”; ne sono importanti esempi i caroteni e le superossido dismutasi.
- I caroteni si ritrovano nei vegetali e svolgono azione antiossidante nei confronti dell’ossigeno singoletto generatosi in corso di fotosintesi. E’ stato calcolato che una molecola di B-carotene è in grado di neutralizzare circa 1000 molecole di ossigeno singoletto e ciò è determinante se si considera che il 20% dell’ossigeno molecolare consumato nel corso del “respiratory burst” dei leucociti PMN, è convertito nella specie reattiva dalla mieloperossidasi. Inoltre pare che
sia da attribuire ai carotenoidi la neutralizzazione del 40% dell’ossigeno singoletto nel torrente plasmatici.
- La superossido dismutasi (SOD) è un enzima presente in tutte le cellule, la cui attività catalitica consiste nella dismutazione di due molecole di anione superossido in perossido di idrogeno e ossigeno molecolare. Si ottiene così un debole ossidante relativamente stabile (il perossido di idrogeno) in confronto al precursore di partenza (l’anione superossido) molto più aggressivo.
O
2• -⇒ O2
+ H
2O
2In realtà si deve tener presente che in particolari condizioni, come ad esempio l’acidosi, la presenza di metalli di transizione liberi, può determinare la trasformazione del perossido di idrogeno a radicale idrossile.
Esistono diverse isoforme della SOD, che si differenziano in base alla natura del nucleo metallico attivo e sulla base degli aminoacidi costituenti. Si possono così riassumere: Cu e Zn-SOD (citosoliche), Mn-SOD (mitocondriali), Mn-SOD extracellulari (Landis G.N. et al., 32).
3. perossidasi: Del primo gruppo di antiossidanti fanno parte anche le perossidasi che esercitano la loro azione nei confronti dei perossidi, sostanze radicaliche relativamente deboli derivanti dall’attacco dei ROS sui substrati organici come carboidrati, lipidi, amminoacidi.
In particolare esistono gli idroperossidi (R-OOH) e il perossido di idrogeno (H2O2) i quali, in ambiente acido e in presenza di metalli di
transizione dissociati, possono dare origine a radicali molto più nocivi, come l’alcossile, il percossile, l’idrossile. Le perossidasi hanno un principio d’azione comune che prevede la demolizione del perossido con
liberazione di una molecola di ossigeno molecolare e una di alcool, se il substrato è un idroperossido, oppure di acqua, se il substrato è perossido di idrogeno.
In questo ultimo caso la perossidasi viene chiamata catalasi, ed esiste nelle maggior parte delle cellule animali e vegetali in cui svolge la funzione di inattivare il perossido di idrogeno.
2 H2O2
⇒ 2H2O+ O2
Le perossidasi in grado di agire anche su altri tipi di perossidi organici presentano come cofattore il glutatione e pertanto sono chiamate glutatione perossidasi. Queste hanno una diffusione ubiquitaria nei tessuti e aumentano fortemente in presenza di elevati livelli di perossidi. La glutatione perossidasi compete con le catalasi per il substrato H2O2
ed è la risorsa protettiva maggiore contro bassi livelli di stress ossidativi. Il ruolo protettivo del glutatione (GSH) nei confronti dello stress ossidativo è svolto attraverso diversi meccanismi:
1. Come suddetto il glutatione è un cofattore di diversi enzimi detossificanti , quali la glutatione per ossidasi, la gluatatione transferasi e altri.
2. Il GSH partecipa nel trasporto degli aminoacidi attraverso le membrane cellulari.
3. Il GSH è capace di rigenerare i più importanti antiossidanti , come la vitamina C ed E, nelle loro forme attive.
1.2.2 Antiossidanti che agiscono inattivando specie reattive già
formate
Il secondo gruppo di antiossidanti comprende una serie di sostanze generalmente a basso peso molecolare, chimicamente eterogenee, dette scavenger e chain breaker.
1. Gli scavenger (“spazzini”) riducono la concentrazione di radicali liberi rimuovendoli dal mezzo in cui si trovano, grazie alla loro capacità di interagire direttamente con essi e quindi di inattivarli. Tra questi, l’ubichinone, i composti tiolici e l’acido urico.
L’ubichinone è una sostanza liposolubile, presente in tutti i sistemi di accoppiamento di energia legati alle membrane; è conosciuto anche come coenzima Q
È un importante trasportatore di elettroni e rientra in un complesso sistema di ossidoriduzioni a livello mitocondriale. In realtà l’ubichinone può comportarsi sia da scavenger che da generatore di specie reattive, attraverso il fenomeno di autoossidazione, mediante una reazione il cui equilibrio dipende dalle condizioni chimiche del microambiente. In particolare, a livello delle membrane biologiche prevale l’attività antiossidante nei confronti della lipoperossidazione. Pertanto l’ubichinone possiede effetti protettivi nei confronti del danno ossidativo verso i lipidi, le proteine e il DNA.
Tra gli scavenger idrosolubili, i tioli rappresentano una componente quantitativamente significativa della barriera antiossidante sia intracellulare che plasmatica. Di questi fa parte il sistema della
tireodoxina (TRX) che è attiva nella sua forma ridotta TR-(SH)2 ( in
seguito all’azione della tireodoxina riduttasi).
L’acido urico, prodotto in seguito all’ossidazione dell’ipoxantina e della xantina, è una molecola idrosolubile che si accumula nei liquidi corporei e, a pH fisiologico, è presente in forma completamente ionizzata (urato). Si è visto che l’urato è un potente antiossidante ad azione scavenger nei confronti del radicale idrossile, dell’acido ipocloroso, dell’ossigeno singoletto e dell’ozono. Inoltre esso è in grado di chelare ioni di metalli di transizione.
2. I chain breaker (“che spezzano la catena”) sono agenti in grado di bloccare la propagazione delle reazioni radicaliche a catena. Tra queste sono da citare carotenoidi, tocoferoli (liposolubili) e ascorbato (idrosolubile).
I caroteni, oltre che agire da “quencher”, possono agire anche da chain breaker, formando complessi con il radicale idroperossilico e bloccandone l’azione spiccatamente elettrofila che determina la lipoperossidazione. Tra i caroteni va considerata a parte la vitamina A che, essendo fortemente insatura, risulta molto reattiva nei confronti dei radicali perossilici; questi vengono intrappolati nella sua molecola, la quale funziona principalmente da chain breaker piuttosto che da donatrice di equivalenti riducenti.
I tocoferoli, riuniti in otto principali isomeri sotto la denominazione di vitamina E, sono ampiamente distribuiti in natura.
In particolare la forma alfa agisce come un antiossidante catturando i radicali lipoperossilici prima che interagiscano con il substrato, prevenendo, in questo modo, il danno a carico di strutture lipidiche
complesse e delicate quali le membrane biologiche e le lipoproteine plasmatiche.
La vitamina C è una vitamina idrosolubile, la cui attività antiossidante, in vivo, è legata alla capacità di esistere in forma ridotta e ossidata tra loro interconvertibili. Essa è in grado di agire come scavenger nei confronti dei radicali superossido e idrossilico e di intrappolare i radicali idroperossilici nella fase acquosa, prima che diffondano nei lipidi della membrana, prevenendo così la lipoperossidazione. Come l’ubichinone, anche la vitamina C può agire da agente proossidante, anche se tale azione è meno rilevante.
1.2.3 Antiossidanti che agiscono dopo che il danno da radicale si
è instaurato
Al terzo gruppo di antiossidanti appartengono quelle sostanze che agiscono esclusivamente dopo che il danno da specie reattive si è instaurato. La loro azione prevede prima l’identificazione del segmento molecolare ossidato, poi la separazione del frammento ormai inutilizzabile e, infine, la sintesi e l’inserimento di un nuovo segmento in sostituzione di quello danneggiato. Tali sostanze, dette agenti di riparo, sono le idrolisi, le trasferasi e le polimerasi, tutte indispensabili per la riparazione del danno da radicali liberi di importanti molecole o strutture cellulari.
1.2.4 Agenti di adattamento
Infine ci sono gli agenti di adattamento che comprendono tutte quelle sostanze o tecniche o procedure attraverso le quali è possibile
potenziare il sistema antiossidante fisiologico dell’organismo. Per esempio, un corretto esercizio fisico o l’adozione di un regime alimentare controllato sono misure di per sé in grado di controllare il metabolismo ossidativo attraverso la riduzione della produzione di specie reattive e l’induzione di enzimi ad attività antiossidante.
In conclusione, gli antiossidanti enzimatici più efficienti sono (30): • superossido dismutasi;
• catalasi;
• glutatione per ossidasi.
Mentre gli antiossidanti non enzimatici più efficaci sono (31): • vitamina C;
• vitamina E; • carotenoidi;
• antiossidanti tiolici; • flavonoidi naturali.
1.3 EQUILIBRIO OSSIDANTI-ANTIOSSIDANTI: LO STRESS OSSIDATIVO
La tendenza a considerare gli agenti ossidanti come “cattivi” e gli antiossidanti come “buoni” non corrisponde alla realtà. Infatti una più realistica considerazione deve far ritenere corretto un equilibrio fra ossidanti e antiossidanti. Negli organismi sani questo equilibrio è mantenuto. In condizioni patologiche, invece, lo squilibrio tra produzione di ROS e le difese antiossidanti produce uno “stress ossidativo” .
Ciò può essere dovuto a :
1. aumentata produzione di specie reattive: • radiazioni, inquinamento
• gravidanza
• alimentazione, alcool, fumo, esercizio fisico • stress psicoemotivo
• traumi, infiammazioni, infezioni, vasculopatie, neoplasie.
• Farmacoterapia, radioterapia, raggi x 2. riduzione delle difese antiossidanti:
• ipovitaminosi, diete squilibrate • sindromi da malassorbimento • fattori genetici o iatrogeni
• eccessiva produzione di specie reattive • sovraccarico del sistema microsomiale
3. aumento dei radicali liberi e riduzione degli antiossidanti
Agendo da tossine endogene i radicali liberi danneggiano tutti i tipi di macromolecole come proteine, carboidrati, lipidi e acidi nucleici. Vengono anche prodotti danni extracellulari consistenti principalmente in perossidazione dell’acido arachidonico e depolimerizzazione di glicosamminoglicani del glicocalice e degli interstizi, degradazione del collageno con aumento della permeabilità vascolare e destabilizzazione dei tessuti, inibizione di proteine difensive fisiologiche come l’α-1-antitripsina e la fibronectina, alterazione dell’omeostasi ionica. Sul piano generale queste lesioni, dapprima cellulari e poi tissutali, saranno responsabili, infine, di patologie d’organo.
Come descritto precedentemente lo stress ossidativo a carico dei diversi siti cellulari è indotto da situazioni fisiopatologiche diverse che possono essere così riassunte:
1. stress ossidativo indotto prevalentemente da modificazioni reattive della superficie cellulare: provocato dall’attivazione della membrana plasmatica (soprattutto a carico dei leucociti PMN) in corso di processi reattivi quali infezioni e infiammazioni
2. stress ossidativo indotto prevalentemente da una ridotta efficienza della respirazione cellulare, per una patologia primaria dei mitocondri, un’eccessiva attivazione metabolica.
3. stress ossidativo secondario prevalentemente a induzione farmacometabolica, provocato da un’attivazione del
sistema di idrossilazione a funzione disintossicante del citocromo P 450
4. stress ossidativo indotto prevalentemente da variazioni della tensione intracellulare di ossigeno, tipico delle lesioni da ischemia-riperfusione (Iorio E.L., 2004).
1.3.1 Effetti dello stress ossidativo sulle malattie organiche Alterazioni lipidica:
La perossidazione lipidica avviene sugli acidi grassi insaturi e polinsaturi; la frammentazione e le alterazioni molecolari degli acidi grassi insaturi dei fosfolipidi determinano destrutturazione delle membrane, diminuità fluidità, alterazione delle interazioni lipidi-lipidi e lipidi-proteine e, di conseguenza, alterata permeabilità e reattività cellulare. Il danno ossidativo a carico degli acidi grassi insaturi dei lipidi di membrana inizia quando l’idrogeno del gruppo laterale –CH2,
localizzato tra due doppi legami, è attaccato dai radicali liberi derivati dall’ossigeno, in particolare da OH• . L’interazione radicali-lipidi avvia una reazione a catena autocatalitica (propagazione) con formazione di perossidi e danno esteso a livello della membrana, degli organuli e della cellula.
Un esempio molto chiaro della complessità dei meccanismi che regolano lo stato ossidativo dei tessuti è rappresentato dal ruolo del radicale perossido nell’iniziare e terminare la perossidazione lipidica. In corso di riperfusione post-ischemica, in cui si ha la formazione di una
quantità di radicale superossido sufficiente a causare danno tissutale, la somministrazione di SOD protegge il tessuto riperfuso. Questo però è vero solo fino ad una certa concentrazione di SOD, oltre la quale la protezione scompare e, al crescere ancora della dose, il danno viene addirittura peggiorato. La ragione di ciò risiede nel doppio ruolo della SOD nella perossidazione lipidica. Rilasciando e riducendo il ferro, il superossido può iniziare la catena di reazioni del radicale libero che si arresta solo con l’annullamento radicale-radicale. Poiché il superossido viene prodotto continuamente da tutte le cellule, sembra possibile che basse concentrazioni di radicale possano utilmente terminare la catena di perossidazioni lipidiche. Il radicale superossido (O2• - ), quindi, oltre ad
avviare la perossidazione lipidica è in grado di arrestarla, tanto che, eliminare oltremisura il radicale può aumentare la perossidazione lipidica (Verna F. et al., 2005) .
Alterazioni glicoproteiche:
Si possono avere fenomeni di alchilazione di gruppi funzionali critici di proteine (ad esempio gruppi SH) da parte di prodotti aldeidici derivati dalla perossidazione, con formazione di ponti disolfuro intramolecolari o rottura dei legami peptidici. Ciò può determinare alterazioni a carico di proteine essenziali per l’omeostasi cellulare. Importante è l’alterazione di proteine del citoscheletro (actina e tubulina) e delle proteine di regolazione dei canali del calcio.
Gli effetti dei radicali liberi sui carboidrati possono determinare depolimerizzazione dei polisaccaridi con alterazione dei recettori di membrana (La Torre F. et al., 1996).
Alterazioni del DNA nucleare e mitocondriale:
Gli acidi nucleici vengono danneggiati per ossidazione delle basi nucleotidiche e conseguente mutazione genomica o per rottura dello scheletro fosforibosilico. A differenza delle rotture a singolo filamento, le rotture a doppio filamento non possono essere riparate, con conseguente morte cellulare per inefficacia della replicazione cromosomica. Tutte queste modificazioni sono mutagene, poiché cambiano gli appaiamenti tra basi, che non rispettano più le regole di Watson e Crick, determinando errori nella fase di replicazione del DNA (La Torre F. et al., 1996) (Van Holde M., 1998) (Valko M et al., 2006).
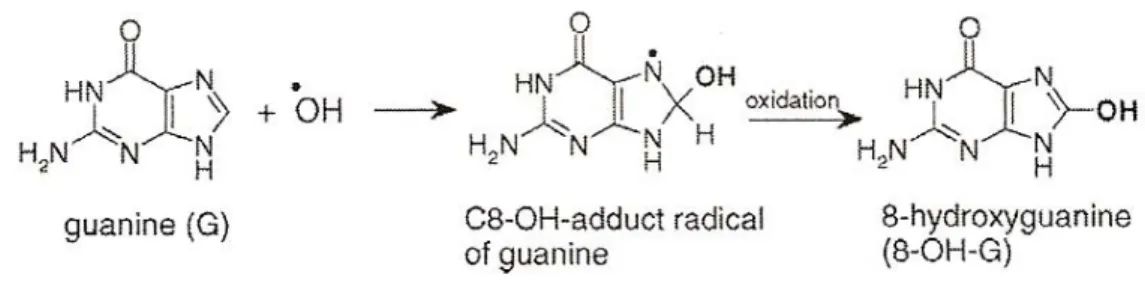
L’interazione delle basi azotate o delle molecole di zucchero dei nucleotidi con i radicali liberi generano una varietà di basi o zuccheri modificati, rotture a livello della catena del DNA, siti privi di basi o cross-links. Un esempio è rappresentato dalla reazione di una guanina con un radicale idrossilico che determina la formazione di una 8-idrossiguanina (8-OH-G) (vedi figura 1.4). La presenza di 8-OH-G nell’urine umane fu riportata per la prima volta da Ames et al. (Shigenaga M.K. et al.,1989). Questo prodotto dell’ossidazione del DNA è importante perché si forma facilmente ma è in grado di indurre mutazioni e tumori. Inoltre è un buon marker dello stress ossidativo degli organismi e quindi, potenzialmente, dell’oncogenesi (Kasai H. et al., 2001).
Figura 1.4 - reazione tra una guanina e un radicale idrossilico.
Oltre ai ROS anche gli RNS sono implicati nel danno al DNA. La reazione tra la guanina e i perossinitriti determina la formazione di 8-nitroguanina che può determinare a sua volta una modificazione nelle basi azotate, da G:C a T:A. La potenziale connessione tra questo e il processo ontogenetico non è ancora stata ben chiarita.
Sono state individuate correlazioni tra l’insorgenza delle neoplasie e il danno ossidativo al DNA mitocondriale. Il DNA mitocondriale è più suscettibile allo stress ossidativi rispetto al DNA nucleare in quanto:
• in condizioni fisiologiche i mitocondri convertono circa il 5% dell’ossigeno consumato in anioni superossido e successivamente in perossido di idrogeno.
• La capacità di riparazione del DNA mitocondriale è molto più limitata.
• Il DNA mitocondriale non è protetto dagli istoni.
Il perossido di idrogeno e altre specie reattive dell’ossigeno sono implicati nell’attivazione di geni nucleari che sono coinvolti nella trascrizione e replicazione del genoma mitocondriale. Ancora non è stata ben chiarita la correlazione tra alterazioni del DNA mitocondriale e
livello di cellule neoplastiche (Penta J.S et al.,2001). Inoltre frammenti di DNA mitocondriale sono stati ritrovati inseriti a livello del DNA nucleare, e questo suggerisce un possibile meccanismo per l’attivazione di oncogeni (Penta J.S et al.,2001).
In conclusione si può affermare che lo stress ossidativo è direttamente o indirettamente coinvolto con il danno cellulare e tissutale che si riscontra in un alto numero di patologie. In medicina umana l’intervento dei radicali liberi è stato chiamato in causa nella patogenesi di numerosissime malattie (Flora S.J., 2007):
• forme tumorali (Coehen J.H. et al., 2000) • artrite (Halliwell B., 1997)
• cataratta (Mastromatteo A. et al., 2003)
• retinite pigmentosa e altre patologie oculari (Stefek M. et
al.,2005)
• patologie del sistema cardiocircolatorio (ipertensione, aterosclerosi, ictus e infarto) (Polidori M.C. et al.,1998) (Yang T. et al., 2001). Le LDL, deputate principalmente al trasporto di colesterolo nel plasma, a contatto con i radicali liberi vengono ossidate con alterazioni delle proprietà fisico strutturali e della loro attività biologica, e trasformate in fattori causali del processo aterosclerotico (McEwen J.E. et
al., 2005). L’anione superossido, inoltre è in grado di
distruggere l’ossido nitrico che regola il calibro dei vasi, provocando ipertensione (Zalba G. et al., 2005)
• patologie del sistema nervoso centrale (demenza di Alzheimer, morbo di Parkinson) (Linert W. et al., 2000) (Venarucci D. et al., 1999)
• malformazioni teratogeniche (Wells P.G. et al., 2005)
Anche nel cane sono stati condotti studi finalizzati ad evidenziare questo tipo di correlazione con risultati interessanti per quanto concerne soprattutto alcuni tipi di patologie:
• patologie cardiache (Gu W. et al., 2003)
• tumori (Quong J. et al., 2002) (Kumaraguruparan R. et al., 2004) (Szczubial M. et al., 2004) (Vajdovich P. et al., 2005) • patologie infiammatorie (Pavlica Z. et al., 2004)
• patologie infettive (Jacobson L.S. et al., 2002) (Kiral F. et
al., 2005)
• insufficienza renale (Singh D. et al., 2006)
Ancora non è stato possibile chiarire con certezza se lo stress ossidativo possa essere considerato una causa primaria o solo l’effetto della malattia stessa, ma, anche in quei casi in cui le specie reattive si sviluppino secondariamente alla patologia, l’innesco di reazione a catena può comunque contribuire ad aggravare il danno cellulare.
Risulta chiaro quindi che, la valutazione del patrimonio antiossidante e dello stato ossidativo del soggetto, rappresentano un indicatore importante del buon funzionamento dell’organismo, in quanto il primo permette di monitorare i mezzi a disposizione per far fronte ad una eventuale situazione di stress ossidativo, mentre il secondo ci fornisce le indicazioni per valutare un eventuale danno cellulare (Langhseth L et al., 1995).
S
ST
TR
RE
ES
SS
S
O
OS
SS
SI
ID
DA
A
TI
T
IV
V
O
O
E
E
O
ON
N
CO
C
OG
GE
EN
N
ES
E
SI
I
2.1 RUOLO DELLE SPECIE REATTIVE NELL’INCIDENZA DELL’ONCOGENESI
Lo sviluppo del tumore, sia nell’uomo che negli animali, è un processo caratterizzato da varie fasi in cui si assiste a complessi cambiamenti sia a livello cellulare che molecolare, mediati da una notevole varietà di stimoli endogeni e esogeni.
Tra questi, ormai da molto tempo, si è supposto che fossero implicati i radicali liberi (Valko M. et al, 2004). In particolare, negli ultimi vent’anni, c’è stato un interesse crescente nei confronti dei ROS (specie reattive dell’ossigeno) e degli RNS (specie reattive dell’azoto) allo scopo di indagare la loro diretta o indiretta implicazione nei numerosi meccanismi coinvolti nell’oncogenesi.
E’ noto che ROS e RNS svolgono una duplice funzione nei sistemi biologici, dal momento che possono essere sia dannosi che benefici a livello degli organismi viventi. Gli effetti benefici riguardano il ruolo fisiologico che questi svolgono nel metabolismo cellulare e nella risposta alle noxae patogene. D’altra parte, ad alte concentrazioni, i ROS possono essere importanti mediatori del danno cellulare a vari livelli, a carico delle membrane, dei lipidi, delle proteine e degli acidi nucleici (Valko M. et al, 2006).
Nonostante la presenza di sistemi di difesa antiossidanti, il danno ossidativo che si accumula durante il ciclo vitale è stato individuato come elemento chiave nello sviluppo di patologie tipiche
dell’invecchiamento come il tumore, l’arterosclerosi, le artriti e altri disordini neurodegenerativi (Valko M. et al, 2006) .
Numerosi lavori di ricerca, principalmente in medicina umana, hanno discusso gli effetti che lo stress ossidativo può avere sui diversi stadi della carcinogenesi, dall’insorgenza, all’espansione del clone cellulare neoplastico, all’acquisizione dei caratteri di malignità (Dreher D. et al, 1996). Da questi studi, infatti, è emerso che le cellule tumorali mostrano una alterata espressione degli antiossidanti che metabolizzano i ROS (particolarmente della superossido dismutasi e delle catalasi) (Oberley L.W. et al, 1979), (Oberley L.W. et al, 1981), producono livelli di ROS (particolarmente idroperossidi) più alti rispetto alle cellule normali (Spitz D.R. et al, 2000), (Szatrowski T.P et al, 1991) ed infine che, antiossidanti introdotti con la dieta, hanno un effetto benefico nel trattamento e nella prevenzione dei tumori maligni (Valko M. et al, 2004), (Valko M. et al, 2006). Farinati F. et al hanno eseguito uno studio atto a confermare l’importanza patogenetica dei ROS in corso di tumore gastrico. A tale scopo hanno monitorato la concentrazione di sostanze reattive dell’acido tiobarbiturico (TBARS) e la concentrazione dell’8-idrossideossiguanina (8-OHdG) (2 metodi indiretti di quantificare il danno al DNA mediato da ROS) in corso di gastrite cronica successivamente evoluta a tumore. E’ emerso che le gastriti croniche sono caratterizzate da un accumulo di danno ossidativo a livello del DNA con potenzialità mutageniche e ontogenetiche.
E’ stato stimato che una cellula umana è esposta approssimativamente a 105 insulti ossidativi al giorno da parte di radicali di varia natura (Valko M. et al, 2006). Da questo danno ossidativo
derivano modificazioni del materiale genetico che rappresentano un primo step nell’oncogenesi.
Diversi studi hanno dimostrato che tutte e 4 le basi azotate che si trovano nella doppia elica del DNA possono essere modificate dai ROS ma le alterazioni sulle basi CG (citosina-guanina) sono molto più frequenti di quelle sulle basi AT (adenina-tirosina) (Retel J. et al, 1993). Infatti, la maggior parte delle mutazioni provocate dai radicali liberi in corso di tumore nell’uomo sembra determinare modificazioni a livello della guanina, inducendo trasformazioni da G a T (soprattutto in corso di soppressione del gene p53) (Higinbotham K.G. et al, 1992) (Lunec et al, 2002). Il tipo di modificazione che è stato osservato più volte è rappresentato dalla sostituzione di paia di basi, mentre delezioni o inserzioni di basi si verificano più di rado.
Normalmente le alterazioni del DNA causate dai radicali sono risolte attraverso meccanismi più o meno specifici, di cui, il più importante, si pensa che sia rappresentato dalla rimozione delle basi mutate. Errori nei processi di riparazione del DNA possono determinare, a loro volta, l’insorgenza di mutazioni, e quindi ricoprire un ruolo significativo nei processi oncogenetici. Si è visto che circa l’80% dei tumori nell’uomo sono causati da sostanze cancerogene che danneggiano il DNA o interferiscono con la sua riparazione o replicazione (Dreher D.
et al, 1996) (Voet D et al, 2005).
E’ noto che i meccanismi di riparazione diventano sempre meno efficienti, con l’età, e questo porta ad un accumulo di lesioni a carico del materiale genetico. Inoltre sembra che la sequenza specifica dei siti danneggiati del DNA influisca sulla frequenza delle mutazioni, quindi, lo