Capitolo 5
Modello ODE della proteolisi del collagene
5.1 DESCRIZIONE
Dopo aver visto e compreso quali sono i meccanismi che portano alla degradazione del collagene, sarà presentato in questo capitolo il primo modello teorico del network biochimico che descrive la proteolisi del collagene di tipo I da parte della metalloproteinasi di matrice 2 (MMP2) e della membrane-type 1 (MT1-MMP) in presenza dell'inibitore tissutale delle metalloproteinasi 2 (TIMP2). Questo modello, che si trova in letteratura ed è costituito da un sistema di equazioni differenziali ordinarie non lineari, descrive l'evoluzione nel tempo della concentrazione delle varie specie coinvolte e viene poi confrontato con il corrispondente modello ad agenti messo a punto in questo lavoro di tesi.
Abbiamo già visto come le MMP siano coinvolte nella proteolisi del collagene ma, sebbene si sapesse dell'esistenza di queste proteine da molto tempo e fossero già studiate sperimentalmente, solo ultimamente si è arrivati ad una descrizione quantitativa ed integrativa dei meccanismi biochimici responsabili della degradazione della matrice extracellulare.
Il modello che andremo a vedere, descrive infatti tutta la rete biochimica responsabile appunto della degradazione del collagene di tipo I da parte della MT1-MMP, che sotto condizioni fisiologiche risiede alla superficie cellulare, e della MMP2 in presenza dell'inibitore TIMP2. Tutte le reazioni biochimiche coinvolte sono modellate in una soluzione grossa e ben mescolata ed in un sistema libero da cellule. Questa descrizione segue una varietà di approcci sperimentali dove le MMP2 libere, le MT1-MMP legate a frammenti di membrana, o le proteine prive del loro dominio transmembrana che le restringe sulla superficie cellulare (TM-MT1-MMP) interagiscono con i loro substrati o i loro inibitori.
Sotto condizioni fisiologiche le MMP2 sono secrete principalmente da cellule endoteliali nella loro forma inattiva, o zimogeno, o pro-MMP2, ed è stato stabilito che la sua attivazione avviene maggiormente attraverso un meccanismo che coinvolge la formazione del complesso zimogeno, MT1-TIMP2 e TIMP2 in un rapporto stechiometrico di 1:1:1.
Il modello proposto può servire come strumento per quantificare l'attivazione del pro-MMP2 in funzione delle concentrazioni di MT1-MMP e TIMP2. In accordo con una precedente ipotesi basata su esperimenti riguardante gli effetti del TIMP2 sull'attivazione del pro-MMP2, in questo modello si dimostra che basse concentrazioni di TIMP2 non sono sufficienti a far partire l'attivazione della
pro-MMP2, mentre alte concentrazioni inibiscono il processo di attivazione del zimogeno. Inoltre si fanno previsioni sui rapporti di concentrazione: l'attivazione infatti avviene a più alte velocità di reazione.
Viene incorporata in questa descrizione anche la perdita dell'ectodominio da parte dell'MT1-MMP, un processo dove la parte catalitica del MT1-MMP (MT1cat) si libera dal resto della proteina creando un frammento di 18 kDa. Si mette in evidenza il fatto che la perdita dell'ectodominio regola le dinamiche funzionali della popolazione delle MT1-MMP, imponendo così un meccanismo di regolazione extra per l'attivazione della pro-MMP2.
Una volta attivata, la MMP2 può legarsi ed essere inibita dall'inibitore TIMP2. In questo modello si testano due ipotesi, poiché la MMP2 può formare con il TIMP2 sia un complesso a singola isoforma sia a due isoforme ( complesso intermedio e finale), e si predicono poi le dinamiche delle due specie. In quest'ultimo caso, si vede come la isoforma intermedia sia una specie a bassa concentrazione ed estremamente transitoria che ne rende difficile l'osservazione sperimentale e suggerisce condizioni possibili dove le molecole specifiche possono essere individuate.
L'enzima che non è inibito dal TIMP2 può legare e degradare collagene. Il modello delinea questo fenomeno considerando l'effetto del rapporto iniziale delle concentrazioni enzima proteolitico/inibitore sul progresso dell'attività collagenolitica dell'enzima.
Inoltre si vede che l'approccio delle due isoforme MMP2-TIMP2 descrive un più forte effetto inibitorio, inducendo un responso quasi bifasico (o tutto o niente) nel potenziale enzimatico dell'MMP2, che dipende nel rapporto delle concentrazioni iniziali enzima/inibitore.
Infine si fondono tutti i moduli summenzionati per avere una visione quantitativa del sinergismo MMP2-MT1-MMP nella degradazione del collagene I.
Questo è il primo modello cinetico con reazioni biochimiche sviluppato per studiare le proprietà proteolitiche della famiglia delle metalloproteinasi di matrice (MMP), ed è il primo passo verso una descrizione più dettagliata che spiegherà la moltitudine di enzimi e substrati dei processi proteolitici nella matrice extracellulare.
5.2 METODI E RISULTATI
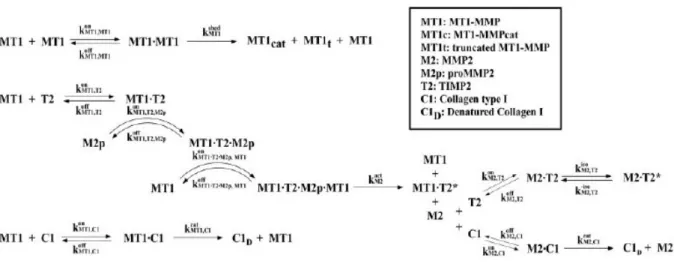
5.2.1 La formulazione del modelloIl sistema di equazioni differenziali ordinarie che descrivono l'evoluzione nel tempo della concentrazione delle varie specie viene mostrato schematicamente in figura 5.1. Le equazioni stesse vengono riportate in appendice, come tutti i grafici che riportano i risultati sperimentali trovati grazie al modello.
Questo sistema è stato numericamente risolto usando il software Mathworks Matlab, e per una variazione di concentrazioni iniziali di solito simili a quelle usate in molti esperimenti in vitro. Le costanti di velocità per ognuna delle reazioni incluse nel network biochimico sono state trovate sperimentalmente.
Figura 5.1 – Schema delle reazioni biochimiche. Gli asterischi denotano specie inattivate o inibite, mentre i punti denotano la formazione di un complesso. La legenda descrive le notazioni adottate dalle specie chimiche.
Basato sull'ampia analisi dei dati sperimentali pubblicati, presentiamo il network biochimico della proteolisi del collagene I indotta dalla MT1-MMP e dalla specie libera MMP2. Quest'ultima è attivata dalla formazione del complesso con l'MT1-MMP e l'inibitore TIMP2. Lo schema di reazione è mostrato in figura 5.1.
Sotto condizioni fisiologiche, la MT1-MMP è un enzima chiave per la capacità invasiva della matrice extracellulare delle cellule. La sua attivazione avviene maggiormente intracellularmente, e può degradare il collagene o si può legare alla TIMP2, che è secreto o dalle stesse cellule oppure dalle cellule vicine, formando un dimero, l'MT1-MMP TIMP2. Questo dimero ha il potere di indurre l'attivazione del zimogeno pro-MMP2.
libero dal TIMP2, inizia l'attivazione del zimogeno, che più tardi matura in un enzima proteolitico pienamente funzionale attraverso un meccanismo autocatalitico.
Le metalloproteinasi di matrice che non partecipano agli eventi di attivazione, possono sia scindersi proteoliticamente, secernendo il loro dominio catalitico, MT1cat, oppure possono legarsi al collagene e denaturarlo. Il rilascio della porzione extracellulare delle proteine transmembrana di tipo I, indirizzato alla perdita dell'ectodominio, è stato nominato come il meccanismo regolatorio che controlla l'attività di una varietà di proteine nella superficie cellulare.
Una volta che il zimogeno è stato attivato dall'MT1-MMP alla superficie cellulare, può diffondere nella matrice di collagene ed iniziare gli eventi proteolitici che portano alla degradazione delle fibrille. Esso può anche essere inibito dopo il legame con il TIMP2 libero.
Nell'analisi di questo meccanismo, si adottano e si mettono a confronto due approcci, un meccanismo inibitorio a singolo step, ed uno schema dove le due specie formano due distinte isoforme, MMP2 TIMP2 e MMP2 TIMP2*.
Il processo collagenolitico indotto dalla MMP2 è considerato una semplice reazione catalitica dove l'enzima inizialmente forma un dimero con il collagene I, MMP2-collageneI, ed è questo dimero che su dissociazione porta al prodotto denaturato.
Adesso andiamo ad esaminare tute le reazioni del modello divise in più parti, come fossero tanti “moduli”.
5.2.2 L'attivazione della pro-MMP2
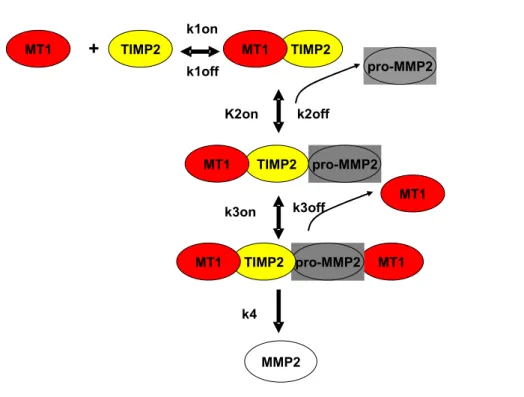
Il presente modello teorico ci fornisce uno strumento quantitativo per esaminare gli effetti delle concentrazioni iniziali di pro-MMP2, TIMP2 e MT1-MMP sulla cinetica di attivazione del proenzima. La cinetica dipenderà dalle concentrazioni delle due molecole coinvolte nel meccanismo di attivazione: l'MT1-MMP libero ed il trimero MT1-MMP·TIMP2·pro-MMP2. Così una descrizione dettagliata delle dinamiche delle due specie può darci una visione d'insieme della cinetica di attivazione, schemattizzata in figura 5.2.
Considerando le MT1-MMP (nella loro forma TM-MT1-MMP) come molecole in un'ampia soluzione con TIMP2 e pro-MMP2 e variando le condizioni iniziali del proenzima, dell'inibitore TIMP2 e dell'enzima di attivazione MT1-MMP, si possono compiere numerosi esperimenti studiando la formazione dei differenti complessi, come il complesso MT1-MMP·TIMP2 o quello MT1-MMP·TIMP2·pro-MMP2, o calcolando la disponibilità dell'MT1-MMP libero. Per i calcoli è stata usata una concentrazione iniziale di 50 nM, mentre il TIMP2 varia da 0 a 100 nM. Facendo attenzione al particolare set di dati e prendendo in considerazione la dipendenza dei meccanismi di attivazione sulla concentrazione del MMP libero e del triplo complesso MT1-MMP·TIMP2·pro-MMP2, si può testare l'esistenza di concentrazioni che possono portare all'attivazione del proenzima, espresso quantitativamente come la quantità di pro-MMP2 iniziale che è trasformato nella protease attiva. A basse concentrazioni dell'inibitore (per 4 nM di TIMP2) le MMP sono predominanti. Ad alte concentrazioni dell'inibitore invece, la quantità di MT1-MMP libero arriva quasi a livello zero. L'intera quantità dell'enzima viene esaurita sia formando il dimero con l'inibitore, sia formando il trimero con il TIMP2 e la pro-MMP2. E' proprio l'ultimo complesso che porterà all'attivazione del proenzima, un processo che, per queste condizioni, è improbabile poiché non c'è attivatore libero. Infatti l'attivazione della pro-MMP2 inizia solitamente a livelli intermedi di quantità di inibitore.
La cinetica di formazione del proenzima può essere esaminata prendendo in considerazione uno step di attivazione nel meccanismo studiato. Come già menzionato, l'attivazione fisiologica della pro-MMP2 avviene attraverso una protease già attivata, di solito la MT1-MMP, che inizia la scissione del suo dominio propeptide. Lo step di attivazione è come una reazione enzimatica dove il trimero MT1-MMP·TIMP2·pro-MMP2, che può essere considerato il nuovo substrato classico, forma un complesso con l'enzima di attivazione MT1-MMP.
A questo punto, conoscendo la cinetica calcolata per l'attivazione del proenzima, si può calcolare la quantità di enzima attivo formato nel tempo. I calcoli per l'attivazione del proenzima sono stati fatti per i range delle concentrazioni iniziali di MT1-MMP e di TIMP2.
MT1 + TIMP2 pro-MMP2 MT1 pro-MMP2 TIMP2 MT1 TIMP2 MT1 pro-MMP2 TIMP2 MT1 MT1 MMP2 k1on k1off K2on k2off k3on k3off k4
Figura 5.2 – Schema dell’attivazione della pro-MMP2
5.2.3 Perdita dell'ectodominio da parte della MT1-MMP
Adottando un approccio simile a quello usato per studiare l'attivazione della pro-MMP2 ed utilizzando il modello teorico che abbiamo, si può avere una visione d'insieme delle dinamiche della perdita dell'ectodominio da parte di due membrane type 1 libere dall'inibitore, che formeranno poi un MT1 catalitico (MT1cat). Lo schema di quanto appena detto si trova in figura 5.3. Questa specie formatasi (18 kDa di peso ) non sarà poi in grado di scindere il collagene né di legarsi all'inibitore. Considerando le interazioni intermolecolari in soluzione delle membrane type 1 che mancano della loro regione transmembrana, si possono studiare quantitativamente le dinamiche della perdita dell'ectodominio dopo l'assegnazione delle costanti cinetiche al processo. Queste costanti descrivono la cinetica di formazione di una singola MT1cat quando si incontrano due MT1-MMP libere ed una scinde autocataliticamente l'altra.
I risultati numerici aiutano a capire la funzionalità della formazione di un MT1cat in un ambiente dove molti processi, come l'attivazione dello zimogeno o la degradazione del collagene, avvengono in parallelo. Un importante risultato del modello è la scoperta di un meccanismo regolatore indotto dalle TIMP2 durante la perdita dell'ectodominio. L'inibitore infatti può scatenare un meccanismo protettivo per le membrane type 1. Così, una volta legato all'enzima proteolitico MT1-MMP, l'inibitore sposta la reazione d'equilibrio dalla perdita dell'ectodominio verso il percorso di
attivazione del proenzima.
Questo antagonismo, iniziato dall'inibitore, può essere visualizzato graficando i bilanci molecolari delle MMP2 attivate e quindi trovando le MT1-MMP libere per diverse concentrazioni iniziali di TIMP2. A bassi livelli di MT1-MMP iniziale e di inibitore la specie dominante, dopo 12 ore dall'inizio delle reazioni biochimiche, è sempre la MT1-MMP libera dall'inibitore. All'aumentare della concentrazione iniziale di membrane type 1, il meccanismo esaminato inizia, così come la formazione della MT1cat insieme alla riduzione della quantità di MT1 libera. Un aumento della concentrazione dell'inibitore invece, dà il via al meccanismo di inibizione delle proteasi si superficie e porta il bilancio verso il complesso MT1-MMP·TIMP2·pro-MMP2, ossia il primo step verso l'attivazione del proenzima.
Tuttavia, ad alti livelli iniziali di MT1-MMP, la perdita dell'ectodominio risulta predominante rispetto alla formazione del triplo complesso.
Tutto questo porta al decremento della quantità di membrane type 1 libero dall'inibitore, anch'esso attivatore del proenzima insieme al triplo complesso; questo decremento, come già menzionato, è predominante specialmente quando c'è una grande quantità di enzimi proteolitici. Considerando il network biochimico dell'attivazione del proenzima, il decremento di questi due parametri si rifletterà in una riduzione della quantità di MMP2 attivata , specialmente a più alte concentrazioni di MT1-MMP dove il meccanismo di perdita è predominante. Ma non solamente la disponibilità di MT1-MMP, sia libera che complessata, regola il processo di attivazione; infatti anche la quantità di TIMP2 libero, come parte del triplo complesso, influisce il sopracitato meccanismo.
Figura 5.3 – Schema della perdita dell’ectodominio
MT1
+
MT1 k11on MT1 MT1 MT1+
MT1catk12
5.2.4 Collagenolisi indotta dal MT1-MMP
Le membrane type 1 che non partecipano all'attivazione del prodominio e alla perdita dell'ectodominio sono enzimi proteolitici estremamente potenti. E' già stato stabilito sperimentalmente il potenziale degradante del membrane type 1 per vari tipi di collagene. L'enzima legato alla superficie può scindere il collagene di tipo I, II e III sotto condizioni non denaturanti ( a temperature sotto i 35°) in frammenti di lunghezza ¾ e ¼ della fibra iniziale. Mettendo vari tipi di collagene in incubazione con proteasi a differenti concentrazione, si nota che l'MT1-MMP “digerisce” il collagene di tipo I in un modo migliore rispetto al II e al III.
Il modello può essere usato efficacemente per spiegare i vari aspetti del comportamento della MT1-MMP, come dettato, la maggior parte delle volte, dal suo ambiente circostante, dalle fibre di collagene e dal TIMP2. Da un lato, si può descrivere quantitativamente e qualitativamente i vari passi della proteolisi del collagene I per mezzo delle membrane type 1 ( figura 5.4 ). Dall'altro lato, la descrizione integrativa e quantitativa delle proprietà enzimatiche può essere utile per avere un'idea degli effetti dell'inibitore sulla redistribuzione dei vari compiti paralleli delle MT1-MMP, incluso la proteolisi del collagene, la perdita dell'ectodominio e l'attivazione della pro-MMP2. Tuttavia, per una descrizione più completa degli eventi biochimici che iniziano da entrambe le proteasi studiate, sarà utile introdurre e studiare gli eventi proteolitici ed inibitori che sorgono dalle MMP2. Inoltre, considerando il network biochimico completo, saranno analizzati i processi paralleli che nascono dalle membrane type 1.
Figura 5.4 – Collagenolisi dovuta alla membrane type 1
MT1
+
C1 MT1 C1 MT1+
C1denk9on k10
5.2.5 Isomerizzazione MMP2·TIMP2
Attivato il zimogeno, quest'ultimo si può legare all'inibitore ed essere inibito o può degradare il collagene circostante ( figura 5.5 ). Per studiare la cinetica di inibizione della MMP2 da parte della TIMP2, si possono adottare in questo modello due approcci: un meccanismo a singolo step ed un approccio a due isoforme. In qust'ultimo caso, l'inibizione dell'attività dell'MMP2 avviene come un processo a due step dove l'inibitore inizialmente forma un complesso allentato con la MMP2, l' MMP2·TIMP2, che poi matura in una seconda forma, MMP2·TIMP2*. Questo processo di maturazione è attribuito ai cambiamenti conformazionali che avvengono durante lo step di stabilizzazione del complesso. Nell'approccio a due isoforme, il modello può essere usato per avere un'idea della natura del complesso intermedio MMP2·TIMP2, una specie che differenzia i due modelli e che è responsabile della differenza dell'ordine di grandezza delle costanti. Per differenti concentrazioni iniziali dell'enzima e dell'inibitore, il modello può essere usato per calcolare le concentrazioni delle due isoforme.
Figura 5.5 – La MMP2, una volta attivata, può legarsi al TIMP2 ed essere inibita oppure può degradare il collagene circostante
MMP2
MMP2
MMP2
TIMP2*
TIMP2
MMP2
C1
MMP2
+
C1
k5on
k5off
k6off
k7on
k6on
k8
k7off
5.2.6 Complesso MMP2·Collagene I
L'abilità dell'MMP2 nel degradare il collagene di tipo I è molto ben documentata. ( schema in figura 5.5 ). Nel seguente approccio, si considera che l'MMP2 possa essere assorbito e possa scindere il collagene con delle costanti misurate sperimentalmente.
I risultati sperimentali che descrivono la scissione del collagene di tipo I di un tendine di topo e della pelle bovina possono essere riprodotti usando questo approccio teorico.
5.2.7 Effetti dell'inibitore sulla collagenolisi indotta dalla MMP2
Combinando i due moduli sopra descritti, l'inibizione della MMP2 da parte dell'inibitore e l'attività proteolitica della MMP2, si è in grado di sviluppare una descrizione quantitativa dettagliata dell'effetto dell'inibitore sul potenziale collagenolitico dell'enzima.
Il modello fornisce uno strumento per delineare l'effetto dell'inibitore sull'assorbimento dell'enzima sulle fibre di collagene. Andando ad indagare l'attività collagenolitica della MMP2 in un ambiente privo di collagene I e per differenti rapporti iniziali MMP2/TIMP2, si può trovare la percentuale dell'enzima che rimane assorbito dall'inibitore allo stato stazionario per entrambi gli approcci e dopo 12 ore dall'inizio dell'esperimento. L'approccio delle due isoforme descrive un più forte effetto inibitorio rispetto all'altro approccio. Questa descrizione dell'inibizione ha caratteristiche bifasiche.
5.2.8 Sinergismo MMP2/MT1-MMP
Finora, si è sviluppato un modello della proteolisi del collagene I da parte della MT1-MMP e della MMP2, seguendo un approccio modulare. Ogni step del percorso proteolitico è stato studiato separatamente, ed i risultati degli esperimenti numerici ci danno un'idea delle dinamiche di interazione delle varie specie che comprendono ogni particolare modulo. Fondendo tutti i moduli sopramenzionati, si può studiare l'intero percorso simultaneamente. Questo permetterà di quantificare gli eventi proteolitici paralleli che iniziano da entrambi gli enzimi proteolitici studiati: il sinergismo enzimatico.
Per un range di concentrazioni iniziali di MT1-MP e di TIMP2 ed in presenza di pro-MMP2 si possono seguire le dinamiche e le interazioni di ognuna delle specie formate a differenti step temporali nello stesso modo in cui si monitora la proteolisi del collagene.
modello composto. L'attivazione del proenzima avviene a livelli intermedi di TIMP2, ed il massimo si trova intorno a rapporti di concentrazione iniziale MT1-MMP/TIMP2 di 3:2. La collagenolisi è aumentata a basse concentrazioni dell'inibitore ed è soppressa ogni volta in cui la quantità iniziale dell'inibitore si trova in eccesso stechiometrico.
La domanda che può sorgere spontanea è sotto quali condizioni è importante la proteolisi che inizia dalla MMP2 attiva? Esistono rapporti di concentrazione tra proenzima-inibitore-attivatore che possono portare ad un sinergismo nella proteolsi del collagene I?
Per rispondere a queste domande si usa il modello teorico per calcolare la quantità di collagene che è stato degradato separatamente da ognuno degli enzimi proteolitici, MT1-MMP e MMP2, per lo spettro delle condizioni iniziali usate a differenti istanti di tempo. Per ognuna di queste condizioni iniziali c'è sempre dell'MMP2 attivata. Il set di queste condizioni iniziali sotto cui la collagenolisi indotta da MMP2 è masima è calcolata per differenti istanti di tempo. Graficando questi massimi come una funzione delle condizioni iniziali, può essere costruito un diagramma di fase.
Considerando la quantità di proenzima utilizzato viene calcolata anche la quantità del substrato degradato da altri enzimi.
Per basse concentrazioni di pro-MMP2, la proteolisi è maggiormente portata avanti dal membrane type 1. Ad alte condizioni iniziali di proenzima invece, l'attività collagenolitica della MMP2 diventa comparabile a quella della MT1-MMP. E' proprio sotto queste condizioni che il sinergismo MMP2/ MT1-MMP diventa profondo.
Si è visto che anche la parte catalitica della membrane type 1 ha proprietà proteolitiche è può arrivare a degradare il collagene; la percentuale che degrada è tuttavia così piccola che può ritenersi trascurabile, ed è per questo che nel modello non viene considerata.
Dunque MMP2 e MT1-MMP possono agire in modo sinergistico in un processo ben regolato per migliorare il meccanismi proteolitico ed attenuare le barriere restrittive della matrice extracellulare.