Capitolo 1
I
9
Le cellule staminali
Una cellula per essere definita staminale deve essere non specializzata e capace di autorinnovarsi per lunghi periodi attraverso divisione cellulare. Inoltre, le cellule staminali devono essere capaci di dare origine ad almeno un tipo cellulare differenziato. Sulla base della loro potenzialità differenziativa le cellule staminali possono essere classificate in totipotenti, pluripotenti, multipotenti e unipotenti.
Le cellule staminali totipotenti si ritrovano allo stadio di preblastocisti dello sviluppo embrionale e possono dare origine a tutti i tipi cellulari compresi quelli dei tessuti extraembrionali.
Le cellule staminali pluripotenti si ritrovano a livello della massa cellulare interna (ICM) della blastocisti dell’embrione. Esse possono dare origine a tutti i tipi cellulari, ma non sono in grado di formare un intero organismo perché incapaci di formare i tessuti extraembrionali come la placenta, essenziali per lo sviluppo fetale. Le cellule staminali embrionali sono pluripotenti e durante lo sviluppo queste cellule danno origine alle cellule staminali adulte (chiamate anche cellule staminali somatiche). Esse sono generalmente cellule staminali, che si ritrovano nei tessuti dell’organismo adulto, dove possono rinnovarsi e dare origine solamente ad un tipo cellulare specializzato (cellula staminale unipotente) oppure a diversi tipi cellulari specializzati (cellula staminale multipotente) del tessuto in cui risiedono (Robert, 2004).
Le cellule staminali adulte sono state individuate in diversi organi e tessuti ed hanno il ruolo di mantenere l’omeostasi tissutale e riparare i tessuti danneggiati. L’attività di queste cellule viene regolata da fattori intrinseci ed estrinseci quali segnali ambientali, contatti cellulari e sostanze secrete che creano un microambiente, o nicchia, in cui la cellula risiede.
Negli ultimi anni, la biologia delle cellule staminali ha ricevuto un’attenzione crescente proprio nella prospettiva di un possibile utilizzo di tali cellule per ricostituire parti del corpo lesionate da traumi o malattie (Zandonella, 2005). Tuttavia, le basi cellulari e molecolari che regolano la biologia delle cellule staminali in vivo rimangono ancora poco conosciute.
Lo studio in vivo delle cellule staminali adulte è, infatti, problematico nei mammiferi poiché tali cellule sono rare e difficilmente accessibili in quanto disperse nei tessuti differenziati. Inoltre, dato che il microambiente cellulare, la nicchia, è difficile da riprodurre in vitro, sistemi modello alternativi sono frequentemente utilizzati per lo
studio della biologia delle cellule staminali (Weissman, 2000; Pearson, 2001; Newmark e Sanchez Alvarado, 2002; Tsai et al., 2002; Tanaka, 2003).
Tra questi sistemi modello noi abbiamo selezionato le planarie poiché possiedono un’abbondante popolazione di cellule staminali pluripotenti che è mantenuta nell’organismo adulto ed è accessibile sperimentalmente.
Il sistema modello: le planarie
Le planarie (Platelminti, Tricladi), note per le loro straordinarie capacità rigenerative, sono organismi acelomati con lo spazio corporeo interno occupato dal parenchima, un tessuto di tipo mesenchimatico con funzione trofica, di difesa immunitaria e di sostegno. Inoltre, sono tra i primi organismi a presentare un sistema nervoso centralizzato costituito da una coppia di gangli cefalici connessi da due cordoni nervosi longitudinali ventrali.
Le planarie rappresentano, per vari aspetti, un organismo modello per studiare in vivo la biologia delle cellule staminali adulte. Oltre a possedere un’abbondante popolazione di cellule staminali adulte pluripotenti, i neoblasti, negli ultimi anni sono stati fatti notevoli progressi nello sviluppo di tecniche sperimentali. Il genoma è stato completamente sequenziato (Robb et al., 2008), e sono disponibili banche dati molecolari per EST e specifici marcatori molecolari. Negli ultimi anni è stata anche sviluppata la possibilità di produrre interferenza genica in vivo (RNAi) (Sanchez Alvarado e Newmark, 1999) e di isolare frazioni purificate di neoblasti (Hayashi et al., 2006). Un ulteriore vantaggio sperimentale offerto dalle planarie è la possibilità di avere organismi privi di cellule staminali: i neoblasti possono, infatti, essere selettivamente distrutti con dosi elevate di raggi X, che lasciano inalterate le cellule differenziate (Salvetti et al., 2000; Reddien et al., 2005a, b), consentendo il confronto diretto tra planarie prive di cellule staminali e animali wild-type.
Infine, l’utilizzo delle planarie non solleva problemi di natura etica e, in tempi rapidi, è possibile avere a disposizione numerosi animali poiché questi organismi, che sono facilmente allevabili in laboratorio a basso costo, si dividono rapidamente per scissione
11
I neoblasti e la rigenerazione
La caratteristica principale di questi animali risiede nelle loro capacità rigenerative: a differenza degli animali più evoluti, le planarie, in seguito ad un trauma, non vanno incontro a processi di cicatrizzazione, ma rigenerano le parti mancanti grazie alla presenza dei neoblasti, che, da uno stato indifferenziato, si differenziano in cellule tipiche della struttura da riparare. Le planarie sono capaci di rigenerare lungo tutti gli assi del corpo e di ricreare l’intero organismo a partire da minuscoli frammenti, pari a 1/279 del loro corpo.
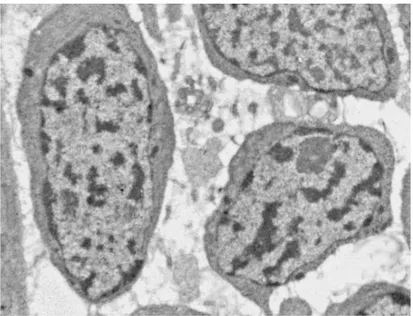
I neoblasti sono le uniche cellule proliferanti in planaria, capaci di autorinnovarsi illimitatamente e di dare origine a tutti i tipi cellulari differenziati, sia della linea somatica sia di quella germinale. Da un punto di vista morfologico, i neoblasti sono piccole cellule rotondeggianti, dal diametro medio di 8-10 μm, con ampio nucleo e scarso citoplasma indifferenziato ricco di ribosomi (Fig. 1.1), in cui sono riscontrabili accumuli di ribonucleoparticelle, mRNA associato a proteine, detti corpi cromatoidi, che, si pensa, servano alla cellula come pronta risorsa di mRNA per una rapida risposta ad induzioni al differenziamento (Fig. 1.2).
Fig 1.1: Immagine al microscopio elettronico a trasmissione (TEM) di neoblasti.
Fig. 1.2: Immagine al microscopio elettronico a trasmissione (TEM): le frecce indicano la presenza di corpi cromatoidi all’interno del citoplasma di un neoblasto.
13
Localizzazione dei neoblasti
La localizzazione dei neoblasti è stata definita utilizzando quattro diversi metodi di indagine: mediante l’analisi dell’espressione di marcatori molecolari di proliferazione cellulare come DjMCM2 (Mini Chromosome Manteinance) (Salvetti et al., 2000) e
DjPCNA (proliferating cell nuclear antigen) (Kato et al., 2001; Orii et al., 2005);
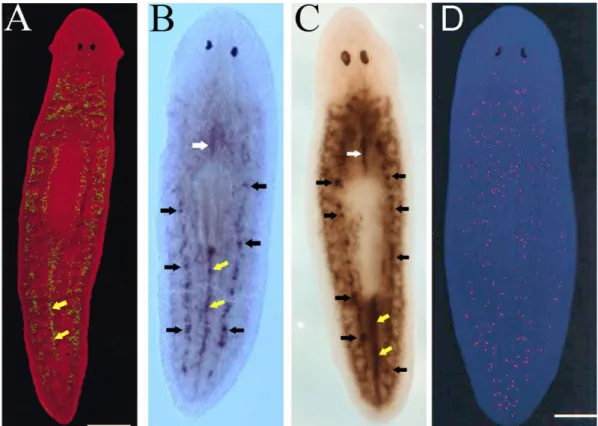
mediante saggi di incorporazione di Bromodessossiuridina (BrdU) (Newmark e Sanchez Alvarado, 2000), e mediante l’analisi della distribuzione delle mitosi (Baguñà, 1974; Newmark e Sanchez Alvarado, 2000) (Fig. 1.3).
Queste cellule si ritrovano sparse all’interno di tutto il parenchima, ad eccezione del faringe e della regione anteriore agli occhi, e accumulati in cluster disposti lungo due cordoni laterali dorsali. In Dugesia japonica i neoblasti si ritrovano anche accumulati lungo la linea mediana dorsale del corpo. Per quanto riguarda la funzione dei neoblasti, queste cellule sono implicate nel turnover cellulare che garantisce una corretta omeostasi di tutto l’organismo, nei processi di crescita e decrescita corporea in risposta a stimoli esterni favorevoli o meno ed, infine, nella rigenerazione. In seguito ad un trauma, come risposta immediata si ha una contrazione muscolare che permette l’avvicinamento dei lembi della ferita; la chiusura è quindi determinata da una migrazione delle cellule epiteliali ai margini del taglio e, successivamente, dal ripristino di una lamina basale sottostante l’epitelio. I neoblasti proliferano intensamente al di sotto della ferita nel cosiddetto postblastema e la loro progenie, in via di differenziamento, migra andando a formare il blastema.
Fig 1.3: Distribuzione di neoblasti nelle planarie intatte. (A) Marcatura con BrdU (da Newmark e Sanchez Alvarado, 2000). (B) Espressione di DjPCNA in una planaria intatta (visione dorsale) visualizzata mediante esperimenti di ibridazione in situ whole mount (da Orii et al., 2005). (C) Espressione di DjMCM2 in una planaria intatta (visione dorsale) visualizzata mediante esperimenti di ibridazione in situ whole mount (da Salvetti et al., 2000). Le frecce nere indicano gli accumuli di neoblasti in posizione dorso laterale; la freccia bianca indica i neoblasti accumulati lungo la linea mediana dorsale anteriormente al faringe; le frecce gialle indicano l’accumulo di neoblasti nel parenchima tra le due branche posteriori dell’intestino posteriormente al faringe. (D) Immagine al microscopio confocale che mostra la distribuzione delle mitosi in una planaria intatta visualizzate con un anticorpo anti istone H3 fosforilato (da Newmark e Sanchez Alvarado, 2000).
15
I raggi X ed eliminazione selettiva dei neoblasti
Poiché i neoblasti sono le uniche cellule proliferanti del corpo delle planarie, si ha la possibilità di eliminarli selettivamente, rispetto alle cellule differenziate, mediante l’impiego di dosi sterilizzanti di raggi X (Baguñà et al., 1989). Sono state individuate per ogni specie dosi e tempi di irraggiamento specifici che permettono questa sterilizzazione mirata e per D. japonica viene utilizzata la dose di 30 Gy (Salvetti et al., 2000).
In seguito ad irraggiamento si ottiene un animale del tutto uguale al wild-type, tranne che per la perdita dei neoblasti. A causa di questa assenza, ciò che ne consegue è che le planarie perdono la capacità di rigenerare e di rinnovare le vecchie cellule differenziate, che porterà in breve tempo, circa due settimane, alla morte dell’animale (Baguñà et al., 1989; Guo et al., 2006; Lange, 1968a; Lange, 1968b; Lange, 1968c; Orii et al., 2005; Reddien et al., 2005b; Salvetti et al., 2000; Salvetti et al., 2005).
Sottopopolazioni di neoblasti
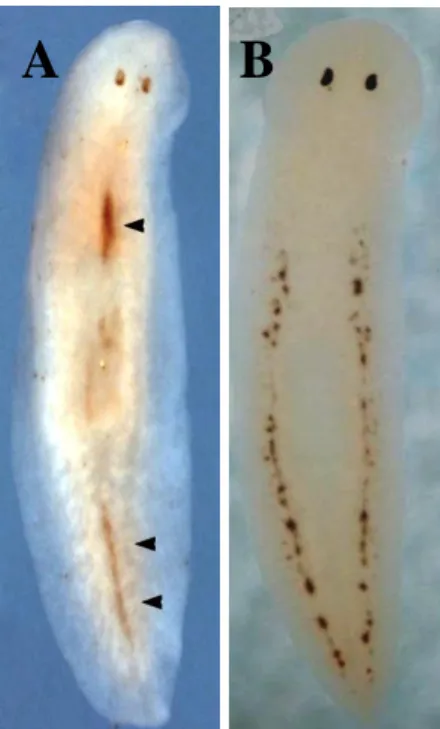
La popolazione di neoblasti è composta da distinte sottopopolazioni di cellule come dimostrato dall’identificazione di un omologo del gene Piwi di Drosophila (DjPiwi-1) che è esclusivamente espresso in un gruppo di neoblasti distribuiti lungo il cordone dorsale centrale (Rossi et al., 2006) (Fig.1.4A).
Le cellule esprimenti DjPiwi-1 mostrano alcune caratteristiche che permettono di considerarle neoblasti: hanno una morfologia simile a queste cellule e sono sensibili al trattamento ai raggi X (Rossi et al., 2006). Diversamente dai neoblasti, le cellule esprimenti DjPiwi-1 non partecipano in maniera diretta al processo rigenerativo. Infatti, dopo il taglio le cellule esprimenti DjPiwi-1 non si accumulano a livello della superficie della ferita e la loro posizione rimane invariata lungo tutto il corso della rigenerazione, indipendentemente dall’orientamento del taglio.
Una seconda sottopopolazione di neoblasti è stata identificata dall’analisi dell’espressione del gene Djnos omologo del gene nanos di Drosophila. Cellule esprimenti nanos sono considerate cellule staminali della linea germinale e sono localizzate lungo il parenchima dorso laterale (i territori presuntivi dove si formeranno i testicoli) e in due zone ventrali (le regioni presuntive dove si formeranno le gonadi). Queste cellule della linea germinale sono indistinguibili dai neoblasti all’analisi morfologica, mostrano la loro stessa sensibilità ai raggi X, ma non contribuiscono alla
rigenerazione. Inoltre, le cellule esprimenti Djnos non incorporano bromodeossiuridina (Sato et al., 2006).
L’eterogeneità dei neoblasti è stata anche confermata dall’esistenza di due differenti sottopopolazioni di cellule sensibili ai raggi X (X1 e X2) identificate mediante l’utilizzo combinato del trattamento con i raggi X e l’analisi al FACS (Reddien et al., 2005b; Hayashi et al., 2006). Questa analisi permette di suddividere le cellule di planaria in tre frazioni definite dal loro contenuto in DNA e citoplasmatico e dalla loro sensibilità ai raggi X: la frazione Xis resistente ai raggi X e le due frazioni X1 e X2 sensibili ai raggi X. L’analisi dell’espressione di marcartori molecolari e delle caratteristiche ultrastrutturali su queste frazioni cellulari ha rivelato che la frazione X1 contiene principalmente cellule proliferanti sensibili ai raggi X che quindi vengono perse dopo irraggiamento, la frazione X2 contiene cellule differenziate e una piccola parte di cellule staminali sensibili ai raggi X, la frazione Xis è costituita da una grande varietà di cellule differenziate
In base ad ulteriori analisi i neoblasti delle frazioni X1 e X2 sono stati classificati come cellule di tipo A e B. Le cellule staminali di tipo A, concentrate nella frazione X1, sono caratterizzate da un nucleo ricco in eucromatina, sono di grandi dimensioni e ricche di corpi cromatoidi. Le cellule staminali di tipo B, concentrate nella frazione X2, possiedono un nucleo ricco in eterocroamatina, sono più piccole ed hanno pochi corpi cromatoidi (Higuchi et al., 2007). Quindi, il termine neoblasti non è riferito ad una singola popolazione di cellule staminali ma ad un insieme di differenti sottopopolazioni di cellule staminali ognuna delle quali esprime particolari marcatori molecolari ed ha distintive proprietà genetiche e/o proliferative.
17 Fig. 1.4: (A) Espressione di DjPiwi-1 in una planaria intatta (visione dorsale) visualizzata mediante ibridazione in situ whole mount (da Rossi et al., 2006). Le punte di freccia indicano gli accumuli di segnale d’espressione lungo la linea mediale. (B) Espressione di DjNos in una planaria intatta (visione dorsale) visualizzata mediante esperimenti di ibridazione in situ whole mount.
Fig. 1.5: Profili al FACS di cellule ottenute da planarie non irradiate (pannello A) ed irradiate (pannello B) (Hayashi et al., 2006). Il confronto dei profili dei pannelli A e B mostra una regione con un’ alta marcatura di Hoechst e debole marcatura con calceina AM eliminata dopo trattamento con i raggi X, che è quindi assente nel pannello B: questa regione corrisponde alla popolazione di cellule denominata X1. Una seconda regione sensibile ai raggi X, con marcatura debole di Hoechst e calceina AM, corrisponde alla popolazione di cellule denominata X2: circa la metà delle cellule contenute in questa frazione viene persa dopo trattamento con i raggi X. La regione che rimane inalterata, presente nel pannello A che B corrisponde alla frazione cellulare insensibile ai raggi X denominata Xis. L’asse x rappresenta l’intensità della marcatura con calceina, l’asse y l’intensità della marcatura con Hoechst.
Analisi del profilo genetico dei neoblasti mediante la metodica dei microarray
La possibilità di eliminare selettivamente i neoblasti rispetto alle cellule differenziate in seguito ad irraggiamento è stata utilizzata per analizzare il profilo genetico dei neoblasti, utilizzando la metodica dei microarrays. L’ipotesi alla base di questo studio è che in animali trattati con la dose letale di 30 Gy si verifichi una sotto regolazione dei geni espressi nei neoblasti. I risultati ottenuti hanno permesso l’identificazione di 44 geni espressi a bassi livelli in planarie irradiate con 30 Gy (Rossi et al., 2007). La maggior parte di questi geni sono omologhi di fattori coinvolti nel rimodellamento della cromatina, come, ad esempio, proteine che regolano l’accesso alla cromatina ed omologhi di fattori trascrizionali, suggerendo che modificazioni epigenetiche possano svolgere un ruolo importante nella regolazione trascrizionale dei neoblasti (Rossi et al., 2007) e incoraggiando ulteriori studi finalizzati alla comprensione del ruolo specifico giocato da questi fattori. Molte evidenze suggeriscono che la struttura generale della cromatina contribuisce al mantenimento della potenzialità delle cellule staminali embrionali e adulte e che cambiamenti nell’accessibilità della cromatina accompagnino la determinazione delle cellule staminali (Bernstein et al., 2006). In seguito al progressivo rimodellamento della cromatina, le cellule perdono la loro plasticità e capacità di cambiare la loro identità in risposta ai diversi stimoli. In contrasto, le cellule staminali mantengono sempre questa plasticità che permetterà loro di intraprendere diversi percorsi differenziativi (Ringrose e Paro, 2004; Bernstein et al., 2006). Quindi, totipotenza e determinazione cellulare corrispondono a stadi epigenetici con diverse potenzialità di sviluppo (Surani et al., 2007).
19
RbAp48
Le proteine RbAp48 (retinoblastoma-associated protein) sono state per la prima volta caratterizzate nelle cellule umane come proteine che si legano alla proteina soppressore di tumore retinoblastoma (Rb) (Qian et al., 1993) e, successivamente, si è trovato che co-precipitavano con l’istone deacetilasi 1 (Nicolas et al., 2000).
Esse appartengono alla famiglia di proteine WD40 caratterizzate dalla presenza di quattro o più ripetizioni di 40 amminoacidi che in genere terminano con il dipeptide triptofano-acido aspartico. Le proteine WD40 sono una grande famiglia altamente conservata in tutti gli eucarioti e sono implicate in diversi processi cellulari quali trasduzione del segnale, regolazione della trascrizione, controllo del ciclo cellulare ed apoptosi (Li e Roberts, 2001). Il motivo ripetuto WD40 agisce come un sito di interazione proteina-proteina e permette l’assemblaggio in complessi di proteine che contengono questa ripetizione.
RbAp48 gioca un ruolo molto importante in diversi aspetti del metabolismo della cromatina, quali assemblaggio dei nucleosomi e modificazione degli istoni (Scuto et al., 2007). Infatti, le proteine RbAp48 sono componenti di molti complessi importanti coinvolti nel metabolismo della cromatina (Philpott et al., 2000) in diversi organismi.
Questi complessi comprendono:
- l’istone acetil transferasi Hat1, coinvolta nell’acetilazione di istoni di nuova sintesi (Parthun et al., 1996);
- NuRD (nucleosome remodeling histone deacetylase complex), che è un complesso multisubunità contenente una attività deacetilasica e una attività di rimodellamento della cromatina ATP-dipendente che mantiene i geni in uno specifico stato di repressione (Xue et al., 1998; Zhang et al., 1998; Zhang et al., 1999);
-NURF (nucleosome remodeling factor), un complesso ATP-dipendente coinvolto nella regolazione della trascrizione in Drosophila (Martinez-Balbas et al. 1998);
- il complesso Sin3, che contiene istone deacetilasi ed è coinvolto nella repressione trascrizionale (Narlikar et al., 2002)
- CAF-1, un fattore di assemblaggio della cromatina accoppiato alla sintesi del DNA (Verreault et al., 1996)
Dato che tutti questi fattori hanno gli istoni come loro substrati, l’ipotesi generale è che possano interagire con gli istoni mediante la subunità comune RbAp48 (Loyola e Almouzni, 2004). Quindi, a seconda della composizione delle subunità del complesso di cui fa parte, RbAp48 è capace di regolare tutti gli stadi del metabolismo della
cromatina. In accordo con questo ruolo, la riduzione dell’espressione di AtMSI1, l’omologo di RbAp48 in Arabidopsis, induce errori nel programma di sviluppo. L’ analisi dei mutanti in cui l’espressione di AtMSI1 è ridotta rivela che AtMSI1 è richiesto per la corretta espressione temporale e organo-specifica dei geni omeotici (Hennig et al., 2003). Inoltre ulteriori studi di sviluppo suggeriscono un ruolo delle proteine RbAp48 nel mantenimento dei cambiamenti epigenetici durante le divisioni cellulari (Köhler et al., 2003).
RbAp48 e la via di traduzione mediata da Ras
Sebbene il suo ruolo nel metabolismo della cromatina sia la funzione meglio studiata, RbAp48 è coinvolto in altri processi cellulari. Ad esempio gioca un ruolo importante nella regolazione del pathway di trasduzione del segnale di Ras in C. elegans e S.
cerevisiae (Lu e Horvitz, 1998; Qian et al., 1993; Qian et al., 1995; Ruggieri et al.,
1989; Scuto et al., 2007). Lin-53 (omologo di C. elegans) antagonizza il segnale di Ras durante lo sviluppo della vulva del nematode (Lu e Horvitz, 1998).
In S. cerevisiae la sovraespressione dell’omologo di RbAp porta alla riduzione dei livelli di cAMP in risposta al glucosio, che è consistente con una regolazione negativa del segnale di Ras. Infatti, in S. cerevisiae il segnale di trasduzione per la crescita in risposta ai nutrienti è mediata dal pathway Ras-cAMP. Le proteine Ras nel lievito giocano un ruolo importante in questo processo: attivano l’adenilato ciclasi, che induce la formazione di AMP ciclico. I livelli di questo secondo messaggero regolano, attraverso fosforilazione di proteine, la progressione del ciclo cellulare attraverso la fase G1.
Il pathway di segnalazione di Ras è coinvolto in molti importanti processi cellulari, come la proliferazione, l’apoptosi, l’organizzazione del citoscheletro e il differenziamento (Bar-Sagi e Hall, 2000; Cox e Der, 2003; Downward, 2003; Hancock, 2003; Shields et al., 2000).
21 staminali (Azuara et al., 2006; Boyer et al., 2006 a,b; Kamminga et al., 2006; Lee et al., 2006), recenti evidenze indicano che non è indispensabile per la pluripotenza delle cellule staminali e che possa essere importante per il differenziamento e il mantenimento della multipotenza nelle cellule progenitrici tardive (Chamberlain et al., 2008). Nonostante questi dati dimostrino un ruolo di PRC2 nelle cellule staminali, non sono disponibili dati diretti che dimostrino il ruolo in vivo dei fattori RbAp48 nella biologia delle cellule staminali.
Le proibitine
Le proibitine sono proteine ubiquitarie, abbondantemente espresse e conservate nell’evoluzione. Omologhi sono stati identificati in molti organismi dagli eucarioti più semplici quali i lieviti, così come nelle piante, vermi, insetti, fino ai mammiferi. Il nome attribuito a queste proteine deriva dalla loro capacità di bloccare la proliferazione cellulare dato che l’mRNA quando viene microiniettato nei fibroblasti e cellule Hela causa l’arresto della crescita, e la microiniezione dell’oligonucleotide antisenso induce l’entrata nella fase S del ciclo cellulare (Nuell et al., 1991). Tuttavia questo effetto è stato successivamente attribuito solo alla 3’UTR dell’mRNA di PHB e non alla proteina (Jupe et al., 1996).
Le proibitine, PHB1 e PHB2, sono localizzate principalmente nella membrana interna dei mitocondri nella maggior parte delle cellule, dove sono associate a formare un complesso che stabilizza le proteine di nuova sintesi del mitocondrio. Oltre al loro ruolo come proteine chaperone nei mitocondri, esistono diverse evidenze che le proibitine sono localizzate anche nel citoplasma e nel nucleo dove svolgono diverse funzioni cellulari (Terashima et al. 1994, Wang et al., 2002).
Regolazione trascrizionale di PHB2 mediata da recettori per gli estrogeni
Come detto precedentemente PHB2 si ritrova anche nel nucleo dove interagisce con il recettore degli estrogeni e reprime l’attivazione trascrizionale mediata da questi (Kurtev et al., 2004).
La funzione proposta è che PHB2 si comporti come mediatore della repressione trascrizionale, determinata da recettori nucleari per ormoni, attraverso il reclutamento della istone deacetilasi. Acetilazione e deacetilazione dei residui di lisina nelle code N-terminali degli istoni sembrano essere necessarie per una serie di eventi nucleari cruciali quali silenziamento, replicazione e corretta riparazione del DNA. HDAC1, in
particolare, è implicato nella regolazione della progressione del ciclo cellulare, nel differenziamento e nello sviluppo (Ng e Bird, 2000); una serie di studi ha rivelato anche un suo potenziale ruolo nella carcinogenesi (Cress e Seto, 2000).
PHB2 interagisce con HDAC1 tramite due domini: uno all’N-terminale ed uno al C-terminale ed è capace di interagire anche con altri membri della famiglia HDAC, per esempio HDAC5, appartenente, però, ad un’altra classe di deacetilasi. PHB2 inizialmente è stata identificata come inibitore antagonista dipendente dell’attività trascrizionale del recettore degli estrogeni, capace di eseguire la sua funzione attraverso una competizione con co-attivatori per il legame ai recettori degli estrogeni, in particolare il recettore per gli estrogeni α (ERα). Studi successivi hanno rilevato, inoltre, un effetto repressivo di PHB2 sui ligandi collegati ai recettori degli estrogeni. Da queste evidenze e dalla dimostrazione che PHB2 interagisce effettivamente sia con ERα che con HDAC1, è stato proposto che PHB2 agisca come co-regolatore di ERα attraverso il reclutamento di HDACs nei geni target dei recettori nucleari (Kurtev et al. 2004).
Da notare che il legame PHB2-ER avviene soltanto in presenza di estrogeni. Le interazioni di PHB2 non si limitano ai soli ERα: essa si lega anche con altri membri della famiglia di recettori nucleari, quali COUP-TFI e COUP-TFII (Pereira et al., 2000), proteine che, legandosi al DNA, fungono da regolatori negativi per la funzione di attivazione di altri recettori ormonali nucleari. In accordo con la funzione di repressori, i COUP-TFs vanno ad associarsi direttamente o meno con le deacetilasi, incluse HDAC1 (Smirnov et al., 2000) e HDAC5 (Kurtev et al., 2004), verificando, così, l’esistenza non solo di un’interazione fisica, ma anche funzionale tra PHB2 e i COUP-TFs.
Alla luce di questi risultati è stato proposto, infine, che PHB2 agisca come una più generale proteina con funzione di co-repressore capace di interagire con una serie di recettori nucleari per ormoni e che esegue la sua funzione reclutando le deacetilasi.
Ruolo di PHB2 nel differenziamento muscolare
Durante il differenziamento muscolare due famiglie di fattori di trascrizione, MRF (Myf5, MyoD, miogeneina e MRF4) e MEF2 giocano un ruolo decisivo. Entrambi i
23 espressa nelle cellule miogeniche C2C12, inibisce l’induzione della trascrizione della miogenina e il conseguente differenziamento muscolare. In questo studio è anche stato rivelato che PHB2 recluta la HDAC1, che potrebbe essere responsabile della sua attività di repressione (Sun et al., 2004).
Protezione della coesione tra cromatidi fratelli mediata da PHB2
La coesione tra cromatidi fratelli è essenziale per una corretta segregazione alla mitosi. Uno studio condotto su cellule umane HeLa, ha dimostrato il coinvolgimento di PHB2 nella regolazione della coesione dei cromatidi fratelli durante la mitosi (Takata et al., 2007). L’eliminazione selettiva mediante RNAi del gene PHB2 determina una prematura separazione dei cromatidi fratelli e difetti nell’aggregazione dei cromosomi, accompagnata dall’arresto della mitosi, causata dall’attivazione del checkpoint del fuso: in assenza di PHB2, le coesine si trovano ad essere dissociate dai centromeri durante l’inizio della mitosi (Kitajima et al., 2005). In questo contesto, la funzione di PHB2 sembra essere quella di impedire la fosforilazione delle coesine e la loro conseguente rimozione dal centromero (Takata et al. 2007). Con un’analisi più nel dettaglio, mediante trattamento delle cellule con colcemide per 3 ore, è possibile osservare che i cromosomi in metafase trattati possiedono cromatidi fratelli separati lungo tutta la lunghezza del cromosoma, a differenza dei controlli che rimangono legati a livello del centromero.
PHB2 e le cellule staminali
Studi effettuati utilizzando metodiche di proteomica (elettroforesi bidimensionale ed analisi di spettroscopia di massa MALDI-TOF) hanno permesso di ipotizzare in vitro una correlazione tra l’espressione di PHBs e il mantenimento dello stato indifferenziato e proliferante di cellule epatiche staminali (HSL) (Saheki et al., 2008). Cellule HSL proliferano nel medium di Eagle modificato da Dulbecco (DMEM) con il 10% di siero bovino fetale (FCS) senza andare incontro a differenziamento o tumurogenesi e non mostrano cambiamenti morfologici spontanei anche in colture a lungo termine.
Aggiungendo al terreno di coltura butirrato di sodio (NaB), esso determina un effetto antiproliferativo nelle cellule HSL che vanno incontro a cambiamenti morfologici, convertendosi in cellule appiattite dall’ampio citoplasma. NaB agisce come inibitore delle istone deacetilasi in un’ampia varietà di tipi cellulari e la sua capacità di induzione
al differenziamento cellulare è ampiamente studiata. Scarse informazioni si hanno, invece, per gli effetti antiproliferativi osservati nelle cellule HSL.
Per mezzo degli studi di proteomica citati e valutando le concentrazioni proteiche presenti nelle cellule HSL prima e dopo i trattamenti con NaB, sono state individuate sei proteine implicate nella proliferazione delle cellule HSL in vitro, tra cui anche la proteina PHB2. È stato ipotizzato che questa proteina sia implicata nell’attivazione della cascata classica della chinasi mitogen-activated protein (MAP) convertendo cellule HSL in cellule proliferanti. Analisi di RT-PCR, per valutare un cambiamento a livello trascrizionale, non hanno evidenziato un cambiamento nei livelli dell’espressione degli mRNA di queste proteine. Sono stati ipotizzati, perciò, altri meccanismi con cui avvenga il cambiamento nelle concentrazioni proteiche, tra cui la degradazione delle proteine già sintetizzate, una regolazione traduzionale oppure modificazioni post-traduzionali. Informazioni sul ruolo in vivo di fattori PHBs nella biologia delle cellule staminali adulte non sono, invece, ancora disponibili.