PARTE SPERIMENTALE
1. INTRODUZIONE
La presente tesi ha avuto lo scopo di valutare la farmacocinetica in vivo su conigli albini dell’atenololo dopo somministrazione buccale di microparticelle preparate mediante spray congealing.
Lo studio si è articolato in 3 parti:
• Somministrazione a conigli albini di atenololo come soluzione per via endovenosa, sottoforma di microparticelle per via buccale e di compresse per via orale. Prelievi di campioni di sangue a predeterminati intervalli di tempo.
• Messa a punto di un idoneo metodo analitico HPLC per la determinazione del farmaco nei campioni biologici: scelta dell’eluente, del detector di rilevazione, di un opportuna tecnica di trattamento dei campioni biologici per la precipitazione delle proteine plasmatiche
• Analisi di tutti i campioni, elaborazione dei dati.
2. MATERIALI
Atenololo (ATL, Sigma-Aldrich, lot n. 075K1888, Italy); Lutrol F127 (PF127) (BASF, Germania); stearoyl polyoxylglycerides (GLC, Gelucire® 50/13) (Gattefossè, Francia)
a. CENNI SUL PRINCIPIO ATTIVO
ATENOLOLO
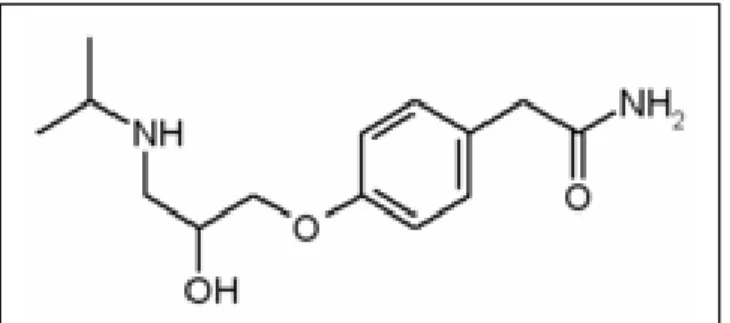
L’atenololo (Figura7) è un farmaco β-bloccante cardioselettivo senza attività simpatomimetica intrinseca.
I farmaci β-bloccanti sono stati introdotti nel 1966 per il trattamento delle patologie cardiovascolari.
Questi farmaci sono particolarmente efficaci in caso di infarto coronario, meglio conosciuto come angina pectoris, ipertensione arteriosa e aritmia coronarica.
Figura 7. Formula di struttura dell’atenololo
[2-(4-(2-idrossi-3-(isopropilamino)propossi)fenil)acetamide]
Il farmaco appare come una polvere bianca, inodore e di consistenza fine.
L’atenololo è un farmaco idrosolubile con un basso coefficiente di ripartizione tra n-ottanolo e tampone fosfato (0,16M): il valore è 0,008 a pH 7 e 0,052 a pH 8.
b.
CENNI SU GLI ECCIPIENTI
GELUCIRE 50/13
I Gelucire sono una famiglia di materiali costituiti da una miscela di gliceridi e di esteri di acidi grassi del polietilenglicole.
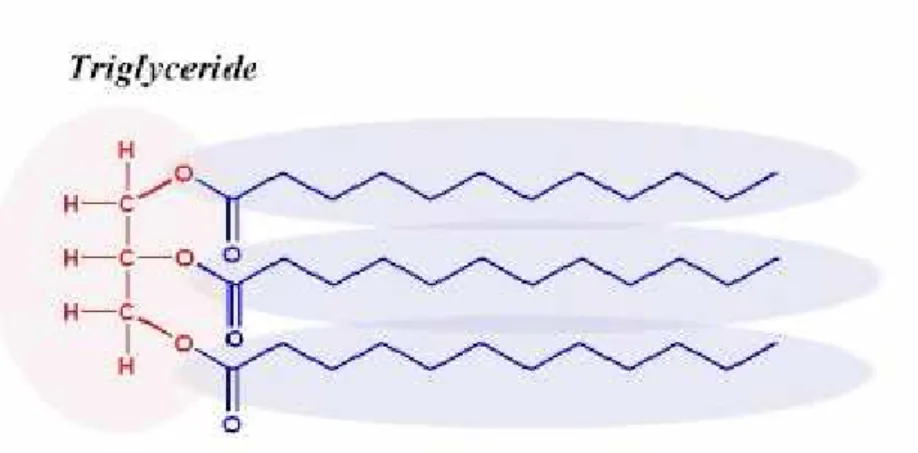
I gliceridi sono sostanze naturali presenti in prodotti come l’olio di oliva, di girasole o di cocco; chimicamente sono esteri ottenuti da acidi grassi e dal glicerolo, la cui struttura di base è:
Figura 8. Formula generale di un trigliceride
Tutti e tre i gruppi possono essere esterificati, come nella figura, e in questo caso si tratta di un trigliceride, oppure se è sostituito solo uno o due –OH saranno un mono o un digliceride.
La composizione dei Gelucire può essere controllata mediante la scelta degli oli di partenza o delle condizioni di preparazione, ma in effetti il materiale ha sempre proprietà idrofile per la presenza degli esteri del PEG.
La nomenclatura dei Gelucire fornisce informazioni riguardo alle loro proprietà: ciascun materiale viene definito da due numeri, il primo si
riferisce approssimativamente al punto di fusione e il secondo al valore di HLB (Hydrophylic-Lipophylic-Balance).
Il punto di fusione è un elemento importante la preparazione delle
forme farmaceutiche, mentre l’HLB fornisce informazioni
sull’idrofilicità, può variare
in una scala da 1 a 20, i valori che vanno da 1 a 10 indicano un carattere prettamente lipofilo mentre da 10 a 20 idrofilo.
Il valore di HLB dipende dalle proporzioni relative dei vari componenti della miscela, come guida si può utilizzare la tabella V che correla le caratteristiche dei prodotti al contributo HLB. [11]
Tabella V
PRODOTTO HLB
Trigliceridi 1-2
Digliceridi 2-3
Monogliceridi 3-4
PEG diesteri di acidi grassi 6-15
PEG monoesteri di acidi grassi 10-15
LURTOL F127 (POLOXAMER 407)
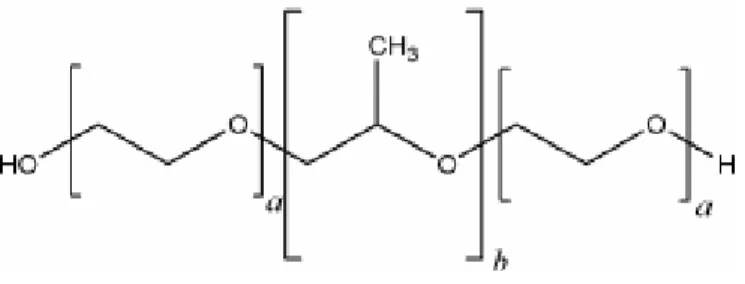
I poloxameri, la cui formula generale è riportata in Figura 9, sono una classe di polimeri a blocchi di tipo ABA costituiti da un blocco centrale idrofobico di polipropilene ossido al quale sono legati due blocchi idrofili di polietilene ossido.
Il polimero deriva dalla polimerizzazione sequenziale di ossido di propilene e ossido di etilene.
Figura 9. Schematizzazione della formula di struttura del polimero. I blocchi indicati
con a e b rappresentano rispettivamente il polietilenglicole e il polipropilenglicole
Combinando blocchi di peso molecolare differente possono variare le caratteristiche del composto finale, come la consistenza ( liquida,
semisolida o solida) o il carattere liofilo o idrofilo.
Il Lutrol F127 ha un peso molecolare di 12200 D, con il 73% di polietilene e il 27% di polipropilene; questa proporzione rende il polimero facilmente solubile in acqua.
Proprietà: la proprietà principale del Lutrol F127 è la capacità di formare un gel termo-reversibile le cui proprietà reologiche dipendono dalla concentrazione.
La viscosità aumenta all’aumentare della temperatura e della concentrazione; quando la concentrazione è superiore al 16% p/v la transizione sol-gel avviene tra 15°C e 25°C.
Applicazioni principali
• Riduzione della velocità di idrolisi dell’indometacina [12], il polimero protegge il principio attivo creando delle aree
idrofobiche tridimensionali che incapsulano il farmaco e ne evitano l’idrolisi.
• Incremento o modifica delle caratteristiche di rilascio di farmaci poco solubili da forme solide. Le caratteristiche di rilascio dei principi attivi dipendono dalle concentrazioni del polimero e dalla temperatura; è stato osservato con diclofenac e idrocortisone [12] che la velocità di rilascio diminuisce aumentando la concentrazione di Lutrol F127 ma aumenta incrementando la temperatura.
• Il Lutrol F127 è utilizzato inoltre in formulazioni dentali, dentifrici, formulazioni oftalmiche e nelle nanoparticelle. [12]
3. METODI DI ANALISI HPLC
La determinazione quantitativa dell’Atenololo è stata effettuata mediante cromatografia liquida ad alta risoluzione (HPLC) per confronto con una curva di taratura esterna.
L’apparecchiatura HPLC impiegata per l’analisi era costituita da un sistema Shimadzu LC-20AD con rivelatore UV SPD-10 e sistema di integrazione CromatoPlus. Il sistema di iniezione utilizzato era un SIL-10AD VP Shimadzu auto injector, della capacità di 20 µl. La colonna in fase inversa era una Gemini (Phenomenex) di lunghezza 25 cm e di diametro interno 4,6 mm impaccata con una fase C18 da 5 µ.
L’analisi del farmaco nel plasma prevedeva il trattamento del campione biologico per la separazione delle proteine plasmatiche e la successiva analisi cromatografia. Sono stati effettuati diversi tentativi per trovare il metodo migliore che permettesse di individuare il picco del farmaco in presenza delle proteine plasmatiche.
I METODO: a 80 µl di plasma sono stati aggiunti 10 µl di soluzione standard di farmaco in acqua e 80 µl di HCLO4 /MeOH; il campione è stato quindi sottoposto a centrifugazione per 10 minuti a 12500 rpm. In questo modo sono state precipitate parte delle proteine plasmatiche, e 20 µl di sovranatante sono stati iniettati in colonna.
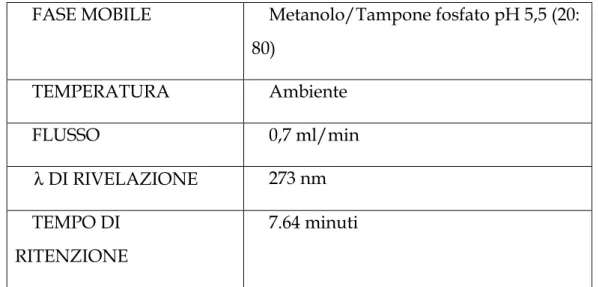
Tab. VI – Condizioni operative per l’analisi HPLC secondo il Metodo I
FASE MOBILE Metanolo/Tampone fosfato pH 5,5 (20:
80) TEMPERATURA Ambiente FLUSSO 0,7 ml/min λ DI RIVELAZIONE 273 nm TEMPO DI RITENZIONE 7.64 minuti
Per la preparazione del tampone fosfato sono state utilizzate soluzioni acquose di NaH2PO4 H2O (0.06 M) e Na2HPO4 (0.06 M) in rapporto 96.1:3.9.
Il tracciato cromatografico non risultava soddisfacente a causa di sovrapposizione di picchi di proteine plasmatiche al picco del farmaco.
II METODO: Nella seconda metodica provata è stato usato un detector a fluorescenza. L’apparecchiatura HPLC impiegata per l’analisi dei campioni ottenuti era costituita da un sistema Shimadzu LC-10AD con rivelatore a fluorescenza RF551 e sistema di integrazione CromatoPlus. Il sistema di iniezione utilizzato era un SIL-10AD VP Shimadzu auto injector, della capacità di 20 µl. La colonna in fase inversa era ancora una Gemini (Phenomenex) come quella descritta sopra.
A 80 µl di plasma venivano aggiunti 10 µl di soluzione standard di farmaco in acqua e 80µl di HCLO4 /MeOH, il tutto sottoposto a centrifugazione per 10 minuti a 12500 rpm e 20 µl di sovranatante erano iniettati. Le condizioni operative sono riassunte in tabella VII [13].
Tab VII. – Condizioni operative per l’analisi HPLC secondo il Metodo II
FASE MOBILE Tampone fosfato pH 5,5 / CH3OH
(80:20) TEMPERATURA Ambiente FLUSSO 0,7 ml/min λ ex 280 nm λ em 300 nm TEMPO DI RITENZIONE 9,0 minuti
Con questa metodica il cromatogramma presentava molti meno picchi attribuibili alle proteine plasmatiche, ma in corrispondenza del picco del farmaco ne risultavano altri che lo coprivano parzialmente e non permettevano una buona integrazione.
III METODO: è stato usato lo stesso strumento e la stessa metodica di trattamento dei campioni biologici del Metodo I. L’unica differenza ha riguardato la fase mobile costituita da tampone fosfato pH 3,8/metanolo(90:10)/acetonitrile (90:10). Il flusso era di 1 ml/min, la lunghezza d’onda e il tempo di ritenzione erano 273 nm e 6.12 min, rispettivamente. Il tampone fosfato è stato preparato a partire da acido fosforico 85% diluito con acqua bidistillata, portato a pH 3.8 con NaOH 1 N. In questo caso risultavano sempre molti picchi ma decisamene più interpretabili rispetto alle prove precedenti. Allo scopo di individuare in modo più chiaro il picco relativo al farmaco è stato usato uno standard interno, il sotalolo [13], ma senza un apprezzabile miglioramento.
IV METODO: Mantenendo inalterate la fase mobile e il flusso è stato cambiato il trattamento del campione: 80 µl di plasma sono stati addizionati di 10 µl di soluzione standard, sono stati portati a secco in
centrifuga sotto vuoto alla temperatura di 40°C. I campioni sono stati successivamente ripresi con 170 µl di CH3CN, agitati al mixer per un minuto e quindi iniettati. Il tracciato cromatografico risultava molto più pulito, ma non si riusciva ad estrarre in maniera adeguata il farmaco. Anche questo metodo è quindi risultato non soddisfacente.
V METODO In questo caso è stata modificata nuovamente la fase mobile usando come eluente tampone fosfato pH 3,8/acetonitrile (90:10). A 80µl di plasma venivano aggiunti 10 µl di soluzione standard e 80 µl di HCLO4 /MeOH; i campioni erano centrifugati per 10 minuti a 12500 rpm ed il supernatante veniva analizzato mediante HPLC. I picchi delle proteine plasmatiche rimanevano, ma in questo caso non disturbavano il picco del farmaco che usciva a 6,0 minuti. Il tampone fosfato è stato preparato a partire da acido fosforico 85% diluito con acqua bidistillata, portato a pH 3.8 con NaOH 1 N. Questa metodica è risultata la migliore ed è stata usata per la costruzione della retta di taratura e l’analisi successiva dei nostri campioni. Le condizioni operative sono riassunte in tabella VIII.
Tab VIII. – Condizioni operative per l’analisi HPLC secondo il Metodo V
FASE MOBILE Tampone fosfato pH 3,8 /
CH3CN (90:10) TEMPERATURA Ambiente FLUSSO 1 ml/min λ DI RIVELAZIONE 273 nm TEMPO DI RITENZIONE 6,0 minuti
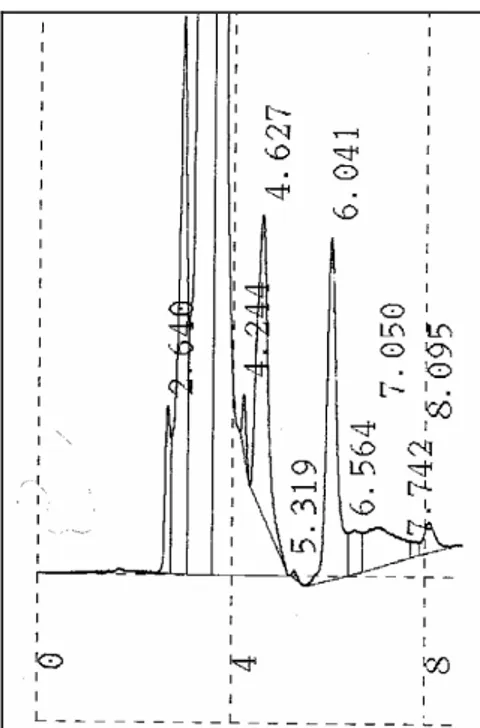
Nella figura 10 è riportato l’esempio di un cromatogramma dell’atenololo in presenza di materiale biologico.
4. FORMULAZIONI
Le formulazioni utilizzate nello studio sono state: microparticelle contenenti atenololo (15.51% p/p) e PF127 (AL); microparticelle ALG contenenti atenololo (14.73% p/p) ed una miscela di PF127 e GLC in rapporto 3:1; compresse commerciali contenenti 50 mg di atenololo utilizzate come riferimento.
Le microparticelle sono state preparate in collaborazione con un gruppo di ricercatori dell’università di Bologna [14] mediante una
Figura 10. Esempio di un cromatogramma
HPLC dell’atenololo in presenza di materiale biologico (plasma).
tecnica di spray-congealing che utilizza un ugello ad aria compressa messo a punto dallo stesso gruppo di ricerca.
L’atomizzatore è un dispositivo a due componenti azionato ad aria compressa, chiamato “Wide Pneumatic Nozzle” (Figura 11) che sfrutta per il suo funzionamento l’effetto Venturi, anche se in una configurazione insolita, perchè contrariamente a quanto avviene negli atomizzatori pneumatici tradizionali, l’aria viene alimentata in direzione radiale mentre il liquido viene introdotto assialmente e procede con percorso rettilineo.
Figura 11: schema dell’ ugello a venturimetro (A: entrata del materiale fuso; B: entrata aria
di condizionamento; C: scarico)
Il getto d’aria investe il materiale in caduta, provocando nel punto C la frantumazione del materiale e la formazione di goccioline che, essendo accelerate in maniera minima dall’aria, cadono formando un cono di diametro ristretto.
L’ugello, posizionato a circa 2 metri di altezza e in posizione perfettamente perpendicolare al terreno, è riscaldato per mezzo di resistenze ad una temperatura di poco superiore al punto di fusione
dell’eccipiente più altofondente, al fine di evitare la solidificazione del materiale all’interno dello strumento.
Per l’alimentazione dell’ugello viene preparata una miscela riscaldando su piastra il poloxamero ad una temperatura superiore di circa 10°C al punto di fusione, quindi vengono aggiunti eventuali altri eccipienti, facendo attenzione a solubilizzarli completamente mediante un’energica agitazione, ed infine alla miscela ottenuta viene addizionato il principio attivo.
Una volta ottenuto il composto fuso si procede con il caricamento dello strumento, regolato in modo che l’aria in entrata venga mantenuta alla pressione stabile di 2 bar e la temperatura portata a valori più alti del punto di fusione del poloxamero, perché è un polimero altamente viscoso, quindi il flusso del materiale in uscita risulterebbe notevolmente rallentato con conseguente solidificazione ed otturazione dell’ugello.
Sono state preparate microparticelle contenenti Atenololo e Lutrol F127 (1:4) e microparticelle contenenti Atenololo, Lutrol F127 e Gelucire 50/13 (1:3:1) e i campioni ottenuti sono stati caratterizzati mediante microscopia elettronica a scansione (SEM), analisi dimensionale, studi di mucoadesione, analisi dei profili di dissoluzione in vitro.
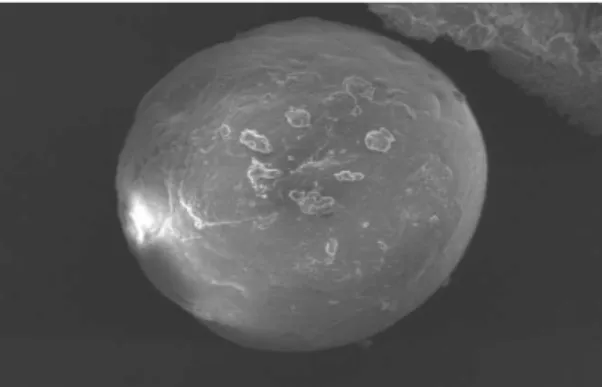
La microscopia elettronica a scansione delle microparticelle contenenti Atenololo e Lutrol F127 (AL) mostra che sono perfettamente sferiche, con la superficie un po’ rugosa e ben separate le une dalle altre (Figura 12), all’analisi dimensionale risultano >500 nm, ma c’è anche una discreta frazione di microparticelle comprese tra 100-355 nm.
Figura 12. immagine SEM di una microparticella contenente Lutrol F127 e Atenololo (400x)
Dal test di mucoadesione è risultato che le microparticelle AL hanno buone proprietà mucoadesive, la forza di distacco è risultata uguale a 4,01 ± 0,08 mN/cm2; il profilo di rilascio delle microparticelle a pH 6,4 ha messo in evidenza che queste microparticelle non esercitano alcun tipo di controllo rispetto al farmaco puro.
Dalle microparticelle sono state preparate delle matrici per compressione diretta alla pressione di 1 tonnellata per 10 secondi aggiungendo una piccola percentuale di magnesio stearato come lubrificante; le compresse avevano peso 250 mg, diametro 11 mm, spessore 2,48 mm e durezza 3,5 Kg. Il profilo di dissoluzione delle compresse, sempre a pH 6,4, ha evidenziato un qualche controllo del rilascio.
L’analisi morfologica delle microparticelle contenenti Atenololo, Lutrol F127 e Gelucire 50/13 (ALG) ha mostrato che hanno superficie levigata, sono perfettamente sferiche e non formano aggregati (Figura 13), all’analisi dimensionale si evidenzia un notevole aumento della frazione >500 nm a causa dell’aumento della viscosità del materiale da nebulizzare, rispetto all’altra formulazione.
Figura 13. immagine SEM delle microparticelle di Lutrol F127-Gelucire 50/13 (3:1) con 20% di atenololo (A-380x e B-150x)
Dal test di mucoadesione è risultato che le microparticelle possiedono ancora ottime proprietà mucoadesive, i valori rimangono intorno a 4 mN/cm2.
Anche da queste microparticelle sono state preparate compresse con lo stesso procedimento con cui sono state preparate quelle contenenti solo Lutrol e le caratteristiche fisiche delle matrici così ottenute sono risultate le stesse.
Il profilo di dissoluzione delle microparticelle ALG evidenzia un certo controllo del rilascio, e questo controllo è molto più marcato nelle compresse perché il Gelucire, eccipiente lipofilo, tende a limitare l’idratazione della matrice polimerica e quindi ad ostacolare la solubilizzazione del farmaco nel solvente.
5. STUDI DI PERMEAZIONE
DELL’ATENOLOLO IN VIVO
Gli animali utilizzati nello studio erano conigli albini femmine New Zealand del peso di 4.0-4.5 Kg, usati e curati come prescritto nella pubblicazione “Guida per la cura e l’uso di animali da laboratorio”(NIH Pubblication No. 92-93, revised 1985). Tutti gli esperimenti erano conformi all’ARVO, Risoluzione sull’uso degli animali nella ricerca; gli animali sono stati tenuti sotto supervisione veterinaria e i protocolli sono stati approvati dal comitato etico-scientifico dell’Università di Pisa. Gli animali erano alloggiati in gabbie standard singole, in una stanza con luce controllata, alla temperatura di 19±1 °C e 50±5% di umidità relativa, senza restrizioni di cibo o acqua. Questi erano anestetizzati per somministrazione intramuscolare di 8.73 mg kg¯1 di tiletamina cloridrato e 8.63 mg kg¯1 di zolazepam cloridrato (Zoletil 100®, Laboratories Virdac, France). Nell’area sublinguale, in contatto con la superficie ventrale della lingua venivano somministrati 250 mg di formulazione AL (microparticelle AT/PF127) o ALG (microparticelle AT/ PF127: Gelucire) o una compressa commerciale di atenololo da 50 mg (formulazione di riferimento).
Per valutare la biodisponibilità assoluta dell’atenololo venivano somministrati per via endovenosa 2.5 mg di farmaco in soluzione acquosa. Campioni di sangue (400-500 µl) erano prelevati dalla vena marginale dell’orecchio del coniglio ad intervalli di tempo di 10, 20 (solo per la somministrazione endovenosa), 30, 60, 90 minuti e 2, 3, 4, 8, 12, 16, 20 e 24 ore dopo la somministrazione delle formulazioni. Dopo centrifugazione per 10 minuti a 10000 rpm i campioni di plasma erano separati e conservati a -20 °C. Per l’analisi i campioni di plasma erano deproteinizzati con un eguale volume di miscela di metanolo contenente
il 6 % v/v di acido perclorico. Dopo centrifugazione per 10 minuti a 12500 rpm, 20 µl di sovranatante erano iniettati per l’analisi all’HPLC seguendo il Metodo V riportato nel paragrafo n. 3 . Ogni test veniva ripetuto almeno quattro volte.
6. RISULTATI
I risultati degli studi farmacocinetici sono riassunti in tabella IX dove per ciascuna formulazione allo studio (compresse commerciali e microparticelle AL e ALG date per via orale e per via buccale, rispettivamente) sono riportati: AUC0-24 ( area sotto la curva della concentrazione plasma-tempo fino a 24 ore), Cmax (concentrazione plasmatica massima), Tmax (tempo di picco) e C24h (concentrazione di atenololo nel plasma dopo 24 ore). Il relativo profilo farmacocinetico è mostrato in figura 14 .
La biodisponibilità assoluta (A.B.) dell’atenololo dalle formulazioni testate è stata calcolata usando la formula classica:
A.B. = [AUCx * doseiv / AUCiv * dosex] *100
dove AUCx eAUCiv sono le AUC calcolate dopo somministrazione orale o buccale e endovenosa rispettivamente; dosex e doseiv sono le corrispondenti dosi di atenololo.
La concentrazione plasmatica dopo somministrazione endovenosa decresce repentinamente nel tempo, si riduce al 12% della dose dopo 4 ore dalla somministrazione. Il relativo profilo farmacocinetico è mostrato in figura 15.
I dati farmacocinetici delle compresse in commercio mostrano un picco della concentrazione di atenololo (2.77±0.67 µl/ml) 3h dopo la somministrazione e una concentrazione residua di farmaco a 24h di 0.20±0.10 µl/ml, con un valore di AUC di 21.91±6.89 µl/ml h. La letteratura scientifica riporta dati opposti circa la farmacocinetica
dell’atenololo nei conigli. Grupta e Jain [15] ottennero valori di Cmax e AUC molto minori rispetto al presente studio, nonostante lo stesso valore di Tmax (3.00 h). In uno studio comparativo tra differenti formulazioni contenenti atenololo (orale, endovenosa e matrice transdermica), Shin e Choi [16] trovarono valori di AUC e Cmax vicini a quelli del presente lavoro dopo somministrazione orale, sebbene il tempo del picco fosse a 1,6 h e la biodisponibilità assoluta molto più alta (77.4 vs 17.42%)
La somministrazione di microparticelle (AL e ALG) determina uno spostamento del Tmax da 3.00h a 6.00hparagonato alla formulazione di riferimento con lo stesso valore di Cmax (2.69 e 2.63 µl/ml).
Questo comportamento può essere dovuto ai numerosi fenomeni che la formulazione subisce nel sito di somministrazione: scarsa idratazione nel modesto volume di fluido salivare, gelificazione del PF127, diffusione dell’atenololo attraverso il gel e infine diffusione dell’atenololo attraverso la membrana buccale molto ricca di circolazione sistemica.
Dopo somministrazione delle formulazioni AL e ALG, la quantità di atenololo rimane più elevata rispetto alle compresse di riferimento durante l’intera fase di eliminazione con differenze statisticamente significative per ALG, mostrando un profilo di rilascio prolungato; la concentrazione a 24h era di 0.56±0.15 e 0.75±0.1 contro 0.2±0.1 µl/ml rispettivamente per AL,ALG e le compresse commerciali. Questi dati sembrano confermare la ben conosciuta funzione di deposito della mucosa buccale [17]. Inoltre le migliori performance dei sistemi microparticellari si rispecchiano anche nelle misurazioni delle AUC che risultano più alte rispetto alle compresse convenzionali somministrate per via orale, infatti la formulazione ALG mostra i più alti valori di AUC (30.51±3.09 µl/ml h).
L’alta quantità di atenololo permeata dalle microparticelle attraverso il tessuto buccale appare dovuta all’attività di enhancer del PF127. La differenza tra le formulazioni AL e ALG può essere riconducibile al differente tempo del processo di idratazione: la formulazione AL forma un gel uniforme con una struttura compatta già dopo 10 min, mentre ALG, contenente meno additivo idrofilico (GLC), evidenzia una più bassa formazione di gel nello stesso tempo. Quando le formulazioni sono allo stato di gel subiscono un più facile wash-out dalla saliva, quindi AL è più facilmente rimosso dal sito di assorbimento. Inoltre l’addizione di eccipienti scarsamente idrofili al PF127 sembra aumentare ulteriormente la permeabilità del farmaco, come mostrato da Morishita et al [18] che trovò che l’addizione di adiuvanti lipofili al gel di PF127 aumentava la biodisponibilità di insulina nei ratti dopo somministrazione buccale.
Infine è importante notare che la quantità di farmaco somministrato era di 50 mg per le compresse orali e di 40 mg per le microparticelle; nonostante un più basso dosaggio di farmaco le microparticelle producono una biodisponibilità assoluta doppia rispetto al riferimento. Quindi una riduzione della dose potrebbe essere resa possibile dalla somministrazione di atenololo in microparticelle per via buccale.