Validazione in vitro dell’interfaccia
neurale a rilascio di farmaco
Il passo che segue alla progettazione dell’interfaccia e alla sua validazione come sistema di rilascio è la valutazione dell’efficacia del rilascio della proteina. In altre parole si vuole non solo che il farmaco venga rilasciato, ma anche che mantenga la sua funzionalità. A tale scopo sono state eseguite delle prove in vitro utilizzando come linea cellulare i fibroblasti renali felini Crandell (CrFK) e come sostanza da rilasciare l’albumina fluorescente, cioè albumina marcata con fluorescina. La fluoresceina-5-isotiocianato (FITC) è un colorante fluorescente che appartiene al gruppo dei coloranti derivati dallo xantene. La FITC viene impiegata per la marcatura di diverse biomolecole, in questo caso albumina di siero bovino, permettendone l’analisi in fluorescenza.
Per testare l’effettiva efficacia del rilascio, le prove in fluorescenza sono state eseguite a due diversi tempi, in particolare dopo 6 e 24 ore di incubazione delle cellule con la proteina fluorescente.
6.1 Prova sperimentale con albumina marcata
Il procedimento utilizzato per la realizzazione del sistema a rilascio è lo stesso di quello descritto nei capitoli precedenti. L’unica variante è dovuta al fatto nel film di alginato è intrappolata l’albumina marcata FITC. Inizialmente, viene deposto sull’array un sottile film o di PPy o di ossido di silicio. Intorno al microarray viene poi fatta aderire, tramite un film adesivo al bordo, una well di 1 cm di diametro e 1 cm di altezza.
Fig. 6.1 Immagine del chip al quale viene fatta aderire la well
Successivamente, il chip è sottoposto a sterilizzazione per circa un’ora agli UV. Tutte le fasi successive sono state eseguite al buio, per preservare la caratteristica di fluorescenza dell’albumina.
La soluzione utilizzata per la deposizione del film di rilascio è costituita da:
300 μ di soluzione di alginato 200 l μg /ml
250 μ di albumina marcatal 11 30 μ M
per un volume totale di soluzione di 550 μ . l
Depositato il film, si è attesa la sua asciugatura. Sperimentalmente si è osservato che il tempo necessario è circa 24 ore. Poiché la perdita di fluorescenza diminuisce rapidamente, l’evaporazione del film è avvenuta in un luogo fresco alla temperatura di 4°C, mantenendo però un flusso stabile, adeguato all’evaporazione del solvente; infatti alla temperatura di 4°C la proteina rimane stabile (cioè fluorescente) anche fino a una settimana.
11
Bovine Serum Albumin Conjugates crf. In Appendice pag 114
Al termine delle 24 ore è stato possibile procedere alla reticolazione con gli ioni calcio: 200 μ di soluzione di calcio al 30% sono stati deposti sul film per l
qualche istante e poi aspirati.
Successivamente è stato necessario deporre la fibronettina, una proteina che permette l’adesione cellulare: 300 μ della soluzione di fibronectina 10 l
ml g /
μ vengono deposti sulla superficie dell’array e poi il tutto incubato per 20 min a 37°C. Trascorsi i 20 min il liquido è aspirato e si procede alla semina delle cellule.
6.1.1 Preparazione della linea cellulare
Le cellule sono state mantenute in incubatore a 37°C. Prima di essere seminate sull’interfaccia realizzata è stato necessario staccarle dalla superficie della fiasca a cui avevano aderito. Di seguito sono stati riportati i vari step che hanno permesso la semina dei fibroblasti sul chip:
¾ Si aspira il mezzo di coltura dalla fiasca (3cm×5cm2). ¾ Si lava con 3 ml di PBS12
.
¾ Si aggiungono 300 μ di tripsina nella fiasca e si mette a incubare a l
37°C per qualche minuto per staccare le cellule.
¾ Si aggiungono 2 ml di terreno e si mette il tutto in una falcon da 15 ml.
¾ Si centrifuga a 2000 rpm per 6 min. ¾ Si elimina il surnatante.
¾ Si risospendono le cellule in 2 ml DMEM completo.
¾ Si prendono 10μ della sospensione cellulare e si effettua una l
conta con camera Burker.
¾ Si seminano 100000 cellule sul chip e si pone tutto in incubatore.
12
Phosfate Buffered Saline crf in Appendice pag 111
6.2 Risultati ottenuti e discussione
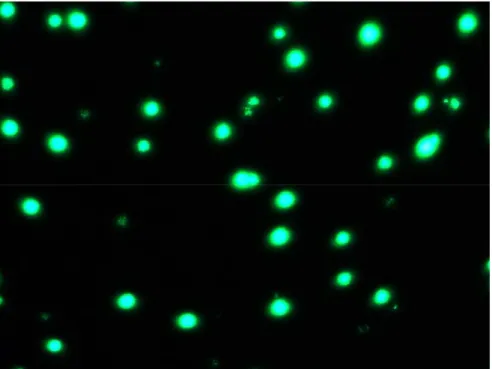
Il punto critico degli esperimenti eseguiti è la perdita di fluorescenza dell’albumina marcata incubata alla temperatura di 37°C. Quello che ci si attende sperimentalmente è un picco di fluorescenza, se l’attività della proteina non è danneggiata dall’inglobamento nella matrice e poi una rapida decadenza per effetto della temperatura. Allo scopo di valutare tali tempistiche sono state fatte prove a 6 e 24 ore di incubazione. Nella prima prova effettuata, il chip su cui sono state seminate le cellule era composto da un film sottile di ossido di silicio, film di alginato e fibronectina. Terminata la preparazione dell’interfaccia, sono state aggiunte le cellule. Passate 6 ore in incubazione a 37°C, è stato aspirato il surnatante e successivamente effettuati due lavaggi con 500 μ di PBS; quindi le l
cellule sono state fissate al substrato trattandolo con una soluzione di paraformaldeide all’1% per circa 30 min a 4°C. Aspirata la soluzione, il campione è stato lasciato asciugare per qualche minuto e poi analizzato in fluorescenza ed al FIB.
Fig. 6.2 Immagine al microscopio a fluorescenza di CrFK su substrato di CNT e
Fig. 6.3 Immagine al microscopio a fluorescenza di CrFK su substrato di CNT e
SiO dopo sei ore (a 40X) 2
Dalle immagini sopra è evidente che le cellule hanno adeso perfettamente all’array, ma soprattutto che la proteina ha diffuso abbondantemente dal film all’interno delle cellule. Dopo l’analisi al microscopio a fluorescenza il campione è stato analizzato al FIB. Di seguito sono riportate le immagini FIB relative allo stesso campione.
Fig. 6.4 Immagine al FIB di CrFK su substrato di CNT e SiO dopo sei ore ( a 800X) 2
Fig. 6.5 Immagine al FIB (10 kX)di una cellula CrFK su substrato di CNT e
Le immagini raccolte, testimoniano che la fluorescenza, espressa dalle cellule adese all’array, è estremamente intrusa, in più che la densità delle cellule sui nanotubi è molto elevata, a dimostrazione del fatto che esse aderiscono bene al substrato. Le cellule tuttavia appaiono ancora molto tondeggianti e non possiedono la tipica forma allungata che le caratterizza. Sono inoltre separate le une dalle altre e non manifestano particolare interazione. Tutto questo è dovuto al fatto che le sei ore di incubazione non sono sufficienti a stabilizzarle in coltura. Tuttavia (come evidente dalla Fig. 6.5) esse aderiscono perfettamente al substrato, rendendo anzi molto difficile la rimozione delle stesse.
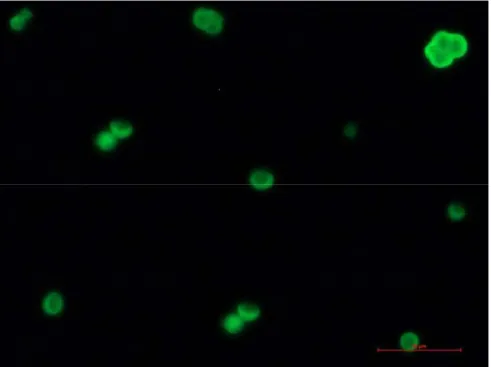
Nella seconda prova, è stato valutato il rilascio della proteina e la sua attività, dopo 24 ore.
Fig. 6.6 Immagine al microscopio a fluorescenza di CrFK su substrato di CNT e SiO dopo 24 ore (40 X) 2
Fig. 6.7 Immagine al microscopio a fluorescenza di CrFK su substrato di CNT e SiO2dopo 24 ore (40X)
Rispetto alle immagini precedenti, relative ad un tempo di incubazione di sei ore, l’intensità della fluorescenza è qui inferiore, ciò a dimostrazione del fatto che l’attività della proteina diminuisce all’aumentare del tempo di incubazione alla temperatura di 37°C. Tuttavia è evidente che le cellule tendono a formare isole (Fig. 6.6),molte di esse sono in fase di replicazione; (Fig. 6.7). Si evince, dunque, che le cellule non solo aderiscono al substrato di CNT, ma tendono a replicarsi e svolgere tutte le loro normali attività metaboliche.
Fig. 6.8 Immagine al FIB di CrFK su substrato di CNT e SiO dopo 24 ore (1 kX)
2
Fig. 6.9 Immagine al FIB di una cellula CrFK su substrato di CNT e
SiO dopo 24 ore (6,5 kX) 2
Tuttavia, sebbene la fluorescenza sia diminuita, da un’analisi al FIB è possibile notare la presenza di cellule allungate, che dimostrano il fatto che i fibroblasti, dopo 24 ore sono cresciuti e si sono adattati perfettamente al substrato di adesione.
Nella terza prova, sono state mantenute le stesse condizioni sperimentali della prova precedente, il tempo di incubazione è stato mantenuto a 24 ore ma si è adoperato un substrato di CNT ricoperto da un sottile strato di PPy
Fig. 6.10 Immagine al microscopio a fluorescenza di CrFK su substrato di CNTS e PPy dopo 24 ore (40X)
Dopo 24 ore di incubazione, il numero di cellule fluorescenti è molto basso ma tuttavia alcune cellule appaiono in fase di duplicazione. Inoltre come è possibile osservare dalle immagini al FIB (Fig.6.11 e 6.12), è evidente che le cellule crescano bene sul substrato di nanotubi e PPy, infatti hanno la forma caratteristica allungata dei fibroblasti.
Fig. 6.11 Immagine al FIB di CrFK su substrato di CNTS e PPy dopo 24 ore
Fig. 6.12 Immagine al FIB di CrFK su substrato di CNTS e PPy dopo 24 ore con ingrandimento 2,00kX
I risultati ottenuti permettono di concludere, che le cellule si adattano bene sui CNT costituendo quest’ultimi una superficie ottimale per la crescita delle cellule ed una loro eventuale differenziazione.
Dai risultati combinati ottenuti tramite microscopia FIB e microscopia a fluorescenza, si evince che l’array di CNT con i vari coating, crea una matrice 3D altamente porosa sulla quale le cellule aderiscono e crescono; è stato inoltre possibile verificare il rilascio della proteina dal film e la fagocitosi della proteina ancora attiva da parte delle cellule adese all’array.