CAPITOLO PRIMO
Il sistema robotico MIT-Manus
La terapia riabilitativa tradizionale viene somministrata dal terapista che assiste il paziente nell’eseguire gli esercizi che favoriscono il riapprendimento e il recupero delle facoltà motorie. Non esiste fino ad oggi la prova che un trattamento riabilitativo sia sicuramente superiore agli altri.
La terapia tradizionale presenta dei limiti, quali, ad esempio, il tempo definito in cui il paziente può eseguire gli esercizi alla presenza del terapista, l’obbligo per il paziente di recarsi nella struttura dove avvengono le sedute riabilitative ed una valutazione funzionale di tipo qualitativo o semi-qualitativo.
Il concetto di riabilitazione neurologica è il seguente: la funzionalità degli arti deve essere ripristinata tramite esercizi ripetitivi e frequenti.
Il trattamento robotico offre alcuni vantaggi rispetto alla terapia tradizionale: può essere effettuato con minima (o nessuna) supervisione, le traiettorie possono essere personalizzate con la possibilità di utilizzo di vari feedback, di registrazione delle forze e di misure cinematiche impiegate per una valutazione funzionale quantitativa. Il paziente ha un ruolo centrale nella terapia che offre anche motivazioni di tipo psicologico. Inoltre il trattamento robotico si può affiancare al trattamento tradizionale. Quindi i dispositivi robotici possono offrire una terapia motoria controllabile, riproducibile e quantificabile.
I sistemi robotici per la riabilitazione possono contribuire ad una maggiore comprensione dei processi di recupero funzionale.
1. 1 Descrizione del sistema robotico
Il MIT-Manus è un sistema robotico progettato a partire dal 1989, presso il Massachusetts Institute of Technology (MIT) dai professori Neville Hogan e Hermano Igo Krebs, brevettato nel 1995 [25], prodotto dalla IMT, Interactive Motion Technologies. Inc.
La sperimentazione clinica è iniziata nel 1994 al Burke Rehabilitation Hospital, White Plains, NY, e in dieci anni molti ospedali in tutto il mondo hanno adottato il sistema robotico MIT-Manus per la terapia riabilitativa dell’arto superiore nei pazienti con danni neurologici:
Spaulding (MA), Rhode Island (RI), Osaka Prefectural (Japan), Helen Hayes Rehabilitation Hospitals (NY), Baltimore (MD), Cleveland Veterans Administration Mediacal Center (OH).
In Italia si trova in quattro centri: acquisito dalla Scuola Superiore Sant’Anna di Pisa è disponibile presso il Dipartimento di Riabilitazione U.O.C. Medicina Riabilitativa Ospedale Versilia, AUSL 12 Lido di Camaiore (LU), a Roma nel Campus Biomedico, all’Ospedale Pediatrico Bambino Gesù a Roma e alla Fondazione Salvatore Maugeri a Pavia..
Il MIT-Manus è un sistema robotico di tipo operativo, caratterizzato cioè da un’interfaccia uomo-macchina limitata all’end-effector. A differenza di quanto si verifica nei robot industriali, per i quali deve essere di norma escluso ogni contatto con l’operatore umano per motivi di sicurezza, il MIT-Manus è stato progettato specificamente per interagire con il paziente, e in modo tale che l’interazione sia sempre sicura, stabile e, quando appropriato, cedevole.
Il sistema MIT-Manus può muovere, guidare o perturbare il movimento dell'arto superiore di un soggetto e registrare variabili, quali la posizione, la velocità e le forze applicate.
La terapia riabilitativa con la macchina robotica MIT-Manus consiste nel proporre al paziente una serie di compiti motori complessi nei quali viene richiesto di muovere l'effettore del robot per effettuare movimenti consistenti nel raggiungimento di obiettivi in uno spazio bidimensionale (movimenti di reaching). Se il paziente non riesce a portare a termine il compito proposto, il robot assiste e guida attivamente l'arto paretico nel completarlo correttamente.
Figura 11. Il sistema robotico MIT-Manus all’Ospedale Versilia (LU).
Il MIT-Manus è un sistema robotico modulare per applicazioni cliniche neurologiche, in particolare per il trattamento riabilitativo dell’arto superiore nei pazienti che hanno subito ictus, lesioni al sistema nervoso centrale o periferico a causa di un trauma.
In queste patologie il paziente perde le capacità motorie di alcuni gruppi muscolari e il completo range di movimento degli arti. Il paziente quindi deve essere sottoposto a terapia fisica e occupazionale per recuperare le capacità motorie perse. Le attuali macchine riabilitative permettono la riabilitazione di singoli gruppi muscolari, ma per ottenere il recupero dell’intero range di movimento bisogna riabilitare gruppi muscolari multipli.
1. 1. 1 L’architettura hardware
Il MIT-Manus è un sistema robotico modulare, un terapista robotico interattivo costituito da un braccio mobile che interagisce col paziente per riabilitare le capacità motorie dell’arto superiore.
Il paziente è seduto assicurato ad una sedia che gli provvede una corretta postura, con un arto fissato al braccio robotico che si trova su un tavolo posto di fronte a lui. Il braccio mobile del robot guida il braccio del paziente in una serie di esercizi impostati che il paziente visualizza su un monitor. Il sistema permette di effettuare contemporaneamente la valutazione funzionale e la terapia motoria.
Figura 12. Raffigurazione del sistema costituito dal sedile che assicura l’immobilizzazione e la giusta posizione del paziente, dal braccio robotico e dal monitor dove vengono visualizzati i task.
Il braccio paretico indossa un’ortesi e afferra il manipolatore del robot compiendo delle traiettorie planari che possono essere seguite sul monitor.
Il braccio robotico è costituito da un meccanismo tipo SCARA (Selective Compliance Assembly Robot Arm).
Il robot SCARA è un robot di montaggio a cedevolezza selettiva con gli assi dei giunti verticali e paralleli tra loro; la struttura presenta elevata rigidezza a carichi verticali e cedevolezza a carichi orizzontali. Da un punto di vista costruttivo è costituito da due elementi rigidi collegati tra loro da due giunti rotoidali, per effettuare movimenti nel piano, e un terzo
elemento collegato mediante un giunto prismatico, per effettuare i movimenti verticali, permettendo in totale 3 gradi di libertà.
Il robot SCARA è un manipolatore industriale di semplice struttura; è stato scelto per la sua configurazione e le sue caratteristiche che permettono di ottenere movimenti con bassa impedenza nel piano orizzontale e impedenza infinita nel piano verticale, assicurando cioè lo spazio di lavoro solo al piano orizzontale: questa caratteristica viene sfruttata perchè la terapia che si effettua con il sistema MIT-Manus prevede movimenti planari di reaching dove il braccio robotico non eserciti resistenza o attrito ma sia il più possibile cedevole e sicuro per il paziente.
Figura 13. Il meccanismo SCARA nel braccio del sistema robotico MIT-Manus
Il sistema MIT-Manus ha configurazione SCARA planare a catena cinematica chiusa, senza il giunto prismatico; è costituito da 5 elementi, attuati da motori brushless con una coppia statica di 7,86 Nm e sensorizzati per la misura di posizione, velocità e forza [26].
Figura 14. Disegno schematico del braccio robotico del sistema MIT-Manus.
Le caratteristiche distintive del sistema robotico MIT-Manus sono la bassa impedenza meccanica, che gli consente di adattarsi prontamente alle azioni del paziente, il controllo di
impedenza, che consente alla macchina di essere cedevole, e la backdrivability. Rispetto ai robot industriali il MIT-Manus è configurato per operazioni sicure, stabili e cedevoli al contatto con il paziente, ma allo stesso tempo è in grado di esercitare una discreta forza per guidare l’arto del paziente nella terapia robotica assistita dal robot. Il sistema di controllo modula la reazione del robot alle perturbazioni meccaniche e assicura il comportamento cedevole.
La macchina ha una bassa impedenza intrinseca, una bassa inerzia isotropica (1±0.33 kg, anisotropia massima 2:1), un basso attrito isotropico (0.84 ± 0.28 N, anisotropia massima 2:1) ed è in grado di produrre un determinato range di forze (0-45 N) ed impedenze (0-2 N/mm).
Il MIT-Manus è un robot costituito da vari moduli [27]: InMotion1 Linear Robot, InMotion2 Shoulder-Elbow Robot, InMotion3 Wrist Robot e Grasp Sensor.
Il modulo InMotion1 Linear Robot guida il movimento del braccio in ogni direzione e orientamento, sia nel piano orizzontale che verticale. Venendo guidati nell’ abduzione, nell’elevazione e nella flessione della spalla, i pazienti possono simulare una vasta gamma di movimenti, utili per le attività della vita quotidiana. L’obiettivo principale di questo modulo è portare i benefici della terapia robotica in tutto lo spazio dei movimenti del braccio, anche nei movimenti contro la forza di gravità. Il modulo permette movimenti liberi del braccio del paziente nel piano orizzontale e verticale, fornisce resistenza ai movimenti del paziente nel piano verticale contro la forza di gravità ed è in grado di provvedere un’assistenza parziale o completa in tutti i movimenti.
Sono stati sviluppati due prototipi: il primo era costituito da una slitta lineare accoppiata ad una guida a vite che aveva il vantaggio di permettere un’efficace conversione del moto rotatorio dei motori al moto lineare della slitta con poco attrito e con un meccanismo reversibile (backdrivable). I giochi della terapia robotica relativi a questo modulo, consentivano movimenti di abduzione della spalla tra i 45° e i 65° e da 30° a 90° per il sollevamento e la flessione della spalla. Il modulo era in grado di esercitare 65 N nella direzione verticale (il peso del braccio è mediamente 20 N) e 45 N verso il basso e raggiungere una rigidezza aggiuntiva di 10 N/mm, più grande dei valori raggiunti in terapia. Questo modulo ha ottenuto buoni risultati sia utilizzato singolarmente che montato sul modulo planare. Nel secondo prototipo si sono compensati maggiormente l’attrito e l’inerzia (attrito ridotto del 25% ed inerzia del 76%) includendo dei magneti nel motore e utilizzando motori lineari DC.
Figure 15. Modulo InMotion1 Linear Robot, due diverse prospettive.
Il modulo planare InMotion2 Shoulder-Elbow Robot ha due gradi di libertà traslazionali per il movimento del braccio e del polso, permette movimenti lineari di reaching, e consente un piccolo movimento nel piano verticale con un set di molle.
Il modulo planare è costituito dal sistema direct-drive SCARA a 5 link rigidi attuato da 2 motori brushless con una coppia statica di 7.86 Nm e sensorizzati con encoder a 16 bit per misurare la posizione e la velocità.
Figura 16. Modulo InMotion2 Shoulder-Elbow Robot
Il modulo per il polso InMotion3 Wrist Robot ha 3 gradi di libertà per la pronosupinazione del braccio, la flesso-estensione e la abduzione/adduzione del polso; è costituito da un meccanismo differenziale collegato ad un quadrilatero articolato con un sistema di attuazione ad ingranaggi, fornisce al paziente livelli di assistenza regolabili e/o variabili nel tempo con un’impedenza rotazionale programmabile.
Questo modulo può essere sostituito da un semplice hand holder che ha funzione di sostegno per il polso e la mano durante il movimento dell’avambraccio.
Figura 17. Visione laterale (a sinistra), frontale (al centro) e dall’alto (a destra) del moduloInMotion3 Wrist Robot
Figura 18.Modulo per il polso costituito dal hand holder
Il Grasp Sensor è composto da un sensore sensibile alla pressione avvolto attorno ad un cilindro di altezza 10,8 cm e diametro 3,8 cm; il sensore fornisce in uscita un voltaggio proporzionale alla pressione ottenuta come integrale della forza sull’area. Se usato congiuntamente con il sensore di forza del modulo InMotion2 i carichi di spinta o sollevamento possono essere filtrati e distinti dalle forze di presa. Se il sensore è spinto ed afferrato viene registrata solo la forza di presa.
Figura 19. Il Grasp Sensor contenuto nel handle
Il meccanismo è montato su una base cilindrica che permette di regolare la posizione verticale del dispositivo.
Figura 20. La base cilindrica del robot
Il sistema robotico MIT-Manus è provvisto di molti sensori per misurare la posizione, la velocità e la forza di interazione applicata, cioè quei parametri fondamentali per la caratterizzazione del task motorio. Oltre agli encoder ottici incrementali ridondanti a 16 bit, nei motori si trovano dc-tachometer con una sensibilità di 1,75 V/rad/s, e dei sensori di coppia (torque sensor) sull’albero motore con una coppia massima di 22,6 Nm. Per minimizzare i disallineamenti, gli attuatori e i sensori sono posizionati sullo stesso asse. Gli encoder e i torque sensor sono posizionati sull’albero d’ uscita dei motori brushless, mentre il dc-tachometer è collocato sulla cima dell’albero motore.
Figura 21. I sensori e loro posizionamento
Gli attuatori permettono una coppia massima di 0,108 Nm ed includono, per il controllo della posizione, un potenziometro con 0,9 Kohm/rad e tachometers con sensibilità di 0,07 V/rad/sec.
Il sistema di attuazione comprende due motori brushless direct drive high torque coassiali che attuano i giunti rotoidali della spalla (M1 con asse coincidente all’asse del giunto stesso) e del gomito (M2); gli assi dei giunti sono verticali e paralleli tra di loro.
Un motore aggiuntivo (M3) è richiesto per il movimento del modulo del polso.
Figura 22. Posizionamento dei motori M1, M2 e M3 nel braccio robotico
Il controllo di impedenza del sistema robotico è ottenuto con un feedback non lineare di posizione e velocità che riesce a produrre una rigidezza e un attrito costante all’effettore. Tale controllo robusto è possibile grazie all’alta reversibilità del meccanismo (backdrivability).
L’equazione che regola il controllo di impedenza è:
τ = - JT
(q) [KP x + KD x]
dove τ è il vettore coppia ai giunti, J(q) è lo Jacobiano del manipolatore, q è il vettore degli angoli dei giunti, x = x- xdesiderato è il vettore spostamento dalla posizione nominale, KP è la
matrice rigidezza in N/m (KP=[100 0; 0 100]) e KD è la matrice di smorzamento in Ns/m
(KD=[2 0; 0 2]).
Il sistema di controllo del robot è implementato in un personal computer (486 CPU-66 MHz) con un convertitore A/D a 16 bit, un convertitore D/A, porte I/O e una carta DIO digitale a 32 canali. Oltre alla funzione primaria del controllo, il computer permette di visualizzare gli esercizi che devono essere effettuati sia al paziente che al terapista via video-splitter con monitor dedicati.
La working station riabilitativa comprende inoltre un secondo personal computer (386 CPU-25 MHz) che permette al paziente di visualizzare on-line informazioni audio e video. La comunicazione tra i due computer viene effettuata attraverso porte seriali con una velocità di trasmissione con uprate delle immagini video di 30 frame/s.
La workstation è montata su un tavolo con poltrona regolabile: la seduta può ruotare di 360° e spostarsi di 0,5 m sotto il tavolo, per facilitare il trasferimento dei pazienti costretti su sedia a rotelle. La poltrona è provvista di tre cinghie per l’immobilizzazione corretta del paziente e per limitare i movimenti del busto, e un supporto per i piedi.
Il piano del tavolo può essere regolato di 0,25 m in verticale per meglio provvedere da supporto al gomito del paziente. La superficie del piano è in Teflon, come la base di supporto per il gomito. Il sostegno per la mano del paziente è diverso nei moduli a due e a tre gradi di libertà. Nel modulo a tre gradi di libertà la mano viene assicurata al supporto con un sistema di fissaggio magnetico, che permette un rapido posizionamento. Nel modulo a due gradi di libertà il supporto per la mano è fatto su misura e consente all’arto paretico del paziente di afferrare l’end-effector del robot. Sono stati realizzati supporti di diverse dimensioni e per la mano destra e sinistra, in polietilene ad alta densità (HDPE), in fibra di carbonio e in resine epossidiche.
La tabella 2 riassume l’architettura e le caratteristiche principali del sistema robotico MIT-Manus.
1. 1. 2 Il software del sistema MIT-Manus
Le componenti hardware sono controllate attraverso la scheda di acquisizione dati (DAQ) del PC: i dati vengono letti e scritti passando dai canali con conversioni analogiche e digitali (a/d), e digitali ed analogiche (d/a).
Il sistema software gira su piattaforma Linux Kernel 2.4 espansa con RTLinux 3.1, che garantisce al software di non essere soggetto ad interruzioni, e di lavorare in real time. RTLinux 3.1 gira sotto una serie di Linux Kernel Modules (LKM), mentre il control loop del robot gira sotto altri LKM. Il control loop del robot, durante ogni periodo di campionamento, compie le seguenti azioni: legge i dati dai sensori del robot, legge i dati dalle fonti di riferimento, calcola i comandi basati sui dati forniti come input, fornisce ai motori i dati del controllo ed invia i dati ai log channel. I programmi che forniscono i dati sorgente, che salvano i dati log e interagiscono con il display grafico del monitor sono separati dal codice LKM del control loop. Questi programmi Linux sono denominati “user-mode”, e comunicano con il control loop utilizzando altri programmi: gli “RTLinux real-time fifos”, o gli “RTLinux shared memory buffers”, questi ultimi permettono ai programmi “user-mode” scritti in C di condividere una o più aree di memoria con LKM.
Spazio di lavoro Rettangolare (dimensione massima 400mm).
Meccanismo
Robot Scara.
Catena cinematica chiusa con giunti i cui assi sono verticali e paralleli tra loro.
Sensori
Posizione, velocità e forza: encoder ottici incrementali a 16 bit, dc-tachometers, torque sensor e grasp sensor
Attuatori Motori brushless direct drive high torque coassiali.
Trasmissione a link rigidi.
Sistema di controllo Controllo di impedenza.
Interfaccia
Visiva: 2 monitor, uno per il paziente e uno per il terapista.
Aptica: handle sensorizzato.
Caratteristiche principali
Sistema robotico modulare con moduli a 2 e 3 gdl. Robot di tipo operativo con bassa impedenza meccanica , bassa inerzia e basso attrito quasi isotropici, elevata cedevolezza nel piano orizzontale dovuta al controllo di impedenza e rigidezza infinita nel piano verticale, sistema backdrivable.
Tabella 2. Caratteristiche principali del sistema robotico MIT-Manus
Il codice sorgente del robot è scritto in C: il file sorgente ha estensione “.c”, ogni file sorgente genera un file oggetto con estensione “.o”.
Il control loop LKM è scritto in C, il linguaggio del Linux Kernel. I programmi user-mode (come la Grafical User Interface, GUI) possono essere scritti in C, o in C++ o in qualunque altro linguaggio che gira su un sistema Linux, come ad esempio Tcl/Tk.
Figura 23. Menù software dei sei giochi
Il Movement Imaging fornisce la rappresentazione obiettiva dei movimenti del paziente. Le viste disponibili includono la visualizzazione del singolo movimento, prestazioni aggregate e movimenti aggregati sequenziali che mostrano le variazioni nel tempo. Un toolbox di misure di valutazione assicura che il movement imaging possa essere standardizzato per molteplici scopi. Queste rappresentazioni vengono fatte osservare al paziente al termine dell’esecuzione dell’esercizio come feedback.
Figura 24. Grafici visualizzati nel Movement imaging
La terapia che si effettua con il MIT-Manus rientra nella classe delle terapie Java [28], che comprende anche altri robot per la riabilitazione come l’ARM Guide e il MIME.
Le interfacce per l’utente sono di quattro tipi diversi: il “test di stato” misura i progressi riabilitativi, i “therapy games” costituiscono la terapia, le “tabelle di progresso” informano i pazienti dei progressi riabilitativi e la “pagina per il terapista” permette di descrivere e monitorare i protocolli riabilitativi.
Lo scopo dei test di stato è stimare le capacità motorie residue dei pazienti. Per esempio, il test di velocità (“speed test”) misura la velocità e l’accuratezza del movimento: il paziente muove il cursore da un punto di partenza verso un target a distanza fissa misurando il tempo impiegato per svolgere il movimento. Il target cambia posizione in maniera random e ogni volta viene acquisito il tempo di esecuzione. Altri test di stato sono il test per valutare la coordinazione (“coordination test”) che consiste nel far tracciare al paziente una figura a forma di otto misurando l’errore di esecuzione nella traiettoria, e il test di forza (“strength test”) che si ottiene facendo tenere al paziente la mano fissa in un punto mentre il dispositivo applica una forza divergente misurando lo spostamento.
I therapy games sfidano le abilità motorie e sensoriali dei pazienti in contesti accattivanti che permettono un maggior coinvolgimento emotivo. Per esempio “Breakout therapy” (nel MIT-Manus “Pong”) è una versione modificata del gioco classico Breakout in cui il giocatore controlla una paletta su cui deve rimbalzare una pallina che va a colpire dei mattoncini target: un punteggio viene assegnato in base al numero di mattoncini distrutti in tre tentativi. Quando si utilizza un joystic a ritorno di forza o l’endle di un robot come dispositivo di input, il sistema può assistere fisicamente o resistere al paziente che sta svolgendo il gioco. Ad esempio nella Breakout therapy se il paziente è troppo lento nell’eseguire i movimenti, il sistema di feedback aiuta il movimento del paziente predicendo la traiettoria della palla dopo ogni rimbalzo. Questo è possibile perché viene programmata virtualmente la lunghezza a riposo di una molla che attrae l’handle del joystic (e quindi la paletta nel gioco) alla posizione richiesta per far rimbalzare la pallina. Se il paziente è abbastanza coordinato, il joystick può resistere al movimento, impostando la lunghezza a riposo della molla lontana dalla posizione richiesta alla paletta, rendendo il gioco più competitivo.
I test di stato vengono eseguiti ripetitivamente per quantificare le capacità residue del paziente. I giochi sono realizzati per essere più coinvolgenti rispetto ai test di status, più semplici e per far eseguire una serie di movimenti ripetitivi.
Le tabelle di progresso forniscono le informazioni sul progresso delle abilità del paziente durante la terapia riabilitativa.
1. 2 La terapia riabilitativa con il sistema robotico
Manus
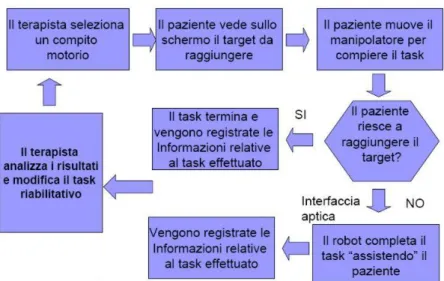
Figura 25. Schema generale della terapia riabilitativa robotica
Il terapista esegue inizialmente la tradizionale valutazione per mezzo delle scale di valutazione, e la ripete durante il corso delle sedute riabilitative per avere un confronto coi risultati ottenuti con il robot .
La terapia inizia con l’inserimento dell’ID, da parte del terapista, del soggetto che prende parte alla terapia robotica.
La terapia robotica con il sistema MIT-Manus consiste nel proporre al paziente una serie di compiti complessi, equivalenti a giochi, nei quali viene richiesto di muovere l’effettore del robot per disegnare, ad esempio, figure geometriche di base quali cerchi e quadrati. Il paziente può usare l’arto sano per insegnare al robot un esercizio, che sarà replicato dal dispositivo quando il paziente afferrerà l’handle con l’arto paretico, oppure praticarlo direttamente con l’arto da riabilitare. Se il paziente non riesce a portare a termine il compito proposto, il robot assiste e guida attivamente l’arto paretico nel completarlo correttamente. Mano a mano che il paziente recupera le abilità durante il corso della terapia, viene aumentato il livello di difficoltà degli esercizi fino alla possibilità di applicare un campo di forza divergente che costringe il paziente ad esercitare un controllo consapevole del movimento, andando quindi a recuperare non solo il range di movimento, ma il controllo dell’arto.
Il robot è in grado di guidare, assistere e perturbare i movimenti effettuati dal paziente registrando per ogni attività quantità utili alla valutazione dello stato del paziente durante la terapia come il tempo di esecuzione di un esercizio e le traiettorie eseguite.
I giochi sono stati realizzati per valutare la funzione motoria residua dell’arto superiore, per documentare e caratterizzare il recupero del paziente, per far eseguire esercizi ripetitivi e per
massimizzare l’integrazione di feedback sensoriali forniti dalla macchina (visivi, audio) agli stimoli sensoriali propriocettivi.
Alcuni giochi richiedono soprattutto movimenti della spalla, altri quelli del gomito ed alcuni la coordinazione tra spalla e gomito.
Figura 26. Lo schema illustra quali articolazioni e i relativi gruppi muscolari sono maggiormente sollecitati nei movimenti proposti dal robot.
Durante la terapia il paziente non è mai lasciato solo, ma è supervisionato dal terapista, che lo assiste in quei movimenti che da solo non è in grado di fare, lo osserva e provvede ad eventuali spiegazioni.
In genere la terapia ha la durata di sette settimane e consiste in esercizi giornalieri compiuti prima con l’arto sano seguiti da tre serie di venti ripetizioni con l’arto paretico. Ogni ripetizione è preceduta o seguita da esercizio attivo guidato dal terapista o dal robot. In genere durante il programma delle sette settimane vengono eseguite 25 sessioni con 1500 ripetizioni assistite dal robot, 100 ripetizioni non assistite e tre sessioni di valutazione.
Durante l’esecuzione degli esercizi possono venire registrate dal robot le variabili cinematiche ed eventuali segnali che mostrino l’attivazione muscolare.
Al termine delle sessioni di terapia il paziente viene nuovamente valutato tramite le tradizionali scale di valutazione .
Il protocollo di valutazione funzionale utilizzando il sistema robotico MIT-Manus dell’ospedale Versilia prevede un approccio matematico applicato ai dati provenienti da registrazioni di esercizi effettuati con il robot per la riabilitazione dell’arto superiore.
Durante ogni sessione i soggetti sono sottoposti ad una terapia robot-mediata di 45 minuti: 5 sessioni a settimana per 4 settimane.
Si distinguono due diversi esercizi: nelle prime due settimane i soggetti effettuano un movimento di “reaching” planare, “clock-like therapy”, che enfatizza i movimenti del gomito e della spalla spostando il cursore mobile dal centro ad ognuno dei target disposti lungo una circonferenza.
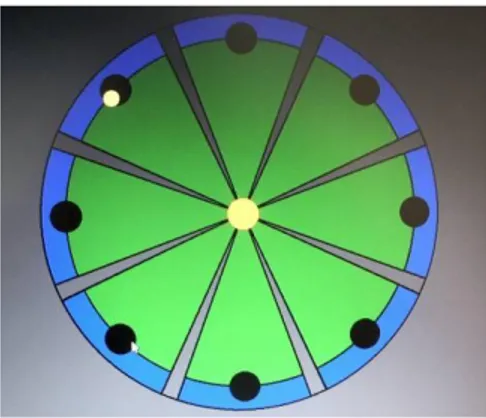
Figura 27. Esercizio “clock-like”.
Nelle successive due settimane i soggetti svolgono gli esercizi seguendo uno scenario innovativo, “fan-like therapy” che consiste di un target centrale e sette periferici, disposti sulla superficie di un ventaglio.
Questo scenario è stato implementato per ridurre la stimolazione della sinergia flessoria evitando un rinforzamento dei muscoli bicipiti e pettorali. Allo scopo di ridurre l’attività dei muscoli flessori e aumentare l’estensione del braccio sono stati modificati la direzione e la lunghezza dei movimenti. In confronto allo scenario della clock-like therapy, il range di movimento (ROM) del gomito è stato ridotto.
Figura 28 .Esercizio “fan-like”
Entrambe le terapie robotiche sono composte da due tipologie di esercizi: movimenti non-assistiti (Record) e movimenti non-assistiti (Adaptive) dal robot. In dettaglio:
- Record: una serie di 16 ripetizioni non assistite dal robot di tipo clock therapy e 14 ripetizioni non assistite di tipo fan-therapy. L’obiettivo degli esercizi è muoversi verso ognuno dei target rossi mostrati sul monitor di fronte al paziente. Se il paziente è in grado di svolgere il compito allora il robot incita il soggetto a muoversi verso il target successivo. Nel caso in cui il paziente non è in grado di raggiungere il target, il terapista ferma il dispositivo e muove l’arto del paziente passivamente alla posizione iniziale successiva.
- Adaptive : una serie di 320 ripetizioni assistite (clock-like) e 280 ripetizioni assistite (fan-like) per ogni target. Il robot pre-posiziona l’arto del soggetto al target centrale quando il programma è attivato. Basato sulle performance dei pazienti, il programma aumenta o diminuisce l’assistenza necessaria per raggiungere i target.
Ogni sessione in entrambi i trattamenti è composta da:
- una serie di ripetizioni assistite ad ognuno dei target del robot (training test); - una serie di ripetizioni non assistite ad ognuno dei target dei robot (Record); - tre serie di ripetizioni non assistite (Adaptive).
Alla fine di ogni serie Adaptive, al paziente è chiesto di effettuare una serie di 16 movimenti non assistiti (Record).
Ad ogni serie Adaptive seguono cinque serie di ripetizioni ed il display visivo provvede ad assegnare al paziente un punteggio per la performance. I cinque indicatori di performance (illustrati in figura 39) sono specificati come segue:
- Movimento iniziato: questa misura indica la percentuale di tempo necessaria perchè il paziente sia abile ad iniziare il movimento senza assistenza del robot. Un punteggio del 100% indica che il paziente è in grado di dare inizio al movimento in maniera indipendente.
- Distanza massima lungo gli assi: questo indicatore indica la percentuale di tempo in cui il paziente è in grado di raggiungere il centro del target. Questa misura non indica il livello di assistenza del robot, piuttosto la frequenza con cui il target è colpito. Un punteggio del 100% indica che il paziente raggiunge tutti i target della serie.
- Potenza attiva: si riferisce allo sforzo percentuale per ogni movimento per raggiungere il target desiderato. Un punteggio del 100% indica che il paziente esercita sforzi attivi su ogni serie di target.
- Minima deviazione di jerk: questa misura indica la smoothness relativa di ogni movimento come funzione del jerk o di una brusca accelerazione o decelerazione. Un punteggio del 100% indica che il paziente ha completato ogni movimento distinto senza alcuna perturbazione. I soggetti spesso migliorano questo punteggio rallentando i propri movimenti.
- Distanza lungo la linea retta: misura la relativa accuratezza dei movimenti nel raggiungimento dei target desiderati. Un punteggio del 100% indica che il paziente ha completato ogni movimento accuratamente senza assistenza per minimizzare deviazione di traiettoria.
Figura 29. Indicatori di performance (biofeedback)
La terapia robotica è stata accettata con soddisfazione dai pazienti: essi eseguono un maggior numero di movimenti rispetto alla terapia tradizionale con risultati migliori, e sono coinvolti emotivamente grazie ai giochi, rendendosi maggiormente conto dei progressi. La tabella sottostante mostra il grado di soddisfazione verso il sistema MIT-Manus: il robot viene visto come un valido strumento che si affianca al terapista ma naturalmente non lo sostituisce.
Figura 30. Esiti del questionario sul gradimento della terapia robotica mediante il sistema robotico MIT-Manus.
1. 3 Sperimentazioni cliniche con il robot MIT-Manus.
In letteratura si trovano molte sperimentazioni cliniche, a partire dal 1998, utilizzando il robot modulare MIT-Manus, portate avanti soprattutto dagli ideatori e realizzatori del robot, Hermano Igo Krebs e Neville Hogan e dai loro collaboratori.
Dopo dieci anni di sperimentazioni si può affermare che il robot MIT-Manus è un robot sicuro ed efficace per la terapia dei pazienti che hanno subito ictus, che gli esercizi che esso propone sottoforma di giochi favoriscono il recupero motorio e permettono di studiare e comprendere i meccanismi coi quali esso avviene. Il sistema robotico MIT-Manus è accettato volentieri dai pazienti che praticano una terapia più coinvolgente ed accattivante, tanto da diffondersi in tutto il mondo, arrivando anche in Italia nel 2005.
Di seguito sono descritti i principali studi condotti utilizzando il robot MIT-Manus.
Nel 1998 Krebs, Hogan, Aisen e Volpe pubblicarono i risultati di uno studio per dimostrare la composizione del movimento utilizzando i dati forniti dal robot [26].
Già Woodworth nel 1899 sosteneva che il movimento dell’arto è composto da una sequenza di submovimenti. In particolare Woodworth era convinto che ci fossero due tipi di componenti dei submovimenti: l’impulso iniziale e il controllo. Il controllo era costituito da una sequenza di aggiustamenti fini che si aggiungevano all’impulso iniziale; Woodworth pensava che per eliminare il controllo fosse sufficiente chiudere gli occhi. Successivamente altri ricercatori portarono alcune varianti a questa tesi: Crossman e Goodeve consideravano i
submovimenti periodici con profili di spostamenti rappresentabili con la funzione errore. Marasso e Mussa-Ivaldi utilizzarono la funzione B-Spline per rappresentare i submovimenti.
Parteciparono alla sperimentazione venti pazienti del Burke Rehabilitation Hospital che avessero subito un unico ictus con paresi dovuto a cause vascolari nell’area motoria corticale e subcorticale. Venne utilizzato il modulo lineare a due gradi di libertà. I pazienti furono divisi in due gruppi di 10 persone: il gruppo della terapia robotica e della terapia tradizionale. Entrambi i gruppi ricevettero la terapia convenzionale: il gruppo della terapia robotica ricevette un’addizionale terapia con il robot per 4-5 ore a settimana., mentre il gruppo tradizionale ricevette una sola ora di trattamento con il robot a settimana. La terapia del gruppo tradizionale fu equivalente a quella del gruppo della terapia robotica eccetto per la sola ora di terapia robotica in più di quest’ultimo. Se il paziente non fosse stato in grado di portare a termine il task, poteva usare l’arto sano o l’aiuto del terapista per completare l’esercizio. Venne compiuta l’analisi cinematica delle traiettorie eseguite dai pazienti.
I dati ottenuti mostrano un repertorio di primitive nei submovimenti, ognuno con un caratteristico profilo di velocità, che rappresenterebbero i blocchi costitutivi dei movimenti complessi. I submovimenti furono evidenti in una serie di cerchi disegnati da individui sani.
L’esercizio consisteva nel disegnare cerchi dal diametro di circa 0.25 m a velocità costante. Dopo aver disegnato quattro cerchi, il paziente doveva ridisegnare il cerchio velocemente.
La figura centrale mostra il diagramma polare dove il raggio è proporzionale alla velocità, graficata rispetto all’angolo di spostamento. Il profilo di velocità è normalizzato alla massima velocità del set e sono mostrate le regioni iniziali di accelerazione e finali di decelerazione.
Il grafico mostra una traiettoria consistente e il profilo di velocità suggerisce che il movimento è composto da un piccolo numero di submovimenti. Questo tipo di quantizzazione è una caratteristica del comportamento umano e venne utilizzata per sviluppare una nuova procedura di terapia col robot.
Fu realizzato anche un modello matematico per descrivere il movimento come composizione di submovimenti e successivamente Viviani e Terzuolo trovarono la correlazione tra la velocità e il raggio di curvatura dei movimenti umani: ad un picco nella curvatura corrisponde una depressione nel grafico della velocità. La curvatura venne sfruttata per determinare visivamente dal grafico della velocità il massimo numero di submovimenti che compongono il movimento.
Nei risultati clinici il 30% dei pazienti lamentarono dolori alle articolazioni del polso, gomito e spalla, senza differenza tra quelli che praticarono una terapia tradizionale e quelli che praticarono terapia robotica, i quali si mostrarono soddisfatti del nuovo tipo di terapia. Inoltre il gruppo sperimentale mostrò un miglioramento maggiore e più veloce rispetto al gruppo di controllo: come mostra la tabella, ci fu un miglioramento soprattutto nella scala di valutazione Fugl-Meyer, nel Motor Power Score e nel Motor Status Score per quanto riguarda la spalla e il gomito:
Il gruppo di controllo non migliorò dopo sei settimane dalla comparsa dell’ictus, mentre sette pazienti nel gruppo sperimentale continuarono a migliorare anche dopo otto settimane dall’ictus. Si vide inoltre che il gruppo di controllo e quello sperimentale ebbero lo stesso progresso nella FIM durante il tempo del ricovero in ospedale (forse perché entrambi i gruppi nella terapia standard svilupparono tecniche di adattamento e compensazione funzionale).
Analizzando i grafici delle traiettorie e delle velocità si nota un’ evoluzione nel controllo del movimento: nella prima settimana la traiettoria non era precisa, come dimostrano i vari cambi di direzione corrispondenti a variazioni frequenti e sconnesse di velocità; ad undici settimane il grafico circolare suggerisce una connettività. Il tempo in cui il compito venne eseguito diminuì col progredire della terapia.
Figura 32. Grafici delle traiettorie e velocità durante le settimane di terapia.
Il sistema MIT-Manus dimostrò di non avere effetti negativi sul paziente, di essere ben tollerato, di essere un valido strumento per la riabilitazione motoria e per studiare i meccanismi neurologici di recupero motorio.
Nel 1999 Krebs, Hogan, Volpe, Aisen, Edelstein e Diels presentarono i risultati di un trial clinico durato tre anni, a partire dal 1995, per indagare gli effetti della terapia robotica a lungo termine [29]. I pazienti furono trattati durante i tre anni dalla stessa equipe clinica; furono
divisi in due gruppi di dieci persone ciascuno: uno fu sottoposto alla terapia robotica e l’altro ad una terapia robotica fittizia, ricevendo contemporaneamente entrambi la terapia tradizionale.
Il gruppo della terapia robotica fu sottoposto a 4-5 ore addizionali a settimana di trattamento col sistema MIT-Manus, l’altro gruppo ricevette solamente un’ora in più di trattamento con il robot che si affiancò alla terapia tradizionale.
Dodici pazienti furono richiamati e valutati dopo tre anni; dei rimanenti otto, quattro non furono rintracciati, uno morì e tre ebbero o un secondo ictus o altre complicazioni cliniche. Non ci fu un controllo per le attività svolte dai pazienti all’esterno dell’ospedale. I pazienti furono sottoposti alla tradizionale valutazione mediante le scale di valutazione Fugl-Meyer (F-M), Motor Power (MP) per la spalla ed il gomito e la Motor Status Score per la spalla, il gomito (MS1) e per il polso e le dita (MP2).
Le tabelle sottostanti mostrano i punteggi nelle scale di valutazione: la prima mostra i punteggi iniziali relativi ai venti pazienti esaminati alla loro ammissione alla terapia e nella dimissione dall’ospedale; la seconda mostra i punteggi relativi ai dodici pazienti che furono riesaminati a distanza di tre anni.
Tabella 4. Punteggi dei pazienti partecipanti allo studio nelle scale di valutazione al primo ricovero (sopra) e (sotto) dopo tre anni dalla dimissione dall’ospedale. RT indica il gruppo sperimentale della terapia robotica, ST
il gruppo di controllo che ricevette la terapia tradizionale. Δ1 indica il momento di ammissione in ospedale, Δ2 il momento della dimissione dall’ospedale e Δ3 il momento di ammissione al follow up.
I dati sono da interpretare con cautela perchè il numero di pazienti che parteciparono al trial è ridotto. Comunque il gruppo di pazienti che fecero terapia robotica durante la fase acuta della riabilitazione, migliorarono maggiormente dopo la dimissione dall’ospedale rispetto al
gruppo di controllo. Il miglioramento riguardò soprattutto i gruppi muscolari più utilizzati nel trattamento riabilitativo, cioè la spalla e il gomito. Si può notare come i punteggi della scala di valutazione MS1 per la spalla e il gomito dei pazienti della terapia robotica sia il doppio rispetto ai punteggi dei pazienti sottoposti a terapia tradizionale. Inoltre entrambi i gruppi mostrarono miglioramenti dalla dimissione dall’ospedale al richiamo nei tre anni successivi: otto pazienti su dodici continuarono a migliorare sostanzialmente nel periodo successivo alla dimissione.
Questo risultato modificò la teoria fino a quel momento sostenuta che il recupero motorio fosse possibile solo entro le undici settimane dopo l’ictus. I risultati suggeriscono che c’è l’opportunità di recupero motorio continuando la terapia anche dopo la fase acuta.
Nello stesso studio si cercò di indagare i meccanismi del recupero neurologico, cercando una diversificazione nei vari tipi di ictus. Si utilizzò la tomografia computerizzata (CT) come tecnologia di imaging che permettesse di classificare gli ictus in base alla locazione della lesione.
Dei dodici pazienti richiamati, sei mostrarono lesioni esclusivamente subcorticali e sei lesioni subcorticali e corticali: cinque pazienti ebbero lesioni al corpo striato (CS) più piccole (13.3±3.9 cm3) e sei al corpo striato e alla corteccia (CS+) (dimensione 95.1±25.2 cm3, p<0.05). Anche se le lesioni esclusivamente subcorticali sono ridotte come dimensione, studi suggeriscono che i pazienti con ictus confinato ai gangli basali hanno minor risposta al trattamento riabilitativo rispetto al gruppo con lesioni maggiori; le lesioni isolate nei gangli basali causano persistenti interazioni corticotalamiche che causano disfunzioni e impediscono il recupero. Gli studi effettuati furono in accordo con questa teoria, come si può vedere dai grafici.
Il gruppo CS+ ottenne risultati migliori durante il primo periodo riabilitativo, anche se il gruppo CS si dimostrò migliore nel periodo dopo il ricovero e la successiva chiamata. Questi risultati sono in accordo con la teoria di Saji (1997) che sostiene che l’ictus è seguito dalla degenerazione transneurale nei gangli basali, e una volta che la degenerazione è completata comincia il periodo di recupero. Il recupero motorio durante la riabilitazione nella fase immediatamente successiva all’ictus non è completo e per comprenderlo è necessario compiere studi trasversali nel tempo.
Andando ad analizzare le traiettorie effettuate nel movimento di reaching si ottengono ulteriori informazioni.
Figura 33. Risultati della valutazione funzionale per i pazienti sottoposti allo studio. Δ1 indica il momento di ammissione all’ospedale, Δ2 indica il momento di dimissione dall’ospedale,
Δ3 india il momento di ammissione al follow up.
I pazienti del gruppo CS mostrarono una traiettoria precisa eseguita in modo lento, mentre i pazienti del gruppo CS+ effettuarono un movimento più veloce ma meno preciso, in accordo con la teoria che l’attività di un gruppo di neuroni motocorticali è collegata alla direzione di reaching. Inoltre il gruppo CS dimostrò maggiori difficoltà nel compiere esercizi velocemente, mentre il gruppo CS+ mostrò più difficoltà nell’eseguire correttamente le traiettorie.
Il sistema MIT-Manus si dimostrò ancora una volta un valido strumento riabilitativo per la terapia e per studiare il riapprendimento motorio a livello neurale evidenziando come i movimenti eseguiti con l’arto paretico influenzino il recupero motorio. I miglioramenti si possono vedere anche dopo tre anni dal ricovero, il processo di recupero neurale continua anche dopo i tre mesi successivi all’ictus e il recupero neuro-motorio dipende dalla localizzazione della lesione a livello cerebrale.
Figura 34. Traiettorie eseguite durante la terapia dai diversi gruppi e andamento della velocità nel tempo.
Nel 2002 Rohrer, Fasoli, Krebs pubblicarono uno studio, utilizzando il robot MIT-Manus, che indagasse i cambiamenti della fluidità (smoothness) del movimento durante la terapia riabilitativa, cercando di individuare i parametri che permettessero di riconoscere e quantificare la smoothness, parametri utili per una valutazione funzionale quantitativa del paziente [30].
La smoothness è una caratteristica della coordinazione dei movimenti umani: i pazienti che hanno subito un danno neurologico per eseguire un movimento compiono tanti piccoli movimenti a scatti e solo a poco a poco, con il trattamento riabilitativo, recuperano la fluidità del movimento. Si vide che la smoothness si basa sulla minimizzazione del jerk, la derivata terza della posizione nel tempo; ulteriori considerazioni furono possibili studiando lo snap, la quarta derivata nel tempo della posizione, e contando i picchi della velocità. L’interpretazione della smoothness come minimizzazione del jerk permise di identificare la sindrome di Huntington negli individui presintomatici.
Lo studio fu eseguito su 31 soggetti tra i 19 e 78 anni (dieci donne e ventuno uomini) allo Spaulding Rehabilitation Hospital (Boston, MA). Dodici pazienti erano nella fase acuta di
recupero perché avevano subito un ictus da meno di un mese, mentre 19 erano nella fase cronica trovandosi tra i 12 e 53 mesi dopo l’ictus.
Il sistema MIT-Manus fu utilizzato come strumento di misura di posizione, velocità e forza: in maniera passiva permetteva al paziente di eseguire movimenti di reaching planare utilizzando l’esrcizio “Clock-like”.
I pazienti furono divisi in due gruppi: gli “inpatient”, costituito da 12 elementi, ricevettero la terapia robotica cinque volte alla settimana per quattro settimane, il gruppo degli “outpatient”, costituito da 19 soggetti, tre volte alla settimana per sei settimane.
I pazienti vennero valutati con la scala di valutazione Fugl-Meyer all’inizio, a metà e a fine terapia.
I parametri presi in considerazione furono: il jerk, la velocità, il tempo medio di arresto, il numero di picchi nel profilo di velocità e il tent (inteso come il rapporto tra l’area compresa sotto la curva di velocità e la curva stessa).
Figura 35. Differenza tra i valori del primo giorno di terapia e l’ultimo per le diverse grandezze prese in esame.
I cerchi rappresentano una significatività statistica (p<0.05). In molti casi ci sono variazioni nei picchi di velocità, ma senza un andamento costante nella direzione della variazione. La velocità media (distanza totale percorsa sulla durata totale del movimento) tende ad aumentare sia per inpatient che per gli outpatient, con variazioni più significative
negli outpatient. Ugualmente il tempo di durata del movimento tende a diminuire per entrambi i gruppi, con variazioni più significative negli inpatient. La corrispondenza tra le velocità medie e il tempo di durata del movimento è dovuta alla velocità nominale del movimento, che rimane costante. L’esistenza di andamenti precisi della velocità media e della durata indica il possibile utilizzo di queste quantità come misure valutative del ricovero.
Un aumento di valori corrisponde ad un aumento in smoothness .
Alcuni soggetti non mostrano però questi andamenti: sei soggetti non hanno variazioni significative nel tempo di durata del movimento e dieci soggetti non mostrano variazioni nella velocità media.
Tutti i soggetti, a parte uno, mostrano un aumento significativo in uno o più metriche, ventidue soggetti mostrano un aumento in quattro o più metriche. I movimenti dei pazienti di entrambi i gruppi tendono a diventare più fluidi nel corso della terapia. Per tutte le grandezze prese in considerazione per valutare la fluidità di movimento, escluso il tent, c’è una differenza significativa (p<0.0001) tra i due gruppi. Gli inpatient mostrano nella velocità, MAPR, nei picchi, un maggior aumento di fluidità rispetto agli outpatient. Però gli inpatient mostrano una diminuzione di fluidità nella metrica jerk mentre gli outpatient mostrano un aumento.
Figura 36. Andamento nel tempo delle grandezze analizzate.
Anche se c’era una grande differenza d’età tra i pazienti, non si mostrò significativa a livello statistico tra i due gruppi. Per dimostrare che la variazione nella fluidità di movimento è collegata consistentemente alle variazione dei parametri presi in esame, questi stessi furono
messi in correlazione con le variazioni dei punteggi della Fugl-Meyer. La correlazione è evidente in alcuni casi indicando una relazione tra la smoothness e le metriche prese in esame.
Tabella 5. Grado di correlazione tra le grandezze prese in esame e i punteggi nella scala di valutazione Fugl-Meyer
Un basso valore di jerk non è l’unico modo per quantificare la fluidità di movimento. Per esempio un basso snap (la quarta derivata nel tempo della pozione) descrive la cinematica dei movimenti lineari da punto a punto più accuratamente del jerk, anche se la variazione dell’accelerazione fornisce una descrizione fisica di smoothness e offre alcuni vantaggi come la semplicità teorica e la più semplice trattabilità computazionale ed analitica.
La fluidità del movimento è una naturale conseguenza delle proprietà di filtraggio passa-basso del sistema neurale, muscolare e scheletrico; inoltre è il risultato di una coordinazione acquisita con lo sviluppo: i neonati mostrano dei movimenti con maggiori picchi di velocità rispetto ai movimenti degli adulti che hanno sviluppato un controllo del movimento con lo sviluppo. Questo indica che la fluidità del movimento è una caratteristica acquisita con un processo di sviluppo coordinato e non una conseguenza della struttura del sistema neuro-muscolare ed è quindi teoricamente recuperabile anche se si sono subite lesioni a livello del sistema nervoso centrale.
L’esistenza di submovimenti che realizzano un gesto indica una rappresentazione interna discreta dei comandi motori: un sistema di controllo basato su submovimenti discreti richiede un minor trasferimento di informazioni (piccola banda passante) tra il controllore (sistema nervoso centrale) e il sistema che deve essere controllato (sistema muscolo-scheletrico).
La perdita di fluidità nei movimenti di pazienti che hanno subito un ictus può essere recuperata con una terapia che ristabilisca la coordinazione.
Nel 2003 Fasoli, Krebs, Hogan, Stein e Frontera [31] presentarono i risultati di una sperimentazione clinica per dimostrare che la terapia robotica utilizzando il sistema MIT-Manus riduce la perdita di abilità motoria e favorisce il recupero dell’arto paretico nell’ictus cronico.
Vennero sottoposti alla sperimentazione venti pazienti (16 uomini e 4 donne) di età compresa tra 19 e 77 anni, che avessero subito un solo ictus unilaterale fino a cinque anni prima: 14 soggetti con un ictus nell’emisfero destro, 6 in quello sinistro. La terapia si svolse
tre volte a settimana per sei settimane. I pazienti furono sottoposti precedentemente ad una valutazione mediante la Modified Ashworth Scale, la Fugl-Meyer, MRC e la Motor Status Score. Furono utilizzate due diverse modalità di terapia utilizzando il sistema MIT-Manus, in base alle abilità residue dell’arto del paziente. I pazienti che inizialmente non fossero stati in grado di muovere l’handle del robot da soli furono assegnati alla terapia sensomotoria. In questa terapia, il robot fornì assistenza attiva e guidò il braccio del paziente permettendogli di eseguire il movimento per raggiungere il target. I pazienti che invece furono in grado di raggiungere il target senza l’assistenza del robot furono assegnati al gruppo di terapia progressiva-resistiva. I pazienti che fecero parte di questo gruppo eseguirono gli stessi esercizi di reaching planare della terapia senso-motoria con il robot che generava una forza opposta per perturbare la traiettoria, in modo che i pazienti eseguissero un controllo attivo del movimento (campo divergente). L’intensità della forza generata dal robot fu determinata da un algoritmo adattativo che utilizzava le misure della forza muscolare del paziente ottenute alla fine di ogni sessione di terapia per determinare la forza generata dal robot nella sessione successiva.
I risultati mostrano come la terapia robotica contribuisca a diminuire la disabilità motoria: nessun paziente accusò dolore durante il trattamento, inoltre i pazienti furono soddisfatti nel veder muovere l’arto paretico. I risultati mostrano anche un sostanziale miglioramento nei movimenti del polso e della mano nei pazienti appartenenti al gruppo della terapia progressiva-resistiva, risultato non visibile invece nei pazienti della terapia senso-motoria.
La tabella 6 mostra i punteggi ottenuti con le scale di valutazione durante il periodo della terapia, con la significatività statistica e l’indice di correlazione.
Lo studio permise agli autori di formulare alcune considerazioni: la terapia motoria robotica si mostrò efficace nel ridurre la disabilità motoria in pazienti colpiti da ictus permettendo l’esecuzione di movimenti ripetitivi e dimostrando come il processo di recupero motorio sia molto simile al processo di apprendimento motorio, la scelta di includere nella terapia pazienti che subirono un ictus da uno a cinque anni precedentemente alla terapia evidenziò che si può effettuare terapia motoria anche nella fase cronica dell’ictus con buoni e continui risultati, indicando che il riapprendimento motorio non si verifica solo nella fase acuta della malattia. I risultati mostrarono che la terapia ha effetti sui gruppi muscolari in modo non specifico, effetti che si possono riscontrare in maniera evidente solo nei pazienti della terapia progressiva-resistiva. In questi pazienti la terapia permise un maggiore reclutamento delle unità motorie e contribuì ad aumentare la frequenza di attivazione e la sincronizzazione delle moto-unità, aumentando il controllo del movimento.
L’anno successivo lo stesso gruppo presentò la continuazione dello studio precedente, per valutare gli effetti della terapia nei quattro mesi successivi [32].
Il gruppo di persone prese in esame era composto da 42 pazienti (28 uomini e 14 donne) di età compresa tra i 19 e i 77 anni, che avessero subito un ictus unilaterale nei precedenti cinque anni.
Come negli studi precedenti, i pazienti furono sottoposti a valutazione funzionale prima di iniziare la terapia mediante le tradizionali scale di valutazione: la Modified Ashworth Scale, la FMA, la MRC, la MSS e la Linkert per valutare il dolore.
Per la terapia fu utilizzato il modulo planare InMotion2: i pazienti ricevettero un’ ora di terapia robotica tre volte a settimana per sei settimane, effettuando circa 18000 movimenti ripetitivi di reaching nel corso della terapia. I pazienti furono, come in precedenza, suddivisi in due gruppi: uno sottoposto a terapia senso-motoria e l’altro alla progressiva-resistiva. Le valutazioni del follow-up mostrarono una diminuzione della disabilità motoria dovuta alla terapia fino ai quattro mesi successivi alla fine della terapia, e i pazienti presentavano meno dolore alla spalla. Come mostra la tabella, miglioramenti significativi sono indicati dalla FMA, dalla MSS per la spalla e il gomito.
I risultati supportano l’ipotesi che si può avere recupero motorio anche dopo un anno dall’ictus, anche se i maggiori risultati si ottengono durante il primo mese di terapia, e fu ancora una volta confermato che il sistema robotico MIT-Manus è un valido strumento per la riabilitazione e la valutazione funzionale.
Tabella 7. Risultati delle valutazioni sui pazienti sottoposti a terapia.
Nello stesso anno fu presentato dal gruppo di Krebs uno studio dove venne indagata l’influenza della terapia motoria nel recupero cerebrale, effettuando una terapia non più costituita solamente da movimenti di reaching ma utilizzando il modulo InMotion3 che permette movimenti nello spazio [27].
Durante le prime sei settimane i pazienti utilizzarono il modulo planare per la terapia, seguito da sei settimane con il modulo InMotion3 che permette di effettuare movimenti sul piano verticale contro la forza di gravità. Il protocollo fu costituito da dodici settimane di terapia effettuata tre volte alla settimana per un’ora. Nella terapia planare il centro del workspace fu localizzato di fronte al paziente sulla linea mediana del corpo con un’elevazione della spalla di 30°. I movimenti di reaching partivano dal centro del workspace e si estendevano lungo otto direzioni.
La terapia col modulo InMotion3 comprese dei movimenti di reaching lungo due linee verticali, nel range di abduzione di 45°-65° e di 30°-90° di elevazione e flessione della spalla, un range considerato sicuro.
Il protocollo inoltre prevedeva anche un nuovo algoritmo adattativo che incoraggiasse i pazienti ad iniziare i movimenti con il braccio paretico.
La tabella 8 mostra i risultati ottenuti dai pazienti:
Tabella 8. Risultati delle scale di valutazione ottenuti nello studio.
I risultati mostrano come il modulo InMotion3 sia sicuro e ben accettato dai pazienti, che non presentarono effetti negativi (come il dolore alla spalla). Inoltre si ottenne un ulteriore miglioramento nella mobilità della spalla e del gomito. Nei pazienti infatti si nota una riduzione della disabilità nei movimenti verticali congruente con quella che si ottenne nei movimenti planari (5,2 % per l’esercizio verticale e 5,0 % per l’esercizio planare secondo la Fugl-Meyer). I valori della scala di Ashworth indicano che non si verificò un aumento nel tono muscolare o della spasticità durante il corso della terapia.
Nel 2005 lo stesso gruppo di Krebs pubblicò i risultati di uno studio utilizzando il MIT-Manus per la messa a punto di una terapia “ottima” cercando di comprendere come il ripristino di alcune abilità motorie avesse influenze funzionali su altri livelli e capacità, come cioè la terapia motoria andasse a modificare le abilità ad un livello alto [33].
Per la terapia si utilizzò il modulo del polso in aggiunta al modulo planare. Il robot, se necessario, fornì assistenza ai pazienti nella fase di reaching. La difficoltà fu graduata per permettere ai pazienti di completare il task senza l’aiuto del terapista.
Prima della terapia i partecipanti furono valutati tramite la scala di valutazione Fugl-Meyer.
Allo studio parteciparono 24 soggetti, suddivisi in due gruppi: il gruppo A sostenne 18 sessioni di terapia robotica senso-motoria (un’ora tre volte a settimana per sei settimane) consistente in tre serie di 20 ripetizioni di movimenti planari di reaching, il gruppo B sostenne sempre 18 sessioni con la stessa modalità ma di terapia free-hand con il terapista. Alla fine il numero di movimenti effettuati dai pazienti del gruppo B fu stimato la metà di quelli eseguiti dai pazienti del gruppo A.
Il guadagno statistico dall’ammissione alla dimissione fu evidente in entrambi i gruppi, ma i miglioramenti del gruppo B furono quantificati la metà (con la scala Fugl-Meyer) rispetto a quelli ottenuti dai pazienti sottoposti a terapia robotica, come mostra la tabella 10 tratta da quello studio.
Tabella 9. Risultati ottenuti nella valutazione dei pazienti sottoposti allo studio.
Questo risultato evidenzia una relazione tra il numero di ripetizioni di un esercizio e il ripristino delle abilità: più ripetizioni vengono effettuate e maggiore è l’ effetto della terapia: in questo la terapia robotica permette dei risultati superiori alla terapia tradizionale perché permette di effettuare un numero di ripetizioni maggiori rispetto a quelle che può effettuare un terapista. I due gruppi inoltre eseguirono movimenti di tipo diverso: i pazienti della terapia senso-motoria effettuarono solo movimenti di reaching, mentre quelli della terapia free-hand eseguirono movimenti di reaching e movimenti più complessi di manipolazione di oggetti, introducendo elementi percettivi alla semplice attività motoria. Dallo studio sembra che i soggetti che abbiano subito gravi compromissioni beneficino maggiormente di esercizi che mirino al ripristino di abilità motorie principali prima di funzionalità più complesse. Questo perché la terapia si deve focalizzare sul ripristino di circuiti motoneurali senza introdurre ulteriori processi percettivi o funzionali che possano interferire col riapprendimento.
Parallelamente alla terapia convenzionale con valutazione tramite l’elaborazione di grandezze cinematiche misurate dal robot, si è sviluppato un innovativo metodo di valutazione tramite l’integrazione delle variabili cinematiche con altre informazioni, come i segnali biomedici (EMG, EEG…) ottenuti dai pazienti durante lo svolgimento degli esercizi.
L’utilizzo dei segnali biomedici ha lo scopo di verificare gli effetti della terapia direttamente sui gruppi muscolari (EMG) o sull’attività nervosa cerebrale (EEG): nuove misure, come il tempo di attivazione muscolare e l’ampiezza dei segnali vengono integrate alle informazioni di posizione, velocità e forza effettuate dal robot per meglio comprendere l’efficacia della terapia e il riapprendimento motorio.
Inoltre le nuove informazioni possono essere impiegate per individuare l’intenzione del movimento da parte di quei pazienti che hanno subito gravi danni e non sono in grado di effettuare la terapia senza l’aiuto del terapista o del robot, e quindi integrate al sistema di controllo del robot, possono permettere nuove tipologie di terapia.
L’utilizzo del segnale EMG presenta alcuni vantaggi: permette di personalizzare la terapia robotica selezionando dei particolari gruppi muscolari per guidare il robot, è uno strumento per verificare l’effettiva presenza di attività che genera movimento durante la terapia robotica, permette di guidare il robot più semplicemente rispetto all’analisi cinematica, permette ai soggetti che hanno subito gravi compromissioni di attivare l’assistenza del robot in quanto viene percepita l’intenzione del movimento, infine fornisce dati critici per comprendere il processo di recupero dall’ictus e ulteriori misure valutative del ricovero del paziente. Si effettua un utilizzo innovativo del segnale EMG: nella terapia motoria robotica infatti l’EMG veniva già utilizzato, ma solo per verificare il cambiamento dell’attivazione muscolare prima e dopo il trattamento e per confermare l’attività o l’inattività muscolare durante il trattamento riabilitativo. Un utilizzo ancor più innovativo è la stimolazione neuromuscolare guidata dal segnale EMG, che consiste nel riapprendimento motorio con il controllo volontario del movimento: il segnale elettromiografico viene registrato da alcuni muscoli, come ad esempio i flessori del polso e delle dita, e quando superano una certa soglia, un sistema di stimolazione neuromuscolare assiste il soggetto nel compiere il movimento che intende fare.
Nel 2003 fu presentato un interessante lavoro che presentava l’utilizzo innovativo di quantità come velocità, tempo e segnale EMG con metodo a soglia, integrate nel controllo di impedenza del MIT-Manus per attivare l’assistenza del robot [34]. L’innovazione consisteva nell’includere uno specifico feedback collegato al movimento e la specificazione di alcuni parametri di controllo in un algoritmo progressivo.
Il controllo di impedenza del MIT-Manus è equivalente ad un sistema molla-smorzatore che guida l’arto del paziente con movimenti di durata costante minimizzando il jerk da una posizione iniziale ad una finale. L’effetto della molla sull’energia potenziale è quello di limitare le deviazioni lungo l’asse y (asse verso il quale ci si sta muovendo per raggiungere l’obiettivo) e lungo l’asse x (normale alla direzione del moto).
Il nuovo controllo di impedenza mette il paziente in grado di raggiungere il target senza assistenza perché riduce a zero la forza di resistenza verso il target: l’algoritmo precedente impediva soltanto al paziente di uscire dalla traiettoria desiderata.
I grafici sottostanti mostrano il campo di energia potenziale con il primo controllo e col secondo tipo di controllo.
Figura 38. Andamento dell’energia potenziale con l’algoritmo di controllo tradizionale (a sinistra) e con il nuovo algoritmo di controllo implementato (a destra).
Durante la terapia il tempo impiegato dai pazienti per effettuare il movimento e la rigidità della molla variano da paziente a paziente e in base alla performance del paziente stesso. Viene utilizzato quindi un algoritmo progressivo relativo alla performance, in modo da effettuare un controllo soggettivo per ogni performance, per ogni paziente.
Il paziente inoltre viene aggiornato sulla qualità della sua performance da una barra colorata posta sul monitor del gioco.
Vennero eseguite quattro tipologie di misure: l’abilità del paziente nell’iniziare il movimento (PM1), l’abilità nello spostamento dalla posizione iniziale alla posizione del target (PM2), lo spostamento della posizione dall’asse del target (PM3) e la capacità nel raggiungere il target (PM4).
La misura PM1 registrava quante volte il paziente iniziava il gioco muovendo il braccio con un’attivazione del segnale elettromiografico sopra una certa soglia. La misura PM2 era utilizzata per ricavare la durata del movimento, PM3 per correggere la stiffness nel sistema di controllo e PM4 registrava la distanza massima che il paziente raggiungeva lungo l’asse del target. Per quanto riguarda la misura PM1, furono utilizzati tre metodi per determinare l’istante di inizio del movimento; se il paziente non fosse stato in grado di attivare nessuno dei tre modi per iniziare il movimento, il gioco iniziava da solo dopo 2 secondi. Il primo metodo prevedeva che il paziente muovesse il braccio al di sopra di una modesta soglia di velocità, metodo utilizzato per tutti i pazienti indipendentemente dal loro livello di disabilità. Questo sistema permise ai pazienti di impegnarsi ad iniziare il movimento e di non aspettare passivamente che il robot li guidasse. L’istante iniziale del movimento è utilizzato per
ricavare il tempo di esecuzione del movimento, dato fondamentale da inserire nell’equazione di controllo. La soglia di velocità viene definita come il 10% del valore di velocità massima calcolata minimizzando il jerk. Il secondo metodo consisteva nel processare i segnali EMG utilizzando il sistema Bagnoli della Delsys. Si registrano le attività elettromiografiche di 14 muscoli della spalla e del braccio durante movimenti di reaching in soggetti normali e soggetti con ictus. Durante il movimento almeno uno di questi quattro muscoli si attiva: il grande pettorale, il deltoide, il bicipite e il tricipite. Il gioco iniziava quando almeno uno dei segnali elettromiografici relativi a questi muscoli raggiungesse un’ampiezza superiore ad una soglia. Il terzo metodo fu molto simile al secondo, ma per ogni direzione del movimento il gioco iniziò solo dopo che si fosse verificato un aumento nell’attivazione dell’ EMG in un particolare muscolo. Il muscolo era considerato attivo quando la sua attività di base aumentava di tre deviazioni standard per almeno 30 ms. I segnali vennero processati con un filtro passa basso (filtro di Butterworth di secondo ordine a 10 Hz), raddrizzati e processati con un filtro passa basso (a media mobile 60 msec).
Le misure PM2 e PM3 valutano la performance del paziente durante ogni gioco che consiste nel muovere il cursore tra otto target posti in circolo.
Figura 39. Traiettorie eseguite nella terapia e rappresentazioni dei segnali EMG dei quattro muscoli presi in esame.