CAPITOLO
2:
METODI
DI
SEPARAZIONE
DELL’IDROGENO
Il processo di separazione dell’idrogeno da correnti gassose è sempre stato, nell’industria chimica, un processo di interesse: l’idrogeno viene utilizzato per la sintesi di importanti prodotti chimici, come l’ammoniaca ed il metanolo, nonché come reagente negli impianti petrolchimici (processi di hydrotreating e hydrocracking), in cui è sempre più richiesto a causa del deterioramento della qualità delle risorse petrolifere nonché della legislazione sempre più stringente sui livelli di zolfo, aromatici ed azoto nei prodotti petroliferi [10]. Negli ultimi anni, con lo sviluppo e il perfezionamento dei vari processi di produzione e con la sempre maggiore richiesta di idrogeno in applicazioni energetiche, l’interesse per i processi di separazione è cresciuto ulteriormente portando alla scoperta e alla ricerca di nuove tecniche di separazione, quali ad esempio quelle a membrana. I processi utilizzati attualmente per la separazione dell’idrogeno da correnti gassose sono tre:
Separazione criogenica
PSA (pressure swing adsorption)
Separazione attraverso membrane
In Tabella 2.1 si confrontano le tre diverse tecnologie disponibili per la separazione dell’idrogeno.
Tabella 2.1 – Confronto tra le diverse tecnologie per la separazione dell’idrogeno [11]
2.1 Separazione criogenica
La separazione criogenica è una tecnologia affermata per il recupero e la purificazione dell’idrogeno da miscele di idrocarburi. I costi di investimento per l’impianto sono elevati, ma si possono ottenere recuperi multipli di prodotti come paraffine liquide (propano, butano) in raffineria o etilene e propilene in petrolchimica. Il processo è particolarmente adatto per alimentazioni gassose contenenti il 40-80% di idrogeno e che siano disponibili a pressioni sopra i 28 bar.
La separazione criogenica sfrutta la differenza delle temperature di ebollizione dei componenti di una miscela. L’idrogeno, rispetto a tutti gli altri idrocarburi, ha una volatilità relativa molto elevata. Il modo più semplice di effettuare la separazione è il processo di condensazione parziale, in cui le impurezze contenute nell’alimentazione vengono condensate tramite raffreddamento all’interno di scambiatori in alluminio in cui i prodotti vengono invece riscaldati. L’energia richiesta in termini di refrigerazione si ottiene facendo espandere gli idrocarburi liquidi condensati (effetto Joule-Thomson) ed eventualmente con un circuito frigorifero esterno o per turboespansione dell’idrogeno recuperato.
2.2 Pressure swing adsorption
La Pressure Swing Adsorption è stata utilizzata in raffineria e negli impianti chimici a partire dagli anni ’60 [7]: il processo di separazione di miscele gassose attraverso questa tecnica è basato sulla capacità dei sorbenti solidi di adsorbire con una certa selettività una elevata quantità di determinati composti ad alte pressioni parziali piuttosto che a basse pressioni. In Figura 2.1 sono a titolo d’esempio mostrate le isoterme di adsorbimento su carbone attivo di una serie di idrocarburi.
Figura 2.1 - Isoterme di adsorbimento di idrocarburi leggeri [20]
In un ciclo PSA dunque il desorbimento è effettuato a pressioni molto più basse di quelle della fase di adsorbimento. La rigenerazione prevede due processi contemporanei (Figura 2.2): la depressurizzazione e il flussaggio. Se la depressurizzazione ha il compito di abbassare la pressione parziale dell’adsorbato così da permetterne, a livello
termodinamico, il desorbimento, è il gas di lavaggio (o gas di coda, tail gas) che trasporta l’adsorbato stesso fuori dall’unità. Il ciclo è globalmente adiabatico: il calore di adsorbimento rimane nel sorbente ed è utilizzato nella fase di rigenerazione in cui fornisce il calore di desorbimento [20].
Figura 2.2 - Ciclo della PSA [20]
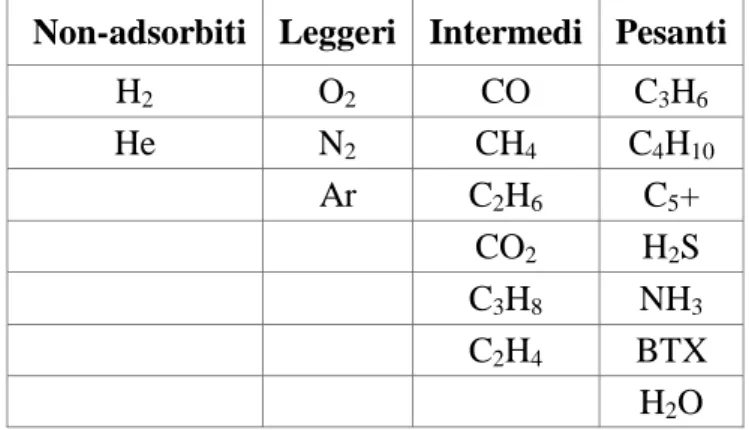
Per quanto riguarda la separazione tramite PSA dell’idrogeno da altri gas, va osservato che l’idrogeno è adsorbito solo in minime quantità e può quindi essere separato facilmente da tutti i componenti tipicamente presenti nel gas di sintesi, che, essendo più pesanti, mostrano affinità molto più elevate (Tabella 2.2)
Tabella 2.2 - Forza di adsorbimento relativa di impurezze tipiche su carbone attivo
Non-adsorbiti Leggeri Intermedi Pesanti
H2 O2 CO C3H6 He N2 CH4 C4H10 Ar C2H6 C5+ CO2 H2S C3H8 NH3 C2H4 BTX H2O
Il processo è di tipo ciclico ed ogni ciclo si sviluppa in quattro fasi, di seguito elencate: 1) introduzione del gas nel letto adsorbente ad alta pressione (30bar);
2) adsorbimento dei gas sul letto adsorbente ed uscita dell’idrogeno puro alla fine del letto;
3) depressurizzazione e flussaggio con tail gas del letto, per rimuovere dall’adsorbente i composti adsorbiti (fase di rigenerazione);
4) ripressurizzazione con parte dell’idrogeno prodotto del letto adsorbente rigenerato, per prepararlo ad un nuovo ciclo di adsorbimento
Le diverse fasi del processo PSA sono mostrate in Figura 2.3. E’necessario utilizzare letti di adsorbimento multipli in parallelo, tutti soggetti allo stesso ciclo ma in tempi diversi, così da rendere il processo globalmente continuo.
Figura 2.3 - Schema di un sistema a 4 letti di PSA.
La forza motrice della separazione è la differenza di pressione parziale delle impurità tra l’alimentazione e il gas di coda: affinché si abbia un buona purezza dell’idrogeno separato il rapporto minimo tra i due valori di pressione deve essere di 4 a 1. Le pressioni assolute dell’alimentazione e del gas di coda sono anch’esse importanti per avere un buon recupero di idrogeno. La pressione di alimentazione ottimale varia tra 15
bar e 30 bar, mentre la pressione del gas di coda deve essere la più bassa possibile. Poiché di solito si cerca di evitare il vuoto, essa è mantenuta leggermente al di sopra della pressione atmosferica. Come gas di coda si utilizza solitamente una piccola percentuale dell’idrogeno prodotto, che viene poi usato come combustibile. Questa tecnologia di purificazione dell’idrogeno, da un sistema iniziale a 4 letti, si è evoluta verso schemi più moderni composti da 8 o 12 unità. L’uso di una serie di valvole di commutazione e di letti, insieme ad un microprocessore di controllo, provvedono al funzionamento in continuo dell’intero processo garantendo in questo modo un’ottima efficienza di separazione. Due fondamentali vantaggi della tecnologia PSA sono la possibilità di rimuovere le impurezze a qualsiasi livello desiderato (fino a ppm) semplicemente cambiando le condizioni operative, e di produrre idrogeno molto puro. La purezza varia tipicamente tra 99% e 99.999%, e il suo impatto sul recupero di idrogeno è modesto. D’altra parte però la quantità di H2 recuperabile è moderata, tra
80% e 92% in condizioni ottimali. L’utilizzo della tecnologia PSA comporta bassi costi di investimento in quanto le tubazioni, le camere di adsorbimento e le valvole commutatrici sono tutte in acciaio al carbonio, ed il materiale adsorbente è costituito o da carboni attivi o da zeoliti.
2.3 Separazione mediante membrane
I processi di separazione dell’idrogeno su membrana sono stati usati in raffineria e in impianti petrolchimici a partire dalla fine degli anni ’70. Negli ultimi 15 anni l’interesse, sia a livello industriale, che a livello di ricerca, è cresciuto notevolmente. L’utilizzo delle membrane presenta i seguenti vantaggi, se confrontato con la tecnologia dominante, cioè la PSA [21]:
in certi casi è possibile ottenere più alti recuperi di idrogeno con un prodotto puro al 100%;
i costi operativi sono inferiori;
l’espansione della capacità dell’impianto è facilmente realizzabile, semplicemente aggiungendo nuovi moduli di membrana.
la pressione di alimentazione alla sezione di separazione è minore rispetto alla PSA: valori tipici per un impianto a membrana sono compresi tra 14 e 50 bar, mentre per la PSA l’intervallo di pressione è 10-125 bar.
Le tecniche di separazione su membrana dell’idrogeno possono risultare quindi già oggi competitive. Un ulteriore non trascurabile vantaggio deriva dalla considerazione che in futuro si renderà sempre più necessario, al fine di limitare le emissioni di gas serra, confinare la CO2 prodotta dal processo di gassificazione di combustibili solidi.
Utilizzando la tecnologia PSA la corrente di anidride carbonica lascia l’unità di separazione a pressione pressoché atmosferica. Nel caso di quasi tutti i processi a membrana, invece, l’idrogeno permea attraverso il materiale, mentre la CO2 lascia
l’impianto in pratica alla pressione di alimentazione, che può arrivare a circa 35 bar. Comprimere la CO2 da 35 a 70 bar (pressione di confinamento) richiede 1/6 dell’energia
necessaria per comprimerla da 1 a 70 bar, con notevoli benefici economici ed ambientali. La separazione di gas attraverso membrana avviene grazie al fatto che il materiale costituente la membrana, è altamente permeabile rispetto ad un solo componente della miscela. Grazie alla specifica velocità di attraversamento tipica di ogni componente, le membrane permettono di separare il flusso di permeato, ricco nelle specie che attraversano più velocemente la membrana ed un flusso, di retentato, contenente i gas residui. Le caratteristiche più importanti delle membrane per la separazione di gas sono [22]:
la permeabilità (mol.m/m2.s.Pa in unità SI), che esprime la capacità di una determinata specie gassosa di attraversare un materiale, e si calcola come flusso molare di gas che permea attraverso la membrana, normalizzato rispetto alla superficie e allo spessore della membrana stessa e alla pressione parziale transmembranale del gas;
la permeanza (mol/m2.s.Pa), caratteristica della membrana più che del materiale, definita come flusso molare di gas normalizzato rispetto alla superficie ed alla
pressione parziale transmembranale; essa è utilizzata in luogo della permeabilità soprattutto nel caso in cui ci sia incertezza sullo spessore della membrana;
la selettività (adimensionale), definita come rapporto tra le permeabilità di due specie gassose, che rappresenta l’efficienza di separazione della membrana;
le condizioni operative, esprimibili come intervallo di temperatura e pressione transmembranale in cui la membrana può operare efficientemente e senza rischio di rottura o deterioramento;
la resistenza chimica alle specie presenti nella corrente di alimentazione, che possono eventualmente agire in modo da deteriorare le prestazioni della membrana, ad esempio ricoprendone irreversibilmente la superficie.
E’ necessario sottolineare il fatto che le prestazioni di questi materiali variano fortemente con la temperatura e quindi una eventuale scelta tra le diverse opzioni deve essere effettuata tenendo conto dell’impianto in cui il modulo di separazione deve essere inserito e della destinazione d’uso dell’idrogeno prodotto. I moduli di separazione a membrana possono avere diverse geometrie, dipendenti dal tipo di applicazione e di materiale da cui sono costituite:
tubolari;
fibre cave (hollow fiber); a spirale (spiral wound); piane (flat sheet o plate frame).
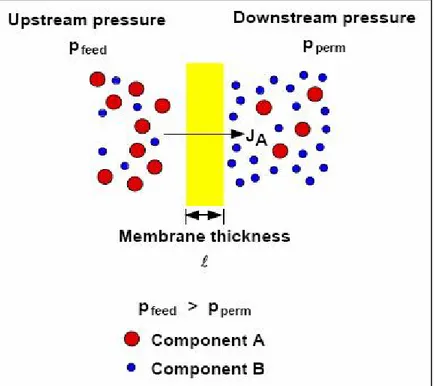
In tutti i tipi di moduli la forza motrice è rappresentata da una differenza di pressione parziale dei diversi gas tra il lato dell’alimentazione e quello del permeato. I gas sono quindi forzati attraverso la membrana: mentre il composto selettivamente più veloce permea all’interno del materiale verso la zona a bassa pressione parziale ed esce come permeato, quello più lento prosegue il suo cammino ed esce praticamente alla stessa pressione di ingresso come retentato. La differenza di pressione parziale può essere indotta o alimentando sul lato del permeato un gas di diluizione (sweep gas), o più frequentemente applicando una differenza di pressione assoluta tra i due lati. Le
membrane utilizzabili per la separazione dell’idrogeno dall’anidride carbonica si possono suddividere in cinque tipologie che differiscono oltre che per il materiale di costruzione anche per i meccanismi di diffusione del gas attraverso la membrana[23] : membrane polimeriche;
membrane metalliche dense; membrane ceramiche microporose; membrane ceramiche dense; membrane composite.
Di queste tipologie, soltanto le prime due (polimeriche e metalliche) sono attualmente disponibili in commercio, mentre le altre sono ancora in fase di sviluppo.
2.3.1 Membrane polimeriche
Le membrane polimeriche sono le uniche attualmente usate su scala industriale per la separazione di gas. Il trasporto di gas attraverso una membrana polimerica densa è solitamente descritto tramite il meccanismo di soluzione-diffusione, mostrato in Figura 2.4. Esso può essere schematizzato in tre fasi [24][25] :
l’adsorbimento della molecola sul lato dell’alimentazione
la diffusione attivata all’interno del polimero per gradiente di pressione parziale il desorbimento della molecola sul lato del permeato
Il passaggio delle molecole è permesso dalla microporosità intrinseca nella struttura dei polimeri, esprimibile con il concetto di volume libero.
Il flusso J per area unitaria [mol/m2s] di una specie gassosa A attraverso una membrana si calcola come:
s p p P J perm A feed A A A con pAfeed e pAperm [Pa] pressione parziale del componente A rispettivamente sul lato
dell’alimentazione e del permeato, s [m] spessore della membrana, PA [mol.m/m2sPa]
permeabilità della membrana rispetto ad A.
Figura 2.4 - Trasporto di gas attraverso membrane polimeriche
La permeabilità di una specie A in un materiale polimerico è un fattore che caratterizza le prestazioni di una membrana e si può esprimere come prodotto di un coefficiente di diffusività e di un coefficiente di solubilità:
A A
A D S
P
La selettività tra due specie risulta quindi:
B A B A B A B A S S D D P P /
Il coefficiente di diffusività dipende essenzialmente dalla dimensione della molecola e diminuisce all’aumentare di questa. Per molti polimeri esso si può mettere ad esempio in relazione con il volume critico della specie gassosa. Il coefficiente di solubilità è invece più elevato per molecole facilmente condensabili e si può considerare proporzionale alla temperatura critica [25]. La diffusività e la solubilità di alcuni gas in due tipi di membrane sono mostrate in Figura 2.5.
.
La
Figura 2.5 - Solubilità e diffusività di vari gas nei polimeri Polisulfone (PSF) e Polidimetilsilosano (PDMS) [26]
La maggior parte delle membrane polimeriche in commercio sfrutta la selettività diffusionale e lascia quindi permeare molecole di dimensioni inferiori bloccando quelle più grandi. Esse sono capaci di separare efficacemente l’idrogeno da gas come CO, CH4, N2, H2S, C2-C5, Ar e vengono quindi largamente utilizzate per il recupero di
(a) (b)
metanolo, nonché per l’aggiustamento del rapporto H2/CO del gas di sintesi. Queste
membrane, costituite da polimeri come poliimmide (PI), polisulfone (PS), acetato di cellulosa (CA) e commercializzate da diverse ditte, tra cui Air Liquide, Air Products, UOP e UBE, sono difficilmente utilizzabili per la separazione di idrogeno dall’anidride carbonica: la selettività risulta infatti molto bassa (2-3), a causa dell’elevata solubilità della CO2 (SH2/SCO2<1, DH2/DCO2>1) [27].
Per superare questo limite sono in fase di studio materiali polimerici che esibiscono una elevata solubilità rispetto alla CO2, in modo da massimizzare il rapporto SCO2/SH2, ed
una abilità di filtraggio molecolare molto debole, così da portare DCO2/DH2 il più
possibile vicino a 1. In questo modo il gas che permea più velocemente la membrana è la CO2, che è resa disponibile a pressioni inferiori, mentre l’idrogeno è prodotto ad alta
pressione. Questo sistema è quindi ottimale per configurazioni in cui l’utilizzo a valle dell’impianto richieda H2 ad alta pressione e in cui non venga attuato il confinamento
della CO2 [28]
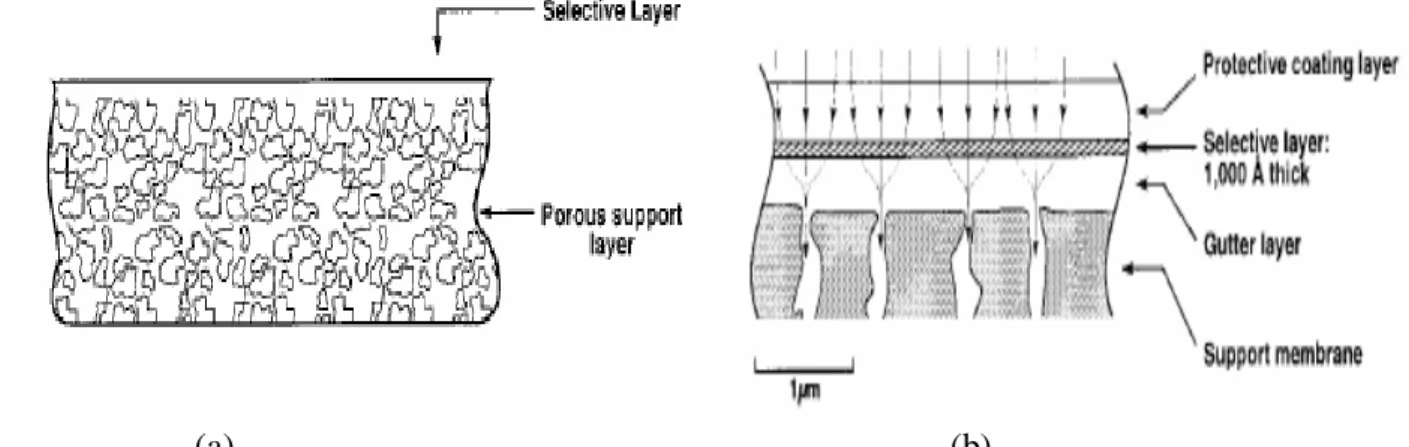
Le membrane possono essere divise in due categorie principali: le membrane a separazione di fase e le membrane composite a film sottile. Le membrane a separazione di fase sono chimicamente omogenee ma strutturalmente eterogenee, in quanto sono costituite da un sottile e molto denso strato di polimero supportato su di uno strato dello stesso polimero,spesso e poroso. Le membrane composite a film sottile sono sia chimicamente che strutturalmente eterogenee, in quanto sono composte da uno strato poroso di polimero rivestito con uno strato sottile e denso di un altro polimero.
I moduli delle membrane polimeriche sono essenzialmente di due tipi, a fibra cava (hollow fiber) o a spirale (spiral wound). Questi tipi di moduli permettono di avere elevate superfici di membrana in piccoli volumi. La struttura ed il funzionamento dei due diversi tipi di membrane sono mostrati, rispettivamente, nelle Figure 2.7 e 2.8.
Figura 2.7 – Struttura e funzionamento di una membrana a fibra cava
Le membrane polimeriche lavorano a temperature massime di 100-150°C e possono sopportare pressioni transmembranali fino a 100 bar. La permeabilità è relativamente bassa, nell’ordine di 10-5 mol.m/m2.s.bar. La resistenza di questi materiali a specie quali H2O, H2S, NH3, CH3OH, CH3OCH3 è solitamente buona, compatibile con la
composizione della miscela prodotta dai processi di gassificazione di combustibili solidi.
L’interesse per le membrane polimeriche è recentemente diminuito, a causa dei problemi di intasamento e di instabilità termica che ne pregiudicano l’efficienza nel tempo e del fatto che sembra si sia raggiunto, nelle prestazioni di questo tipo di materiali, un limite che si colloca al di sotto del livello desiderato per molte applicazioni pratiche. Per questi motivi la ricerca si è concentrata su membrane costituite da materiali inorganici.
2.3.2 Membrane metalliche dense
La dissoluzione selettiva dell’idrogeno in metalli nobili come palladio, titanio e argento è nota da tempo. Le ricerche in questo campo si sono concentrate sul palladio, in quanto questo metallo esibisce la più elevata selettività o efficienza di separazione grazie all'azione catalitica che esercita nei processi di dissociazione e ricombinazione dell'idrogeno da molecolare ad atomico e viceversa [23].
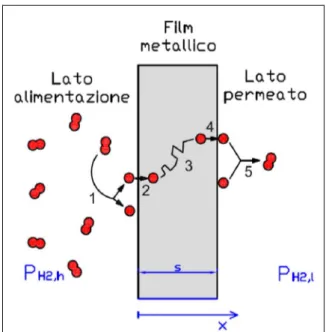
La permeazione dell’idrogeno attraverso strati densi di palladio implica diversi fenomeni in serie, mostrati in Figura 2.9, secondo un meccanismo detto di soluzione-diffusione [23][29][30]:
a. il trasporto molecolare dal bulk del gas fino allo strato limite gassoso adiacente alla superficie;
b. l’adsorbimento dissociativo della molecola sulla superficie del metallo (1); c. la dissoluzione reversibile degli atomi nel reticolo cristallino del metallo (2); d. la diffusione dell’idrogeno atomico nella membrana (3);
e. la transizione dal reticolo cristallino alla superficie del metallo sul lato del permeato (4);
f. il desorbimento ricombinativo (5);
Figura 2.9 - Fasi della permeazione dell’idrogeno in membrane metalliche dense
La velocità globale di permeazione dell’idrogeno può essere determinata da un unico step limitante o da una combinazione di essi. Il flusso molare di idrogeno permeato può essere espresso con la legge di Fick:
dx dC D J H H H2 2
dove DH2 è il coefficiente di diffusione, CH la concentrazione dell’idrogeno atomico nel
reticolo del metallo e x la coordinata spaziale parallela alla direzione del flusso. Se la velocità è determinata dalla diffusione atomica nel metallo (step 3), vale la legge di Sievert [31]: 5 . 0 2 H H K p C
che esprime la relazione d’equilibrio all’interfaccia gas/solido tra la pressione parziale dell’idrogeno nel bulk del gas (pH2) e la sua concentrazione molare nel metallo (CH).
atomica. Integrando sullo spessore della membrana, considerando costanti DH2 e K, si ricava:
H h H l
H l H h H H H p p s P s p p KD J 2, 2, 2 , 2 , 2 2 2 2 con PH2 [mol.m/m2.hr.bar] costante di permeabilità dell’idrogeno, s [m] spessore della
membrana, pH2,h e pH2,l [bar] pressione parziale dell’idrogeno rispettivamente lato
alimentazione e lato permeato. Una formula più generale tipicamente utilizzata è [29][30][31]:
n
l H n h H H H p p s P J 2 2, 2, 2 dove n è un coefficiente esponenziale ricavato sperimentalmente. Se il processo limitante dal punto di vista cinetico è la diffusione degli atomi di idrogeno nel metallo (step 3) l’esponente n assume valori vicini a 0.5, in accordo con la legge di Sievert. Se invece i fenomeni superficiali (step 1 e 2) risultano rilevanti, n tende ad aumentare fino ad un massimo di 1.
La permeabilità risulta inoltre dipendere dalla temperatura secondo una relazione di tipo Arrhenius: RT E P T PH2( ) H2,0 exp att
dove PH2,0 è un fattore preesponenziale e Eatt (J/mol) è un’energia di attivazione
apparente.
Spesso, anziché tramite la permeabilità, le membrane vengono caratterizzate dalla permeanza, data dal rapporto tra PH2 e lo spessore della membrana s, dato che
L’utilizzo di membrane al palladio, se da una parte assicura una selettività all’idrogeno teoricamente infinita, dall’altra comporta alcuni problemi. A temperature inferiori a 300°C il palladio esibisce, ad esempio, una transizione di fase α-β che dipende dalla concentrazione di idrogeno nel metallo. Le conseguenti espansione e contrazione del reticolo sottoposto a cicli di concentrazione e temperatura portano all’infragilimento e alla rottura della membrana. Il fenomeno può essere controllato ed evitato utilizzando, anziché palladio puro, sue leghe con argento o rame, che non sono sottoposte alla transizione di fase nelle condizioni di utilizzo.
Le membrane al palladio autosupportanti, che consistono in film di spessore tra 50 e 150 µm, sono commercializzate da due ditte (Johnson Matthey lega Pd/Cu, ATI Wah Chang lega Pd/Ag). Esse hanno costi molto elevati e sono utilizzate principalmente per la produzione di idrogeno a purezza elevata (impurezze <1ppb) da utilizzare in celle a combustibile o per la produzione di semiconduttori. Esse operano a temperature variabili tra 300°C e 600°C, con pressioni transmembranali di 20-40 bar. La natura catalitica del palladio comporta una notevole sensibilità a veleni come i composti dello zolfo, che reagiscono con la superficie alterando la struttura del metallo (avvelenamento irreversibile) e come idrocarburi insaturi, Hg, Cl2, HCl, che vengono chemiadsorbiti
sulla superficie (avvelenamento reversibile). Il flusso di permeato ottenibile utilizzando queste membrane, a causa dello spessore relativamente elevato, è limitato, pari a circa 40-100 mol/m2.hr.bar.
Molte sperimentazioni sono in corso per aumentare le prestazioni delle membrane metalliche dense. La principale linea di ricerca prevede la deposizione di film metallici densi molto fini (0.5-20 µm) su supporti porosi che assicurino la stabilità meccanica, in modo da minimizzare lo spessore dello strato selettivo ed aumentare il flusso di permeato. I materiali che costituiscono i supporti possono essere metallici (acciaio inox) o ceramici (allumina o silice). Deve essere posta attenzione al diverso coefficiente di espansione termica dei materiali accoppiati, che può portare all’accumulo di tensioni nella struttura. Per questo motivo e per favorire l’adesione del metallo sulla superficie del supporto, solitamente si usano configurazioni con una serie di strati (fino a 4) con
composizione diversa e spessore e dimensione dei pori decrescente nella direzione del lato dell’alimentazione.
La principale tecnica di produzione di membrane al palladio auto-supportanti, prodotte solitamente in configurazioni tubolari, è il rolling method.
2.3.3 Membrane ceramiche microporose
Generalmente le membrane microporose per la separazione dell’idrogeno sono prodotte applicando da uno a tre strati sottili con dimensione dei pori inferiore a 1 nm su un supporto macroporoso ceramico (solitamente allumina) o metallico (acciaio inox). Anche il supporto può essere composto di più strati a porosità variabile che favoriscono il processo di deposizione del film di membrana. Le membrane sono disponibili in configurazioni piane, a disco o più spesso tubolari. I film microporosi sono generalmente composti da ossidi metallici, i più diffusi dei quali sono la silice (SiO2),
l’allumina (Al2O3) e l’ossido di titanio (TiO2). Essi vengono depositati sui supporti
essenzialmente tramite due tecniche: la chemical vapour deposition o la sol-gel
technique.
I vantaggi assicurati dall’utilizzo di queste membrane rispetto alle altre tipologie sono molteplici [32]:
la scelta del materiale non è limitante e quindi può essere effettuata tenendo conto dell’ambiente di lavoro delle membrane;
i materiali e di conseguenza le membrane sono molto meno costosi;
le membrane possono operare a temperature molto più elevate (fino a 900°C); la compatibilità con le condizioni operative è assicurata dal fatto che
praticamente ogni materiale metallico o ceramico può essere utilizzato come supporto.
Il principale svantaggio è l’impossibilità di ottenere selettività infinite a causa del fatto che non si possono fabbricare membrane con porosità discreta e prive di difetti. Sono
stati però ottenuti fattori di separazione pari a 100, con cui si può ottenere una purezza del 99%. Utilizzando inoltre più stadi di separazione, si può tranquillamente ottenere la purezza richiesta anche dalle applicazioni più delicate. Inoltre è necessario approfondire la ricerca sulla fabbricazione di queste membrane, che mostrano spesso pori sovradimensionati che ne pregiudicano le prestazioni.
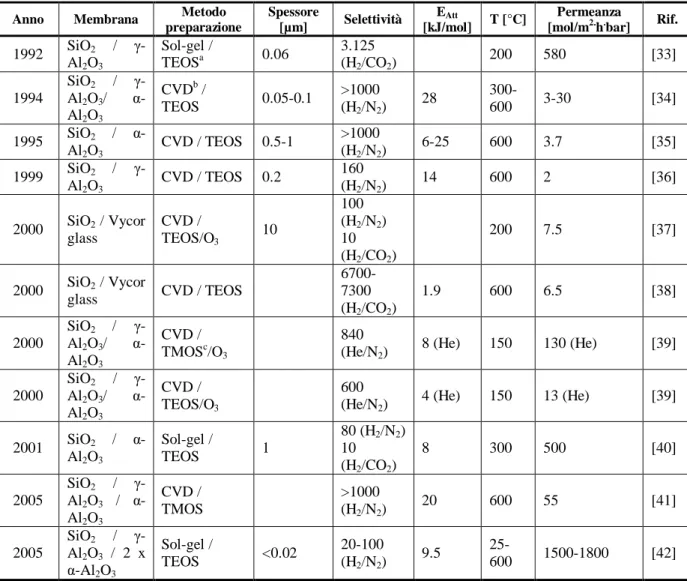
In Tabella 2.3 sono riportati i principali risultati di recenti sperimentazioni su membrane ceramiche microporose per la separazione dell’idrogeno da altri gas.
Tabella 2.3 - Sperimentazioni su membrane ceramiche microporose per la separazione dell’idrogeno
Anno Membrana Metodo
preparazione Spessore [µm] Selettività EAtt [kJ/mol] T [°C] Permeanza
[mol/m2.h.bar] Rif.
1992 SiO2 / γ-Al2O3 Sol-gel / TEOSa 0.06 3.125 (H2/CO2) 200 580 [33] 1994 SiO2 / γ-Al2O3/ α-Al2O3 CVDb / TEOS 0.05-0.1 >1000 (H2/N2) 28 300-600 3-30 [34] 1995 SiO2 / α-Al2O3 CVD / TEOS 0.5-1 >1000 (H2/N2) 6-25 600 3.7 [35] 1999 SiO2 / γ-Al2O3 CVD / TEOS 0.2 160 (H2/N2) 14 600 2 [36] 2000 SiO2 / Vycor glass CVD / TEOS/O3 10 100 (H2/N2) 10 (H2/CO2) 200 7.5 [37] 2000 SiO2 / Vycor glass CVD / TEOS 6700-7300 (H2/CO2) 1.9 600 6.5 [38] 2000 SiO2 / γ-Al2O3/ α-Al2O3 CVD / TMOSc/O3 840 (He/N2) 8 (He) 150 130 (He) [39] 2000 SiO2 / γ-Al2O3/ α-Al2O3 CVD / TEOS/O3 600
(He/N2) 4 (He) 150 13 (He) [39]
2001 SiO2 / α-Al2O3 Sol-gel / TEOS 1 80 (H2/N2) 10 (H2/CO2) 8 300 500 [40] 2005 SiO2 / γ-Al2O3 / α-Al2O3 CVD / TMOS >1000 (H2/N2) 20 600 55 [41] 2005 SiO2 / γ-Al2O3 / 2 x α-Al2O3 Sol-gel / TEOS <0.02 20-100 (H2/N2) 9.5 25-600 1500-1800 [42] a
Le membrane ceramiche porose possono essere classificate in base alla dimensione dei pori, in accordo con la definizione data dalla IUPAC:
macropori (d>50 nm); mesopori (2 nm<d<50 nm); micropori (d<2 nm).
Esistono cinque diversi meccanismi di trasporto dei gas nelle membrane porose (Figura 2.10) [23][33][43]:
diffusione di Knudsen; flusso viscoso o di Poiseuille; condensazione capillare; diffusione superficiale; setaccio molecolare.
Il contributo relativo dei diversi meccanismi dipende tanto dalle caratteristiche della membrana e del gas da permeare, quanto dalle condizioni operative come temperatura e pressione.
La proporzione reciproca tra diffusione di Knudsen e flusso laminare convettivo è governata dal rapporto tra il raggio del poro e il cammino libero medio della molecola, che si può calcolare come:
M RT P 2 2 3
con µ [Pa.s] viscosità del gas, P [Pa] pressione totale, M [g/mol] peso molecolare, T [K] temperatura.
Flusso viscoso. Se il rapporto λ/r<<1, il flusso viscoso o di Poiseuille predomina ed il trasporto di materia può essere descritto dall’equazione:
RT L p p p r G m h l vis 16 2 con GVis [mol/m2s] flusso molecolare del gas, r [m] raggio del poro, pm [Pa] pressione
parziale media, ph e pl pressioni parziali del gas sul lato dell’alimentazione e del
permeato, L [m] lunghezza del poro. Il flusso viscoso non permette la separazione tra specie gassose.
Diffusione di Knudsen. Se al contrario r/λ<<1, si ha il flusso di Knudsen, con più collisioni con le pareti dei pori che tra le molecole. Ad ogni collisione con le pareti le molecole sono momentaneamente adsorbite e poi riflesse in direzione casuale. Ciascuna molecola si muove indipendentemente dalle altre, e quindi la separazione di miscele gassose è ottenuta poiché specie differenti si muovono a velocità diversa. Il flusso di gas si calcola come:
MRT L p p r Gmol h l 2 3 8 con GKnudsen [mol/m2s] flusso molecolare del gas. La separazione di gas con questo
meccanismo si ottiene usando membrane con dimensione dei pori inferiore a 50 nm. Per la diffusione di Knudsen il rapporto di rapporto di selettività α (fattore di separazione ideale) può essere stimato attraverso la radice quadrata dei pesi molecolari:
A B B A M M /
In Tabella 2.4 sono riportati i fattori di separazione per le principali miscele gassose binarie contenenti idrogeno, calcolati in base a questa equazione. In realtà il fattore di separazione reale risulta più basso, a causa di meccanismi come la controdiffusione, la diffusione non separativa, la polarizzazione per concentrazione sul lato dell’alimentazione o del permeato e il flusso viscoso nei pori più grandi.
Tabella 2.4: Fattori di separazione calcolati basati sul flusso di Knudsen per miscele gassose binarie
Miscela Gassosa Fattore di separazione H2/N2 3.74 H2/CO 3.74 H2/H2S 4.33 H2/CO2 4.69 H2/SO2 5.81
Setaccio molecolare. Per funzionare come setaccio molecolare, una membrana deve avere diametro dei pori intermedio tra quelli delle molecole da separare (vedere Tabella 2.5). Fattori di separazione più grandi di 10 si possono comunque ottenere con pori inferiori a 0.5 nm, mentre se il diametro è intermedio il fattore di separazione risulta teoricamente infinito.
Tabella 2.5 - Diametro cinetico di molecole gassose [44] Molecola Diametro cinetico [nm] He 0.26 H2O 0.265 H2 0.289 CO2 0.33 N2 0.364 CH4 0.38
Nelle situazioni pratiche, la membrana sarà caratterizzata da una distribuzione di dimensioni dei pori, e perciò la permeabilità di un gas è influenzata da una combinazione di meccanismi di trasporto.
Diminuendo il diametro dei pori di una membrana, se ne abbassa la porosità, e si ottiene un minore flusso di gas. Perciò, per ottenere una membrana efficiente, la porosità e la dimensione dei pori o, in altri termini la permeabilità e la selettività, devono essere attentamente bilanciate.
Condensazione capillare. La separazione dei gas può essere influenzata anche dalla parziale condensazione di alcuni componenti della miscela gassosa nei pori, con l’esclusione delle altre specie ed il conseguente trasporto nei pori della molecola condensata.
Diffusione superficiale. L’adsorbimento selettivo dei componenti di una miscela sulla superficie dei pori e la successiva diffusione superficiale possono anch’esse facilitare la separazione. Per questo meccanismo il flusso totale decresce all’aumentare della temperatura, poiché l’aumento della diffusività è superato dalla diminuzione della concentrazione superficiale.
Nelle membrane ceramiche commerciali, con pori di dimensioni maggiori di 4 nm (regione dei mesopori), la diffusione di Knudsen risulta il meccanismo dominante e quindi si ottengono nel caso della separazione dell’idrogeno da molecole di basso peso molecolare selettività limitate.
Diverse recenti sperimentazioni hanno portato allo sviluppo di membrane ceramiche microporose (d<2 nm) che mostrano selettività molto più elevate di quelle riportate in
Tabella . Sperimentalmente è stato riscontrato che in tali membrane il flusso JA
(mol/m2s) di una specie gassosa A risulta direttamente proporzionale alla differenza di pressione parziale di A tra i due lati della membrana:
Ah Al
A A p p s P J , ,e che la permeabilità PA (mol.m/m2.s.Pa) aumenta con la temperatura secondo la
relazione [41]: RT E P P att exp 0
con energie di attivazione apparenti Eatt variabili tra 2 e 40 kJ/mol, dipendenti dalla
dimensione dei pori e delle molecole di gas. Questo significa che il meccanismo di permeazione non è né il flusso laminare (proporzionale a 1/T), né il flusso di Knudsen (proporzionale a 1/√T), né la diffusione superficiale (flusso decrescente all’aumentare della temperatura). Il meccanismo è stato indicato come trasporto attivato o diffusione microporosa, e prevede cinque step [43]:
1. trasporto della molecola in fase gassosa fino ai micropori attraverso uno strato adsorbito sulla superficie esterna o direttamente dalla fase gas;
2. l’ingresso della molecola dal sito di adsorbimento esterno al microporo al sito all’interno di esso, o il parallelo ingresso direttamente dalla fase gas;
4. il desorbimento dal microporo verso la superficie esterna o direttamente verso la fase gas;
5. il desorbimento dalla superficie esterna della membrana.
La selettività è determinata dalla differenza nelle dimensioni delle molecole (vedere Tabella 2.5), dalle loro caratteristiche di adsorbimento sulla membrana e dalla loro diffusività microporosa.
2.3.4 Membrane ceramiche dense
Le perovskiti sono una famiglia di minerali a struttura cubica di formula generale ABO3
dove A e B sono cationi di dimensione diversa. La struttura generale delle perovskiti, riportata in Figura 2.11, è pseudo-cubica, con A (catione più grande) nel centro del cubo e B (catione piccolo) ai vertici, spesso con struttura distorta a causa di rapporti A/B non stechiometrici; gli anioni di ossigeno sono situati nel centro delle facce del cubo.
Figura 2.11 - Struttura generale delle perovskiti
Negli anni ‘80 del secolo scorso è stata scoperta la conduzione non elettrogalvanica di protoni in questi minerali (ad esempio nel ceriato di stronzio SrCeO3) ad alta
temperatura [45][46]. Questa passa attraverso una serie di step ( Figura 2.12): a. ossidazione (catalitica o non catalitica) di H2 ad H+ sul lato dell’alimentazione;
b. adsorbimento dei protoni e degli elettroni nel cristallo; c. conduzione mista protonica-elettronica;
d. desorbimento dei protoni e degli elettroni;
Lo step che determina la cinetica globale del processo è solitamente la conduzione mista nel cristallo.
Figura 2.12 - Meccanismo di permeazione dell’idrogeno in membrane ceramiche dense
Dopo decenni di studi è stato dimostrato che il livello più alto di conduzione protonica si ottiene attraverso perovskiti dopate selettivamente, come ceriati e zirconati di bario e stronzio. In particolare SrCeO3 e BaCeO3 dopati con cationi trivalenti come Y, Yb e Gd
sono stati identificati come ottimi conduttori di protoni a temperatura elevata.
La formula generale delle perovskiti dopate è A1-xA’xB1-yB’yO3-δ. Dopando i siti B con
cationi di valenza inferiore si producono vacanze di ossigeno, necessarie per ottenere la massima conducibilità protonica. L’idrogeno viene infatti inglobato nel cristallo di perovskite tramite reazione con le vacanze di ossigeno e l’ossigeno del minerale in presenza di umidità1:
1
Notazione di Kroger-Vink: MS C
; M = atomi, vacanze (V), interstiziali (i), elettroni (e), buchi (h); S = sito del reticolo occupato (atomi, interstiziali, ecc.); C = carica nulla (x), positiva (•), negativa (‘)
O i O i O O OH H O H O V O H2 2 E in assenza di umidità: ' 2 / 1 H2 OO OHO e
Una volta incorporati gli ioni di idrogeno sono condotti per trasferimento tra gli atomi di ossigeno nelle normali posizioni reticolari. E’ stato dimostrato che aumentando la distanza degli ioni di ossigeno l’energia di attivazione per la conduzione protonica diminuisce, ed aumenta la mobilità dei protoni: per questo è necessario dopare il materiale aumentando la concentrazione delle vacanze di ossigeno. Molto importante per il corretto funzionamento delle membrane è la stabilità chimica, e in particolare la resistenza a gas acidi come H2O e CO2. Questa, soprattutto a basse temperature, non è
molto elevata, in particolare per BaCeO3, che ha caratteristiche basiche e si può
decomporre in Ba(OH)2 e CeO2.
I vantaggi delle membrane ceramiche dense sono:
il materiale delle membrane è abbastanza economico ed il sistema è semplice; la selettività per l’idrogeno è teoricamente infinita (per membrane prive di difetti); le temperature necessarie per la permeazione sono compatibili con quelle dei
processi, ad esempio, di gassificazione;
il sistema è molto versatile e adattabile a numerose applicazioni.
Il principali svantaggi sono la limitata permeabilità, dovuta alla bassa conducibilità elettronica di questi materiali e la precaria resistenza meccanica specialmente con geometrie tubolari, a causa dell’aumento di concentrazione delle vacanze al decrescere della pressione parziale dell’ossigeno (infatti la membrana tende a espandersi dal lato povero di ossigeno mentre si contrae dal lato ricco, sottoponendo l’intera struttura ad un notevole stress).
2.3.5 Membrane composite
Le membrane composite, costituite da diversi materiali, permettono di aggirare i limiti tipici delle membrane ceramiche dense: combinando infatti due fasi con caratteristiche di conducibilità opposte (una fase buona conduttrice di elettroni e l’altra buona conduttrice di protoni), si riesce infatti a incrementare il flusso di idrogeno attraverso la membrana. Le membrane composite possono essere raggruppate nei seguenti gruppi [47][48][49]:
Membrane composite ceramica/ceramica: incorporano in una fase proton-conduttrice composta da perovskiti una seconda fase anch’essa ceramica ma elettron-conduttrice. Questa combinazione si può ottenere con il dopaggio eccessivo delle perovskiti con metalli di transizione, o miscelando due distinte fasi ceramiche. Lavorano ad elevate temperature ed hanno permeabilità all’idrogeno relativamente bassa, ma una elevata resistenza chimica.
Cermet per alta temperatura: le membrane miste ceramiche-metalliche combinano la matrice ceramica proton-conduttrice con una fase metallica che assicura elevata conducibilità elettronica anche per minime quantità di metallo. Questo svolge anche un’azione catalitica nei confronti della dissociazione dell’idrogeno sul lato dell’alimentazione, diminuendo quindi la resistenza dovuta a questo step del processo. Le membrane cermet assicurano una resistenza meccanica molto più elevata delle composite ceramiche, ma la fase metallica risulta molto sensibile a veleni come i composti dello zolfo e il monossido di carbonio.
Cermet per alta temperatura con metalli permeabili all’idrogeno: inserendo una fase metallica permeabile all’idrogeno (essenzialmente Pd e sue leghe) si ottengono permeabilità sensibilmente più elevate.
Composite per temperature intermedie: queste membrane incorporano una fase ceramica in una fase metallica composta da metalli non nobili. I due lati della membrana devono essere ricoperti da un sottile film catalitico (Pd) che protegga il metallo sottostante, molto reattivo.
Per ogni tipo di membrana composita esiste un rapporto ottimale tra la frazione conduttrice di elettroni e la frazione conduttrice di protoni per il quale la permeabilità all’idrogeno è massima. In Tabella 2.6 si riportano le prestazioni dei diversi gruppi di membrane composite ed i relativi vantaggi e svantaggi:
Tabella 2.6 – Caratteristiche delle membrane composite per la separazione di idrogeno [47]
Membrana Spessore [mm] Temperatura operativa [°C] Flusso H2 massimo [ml/min.cm2] Conduttività ambipolare [S/cm] Permeabilità
[mol/m.hr.atm0.5] Vantaggi Svantaggi
Ceramica / Ceramica 0.1-0.5 700-950 0.1 10 -4-5.10-3 economiche resistenti ai veleni basso flusso H2 fragili Cermet alta T 0.1-0.5 700-950 1 2 . 10-4-10-2 flusso H2 più elevato delle ceramiche economiche catalizzatore integrato meno fragili suscettibili ai veleni flusso H2 inferiore alle cermet con Pd Cermet alta T con metalli H2 -perm. 0.1-0.5 550-950 4 0.01 (600-950°C) flusso H2 elevato catalizzatore integrato meno fragili costose suscettibili ai veleni Composite media T 0.05-0.5 300-750 >10 0.1 (380-450°C) il più elevato flusso di H2 compatibili con sistemi di desolforazio ne suscettibili ai veleni difficoltà di fabbricazio ne
2.3.6 Confronto tra membrane
In Tabella 2.7 è sviluppato un confronto sintetico tra le varie tipologie di membrane prese in considerazione. La scelta tra le diverse possibilità deve essere effettuata alla luce non solo delle prestazioni delle singole categorie, ma anche tenendo conto della tecnologia di produzione di idrogeno che sta a monte del sistema di separazione e della destinazione d’uso del prodotto che si trova al contrario a valle. Per questo motivo è essenziale un’integrazione con le altre linee di ricerca.
Tabella 2.7 - Proprietà delle membrane per la separazione dell’idrogeno [50] Polimeriche dense Metalliche dense Ceramiche microporose Ceramiche dense Cermet Intervallo di temperature <100°C 300-600°C 200-600°C 600-900°C 550-950 Selettività H2 / N2 bassa >1000 5-139 >1000 >1000 Flusso di H2 x 103 mol/m2.hr.bar basso 60-300 60-300 6-80 100-500 Stabilità rigonfiamento, compattazione transizione
di fase stabili in H2O stabili in CO2
suscettibili ai veleni
Veleni HCl, SOx
H2S, HCl,
CO H2S H2S, HCl, CO
Materiali polimeri palladio e sue leghe silice, allumina, zirconia, titania ceramiche proton-conduttrici Metalli + ceramiche proton-conduttrici Meccanismo di trasporto soluzione - diffusione soluzione - diffusione setaccio molecolare conduzione mista conduzione mista
![Tabella 2.1 – Confronto tra le diverse tecnologie per la separazione dell’idrogeno [11]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7373754.95747/2.892.154.821.209.526/tabella-confronto-diverse-tecnologie-separazione-idrogeno.webp)
![Figura 2.1 - Isoterme di adsorbimento di idrocarburi leggeri [20]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7373754.95747/3.892.240.695.494.922/figura-isoterme-adsorbimento-idrocarburi-leggeri.webp)

![Figura 2.5 - Solubilità e diffusività di vari gas nei polimeri Polisulfone (PSF) e Polidimetilsilosano (PDMS) [26]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7373754.95747/11.892.154.812.403.856/figura-solubilità-diffusività-vari-polimeri-polisulfone-polidimetilsilosano-pdms.webp)