RIASSUNTO ANALITICO
L'Epilessia Mioclonica Giovanile (JME) è una sindrome elettroclinica ad esordio giovanile, con forte componente genetica, caratterizzata da crisi generalizzate miocloniche, tonico-cloniche e talora assenze tipiche. L’EEG intercritico è tipicamente costituito da punte/polipunta-onda a 3-6 Hz.. La fotosensibilità è frequente. Abbiamo sottoposto ad EEG-fMRI con task di Stimolazione Luminosa Intermittente (SLI) low luminance una coorte di 10 pazienti con JME ed un gruppo di controlli sani. Utilizzando il task SLI come regressore abbiamo osservato: nei controlli attivazione delle aree visive striate ed extrastriate (RSN1) e del putamen, deattivazione di aree cerebrali deputate alla preparazione ed attuazione del movimento (RSN3); nei pazienti attivazione della RSN1, deattivazione delle aree costituenti il default mode network (RSN2). Il task SLI ha determinato la comparsa di anomalie fotoparossistiche (PPR) elettroencefalografiche in 7/10 pazienti. Nei soggetti JME fotosensibili abbiamo condotto una analisi temporale del segnale BOLD in intervalli antecedenti e successivi alla PPR. I fenomeni dominanti sono risultati: attivazione del putamen prima della PPR, attivazione della RSN3 e del talamo dopo l’anomalia (picco a 2.5-5 sec); successivamente abbiamo prevalentemente osservato fenomeni di deattivazione: RSN3, caudato-putamen bilateralmente, RSN2 nella sua componente anteriore.
I nostri risultati suggeriscono che la circuiteria dei nuclei della base possa avere un ruolo nel contesto di alterazioni della connettività funzionale tra aree cerebrali deputate al movimento e aree visive. L’anomalia epilettiforme foto-indotta potrebbe rappresentare l’espressione finale di complessi cambiamenti che avvengono nel sistema striato-talamo-corticale, verosimilmente core etiopatogenetico della JME.
SUMMARY
Juvenile Myoclonic Epilepsy (JME) is a young onset electroclinical syndrome, characterized by myoclonic, generalized tonic-clonic and possibly typical absence seizures. Interictal EEG displays 3-6 Hz spike/polyspike and wave pattern. Photosensitivity is frequent. We performed an EEG-fMRI study with low luminance intermittent light stimulation in 10 JME patients and in healthy controls. Related to the light stimulus itself we observed: in the control cohort activation of the visual areas (RSN1) and the putamen, deactivation of the sensorimotor areas (RSN3); in the JME group activation of the RSN1, deactivation of the default mode network (RSN2). In the seven out of 10 patients who had a PhotoParoxysmal Response (PPR) we then performed a temporal analysis of BOLD signal related to PPR, in a time window from 15 seconds before until 15 seconds after the
EEG paroxysm. Prevailing phenomena were: activation of the putamen before the PPR, activation of the RSN3 and thalamus after the PPR (peak at 2.5-5 sec.), then we mainly observed deactivations of the RSN3,the caudate-putamen, the anterior component of the RSN2. Our result suggest basal ganglia circuitry may play a role in the context of functional connectivity between motor and visual neural networks. The PhotoParoxysmal Response could feature the final expression of pathogenic phenomena occurring in the striato-thalamo-cortical system, possibly core of JME.
1) INTRODUZIONE
1.1 Risonanza Magnetica dell’Encefalo
1.1.1 Le basi della Risonanza Magnetica
La Risonanza Magnetica Nucleare è un fenomeno che origina in nuclei atomici con numero dispari di protoni e/o neutroni. Nell’imaging a Risonanza Magnetica (Magnetic Resonance Imaging: MRI) il segnale misurato origina dai nuclei degli atomi di idrogeno tissutali, cioè dai protoni. Questi presentano una proprietà fisica caratteristica detta spin: ciascun spin si comporta come un dipolo magnetico e si orienta lungo la linea di forza di un campo magnetico esterno, in senso parallelo o antiparallelo rispetto al campo stesso. Dentro lo scanner MRI la maggior parte dei protoni si allinea in senso parallelo al campo magnetico B prodotto dalla macchina, dando luogo a una
magnetizzazione M netta, che rappresenta lo stato di equilibrio. Quando i protoni vengono sottoposti
a un’onda elettromagnetica a radiofrequenza (RF) con una frequenza specifica, proporzionale al campo magnetico B (frequenza di Larmor, 42.6 MHz/Tesla), alcuni nuclei assumono energia modificando il loro spin da parallelo a antiparallelo. Ciò modifica il valore del vettore M (magnetizzazione longitudinale) lungo l’ asse z. La durata dell’ impulso RF determina l’angolo di deflessione del vettore M. Lo spin netto inizia a ruotare in modo simile ad una trottola intorno al vettore di magnetizzazione M (movimento di precessione). Durate la precessione i protoni emettono un’onda elettromagnetica proprio alla frequenza di Larmor (fig. 1). Terminato l’impulso a RF il movimento di precessione tende ad esaurirsi e gli spin riassumono l’orientamento originale del vettore M (rilassamento), generando il segnale registrato che si determina quindi con il ritorno del vettore M alla posizione di equilibrio (FID: Free Induction Decay).
Fig. 1 Il vettore di magnetizzazione M inclinato ruota intorno al suo asse primitivo (parallelo al campo magnetico B)
In sintesi il vettore di magnetizzazione M (e quindi la presenza di protoni) è registrato con questa sequenza di eventi:
Esposizione dentro lo scanner MRI a un campo magnetico B di elevata intensità. Come conseguenza si sviluppa un vettore M parallelo al campo B.
Esposizione ad un’onda elettromagnetica a RF, con frequenza pari a quella di Larmor e durata di pochi millisecondi. Si produce quindi il movimento di precessione.
Registrazione della frequenza emessa dai protoni durante il movimento di precessione tramite una bobina ricevente. Viene misurato l'andamento della magnetizzazione nel piano perpendicolare al campo magnetico principale (Free
Induction Decay, o FID)1.
1.1.2. Codifica spaziale in MRI
L’effetto MR descritto nel paragrafo precedente permette solamente di rilevare la presenza di protoni. Il segnale deve andare incontro ad una codifica spaziale su tre piani ortogonali per poter dar luogo ad una immagine. Per questa ragione si utilizzano diverse metodiche di codifica.
Codifica di frequenza: Durante l’acquisizione del segnale emesso dai protoni viene acceso un gradiente di codifica di frequenza, modificando il campo magnetico in modo che aumenti linearmente nella direzione dell’asse x (ortogonale all’asse del campo magnetico B) (fig.2). In tal modo la frequenza di Larmor del singolo protone dipende dalla sua posizione nel cervello secondo l’asse x. Il segnale emesso da tutti i protoni è sottoposto tramite una trasformata di Fourier ad analisi dallo spettro di frequenza. In tal modo si può determinare la presenza del singolo protone lungo l’asse x.
Codifica di fase: Fra l’impulso a RF iniziale e l’acquisizione viene acceso un
gradiente di codifica di fase (fig. 3). In questo modo protoni che si trovano nello
stesso punto dell’asse x ma in una diversa posizione sull’asse y presentano in acquisizione una stessa frequenza, ma una diversa fase.
Fig. 3 Codifica di fase
Slice selection: Viene acceso all’inizio dell’esperimento un gradiente che permane durante l’impulso a radiofrequenza (slice gradient). In tal modo si induce un movimento di precessione solo in una slice del volume. Ripetendo con diverse frequenze di eccitazione si può così ricostruire anche l’asse z (parallelo al campo magnetico B) (fig. 4).
1.1.3 Segnale MRI e tempi di rilassamento
L’ ampiezza iniziale del segnale dipende dalla quantità di protoni presenti nel campione (Densità
Protonica, DP). La velocità di ritorno all’equilibrio è influenzata dai “tempi di rilassamento”,
costituiti da1:
una componente longitudinale (parallela al campo magnetico) che si avvicina al suo massimo valore (valore di equilibrio) in modo esponenziale con la costante di tempo T1 (tempo di rilassamento longitudinale). Indica la rapidità con cui si ricostruisce la magnetizzazione diretta lungo la direzione del campo principale, e dipende dall'interazione tra protoni e le molecole circostanti (rilassamento spin-reticolo).
una componente trasversale (perpendicolare al campo magnetico) che si riduce progressivamente in modo esponenziale con la costante di tempo T2 (tempo di rilassamento trasversale). Indica la rapidità con cui si distrugge la componente di magnetizzazione trasversale in condizioni ideali, e dipende dall'interazione mutua di protoni vicini (rilassamento spin-spin). Le disomogeneità locali del campo magnetico possono accelerare il processo di sfasamento degli spin che avviene con una costante reale T2*.
Il T1 è più lungo del T2 , poichè quando non esiste più il vettore di magnetizzazione trasversale, il vettore di magnetizzazione longitudinale non ha ancora raggiunto la lunghezza che possedeva prima dell’impulso di RF2
. Nell’uomo i valori di T1 a 3 Tesla sono circa 850 ms per la sostanza bianca 1300 ms per la grigia, 4500 ms per il liquor3. Le sequenze MRI che sfruttano T1 sono particolarmente utili per studiare la morfologia cerebrale. Per T2 invece c’è minore contrasto fra sostanza bianca e grigia (80 vs 100 ms a 3 Tesla), mentre il liquor ha lungo T2 (circa 2000 ms), cosicché si può distinguere facilmente tessuto cerebrale da compartimenti liquidi (es. edema)3.
1.2 Risonanza Magnetica Funzionale (fMRI)
1.2.1 Principi fisiologici di fMRI
La Risonanza Magnetica Funzionale (Functional Magnetic Resonance Imaging: fMRI) è una metodica avanzata di neuroimaging in grado di valutare la funzionalità del cervello, in modo complementare rispetto all’imaging morfologico. La metodica è stata inizialmente sviluppata sull’animale da Ogawa et al nel 1990, contestualmente alla definizione dell’effetto BOLD (Blood
Oxygenation Level Dependent)4. Nel 1992 furono condotti i primi studi su essere umano5-7. Da allora la fMRI ha conosciuto una diffusione esponenziale nello studio diagnostico e nella ricerca in neuroscienze. Il razionale fisiopatologico che sottende la fMRI è determinato fondamentalmente dal metabolismo neuronale. L’attività cerebrale richiede il consumo di glucosio ed ossigeno, il cui apporto viene fornito dal microcircolo capillare, derivato dai vasi arteriosi cerebro afferenti . A riposo il cervello estrae il 30-40% dell’ossigeno trasportato dall’emoglobina. Di conseguenza, mentre il sangue arterioso cerebroafferente contiene quasi esclusivamente ossiemoglobina, il sangue venoso cerebroefferente comprende sia ossiemoglobina sia deossiemoglobina. Il cambiamento funzionale avviene a livello del microcircolo, a circa 2-3 mm dall’attività neuronale vera e propria. L’ossiemoglobina è diamagnetica, mentre la deossiemoglobina è paramagnetica; le sostanze paramagnetiche alterano la suscettività magnetica locale, creando distorsioni del campo magnetico e determinando una rapida perdita di magnetizzazione dei nuclei di idrogeno secondo il tempo di
rilassamento T2*. Di conseguenza sequenze sensibili a T2* presentano un segnale maggiore in
presenza di ossiemoglobina, minore se prevale deossiemoglobina. L’attività cerebrale determina cambiamenti nel flusso ematico e nel volume ematico regionale che risultano in variazioni del rapporto fra le due forme di emoglobina4, 6. Un incremento dell’attività neuronale locale porta infatti ad un immediato aumento del tasso di estrazione di ossigeno nel letto capillare e dunque ad un aumento nella concentrazione relativa di deossiemoglobina (initial dip); questa fugace modificazione iniziale non è di norma registrabile nell’uomo. Dopo circa 3 secondi segue un aumento sia del flusso ematico cerebrale (CBF) sia del volume ematico cerebrale (CBV), che raggiunge un picco a 5-6 secondi (risposta emodinamica). La risposta emodinamica compensa l’aumento di estrazione di ossigeno e fornisce addirittura un eccedenza di ossiemoglobina (overshoot). In questa fase il rapporto tra ossiemoglobina e deossiemoglobina aumenta e il campo magnetico risulta più omogeneo; gli spin eccitati defasano più lentamente in un campo magnetico più omogeneo, con un conseguente incremento di segnale T2* nello stato attivato rispetto allo stato di riposo. L’entità dell’aumento di segnale dipende in maniera esponenziale dall’intensità del campo magnetico statico: Se lo stimolo perdura nel tempo l’overshoot presenta un plateau, che si esaurisce al termina della richiesta metabolica neuronale (fig. 5).
Fig. 5 In condizioni di riposo il tasso di estrazione di ossigeno e il rapporto ossiemoglobina/deossiemoglobina nei
capillari e nelle venule sono costanti. La deossiemoglobina è paramagnetica e determina disomogeneità nel campo magnetico locale. Queste portano ad un rapido defasamento degli spin che risulta in un basso segnale BOLD (immagine
a). L’attivazione corticale determina un aumento del tasso di estrazione dell’ossigeno, cui segue un incremento del CBF
nettamente superiore al fabbisogno. Ne risulta un aumento del rapporto ossiemoglobina/deossiemoglobina rispetto alla condizione di riposo, con una maggiore omogeneità del campo magnetico e un defasamento degli spin eccitati più lento
rispetto alla condizione basale, risultando in un aumento del segnale MRI (effetto BOLD) (immagine b) (modif. da 8)
Infine l’incremento del CBV determina un undershoot (fino a 30 secondi dopo lo stimolo): quando CBF e tasso di estrazione dell’ossigeno ritornano ai valori iniziali, nelle venule dilatate rimane un volume di sangue superiore al basale, dove si accumula deossiemoglobina in misura maggiore delle condizioni pre-stimolo (fig. 6).
Fig. 6 Decorso temporale di risposta emodinamica attivata da un lungo (cira 20s) evento-stimolo. L’iniziale caduta di
segnale (initial dip) non è rilevabile negli studi di fMRI sull’uomo. Dopo 3s dall’ inizio dello stimolo si ha un incremento di segnale che raggiunge il picco dopo 5-6s (overshoot) dall’inizio dello stimolo. Alla fine dello stimolo
spesso il segnale cade sotto i livelli base pre-stimolo (undershoot) (modif. da 8)
L’effetto BOLD, quindi, misura indirettamente l’aumento dell’attività neuronale rilevando i cambiamenti nell’omogeneità del campo magnetico locale causati dalla risposta emodinamica (iperafflusso di sangue ossigenato). Al fine di poter misurare variazioni dell’effetto BOLD è necessario utilizzare sequenze specifiche di Risonanza Magnetica che presentino una elevata dipendenza dal T2*-tissutale e che permettano una rapida acquisizione di immagini, come la.
gradient-echo echo-planar imaging (GE-EPI).
La fisiologica della risposta emodinamica determina la sensibilità temporale della metodica. I fenomeni misurati si sviluppano nell’ordine di secondi .La risoluzione spaziale è invece determinata dalla misura del singolo voxel. Voxels di dimensioni ridotte offrono una migliore risoluzione temporale, ma contengono anche un minor flusso ematico, dando quindi luogo ad un segnale più debole.
La risposta emodinamica è rappresentata matematicamente dalla Haemodynamic Response
Function (HRF). La HRF è stata descritta in letteratura con diversi modelli, sia standard (es. HRF
canonica con doppia gamma) sia basis sets non standard (es. Finite Impulse Response, canonica HRF con derivate temporali).
1.2.2 Tecnica di acquisizione fMRI
In MRI si possono utilizzare diverse sequenze di acquisizione, in dipendenza dell’oggetto di interesse. Mentre le sequenze Inversion Recovery e Spin-Echo servono perlopiù alla misurazione di
T1 e T2, la sequenza gradient-echo (GE) ha alcune caratteristiche specifiche che la rendono particolarmente utile alla MRI funzionale. Si tratta di una sequenza veloce che permette di ridurre significativamente il tempo di acquisizione attraverso la riduzione del TR (tempo intercorrente tra due impulsi a RF) associata a una riduzione dell’ angolo di ribaltamento (“flip angle”) della magnetizzazione longitudinale M. La GE è caratterizzata da una singola eccitazione seguita da un gradiente applicato lungo l'asse di lettura (dephasing gradient), che modifica la fase degli spin in modo spazialmente dipendente; alla fine del gradiente il segnale è completamente annullato in quanto la coerenza tra gli spin sarà persa. Si applica quindi un gradiente di lettura di polarità contraria (rephasing). Quando l'area del gradiente di lettura sarà pari a quella del dephasing gradient, gli spin si troveranno ad avere una fase di nuovo coerente (a meno degli effetti del rilassamento T2*), e quindi un segnale sarà di nuovo rilevabile come eco9. La sequenza più spesso utilizzata per fMRI è la gradient-echo echo-planar imaging (GE-EPI), che permette di ottenere un immagine completa in circa 50-100 ms, in confronto ai molti secondi necessari con le sequenze standard convenzionali (funzionali).
1.2.3 Disegni sperimentali
I modelli sperimentali di fMRI hanno tratto ispirazione dall’utilizzo di altre metodiche di studio funzionale del sistema nervoso centrale. Il primo disegno sperimentale sviluppato deriva dalla PET cerebrale ed è denominato block design: stimoli uguali vengono ripetuti in blocchi, l’analisi statistica confrontava i valori medi di ciascun blocco. Nel block design il paziente può però andare incontro a fatica e abitudine, inficiando così il risultato osservato. Successivamente è stato implementato anche l’event-related design, tratto dagli studi con potenziali evocati. In questo disegno vengono proposti stimoli singoli, in ordine casuale o periodico, confrontando successivamente le singole risposte 10, evitando così fenomeni di fatica e abitudine. L’event related design permette di osservare caratteristiche precise della risposta HRF, quali onset e ampiezza, non definibili con il block design (fig. 7).
Fig. 7. Nel block design gli eventi appartenenti alla stessa condizione sono raggruppati insieme, e sono separati da un
blocco corrispondente allo stato di riposo. Nei paradigmi event related gli eventi appaiono in un ordine casuale e sono
presentati ad una distanza sufficientemente ampia in modo da evitare sovrapposizione delle risposte BOLD (modif da 8)
1.2.4 Preprocessing dei dati funzionali
I dati grezzi derivanti dalle sequenze GE-EPI richiedono una preliminare elaborazione allo scopo di minimizzare gli artefatti e aumentare il rapporto segnale/rumore. Molti di questi step possono essere effettuati tramite un software di analisi dati, quale FSL11:
Brain Extraction Tool (BET): metodo automatico per la segmentazione MRI in Brain e non-Brain (occhi, pelle, muscoli).
Slice scan time correction: esiste un minimo intervallo temporale (delay=tempo di rilassamento/numero slice), tra l’acquisizione dei diversi strati che costituiscono il volume di interesse. E’ necessario riallineare i dati ad uno stesso riferimento temporale tramite algoritmi di interpolazione temporale.
Motion correction: il metodo più usato a questo scopo consiste nella co-registrazione dei volumi di dati acquisiti in tempi successivi con il volume iniziale attraverso trasformazioni di corpo rigido (traslazioni e rotazioni sui 3 piani dello spazio) e successiva interpolazione spaziale.
Smoothing (filtraggio spaziale): metodica di filtraggio spaziale con funzioni matematiche gaussiane, in grado di aumentare il rapporto segnale/rumore. L’intensità in ciascun voxel viene sostituita dalla media pesata delle intensità dei voxel contigui.
Filtraggio temporale: si utilizzano filtri passa-alto e passa-basso allo scopo di eliminare sorgenti artefattuali di natura periodica a bassa frequenza (componenti fisiologiche e prodotte dal sistema) ed altra frequenza(componenti elettroniche).
vengono co-registrati con immagini anatomiche ad alta risoluzione acquisite durante la stessa sessione d’esame.
1.2.5 Analisi statistica dei dati
Un’esperimento fMRI richiede un disegno adeguato, costituito da un’alternanza di periodi di stimolo e periodi di rest ripetuti un numero sufficiente di volte, cosicchè la differenza di segnale fra le due condizioni correli in maniera significativa con la funzione di interesse. Sono state proposte varie metodiche di elaborazione dei dati fMRI con il fine di produrre Statistical Parametrical Maps
(SPM), che identifichino regioni cerebrali con cambiamenti significativi fra stimolo e rest.
L’approccio più frequentemente utilizzato è il General Linear Model (GLM), modello statistico inferenziale che prevede la definizione di un segnale atteso sulla base del paradigma sperimentale e dei corrispondenti predittori12. Il segnale atteso è dato dalla somma lineare dei singoli predittori, ciascuno corretto per la dinamica temporale della risposta emodinamica.
Il GLM può essere così espresso:
Y=X
1b
1+ X
2b
2+…….+ X
pb
p+e
Laddove Y è il valore osservato, X è la explanatory variable (conosciuta), b è il parametro (sconosciuto) ed e è l’errore residuo.
A sua volta Y può essere espresso come il vettore di una matrice dove ciascuna colonna rappresenta il valore di ciascun voxel a tempi diversi (design matrix):
Y=Xb+e
Il fine del modello GLM è l’individuazione del parametro b in ciascun voxel (Friston). Nel modello possono essere incluse quante explanatory variables vogliamo, definite regressori.
I regressori possono essere costituiti da variabili di interesse o da confounds, al fine di separare il segnale dal rumore. I regressori di interesse sono tipicamente ottenuti da convoluzioni (rappresentazioni matematiche di eventi di interesse) a loro volta espressione della canonica HRF o di altre non canoniche basis set (es. derivate temporali, Fourier basis set, Finite Impulse Response: FIR). La forma della HRF canonica deriva da osservazioni in regioni sensitive del cervello, quali V113, A114, S115. Presuppone una linearità fra attività neuronale e risposta BOLD, che è mantenuta se gli eventi in esame sono separati di almeno 2-5 secondi13. La linearità implica che forma ed
ampiezza di HRF dipendano solamente dal task in esame. In un sistema lineare il segnale al tempo t (predittore del time course del segnale BOLD e quindi explanatory variable) è definibile come:
X(t) = v(t) * h (t)
Dove v è la funzione stimolo ed h è HRF.
La scelta della rappresentazione matematica dell’evento di interesse è dettata dalla natura dell’evento stesso. La canonica HRF è in grado di fornire la massima sensibilità per eventi che si avvicinino a tale funzione; le altre basis set non convenzionali prescindono dalla definizione a priori della forma della risposta emodinamica e sono in grado di definire anche componenti che non rispondano a questa16. La scelta corrisponde al modello da testare, implicitamente comprendendo una serie di assunzioni sulla relazione fra lo stimolo, la risposta neuronale e il segnale emodinamico. Non è noto, ad esempio, se la HRF canonica possa essere il modello reale in condizione patologiche, quali il focus epilettogeno17.
Il GLM quindi confronta il time course del segnale acquisito in ogni voxel del volume di interesse con il segnale atteso attraverso un’analisi di varianza (ANOVA): i voxels in cui la varianza del segnale acquisito viene spiegata in maniera significativa dalla varianza del segnale atteso sono rappresentati in una SPM.
Esistono anche modelli statistici non inferenziali per l’analisi dei dati fMRI. Ad esempio la
Indipendent Component Analysis (ICA) non necessita di applicare un modello a priori18. Si tratta di una tecnica di analisi multivariata il cui fine è l’identificazione delle funzioni spaziali e temporali che meglio descrivono i dati osservati19. Nell’analisi ICA spaziale si ottiene un data set di pattern anatomici, ciascuno associato a un time course, che può essere valutato qualitativamente considerando la distribuzione anatomica che ci aspetteremmo in risposta al task in esame (es. attivazione area motoria primaria in un task motorio). Ne è possibile anche un’analisi quantitativa: il time course di ciascuna componente può essere messo in relazione a un definito paradigma di stimolo.
1.3 Le epilessie
1.3.1 Definizione ed epidemiologia
L'epilessia (dal greco επιληψία, "sono preso, sono colpito da qualcosa") è una condizione clinica caratterizzata da una predisposizione prolungata alla generazione di crisi epilettiche20. E’ operativamente definita dal ripetersi di almeno due crisi epilettiche non provocate21. La crisi epilettica a sua volta rappresenta il correlato clinico di una scarica eccessiva e/o ipersincrona di un gruppo di neuroni21.
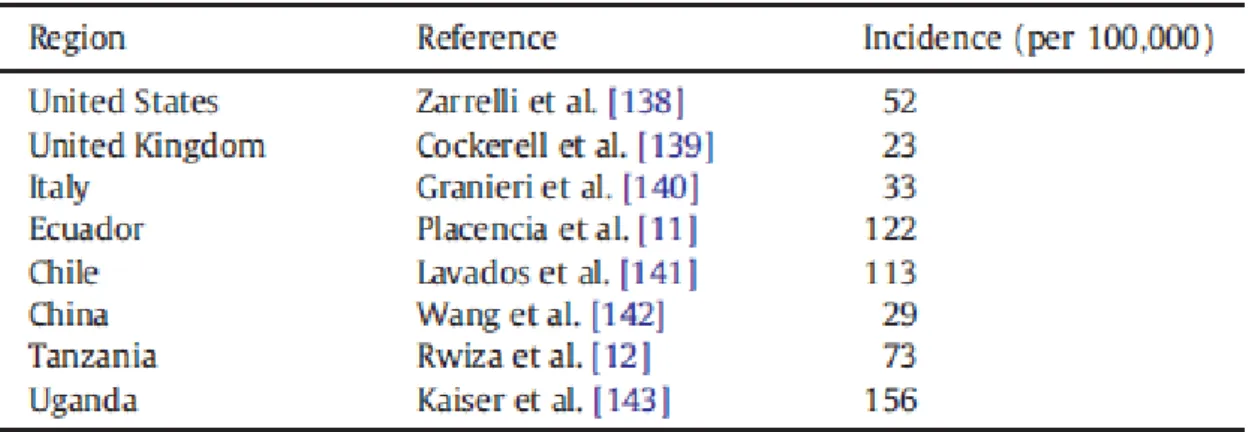
L'epilessia non è una patologia rara ed interessa più di 60 milioni di persone nel mondo22, 23. La prevalenza di epilessia attiva è stimata essere 4-10/1000 persone24. La prevalenza lifetime di crisi epilettiche è ancora più elevata: si stima che fino al 5% della popolazione possa avere una crisi epilettica non provocata nel corso della vita25. I valori di incidenza si attestano intorno a 40-70/100000 nei Paesi industrializzati, mentre sono più elevati (oltre 100/100000) in Africa e America Latina25-27.
Tab. 1 Incidenza di crisi ricorrenti non provocate in studi population-based (modif. da 27)
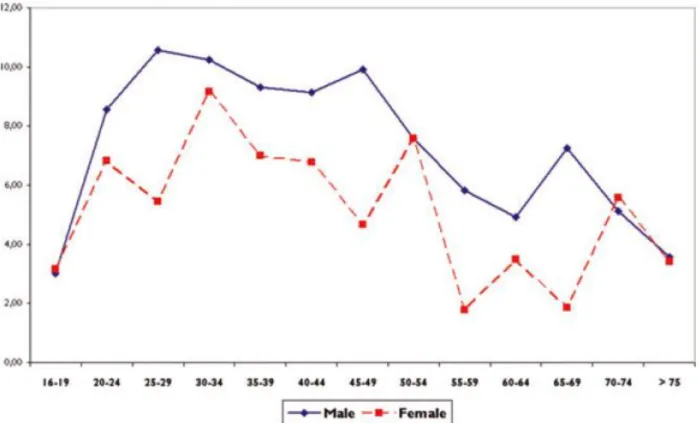
Prevalenza e incidenza di epilessia presentano un andamento bimodale nei Paesi Occidentali, con picchi in età avanzata e nell'infanzia28.
Fig. 8 Prevalenza di epilessia età e genere specifica in Europa (modif da 28)
1.3.2 Classificazione delle crisi epilettiche
La storia delle classificazioni delle crisi e delle sindromi epilettiche riflette i progressi metodologici e diagnostici che hanno avuto luogo negli ultimi 30 anni. I due sistemi classificativi sui quali si sono poi sviluppate diverse proposte di aggiornamento sono la classificazione delle crisi epilettiche del 1981 e la classificazioni delle epilessie e delle sindromi epilettiche del 1989.
La classificazione delle crisi epilettiche del 1981 è fondamentalmente basata sull’osservazione clinica ed elettroencefalografica e prescinde da considerazioni fisiopatologiche29. Distingue:
Crisi parziali : esordiscono in un solo emisfero
Semplici (coscienza preservata): la semeiologia dipende dalla sede del focus (es. motoria, sensitiva, autonomica)
Complesse (coscienza non preservata): possono essere precedute da aura (sintomi iniziali percepiti dal paziente), seguita da perdita del contatto con l’ambiente e talora automatismi
Secondariamente generalizzate: iniziano con sintomi focali e poi risultano in una crisi generalizzata tonico-clonica
Assenze: perdita improvvisa di contatto con l’ambiente. Durano pochi secondi e possono ripetersi più volte nella giornata. Possono essere tipiche o
atipiche.
Tonico-cloniche: costituite da fase tonica (contrazione tonica muscolatura striata, morsus, incontinenza urinaria, arresto del respiro, fenomeni autonomici) e fase clonica (contrazioni ritmiche muscolatura striata).
Miocloniche: breve contrazione di un muscolo di un gruppo di muscoli o di diversi gruppi di muscoli, ripetitiva o singola. Il recupero è immediato e il paziente spesso rimane cosciente. In concomitanza con la mioclonia l'elettromiografia mostra potenziali bifasici o polifasici della durata di 20-120 msec seguiti da una contrazione tonica o da un'atonia.
Toniche: contrazione tonica della muscolatura striata. Cloniche: scosse cloniche spesso irregolari e asimmetriche.
Atoniche: brusco cedimento posturale per improvvisa riduzione o abolizione del tono muscolare.
La classificazione delle epilessie e delle sindromi epilettiche del 1989 definisce invece alcune entità nosografiche caratteristiche secondo il seguente schema (tab. 2)30:
Tab. 2 Classificazione internazionale delle epilessie e delle sindromi epilettiche (modif. da 30)
Tale inquadramento permetteva anche una distinzione etiologica in epilessie sintomatiche (espressione di una noxa patogena sull’encefalo), idiopatiche (a causa sconosciuta) e criptogeniche (noxa patogena presunta ma non dimostrata)30.
In base a queste schematizzazioni sono state elaborate diverse proposte di aggiornamento, che hanno tenuto conto degli avanzamenti diagnostici, specie in ambito genetico e neuroradiologico. La International League Against Epilepsy ha istituito una task force, che nel 2010 ha avanzato una
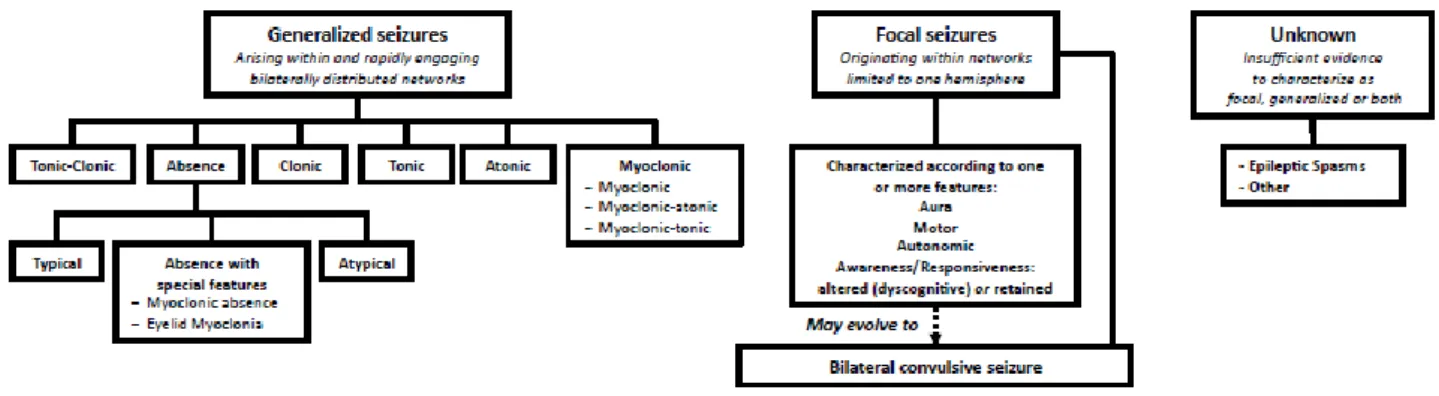
nuova proposta di classificazione 31. Innanzitutto è stata ridefinita la nomenclatura, rinominando ad esempio le crisi parziali in crisi focali ed eliminando la distinzione in semplici e complesse (fig. 9).
Fig. 9Schema della proposta di classificazione ILAE 201031
La nuova proposta ha inoltre rielaborato l’inquadramento etiologico classico, distinguendo forme ad etiologia genetica, strutturale-metabolica, sconosciuta. Il cambiamento terminologico è riassunto nella seguente tabella (tab. 3):
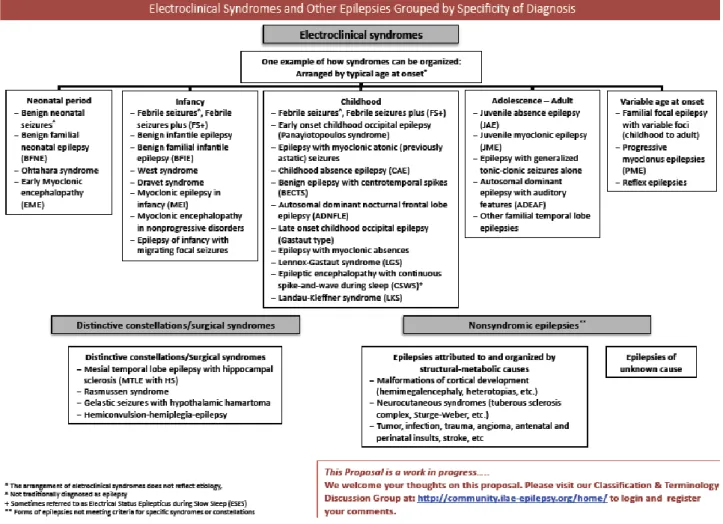
Infine la Task Force ha sistematizzato la classificazione elettroclinica delle epilessie (fig. 10):
Fig. 10 Proposta ILAE per la classificazione delle crisi e delle sindromi epilettiche 31
1.3.3 Etiologia delle epilessie
Ogni evento patologico a carico della corteccia cerebrale può teoricamente dar luogo a crisi epilettica. I fattori di rischio per epilessia sono quindi molteplici e dipendono fondamentalmente dall’interazione fra suscettibilità genetica ed agenti ambientali.
Nella maggior parte delle epilessie non è possibile identificare una etiologia specifica32 (tab.4).
Nell’ambito delle epilessie sintomatiche i fattori etiologici preponderanti nei Paesi Occidentali sono gli accidenti cerebrovascolari, i traumi cranici, i tumori cerebrali, le cause congenite (traumatiche, malformative, ereditarie)25.
In ogni caso i fattori genetici rivestono un ruolo importante; possono essere direttamente responsabili di epilessie geneticamente determinate, isolate o nel contesto di forme sindromiche, oppure possono modulare la suscettibilità a insulti epilettogeni33. In alcuni casi le epilessie idiopatiche sono vere e proprie malattie monogeniche, in cui un difetto genetico ben definito determina alterazioni nella eccitabilità neuronale; molto spesso le epilessie monogeniche sono
canalopatie34.
In altri casi il contributo genetico rappresenta un fattore predisponente; in questo senso sono state identificate molte microdelezioni ritenute fattori di suscettibilità35.
E’ ormai noto come i fattori genetici, siano essi causativi o predisponenti, rappresentino il principale substrato delle epilessie generalizzate idiopatiche, definite dalla proposta di classificazione del 2010 “epilessie generalizzate su base genetica” 31.
1.3.4 Le epilessie generalizzate idiopatiche (IGE)
Le epilessie generalizzate idiopatiche (IGE) rappresentano il 20-30% di tutte le epilessie36. La nuova denominazione di epilessie generalizzate genetiche deriva dal fatto che queste forme presentano una forte componente genetica, e non sono in genere accompagnate da disabilità neurologica36. L’architettura genotipica delle IGE probabilmente rappresenta un continuum biologico, nel quale una piccola frazione (1-2%) è rappresentata da forme monogeniche, mentre la maggioranza dei pazienti presenta una suscettibilità oligo/poligenica37. Tipicamente sono presenti crisi generalizzate (tonico-cloniche, assenze, crisi miocloniche) ricorrenti e non provocate, ad insorgenza età –correlata, in assenza di lesioni strutturali dell’encefalo o di disturbi metabolici30, 31. Le forme più comuni sono l’epilessia con assenze dell’infanzia, l’epilessia con assenze del giovane, l’epilessia mioclonica giovanile, e l’epilessia con sole crisi generalizzate tonico-cloniche38
. L’EEG è tipicamente caratterizzato da punte/polipunte-onda ad espressione diffusa, spesso precipitate da iperventilazione e deprivazione di sonno. Le scariche possono essere talora associate a manifestazioni cliniche39, 40. Il trattamento è estremamente specifico, dal momento che AEDs utili nelle crisi focali possono essere deleteri nelle IGE41. Le IGE costituiscono quindi un complesso nosologico piuttosto omogeneo, nel contesto del quale si possono individuare sindromi specifiche.
1.4 Epilessia mioclonica giovanile (JME)
1.4.1 Definizione e caratteristiche cliniche
La JME rappresenta una sindrome elettroclinica nell’ambito delle IGE. Sebbene il primo caso riportato risalga al 186742, 43, la caratterizzazione sindromica è stata sistematizzata negli anni ’50 da Dieter Janz44. Il cosiddetto piccolo male impulsivo assunse così anche l’eponimo di sindrome di
Janz. Nel 1975 la International League Against Epilepsy ha ufficialmente adottato il termine epilessia mioclonica giovanile45, che rappresenta attualmente la denominazione ufficiale. La JME insorge generalmente nella pubertà ed è caratterizzata da mioclonie bilaterali, singole o ripetitive, aritmiche e irregolari, prevalenti agli arti superiori, generalmente non associate a perdita di coscienza30. Sono spesso presenti anche crisi tonico-cloniche; in un terzo dei casi possono essere associate anche assenze46. Quando sono presenti, le assenze precedono per età di esordio le mioclonie, che a loro volta sono seguite dalle crisi tonico-cloniche. La prevalenza della JME si attesta intorno a 0.5-1:1000 persone, rappresentando il 5-10% di tutte le epilessie47. La componente genetica è ben riconosciuta. Circa un terzo dei pazienti presenta familiarità per epilessia, con una lieve prevalenza femminile. Nella maggior parte dei casi esiste una ereditarietà complessa in cui si pensa giochino un ruolo fondamentale mutazioni a tipo Polimorfismo di Singolo Nucleotide (SNPs) o microdelezioni48. Sono documentate famiglie con mutazioni monogeniche e ereditarietà autosomico dominante a penetranza incompleta48, specie in geni codificanti canali ionici, come
CACNB4 (subunità beta4 canali del calcio), GABRA1 (subunità recettore GABA), CLCN2 (subunità
canale del cloro). Sono inoltre riportati casi di mutazioni nel gene della mioclonina (EFHC1) nel sito EJM1 a 6p12-p1148, 49.
Talora il fenotipo JME viene ereditato nel contesto di forme sindromiche differenti: nell’ambito di una stessa famiglia possono essere presenti soggetti con JME, epilessia con grande male al risveglio, assenze dell’infanzia e altre forme ancora48
. La recente applicazione di metodiche tipo Genome Wide Association Studies (GWAS) a famiglie con ereditarietà complessa ha permesso di meglio caratterizzare queste forme complesse, identificando loci di suscettibilità per IGE a 5q34 e per crisi miocloniche specificatamente a 2q3437.
Nella JME le crisi sono particolarmente sensibili alla deprivazione di sonno, all’alcol, alla stimolazione luminosa50 e frequentemente possono essere indotte da task cognitivi (es. concentrazione mentale, calcolo, lettura) e da compiti motori delle mani51, 52. Ci sono evidenze che i pazienti possano presentare tratti di personalità e talora lievi deficit cognitivi imputabili a disfunzione dei lobi frontali53, 54. Farmaco di prima scelta è il valproato, seguito da lamotrigina, levetiractam, clonazepam, mentre zonisamide e topiramato sono solo parzialmente efficaci55. Spesso il farmaco adatto rende il paziente seizure free, ma il rischio di recidiva alla sospensione
della terapia è piuttosto alto, intorno all’80%56, 57
. Dal punto di vista elettroencefalografico la sindrome è contraddistinta dalla presenza di anomalie a tipo punta e polipunta-onda ad espressione diffusa58 e dalla frequente presenza di fotosensibilità; le anomalie interictali possono rispondere agli stessi fattori provocativi descritti per le crisi59
1.4.2 Fisiopatogenesi
Per definizione le indagini di neuroimaging sono negative all’ispezione visiva canonica, come nelle altre IGE. L’avvento di metodiche avanzate MRI ha però modificato questa concezione. Da lungo tempo è noto come nella corteccia cerebrale, cerebellare e nell’ippocampo di pazienti con JME possano essere presenti neuroni parzialmente distrofici, tanto da ipotizzare una microdisgenesia, intesa come minima anomalie di sviluppo cerebrale60. Sono descritte anche alterazioni microstrutturali della corteccia cerebrale rilevate con tecniche MRI quantitative. La maggior parte delle evidenze suggeriscono alterazioni microstrutturali a carico della corteccia frontale mesiale (area supplementare motoria) e del cingolo posteriore61-64.
Anche le strutture sottocorticali sembrano avere un ruolo importante. Diversi Autori hanno ipotizzato alterazioni nel circuito talamo-corticale, descrivendo alterazioni volumetriche e microstrutturali a carico del putamen65 e del talamo66, in aggiunta a alterazioni nella diffusività della sostanza bianca delle fibre di associazione talamo-corticali67, 68. Ulteriori evidenze derivano dall’osservazione che le anomalie microstrutturali potrebbero rappresentare anomalie del folding corticale in diverse regioni dell’encefalo, come se possano essere presenti sottili e precoci anomalie dello sviluppo corticale69. Le evidenze neuroradiologiche hanno spinto molti Autori a considerare la JME come espressione di una disfunzione talamo-corticale ad origine prevalentemente frontale70. Studi neurofisiologici suggeriscono che nelle IGE le crisi generalizzate possano avere genesi focale, dal momento che la stimolazione unilaterale della corteccia frontale mesiale è in grado di provocare assenze e crisi tonico-cloniche71. D’altra parte, il fenotipo EEG polipunta, caratteristico della JME, presenta importanti similitudini neurofisiologiche con i fusi del sonno, che hanno notoriamente origine talamo-corticale72. Nel contesto di questa circuiteria è stata proposta la cortical focus
theory73: secondo questa ipotesi nelle IGE sfumate alterazioni corticali potrebbero essere il primum movens, mentre il talamo, grazie alle sue ampie connessioni, sarebbe responsabile della diffusione e del mantenimento della scarica epilettiforme. Lunghe fibre di associazione costituite da sostanza bianca costituirebbero le vie di diffusione fra regioni distanti74, con una particolare iperconnettività del sistema motorio nella JME, probabilmente in relazione alla frequente azione attivante dei tasks cognitivi e motori sulle crisi miocloniche75. Avanzini et al. hanno successivamente proposto di considerare la JME una epilessia di sistema, che riflette la patologica espressione (ictogenesi) di un
sistema neurale la cui attività integrata è normalmente deputata a funzioni fisiologiche76. Secondo Avanzini la JME sarebbe espressione di una disfunzione nel sistema coinvolgente aree motorie, premotorie, e sottocorticali (talamiche). I meccanismi oscillatori del talamo potrebbero agire da trigger delle polipunta corticali associate alle crisi miocloniche; scariche particolarmente intense e prolungate potrebbero dar luogo a crisi tonico-cloniche76. Infine diversi Autori hanno descritto anomalie volumetriche o di folding a carico della corteccia occipitale69, 77, suggerendo una possibile associazione tra questa osservazione e la frequente presenza di fotosensibilità in JME.
1.5 L’elettroencefalogramma (EEG)
1.5.1 Origine del segnale elettroencefalografico
L’Elettroencefalogramma (EEG) è una metodica inventata nel 1929 da Hans Berger in grado di misurare l’attività elettrica cerebrale a livello dello scalpo; l’EEG registra le modificazioni del potenziale elettrico extracellulare (potenziale di campo), in seguito all’attività dei neuroni corticali e in minor parte della glia78.
Le cellule neuronali attivate generano correnti elettriche trans membrana con due meccanismi: una depolarizzazione rapida delle membrane (responsabile del potenziale di azione, mediata da correnti voltaggio-dipendenti) e una depolarizzazione lenta (attivazione sinaptica, mediata da neurotrasmettitori)79. I neuroni piramidali presentano una disposizione spaziale (a palizzata con dendriti rivolti verso la superficie) e caratteristiche di membrana tali da costituire “dipoli di corrente”. Il segnale EEG non deriva però dai potenziali di azione, che tendono ad essere asincroni, ma principalmente da eventi più lenti, come i potenziali post-sinaptici e dalle oscillazioni “collettive” del potenziale di molti neuroni (come quelle generate da correnti transmebrana con effetto “pace-maker”), che sono in grado di raggiungere l’ampiezza e il sincronismo necessario per divenire registrabili con l’EEG78, 79
. Le correnti cellulari sono dell’ordine di microVolt e devono essere amplificate un milione di volte per poter essere registrate e analizzate dallo scalpo. Il segnale elettrico raccolto dagli elettrodi viene inviato tramite un cavo schermato ad una testina di amplificazione e poi inviato all’elettroencefalografo propriamente detto; questo può essere analogico (trascrive, per mezzo di penne scriventi, su carta che scorre a una velocità costante) o digitale. Il tracciato così ottenuto è costituito da una successione di onde sinusoidali rappresentanti la differenza di potenziale generata dai neuroni sotto agli elettrodi registranti. I potenziali rilevabili tramite EEG sono quelli che fluiscono perpendicolarmente rispetto allo scalpo, diversamente dalla magnetoelettroencefalografia (MEG) nella quale è possibile misurare anche potenziali paralleli allo scalpo80.
1.5.2 Caratteristiche dell’EEG
La risoluzione temporale dell’EEG è ottima (dell’ordine di millisecondi) mentre la risoluzione
spaziale presenta notevoli limiti81. Un elettrodo di superficie registra un’area sottostante di diversi
cm quadrati. Inoltre la propagazione dell’attività elettrica lungo vie fisiologiche o attraverso volumi di conduzione (parenchima cerebrale, liquor cefalorachidiano, teca cranica) può dare luogo a false localizzazioni. Il campionamento spaziale dell’EEG è incompleto, dal momento che larghe aree corticali, specie nelle regioni basali e mesiali, non sono coperte dagli elettrodi di superficie82.
1.5.3 Ritmi fisiologici di veglia nell’adulto
Il tracciato EEG è costituito da onde che si caratterizzano per frequenza , ampiezza e morfologia.La frequenza è il numero di onde che si succedono nel tempo di un secondo, espressa in Hertz (Hz). Ciascun grafoelemento è caratterizzato da una morfologia propria (es. punte, onde trifasiche).Per
attività si intende ogni onda EEG o una qualsiasi sequenza di onde. L’attività di fondo è definita in
base alla frequenza e rappresenta la base su cui appare un quadro normale o patologico, dalla quale questo si differenzia. Le attività prendono il nome di ritmo quando sviluppano periodicità ed ampiezza stabili e forma costante. La reattività consiste nella modificazione del tracciato in risposta a stimoli (apertura degli occhi, stimolazione luminosa, rumori, stimoli tattili, ecc.)
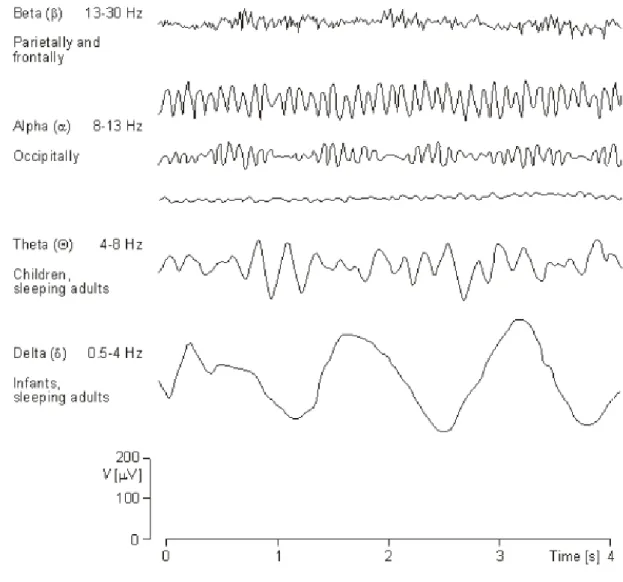
I ritmi EEG che possono essere osservate in veglia sono le seguenti (fig. 11):
Ritmo alfa (8-12,5 Hz): EEG di veglia quieta, a occhi chiusi, maggiore rappresentazione sule regioni posteriori. Tipicamente reattivo all’apertura degli occhi (reazione di arresto). Ampiezza media 30 microVolt (15-45 microVolt). Morfologia perlopiù regolare o fusiforme. Può presentarsi anche come subarmoniche del ritmo fondamentale. Le onde alfa sono originate a livello corticale, prevalentemente dalla corteccia parietale ed occipitale, e sono probabilmente modulate dal pulvinar talamico; nella corteccia visiva l’origine del dipolo elettrico sembra essere a livello del soma e dei dendriti delle cellule piramidali degli strati IV e V, specialmente in prossimità della scissura calcarina83 .
Ritmo beta (13-30 Hz): attività beta di bassa ampiezza (<30 microVolt), normalmente presente nell’EEG normale di veglia dell’adulto, con prevalenza anteriore. L’attività beta è correlata a processi mentali e cognitivi di vario tipo e sostituisce il ritmo alfa anche sulle regioni posteriori all’apertura degli occhi (reazione di arresto). Evidenze sperimentali suggeriscono un’origine corticale del ritmo beta , specie a livello della corteccia somatosensoriale, con una possibile modulazione da parte dei nuclei intralaminari del talamo84.
Ritmo delta (<4 Hz): assente in condizioni di veglia nel soggetto normale. Voltaggio medio 150 microVolt.
Ritmo theta (5-7,5 Hz): talora presente fisiologicamente sulle regioni temporali nella veglia del soggetto adulto. Voltaggio medio 100 microVolt.
Ritmo gamma (30-80 Hz): banda di frequenze generalmente non visibile sull’EEG standard. E’ ormai noto che il ritmo gamma sia presente con continuità nell’attività EEG , specie durante veglia e sonno REM, ma sia mascherato dagli altri ritmi cerebrali. Il ritmo gamma era ignoto prima dell’avvento dell’EEG digitale, in quanto l’EEG analogico tagliava tutte le frequenze superiori a 25 Hz. Alcuni Autori hanno suggerito che sia espressione di attività cognitive superiori e che la sincronizzazione di diverse aree cerebrali nella banda gamma sia necessaria nel produrre un contenuto di coscienza complesso e unitario (es. la percezione) (binding
problem)85-87 e possa anche essere correlato alla meditazione e a stati di coscienza focalizzati88.
1.5.4 Attività EEG epilettiforme
Le attività EEG epilettiformi vengono distinte in89:
Punta (spike): grafoelemento chiaramente distinto dall’attività di fondo, con apice puntuto e durata compresa fra 20 e 70 msec. La componente principale è generalmente negativa. Onda aguzza (sharp wave): grafoelemento chiaramente distinto dall’attività di fondo, con
apice puntuto e durata compresa fra 70 e 200 msec. La componente principale è generalmente negativa.
Poli-punta (polyspikes): due o più punte in serie.
Complesso punta-onda (spike and wave): pattern costituito da una punta seguita da una onda lenta (che ha ampiezza maggiore della punta).
1.5.5 EEG nelle epilessie generalizzate idiopatiche (IGE)
L’elettroencefalogramma rappresenta un importante ausilio nella classificazione sindromica delle epilessie. In particolare l’EEG è utile nella classica distinzione fra epilessie focali e generalizzate. L’hallmark delle IGE è rappresentato dalla punta, dalla poli-punta onda e dalla punta-onda generalizzata, bilaterale, sincrona e simmetrica inscritta su una normale attività background90, 91. Diversamente dalle epilessie focali la sola morfologia dei grafoelementi non permette di distinguere anomalie critiche ed intercritiche; per tale distinzione il correlato clinico è imprescindibile90.
Le anomalie intercritiche permettono di sospettare la diagnosi sindromica di una IGE specifica: Epilessia a tipo assenze del bambino (Childhood Absence Epilepsy: CAE): punta-onda
bilaterale, sincrona, simmetrica, alla frequenza di 3 Hz30.
Epilessia a tipo assenze giovanili (Juvenile Absence Epilepsy: JAE): punta-onda bilaterale, sincrona, simmetrica generalmente a una frequenza leggermente superiore alla CAE: 3,5-4 Hz30.
Epilessia mioclonica giovanile (Juvenile Myoclonic Epilepsy: JME): Il tracciato interictale è costituito da un mix irregolare di punte/polipunta-onda a 3-6 Hz con frammentazione interscarica92, 93. Si possono osservare anche complessi polipunta-onda rapidi (>3,5 Hz) e meno frequentemente punta-onda a 3 Hz93. Sono descritte anche anomalie focali92.
Epilessia con crisi di grande male al risveglio (Epilepsy with Grand Mal Seizures on Awakening: EGMA): anomalie con caratteri simili alla JME94.
Epilessia con assenze miocloniche (Epilepsy with Myoclonic Abscences: EMA): punta-onda generalizzata95.
Epilessia con crisi miocloniche astatiche (Epilepsy with Myoclonic Astatic Seizures: Doose Syndrome): punte-onda generalizzate a 2-3 Hz irregolari o interrotte da onde lente, talora poli-punta onda96.
Altre sindromi non riconosciute nella classificazione ufficiale presentano alcuni caratteri suggestivi, quali punta e polipunta-onda rapide nella perioral mioclonia with absences o nella sindrome di Jeavons97-99.
La maggior parte degli studi sulla fisiopatologia delle anomalie intercritiche nelle IGE riguarda le
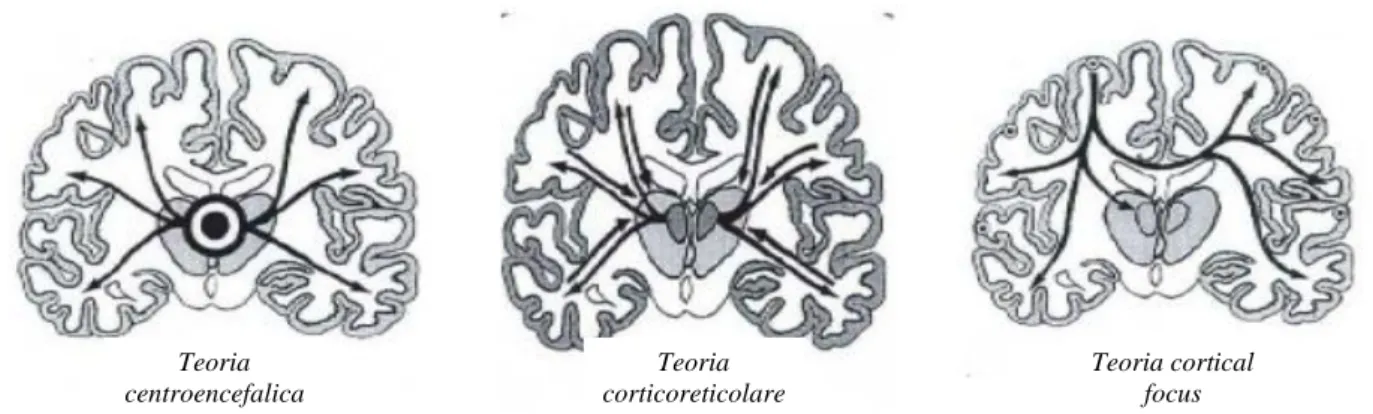
assenze del bambino, ritenute prototipo elettroclinico delle epilessie generalizzate73 (fig. 12). Penfield e Jasper proposero negli anni ’50 la teoria centro encefalica, secondo la quale esisterebbe un pacemaker nel tronco dell’encefalo e nel diencefalo responsabile della attività critica100
. Questa idea è stata quindi sviluppata con la teoria corticoreticolare101, che suggeriva la presenza di una circuiteria critica talamo-corticale, e con la talamic clock theory, che postulava la presenza di un pacemaker nel nucleo reticolare del talamo102. Altri Autori hanno invece proposto che l’origine della punta-onda risieda nella corteccia cerebrale, con il talamo coinvolto solo secondariamente (cortical focus theory)73. Ci sono inoltre evidenze di similitudini fra punta-onda e fusi del sonno (grafo elementi fisiologici del sonno NREM): è stato proposto che il network cortico-talamo-corticale sia lo stesso, ma il trigger sarebbe cortico-talamo-corticale per le punta-onda, talamico per i fusi del sonno103. Nell’animale questo trigger è stato individuato nella regione periorale della corteccia somatosensoriale, ma ulteriori studi sono necessari nell’uomo104.
Fig. 12 Ipotesi fisiopatogenetiche su assenze dell’infanzia
Secondo la classifica definizione di Weir105 la punta-onda è fondamentalmente costituita da quattro componenti: punta 1 (polarità negativa, ampiezza 25-50 microVolt, durata 10 ms), positive transient (circa 100-150 ms), punta 2 (principale componente, polarità negativa, durata 30-60 ms), onda lenta
Teoria centroencefalica Teoria corticoreticolare Teoria cortical focus
(cupoliforme, polarità negativa, durata 150-200 msec). Studi EEG-source hanno individuato sulle regioni anteriori e centrali l’origine delle prime tre componenti, esclusivamente sulle regioni centrali l’origine dell’onda106
.
Nelle IGE è talora possibile riscontrare caratteri elettroencefalografici atipici. In particolare diversi Autori hanno descritto anomalie focali in pazienti con epilessie generalizzate; la prevalenza sembra essere circa il 30% dei casi107-109.
1.5.6 Prove di attivazione nell’EEG standard
Iperventilazione: storicamente primo metodo utilizzato in EEG, particolarmente efficace nell’evocare anomalie critiche e intercritiche nelle assenze del bambino110.
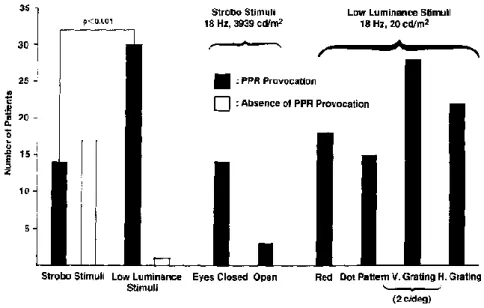
Stimolazione luminosa intermittente (SLI): efficace prevalentemente nell’elicitare anomalie generalizzate, in minor modo anomalie focali. Sebbene sia la metodica più facilmente standardizzabile, esiste una grande diversità metodologica di esecuzione.
La metodica attualmente accettata è quella recentemente proposta da Kasteleijn-Nolst Trenité et al.111, sintetizzata nei seguenti punti:
SLI prima dell’iperpnea o dopo almeno di 3 minuti.
Flashes di intensità pari ad almeno 0,70 Joule con stimolatore a distanza di 30 cm.
Determinazione della fotosensibilità in 3 diverse condizioni (chiusura degli occhi, occhi chiusi, occhi aperti) per ciascun treno di flashes.
Treni di flashes di durata 5 secondi.
Utilizzo delle seguenti frequenze di flashes nell’ordine elencato: 1-2-8-10-15-18-20-25-40-50-60 Hz.
In caso di risposta fotoparossistica (PPR) generalizzata a una delle suddette frequenze (soglia inferiore) saltare le frequenze successive e ripartire da 60 Hz scendendo gradualmente fino all’occorrenza di nuova PPR generalizzata (soglia superiore).
1.6 La fotosensibilità
1.6.1 Definizione
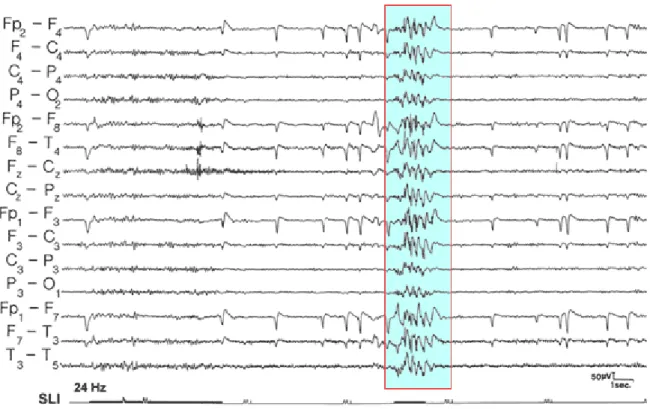
La fotosensibilità è un endofenotipo fortemente ereditario, che si manifesta all’EEG come presenza di punte, polipunte e/o punta-onda in risposta a stimoli visivi (risposta foto parossistica: PPR)112 (fig. 13).
La PPR può essere distinta in base alla topografia sullo scalpo113:
PPR posteriore stimolo-dipendente: i grafoelementi patologici sono strettamente correlati alla frequenza dello stimolo luminoso e si manifestano sulle regioni posteriori.
PPR posteriore stimolo-indipendente: la risposta patologica perdura anche al termine della stimolazione luminosa ed è localizzata sulle regioni posteriori.
PPR generalizzata: i grafoelementi patologici sono diffusi a tutto lo scalpo e possono o meno essere automantenersi al termine della stimolazione luminosa.
Fig. 13 Esempio di risposta fotoparossistica (PPR)
Deve essere distinta dal fisiologico fototrascinamento (comparsa in sede occipitale di un’attività ritmica, sincrona con lo stimolo luminoso, la cui frequenza quindi è la stessa di quella della SLI o può rappresentarne un’armonica) e dalla risposta fotomiogenica (comparsa graduale, ad occhi
chiusi, di un’attività puntuta di origine muscolare dovuta a contrazione ritmica dei muscoli orbito-frontali, strettamente legata alla frequenza dei flashes) (fig. 14).
Fig. 14 Esempi di fototrascinamento (in verde) e risposta fotomiogenica (in giallo)
1.6.2 Storia della fotosensibilità
Crisi epilettiche indotte da stimoli luminosi sono descritte fino dall’antichità classica114, 115
. Ancor prima che le metodiche neurofisiologiche permettessero un inquadramento sistematico, era noto come la luce potesse essere un fattore scatenante le crisi. Nel XIX secolo Gowers riportava il caso di una giovane donna con crisi dopo esposizione a luce solare intensa116, 117. L’avvento dell’EEG negli anni ’30 del XX secolo pose le basi per uno studio obiettivo dei fenomeni elettrofisiologici cerebrali117. Il gruppo di Gastaut iniziò nel 1948 ad utilizzare una lampada stroboscopica per produrre una stimolazione luminosa intermittente (SLI)118. Da allora lo studio neurofisiologico della fotosensibilità ha suscitato sempre maggiore interesse, anche perché la diffusione della televisione e successivamente dei computer ha dato luogo ad alcune problematiche cliniche con ampio risalto mediatico. La prima crisi TV-indotta è stata riportata negli anni ‘50 da Livingston119. Nello stesso periodo Bickford descriveva per primo crisi indotte da pattern luminosi120. Ancora Gastaut, negli anni ’60, studiò sistematicamente una serie di 35 pazienti che avevano presentato crisi davanti a uno schermo televisivo121. La fotosensibilità ha definitivamente assunto risonanza pubblica negli ultimi 30 anni, soprattutto a causa del diffondersi di stimolazioni luminose artificiali. Negli anni ’80 infatti un ragazzo presentò una crisi mentre guardava una puntata di uno show TV statunitense chiamato “Captain Powers”, nella quale abbondavano flashes ad elevata frequenza122
. Nel 1981 Rushton scrisse una lettera a The Lancet in cui riportava il primo caso di crisi epilettiche davanti a videogioco123. Altri Autori riportarono casi analoghi in Europa e nel Regno Unito124, 125. Nel 1993 comparve sugli schermi televisivi britannici una pubblicità detta “Golden Wonder, Pot Noodle”, nella quale erano presenti flashes a rapida frequenza; alla prima messa in onda tre persone presentarono crisi epilettiche. Nel contempo Ferrie pubblicò una review sulla “videogame epilepsy”,
in cui specificava che nella maggior parte dei casi i pazienti erano affetti da IGE e spesso presentavano scosse miocloniche126.
Questi eventi ebbero tale risonanza che diverse autorità regolatorie furono spinte ad emanare raccomandazioni in merito alla luce emessa da schermi TV e computer122.
Nel settembre 1993, sotto gli auspici della British Epilepsy Research Foundation, fu condotta una consensus conference sulla videogame epilesy127. Nel 1994 la UK Independent Television
Committee dettò procedure di safety, successivamente aggiornate nel 1999 e nel 2001; e
sostanzialmente concordanti con le linee guida della National Association of Commercial
Broadcasters in Japan and Nippon Hoso Kyokai; le diverse linee guida specificano che schermi
televisivi e computer dovrebbero evitare di produrre flickers o pattern alternanti a frequenze superiori a 3 Hz, specie se di colore rosso. Anche le Nazioni Unite hanno concordato con questi suggerimenti attraverso la International Telecommunications Union (ITU)128.
Queste raccomandazioni hanno tratto ispirazione anche da un clamoroso evento mediatico, definito “pocket monster incident”: nel dicembre 1997 circa 700 bambini giapponesi presentarono crisi epilettiche durante la visione di un episodio della serie TV Pokemon "Dennō Senshi Porygon" in cui era presente una lunga sequenza di flickers luminosi129-131.
1.6.3 Epidemiologia ed etiologia
La fotosensibilità è classicamente intesa come endofenotipo epilettico. La presenza di PPR, specie se generalizzate e stimolo indipendenti, è infatti associata con epilessia in circa il 95% dei casi132. La fotosensibilità è ben documentata anche in soggetti sani, specialmente bambini e giovani donne133, 134. Nella popolazione generale la prevalenza è circa 1:4000127, 135, 136 (1-10% nell’adulto137, può raggiungere il 20% nel bambino, con prevalenza femminile138). Il picco di incidenza sembra essere la tarda infanzia e la prima adolescenza139. Il fenomeno può scomparire in assenza di trattamento fra i 16 e i 32 anni nel 30% dei casi140. Il significato fisiopatogenetico della fotosensibilità può variare a seconda dell’età di insorgenza. Nei soggetti più giovani è spesso espressione di una predisposizione genetica, mentre nei pazienti adulti può talvolta essere una condizione acquisita (es. disturbi metabolici sistemici o sospensione di farmaci psicotropi). L’evidenza di una componente genetica deriva principalmente da studi su gemelli e famiglie. Gemelli monozigoti presentano una concordanza prossima al 100% e studi familiari suggeriscono un ereditarietà autosomico dominante con penetranza ridotta età-dipendente141 Loci putativi sono stati individuati sul cromosoma 2,6,7 e 16. Specificatamente è stato riscontrato un linkage a 7q32 e
16p13 in famiglie con PPR e epilessia mioclonica142. Il contributo di fattori etnici e razziali non è ben definito e sono stati riportati risultati contrastanti143, 144.
La fotosensibilità è nettamente ridotta in condizioni di sonnolenza o sonno NREM, mentre aumenta nel sonno REM145. La deprivazione di sonno invece è un potente trigger146.
Diversi lavori sono stati pubblicati sull’effetto della terapia antiepilettica. Classicamente si riteneva che l’acido valproico abolisse o attenuasse nettamente la PPR136
; recentemente invece Muhle et al. hanno osservato come il valproato non influenzi le anomalie foto-indotte, mentre è efficace su quelle spontanee147, suggerendo una differente fisiopatologia sottostante i due diversi tipi di alterazioni EEG. Esistono poi reports di efficacia del levetiracetam sia sulle anomalie intercritiche spontanee, sia sulla PPR, in epilessia mioclonica giovanile148.
1.6.4 Correlati clinici della risposta alla stimolazione luminosa
La SLI può indurre una grande varietà di sintomi clinici149: Sintomi soggettivi lievi: visione di linee irregolari o di colori; allucinazioni visive semplici o complesse; nausea, vertigini, etc. Questi sintomi possono avere natura epilettica, ma spesso sono del tutto aspecifici.
Risposta fotomiogenica orbito-frontale: correlata ad artefatti fotomiogenici sull’EEG, ha presumibilmente il significato di un mioclono riflesso corticale. E’ costituita da contrazione ritmiche dei muscoli periorbitali bilaterali e sincrone, indotte da flashes, a comparsa dopo 50-60 ms dallo stimolo luminoso con immediata cessazione al termine dello stesso.
Sintomi critici di tipo epilettico:
o mioclonie palpebrali: spesso nell’ambito della sindrome da assenze con mioclonie
palpebrali, talora associate a perdita di contatto con l’ambiente.
o mioclonie generalizzate: scatti mioclonici che coinvolgono capo, tronco, o arti. o crisi di assenza.
o crisi generalizzate tonico-cloniche.
o crisi focali: nei pazienti con crisi fotoindotte un esordio focale è dimostrabile fino al 65% dei casi, spesso con sintomi visivi semplici o complessi
1.6.5 Fisiopatologia
La genesi della fotosensibilità nell’essere umano e nell’animale sembra essere eminentemente corticale150, 151, con coinvolgimento prevalente delle aree occipitali e fronto-rolandiche152. Le crisi epilettiche, così come le anomalie interictali, presuppongono la sincronizzazione di larghi networks neuronali. La SLI recluta primariamente il sistema visivo, che sembra essere coinvolto sia nella sua
sede primitiva di insorgenza della scarica epilettica. Studi di neurofisiologia hanno dimostrato che la SLI determina un’attività epilettiforme nella corteccia visiva controlaterale, seguita dal coinvolgimento dell’area motoria primaria cui corrisponde la comparsa di mioclono foto-indotto 154-158. E’stato inoltre ipotizzato che la diffusione della scarica in regione soprasilviana possa dar luogo
a crisi generalizzate tonico-cloniche, mentre il coinvolgimento delle aree sottosilviane possa causare crisi parziali complesse113.
Le anomalie foto-indotte insorgono probabilmente dall’esagerazione di fisiologici meccanismi di processazione di input visivi, che in qualche modo determinano una improvvisa ed eccessiva sincronizzazione neuronale. Il trigger delle crisi sembra coinvolgere neuroni in uno o entrambi gli emisferi, con il raggiungimento di una “massa critica” neuronale159, 160
. Studi di magnetoelettroencefalografia (MEG) hanno riportato un incremento della sincronia delle armoniche nella banda gamma nelle epilessie fotosensibili161. Tale sincronizzazione sembra essere correlata alla frequenza di SLI e precedere le anomalie foto-indotte162. Probabilmente ciò riflette una perdita del controllo da parte del cervello sui fenomeni oscillatori ad alta frequenza, che normalmente sono in funzione per connettere transitoriamente differenti aree neuronali163, 164.
Ulteriori specifiche sulla suscettibilità epilettica della corteccia visiva derivano dallo studio dei Potenziali Evocati Visivi154, 165. Nei soggetti fotosensibili i neuroni della corteccia visiva sembrano presentare caratteristiche funzionali predisponenti allo sviluppo di crisi. Porciatti et al.165 hanno dimostrato che pazienti fotosensibili mancano del meccanismo gain control per stimoli a pattern di bassa frequenza temporale ed alta luminanza, suggerendo un link tra fotosensibilità e alterazione dei meccanismi di percezione visiva.
La soppressione del meccanismo gain control può essere effettuata con bicucullina, cosicchè si è ipotizzata una disfunzione GABAergica nella genesi della fotosensibilità166. E’ stato comunque suggerito il coinvolgimento anche di altri sistemi neurotrasmettitoriali, in particolare quello dopaminergico167-169.
L’iperccitabilità della corteccia visiva è supportata da altre evidenze sperimentali. La corteccia visiva, rappresentata nel lobo occipitale del cervello, risponde a stimoli specifici in maniera visuo-topica: nella sua parte posteriore risponde alla luce, procedendo anteriormente diviene sensibile ai bordi statici, poi ai bordi in movimento o ad altri pattern geometrici complessi170, 171. I neuroni visivi presi singolarmente rispondono ciascuno a bordi con specifico orientamento. Quindi uno stimolo visivo attiva selettivamente alcune regioni cerebrali costituite da neuroni “sintonizzati” sulle caratteristiche di quello stimolo. La risposta EEG ai pattern infatti varia in base alla lunghezza delle linee costituenti il pattern, all’angolo sotteso dal pattern, alla sua frequenza spaziale, al duty cycle, alla luminanza, al contrasto172, 173. Impulsi “a grata” che si muovono centripetamente nel
campo visivo non sono in grado di evocare risposte epilettiformi, mentre impulsi analoghi che cambiano ripetutamente direzione o fase (bianco-nero; nero-bianco) sono altamente provocativi174,
175
. Secondo Wilkins ciò è dovuto al fatto che i rapidi cambi di direzione causano modificazioni sincrone nella popolazione neuronale reclutata, a causa della selettività alla direzione degli stessi neuroni175. Presumibilmente, nella persona predisposta, per una carenza di meccanismi inibitori, l’eccessivo reclutamento neuronale (“ipersincronia”) può dare luogo a modificazioni elettroencefalografiche.
La risposta è maggiore quando l’immagine è fusa in visione binoculare e la stimolazione nel centro del campo visivo è efficace tanto quella alla periferia. Sebbene le diverse aree della corteccia visiva appaiano equipotenti nell’evocare crisi, la soglia epilettogena può essere diversa fra i due emisferi, anche in pazienti con IGE112.
Il trait fotosensibile sembra essere un fenomeno dinamico. Infatti applicando farmaci pro convulsivanti alla corteccia visiva del coniglio si può osservare un progressivo cambiamento nella risposta alla SLI, da normali potenziali evocati visivi a punte epilettiformi, correlato al progressivo sviluppo di epilessia176.
La corteccia visiva ha un ruolo fondamentale nella genesi della fotosensibilità, ma altre regioni cerebrali potrebbero essere coinvolte. Nel babbuino fotosensibile Papio Papio le PPR originano frequentemente dalla corteccia motoria151. Talora anche nell’essere umano si osservano scariche epilettiformi con apparente origine frontale e sono stati riportati casi di crisi parziali complesse foto-indotte trattati con successo con lobectomia temporale177. Probabilmente in tal caso è risolutiva l’interruzione chirurgica di vie di propagazione delle crisi; d’altra parte la lobectomia potrebbe anche impedire il raggiungimento di quella “massa critica” di neuroni ipersincroni necessari per generare una crisi. Inoue et al. hanno condotto un’analisi source-dipole tramite MEG in soggetti fotosensibili, osservando l’origine dei dipoli prevalentemente nelle regioni posteriori, nell’area motoria supplementare, nella regione perisilviana e nel lobo temporale mesiale178.
1.6.6 Caratteristiche dello stimolo
Wilkins ha sottolineato che gli stimoli visivi in grado di provocare crisi epilettiche devono avere alcune “forti” caratteristiche175
:
bassa soglia in grado di elicitare una risposta. interferenza con la percezione di altri stimoli.
capacità di evocare potenziali visivi di elevata ampiezza. causare una elevazione del consumo di ossigeno cerebrale.