Capitolo 3
Accumulatori per impianti fotovoltaici
3.1 Introduzione
Negli impianti fotovoltaici stand alone l’accumulatore ha il compito di immagazinare l’energia prodotta dal generatore durante il giorno, in modo che questa possa essere sfruttata per il fabbisogno notturno o in caso di scarsa disponibilità di energia solare.
Esso è il componente più critico di un sistema fotovoltaico stand alone poiché è l’unico che esige manutenzione.
Altra cosa importante è la resa che deve essere molto prolungata nel tempo.
Infatti, nel caso dei lampioni fotovoltaici, per poter funzionare correttamente e consentire una luce omogenea per l’intero periodo richiesto, non devono avere cedimenti di corrente.
3.2 Requisiti degli accumulatori per impianti fotovoltaici
Gli accumulatori impiegati negli impianti fotovoltaici devono possedere dei requisiti particolari per essere adatti alle condizioni di esercizio:• essere dimensionati adeguatamente per quel che concerne la capacità, in modo da garantire l’erogazione di corrente necessaria al carico per un certo periodo di tempo;
• essere scelti in modo da essere adatti all'intensità di corrente fornita dai pannelli e a quella richiesta dal carico;
• essere in grado di stabilizzare tensione e corrente verso il carico reiettando i fenomeni transitori che possono avvenire in un pannello fotovoltaico;
• essere “ciclabili”, ovvero resistenti ad un elevato numero di cicli di carica e scarica;
• offrire una buona resistenza ai gradienti termici;
• possedere un buon rendimento, ovvero elevato rapporto tra l'energia fornita e quella immagazzinata;
• bassa manutenzione;
• basso valore dell'autoscarica; • basso costo.
Le batterie rappresentano gli elementi più costosi di un impianto fotovoltaico anche a causa della loro limitata durata nel tempo, stimata intorno ai 7-10 anni.
Tra le batterie disponibili sul mercato, la più idonea risulta essere la batteria al piombo, grazie soprattutto al rendimento di carica e scarica e al rapporto tra prezzo e prestazioni.
3.3 Principio di funzionamento degli accumulatori al
piombo acido
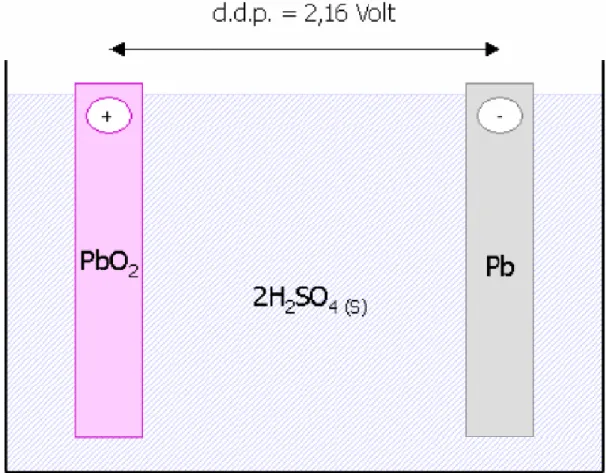
Una batteria in realtà è costituita da una serie di “accumulatori al piombo” comunemente chiamati elementi (nel caso specifico in cui la batteria sia da 12 V sono sei) che forniscono ciascuno una tensione nominale di 2,16 V.
Ciascun elemento della batteria è costituito da una “cella galvanica” in cui avviene una reazione “reversibile” di ossidoriduzione attraverso la quale è possibile, alternativamente “accumulare” e “prelevare” energia elettrica (da cui il termine “accumulatore”).
La “cella galvanica” di un accumulatore al piombo è costituita da un recipiente al cui interno si trova un “elettrolita” ossia una soluzione acquosa di acido solforico H2SO4 (S) (1,32 gr/cm3) in cui sono immersi
due elettrodi posti parallelamente a breve distanza l’uno dall’altro.
L’ elettrodo positivo è costituito da una lastra di diossido di piombo (PbO2) mentre l’elettrodo negativo è costituito da una lastra di piombo
metallico (Pb).
Senza addentrarci troppo nella teoria elettrochimica basta ricordare che un elettrolità è una soluzione in grado di trasportare cariche elettriche attraverso lo spostamento di “ioni” che sono presenti nella soluzione stessa, nel caso specifico in una soluzione acquosa di
acido solforico ( H2SO4(S)) sono presenti ioni H+ e ioni SO4
Immergendo in una soluzione elettrolita una lamina metallica, in funzione delle caratteristiche elettrochimiche degli elementi chimici coinvolti (elettrodo e elettrolita), si genera sulla superficie di contatto tra elettrodo e elettrolita una reazione di ossidoriduzione che determina
all’equilibrio una differenza di potenziale (d.d.p.) in prossimità della superficie di contatto che provoca un movimento di cariche elettriche.
Figura 3.0: Cella galvanica di un accumulatore al piombo
Una importante legge dell’elettrochimica (equazione di Nernst) ci dice che la differenza di potenziale che si stabilisce tra gli elettrodi di una cella galvanica dipende, entro certi limiti, dalla concentrazione di ioni presenti nella soluzione elettrolita (oltre che dalla temperatura).
Infatti lo stato di carica di una batteria al piombo può essere verificato attraverso la misura della densità del suo elettrolita.
3.3.1 Il processo di scarica della batteria al piombo
In un accumulatore al piombo il processo di scarica avviene attraverso una reazione reversibile in cui il piombo di cui sono costituiti gli elettrodi reagisce con l’acido solforico presente nella soluzione elettrolita formando acqua e solfato di piombo.
Durante il processo di scarica la formazione di acqua e di solfato di piombo (PbSO4) causano la diminuzione della concentrazione di acido
solforico (H2SO4) nella soluzione elettrolita e quindi della sua densità
che determina l’abbassamento della differenza di potenziale tra gli elettrodi in accordo con l’equazione di Nernst sopra citata.
Come abbiamo già detto la reazione di ossidoriduzione che è alla base del funzionamento di un accumulatore al piombo avviene sulla superficie di contatto tra gli elettrodi e l’elettrolita, da ciò risulta intuitivo che “l’intensità della corrente elettrica che una batteria può generare è direttamente proporzionale all’area della superficie di contatto tra elettrodi e elettrolita”.
3.3.2 Il processo di ricarica della batteria al piombo
Durante la fase di ricarica di una batteria al piombo avviene un processo inverso a quello appena descritto. Collegando ai due elettrodi un generatore di corrente si ha il passaggio di elettroni dall’elettrodo positivo al generatore e da questo all’elettrodo negativo.
Sull’elettrodo negativo l’afflusso di elettroni provoca la “riduzione” degli ioni Pb2+ con la deposizione sull’elettrodo stesso di atomi di
scomposizione del solfato di piombo (PbSO4) che si era formato nella
fase di scarica.
Sull’elettrodo positivo la sottrazione di elettroni provoca “l’ossidazione” degli ioni Pb2+ in ioni Pb4+ che reagendo con gli ioni O2- presenti in
soluzione per la dissociazione elettrolitica dell’acqua depositano di nuovo diossido di piombo (PbO2) sull’elettrodo positivo liberando in
soluzione ioni H+ che vanno a bilanciare gli ioni SO42- ottenuti dalla
dissociazione del solfato di piombo, di conseguenza si viene così a ripristinare gradualmente l’iniziale concentrazione di acido solforico nella soluzione elettrolita con la contemporanea scomparsa del solfato di piombo.
Il processo di ricarica si può considerare ultimato quando tutte le molecole del solfato di piombo (PbSO4) formatesi durante la scarica
sono state nuovamente scomposte ripristinando l’iniziale concentrazione di acido solforico nell’elettrolita.
Se, raggiunta questa condizione (carica completata), si continua a fornire energia alla batteria non si ha ulteriore incremento di carica ma l’energia fornita produce solamente ulteriore elettrolisi delle molecole d’acqua presenti nella soluzione con la formazione a questo punto di idrogeno H2
e Ossigeno O2 allo stato molecolare (gas) condizione questa
estremamente pericolosa in quanto la miscela dei due gas ad elevate concentrazioni può risultare esplosiva.
Oltre alla formazione di gas pericolosi vi è anche l’effetto, non secondario, della perdita di acqua dalla soluzione, con conseguente variazione della densità e del livello dell’elettrolita rispetto ai valori ottimali, nel caso di batterie con elettrolita liquido, o di formazione di bolle di gas che rimangono imprigionate in modo irreversibile nell’elettrolita nel caso di batterie al gel.
Senza scendere nel dettaglio e nell’analisi dei complicati processi chimico-cinetici che avvengono è comunque intuitivo comprendere che oltre alla durata del ciclo di ricarica anche l’intensità della corrente di carica ha la sua importanza in quanto un’elevata corrente di carica può aumentare i rischi di cui sopra specialmente nel caso di batterie con elettrolita al gel dove la “mobilità” degli ioni risulta ridotta o nel caso di batterie ermetiche in cui la formazione troppo rapida di gas può causare eccessive pressioni e aumenti eccessivi di temperatura che possono portare al prematuro deterioramento della batteria stessa.
3.3.3 La solfatazione degli elettrodi
Come è stato già descritto, nei processi di scarica e successiva ricarica di un accumulatore al piombo le reazioni chimiche che sono coinvolte portano, nella fase di scarica alla produzione di solfato di piombo (PbSO4) e al suo successivo riassorbimento nella fase di ricarica con il
ripristino della iniziale densità della soluzione elettrolita di acido solforico (H2SO4).
Il solfato di piombo è chimicamente un “sale” e ha quindi la tendenza a “cristallizzare” ovvero a compattarsi in una struttura solida depositandosi sugli elettrodi in modo pressoché irreversibile.
E’ ovvio che un elettrodo su cui una parte del materiale attivo è stato sostituito da cristalli di solfato di piombo presenterà una limitata capacità di accumulare/restituire cariche, questo processo è noto con il nome di “solfatazione”.
Purtroppo i sali di solfato di piombo in forma cristallina presentano una elevata difficoltà ad essere riconvertiti in materiale attivo e quindi una
volta che si è determinata la solfatazione estesa degli elettrodi l’accumulatore è da ritenere irreversibilmente danneggiato.
Le cause che portano alla solfatazione degli elettrodi sono molteplici ma la principale causa di solfatazione è la permanenza dell’accumulatore in condizione di scarica anche parziale, ovviamente il fenomeno sarà tanto più rapido quanto maggiore è il livello di scarica e la permanenza in tale stato.
Per garantire quindi una buona durata di una batteria al piombo è opportuno evitare la permanenza per lungo periodo in condizioni di scarica anche solo parziale.
La temperatura aumenta il rischio di solfatazione specie nei lunghi periodi di inattività della batteria in quanto favorisce il lento processo di autoscarica che è una causa della solfatazione.
E’ dunque buona norma, specialmente nei lunghi periodi di inattività, mantenere costantemente le batterie al piombo sotto un piccola corrente di carica (carica di mantenimento) con lo scopo di contrastare il processo di autoscarica e con esso il rischio di solfatazione.
3.4 Accumulatori al piombo acido VRLA
Le batterie al piombo acido regolate con valvole (VRLA, dall’inglese Valve Regulated Lead Acid Batteries), diversamente da quelle sigillate (SLA, dall’inglese Sealed Lead Acid) utilizzano acido solforico diluito “immobilizzato” per eliminare i pericoli dovuti a fuoriuscite accidentali di acido, per rovesciamenti, rotture, cadute e per facilitare il ciclo di ricombinazione dell’ossigeno.
Il ciclo di ricombinazione dell’ossigeno elimina la necessità dell’aggiunta di acqua demineralizzata durante la “vita” della batteria aumentando la sua sicurezza di impiego.
Le batterie regolate con valvole (VRLA) sono equipaggiate, in ogni singola cella, con delle valvole di sfiato per eliminare il pericolo di eccessive pressioni e per prevenire l’ingresso dell’aria esterna nelle celle in modo da prolungare il periodo di stoccaggio.
Proprio per questi vantaggi di assenza di perdite di elettrolito e di manutenzione, minima produzione di gas, aumento del periodo di stoccaggio ed aumento della sicurezza, le batterie VRLA sono state selezionate per una miriade di applicazioni in situazioni critiche, come per esempio negli impianti fotovoltaici stand alone.
3.5 Classifica degli accumulatori in base all’utilizzo
In funzione dell’impiego primario a cui una batteria di accumulatori è destinata sono state sviluppate diverse tecnologie costruttive degli accumulatori stessi.
Possiamo distinguere due grandi famiglie di batterie in base all’utilizzo: Una batteria si dice in servizio di “tampone” quando è costantemente connessa sia all’impianto di ricarica che al “carico” (impianto da alimentare) in modo da provvedere a fornire energia in qualsiasi momento in caso di interruzione della linea di alimentazione primaria (rete domestica o industriale). La batteria funge da fonte energetica di emergenza.
Nel servizio “ciclico” la batteria è scaricata profondamente perché è la fonte primaria dell’energia per le applicazioni in cui è utilizzata come ad esempio nei sistemi fotovoltaici di servizio (carica diurna e scarica notturna) come per i lampioni fotovoltaici.
Dopo l’utilizzo la batteria viene ricaricata per ristabilire la sua capacità iniziale per poter essere riutilizzata.
Nelle tipiche applicazioni in “cicli” il ciclo visto sopra si ripete molto frequentemente e ciò è particolarmente stressante per la batteria.
3.6 Ricarica degli accumulatori SLA e VRLA
In letteratura esistono diversi metodi di carica per le batterie SLA o VRLA.
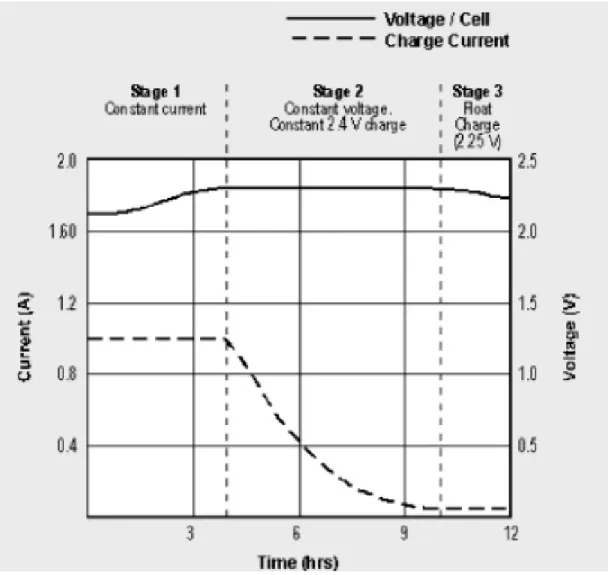
Il metodo di carica classico prevede tre fasi fondamentali:
1. Costant Current: durante questa fase la batteria si carica al 70 % con una corrente costante pari al massimo al 25% della capacità della batteria stessa in un tempo circa pari a 5 ore fino a quando la tensione ai capi di una cella si porta al valore di 2,4 V.
2. Costant Voltage: durante questa fase la batteria viene caricata per il rimanente 30 %, mantenendo costante la tensione ai suoi capi ad un valore pari a 2,4 V a cella (per una batteria da 12 V costituita da 6 celle tale tensione vale 14,4 V) in un tempo pari a circa 5 ore.
3. Float Charge: : durante questa fase la tensione ai capi della batteria viene mantenuta costante ad un valore pari a 2,25 V a cella (per una batteria da 12 V costituita da 6 celle tale tensione vale 13,5 V)
Figura 3.1: Le tra fasi per la carica di una batteria SLA o VRLA
Il valore della tensione limite per il passaggio dalla fase 1 alla fase 3 pari a 2,4 V è un valore critico.
Tale limite è compreso in un intervallo che va da 2,3 V a 2,45 V.
Se si preferisce eseguire una ricarica lenta o se la temperatura dell’ambiente eccede i 30 °C tale limite può trovarsi in un intervallo compreso tra 2,3 V e 2,35 V.
Se si preferisce eseguire una ricarica veloce o se la temperatura dell’ambiente rimane sotto i 30 °C tale limite può trovarsi in un intervallo compreso tra 2,4 V e 2,45 V.
Durante la fase finale denominata “Float Charge” la tensione ottimale di mantenimento della cella dipende dalla temperatura in maniera inversamente proporzionale.
Lo stato di carica di una batteria può essere valutato, con una certa accuratezza, misurando la sua tensione a vuoto dopo almeno 8 ore dalla carica o scarica di quest’ultima.
Tale misura deve essere eseguita in un ambiente con una temperatura controllata. Viene riportata a titolo di esempio la seguente tabella:
Tensione a vuoto Stato di carica %
12,65V 100%
12,45V 75%
12,24V 50%
12,06V 25%
3.7 Protezione da sovra-cariche e sovra-discariche
Il compito principale di un caricabatteria per batterie al piombo acido, è mantenere la batteria ad un elevato stato di carica, proteggendola contemporaneamente da sovra-cariche o sovra-discariche.
Se infatti il pannello fotovoltaico lavora nelle migliori condizioni possibili di soleggiamento (per es. in estate) la corrente di carica della batteria, fornita dal battery charger, può superare il valore massimo consentito (condizione di sovra-carico).
In tal caso si assiste ad un eccessivo riscaldamento della batteria che porta alla nascita di gas accelerando il processo di corrosione delle placche, diminuendo di fatto il tempo di vita della batteria.
Per evitare tale fenomeno il battery charger deve essere provvisto di un fusibile che apre il collegamento col carico se la corrente supera un certo valore.
Ma essendo che tale apertura del fusibile risulta irreversibile si può utilizzare un “polyswitch”, ovvero un dispositivo che se percorso da una corrente elevata aumenta la sua resistenza, e non appena la corrente diminuisce, la sua resistenza ritorna al valore di partenza.
Se invece il pannello fotovoltaico lavora nelle peggiori condizioni possibili di soleggiamento (per es. in inverno) la corrente di carica della batteria, fornita dal battery charger, può non essere sufficiente a caricare completamente la batteria (condizione di sovra-discarica).
In tal caso si assiste ad una diminuzione della capacità della batteria e dunque del tempo di vita della stessa.
Anche il tal caso il battery charger deve aprire il collegamento col carico in modo da evitare la sovra-discarica della batteria.