1
Capitolo 4:
Indagine spettroscopica
sulla natura dei complessi di Rh(I) con
il fosfito 71
L’impiego dei fosfiti 69-75 come leganti del Rh(I) nella reazione di addizione coniugata di acidi boronici ad enoni ha messo in evidenza un comportamento singolare di questi leganti chirali, che si sono rivelati in grado di promuovere la reazione anche quando impiegati in rapporto molare Rh/L 1:1 invece del consueto 1:2. Inoltre la specie cataliticamente attiva ottenuta lavorando con un rapporto Rh:L pari a 1:1 mostra capacità di induzione asimmetrica assolutamente confrontabili alla specie ottenuta a partire dal rapporto Rh/L 1:2 (cfr. Capitolo 3).
Da questi dati sperimentali è possibile dedurre che anche in rapporto molare Rh/L 1:1 si ottiene una specie di Rh coordinata con il fosfito cataliticamente attiva, la cui natura può essere interessante oggetto di indagine. Inoltre avere informazioni riguardo la natura di questi complessi, può aiutare a spiegare altri dati sperimentali, come ad esempio il senso di induzione asimmetrica esibito dai fosfiti nella reazione di addizione coniugata.
Data la natura di questi leganti, la spettroscopia 31P-NMR è sembrata la tecnica di indagine più appropriata non solo riguardo alla complessazione di questo tipo di leganti al Rh, ma anche riguardo alla natura tropos dei complessi nonché alla loro stereochimica, cioè senso di torsione prevalente dell’unità bifenilica del fosfito ed entità della prevalenza.
Particolarmente interessante è lo studio del complesso che si forma a rapporto molare Rh/L 1:1.
Per effettuare questo studio è stato preparato un campione NMR disciogliendo in THF-d8, il solvente più simile al diossano che è il solvente in cui sono state effettuate le prove catalitiche (cfr. Capitolo 3), 0.015 mmol di [Rh(C2H4)2Cl]2 e 0.03 mmol di fosfito 71.
Figura 1 Spettro 31P-NMR (121.4 MHz, THF-d8) del complesso [Rh(C2H4)2Cl]2-71 in rapporto 1:1.
Nello spettro 31P-NMR (Figura 1), non è più visibile il segnale del legante libero a 154.8 ppm, mentre sono presenti più segnali tra 135 e 150 ppm, tra i quali sono chiaramente distinguibili due doppietti, a 137.6 ppm (J = 287.5 Hz) e a 147.9 ppm (J = 295.6 Hz). L’assenza del segnale del legante libero e la presenza di doppietti con la tipica costante di accoppiamento Rh-P1, suggeriscono che 71 è coordinato al centro metallico. La presenza di più segnali è attribuibile al fatto che il [Rh(C2H4)2Cl]2, essendo un dimero, in presenza di un equivalente molare di legante 71 può dar luogo in linea di principio a diverse specie dimeriche contenenti il legante 71 e quindi visibili nello spettro 31P-NMR, ognuna delle quali può essere in equilibrio2 con il corrispondente monomero (Schema 1).
3 Rh Cl Cl Rh Rh L L Cl Cl Rh LL LL Rh L LL Cl Cl Rh L LL Rh L LL Cl Cl Rh LL L Rh L LL Cl Rh L L Cl L* Rh L L Cl Cl Rh L L L = 71 LL = C2H4 o solvente
Schema 1 Possibili complessi Rh-legante chirale.
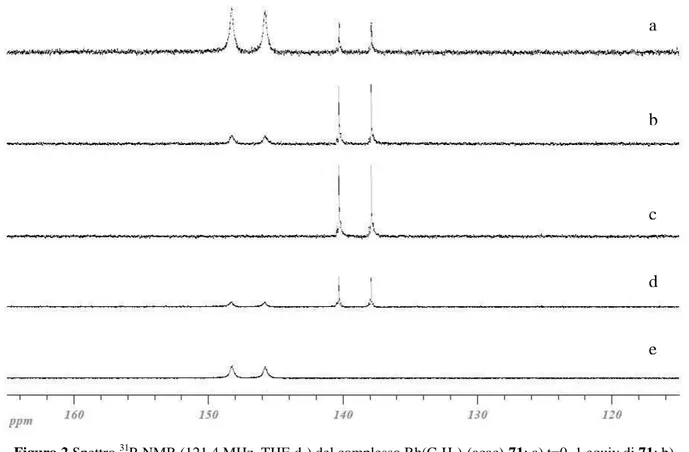
Attribuire ciascun segnale ad una specie precisa è piuttosto complicato, ma un aiuto nell’interpretazione di questo spettro può essere ricavato dall’indagine spettroscopica condotta su una miscela equimolare del legante 71 e di un complesso di Rh(I) monomerico quale il Rh(C2H4)2(acac) disciolta in THF-d8. Nello spettro 31P-NMR della soluzione appena preparata (Figura 2a) non è presente il segnale a 154.8 ppm dovuto alla risonanza del fosforo del legante libero, ma sono chiaramente visibili due doppietti a 139.1 ppm (J = 291.1 Hz) e a 147.1 ppm (J = 303.4 Hz) con la tipica costante d’accoppiamento P-Rh1. Le aree integrate dei due segnali sono in rapporto 1:0.16.
Figura 2 Spettro 31P-NMR (121.4 MHz, THF-d8) del complesso Rh(C2H4)2(acac)-71: a) t=0, 1 equiv di 71; b) t=4 h, 1 equiv di 71; c) t=23 h, 1 equiv di 71; d) t=23 h, 1.5 equiv di 71, e) t=23 h, 2 equiv di 71.
Anche in questo caso, data l’assenza del segnale del legante libero, è ragionevole affermare che tutto il fosfito sia complessato al centro metallico e che, data la natura monomerica del Rh(C2H4)2(acac) e la presenza del legante acac, fortemente coordinante, i due doppietti siano attribuibili alle due specie 95 e 96, rispettivamente di- e monosostituite (Figura 3).
Rh L L O O Rh L O O 95 96 LL L = 71 LL = C2H4 o solvente
Figura 3 Complessi Rh(C2H4)2(acac)-71
a
b
d c
5
Uno spettro 31P-NMR della stessa soluzione, registrato dopo 4 ore, mostra che l’intensità relativa dei due segnali è cambiata rispetto allo spettro precedente (Figura 2b): il rapporto delle aree integrate dei due segnali questa volta è pari a 1:1.67 a favore del doppietto a frequenze più basse. Questo dato indica che la specie che risuona a frequenze più alte è quella che si forma più velocemente, ma nel tempo si converte nella specie che risuona a frequenze più basse. La conversione è completa dopo 23 ore, come dimostra lo spettro 31 P-NMR registrato sulla stessa soluzione dopo questo intervallo di tempo (Figura 2c) in cui è visibile soltanto il doppietto a 139.1 ppm.
Per stabilire a quali specie appartengono i due segnali sono quindi state effettuate delle misure aggiungendo alla soluzione quantità crescenti di fosfito 71. In presenza di 1.5 equivalenti di legante si osserva la ricomparsa del doppietto a frequenze più alte (Figura 2d), la cui intensità aumenta all’aumentare della quantità di legante, mentre quella del segnale a frequenze più basse diminuisce fino a scomparire del tutto: infatti, aggiungendo 2 equivalenti di fosfito è presente soltanto il doppietto a frequenze più alte (Figura 2e).
In base a questi risultati è possibile stabilire che il doppietto a frequenze più alte appartiene al complesso disostituito 95, mentre quello a frequenze più basse al complesso 96, monosostituito.
Il confronto tra gli spettri 31P-NMR delle soluzioni appena preparate di Rh(C2H4)2(acac)/71 1:1 e [Rh(C2H4)2Cl]2/71 1:1 in THF-d8 (Figura 4) mostra che anche la complessazione di 71 al [Rh(C2H4)2Cl]2 genera delle specie che, per posizione dei segnali e costanti d’accoppiamento, possono essere attribuite a complessi disostituiti e monosostituiti al Rh.
Figura 4 Spettro 31P-NMR (121.4 MHz, THF-d8) dei complessi: a) [Rh(C2H4)2Cl]2/71 1:1; b) Rh(C2H4)2(acac)/71 1:1.
Per verificare se anche in questo caso il complesso che si forma più velocemente è quello disostituito che poi evolve a quello monosostituito, sono stati registrati spettri a vari intervalli di tempo. Inoltre per verificare se il fenomeno fosse dipendente dal solvente gli spettri 31 P-NMR sono stati acquisiti su soluzioni tolueniche della miscela [Rh(C2H4)2Cl]2/71 in rapporto molare 1:1.
Lo spettro 31P-NMR della soluzione toluenica di [Rh(C2H4)2Cl]2/71 1:1 appena preparata (Figura 5a) è assolutamente confrontabile per numero, posizione e costante d’accoppiamento dei doppietti, a quello registrato sull’analoga soluzione in THF-d8; sono infatti chiaramente visibili due doppietti a 137.6 ppm (J = 287.5 Hz) e a 147.9 ppm (J = 295.6 Hz) insieme a altri due doppietti uno di intensità inferiore a 144.3 ppm (J = 297.0 Hz) e uno appena visibile a 137.0 ppm (J = 292.3 Hz).
a
7
Figura 5 Spettro 31P-NMR (121.4 MHz, toluene-d8) del complesso [Rh(C2H4)2Cl]2-71: a) t=2 h, “Rh”/71 = 1:1; b) t=30 h, “Rh”/71 = 1:1; c)eccesso di 71, “Rh”/71 = 1:3.
Dopo 30 ore la situazione appare decisamente differente. Infatti, lo spettro 31P-NMR registrato dopo questo intervallo di tempo (Figura 5b) mostra ben visibile un doppietto a 137.0 ppm (J = 292.3 Hz) e appena visibile l’ altro doppietto a 137.6 ppm (J = 287.5 Hz). La posizione di questi segnali e il confronto con gli spettri delle miscele 1:1 Rh(C2H4)2(acac) suggeriscono che anche la complessazione di 71 alla specie dimerica di Rh(I) ha un andamento analogo a quanto osservato per la specie monomerica. L’ipotesi è confermata da quanto si osserva nello spettro registrato sulla stessa miscela a cui è stato aggiunto un eccesso di legante (Figura 5c). In questo spettro oltre al segnale del legante libero a 154.8 ppm, si osservano i due doppietti a frequenze più alte mentre sono scomparsi i doppietti a frequenze più basse.
Sulla base di questi risultati è possibile affermare che il fosfito 71 in presenza di complessi di Rh(I) con leganti etilene dà luogo alla formazione veloce di un complesso disostituito al Rh, che potremmo definire il complesso cineticamente favorito, il quale nel tempo si trasforma completamente nel complesso in cui ad ogni centro metallico è coordinato un solo legante fosfito. Questo complesso “1:1“ è senz’altro quello termodinamicamente più stabile, probabilmente per effetto delle dimensioni del legante 71. Che sia il complesso più stabile lo
a
b
aggiunge un equivalente di [Rh(C2H4)2Cl]2 si riottene, dopo 24 ore, lo spettro di Figura 2b, dimostrando così che la formazione del complesso disostituito al Rh è completamente reversibile.
È quindi possibile in base alle condizioni in cui si lavora ottenere un complesso Rh/legante monosostituito o disostituito.
La presenza di una coppia di segnali sia nella zona a più alte frequenze che in quella a frequenze più basse è verosimilmente dovuta all’equilibrio specie monomerica – specie dimerica sia per il complesso disostituito che per quello monosostituito.
Per confermare questa ipotesi, poiché tale equilibrio può dipendere dalla natura del legante e anche dalla temperatura, sono stati registrati gli spettri del complesso 1:1 Rh/L ottenuto disciogliendo 1 equivalente di [Rh(C2H4)2Cl]2 e 2 equivalenti del fosfito 73 in THF lasciando equilibrare la soluzione per 24 ore.
Figura 6 Spettro 31P-NMR (121.4 MHz, THF) del complesso [Rh(C2H4)2Cl]2-73 in rapporto 1:1 a: a) T=25°C; b) T=40°C; c) T=60°C.
c a
9
Lo spettro 31P-NMR della miscela registrato a temperatura ambiente (Figura 6a) mostra due doppietti a 135.1 ppm (J = 288.2 Hz) e a 136.1 ppm (J = 286.3 Hz) le cui aree integrate hanno un rapporto di 1:6 a favore del segnale a frequenze più basse. Questo rapporto varia con il variare della temperatura: a 40°C (Figura 6b) il rapporto tra i due segnali è di 1:3.15 e a 60°C (Figura 6c) è di 1:2.5.
Questo andamento non è attribuibile alla natura tropos del legante che dà luogo all’equilibrio tra le forma diastereoisomeriche M-P nel complesso, in quanto si ritrova anche negli spettri del complesso ottenuto con il legante atropoisomerico 75b che presenta una unità configurazionalmente stabile (S)-binaftilfosfito legata alla posizione 12 dell’acido deossicolico: la specie Rh-fosfito 1:1 soggiace in questo caso ad un equilibrio più veloce in quanto il doppietto di intensità più bassa è appena visibile a -20°C e chiaramente distinguibile a -60°C (Figura 7).
Figura 7 Spettro 31P-NMR (121.4 MHz, toluene) del complesso [Rh(C2H4)2Cl]2-75b in rapporto 1:1 a: a) T=25°C; b) T=0°C; c) T=-20°C; d) T=-40°C; e) T=-60°C.
È invece verosimile che si instauri un equilibrio monomero - dimero tra le specie monosostituite 97 e 98 (Schema 2). b a c d e
Rh Cl Rh Rh S L L L 97 98
Schema 2 Equilibrio monomero – dimero tra le specie 97 e 98.
In queste condizioni è tuttavia non banale assegnare in modo inequivocabile i segnali a ciascuna specie. È però noto che il valore della costante d’accoppiamento 1JPRh diminuisce passando dalla specie monomerica a quella dimerica. 2 Sembra quindi ragionevole supporre che il segnale con la costante di accoppiamento 31P-103Rh più elevata corrisponda al monomero 97 e l’altro al dimero 98: in particolare, poiché la costante di accoppiamento 1JPRh del doppietto a 135.1 ppm è pari a 288.4 Hz, mentre quella del doppietto a 135.8 ppm è 287.1 Hz, possiamo attribuire il segnale a frequenze più alte alla specie dimerica e quello a frequenze più basse alla specie monomerica.
Una volta chiarito l’andamento della complessazione di questa classe di leganti al Rh(I), rimane da stabilire la natura tropos o meno del complesso, cioè se quando il legante è coordinato al centro metallico la sua unità bifenilica è ancora flessibile e in soluzione sono presenti due specie diastereoisomeriche M-P in equilibrio tra loro.
Per indagare su questo punto sono state effettuate misure 31P-NMR a temperatura variabile sul complesso monosostituito ottenuto a partire da 71, in soluzione toluenica (Figura 8).
A temperatura ambiente, nello spettro in toluene del complesso [Rh(C2H4)2Cl]2-71 (Figura
8a) è presente un doppietto centrato a 137.0 ppm (J = 292.3 Hz) insieme ad un doppietto di
11
Figura 8 Spettro 31P-NMR (121.4 MHz, toluene) del complesso [Rh(C2H4)2Cl]2-71 in rapporto 1:1 a: a) T=25°C; b) T=0°C; c) T=-20°C; d) T=-40°C; e) T=-60°C; f) T=-80°C.
Abbassando progressivamente la temperatura i segnali si slargano fino a coalescere in un unico segnale molto largo alla temperatura di -60°C (Figura 8e). Alla temperatura di -80°C si ha decoalescenza dei segnali (Figura 8f) con comparsa di due doppietti a 126.4 ppme a 129.6 ppm rispettivamente con costante di accoppiamento 1JPRh pari a 293.8 Hz e 288.9 Hz, attribuibili ai due diastereoisomeri M-P in equilibrio veloce a temperatura ambiente (Schema
3). O O O P O O O O Rh Cl LL O O O P O O O O Rh Cl LL M P
Schema 3 Equilibrio tra i complessi M-P.
a b c d f e
diastereoisomeriche, suggerendo che la complessazione al Rh da parte del legante tropos 71 è non selettiva.
Tuttavia nonostante la presenza di entrambe la specie diastereoisomeriche in rapporto 1:1 la reazione di addizione coniugata era risultata altamente enantioselettiva (cfr. Capitolo 3). Questa apparente contraddizione si spiega tenendo conto del fatto che nel caso di attivazione non selettiva di specie tropos3 nella formazione di precursori catalitici, si può ottenere ugualmente un alto livello di induzione asimmetrica se uno dei due complessi diastereoisomerici non è cataliticamente attivo.
Che uno dei due complessi diastereoisomerici che si originano dalla coordinazione dei fosfiti
69-75 al Rh(I) non sia attivo è dimostrato dall’impiego dei due analoghi fosfiti
atropoisomerici 75a e 75b contenenti l’unità binaftilica: solo 75b, che possiede l’unità (S)-binaftilfosfito dà luogo ad un complesso cataliticamente attivo ed enantioselettivo (cfr. Capitolo 3). In base a questi risultati è quindi possibile affermare che nel caso dei fosfiti 71-75 il complesso cataliticamente attivo sia quello contenente il fosfito in cui l’unità bifenilica ha senso di torsione M, corrispondente alla configurazione assoluta S. Il senso di induzione asimmetrica esibito da questi leganti è un’ulteriore conferma. Resta ancora da chiarire il senso di induzione asimmetrica di 69 e 70.
Sulla base di questi risultati è chiaro che nelle condizioni di reazione utilizzate per le prove di addizione del Capitolo 3 erano presenti in soluzione entrambi i complessi [Rh(C2H4)2Cl]2 -fosfito. Anzi, dal momento che il complesso disostituito è quello che si forma più velocemente, è possibile affermare che le reazioni fossero catalizzate da questa specie, presente in minore quantità rispetto agli equivalenti di Rh(I) introdotti. Il minor carico di catalizzatore spiegherebbe anche la velocità di reazione inferiore rispetto a quando venga impiegato un rapporto molare legante/Rh 2:1. Abbiamo perciò deciso di effettuare delle prove catalitiche in cui il complesso di Rh fosse esclusivamente la specie 1:1 e confrontarle con i risultati ottenuti utilizzando un rapporto Rh/fosfito pari a 1:2 (Tabella 1).
13
Tabella 1 Addizione coniugata degli acidi arilboronici 2a-b agli enoni 1a-b catalizzata da [RhCl(C2H4)2]2 in presenza del fosfito 71.
O Ar + [RhCl(C2H4)2]2 (1.5 mol %) 71 (3 o 6 mol %) diossano/H2O (10:1) KOH 1M (0.5 mL) * Ar-B(OH)2 2 a-b Ar = Ph (2a) 4-MeC6H4 (2b) 3 O n n = 1 (1b) 2 (1a) n
Prova enone Ar-B(OH)2 “Rh”/71 T (°C) t (h)a Resa (%)b e.e. (%) (CA)c
33 1a 2a 1:1 25 8 100 85 (R)d 34 1a 2a 1:2 25 5 94 90 (R)d 35 1a 2b 1:1 25 8 100 92 (S)e 36 1a 2b 1:2 25 4 100 96 (S)e 37 1b 2a 1:1 25 2 100 56f 38 1b 2a 1:2 25 2 100 59f
a) interrotta a conversione completa o quando non procedeva oltre. b) determinata mediante GC su fase stazionaria non chirale.
c) configurazione assoluta determinata per confronto con dati di letteratura.4 d) determinato per analisi HPLC su fase stazionaria chirale Chiralcel OD-H, eluente
esano/isopropanolo 99:1, flusso 1 mL/min, rivelatore UV (λ = 220 nm), RT. e) determinato per analisi HPLC su fase stazionaria chirale Chiralpak AD, eluente
eptano/isopropanolo 95:5, flusso 0.9 mL/min, rivelatore UV (λ = 230 nm), RT.
f) determinato per analisi HPLC su fase stazionaria chirale Chiralcel OB, eluente esano/isopropanolo 99.75:0.25, flusso 1 mL/min, rivelatore UV (λ = 220 nm), T=25°C.
In tutti i casi la reazione è stata effettuata facendo formare in situ il sistema catalitico costituito dal legante 71 e dal [RhCl(C2H4)2]2, disciolti in diossano e mantenuti in agitazione a temperatura ambiente per mezz’ora nel caso del complesso “Rh”-71 in rapporto 1:2 o per 24 ore in modo da avere in soluzione solo la specie monosostituita nel caso in cui si impieghi un rapporto “Rh”:71 pari a 1:1. Sono stati poi aggiunti nell’ordine acqua, KOH 1M, l’acido arilboronico e l’enone. La reazione è stata seguita mediante GC ed interrotta una volta giunta a completezza o quando non procedeva ulteriormente, aggiungendo una soluzione diluita di NaHCO3.
Gli eccessi enantiomerici sono stati determinati mediante analisi HPLC su fase stazionaria chirale.
Dai risultati riportati nella Tabella 1 si può notare come l’impiego del complesso monosostituito dia luogo ad una reazione più lenta rispetto a quella catalizzata dal complesso disostituito (prove 33 e 34) che però fornisce il prodotto con resa quantitativa ed e.e. solo lievemente più bassi. Questo andamento è generale, si ottengono conversioni complete del
2-35) ed eccessi enantiomerici di poco inferiori a quelli ottenuti utilizzando il complesso disostituito. Anche nel caso dell’addizione dell’acido fenilboronico al 2-ciclopentenone si ottiene il prodotto desiderato in tempi brevi di reazione, con conversione completa e con e.e. analoghi utilizzando entrambi i complessi catalitici (prove 37 e 38).
Con l’unico inconveniente di una minor velocità di reazione, queste condizioni risultano perciò più convenienti rispetto a quelle che prevedono un rapporto fosfito/Rh pari a 2, in quanto permettono un consumo più contenuto di legante chirale, che ha risvolti positivi sia sul costo della reazione che sulla purificazione del prodotto.
Abbiamo quindi provato ad effettuare nelle condizioni di formazione del complesso monosostituito e con la stessa procedura anche la reazione di formazione del prodotto 94 di doppia addizione (1,4 + 1,2) dell’acido boronico al 2-cicloesenone lavorando a 60°C e impiegando 3 equivalenti di acido fenilboronico. In questo caso però la reazione non procede oltre la formazione del prodotto di addizione coniugata anche prolungando il tempo di reazione.
La reazione di addizione coniugata asimmetrica di acidi arilboronici ad enoni ciclici catalizzata da [Rh(C2H4)2Cl]2 in presenza di fosfiti tropos risulta essere quindi una reazione modulabile, in quanto può essere diretta verso la formazione del prodotto di addizione coniugata 3 o del prodotto di doppia addizione 94 a seconda delle condizioni di reazione utilizzate: in presenza del complesso “Rh”-fosfito in rapporto 1:1 si ottiene esclusivamente il prodotto di addizione coniugata lavorando sia a temperatura ambiente o a 60°C; mentre utilizzando un rapporto Rh/fosfito pari a 1:2 ed un eccesso di acido boronico si può spingere la reazione verso la formazione del prodotto di doppia addizione 94.
15
BIBLIOGRAFIA
1 Iuliano, A.; Losi., D.; Facchetti, S. J. Org. Chem. 2007, 72, 8472-8477.
2 Suárez, A.; Pizzano, A.; Fernández, I.; Khiar, N. Tetrahedron: Asymmetry 2001, 12, 633-642. 3 Mikami, K.; Yamanaka, M. Chem. Rev. 2003, 103, 3369-3400.
![Figura 1 Spettro 31 P-NMR (121.4 MHz, THF-d 8 ) del complesso [Rh(C 2 H 4 ) 2 Cl] 2 -71 in rapporto 1:1](https://thumb-eu.123doks.com/thumbv2/123dokorg/7309794.88193/2.892.85.752.150.520/figura-spettro-nmr-mhz-thf-complesso-rh-rapporto.webp)
![Figura 4 Spettro 31 P-NMR (121.4 MHz, THF-d 8 ) dei complessi: a) [Rh(C 2 H 4 ) 2 Cl] 2 /71 1:1; b) Rh(C 2 H 4 ) 2 (acac)/71 1:1](https://thumb-eu.123doks.com/thumbv2/123dokorg/7309794.88193/6.892.79.765.130.630/figura-spettro-nmr-mhz-thf-complessi-rh-acac.webp)
![Figura 5 Spettro 31 P-NMR (121.4 MHz, toluene-d 8 ) del complesso [Rh(C 2 H 4 ) 2 Cl] 2 -71: a) t=2 h, “Rh”/71 = 1:1; b) t=30 h, “Rh”/71 = 1:1; c)eccesso di 71, “Rh”/71 = 1:3](https://thumb-eu.123doks.com/thumbv2/123dokorg/7309794.88193/7.892.143.788.101.541/figura-spettro-nmr-mhz-toluene-complesso-eccesso-rh.webp)
![Figura 6 Spettro 31 P-NMR (121.4 MHz, THF) del complesso [Rh(C 2 H 4 ) 2 Cl] 2 -73 in rapporto 1:1 a: a) T=25°C; b) T=40°C; c) T=60°C](https://thumb-eu.123doks.com/thumbv2/123dokorg/7309794.88193/8.892.87.765.543.986/figura-spettro-nmr-mhz-thf-complesso-rh-rapporto.webp)
![Figura 7 Spettro 31 P-NMR (121.4 MHz, toluene) del complesso [Rh(C 2 H 4 ) 2 Cl] 2 -75b in rapporto 1:1 a: a) T=25°C; b) T=0°C; c) T=-20°C; d) T=-40°C; e) T=-60°C](https://thumb-eu.123doks.com/thumbv2/123dokorg/7309794.88193/9.892.130.810.510.962/figura-spettro-nmr-mhz-toluene-complesso-rh-rapporto.webp)
![Figura 8 Spettro 31 P-NMR (121.4 MHz, toluene) del complesso [Rh(C 2 H 4 ) 2 Cl] 2 -71 in rapporto 1:1 a: a) T=25°C; b) T=0°C; c) T=-20°C; d) T=-40°C; e) T=-60°C; f) T=-80°C](https://thumb-eu.123doks.com/thumbv2/123dokorg/7309794.88193/11.892.123.807.104.570/figura-spettro-nmr-mhz-toluene-complesso-rh-rapporto.webp)
![Tabella 1 Addizione coniugata degli acidi arilboronici 2a-b agli enoni 1a-b catalizzata da [RhCl(C 2 H 4 ) 2 ] 2 in presenza del fosfito 71](https://thumb-eu.123doks.com/thumbv2/123dokorg/7309794.88193/13.892.117.814.171.597/tabella-addizione-coniugata-acidi-arilboronici-catalizzata-presenza-fosfito.webp)