CAP. 2 MATERIALI E METODI
2.1 SEDIMENTI
2.1.1 Campionamento
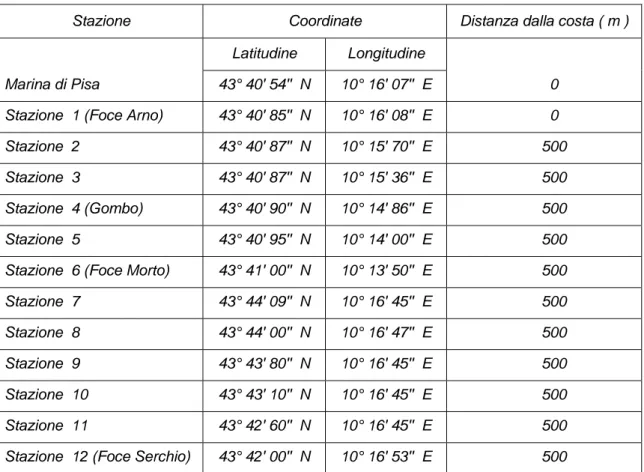
Il campionamento è stato effettuato nel settembre del 2007 a partire dalla foce del fiume Arno fino alla foce del fiume Serchio. Le stazioni da noi scelte sono mostrate in figura 2.1 con le rispettive coordinate, indicate nella tabella sottostante:
Stazione Coordinate Distanza dalla costa ( m )
Latitudine Longitudine
Marina di Pisa 43° 40' 54'' N 10° 16' 07'' E 0 Stazione 1 (Foce Arno) 43° 40' 85'' N 10° 16' 08'' E 0 Stazione 2 43° 40' 87'' N 10° 15' 70'' E 500 Stazione 3 43° 40' 87'' N 10° 15' 36'' E 500 Stazione 4 (Gombo) 43° 40' 90'' N 10° 14' 86'' E 500 Stazione 5 43° 40' 95'' N 10° 14' 00'' E 500 Stazione 6 (Foce Morto) 43° 41' 00'' N 10° 13' 50'' E 500 Stazione 7 43° 44' 09'' N 10° 16' 45'' E 500 Stazione 8 43° 44' 00'' N 10° 16' 47'' E 500 Stazione 9 43° 43' 80'' N 10° 16' 45'' E 500 Stazione 10 43° 43' 10'' N 10° 16' 45'' E 500 Stazione 11 43° 42' 60'' N 10° 16' 45'' E 500 Stazione 12 (Foce Serchio) 43° 42' 00'' N 10° 16' 53'' E 500
Figura 2.1: Ubicazione delle stazioni di campionamento
Il campionamento costituisce la fase preliminare di ogni tipo di analisi e deve essere svolto accuratamente per evitare di condizionare i risultati di tutte le operazioni successive. Il sedimento, utilizzato per la preparazione degli elutriati, è stato prelevato con una benna in acciaio inossidabile, appositamente realizzata nel laboratorio di Biofisica del CNR di Pisa. I sedimenti sono stati posti in contenitori di polietilene accuratamente lavati con soluzioni acidulate (HNO3, 10%), conservati al buio, a 4 °C, per un periodo non superiore a due settimane. I sedimenti sono stati raccolti a circa 500 m dalla costa per tutte le stazioni ad eccezione della stazione di Marina di Pisa, per la quale il sedimento è stato raccolto lungo la costa.
2.1.2 Preparazione degli elutriati
Per l’analisi dei sedimenti, le procedure standard si basano sul principio di “estrarre” dal sedimento i polluenti come acqua interstiziale o “pore water” ovvero come elutriato. Con questo termine si indica una soluzione che si ottiene mescolando energicamente, in opportuni rapporti di volume o peso, il sedimento da saggiare con acqua avente le caratteristiche del corpo d’ acqua ove è localizzato il sedimento stesso.
Per ottenere gli elutriati il sedimento è stato mescolato all’acqua di mare naturale in un rapporto 1:4, 25 g di sedimento in 100 ml di acqua; il rapporto è stato calcolato utilizzando il peso secco del sedimento che è stato determinato mettendone una quota (2 gr) in stufa a 60 °C fino a peso costante. La soluzione, così preparata, è stata sottoposta ad agitazione tramite un agitatore verticale modello STIRRER type BS (VELP Scientifica, BIO CLASS) a 500 rpm per 24 ore. Successivamente, la fase acquosa è stata separata dal sedimento tramite centrifugazione a 7000 rpm per 15 minuti e il sovranatante è stato filtrato con filtri da 0,2 μm (Millipore).
L’elutriato sterile così ottenuto, è stato in parte utilizzato subito per i biosaggi di mutagenesi e in parte conservato a -20 °C per un successivo impiego.
Questa procedura è stata utilizzata per preparare tutti gli elutriati delle dodici stazioni analizzate.
2.2 LIEVITO
Saccharomyces cerevisiae2.2.1 Generalità
Il lievito Saccharomyces cerevisiae è da millenni utilizzato dall’uomo per la produzione di pane, formaggio, vino e birra. Da alcuni decenni, questo semplice eucariote unicellulare, si è rivelato anche un ottimo ed economico organismo modello per affrontare diversi meccanismi biologici molecolari. E’ noto da tempo alla comunità scientifica che lo studio e la comprensione dei meccanismi molecolari che sono alla base dei processi vitali degli eucarioti pluricellulari e dell’uomo, trae molteplici vantaggi dall’utilizzo di un microrganismo, quale il lievito, che cresce e si divide come i batteri, pur conservando la complessità molecolare e organizzativa caratteristica degli eucarioti superiori. Il DNA nucleare di S. cerevisiae è molto più grande del genoma del batterio Escherichia coli, ma molto piccolo rispetto a quello dell’uomo. Il lievito è in grado di sintetizzare la maggior parte delle molecole organiche a partire da composti inorganici, quindi i nutrienti necessari alla sua crescita si limitano a sali minerali, ad una fonte di azoto e ad uno zucchero da utilizzare come fonte di energia. Quando l’ambiente nutrizionale è povero, soprattutto carente in azoto, le cellule diploidi vanno incontro a meiosi, sporificano e si generano da ciascuna quattro spore apolidi contenute in un unico asco, le quali possono essere separate ed utilizzate per dare origine a nuove linee cellulari aploidi stabili (Plevani et al., 1997). In seguito al completo sequenziamento del genoma del lievito sono stati costruiti ceppi ingegnerizzati e vettori plasmidici che permettono l’espressione nel lievito di altri organismi (Minarikova et al., 2001; Pushnova et al., 2001). Sono state identificate diverse omologie tra geni di lievito e geni umani, responsabili dell’insorgenza di varie malattie genetiche e ciò ha fatto sì che l’eucariote S. cerevisiae sia divenuto un buon modello per lo studio delle basi molecolari delle malattie umane (Foury, 1997; Andrade et al., 1998; Brenner, 2000).
2.2.2 Ciclo vitale
Il lievito S. cerevisiae appartiene alla classe dei funghi ascomiceti in quanto le strutture riproduttive sono costituite da aschi. Presenta un ciclo vitale con una fase apolide ed una diploide, in dipendenza delle condizioni nutrizionali variabili. Nel nucleo sono presenti 17 cromosomi + 3 frammenti. Le cellule hanno forma ellissoidale di 5-7 micron e si dividono per gemmazione. Il processo inizia con l’estroflessione della parete della cellula madre, seguita da una divisione nucleare e formazione della parete di separazione. Un simile evento impiega, in condizioni ottimali di nutrimento e ad una temperatura compresa tra 20-30 ° C, un tempo pari a 70-70 minuti. La cellula madre generalmente forma 20-30 gemme. La riproduzione sessuale inizia da una cellula diploide che dà origine ad un asco in cui sono ottenute 4 ascospore aploidi, che appartengono a due differenti tipi di accoppiamento: a e α. L’accoppiamento di una cellula aploide a con una cellula aploide α origina una cellula diploide normale a /α. Cellule apolidi dello stesso sesso possono anche unirsi occasionalmente per formare cellule anormali a / a o α / α, che si possono riprodurre esclusivamente per via sessuale.
Figura 2.2: Ciclo vitale del lievito Saccharomyces cerevisiae, modificato da Plevani et al.,1997.
Per il breve tempo di moltiplicazione e la stabilità dei ceppi, questo microrganismo costituisce un mezzo molto utile per gli studi di genetica di base e applicativa.
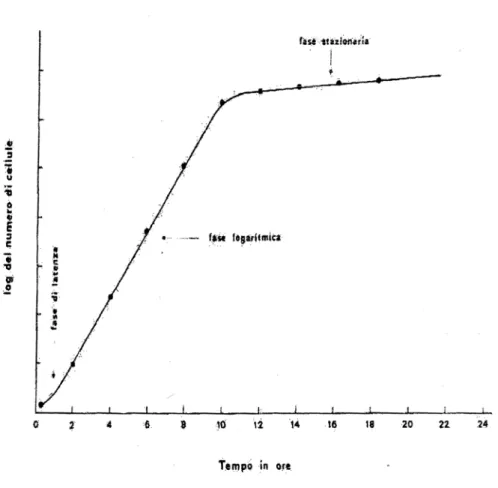
Durante la crescita delle cellule lievito si possono distinguere le seguenti fasi:
- fase di latenza detta anche lag o di adattamento, nella quale le cellule non si dividono,
ma si portano nelle condizioni fisiologiche necessarie per la divisione.
- fase di crescita esponenziale o fase logaritmica, nella quale tutte le cellule si
moltiplicano con un tasso costante e con velocità proporzionale alla densità della coltura.
- fase stazionaria, nella quale il numero delle cellule neoformate è pari a quello delle
cellule che muoiono. Ciò è dovuto all’esaurimento delle sostanze nutritive nel terreno di coltura. Per determinare il tempo che impiega una cellula di lievito per la duplicazione, è necessario analizzare la sua curva di crescita, che varia in base alle condizioni
sperimentali, come il terreno di crescita, la temperatura di incubazione e la presenza di nutrienti (Del Giudice, 1987).
Figura 2.3: Curva di crescita del lievito, modificata da Del Giudice, 1987.
2.2.3 Conteggio delle cellule
Per titolo di coltura si intende il numero di cellule presenti in 1 ml di questa coltura. Conoscere il titolo spesso è un fattore determinante alla realizzazione di un esperimento. Il calcolo può essere eseguito in diversi modi:
- mediante microscopio ottico utilizzando appositi vetrini, come la camera Thoma o di Burker. Nel nostro caso è stata utilizzata la camera Thoma. Questo tipo di conteggio
non consente di distinguere le cellule morte presenti nella soluzione (Del Giudice, 1987);
- mediante piastramento su terreno solido che permette di conoscere il titolo vitale di una coltura. Questo si effettua prelevando da una coltura di mantenimento un’ aliquota nota e diluendola opportunamente in modo da piastrare circa 200 cellule su terreno completo. In seguito le piastre vengono incubate a 30 °C per 5 giorni e, poiché ogni colonia deriva da una singola cellula, dal numero di colonie sviluppate in piastra si può risalire al titolo vitale della coltura (Del Giudice, 1987).
2.3 CEPPO D7
2.3.1 Caratteristiche
E’stato utilizzato il ceppo diploide eucariote D7, ottenuto da Zimmerman incrociando due ceppi aploidi parentali D7A (a: ade 2-40, trp 5-12, ilv 1-92) e D7B (α: ade 2-119, trp 5-27, ilv 1-92) formando un ceppo con il seguente genotipo:
a: ade 2-40 trp 5-12 ilv 1-92
α: ade 2-119 trp 5-27 ilv 1-92
Il ceppo consente di valutare contemporaneamente tre eventi genetici: il crossing over mitotico (CO), la conversione genica mitotica (CG) e la mutazione puntiforme (MP). Le cellule di tale ceppo, se piastrate in terreno di crescita, formano colonie di colore bianco, per complementazione degli alleli ade 2-40 (fenotipo rosso) e ade 2-119 (fenotipo rosa). La CG e la MP si possono mettere in evidenza per la capacità delle cellule, auxotrofe per il triptofano e l’isoleucina, di riprodursi in terreni privi dei rispettivi aminoacidi, cioè di diventare prototrofe. La mutazione che determina la
conversione può avvenire sia nello stesso gene mutato originariamente, che in geni differenti (soppressione esterna).
- La CG è un tipo di ricombinazione non reciproca, cioè un processo di trasferimento unilaterale di piccoli tratti di DNA a singola elica (circa 1000 nucleotidi) tra cromatidi omologhi, nello stesso gene. Se la parte trasferita contiene una sequenza di basi diversa, a causa di una mutazione, da quella dell’elica ad essa complementare, si ha formazione, nel cromatidio interessato dalla conversione, di DNA eteroduplex, il quale viene riparato. Se la riparazione avviene in modo da eliminare la mutazione, si genera un cromatidio contenente una informazione funzionale. Nel ceppo D7 la CG viene evidenziata in due alleli mutati (trp 5-12 e trp 5-27) del “ locus “ trp5, contenuti nel cromosoma VII, i quali determinano una richiesta assoluta di triptofano. Un evento di CG in questo locus rende prototrofe le cellule che lo subiscono. Questo tipo di ricombinazione ha una frequenza spontanea di 0.8-1 convertanti/105 sopravvissuti.
-La MP è un cambiamento di una singola coppia di nucleotidi del DNA che si può avere o per sostituzione di una coppia di nucleotidi con un’altra o per inserzione o delezione di una coppia di nucleotidi. Le mutazioni sono frequentemente reversibili ed un evento che restaura il fenotipo normale è detto inversione o mutazione inversa.
La frequenza della MP nel ceppo D7, viene determinata nel locus genico ilv 1. Le cellule omozigoti per una mutazione (ilv 1-92) acquisiscono la capacità di crescere in un terreno privo di isoleucina in seguito ad un unico evento di reversione. Tale evento si verifica con una frequenza spontanea di 0.4-0.7 revertanti/106 sopravvissuti.
-Il CO è una ricombinazione reciproca, cioè uno scambio che avviene tra i cromatidi di cromosomi omologhi. Nel ceppo D7 il CO viene visualizzato su colonie pigmentate rosso-rosa (twin-spot), che sono dovute alla formazione di cellule omozigoti con genotipo ade 2-40 / ade 2-40 (tale omozigote ha una mutazione che blocca la sintesi dell’adenina per cui si accumula un intermedio che conferisce alla colonia il colore rosso) ed ade 2-19 / ade 2-119 (tale mutazione non blocca completamente, ma comunque rallenta la sintesi dell’adenina per cui il fenotipo risultante è rosa). La condizione di partenza è eteroallelica: ade 2-40 / ade 2-119.
Durante le divisioni cellulari, nella formazione della colonia, si può avere CO e passare perciò dalla condizione di eterozigoti a quella di omozigosi e così la colonia risulta metà bianca e metà rosa o rossa; oppure completamente rossa o rosa, se il CO è avvenuto subito. Tale evento si verifica con una frequenza spontanea di 0.3-0.5 x 10-4 (+ 0.2) cellule/sopravvissuti. (Zimmerman et al., 1975).
2.4 TERRENI DI COLTURA
2.4.1 Terreni liquidi - Terreno al 2 % di glucosio Bacto Peptone 10 g (2 %) Estratto di Lievito 5 g (1 %) Glucosio 20 g (2 %) Acqua Deionizzata 1000 ml - Terreno al 20 % di glucosio Bacto Peptone 10 g (2 %) Estratto di Lievito 5 g (1 %) Glucosio 200 g (20 %) Acqua Deionizzata 1000 mlI terreni liquidi vengono autoclavati a 121 °C alla pressione di 1 atm per 15-20 minuti.
2.4.2 Terreni solidi
-
Terreno completo (A)Bacto Peptone 8 g Glucosio 16 g Estratto di Lievito 4 g Agar 12 g Acqua Deionizzata 800 ml Piastramento: 250-300 cellule/piastra.
- Terreno minimo senza triptofano (B)
Glucosio 16 g Agar 12 g Yeast Nitrogen Base (senza aminoacidi) 5.35 g Adenina 1 ml Isoleucina 2 ml Acqua Deionizzata 800 ml Piastramento: 3-5 x 106 cellule/piastra.
- Terreno minimo senza isoleucina (C)
Glucosio 16 g Agar 12 g Yeast Nitrogen Base (senza aminoacidi) 5.35 g Adenina 1 ml Triptofano 3 ml Acqua Deionizzata 800 ml Piastramento: 20-30 x 106 cellule/piastra.
Tutti i terreni vengono autoclavati a 1 atm per 15-20 minuti. Quindi 20-25 ml di terreno vengono distribuiti in piastre Petri del diametro di 10 cm.
2.4.3 Preparazioni delle soluzioni stock
Adenina Solfato: 400 mg / 100 ml acqua deionizzata Triptofano: 270 mg / 100 ml acqua deionizzata Isoleucina: 2400 mg / 100 ml acqua deionizzata
Tutte le soluzioni sono sterilizzate, prima dell’uso, in autoclave a ½ atm per 15 minuti e conservate a 4 °C; solo la soluzione di adenina solfato è conservata a temperatura ambiente.
2.5 PROCEDURA SPERIMENTALE
CEPPO D7
2.5.1 Colture di mantenimento
Il ceppo D7 del lievito S. cerevisiae può presentare una certa instabilità genetica dovuta a diversi fattori come temperatura, condizioni nutrizionali limitanti nel terreno di crescita e/o di mantenimento ecc., quindi è consigliabile controllare periodicamente le frequenze spontanee di reversione e conversione. Pertanto si allestiscono delle colture di mantenimento in terreno completo liquido in modo da valutarne la frequenza spontanea di CG e MP. Con circa 1500 cellule prelevate da una coltura in fase stazionaria (0.1 x 10-4 ml della coltura di mantenimento in fase stazionaria) si inoculano 8-10 beute contenenti 100 ml di terreno nutritivo liquido completo. Le colture vengono in seguito incubate in agitazione (su agitatore a 100-150 rpm), alla temperatura di circa 30 °C in condizioni semianaerobiche. In tali condizioni, il tempo necessario per una divisione cellulare è di 70-90 minuti e da una cellula madre si originano in genere circa 20-30 cellule (Mortimer e Manney, 1973).
Le beute vengono lasciate crescere per 48 ore in modo da raggiungere la fase stazionaria (150-250 x 106 cell/ml) e successivamente seminate su piastre di terreno completo e selettivo, dopo aver effettuato opportune diluizioni:
- 0.1 ml della sospensione cellulare diluita 10-5 (200 cellule) su terreno completo (chiamato per semplicità A).
- 0.1 ml della sospensione cellulare diluita 10-1 (2-3 x 104 cellule) su terreno minimo privo di triptofano (chiamato per semplicità B).
- 0.1 ml della sospensione cellulare tal quale (20-30 x 106 cellule) su terreno minimo
privo di isoleucina (chiamato per semplicità C).
Le piastre vengono incubate a 30 °C e dopo 5 giorni si contano le colonie cresciute sui terreni A e B, dopo 7 giorni quelle sul terreno C. Dopo la conta, si calcola la media delle colonie presenti sul terreno completo A per valutarne la sopravvivenza e la media delle colonie presenti sui terreni minimi B e C per selezionare rispettivamente convertanti e revertanti.
Si tiene conto del fattore di diluizione che intercorre tra le semine sui differenti tipi di terreno e si valutano le frequenze come segue:
n° di colonie B x 10 = frequenza della CG x 10-5 n° di colonie A
n° di colonie C x 10 = frequenza della MP x 10-6 n° di colonie A
Il piastramento serve nel caso della fluttuazione anche a riscontrare eventuali inquinamenti principalmente dovuti alla presenza di batteri o muffe. Le beute di fluttuazione contenenti cellule sane in fase stazionaria, sono mantenute in frigo a 4 °C fino a quando non vengono utilizzate per gli esperimenti.
2.6 Esperimenti in crescita
2.6.1 Scopo
Con le prove in crescita si possono ottenere dati indicativi sull’eventuale influenza della sostanza in esame sul metabolismo delle cellule. Le cellule, dividendosi, risultano attive metabolicamente e quindi più permeabili alle sostanze presenti nel terreno di coltura. Perciò, mettendo nel terreno la sostanza alla concentrazione da saggiare, questa avrà modo di penetrare all’interno delle cellule e influenzare in qualche modo il loro metabolismo.
2.6.2 Fase stazionaria
Dalla coltura di mantenimento con le migliori frequenze spontanee di CG e MP, si preleva un’aliquota di cellule che viene fatta crescere in presenza della sostanza da analizzare, in questo caso con l’elutriato dei sedimenti marini, si aggiunge del terreno liquido al 2 % di glucosio e si mette ad incubare in agitatore termostatico alla temperatura di 30 °C per 48 ore (tempo necessario per raggiungere la fase stazionaria). Dopo il successivo piastramento, le cellule vengono nuovamente incubate a 30 °C e dopo 5 giorni si contano le colonie cresciute sui terreni A e B mentre dopo 7 giorni quelle sul terreno C. Infine si calcola le media delle colonie cresciute su terreno completo (A) per valutare la sopravvivenza, e la media delle colonie cresciute sui terreni minimi (B e C) in modo da selezionare rispettivamente convertanti e revertanti. La percentuale di sopravvivenza e le frequenze di CG e MP vengono calcolate utilizzando le stesse formule descritte precedentemente per le colture di mantenimento del ceppo.
2.6.3 Fase logaritmica
Dalla coltura di mantenimento con le migliori frequenze spontanee di CG e MP, si preleva un’aliquota di cellule che viene inoculata in terreno liquido al 20 % di glucosio e fatta crescere in presenza della sostanza da analizzare e si mette ad incubare alla temperatura di 30 °C per circa 6 ore (fino al raggiungimento della fase logaritmica). La procedura sperimentale che porta alla successiva incubazione delle piastre, al calcolo e alla valutazione della percentuale di sopravvivenza e delle frequenze di CG e MP è la stessa della fase stazionaria.
In fase logaritmica le cellule sono più permeabili e attive metabolicamente rispetto a cellule in fase stazionaria.
2.7 Esperimenti in crescita alternativi
2.7.1 Scopo
Attraverso gli esperimenti in crescita alternativi, si possono evidenziare e valutare gli effetti provocati da una sostanza durante le prime fasi di crescita cellulare. Esistono delle sostanze che esplicano la loro azione prevalentemente entro le prime ore.
2.7.2 Crescita a 2 ore
Dalla coltura di mantenimento con le migliori frequenze spontanee di CG e MP, si preleva un’ aliquota di cellule che viene fatta crescere in presenza della sostanza da analizzare, in terreno liquido al 2 % di glucosio e messa ad incubare alla temperatura di 30 °C per 2 ore. La procedura sperimentale che porta alla successiva incubazione delle
piastre, al calcolo e alla valutazione della percentuale di sopravvivenza e delle frequenze di CG e MP è la stessa della fase stazionaria e logaritmica.
2.8 Esecuzione dei test di mutagenesi
2.8.1 Fase stazionaria
Sono state preparate tante beute quante sono le tesi previste dall’esperimento nel seguente modo:
- x ml di terreno liquido al 2 % di glucosio; - x ml di elutriato sterile da saggiare;
- x ml di sospensione cellulare, prelevati da una coltura di mantenimento e opportunamente diluiti in modo da avere come concentrazione iniziale 15 cell / ml; Il volume finale all’interno belle beute, deve essere di 4 ml.
Per ogni saggio sono effettuati almeno due controlli mettendo, in entrambe le beute, 3 ml di terreno e 1 ml di sospensione cellulare del ceppo D 7. Le beute sono incubate in agitatore termostatico per 48 h a 30 °C, temperatura ottimale per la crescita delle cellule di lievito. Successivamente, dopo aver fatto le necessarie diluizioni, le soluzioni vengono piastrate e lasciate crescere a 30 °C per 5-7 giorni. Una volta cresciute, si prosegue con la conta delle colonie e si calcolano la sopravvivenza e le frequenze di CG e MP, come descritto per le colture di fluttuazione.
2.8.2 Fase di crescita logaritmica
Si preparano tante beute quante sono le tesi previste dall’esperimento nel seguente modo:
- x ml di terreno liquido al 20 % di glucosio; - x ml di elutriato sterile da saggiare;
- x ml di sospensione cellulare, prelevati da una coltura di mantenimento e opportunamente diluiti in modo da avere come concentrazione iniziale 8-10 x 106cell / ml;
Il volume finale all’ interno delle beute è di 4 ml.
Per ogni saggio sono effettuati almeno due controlli mettendo, in entrambe le beute, x ml di terreno al 20 % e x ml di sospensione cellulare del ceppo D 7.
Le beute sono messe ad incubare in agitatore termostatico per 6 h a 30 °C, dopodichè si segue la stessa metodica utilizzata per la fase stazionaria.
2.8.3 Fase di crescita a 2 ore
Si preparano tante beute quante sono le tesi previste dall’esperimento nel seguente modo:
- x ml di terreno liquido al 2 % di glucosio; - x ml di elutriato sterile da saggiare;
- x ml di sospensione cellulare, prelevati da una coltura di mantenimento e opportunamente diluiti in modo da avere come concentrazione iniziale 170-190 x 106cell / ml;
Per ogni saggio sono effettuati almeno due controlli mettendo, in entrambe le beute, 3 ml di terreno e 1 ml di sospensione cellulare.
Le beute sono messe ad incubare in agitatore termostatico per 2 h a 30 °C, dopodichè si segue la stessa metodica utilizzata per la fase stazionaria e logaritmica.
Questi test di mutagenesi sono stati effettuati allo stesso modo per tutti gli elutriati dei sedimenti derivanti dalle 12 stazioni campionate.
2.8.4 Analisi statistica dei dati
Per tutti i dati acquisiti dagli esperimenti effettuati sul ceppo D7 sono state calcolate le medie e le deviazioni standard. E’ stato utilizzato il test “t” di student per il confronto di due campioni indipendenti e si è valutato come livello di significatività (*) un p ≤ 0.05 (Camussi et al., 1986).
2.9 PROVE DI FITOTOSSICITA’
Lepidium sativum
2.9.1 Generalità
Il Lepidium sativum, detto comunemente crescione inglese, appartiene alla famiglia delle Cruciferae ed è una pianta annuale di rapido sviluppo che raggiunge i 20-40 cm in altezza. E’ utilizzato in cucina perché ricco di vitamine e sali minerali ed inoltre aiuta a disintossicarsi dal fumo. Il L. sativum è originario dell’Africa settentrionale e dell’Asia occidentale ma è ormai diffuso in tutto il mondo ed è presente anche in Italia soprattutto come pianta coltivata.
Negli ultimi decenni, questa pianta viene utilizzata nei test di fitotossicità, in quanto presenta dei tempi rapidi di germinazione e consente di effettuare test della durata di 24 e 48 ore, a differenza di altre piante che hanno bisogno di tempi di esposizione al tossico non inferiori a 120 ore.
2.9.2 Principio del metodo
Il test di tossicità acuta impiegato è quello proposto da De Bertoldi e Zucconi (1983) che consiste nel porre a contatto i semi di L. sativum con la matrice tal quale, oppure con gli estratti acquosi del materiale da saggiare, per 24 ore. La risposta viene espressa tramite l’ “Indice di Germinazione” (Ig), che considera sia gli effetti sulla germinazione che quelli sull’ allungamento radicale, il tutto riferito ad un controllo. Minore risulta l’indice trovato e maggiore sarà la tossicità del campione saggiato. L’azione fitotossica (riduzione dell’ indice di germinazione Ig), può anche essere espressa mediante un ulteriore parametro detto “Indice di Tossicità” (It).
Il test di tossicità su Lepidium è molto flessibile ed i risultati non cambiano per piccole variazioni delle condizioni sperimentali del biosaggio. L’indice di germinazione compensa eventuali variazioni dovute ad uso di tempi o temperature diversi da quelli indicati, tuttavia se la temperatura diminuisce progressivamente, sarebbe opportuno prolungare il periodo di incubazione.
La misura di una fitotossicità può considerarsi elevata quando l’indice di germinazione Ig è inferiore al 40 %, e può portare anche a conseguenze letali. Indici compresi tra 40-60 %, rilevano una tossicità ancora capace di causare danni reversibili come la riduzione temporanea dello sviluppo ma difficilmente letalità; indici superiori al 60-70 % segnalano che le piante non presentano alcun danno; quando Ig è superiore al 100 % significa che la sostanza saggiata ha agito da fitonutriente.
2.9.3 Esecuzione di biosaggio conL. sativum
- Il biosaggio viene eseguito in piastre Petri (8-9 cm di diametro) contenenti carta bibula imbevuta con 1 ml di soluzione da testare;
- si parte da una soluzione tal quale e via via si prendono in esame differenti diluizioni per osservarne i potenziali effetti fitotossici;
- si utilizzano 6-8 semi per piastra e, in questo caso, sono state effettuate 18 ripetizioni per ogni soluzione da saggiare;
- l’incubazione avviene al buio per 24 e 48 ore a circa 27 °C;
2.9.4 Analisi dei dati
- vengono misurati il numero dei semi germinati e la lunghezza media radicale;
- i risultati vengono espressi come indice di germinazione Ig ricavato dal prodotto relativo (controllo = 100) della germinazione per la lunghezza radicale:
Ig = Rt x Lt x 100
Rc x Lc
Dove Rt e Rc rappresentano rispettivamente la radicazione media nel trattamento e nel
controllo, e Lt e Lc le relative lunghezze medie radicali (Zucconi, De Bertoldi, 1983).
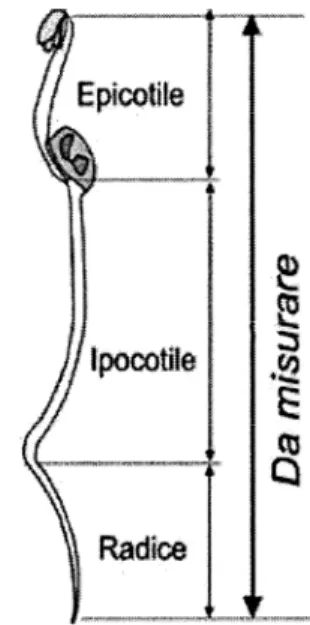
Figura 2.4: schema dei semi germinati, con indicazione del tratto di apparato radicale da misurare (Baudo et al., 1999).
Fig. 2.5: germinazione dei semi di Lepidium sativum.
Si esprime inoltre l’ indice di tossicità It:
It = 100 – Ig
Dove per 100 si considera l’ indice di germinazione del controllo e con Ig quello del trattamento.
2.10 Analisi dei Metalli
Per la determinazione della concentrazione dei metalli in tracce nelle acque è stata utilizzata la voltammetria di ridissoluzione anodica (AVS) con elettrodo (catodo) a film di mercurio. Le tecniche polarografiche sono molto sensibili; tale sensibilità è dovuta ad una prima fase di “preconcentrazione” in cui i vari ioni metallici presenti in soluzione subiscono una riduzione chimica (Me2+ + 2e- = Me0) in seguito all’applicazione di un potenziale elettrico costante superiore a quello necessario per far avvenire le reazioni di riduzione relative ad ogni singolo metallo. I metalli ridotti formano un amalgama con l’elettrodo (catodo) di Hg. La quantità di metallo che si deposita all’elettrodo è funzione del tempo di elettrolisi. Alla fine dell’elettrolisi la soluzione viene fatta riposare per alcuni secondi, dopo di che il potenziale applicato viene fatto diminuire nel tempo in modo tale che i vari metalli depositati sull’elettrodo si riossidino (Me0 = Me2+ + 2e-) e tornino in soluzione rendendo libere le cariche elettriche che determinano una corrente. L’intensità di corrente è proporzionale alla quantità di metallo che si è riossidato e quindi a quello che si era depositato all’elettrodo nella prima fase di deposizione e in definitiva alla concentrazione del metallo in soluzione. Dalla conoscenza del potenziale al quale si verifica l’ossidazione del metallo, si ottiene una identificazione qualitativa del tipo di metallo presente in soluzione. Le misure voltammetriche sono state condotte a pH 2 (aggiunta di 50 µl di HCl Suprapur in 20 ml di campione) per la determinazione della concentrazione totale del metallo disciolto, e a pH 8 per la determinazione della frazione labile.
La concentrazione dei metalli determinata a pH naturale (pH 8), comprende solo il metallo ionico e tutto quello che deriva dai complessi più labili in base alla reazione di riduzione che avviene all’elettrodo:
Per determinare anche la frazione di metallo legata stabilmente a molecole organiche è necessario procedere con trattamenti quali l’acidificazione (pH 2) in modo tale da spostare anche i complessi più stabili.
Le misure voltammetriche sono state condotte con un polarografo Metrohm model 646 VA in connessione con uno stativo 647 VA, equipaggiato con un sistema convenzionale a tre elettrodi, consistente di un elettrodo ausiliario di carbone vetroso, di un elettrodo di riferimento ad Ag/AgCl/KCl (3M) a doppia giunzione e di un elettrodo di lavoro costituito da un disco di carbone vetroso (3 mm) sul quale viene depositato uno strato sottile di mercurio (MFE). Il film di mercurio veniva ottenuto depositando per 600 sec a Edep = -1 V una soluzione 5 ⋅ 10-5 M di Hg(NO3)2, dopodichè la cella elettrolitica veniva
lavata con acqua Milli-Q ed utilizzata per le successive misure dei campioni. Il tempo di deposizione era di 300 sec ed il potenziale di deposizione Edep = -1 V.