CAPITOLO 1
LAB
IOMASSA COMEF
ONTER
INNOVABILE PER LAP
RODUZIONE DIC
HEMICALS1.1 IL RUOLO DELLE BIOMASSE NEL PANORAMA ENERGETICO
Con il termine biomassa si intendono tutte quelle sostanze in forma non fossile di origine biologica, animale e vegetale; possono essere suddivise in quattro categorie [1]:
- residui forestali dell’industria del legno (derivano dalle lavorazioni delle segherie e dagli interventi di manutenzione del bosco);
- sottoprodotti agricoli (paglie, stocchi, sarmenti di vite, ramaglie di potatura, ecc.); - residui dell’industria agroalimentare (sanse, vinacce, lolla di riso, ecc.);
- colture energetiche (servono per la produzione di biocombustibili: girasole, colza, miscanto, canna da zucchero, sorgo, pioppo, acacia, eucalipto, ecc.).
Oltre a queste categorie è necessario considerare il rilevante ruolo che potrà avere l’utilizzo della frazione organica dei rifiuti solidi urbani e gli scarti cellulosici di alcune industrie, come le cartiere.
La produzione mondiale annua di biomasse è stimata essere di oltre 2 x 1011 tonnellate; il 75% è rappresentata da carboidrati e il 20% da lignine. Questi numeri danno l’idea dell’enorme quantità di materia che può essere utilizzata come riserva energetica [2][30].
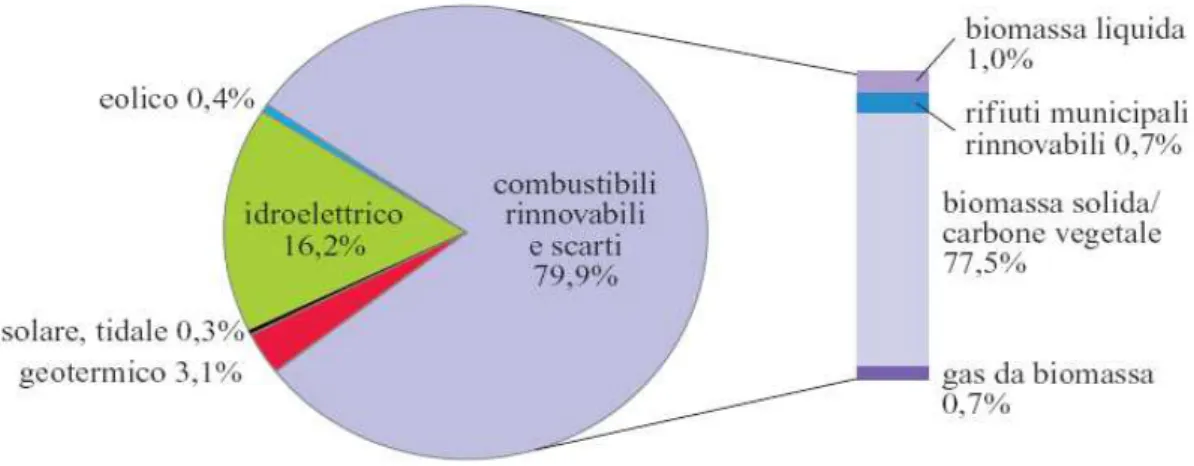
La produzione di energia da fonti rinnovabili era coperta, nel 2003, per quasi l’80% da biomasse (Fig. 1); queste rivestono quindi un ruolo primario. Il peso relativo delle biomasse nella produzione di energia varia da regione a regione [3].
Le biomasse, in natura, non sono fonti rinnovabili in assoluto ma si possono considerare tali se vengono impiegate a un ritmo non superiore alle loro capacità di rinnovamento biologico: le biomasse non sono illimitate quantitativamente ma, per ogni specie vegetale utilizzata, la disponibilità trova un tetto massimo nella superficie ad essa destinata e nei vincoli climatici e ambientali che tendono a limitare in ogni regione le specie che vi possono crescere convenientemente [4].
D’altro canto la biomassa costituisce la forma più sofisticata di accumulo dell’energia solare. Tramite la fotosintesi clorofilliana ed altri processi metabolici gli organismi vegetali utilizzano l’apporto energetico del sole per convertire la CO2 atmosferica e l’acqua nelle complesse molecole di cui sono costituiti: carboidrati, lignina, proteine, lipidi e numerosi prodotti secondari organici e inorganici. La biomassa vegetale assorbe quindi CO2 dall’atmosfera durante la crescita e la restituisce durante la combustione. Il bilancio della CO2 di questi processi è nullo e non contribuisce all’effetto serra [5].
L’utilizzazione di colture dedicate per la produzione di chemicals e per fini energetici può risultare economicamente vantaggiosa quando queste si presentano concentrate nello spazio e disponibili con sufficiente continuità nell’arco dell’anno; una eccessiva stagionalità e una grande dispersione sul territorio rendono infatti più onerosi la raccolta, il trasporto e lo stoccaggio.
Il ricorso alle biomasse attualmente risulta in molti casi oltre i limiti della praticabilità se considerato esclusivamente sotto l’aspetto economico e della resa energetica, ma è interessante e conveniente se si considera anche il valore ambientale dell’intervento (contenimento delle emissioni di CO2 e smaltimento di rifiuti) . Tuttavia l’obiettivo delle bioraffinerie è cercare di rendere la trasformazione della biomassa un processo anche economicamente vantaggioso attraverso la valorizzazione di tutte le sue componenti.
Nell’ambito delle energie rinnovabili le biomasse sono ora considerate come un’importantissima risorsa per il futuro: in termine di contenuto energetico, la produzione complessiva di biomasse equivale a circa 8 volte il consumo mondiale annuale di energia [6]. Negli ultimi anni si è sviluppata una visione multifunzionale dell’agricoltura per una più razionale gestione dello spazio rurale. Coltivare specie che richiedono pratiche colturali poco intensive (non “impoveriscono” il terreno) destinate alla produzione di chemicals e energia su terreni non più richiesti alle colture dedicate all’alimentazione, possono portare numerosi vantaggi: oltre a rappresentare una fonte di reddito aggiuntiva per i proprietari dei terreni può limitare i processi di abbandono delle aree meno competitive quantitativamente e
qualitativamente per le produzioni convenzionali salvaguardandole sia sul piano paesaggistico che su quello della protezione della flora e della fauna.
Le colture dalle migliori “potenzialità energetiche” hanno alta produttività per unità di superficie e di tempo, sono caratterizzate da un alto tasso di efficienza fotosintetica e da una limitata necessità di pratiche agronomiche (lavorazioni del terreno, concimazioni, irrigazioni). Per questo sono state studiate anche specie infestanti come la ginestra, la canna comune e il cardo.
Le potenzialità energetiche delle biomasse risultano evidenti anche limitandoci al caso italiano. L’Italia importa oltre l’80% del suo fabbisogno energetico primario e possiede, secondo una stima, terreni agricoli abbandonati a rischio di dissesto idrogeologico o desertificazione per circa 3 milioni di ettari, oltre ad un patrimonio forestale di 7 milioni di ettari che in gran parte necessita di manutenzione e riconversione. Scelte mirate al corretto sfruttamento di queste risorse potrebbero risolvere parte dei problemi energetici dell’Italia, paese in cui, inoltre, sono stimate essere prodotte oltre 24 milioni di tonnellate di sostanza secca per anno di sottoprodotti e residui agricoli, agro - industriali e forestali che, in parte, potrebbero essere convertiti in chemicals ed energia. Oltre ai citati problemi energetici l’utilizzo di queste biomasse potrebbe contribuire a ridurre il cronico problema dello
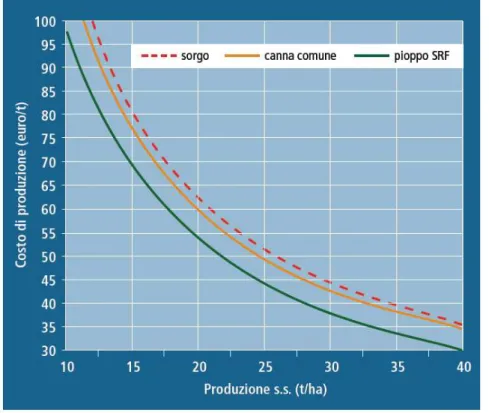
Figura 2 - Costi indicativi di
produzione, raccolta e trasporto in un raggio di 40 km di alcune colture adatte alla valorizzazione energetica [2].
smaltimento dei rifiuti; basti pensare che attualmente la stragrande maggioranza di questi residui e sottoprodotti devono essere smaltiti in discarica [2].
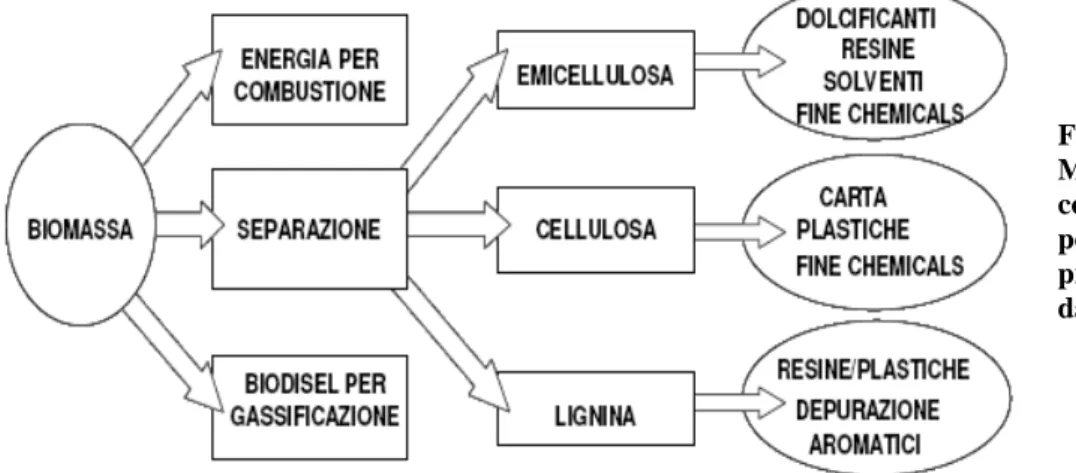
Dalle biomasse si possono ottenere “platform chemicals” ad alto valore aggiunto da usare nella sintesi di prodotti di uso comune normalmente sintetizzati a partire da petrolio. Dalle frazioni di emicellulosa, cellulosa e lignina si ottengono infatti carta, dolcificanti, resine, materie plastiche, solventi e fine chemicals.
1.2 TIPOLOGIE DI COLTURE ADATTE ALLA VALORIZZAZIONE ENERGETICA
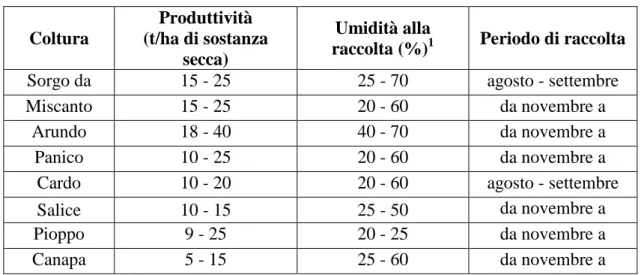
Le specie vegetali coltivate e studiate per la produzione di biomassa (Tab. 1) da utilizzare per la valorizzazione energetica possono essere raggruppate in tre tipologie principali [4].
- Colture da biomassa lignocellulosica: sono specie a elevata produzione di sostanza
secca che possono essere utilizzate in vari processi di conversione. Queste colture possono essere suddivise ulteriormente in 2 categorie.
· Short Rotation Forestry (SFR): le colture di questa categoria che sono adatte al
clima della penisola italiana sono il pioppo (Populus spp.), il salice (Salix spp.) e l’eucalipto (Eucaliptus spp.); queste hanno le caratteristiche migliori per una valorizzazione energetica sostenibile; sono colture fitte a ciclo molto breve che sono reimpiantate dopo il taglio delle piante o, ancora meglio, colture a impianto ultra fitto che vengono ripetutamente tagliate (ogni 1 - 3 anni) nell’arco della vita della piantagione.
· Colture erbacee poliennali o annuali: le specie adatte al clima e al territorio
italiano sono il miscanto (Miscanthus Sinensis Andrerss.), la canna comune
(Arundo Donax Linneaus) e il sorgo da fibra (Sorghum Bicolor). Nelle aree Figura 3 - Materiali di uso comune che possono essere prodotti a partire da biomassa.
con disponibilità idrica limitata possono essere coltivati il cardo (Cynara
cardunculus L.) e il panico (Panicum virgatum L.). Le specie che sono state
oggetto del nostro studio fanno parte proprio di questo gruppo e sono l’arundo, il sorgo ed il miscanto.
- Colture oleaginose: sono già utilizzante industrialmente per la produzione di biodisel
oli vegetali ottenuti da colza, soia e girasole; questi vengono transesterificati con metanolo per produrre combustibile “pulito” (assenza di zolfo e di composti aromatici, minori emissioni di PM10) con proprietà e prestazioni simili a quelle del gasolio ottenuto dal petrolio.
- Colture da carboidrati: sono già utilizzate industrialmente la canna da zucchero,
l’orzo, la bietola, il mais ed il frumento per produrre bioetanolo, da utilizzare come additivo o come combustibile tal quale, per fermentazione dei carboidrati contenuti in queste colture. Generalmente la biomassa subisce un processo di idrolisi e fermentazione ad opera di lieviti e batteri.
Tabella 1 - Produttività di alcune colture adatte alla valorizzazione energetica.
Coltura
Produttività (t/ha di sostanza
secca)
Umidità alla
raccolta (%)1 Periodo di raccolta
Sorgo da 15 - 25 25 - 70 agosto - settembre
Miscanto 15 - 25 20 - 60 da novembre a
Arundo 18 - 40 40 - 70 da novembre a
Panico 10 - 25 20 - 60 da novembre a
Cardo 10 - 20 20 - 60 agosto - settembre
Salice 10 - 15 25 - 50 da novembre a
marzo
Pioppo 9 - 25 20 - 25 da novembre a
Canapa 5 - 15 25 - 60 da novembre a
1 = Il contenuto di umidità alla raccolta della biomassa varia molto in funzione del periodo di raccolta, delle condizioni meteo - climatiche e del tempo che trascorre tra la raccolta della biomassa e la valutazione dell’umidità in essa contenuta.
1.2.1 Miscanto X Giganteus
Il Miscanthus Sinensis Andrerss (Fig. 4) è una graminacea perenne caratterizzata da germogli che raggiungono un’altezza di 3-5 metri, da un elevato ritmo di accrescimento e dalla considerevole capacità produttiva in termini di biomassa per unità di superficie. La specie, originaria dell’Asia orientale, si è ben adattata al clima temperato.
La pianta di miscanto presenta un fusto legnoso ed eretto, non ramificato, formato da una serie di internodi e contenente un midollo centrale. Le foglie, la cui lama può essere lunga fino a 130 cm, sono ampiamente sviluppate e il loro numero varia tra 10 e 20. Sull’apice della pianta si sviluppa una spiga; il diametro dei fusti raramente supera i 2 cm [7].
Attualmente il genere Miscanthus comprende quattordici specie differenti che tra loro possono dare luogo a ibridi. Tra le specie più adatte alla coltivazione sono da considerare M.
Sinensis, M. Sacchariflorus, M. Condensatus e M. Floridulus. Attualmente sono in corso studi
genetici per determinare i caratteri morfologici e produttivi più adatti all’habitat italiano in modo da ottimizzare le capacità produttive: ottenere la massima produzione di sostanza secca per unità di superficie nel minor tempo.
Studi sul genotipo Giganteus [8] hanno evidenziato una resa massima in sostanza secca di oltre 30 tonnellate per ettaro per anno. Dallo studio si evidenzia che la produttività in sostanza secca per ettaro aumenta in modo rilevante se l’apporto idrico è consistente (aumento medio di 8 tonnellate per ettaro) ma non aumenta se il terreno viene concimato (probabilmente perché la specie è già in grado di mobilitare i nutrienti degli strati più profondi del suolo). E’ stato oggetto della presente tesi la determinazione del periodo di raccolta ottimale delle piante in funzione sia della resa in sostanza secca per ettaro, che delle rese in acido levulinico e furfurale ottenute dopo il trattamento di idrolisi acida. Sono comunque da considerare anche altri fattori quali le condizioni climatiche e meteo dell’area nel periodo della raccolta che possono permettere un migliore utilizzo delle macchine operatrici, una ripresa vegetativa più rapida della coltura e, soprattutto, la possibilità di raccogliere un materiale a basso contenuto di umidità. Per il genotipo Giganteus, infatti, lo studio citato ha verificato una progressiva
diminuzione dell’umidità del raccolto fino a valori del 20 - 30 % in peso se la raccolta viene effettuata a marzo; questi valori permettono lo stoccaggio per lunghi periodi della biomassa senza la necessità di ulteriore essiccazione. Raccogliere in questo periodo tuttavia significa perdere fino al 15 % di sostanza secca a causa della caduta delle foglie (Fig. 5).
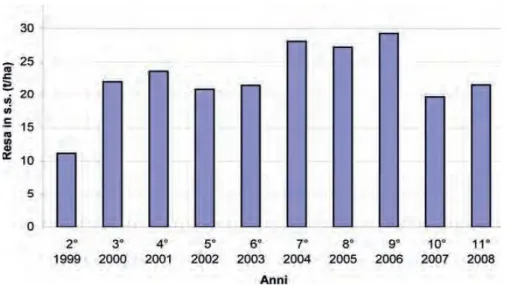
L’Università degli studi di Udine [8] ha effettuato uno studio di produttività in biomassa secca in funzione del tempo di raccolta del miscanto; la produzione in sostanza secca del miscanto, impiantato nel 1996, è compresa tra 11 e 29 tonnellate per ettaro e la media, nei 10 anni in cui è stato effettuato lo studio, è di 22,5 tonnellate per ettaro (Fig. 6); la raccolta è stata effettuata nella seconda metà di marzo. Le differenze riscontrate sono attribuibili principalmente alle variazioni termopluviometriche. Anche in questo studio il contenuto di umidità delle specie raccolte è compreso tra il 10 e il 15 % in peso; si conferma che anticipare la raccolta di circa 2 mesi significa aumentare il contenuto di umidità a circa il 30%.
Gli aspetti di maggiore criticità di questa coltura sono concentrati in 3 fasi: l’impianto e la fase terminale del ciclo produttivo (oltre 10 anni) sono costosi a causa del trapianto ed espianto dei rizomi (l’unità da cui si producono le radici e i fusti delle piante) mentre la raccolta necessita ancora di perfezionamento nella tempistica e nelle modalità. Durante il periodo in cui la coltivazione è a regime i costi e le operazioni da effettuare sono tuttavia praticamente nulli.
Al fine di rendere sostenibile da un punto di vista economico la filiera miscanto è fondamentale la sua valorizzazione energetica anche in termini di produzione di chemicals visto che l’economicità di questa coltura attualmente è strettamente condizionata dagli incentivi pubblici [9]. Figura 5 - Umidità percentuale alla raccolta del miscanto in vari periodi [8].
1.2.2 Sorgo Bicolor
Il sorgo (Fig. 7), un cereale, è diffuso praticamente in tutto il mondo visto che riesce a crescere anche in condizioni ambientali proibitive agli altri cereali (frumento, riso e mais). Le temperature ottimali per tutto il ciclo vegetativo sono comprese tra 20 e 30 °C.
Il sorgo, grazie ad un apparato radicale molto espanso, riesce ad assorbire acqua e nutrienti anche nelle condizioni più difficili; inoltre il sistema fogliare riesce a limitare molto l’evaporazione di acqua pur
mantenendo una elevatissima efficienza fotosintetica. In condizioni di stress idrico particolarmente accentuato e prolungato, la coltura, per limitare i danni, entra in una fase di stasi vegetativa per poi riprendersi quando le condizioni tornano favorevoli. Il sorgo necessita di una disponibilità idrica di circa
300 - 350 mm all’anno. La crescita è lenta nelle prime fasi di coltivazione, soprattutto se le temperature rimangono fresche, ma è estremamente veloce nelle fasi successive tanto che si possono realizzare 2 raccolti in 1 solo anno; la taglia arriva a 5 metri [10] [11]. In generale la variabilità genetica è piuttosto marcata. Esistono diversi genotipi dotati di caratteristiche diverse (taglia, contenuto di carboidrati, caratteristiche della fibra , ciclo colturale, ecc.).
Figura 6 - Resa di biomassa in sostanza secca (t / ha) nei raccolti.
Nell’ambito dello sviluppo delle biomasse agricole per uso energetico, nel centro-nord Italia un certo interesse è stato riservato al Sorghum Bicolor, coltura annuale che comporta pochi vincoli di immobilizzazione del terreno. Per verificare gli aspetti tecnici, produttivi ed economici di questa specie, nel 2007 è stato condotto uno studio, finanziato dalla regione Emilia Romagna, mediante la realizzazione di una coltivazione su 20 ettari [12].
Le prove di densità di investimento (numero di semi per metro quadro) e di concimazione sono state comparate con i parametri biometrici (altezza delle piante, diametro basale ed apicale), i dati produttivi ed il contenuto di umidità della cultura (raccogliere e trasportare biomassa più umida comporta maggiori oneri).
Nonostante la limitata disponibilità idrica dovuta all’andamento climatico poco piovoso nel periodo successivo alla semina, la coltura si è ben sviluppata in seguito all’approfondimento dell’apparato radicale. L’altezza delle piante, mediamente di 3,28 m, è rilevante visto l’andamento climatico piuttosto secco, anche se inferiore alla potenzialità di sviluppo della specie. La produttività in sostanza secca è stata mediamente di 20 t / ha. Considerata la scarsa disponibilità idrica questo è un dato comunque rilevante. Per migliorare le rese può essere opportuno l’uso di acque reflue e fanghi di depurazione.
1.2.3 Arundo Donax Linnaeus
L’Arundo Donax, o canna comune, è una pianta erbacea perenne della famiglia delle Graminacae i cui fusti (cavi e robusti) sono alti fino a 6 metri. Le foglie, di colore grigio-verde, sono lunghe 30 - 60 cm e larghe 2 - 6 cm; l’infiorescenza, una pannocchia lunga fino a 70 cm, viene prodotta a fine settembre.
È naturalmente diffuso nelle regioni
temperate e subtropicali di entrambi gli emisferi e può essere coltivata in diversi suoli e varie condizioni climatiche. La riproduzione avviene per via vegetativa attraverso rizomi sotterranei. Il rizoma, ben ancorato al terreno, si raccoglie a novembre o marzo [13].
L’arundo preleva grandi quantità di acqua dal suolo per sostenere la sua rapida crescita durante la stagione primaverile (fino a 10 cm al giorno, è tra le specie terrestri a crescita più
rapida al mondo). Dato il suo ritmo di crescita elevato la specie è un ottimo candidato per la produzione di biomassa tanto che ne produce, all’anno e per ettaro, la maggiore quantità rispetto a tutte le altre piante erbacee. A seconda del clima può essere raccolta anche 2 - 3 volte l’anno producendo, ogni volta, fino a 25 tonnellate di biomassa. La coltivazione può essere sfruttata per 20 - 25 anni senza necessità di impiantare nuovi rizomi e senza usare fertilizzanti e diserbanti. Esistono oltre 90 ecotipi, ciascuno con un periodo ottimale di raccolta; tra di essi è importante selezionare i migliori in relazione a produttività e resistenza alla siccità; da alcuni ecotipi si possono ottenere rese in biomassa anidra di 30 - 50 tonnellate per ettaro.
Gli input energetici necessari alla coltivazione della canna sono limitati rispetto alle tradizionali colture agrarie; l’arundo donax cresce spontaneamente in ambienti estremi (elevata salinità del terreno e scarsità d’acqua) che rendono difficile la sopravvivenza alle altre specie vegetali; può quindi essere coltivato in terreni marginali grazie all’efficienza dell’apparato radicale che esplora il terreno fino a 3 metri di profondità [14].
1.3 RESIDUI DELL’INDUSTRIA AGROALIMENTARE: GLI SCARTI DELLA TORREFAZIONE
DEL CAFFÈ
Il caffè appartiene alla famiglia delle rubiacee [15]; esistono oltre 60 specie appartenenti al genere coffea. Di queste solo 2 hanno un posto di rilievo nel commercio dei chicchi di caffè: la Coffea Arabica e la Coffea Canephora (Robusta). Attualmente la quasi totalità della produzione proviene dall’America Centrale, dal Brasile e dal Vietnam. La pianta del caffè necessita molta acqua e soffre se è troppo esposta al sole. E’ inoltre importante prestare attenzione all’altitudine per porre al riparo le piante di caffè
dalle forti escursioni termiche tra il giorno e la notte.
La Coffea Arabica è quantitativamente e qualitativamente più importante. La pianta può raggiungere i 10 metri di altezza ma nelle coltivazioni viene mantenuta ad un massimo di 3 metri per facilitare la raccolta dei frutti.
I frutti (Fig. 9) sono rappresentati da drupe che maturando, da verdi diventano rosse. Sono costituiti da una pellicola esterna (esocarpo) che racchiude la polpa (mesocarpo). All'interno
Figura 9 - I frutti della pianta del caffè.
della polpa sono presenti 2 semi. Ogni seme è rivestito da un sottilissimo tegumento (pellicola argentea) e più esternamente è avvolto dal pergamino, una pellicola di colore giallo dorato. Quando le ciliegie sono mature inizia la raccolta; può essere manuale, a setaccio o meccanica. Per estrarre i semi dal frutto si utilizzano 2 metodi. Nel metodo a secco le ciliegie vengono sparse su una superficie pulita e lasciate ad essiccare al sole. Successivamente vengono decorticate per liberare i chicchi di caffè dalla buccia e dal pergamino. I chicchi di caffè così estratti vengono chiamati “naturali”.
Nel metodo in umido le ciliegie vengono messe in acqua e passano attraverso una macchina che le spolpa lacerando la buccia e liberando il seme. Successivamente, i semi del caffè vengono messi in vasche di fermentazione per eliminare la polpa residua e il pergamino. Si passa poi all’essiccazione del chicco. I chicchi di caffè così estratti vengono chiamati “lavati”. Una volta estratto il chicco verde occorre eliminare le impurità (foglie, resti di pergamino, pellicola argentea e bastoncini). A questo punto il caffè verde è pronto per essere imballato e trasportato dai luoghi di produzioni alle torrefazioni sparse in tutto il mondo.
Il caffè verde è costituito da:
- acqua (8 - 14 %) e cellulosa (9 - 15 %);
- minerali (4 %: potassio, calcio, magnesio, fosfati, solfati, etc.) - sostanze azotate (6 - 15 %: proteine e aminoacidi) e sostanze
grasse (4 - 12 %: lipidi, trigliceridi e acidi grassi liberi); - zuccheri (10 %: saccarosio, polimeri dell’arabinosio e del
galattosio);
- cellulosa (9 - 15 %).
Durante il processo di tostatura (Fig. 10) il caffè è sottoposto a riscaldamento controllato in un cilindro rotante mediante correnti di aria calda, tra i 200 °C e i 240 °C; una volta raggiunto il punto di
cottura desiderato la miscela è rapidamente raffreddata. La durata del processo varia a seconda del grado di cottura da raggiungere: si parla di torrefazione lenta se dura più di 10 minuti e di torrefazione rapida se il tempo di cottura è compreso tra 2,5 e 6 minuti.
Durante questo processo il caffè cambia fisicamente (i tessuti si modificano già a 50 °C): esternamente diviene oleoso (si libera caffeone) ed assume la tipica colorazione bruna per effetto della caramellizzazione degli zuccheri, della carbonizzazione della cellulosa e della formazione di composti volatili. Inoltre i chicchi diventano friabili, perdono il 18 - 20 % di peso a causa dell’evaporazione dell’acqua e della liberazione di alcune sostanze volatili (cosa che accade tra 60 e 100 °C); il volume del chicco aumenta del 30 - 50 % poiché all'interno si
Figura 10 -
sviluppa CO2. Anche la composizione chimica cambia: il contenuto di caffeina si riduce, l'umidità scende dal 13 all’1 % e mutano anche le centinaia di sostanze chimiche presenti nei chicchi. In particolare i carboidrati si perdono durante la tostatura per depolimerizzazione e per formazione di composti aromatici mediante reazione con gli aminoacidi.
È proprio durante il processo di tostatura che si producono degli scarti di materiale finemente suddiviso che viene trascinato via dalla corrente d’aria utilizzata nella macchina tostatrice; questi scarti rappresentano un costo per l’azienda di torrefazione perché sono attualmente smaltiti in discarica. Nel presente lavoro di tesi questi scarti sono stati sottoposti al processo di idrolisi per l’ottenimento di acido levulinico e furfurale visto che sono costituiti, in parte, anche da materiali lignocellulosici.
1.4 STRUTTURA E COMPONENTI DELLA BIOMASSA LIGNOCELLULOSICA
La biomassa è una matrice complessa costituita prevalentemente da materiale lignocellulosico; questo materiale, che si trova essenzialmente nella parete cellulare di tutte le cellule vegetali e ne è la struttura portante, è formato da 3 componenti: emicellulosa (23 - 32 %), cellulosa (38 - 50 %) e lignina (15 - 35 %). Cellulosa e emicellulosa costituiscono la parte polisaccaridica del materiale lignocellulosico, detta olocellulosa. Emicellulosa, cellulosa e lignina interagiscono e si associano tra loro per mantenere e rafforzare l’integrità delle pareti cellulari e per conferire stabilità strutturale alla pianta.
Sono inoltre presenti, in composizione variabile, altri componenti non strutturali, organici (amido, proteine ed estratti) e inorganici (ceneri) [16].
Nelle piante il tessuto vegetale è costituito da cellule eucariote provviste di membrana e parete cellulare; queste cellule si distinguono da quelle degli altri regni viventi per la presenza di alcune strutture caratteristiche tra cui, appunto la parete cellulare. La parete, esterna alla membrana cellulare, è costituita proprio da notevoli quantità dei polimeri oggetto di valorizzazione nel presente lavoro di tesi: cellulosa, emicellulosa e lignina.
In particolare la parete cellulare (Fig. 11) è suddivisa in lamella mediana (formata da pectina e acqua, con la funzione di tenere unite le diverse cellule del tessuto vegetale), parete primaria e parete secondaria (interna alla parete primaria). La parete primaria è formata da pectine ed emicellulose e da una componente fibrillare di cellulosa (10-15 %); le macrofibrille di cellulosa sono orientate secondo diverse direzioni. Nella parete secondaria prevale la
componente fibrillare (60 % di cellulosa) che è immersa in una matrice di pectina ed emicellulosa. Le fibrille di cellulosa sono orientate parallelamente tra loro [17].
1.4.1 Cellulosa
La cellulosa è un omopolisaccaride a catena non ramificata di formula generale (C6H10O5)n avente un grado di polimerizzazione (DP) compreso tra 1.000 (nei legni) e 10.000 (per la cellulosa del cotone). La cellulosa costituisce la struttura di sostegno delle biomasse presenti sulla terra; costituisce inoltre circa il 50% del materiale della parete cellulare. Per questo motivo è il polisaccaride più importante e il polimero naturale più abbondante sulla terra. La cellulosa costituisce il 40 - 50 % in peso della biomassa secca. Mediamente circa il 50 % delle pareti cellulari è costituita da cellulosa; questa percentuale varia molto con la specie vegetale tanto che la parete cellulare del lino, ad esempio, è cellulosa al 99 % [18]. L’unità base del polimero è un anello di D-glucosio (più precisamente β-D-glucopiranosio) (Fig. 12). I monomeri, da 300 a 3.000, sono legati tra loro mediante legami 1,4-β-glicosidici.
Il polimero assume una struttura che minimizza l’ingombro sterico: ogni anello di β-D-glucopiranosio è ruotato di 180° rispetto al successivo a
formare una unità di cellobiosio. L’elevata stabilita di tale conformazione conferisce una certa rigidità alla catena polimerica; questa può essere infatti descritta come un nastro (Fig. 13). Figura 11 - La struttura della parete cellulare: il ruolo di cellulosa, emicellulosa e lignina. Figura 12 - Struttura chimica del D - glucosio.
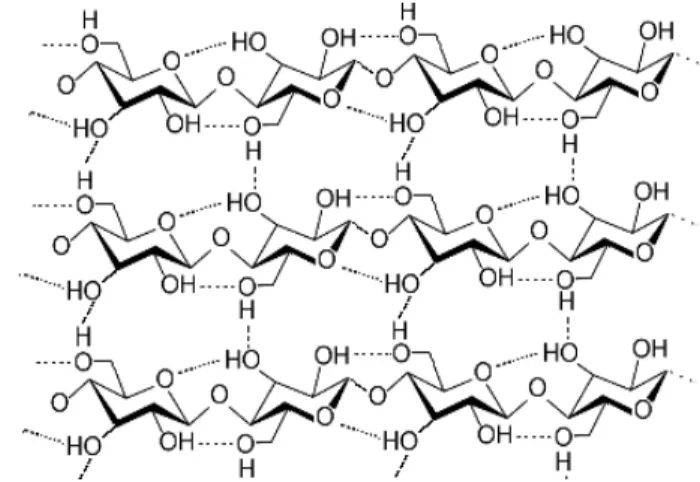
La presenza di un grande numero di gruppi ossidrilici lungo la catena non può che portare alla formazione di legami a idrogeno sia intra che intermolecolari (Fig. 14); i legami a idrogeno sono formati tra un atomo di idrogeno di un gruppo alcolico e un atomo di ossigeno della stessa catena (legame intramolecolare) o di una catena parallela (legame intermolecolare).
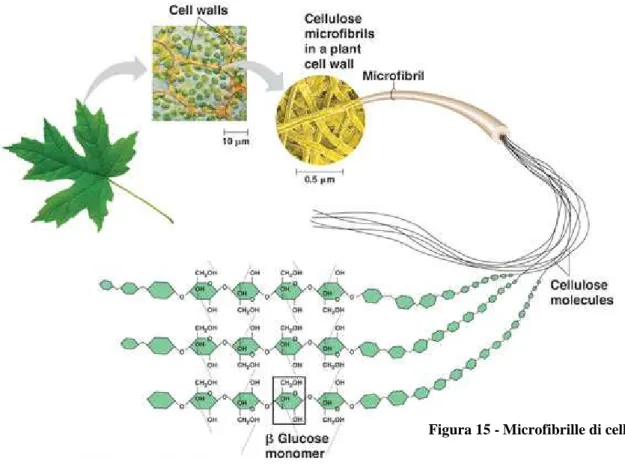
A livello sovramolecolare l’esistenza dei
legami a idrogeno e di interazioni deboli di Van der Waals, porta alla formazione di microfibrille (Fig. 15). In queste strutture le catene polimeriche di cellulosa sono disposte parallelamente le une alle altre ma sono impossibilitate a scorrere le une sulle altre; questo conferisce alla cellulosa una rilevante rigidità oltre ad una notevole resistenza meccanica e chimica; la cellulosa è infatti insolubile e molto più resistente all’idrolisi rispetto agli altri polisaccaridi tanto che non può essere metabolizzata dall’organismo umano. Le fibrille elementari sono formate solo da 36 catene polimeriche ma sono note strutture in cui ci sono oltre 1200 catene [19].
Figura 13 - Il legame glicosidico tra i monomeri costituenti la cellulosa e la struttura spaziale che assume il polimero.
Figura 14 - Legami a idrogeno intra e intermolecolari tra i gruppi ossidrilici
Nelle microfibrille si distinguono zone cristalline, altamente ordinate e difficilmente accessibili ai reattivi chimici, e zone amorfe, più facilmente idrolizzabili. Condizioni di idrolisi acida non molto forte sono sufficienti per attaccare sia la parte amorfa della cellulosa che per idrolizzarne la parte cristallina.
1.4.2 Emicellulosa
L’emicellulosa è un polimero eterogeneo (eteropolisaccaride) non lineare a catena corta (massimo 200 residui saccaridici) che, a seconda del vegetale in cui è sintetizzata, assume varie composizioni; è costituito essenzialmente da unità di pentosi (xilosio e arabinosio) ed esosi (glucosio, galattosio e mannosio); sono presenti anche unità monomeriche di L-ramnosio e di acidi uronici tra cui l’acido glucuronico e l’acido 4-metilglucuronico; gli acidi uronici sono zuccheri con il gruppo alcolico primario ossidato ad acido carbossilico. Lo xilosio è l’unità monomerica più abbondante (Fig. 16).
L’emicellulosa rappresenta circa il 15 % in peso della biomassa secca e, insieme alla lignina, si dispone intorno alle microfibrille di cellulosa. La sua funzione strutturale principale è quella di tenere unite cellulosa e lignina [20].
Nelle catene polimeriche principali i diversi monomeri sono uniti da legami β-(1 → 4) come nella cellulosa; tuttavia sono presenti anche legami 1 → 2 e 2 → 3 che impediscono, insieme all’eterogeneità delle unità monomeriche presenti, alle varie tipologie di emicellulosa di assumere strutture estese ordinate e cristalline (Fig. 17). A parità di condizioni di reazione, l’idrolisi della cellulosa di specie vegetali diverse origina gli stessi prodotti in composizione praticamente uguale; al contrario, l’idrolisi di strutture emicellulosiche appartenenti a specie diverse genera composizioni variabili a causa della diversità che esiste tra l’emicellulosa di specie diverse.
Analizziamo adesso i tipi più comuni di emicellulosa [21].
La catena principale del D-xiloglucano (Fig. 18) è formata da unità di β-D-glucopiranosio unite da legami β-(1 → 4); il monomero che costituisce le catene laterali è essenzialmente xilosio ma si possono trovare anche galattosio, arabinosio o fucosio; tra essi sono presenti legami β-(1 → 2).
Figura 16 - I monomeri presenti nelle emicellulose.
L’e mic ellu los
a D-xilano, o glucuronoarabinoxilano (Fig. 19), è uno dei costituenti essenziali delle latifoglie (15 - 30 % in peso della biomassa); è una delle principali strutture di collegamento tra la lignina e gli altri carboidrati della parete cellulare. Gli arabinoxilani presenti nel D-xilano tendono infatti a legarsi a residui ligninici formando legami esterei ed eterei stabili. Il D-xilano è composto da una catena principale di unità di D-xilopiranosio legate da legame
β-(1 → 4), da ramificazioni costituite da acidi uronici, connessi alla catena principale
mediante legami α-(1 → 2) e unità di L-arabinosio e L-arabinofuranosile, connesse mediante legami α-(1 → 3).
Un altro xilano comune è l’O-acetil-4-O-metilglucurono-β-D-xilano (Fig. 20). Questa emicellulosa è formata da unità di xilopiranosio legate tra loro con legami β-(1 → 4). I gruppi ossidrilici in posizione C2 e / o C3 delle unità di xilosio sono parzialmente acetilati (circa 7 residui acetilici ogni 10 unita di xilosio). Questo xilano non contiene catene laterali di arabinosio.
Figura 18 - Struttura del D - xiloglucano.
Figura 19 - Struttura del D - xilano.
I β-D-glucani (Fig. 21) sono polimeri del D-glucosio in legame β-(1 → 3) e β-(1 → 4).
I D-mannani (Fig. 22), che formano microfibrille simili a quelle della cellulosa, sono le principali emicellulose presenti nelle conifere; sono formati da unità di mannosio connessi da legami β-(1 → 4).
Figura 20 - Struttura del O - acetil - 4 - O - metilglucuro - D - xilano.
Figura 22 - Struttura dei mannani.
La principale emicellulosa appartenente a questa famiglia è il galatto-glucomannano (Fig. 23) che costituisce il 20 % del peso della biomassa secca generata dalle conifere; le unità di D-galattosio sono unite mediante legami α-(1 → 6) alla catena del mannano. Il rapporto tra glucosio, mannosio e galattosio può variare significativamente.
Le latifoglie contengono piccole quantità di glucomannani (2 - 5 % in peso della biomassa); sono formati da uno scheletro di unità di D-mannopiranosio e D-glucopiranosio connesse da legami β-(1 → 4). Non sono presenti residui di D-galattosio.
L’arabinogalattano è l’emicellulosa più importante all’interno della famiglia del D-galattano. È presente sia nelle conifere che nelle latifoglie; la catena principale è formata da unità di D-galattopiranosio unite da legami β-(1 → 3) mentre le ramificazioni sono costituite essenzialmente da β-D-galattopiranosil-(1 → 6)-D-galattopiranosio.
Circa il 40 % dei monomeri costituenti i pentosani contengono sostituenti acetilici e formilici (il rapporto acetile / formile è circa 10 / 1); i monomeri possono essere mono acetilati in posizione C3 o C2 o doppiamente acetilati (in entrambe le posizioni). In presenza di acqua neutra i gruppi vengono idrolizzati producendo acido acetico. Gli H+ derivanti dalla reazione di autoionizzazione dell’acqua sono sufficienti a catalizzare questa reazione. La formazione di acido acetico (acido debole) aumenta esponenzialmente la concentrazione degli H+ in soluzione velocizzando la cinetica di questa reazione ed iniziando a catalizzare anche la reazione di idrolisi dei pentosani a pentosi [22].
1.4.3 Lignina
La lignina costituisce fino al 35 % in peso della biomassa secca; nelle latifoglie è presente per circa il 22 % mentre nelle conifere arriva al 29 %.
La lignina è un eteropolimero fenolico ramificato tridimensionale amorfo, elastico e resistente alla compressione. Grazie a queste caratteristiche agisce da riempitivo e collante tra gli interstizi delle microfibrille di cellulosa conferendo rigidità e robustezza alla pianta e alla parete cellulare.
La lignina, al contrario di cellulosa ed emicellulosa, è resistente all’idrolisi acida. La sua struttura molecolare non è determinabile esattamente e non è generalizzabile a causa della sua composizione eterogenea e della variabilità dei legami coinvolti.
La lignina è sintetizzata negli organismi vegetali per polimerizzazione deidrogenativa di alcuni alcoli cinnamici: l’alcol p-cumarilico idrossi-cinnammico), l’alcol coniferilico (4-idrossi-3-metossi-cinnammico) e l’alcol sinapilico (4-idrossi-3,5-dimetossicinnammico) (Fig. 24). Ogni specie vegetale utilizza una particolare combinazione di questi alcol per produrre un preciso tipo di lignina.
Tali composti sono i precursori delle 3 unità ligniniche più comuni: p - idrossifenile, guaiacile e siringale [18]. Durante il processo di polimerizzazione si formano legami carbonio - carbonio e legami eterei. Le unità monomeriche sono quindi legate mediante questi due tipi di legami; i legami eterei tra gruppi fenolici, che rappresentano fino al 60% dei legami interunità presenti nella lignina, sono più forti dei legami carbonio - carbonio normalmente presenti nella cellulosa e nell’emicellulosa: è questa una delle cause che rende l’eteropolimero ramificato resistente all’idrolisi acida.
Il polimero costituito da alcol coniferilico, caratteristico delle conifere, presenta solo unità guaiaciliche; quello composto da alcol coniferilico e alcol sinapilico, proprio delle latifoglie, è caratterizzato sia da unità guaiaciliche che siringiliche e rende la lignina delle conifere più resistente alla degradazione chimica rispetto a quella delle latifoglie.
La lignina può essere classificata in:
- lignina softwood quando è costituita essenzialmente da alcool coniferilico;
- lignina hardwood quando i componenti principali sono l’alcool coniferilico e sinapilico;
Figura 24 - Da sinistra verso destra: alcol cumarilico, alcol coniferilico e alcol sinapilico.
- lignina grass quando contiene quantità significative di derivati di alcool p - cumarilico. La frazione ligninica delle biomasse, oltre ad essere utilizzata come combustibile, è utilizzata nell’industria come disperdente, indurente, emulsionante, nei laminati plastici, cartoni e manufatti in gomma. La lignina può essere aggiunta ad alcuni polimeri di sintesi; in tal caso riduce sensibilmente l’ossidazione e successiva depolimerizzazione del polimero stesso perché agisce come uno scavenger di radicali. Può inoltre essere usata come materia prima per produrre composti aromatici (vanillina, siringaldeide e p - idrossibenzaldeide) che possono essere usati nell’industria farmaceutica, cosmetica e alimentare [22].
È necessario tenere presente che le proprietà chimiche e fisiche della lignina dipendono dal tipo di processo con cui viene estratta dalle biomasse; la struttura naturale può essere modificata in seguito all’azione dei reattivi chimici utilizzati e dalle reazioni di pirolisi. Sono note 3 metodologie per ridurre le modifiche che si apportano alla lignina nativa in fase di estrazione: l’estrazione con solventi organici, quella con solventi dopo completa macinazione e l’estrazione con solventi dopo trattamento della biomassa macinata con enzimi idrolitici che rimuovono i polisaccaridi associati [28].
La struttura e la reattività di uno specifico campione di lignina dipende, oltre che dalla specie vegetale in cui è stata sintetizzata, anche dal tipo di tessuto della pianta, dalla sua età e dall’ambiente in cui vive. Questa ampia varietà rende difficile definire un modello strutturale preciso e univoco; i modelli che sono stati sviluppati si riferiscono a specifiche unità e legami. La lignina può essere vista come una macromolecola costituita da subunità di fenilpropano (FP) (Fig. 25) tra loro legate sui differenti siti di ogni unità fenolica. Sono stati identificati oltre 20 tipi di legame bifunzionali; i legami eterei più comuni sono: β-O-4 (il legame più comune in assoluto), α-O-4 e 4-O-5; i legami C-C sono
β-5, 5-5, β-1 e β-β (Fig. 26) [23].
Figura 26 - Legami comuni tra unità di fenilpropano presenti nelle lignine. Figura 25 - Unità di
I 3 alcol cinnamici possono essere legati anche in modo trifunzionale; si creano punti di ramificazione che conferisco alla lignina la classica struttura a rete.
Il modello strutturale della lignina naturale proposto da Freudenberg (Fig. 27) è il più famoso: la lignina ha essenzialmente gruppi funzionali idrossilici, metossilici, carbossilici e carbonilici [24].
- La quantità dei gruppi metossilici è compresa tra 0,92 e 0,94 ogni unità di FP.
- I gruppi idrossilici sono di 3 tipi; comunemente le lignine contengono 0,2 gruppi alifatici primari (legati al γ-C-atomo) ogni unità di FP, 0,84 gruppi idrossilici alifatici secondari (legati all’ α-C-atomo) ogni unità di FP e 0,35 gruppi idrossilici fenolici (legati al 4 - C - atomo dell’anello aromatico) ogni unità di FP.
- I gruppi carbossilici sono 0,05 per unità di FP; questi gruppi sono in grado di formare legami a idrogeno e sono fondamentali nel determinare la reticolazione delle lignine. - I gruppi carbonilici sono circa 0,21 ogni unità di FP; sono di 4 diversi tipi: gruppi
aldeidici legati al γ-C-atomo (0,04 per 1 unita di FP), gruppi chetonici legati all’α-C-atomo (0,07 per unità di FP) o al β-C-all’α-C-atomo (0,1 gruppi per unità di FP) e gruppi chinonici.
Figura 27 - Struttura della lignina proposta da Freudenberg.
1.4.4 Pectine
Le pectine si trovano in quantità significative in frutta e verdura; nelle piante sono invece meno comuni ma possono essere presenti nelle pareti cellulari primarie dei semi. Sono costituite da un insieme di polimeri altamente ramificati, gli acidi glucuronici; questi acidi si formano per ossidazione del gruppo alcolico primario degli zuccheri. Tra questi i più rilevanti sono l’acido mannuronico, glucuronico e l’acido D-galacturonico; in quest’ultimo le unità sono legate mediante legami α-(1 → 4) glicosidici. Anche il ramnosio è una componente significativa.
Lo scheletro della struttura pectinica è formato da residui di acido α-(1 → 4)-D-galacturonico, parzialmente metilati. Sono presenti residui di α-(1 → 2)-L-ramnosil-α-(1 → 4)-D-galacturonosil disaccaridi (Fig. 28).
I polisaccaridi comunemente presenti nelle pectine sono il ramnogalatturonano I, il ramnogalatturonano II e l’omogalatturonano. Nel ramnogalatturonano I circa la metà dei residui di ramnosio sono sostituiti in posizione C4 da oligosaccaridi costituiti da L-arabinosio e da D-galattosio.
Nel ramnogalatturonano II, lo scheletro principale è sostituito in posizione C2 e C3 con aldeidi e cheto zuccheri. Ioni Ca++ e Mg++ fanno da ponte tra due residui di catene adiacenti di ramnogalatturonani legandosi ai gruppi carbonilici liberi di catene adiacenti [25].
1.4.5 Componenti non strutturali
Oltre alla componente strutturale lignocellulosica le piante comunemente contengono amido, proteine e altri composti organici ed inorganici [26].
L’amido è costituito da amilosio e di amilopectina. L’amilosio ha una struttura lineare formata da unità di glucosio unite mediante legame α - (1 → 4) glicosidico. La presenza di questo tipo di legame nella catena principale della macromolecola riduce la forza e l’abbondanza dei legami a idrogeno intermolecolari rispetto al polimero cellulosa.
L’amilopectina ha la stessa struttura dell’amilosio, ma in ogni 24 - 30 unità di glucosio sono presenti ramificazioni; tali monomeri sono legati alla catena principale mediante legami α - (1
→ 6). L’amilopectina, che ha un DP più alto dell’amilosio, a causa della presenza delle
ramificazioni non può assumere una struttura ad elica estesa: non si possono quindi formare legami a idrogeno intermolecolari.
Le proteine presenti nella parete cellulare possono essere legate covalentemente alla lignina e ai polisaccaridi per formare strutture altamente reticolate.
Gli estratti sono composti organici a basso peso molecolare presenti nella parete cellulare; tra di essi sono presenti monosaccaridi, polisaccaridi, tannini, terpeni, grassi, cere e composti aromatici. In generale gli estratti costituiscono meno del 5 % della biomassa; rilevanti quantità di estratti sono presenti nelle biomasse solo in rari casi (specie tropicali).
Le ceneri sono residui inorganici che rimangono al termine della combustione del legno; il loro contenuto varia notevolmente con le specie vegetali e con l’ambiente in cui vivono. Elevati contenuti di ceneri possono causare un utilizzo maggiore di acido durante la reazione di idrolisi a causa della loro natura alcalina.
Gli eteroatomi comunemente presenti nelle biomasse sono silicio, potassio, calcio, magnesio, sodio e fosforo. Alluminio, ferro, rame, zinco, piombo e argento sono presenti solo in tracce. Gli anioni più comuni sono cloruri, carbonati, silicati, solfati, idrossidi e ossidi.
Spesso gli hardwoods hanno un contenuto maggiore di ceneri rispetto ai softwoods; il contenuto di ceneri tende ad essere molto più alto nella corteccia che nelle foglie; uno studio finlandese condotto su 5 specie arboree ha evidenziato un contenuto di ceneri dello 0,46 % nello stelo, del 2,97 % nella corteccia e del 4,97 % nel fogliame.
1.5 IL RAPPORTO TRA CELLULOSA, EMICELLULOSA E LIGNINA
Il rapporto esistente tra cellulosa, emicellulosa e lignina è molto complesso, tanto che non è ancora stato pienamente compreso (Fig. 29). Sicuramente l’emicellulosa è il collante tra cellulosa e lignina anche se probabilmente non si formano legami chimici tra i polisaccaridi delle due strutture; queste interagiscono mediante iterazioni intermolecolari più deboli: legami
a idrogeno e forze di Van der Waals. Tali interazioni sono più intense e frequenti nelle zone amorfe della cellulosa.
La conformazione dell’emicellulosa xilano non permette la formazione di legami a idrogeno con strutture polimeriche lineari come la cellulosa. Tuttavia xilani aventi ramificazione possono più facilmente interconnettersi con le catene di cellulosa. Al contrario la catena polimerica degli xiloglucani è simile a quella della cellulosa e le due strutture sono fortemente interconnesse [27].
Sono state individuate varie tipologie di legami tra la lignina e le emicellulose (Fig. 30) [29]: - legami benzil - eterei tra un gruppo idrossile della lignina e un gruppo idrossile del
carboidrato;
- legami benzil - esterei tra un gruppo α-idrossile di un’unita di lignina e un gruppo carbossilico di una emicellulosa;
- legami glicosidici tra un gruppo idrossile alifatico o aromatico e un carboidrato; la lignina può anche essere legata, mediante legami glicosidici, alle catene laterali di arabinoxilani e galattoglucomannani; molte di queste associazioni avvengano via acidi idrossiciannamici che agiscono da ponte tra le emicellulose e la lignina.
- legami acetalici tra due gruppi idrossili dei carboidrati e un gruppo carbonile della lignina.
1.6 CONTENUTO DI CELLULOSA, EMICELLULOSA E LIGNINA NELLE BIOMASSE OGGETTO DEL PRESENTE LAVORO DI TESI Il con ten uto di cell ulo sa,
emicellulosa e lignina nelle biomasse oggetto del presente lavoro di tesi è riportato in tabella 2: tali valori sono stati determinati presso il Dipartimento di Agraria dell’Università di Pisa mediante una apposita metodologia [31] e sono in accordo con i dati di letteratura [32][33]. Tra le biomasse oggetto del presente studio il miscanto ha il massimo contenuto di cellulosa, circa il 40 % in peso rispetto alla biomassa secca, mentre il massimo contenuto di emicellulosa, circa il 24 % della biomassa secca, è presente nel sorgo. Il contenuto di lignina è compreso tra il 7,5 ed il 9 % in peso della biomassa secca. Proteine, estratti e ceneri hanno un contenuto variabile.
Presso il Dipartimento di Agraria dell’Università di Pisa è stata determinata anche la resa in biomassa secca ed i costi di coltivazione delle 3 colture (Tab 2). L’arundo ha una resa in biomassa secca di 37 t / ha · anno ed un costo di coltivazione di 790 € / ha mentre il sorgo ha un costo di coltivazione inferiore: 760 € / ha. Una prova sperimentale è stata realizzata presso il Dipartimento di Agraria per comprendere la risposta produttiva del sorgo ad itinerari tecnici caratterizzati da un diverso livello di intensificazione colturale. Le due tipologie di sistema colturale denominate Basso Input (BI) e Alto Input (AI) differiscono sostanzialmente per la quantità di fertilizzante distribuita:
- BI = 90 kg · ha-1 di N e 60 kg · ha-1 di P2O5 e K2O; - AI = 160 kg · ha-1 di N e 80 kg · ha-1 di P2O5 e K2O. Figura 30 - Tipologie di legami tra emicellulosa e lignina.
Tabella 2 - Resa in biomassa secca, costi di coltivazione, contenuto di cellulosa, emicellulosa e lignina nelle biomasse oggetto del presente studio.
Biomassa Cellulosa (% in peso) Emicellulosa (% in peso) Lignina (% in peso) Resa (t · ha-1) Costo (€ · ha-1) Costo (€ · t-1 ) Arundo 37 21,4 8,4 37 790 21,4 Miscanto 39,7 24 8,9 28 790 28,2 Sorgo BI 34,1 24,2 7,5 19 760 40 Sorgo AI 34,1 24,2 7,5 23 880 38
BIBLIOGRAFIA
1. V. Larocca, Recupero della frazione di emicellulosa, cellulosa e lignina da biomassa
pretrattata mediante steam explosion, Tesi di laurea in Ingegneria Chimica, 2002-2003,
Università degli Studi di Roma “La Sapienza”, Facoltà di Ingegneria. 2. G. Candolo, Economia e politica agraria, 2005, 4, 31.
3. IEA (International Energy Agency), Renewables information, Paris, Organization for Economic Cooperation and Development /IEA, 2005b.
4. G. Candolo, Economia e politica agraria, 2006, 4, 26. 5. G. Tomassetti, Gestione energia, 2005, 4, 4.
6. K. Mollersten, J. Yan, J. R. Moreira, Biomass Bioenergy, 2003, 25, 273.
7. J. C. Clifton-Brown, J. Breuer, M. B. Jones, Global Change Biology, 2007, 13, 2296. 8. R. Giovanardi, M. D. Castelluccio, S. Rosso, G. T. Mazzocco, Ricerca e innovazione,
2009, 3, 42.
9. G. Bezzi, A. Monti, G. Venturi, Agricoltura, 2006, 6, 4.
10. E. Habyarimana, D. Laureti, M. D. Ninno, C. Lorenzoni, Ind. Crops & Prod., 2004, 20 (1), 23.
11. G. Antonopoulou, I. Ntaikou, H. N. Gavala, I. V. Skiadas, K. Angelopoulus, Global
NEST J., 2007, 9 (2), 144.
12. M. Bentini, M. Zucchelli, Ricerca e sperimentazione, 2008, 70.
13. G. Pritoni, A. Monti, G. Venturi, G. Canestraie, Agricoltura, 2006, 11, 80. 14. G. Angelici, L. Ceccarini, E. Bonari, Europ. J. Agr., 2005, 22 (4), 375. 15. F. Vega, Le Scienze, 2008, 480.
16. E. Adler, Wood Sci. Technol., 1977, 11, 169.
17. R. L. Howard, E. Abotsi, E. L. Jansen van Rensburg, S. Howars, African J. Biotechnol., 2003, 2 (12), 602.
18. C. Ververis, K. Georghiou, N. Christodoulakis, P. Santas, R. Santas, Ind. Crops & Prod., 2004, 19, 245.
19. P. T. Larsson, K. Wickholm, T. Iversen, Carbohydr. Res., 1997, 302, 19.
20. T. Doco, P. Williams, M. Pauly, M. O’Neill, P. Pellerin, Carbohydr. Polym., 2003, 53, 253.
21. J. Lundqvist, A. Jacobs, M. Palm, G. Zacchi, O. Dahlman, H. Stalbrand, Carbohydr.
Polym., 2003, 51, 203.
22. W. Riansa-nagawong, P. Prasertsan, Carbohydr. Res., 2011, 346 (1), 103. 23. F. S. Chakar, A. J. Ragauskas, Ind. Crop. Prod., 2004, 20, 131.
24. N. Mosier, C. Wyman, B. Dale, R. Elander, Y. Y. Lee, M. Holtzapple, M. Ladisch,
Biores. Technol., 2005, 96 (6), 673.
25. C. Somerville, S. Bauer, G. Brininstool, M. Facette, T. Hamann, J. Milne, E. Osborne, A. Paredez, S. Persson, T. Raab, S. Vorwerk, H. Youngs, Science, 2004, 306, 2206. 26. B. L. Browning, Encyclopedia of Polymer Science and Engineering ,1989, 17, 843. 27. D. L. Klass, Biomass for Renewable Energy, Fuels and Chemical, 1998, Academic
Press, San Diego.
29. D. J. Hayes, Cat. Today, 2009, 145 (1-2), 138.
30. A. M. Raspolli Galletti, A. Troiano, S. Fugalli, It patent CE2008A 000002, 2008. 31. P. J. Van Soest, J. B. Robertson, B. A. Lewis, J. Dairy Sci., 1991, 74, 3583. 32. S. McIntosh, T. Vancov, Biores. Technol., 2010, 101, 6718.
33. B. Sipos, J. Reczey, Z. Somorai, Z. Kadar, D. Dienes, K. Reczey, Appl. Biochem.