A
nalisi termica del serbatoio
CAPITOLO 3.
Analisi termica del serbatoio
Equation Chapter 3 Section 1
Un importante aspetto del sistema di pressurizzazione proposto consiste nell’uso di un solo serbatoio per entrambi i propellenti separati da un diaframma flessibile, con gli ovvi vantaggi in termini di peso e complessità che ne derivano. In questa configurazione etano e perossido d'idrogeno sono in contatto termico e la capacità termica dell'HP può essere sfruttata al fine di limitare la diminuzione di temperatura e di pressione dovuta all’evaporazione del C2H6 durante l’estrazione del propellente.
Ci proponiamo dunque, in questo capitolo, di eseguire un’analisi preliminare del comportamento termodinamico del serbatoio al fine di mostrare la capacità della configurazione a doppio serbatoio di utilizzare la pressione del C2H6 per pressurizzare il perossido d'idrogeno. Ci proponiamo quindi di modellizzare il sistema al fine di valutare la diminuzione di temperatura del serbatoio stesso, la pressione e il titolo del C2H6 durante lo svuotamento.
3.1.
Modello termodinamico
Un calcolo preliminare può essere effettuato costruendo un modello termodinamico del serbatoio sotto opportune ipotesi semplificative. In particolare partendo da una condizione di stato bifase del C2H6 all’avanzare dello svuotamento il serbatoio raggiunge una condizione alla quale si ha sola presenza di fase gassosa e il C2H6 è uscito dalla campana del vapore saturo. E’ naturale che di ciò si deve tenere conto costruendo due modelli, uno valido nella fase iniziale di presenza simultanea di fase liquida e vapore e uno dove è presente sola fase gassosa. In particolare si ipotizza che il serbatoio non scambi calore con l’esterno e che i due propellenti siano in contato termico perfetto cioè costantemente alla stessa temperatura.
3.1.1. Pressione e temperatura nel serbatoio con etano in condizione
bifase
Fdm
−
Odm
−
,
v vm h
,
L Lm h
,
O Om h
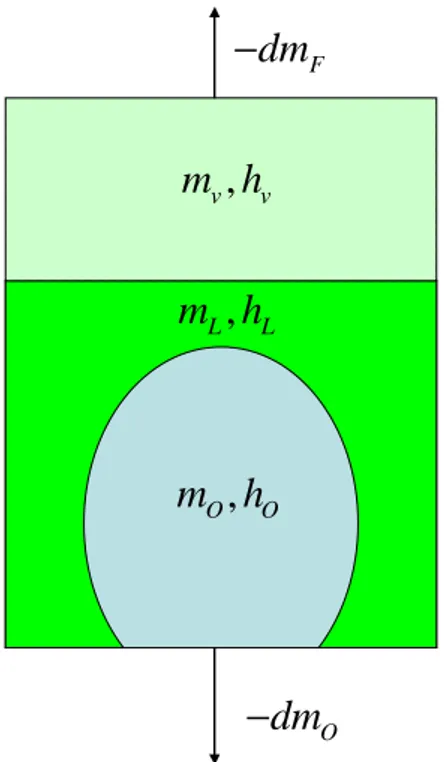
Figura 3.1 Rappresentazione schematica del serbatoio.
Facciamo le seguenti ipotesi semplificative:
• Volume costante V .
• Pressione e temperatura uniformip,T.
• Si ipotizza che ci sia scambio termico perfetto tra i due fluidi.
• Perossido di idrogeno incomprimibile.
• Equilibrio liquido/vapore.
• p,
ρ =
L1
v
L ,ρ =
V1
v
V ,h
L,h
V funzioni solo della temperatura.• Calore di vaporizzazione
Q
v=
h
V−
h
L.• Pareti del serbatoio adiabatiche.
• Rapporto di miscelamento
φ
costante .Con le ipotesi sopraccitate è possibile scrivere l’equazione di continuità per l’etano, la variazione di etano presente nel serbatoio è uguale alla massa estratta da quest’ultimo:
F V L F V L
Modello termodinamico 31
La prima ipotesi permette, scritto il volume del serbatoio come somma del volume occupato dai due fluidi, di ricavare una seconda equazione:
V O L L V O
m
m
m
V
constant
ρ
ρ
ρ
=
+
+
=
⇒
2 21
1
1
0
V L L V O L V L V O L Vm
m
dV
dm
dm
dm
d
ρ
d
ρ
ρ
ρ
ρ
ρ
ρ
⇒
=
+
+
−
−
=
Il rapporto di miscelamento è per definizione il rapporto tra la massa estratta di etano e di perossido di idrogeno: V L F O O
dm
dm
dm
dm
dm
φ
=
−
=
+
−
L’ipotesi di adiabaticità permette di scrivere semplicemente il bilancio entalpico, eguagliando la variazione di entalpia dei due fluidi contenuti nel serbatoio detratta dell’entalpia delle masse estratte al lavoro fatto dalla variazione di pressione sul volume V; si ottiene:
(
L L V V O O)
V F O O d m h +m h +m h −h dm −h dm =Vdp (3.1) eliminando: F V Ldm
=
dm
+
dm
si ottiene: L L V V O O L L V V O Oh dm
+
h dm
+
h dm
+
m dh
+
m dh
+
m dh
+
V V V L O Oh dm
h dm
h dm
Vdp
−
−
−
=
Semplificando e con: v V LQ
=
h
−
h
: segue: L L V V O O v Lm dh
+
m dh
+
m dh
−
Q dm
=
Vdp
Si ottiene un sistema differenziale del primo ordine che lega le masse dei due fluidi presenti nel serbatoio e la temperatura:
(
)
(
)
V V O O L L L v v v v V V O O V L L L V L L V v v v V O V O V V V O O L L L L V O L v v v V V V O m dh m dh dm m dh V dp dT Q dT Q dT Q dT Q dT m dh m dh dv m dh V dp dv v v m m Q dT Q dT Q dT Q dT dT dT dm dT v v dv m dh m dh dv m dh V dp m m v v dT dT Q dT Q dT Q dT Q dT dm dT v v φ φ φ φ φ = + + − − + + − − − = + + + + + + − = − + (3.2)dove sulla linea di saturazione possiamo esprimere le proprietà termodinamiche e la pressione del serbatoio in funzione della sola temperatura:
( )
L L v =v Tv
V=
v
V( )
T
( )
L L h =h T( )
V V h =h T( )
p= p T( )
v v Q =Q TCon le relative condizioni iniziali, che possono scriversi:
( )
L i Fi
m T =m Massa iniziale della fase liquida di etano.
( )
Fi O im
m
T
φ
=
Massa iniziale di perossido di idrogeno.( )
V i Vi
m T =m Massa iniziale della fase vapore di etano,
è possibile risolvere il problema e ottenere l’andamento delle masse contenute nel serbatoio in funzione della temperatura previa conoscenza delle funzioni termodinamiche che compaiono nelle (3.2).
3.1.2. Pressione e temperatura nel serbatoio con C2H6
completamente vapore
Le (3.2) descrivono la dinamica del serbatoio fin quando l’etano si trova in condizione bifase, una volta finita la fase liquida devono essere opportunamente corrette. Ancora una volta con le seguenti ipotesi semplificative:
Modello termodinamico 33
• Volume costanteV .
• Pressione e temperatura uniformip, T.
• H2O2 incomprimibile.
• Vapore di Van der Waals:
2 V V V V V
R T
a
p
v
b
v
=
−
−
e V V vV V V Vv
h
c T
R T
v
b
=
+
−
• Calore di vaporizzazioneQ
v=
h
V−
h
L. • Condizioni adiabatiche.• Rapporto di miscelamento
φ
costante.La prima ipotesi permette, scritto il volume del serbatoio come somma del volume occupato dai due fluidi, di ricavare l’equazione:
2
1
1
0
V O V V V O V O V V Om
m
m
V
constant
dV
dm
d
ρ
dm
ρ
ρ
ρ
ρ
ρ
=
+
=
⇒
=
−
+
=
segue:0
V V O O V V V V O O V Vv dm
v dm
v dm
m dv
v dm
dv
m
+
+
+
=
⇒
= −
Il rapporto di miscelamento è, come prima:
V V O O
dm
dm
dm
dm
φ −
=
=
−
L’ipotesi di adiabaticità permette di scrivere semplicemente il bilancio entalpico, eguagliando la variazione di entalpia dei due fluidi contenuti nel serbatoio detratta dell’entalpia delle masse estratte al lavoro fatto dalla variazione di pressione sul volume V, si ottiene un’equazione equivalente alla (3.1) dove però, rispetto al caso precedente, scompare naturalmente la massa del liquido
m
L:(
V V O O)
V V O Od m h +m h −h dm −h dm =Vdp
e con , dalla termodinamica:
dp v dT C
otteniamo:
(
)
22
V vV O pO V O V V O V V V Vm c
m c
dm
dm
a
R T
v
dT
dT
(
)( v
)
v
v
b
φ
φ
+
=
=
−
+
−
(3.3) dove: O O V V O O V VV
m
V
m v
m v
v
m
ρ
−
=
+
⇒
=
con le condizioni iniziali
m
V( )
T
f em
O( )
T
f determinate dal caso precedente da0
L f
m ( T )= .
3.1.3. Pressione
Nella fase iniziale la pressione nel serbatoio si ottiene dalla curva di saturazione:
( )
sat sat
p = p T ⇒ p= psat
(
T m( )
O)
Nella fase finale si ottiene dall’equazione di stato:
2 V V V V V
R T
a
p
v
b
v
=
−
−
dove T =T m( )
O e: O O V VV
m
v
m
ρ
−
=
3.2.
Integrazione del modello
Il modello descritto dalle (3.2) e (3.3) può essere integrato previa conoscenza delle funzioni termodinamiche presenti nelle equazioni al variare della temperatura, tali dati possono essere ottenuti per interpolazione di risultati sperimentali reperibili in letteratura come mostrato nelle figure riportate nelle appendici A, B, C.
Integrazione del modello 35
In particolare l’integrazione è stata effettuata in ambiente Matlab con un metodo numerico di Runge-Kutta del quarto ordine. L’integrazione necessita naturalmente dell’imposizione di condizioni iniziali sulle masse nel serbatoio, sulla temperatura iniziale dei propellenti e del volume del serbatoio stesso.
Spinta nel vuoto 50 N
Impulso totale 10000 N s
Impulso specifico nel vuoto (con 85% HP)
220 s
Concentrazione HP 85%
Tabella 3.1 Requisiti di progetto FVP.
Con i dati riportati in Tabella 3.1 è possibile calcolare le grandezze sopraccitate:
0
1
TOTALE TOTALE sp TOTALE FUEL OX FUEL FUEL FUEL OX OXI
m
I g
m
m
m
m
V
m
m
ϕ
ϕ
ν
ν
=
=
+
= ⋅
=
⋅
+
⋅
(3.4)L’integrazione del modello permette da un lato di dimostrare la capacità del sistema, in particolare la possibilità di utilizzare l’etano stesso come carburante e come sistema di pressurizzazione e inoltre mostra la dipendenza del funzionamento del dispositivo al variare delle grandezze in gioco, in particolare temperatura iniziale, masse imbarcate e rapporto di miscelamento. I paragrafi a seguire mostrano quindi il risultato di tale integrazione parametrizzata su tali variabili. Si noti che al progredire dello svuotamento del serbatoio durante lo sparo, la temperatura tende a diminuire. I grafici, riportati in seguito, mostrano l’andamento della pressione nel serbatoio e quello delle masse al suo interno in funzione della temperatura. Non è esplicitata la dipendenza di tali grandezze dal tempo durante lo svuotamento del serbatoio. Tale dipendenza può comunque essere ricavata esplicitando le portate in massa per spinta assegnata:
( )
L L m =m t( )
V V m =m t( )
OX OX m =m t( )
p= p tCiò qui non è stato fatto perché un'analisi nel dominio della temperatura è stata ritenuta sufficiente agli scopi preposti. L’analisi nel dominio del tempo verrà effettuata nei capitoli successivi con ipotesi meno stringenti sul modello termodinamico di svuotamento del serbatoio.
3.2.1. Integrazione parametrizzata sul rapporto di miscelamento con
ϕ
costante
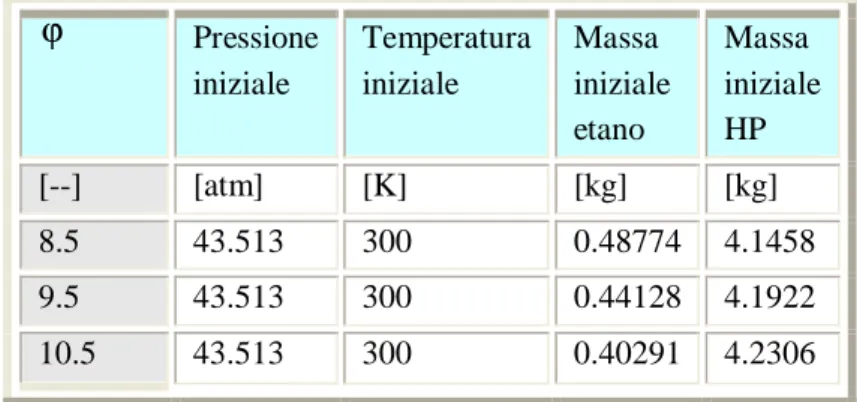
Si riportano i risultati ottenuti sulla base delle condizioni iniziali riportate in Tabella 3.2
ϕ Pressione iniziale Temperatura iniziale Massa iniziale etano Massa iniziale HP [--] [atm] [K] [kg] [kg] 8.5 43.513 300 0.48774 4.1458 9.5 43.513 300 0.44128 4.1922 10.5 43.513 300 0.40291 4.2306
Tabella 3.2 Condizioni iniziali integrazione parametrizzata sul rapporto di miscelamento conϕ costante. 0 5 10 15 20 25 30 35 40 45 240 250 260 270 280 290 300 Pressione Pressione [atm] T emperat ura [K ] OF=9 OF=10 OF=11
Figura 3.2 Temperatura [K] Vs Pressione [atm] parametrizzata sul rapporto di miscelamento a
Integrazione del modello 37
Come si vede la temperatura presenta una variazione poco maggiore di 10K, corrispondentemente ad una diminuzione di pressione di 30 atmosfere dalle 45 iniziali, inoltre si mantiene circa costante intorno al valore di 290 K fino a pressioni dell’ordine delle 5 atmosfere. L’effetto del rapporto di miscelamento è minimo.
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 270 275 280 285 290 295 300 Residual H2O2 T emper at ure [°K ] OF=9 OF=10 OF=11
Figura 3.3 Temperatura [K] Vs HP residuo/ HP iniziale [--] parametrizzao sul rapporto di miscelamento aϕ costante.
La Figura 3.3 mostra l’andamento della massa di perossido presente nel serbatoio al diminuire della temperatura, si noti come fino a che è presente il 20% del perossido inizialmente imbarcato, la temperatura risulta inferiore alla temperatura iniziale di soli 10 K, dopodiché scende drasticamente. L’effetto del rapporto di miscelamento è un lieve guadagno per rapporti alti, si vede, infatti, che all’aumentare del rapporto di miscelamento la diminuzione di temperatura diminuisce, ciò è dovuto all’inerzia termica aggiunta avendo imbarcato una quantità maggiore di perossido di idrogeno.
0 0.05 0.1 0.15 0.2 0.25 270 275 280 285 290 295 300 C2H6 in fase vapore Tem pe ratur a [K ] OF = 9 OF = 10 OF = 11 C2H6 in fase vapore [kg]
Figura 3.4 Temperatura [K] Vs C2H6 in fase vapore [kg] parametrizzata sul rapporto di miscelamento aϕ costante. 0 0.1 0.2 0.3 0.4 0.5 0.6 270 275 280 285 290 295 300 C2H6 in fase liquida Tem per at ur a [K] OF=9 OF=10 OF=11 C2H6 in fase liquida
Figura 3.5 Temperatura [K] Vs C2H6 in fase liquida [kg] parametrizzata sul rapporto di miscelamentoϕ costante.
Integrazione del modello 39 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 270 275 280 285 290 295 300 C2H6 residuo / C2H6 iniziale [--] Tem pe rat ura [K ] OF=9 OF=10 OF=11 C2H6 residuo / C2H6 iniziale
Figura 3.6 Temperatura [K] Vs C2H6 residuo / C2H6 iniziale [--] parametrizzata sul rapporto di miscelamento aϕ costante.
Le Figura 3.4, Figura 3.5 e Figura 3.6 mostrano l’andamento della massa di etano presente nel serbatoio al diminuire della temperatura. La fase vapore dell’etano tende inizialmente ad aumentare a causa della diminuzione di pressione nel serbatoio, la fase liquida scende naturalmente monotonicamente al diminuire della temperatura. Terminata la fase liquida, l’etano esce dalla campana dei vapori saturi, la diminuzione ulteriore di temperatura conseguente all’estrazione di massa del propellente impone la diminuzione della fase vapore presente fino a totale esaurimento dell’etano. L’effetto del rapporto di miscelamento è lo stesso mostrato alle figure precedenti per il perossido di idrogeno, ciò è ovvio avendo ipotizzato i due propellenti istantaneamente all’equilibrio, cioè alla stessa temperatura e alla stessa pressione.
0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016 0.018 0.02 3000 3200 3400 3600 3800 4000 4200 4400 4600 4800 5000 Campana del C2H6 P re ss io ne [kP a] Volume specifico [m3 kg-1] OF = 9 OF = 10 OF = 11
Figura 3.7 Andamento dello svuotamento del serbatoio parametrizzata sul rapporto di miscelamento aϕ costante (Volume specifico [m^3 kg^-1] Vs Pressione [atm]).
La Figura 3.7 mostra come si comporta il serbatoio fin quando l’etano si mantiene dentro la campana del vapore saturo per vari valori del rapporto di miscelamento, si vede come rimanendo all’interno di quest’ultima è possibile limitare il salto termico e di pressione del serbatoio. La scelta del rapporto di miscelamento presenta sotto questo aspetto una scarsa influenza.
3.2.2. Integrazione parametrizzata sulla temperatura iniziale con
ϕcostante
Si riportano i risultati ottenuti sulla base delle condizioni iniziali riportate in Tabella 3.3
ϕ Pressione iniziale Temperatura iniziale Massa iniziale etano Massa iniziale HP [--] [atm] [K] [kg] [kg] 8.5 43.513 300 0.46335 4.1701 9.5 39.034 295 0.46335 4.1701 10.5 34.947 290 0.46335 4.1701
Tabella 3.3 Condizioni iniziali integrazione parametrizzata sulla temperatura iniziale conϕ costante
Integrazione del modello 41 0 5 10 15 20 25 30 35 40 45 240 250 260 270 280 290 300 Pressione Pressione [atm] Temp er at ur a [K ] T iniziale = 300 [°K] = 295 = 290
Figura 3.8 Temperatura [K] Vs Pressione [atm] parametrizzata sulla T iniziale aϕ costante.
Come si vede la variazione percentuale di temperatura è indipendente da quella iniziale, è ovvio però che una temperatura iniziale bassa limita la pressione a valori più piccoli. Dall’altro lato però una temperatura iniziale più bassa permette di rimanere più a lungo all’interno della campana dei vapori saturi, in questa figura ciò si nota dal cambiamento di pendenza delle curve, ne consegue che la pressione presenta una diminuzione più lenta.
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 240 250 260 270 280 290 300
H2O2 residuo/ H2O2 iniziale [--] H2O2 residuo/ H2O2 iniziale
Temp er atur a [ K ] T iniziale = 300 [°K] = 295 = 290
Figura 3.9 Temperatura [K] Vs HP residuo/HP iniziale [--] parametrizzata sulla T iniziale [K] a
Come si vede dalla Figura 3.9 la variazione percentuale di temperatura aumenta leggermente al diminuire di quella iniziale inoltre la condizione di congelamento del perossido viene raggiunta circa nelle stesso momento.
0 0.05 0.1 0.15 0.2 0.25 260 265 270 275 280 285 290 295 300 C2H6 in fase vapore Tem pe rat ura [K ] T iniziale = 300 [°K] = 295 = 290 C2H6 in fase vapore [kg]
Figura 3.10 Temperatura [K] Vs C2H6 in fase vapore [kg] parametrizzata sulla T iniziale aϕ costante. 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0.5 260 265 270 275 280 285 290 295 300 C2H6 in fase liquida T emperat ura [K] T iniziale = 300 [°K] = 295 = 290 C2H6 in fase liquida [kg]
Figura 3.11 Temperatura [K] Vs C2H6 in fase liquida [kg] parametrizzata sulla T iniziale aϕ costante.
Integrazione del modello 43 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 260 265 270 275 280 285 290 295 300 C2H6 residuo / C2H6 iniziale T empe ratu ra [K ] T iniziale = 300 [°K] = 295 = 290 C2H6 residuo / C2H6 iniziale [--]
Figura 3.12 Temperatura [K] Vs C2H6 residuo/C2H6 iniziale [--] parametrizzata sulla T iniziale a
ϕ costante.
Le Figura 3.10, Figura 3.11 e Figura 3.12 mostrano l’andamento della massa di etano presente nel serbatoio al diminuire della temperatura. All’aumentare della temperatura iniziale aumenta la percentuale di fase vapore raggiunta nel serbatoio durante lo svuotamento; a parità di propellenti rimasti nel serbatoio la temperatura iniziale più alta garantisce un’escursione di temperatura percentualmente più piccola, a parità di salto termico invece, la temperatura iniziale più bassa diminuisce la variazione di pressione.
0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016 0.018 1500 2000 2500 3000 3500 4000 4500 5000 Campana del C2H6 P re s s ione [k P a] Volume specifico [m3 kg-1] Ti = 300 [°k] Ti = 295 [°k] Ti = 290 [°k]
Congelamento del perossido
Figura 3.13 Andamento dello svuotamento del serbatoio parametrizzata sulla T iniziale aϕ costante ( Pressione [atm] Vs Volume specifico [m^3 kg^-1]).
La Figura 3.13 mostra come si comporta il serbatoio fin quando l’etano si mantiene dentro la campana del vapore saturo per vari valori della temperatura iniziale.
Osservando i grafici si nota come, alla luce delle semplificazioni fatte, soprattutto come vedremo in seguito sulla costanza del rapporto di miscelamento durante lo svuotamento, abbassare la temperatura iniziale del serbatoio ha fondamentalmente l’effetto di abbassare la pressione di alimentazione del propellente. Si tenga però presente che questa analisi è stata effettuata ipotizzando di imbarcare masse di propellente “stechiometriche”, ne segue che una diminuzione di perossido di idrogeno è associata alla stessa diminuzione percentuale di etano quindi non ha grossa utilità diminuire la temperatura iniziale del serbatoio che andrebbe solo a scapito della pressione iniziale del serbatoio; se prendiamo in considerazione l’ipotesi di imbarcare una quantità di etano maggiore con il piccolo inconveniente di sprecarne una piccola frazione appare utile inseguire lo scopo di mantenere l’etano in condizione bifase fino all’esaurimento totale del perossido di idrogeno, in tal caso la diminuzione della temperatura iniziale permette di diminuire la variazione percentuale di pressione dall’inizio dello sparo all’esaurimento del perossido di idrogeno.
Integrazione del modello 45
3.2.3. Integrazione parametrizzata sulle masse imbarcate con
ϕcostante
La seguente parametrizzazione riassume uno studio volto ad analizzare come variano le prestazioni del serbatoio al variare delle masse inizialmente imbarcate; calcolate le masse “stechiometriche” con le (3.4) appare utile imbarcare una quantità di etano leggermente maggiore:
1
TOTALE FUELm
m
α
ϕ
=
+
(3.5)Si riportano i risultati ottenuti sulla base delle condizioni iniziali riportate in Tabella 3.4
ϕ Pressione iniziale Temperatura iniziale Massa iniziale etano Massa iniziale HP
α
[--] [atm] [K] [kg] [kg] [%] 9 43.513 300 0.46335 4.1701 100 9 43.513 300 0.50968 4.1701 110 9 43.513 300 0.55602 4.1701 120 9 43513 300 0.57919 41701 125Tabella 3.4 Condizioni iniziali integrazione parametrizzata sulle masse imbarcate conϕ costante.
0 5 10 15 20 25 30 35 40 45 240 250 260 270 280 290 300 Pressione Pressione [atm] T emperat ura [K] alfa = 1 = 1.1 = 1.2 = 1.25
Figura 3.14 Temperatura [K] Vs Pressione [atm] parametrizzata sulle masse imbarcate a ϕ costante.
Dalla Figura 3.14 si vede come aumentare la quantità di etano imbarcato permette, a parità di salto termico di diminuire la variazione di pressione del serbatoio.
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 260 265 270 275 280 285 290 295 300
H2O2 residuo / H2O2 iniziale
Temp er atur a [K] alfa = 1 = 1.1 = 1.2 = 1.25
H2O2 residuo / H2O2 iniziale [--]
Figura 3.15 Temperatura [K] Vs H2O2 residuo/H2O2 iniziale [--] parametrizzata sulle masse imbarcate aϕ costante.
La Figura 3.15 mostra l’andamento della temperatura in funzione della massa di HP presente nel serbatoio, anche qui si nota che, nella parte di grafico vicino all’esaurimento del perossido di idrogeno, la massa aggiuntiva di etano imbarcato permette di diminuire il salto termico e conseguentemente la variazione di pressione ( è naturale che il grafico ha senso solo per temperature superiori a quella di congelamento del perossido di idrogeno).
0 0.05 0.1 0.15 0.2 0.25 260 265 270 275 280 285 290 295 300 C2H6 in fase vapore Temp er atu ra [K] alfa = 1 = 1.1 = 1.2 = 1.25 C2H6 in fase vapore [kg]
Figura 3.16 C2H6 in fase vapore [kg] Vs Temperatura [K] parametrizzata sulle masse imbarcate aϕ costante
Integrazione del modello 47 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 280 282 284 286 288 290 292 294 296 298 300 C2H6 in fase liquida alfa = 1 = 1.1 = 1.2 = 1.25 C2H6 in fase liquida [kg] Te mp er atu ra [K ]
Figura 3.17 Temperatura [K] Vs C2H6 in fase liquida [kg] parametrizzata sulle masse imbarcate aϕ costante. 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 260 265 270 275 280 285 290 295 300 C2H6 residuo / C2H6 iniziale C2H6 residuo / C2H6 iniziale [--] Tem per at ura [K] alfa = 1 = 1.1 = 1.2 = 1.25
Figura 3.18 Temperatura [K] Vs C2H6 residuo/C2H6 iniziale [--] parametrizzata sulle masse imbarcate aϕ costante.
Le Figura 3.16, Figura 3.17 e Figura 3.18 mostrano l’andamento della massa di etano presente nel serbatoio al variare della temperatura. La fase vapore raggiunge un valore percentualmente più elevato all’aumentare di
α
, ciò era naturalmente prevedibile. A parità di percentuale di etano consumata il salto termico aumenta all’aumentare diα
ma l’interesse di questa analisi risiede nel fatto che esso diminuisce all’esaurimento del perossido, come si vede dalla Figura 3.15 e dalla Figura 3.18considerando che in questo caso i grafici si interrompono nel momento in cui finisce il perossido di idrogeno. 270 275 280 285 290 295 300 0 10 20 30 40 50 60 70 80 90 100
Prestazioni serbatoio alfa = 1.3825
[--]
Temperature [°K] C2H6 liquido / C2H6 iniziale [%] C2H6 vapore / C2H6 iniziale [%]
Pressione nel serbatoio / Pressione iniziale [%] HP / HP iniziale [%]
Figura 3.19 Prestazioni del serbatoio conα =1.3825 aϕ costante.
2 4 6 8 10 12 14 16 x 10-3 1500 2000 2500 3000 3500 4000 4500 5000 Campana del C2H6 Pre s sion e [k Pa] Volume specifico [m3 kg-1] alpha = 100 [%] alpha = 110 [%] alpha = 120 [%] alpha = 125 [%] Congelamento perossido
Figura 3.20 Andamento dello svuotamento del serbatoio parametrizzata su
α
aϕ costante ( Pressione [atm] Vs Volume specifico [m^3 kg^-1]).Conclusioni 49
Come si vede dalle figure aumentare la massa iniziale di etano imbarcato permette di diminuire la diminuzione di pressione nel serbatoio, ciò è auspicabile in quanto mantiene il più possibile la pressione di alimentazione sul valore di progetto restando più a lungo dentro la campana dei vapori saturo. Al limite per α =1.3825, come mostra la Figura 3.19, la fase liquida dell’etano finisce in corrispondenza dell’esaurimento del perossido di idrogeno, ciò permette di completare lo sparo con una variazione di pressione dell’ordine del 50% a scapito di una piccola quantità di propellente aggiuntivo imbarcato e raggiungere l’esaurimento completo del perossido di idrogeno (il propellente più costoso tra i due) senza rischi di congelamento.
3.3.
Conclusioni
La presente analisi ha la limitazione più forte nell’ipotesi di rapporto di miscelamento costante, ciò verrà superato nel capitolo seguente; si vede comunque che il sistema di pressurizzazione funziona e che, anche se questo studio non ha la pretesa di essere un esaustivo studio di missione, operando sulle condizioni iniziali è possibile mantenere la pressione di alimentazione a valori accettabili. Si tenga presente che la possibilità qui analizzata di imbarcare più etano allo scopo di mantenere la pressione il più possibile vicina a quella iniziale assume un aspetto cruciale nel momento in cui si tenga conto della variazione del rapporto di miscelamento conseguente alla variazione di pressione; tale variazione di rapporto di miscelamento provoca una naturale diminuzione di impulso specifico il che fa aumentare i consumi. L’etano aggiuntivo imbarcato può quindi presentare un effetto ponderale positivo anche sul peso totale a parità di impulso totale.
3.4.
Riferimenti
[1] Peterson C. R., Hill P. G., 1992, Mechanics and Thermodynamics of Propulsion, Addison Wesley Publishing Company.
[2] Ascher H. Shapiro The dynamics and thermodynamics of compressible fluid flow, John wiley and sons Vol. I
[3] Ascher H. Shapiro The dynamics and thermodynamics of compressible fluid flow, John wiley and sons Vol. II
[4] Luca D’Agostino, Dispense per il corso di ingegneria aerospaziale, Pisa, Dip. Ing. Aerospaziale 2007
[5] Huzel D. K., Huang D. H., 1992, Design of Liquid-Propellant Rocket Engines, Rocketdyne Division of Rockwell International.
[6] Daniel J. Moser, Compositex, Sandy, UT, High-Performance, non-toxic spacecraft propulsion
system development, AIAA 2001-3248, 37th AIAA/ASME/SAE/ASEE Joint Propulsion Conference
& Exhibit, Salt Lake City, Utah, 8-11 July 2001.
[7] Fuel Vapor Pressurized Rocket Propulsion Technology, NASA Phase 1 SBIR Contract NAS
8-97153 between NASA-Marshall and Utah Rocketry, Salt Lake City, Utah, March to September 1997.
[8] Bramanti C., Cervone A., d’Agostino L., Assessment of the Propulsive Performance of Fuel
Vapour Pressurized Hydrogen Peroxide Ethane Rocket Engines, XVIII Congresso Nazionale
AIDAA, Volterra, Italy, September 2005
[8] George P. Sutton Rocket propulsion elements, An introduction to the engineering of rockets, sixth edition John wiley and sons, Inc

![Figura 3.3 Temperatura [K] Vs HP residuo/ HP iniziale [--] parametrizzao sul rapporto di miscelamento a ϕ costante.](https://thumb-eu.123doks.com/thumbv2/123dokorg/7298463.86826/9.892.286.712.223.538/figura-temperatura-residuo-iniziale-parametrizzao-rapporto-miscelamento-costante.webp)
![Figura 3.5 Temperatura [K] Vs C2H6 in fase liquida [kg] parametrizzata sul rapporto di miscelamento ϕ costante.](https://thumb-eu.123doks.com/thumbv2/123dokorg/7298463.86826/10.892.211.705.605.983/figura-temperatura-fase-liquida-parametrizzata-rapporto-miscelamento-costante.webp)
![Figura 3.6 Temperatura [K] Vs C2H6 residuo / C2H6 iniziale [--] parametrizzata sul rapporto di miscelamento a ϕ costante.](https://thumb-eu.123doks.com/thumbv2/123dokorg/7298463.86826/11.892.288.714.108.438/figura-temperatura-residuo-iniziale-parametrizzata-rapporto-miscelamento-costante.webp)

![Figura 3.8 Temperatura [K] Vs Pressione [atm] parametrizzata sulla T iniziale a ϕ costante.](https://thumb-eu.123doks.com/thumbv2/123dokorg/7298463.86826/13.892.278.725.133.473/figura-temperatura-vs-pressione-atm-parametrizzata-iniziale-costante.webp)
![Figura 3.10 Temperatura [K] Vs C2H6 in fase vapore [kg] parametrizzata sulla T iniziale a ϕ costante](https://thumb-eu.123doks.com/thumbv2/123dokorg/7298463.86826/14.892.238.674.226.551/figura-temperatura-vs-fase-vapore-parametrizzata-iniziale-costante.webp)
![Figura 3.12 Temperatura [K] Vs C2H6 residuo/C2H6 iniziale [--] parametrizzata sulla T iniziale a](https://thumb-eu.123doks.com/thumbv2/123dokorg/7298463.86826/15.892.285.714.106.437/figura-temperatura-k-vs-residuo-iniziale-parametrizzata-iniziale.webp)