Capitolo 2
Risultati e discussione
RISULTATI E DISCUSSIONE
Separazione dei composti
Le foglie di Ruprechtia polystachya Griseb. sono state essiccate e successivamente estratte, tramite una macerazione statica a temperatura ambiente, con solventi a polarità crescente: n-esano, cloroformio, miscela di cloroformio-metanolo (9:1) e infine metanolo, ottenendo i seguenti residui: 7.863 g (RE), 17.558 g (RC), 14.583 g (RC-M), 74.136 g (RM).
Dai precedenti studi condotti sul genere e da un’analisi preliminare gli estratti scelti come oggetto di studio sono stati l’estratto cloroformico, il cloroformio-metanolico e il metanolico. Questi estratti hanno portato alla separazione di una miscela di glicosidi della quercetina (miscela 1) e di 26 composti puri; di questi metaboliti, 22 (composti 1-22) sono stati completamente caratterizzati, mentre 4 (composti a, b, c e d) sono al momento della pubblicazione di questa tesi ancora in corso di caratterizzazione. Tutti i composti isolati, ad eccezione del composto 2, sono metaboliti secondari appartenenti alla grande famiglia dei derivati fenolici. Il composto 2 è, invece, un metabolita primario assai comune, l’acido palmitico.
Tra i metaboliti identificati troviamo, quindi: 2 acetofenoni (composti 1 e 6);
1 lignano (composto 3);
2 derivati dell’acido gallico (composti 4 e 5); 16 flavonoidi (composti 7-22);
1 acido grasso (composto 2).
I flavonoidi a loro volta possono essere classificati in: 1 flavone (composto 10)
8 flavonoli (composti 9, 11, 12, 17, 18, 19, 20 e 21) 4 diidroflavonoli (composti 7, 8, 14 e 15)
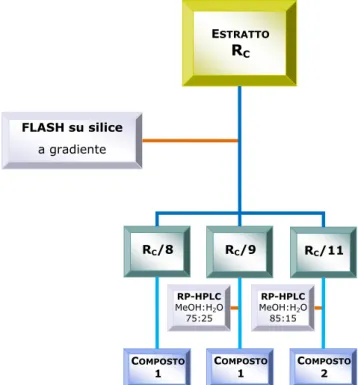
ESTRATTO RC RC/8 FLASH su silice a gradiente RC/9 RC/11 COMPOSTO 1 C OMPOSTO 1 C OMPOSTO 2 RP-HPLC MeOH:H2O 75:25 RP-HPLC MeOH:H2O 85:15
Frazionamento dell’estratto cloroformico RC
Dall’estratto RC, attraverso varie tecniche cromatografiche, illustrate in
Figura 2.1, sono stati isolati e identificati 2 metaboliti (composti 1 e 2). Il composto 1, brevifolina, appartiene alla classe degli acetofenoni, mentre il composto 2, acido palmitico, è un acido grasso.
Figura 2.1 Schema di frazionamento dell’estratto cloroformico, RC
Dallo schema presentato in Figura 2.1 si evince che i composti caratterizzati sono stati ottenuti dall’analisi di solamente 3 frazioni dell’estratto RC. Lo studio delle restanti frazioni, tramite RP-HPLC, non ha
portato alla separazione di nessun’altra molecola pura, ma si sono oottenute solo miscele di acidi grassi non meglio caratterizzati. In particolare non si è rilevato alcun composto di natura triterpenica, come invece ci aspettavamo dalla precedente letteratura sul genere Ruprechtia. Di conseguenza, si è deciso di proseguire l’investigazione del fitocomplesso di R. polystachya studiandone gli estratti più polari, ovvero l’estratto cloroformio-metanolico e l’estratto metanolico.
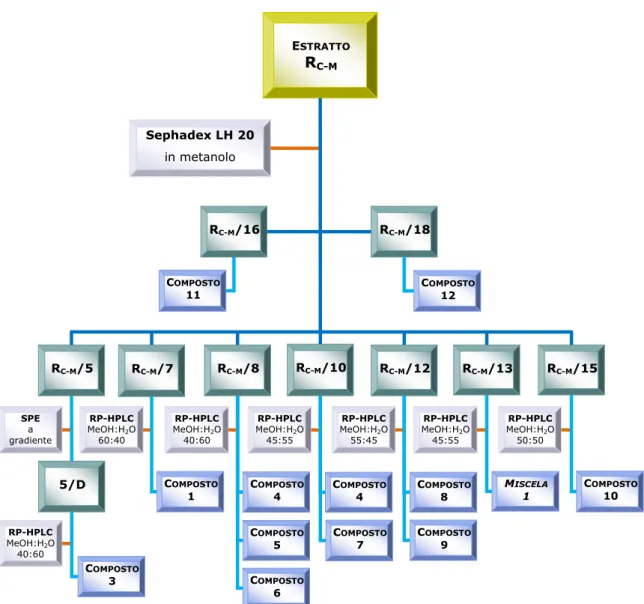
ESTRATTO RC-M RC-M/5 RC-M/8 RC-M/16 Sephadex LH 20 in metanolo COMPOSTO 12 SPE a gradiente COMPOSTO 1 RP-HPLC MeOH:H2O 60:40 RC-M/7 COMPOSTO 11 RC-M/15 RC-M/13 RC-M/10 RC-M/18 RC-M/12 COMPOSTO 3 RP-HPLC MeOH:H2O 40:60 COMPOSTO 4 COMPOSTO 4 COMPOSTO 8 M ISCELA 1 C OMPOSTO 10 RP-HPLC MeOH:H2O 40:60 RP-HPLC MeOH:H2O 45:55 RP-HPLC MeOH:H2O 55:45 RP-HPLC MeOH:H2O 45:55 RP-HPLC MeOH:H2O 50:50 COMPOSTO 5 COMPOSTO 6 COMPOSTO 7 C OMPOSTO 9 5/D
Frazionamento dell’estratto cloroformio-metanolico RC-M
Dall’estratto RC-M, attraverso varie tecniche cromatografiche, illustrate in
figura 2.3, sono stati isolati e identificati 11 metaboliti (composti 1 e 3-12), di cui uno già ottenuto precedentemente dall’estratto RC (composto
1). I composti 1 e 6 appartengono alla classe degli acetofenoni, il composto 3 è un neolignano, i composti 4 e 5 sono derivati dell’acido gallico, il composto 10 è un flavone, i composti 7 e 8 sono diidroflavonoli, e i composti 9, 11 e 12 sono flavonoli. È stata isolata anche una miscela di flavonoli glicosidati aventi come aglicone la quercetina, la miscela 1.
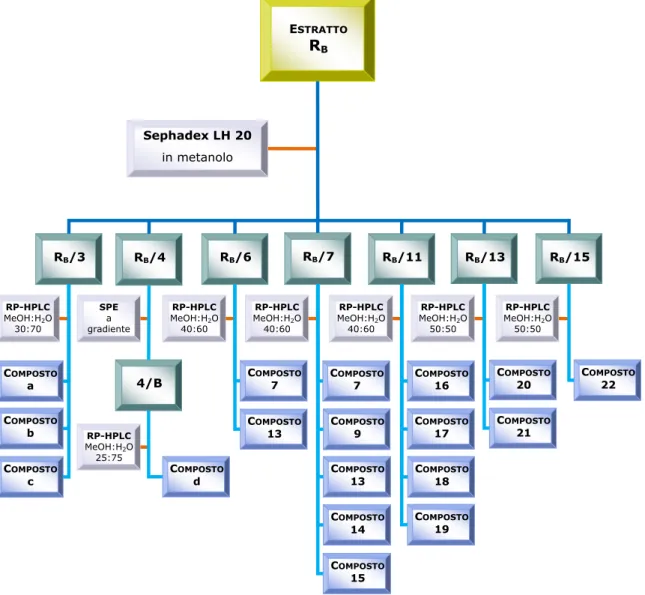
ESTRATTO RB RB/3 RB/6 Sephadex LH 20 in metanolo RP-HPLC MeOH:H2O 30:70 COMPOSTO a SPE a gradiente RB/4 RB/7 RB/11 RB/13 RB/15 COMPOSTO d RP-HPLC MeOH:H2O 25:75 COMPOSTO 7 COMPOSTO 7 COMPOSTO 16 C OMPOSTO 20 C OMPOSTO 22 RP-HPLC MeOH:H2O 40:60 RP-HPLC MeOH:H2O 40:60 RP-HPLC MeOH:H2O 40:60 RP-HPLC MeOH:H2O 50:50 RP-HPLC MeOH:H2O 50:50 COMPOSTO 13 C OMPOSTO 9 C OMPOSTO 17 4/B COMPOSTO b COMPOSTO c COMPOSTO 15 COMPOSTO 13 COMPOSTO 14 COMPOSTO 18 COMPOSTO 21 COMPOSTO 19
Frazionamento dell’estratto metanolico RM
L’estratto metanolico RM è stato ripartito tramite un imbuto separatore in
una porzione n-butanolica, RB, e in una acquosa, RW, rispettivamente di
22.984 g e 51.098 g. Dal residuo n-butanolico, RB, attraverso varie
tecniche cromatografiche secondo lo schema di Figura 2.3, sono stati isolati 16 metaboliti di cui 2 già presenti nell’estratto cloroformio-metanolico (composti 7 e 9). Dei restanti derivati, 4 sono ancora in fase di caratterizzazione (composti a, b, c e d), mentre i composti 13-22 sono già stati completamente caratterizzati. I derivati isolati sono tutti appartenente alla classe dei flavonoidi. Più precisamente i composti 7, 14 e 15 sono diidroflavonoli, i composti 13, 16 e 22 sono catechine, tutti gli altri sono flavonoli.
Determinazione strutturale dei composti
La determinazione strutturale di tutti i composti è stata effettuata mediante spettri NMR mono e bidimensionali (1H, 13C, 13C-DEPT, HSQC,
HMBC, 1D-TOCSY e DQF-COSY) ed è stata confermata tramite spettrometria di massa ESI-MS.
L’analisi NMR è stata eseguita con due tipi di strumenti che operano a campi diversi: 250 e 600 MHz; quest’ultimo è stato impiegato soprattutto per analizzare piccole quantità di campione ottenendo segnali ben risolti e separati. Gli spettri 1H e 13C NMR hanno fornito informazioni sul numero di
protoni presenti, il loro accoppiamento ed il valore delle costanti nonché sul numero di atomi di carbonio. Per determinare il numero di protoni legati a ciascun atomo di carbonio si è operato con l’ausilio della tecnica multi-impulso DEPT (Distortionless Enhancement by Polarization Transfer). L’esperimento 1D-TOCSY (TOtal Correlation SpettroscopY) è stato utile nell’analisi spettroscopica degli zuccheri e nei casi in cui il segnale di un singolo protone si rivelava molto complicato nel semplice spettro 1H-NMR: quest’esperimento consente, infatti, di costruire un sistema di spin eccitando selettivamente un protone che, grazie al trasferimento di magnetizzazione, permette di evidenziare tutti gli altri protoni appartenenti allo stesso sistema.
Molto importanti in fase di determinazione strutturale sono stati gli esperimenti di spettroscopia bidimensionale, che hanno permesso di ottenere un notevole incremento della risoluzione spettrale poiché i segnali vengono a disperdersi in due dimensioni, fornendo quindi ulteriori informazioni sulla correlazione degli stessi. Tutti gli spettri NMR bidimensionali sono stati acquisiti in CD3OD o in CDCl3, in fase positiva con
il trasmettitore regolato sulla risonanza del solvente e sul TPPI, l’incremento di fase proporzionale al tempo, usati per raggiungere una distinzione delle frequenze nella dimensione ω1.
Sono stati effettuati i seguenti esperimenti bidimensionali:
o HSQC (Heteronuclear Single Quantum Coherence), esperimento di correlazione eteronucleare che, impiegando il protone per la rivelazione del segnale, permette di ottenere l’assegnazione di uno spettro 13C dal
corrispondente spettro protonico e viceversa, attraverso la correlazione diretta 1H-13C.
o HMBC (Heteronuclear Multiple Bond Coherence), esperimento di correlazione eteronucleare a lunga distanza che consente di rivelare le correlazioni a più di un legame (2J e 3J) fra un protone e il carbonio non
adiacente, con il vantaggio di mostrare le correlazioni con i carboni quaternari.
o DQF-COSY (Double Quantum Filtered-COrrelated SpettroscopY), esperi-mento che permette di ottenere informazioni sui protoni accoppiati attraverso due o tre legami e di correlare i chemical shifts attraverso gli accoppiamenti scalari omonucleari. Vengono inoltre assegnati i vari sistemi di spin presenti nella molecola anche dove si hanno costanti di accoppiamento molto piccole e, di conseguenza, segnali non ben risolti. L’esperimento filtrato DQF invece permette di distinguere quei segnali, altrimenti coperti, in prossimità del solvente.
Ulteriori informazioni sui composti isolati sono state ottenute mediante analisi spettrometriche come ESI-MS che hanno confermato la struttura dei vari composti attraverso il loro peso molecolare e le frammentazioni, espresse come rapporto massa/carica elettrica (m/z).
ACETOFENONI Composti 1 e 6
Una parte dell’estratto cloroformico (9.6 g) è stata sottoposta a cromatografia flash su gel di silice. Il composto 1 è stato isolato direttamente dalla frazione RC/8, e, in seguito a RP-HPLC, dalla frazione
RC/9, eluendo con una miscela di metanolo-acqua (75:25).
Succes-sivamente lo stesso composto è stato isolato, dopo RP-HPLC, eluendo con una miscela di metanolo-acqua (60:40), anche dalla frazione RC-M/7,
ottenuta da una porzione dell’estratto cloroformio-metanolico (9.723 g) sottoposto a cromatografia su colonna Sephadex LH-20. Il composto 6 è stato ottenuto dalla frazione RC-M/8, tramite RP-HPLC, eluendo con una
miscela di metanolo-acqua (40:60).
OH
H3CO OCH3
O
Figura 2.4 Struttura del composto 1, brevifolina.
Il composto 1 (Figura 2.4), già isolato nella specie Adelanthus decipiens (Hook.) Mitt. (Adelanthaceae), si presenta come un solido cristallino di colore giallo crema e di formula molecolare C10H12O4, determinata
attraverso esperimenti ESI-MS in modalità positiva. Il picco quasi molecolare è a m/z 197 [M+H]+. Gli spettri monodimensionali 1H-NMR, 13C-NMR e 13C-DEPT, insieme ai risultati dell’esperimento bidimensionale
HSQC, hanno permesso di individuare la struttura generale di un acetofenone portante un gruppo ossidrilico in posizione 6 e due gruppi metossilici in posizione 2 e 4. Dal confronto con i dati riportati in
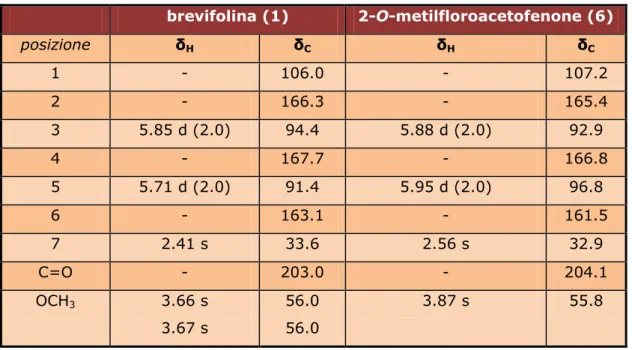
I dati degli spettri 1H-NMR e 13C-NMR della brevifolina sono riportati in Tabella 2.1. OH OCH3 HO O
Figura 2.5 Struttura del composto 6, 2-O-metilfloroacetofenone.
Il composto 6 (Figura 2.5) si presenta come un solido amorfo di colore bianco e di formula molecolare C9H10O4, ottenuta tramite l’ausilio di
esperimenti ESI-MS in modalità negativa. Il picco quasi molecolare risulta a m/z 181 [M-H]-, altri picchi notevoli sono a m/z 167 [M-H-15]- e a m/z
152 [M-H-15-15]- equivalenti alla perdita rispettivamente di uno e di due
gruppi metilici. L’analisi monodimensionale 1H-NMR e 13C-NMR ha permesso di stabilire la struttura come quella di un acetofenone trisostituito, con un gruppo metossilico in 2 e due gruppi ossidrilici in 4 e 6. Confrontando con i dati riportati in letteratura è stato possibile caratterizzare il composto 6 come 2-O-metilfloroacetofenone [Konda et al., 1991].
I dati degli spettri 1H-NMR e 13C-NMR del 2-O-metilfloroacetofenone sono
riportati in Tabella 2.1. OH OR R1O O 1 2 3 4 5 6 7
brevifolina (1) 2-O-metilfloroacetofenone (6) posizione δH δC δH δC 1 - 106.0 - 107.2 2 - 166.3 - 165.4 3 5.85 d (2.0) 94.4 5.88 d (2.0) 92.9 4 - 167.7 - 166.8 5 5.71 d (2.0) 91.4 5.95 d (2.0) 96.8 6 - 163.1 - 161.5 7 2.41 s 33.6 2.56 s 32.9 C=O - 203.0 - 204.1 OCH3 3.66 s 3.67 s 56.0 56.0 3.87 s 55.8
Tabella 2.1 Dati NMR (250 MHz in CDCl3 per il composto 1 e in CD3OD per il composto
2) dei composti 1 e 2. I valori di chemical shift sono indicati in ppm e la loro costante di
accoppiamento in Hz è riportata fra parentesi.
Spettro 2.2 1H-NMR del composto 1.
LIGNANI Composto 3
Una parte dell’estratto cloroformio-metanolico (9.723 g) è stata sottoposta a cromatografia su colonna Sephadex LH-20. La frazione RC-M/5
è stata quindi semplificata ulteriormente tramite una tecnica cromatografica semipreparativa, la SPE. Dalla frazione RC-M/5/D,
analizzata tramite RP-HPLC ed eluendo con una miscela di metanolo-acqua (40:60) si è isolato il composto 3.
Il composto 3 (Figura 2.7) si presenta come un solido amorfo di colore arancio-bruno e di formula molecolare C20H24O6, determinata tramite
analisi ESI-MS in modalità positiva e negativa. I picchi principali sono stati a m/z 743 [2M+Na]+ equivalente al dimero sodiato del composto,
registrato in modalità positiva, e il picco quasi molecolare a m/z 359 [M-H]-, registrato in modalità negativa. Gli spettri monodimensionali 1H-NMR, 13C-NMR, 1D-TOCSY, insieme agli spettri bidimensionali HSQC e HMBC,
hanno permesso di individuare la struttura del derivato fenolico in questione, appartenente alla classe dei lignani. Dai dati presenti in letteratura è stato possibile identificarlo come alcol diidrodeidro-diconiferilico, un neolignano abbastanza comune ma mai precedentemente isolato all’interno della famiglia delle Polygonaceae [Shen et al., 1998].
H3CO HO O OH OCH3 HO 1 3 2 6 9 8 7 5 4 8' 9' 7' 1' 6' 4' 3' 5' 2'
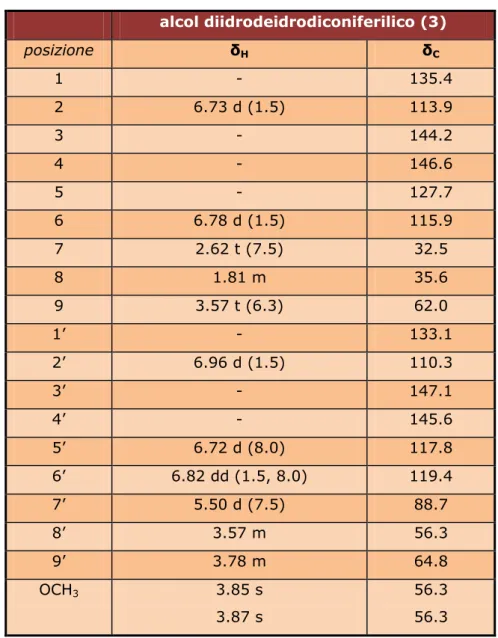
I dati degli spettri 1H-NMR e 13C-NMR dell’alcol diidrodeidrodiconiferilico
sono riportati in Tabella 2.2.
alcol diidrodeidrodiconiferilico (3) posizione δH δC 1 - 135.4 2 6.73 d (1.5) 113.9 3 - 144.2 4 - 146.6 5 - 127.7 6 6.78 d (1.5) 115.9 7 2.62 t (7.5) 32.5 8 1.81 m 35.6 9 3.57 t (6.3) 62.0 1’ - 133.1 2’ 6.96 d (1.5) 110.3 3’ - 147.1 4’ - 145.6 5’ 6.72 d (8.0) 117.8 6’ 6.82 dd (1.5, 8.0) 119.4 7’ 5.50 d (7.5) 88.7 8’ 3.57 m 56.3 9’ 3.78 m 64.8 OCH3 3.85 s 3.87 s 56.3 56.3
Tabella 2.2 Dati NMR (250 MHz in CD3OD) del composto 3. I valori di chemical shift
DERIVATI DELL’ACIDO GALLICO Composti 4 e 5
Una parte dell’estratto cloroformio-metanolico (9.723 g) è stata sottoposta a cromatografia su colonna Sephadex LH-20. Il composto 4 (Figura 2.8) e il composto 5 (Figura 2.9) sono stati isolati entrambi dalla frazione RC-M/8, sottoposta a RP-HPLC eluendo con una miscela di
metanolo-acqua (40:60). Il composto 4 è stato ottenuto anche dalla frazione RC-M/10, sottoposta a RP-HPLC eluendo con una miscela di
metanolo-acqua (45:55). HO OH OH O O
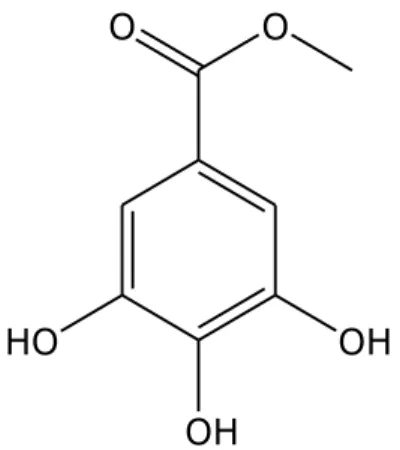
Figura 2.8 Struttura del composto 4, metilgallato.
Il composto 4 (Figura 2.8) si presenta come un solido amorfo di colore bianco e di formula molecolare C8H8O5. In seguito all’analisi dello spettro
monodimensionale 1H-NMR e al confronto con i dati presenti in letteratura
il composto 4 è stato identificato come metilgallato, o estere metilico dell’acido gallico [Kuroyanagi et al., 1982; Haddock et al., 1982].
I dati dello spettro 1H-NMR del metilgallato sono riportati nel capitolo 3.
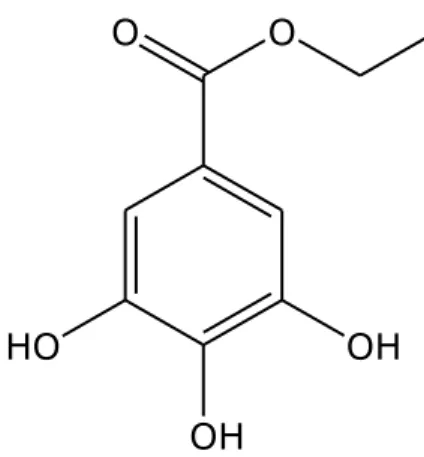
Il composto 5 (Figura 2.9) si presenta come un solido amorfo di colore bianco e di formula molecolare C9H10O5, ottenuta tramite analisi ESI-MS in
modalità negativa. Il picco quasi molecolare è stato registrato a m/z 197 [M-H]-, un altro picco notevole a m/z 169 [M-H-28]-, equivalente alla
perdita del gruppo CH2CH3. La struttura del composto è stata determinata
con l’ausilio degli spettri monodimensionali 1H-NMR e 13C-NMR e, tramite il
identificato come etilgallato, o estere etilico dell’acido gallico [Kandil et al., 1999]. HO OH OH O O
Figura 2.9 Struttura del composto 5, etilgallato.
L’acido gallico e i suoi esteri semplici, come il metilgallato e l’etilgallato, sono composti comuni nel regno vegetale. All’interno di questo lavoro di tesi sono stati isolati anche altri derivati più complessi quali flavonoidi glicosidati con un residuo di acido gallico (composti 20 e 21) e l’epicatechina-3-O-gallato (composto 22). Questi metaboliti verranno trattati a seguire nelle sezioni di questo capitolo riguardanti i flavonoidi. I dati degli spettri 1H-NMR e 13C-NMR dell’etilgallato sono riportati in
Tabella 2.3. etilgallato (5) posizione δH δC 1 - 121.8 2/6 7.04 s 110.1 3/5 - 146.5 4 - 139.9 COO - 168.8 OCH2 4.26 q (7.2) 61.7 CH3 1.32 t (7.2) 14.6
FLAVONOIDI
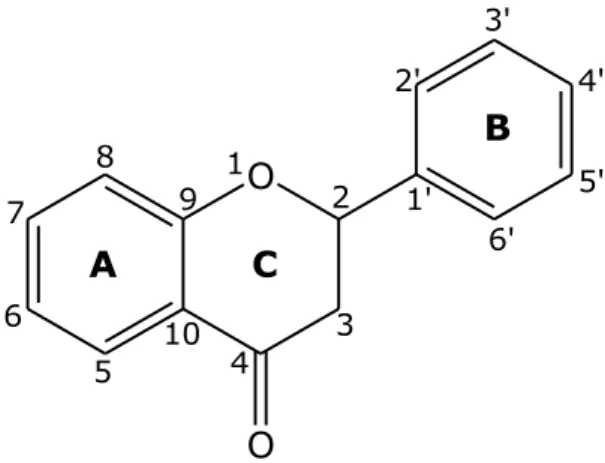
I flavonoidi costituiscono una vasta classe di derivati fenolici, ampiamente diffusi all’interno del regno vegetale. Sono caratterizzati dalla presenza di due anelli aromatici uniti da un terzo anello di natura piranica (Figura 2.10). Il primo anello aromatico, A, porta due gruppi ossidrilici nelle posizioni 5 e 7, ed è condensato all’anello eterociclico, C. Su questo, in posizione 2, è legato il secondo anello aromatico, B, che è sostituito nella posizione 4’, e spesso anche in 3’, con altri gruppi ossidrilici.
O 3 8 7 2 6 5 4 1' 2' 3' 4' 5' 6' 1 A C B 10 9 O
Figura 2.10 Struttura generale dei flavonoidi.
I flavonoidi sono classificati in sottoclassi, a seconda del grado di ossidazione dell’anello piranico. Nelle piante sono presenti come glicosidi, legati a numerosi zuccheri differenti, oppure come agliconi [Bruni et al., 2003; Maffei, 2002].
Nel lavoro di separazione e caratterizzazione dei derivati fenolici isolati dalle foglie di R. polystachya sono stati individuati 16 flavonoidi che saranno illustrati successivamente, suddivisi per sottoclasse. Di questi, 12 sono glicosidati. È bene far notare come la porzione glicosidica sia risultata sempre costituita o da ramnosio in conformazione piranosica o da arabinosio, quest’ultimo sia in conformazione furanosica sia piranosica. Questi dati lasciano supporre una preferenza, nelle vie metaboliche di R. polystachya, per questi due aldosi, entrambi appartenenti alla serie L (a differenza della maggior parte dei monosaccaridi più comuni in natura, che fanno invece parte della serie D).
Flavoni
I flavoni sono flavonoidi con un gruppo carbonilico in posizione 4 e un doppio legame in posizione 2-3.
Composto 10
Una parte dell’estratto cloroformio-metanolico (9.723 g) è stata sottoposta a cromatografia su colonna Sephadex LH-20. Dopodiché la frazione RC-M/15 è stata analizzata tramite RP-HPLC, eluendo con una
miscela di metanolo-acqua (50:50) arrivando all’isolamento del composto 10. O O OH HO OH OH
Figura 2.11 Struttura del composto 10, luteolina.
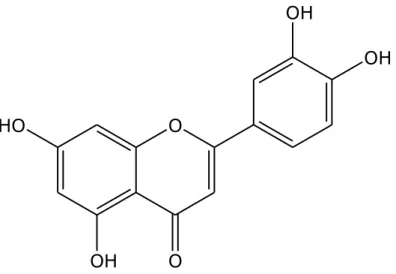
Il composto 10 (Figura 2.11) si presenta come un solido amorfo di colore giallo e di formula molecolare C15H10O6, determinata tramite analisi
ESI-MS in modalità negativa. Il picco quasi molecolare è stato registrato a m/z 285 [M-H]-, mentre un altro picco importante è stato quello del dimero quasi molecolare, a m/z 571 [2M-H]-.
Per definire la struttura è stato importante l’ausilio dello spettro monodimensionale 1H-NMR, e, dal confronto con i dati riportati in
Flavonoli
I flavonoli sono una sottoclasse di flavonoidi caratterizzata dalla presenza di un doppio legame in posizione 2-3, di un gruppo carbonilico in 4 e di un gruppo ossidrilico in 3.
Composti 11 e 12
Una parte dell’estratto cloroformio-metanolico (9.723 g) è stata sottoposta a cromatografia su colonna Sephadex LH-20. Direttamente dalla frazione RC-M/16, senza ricorrere a ulteriori tecniche cromatografiche,
è stato separato puro il composto 11. Similmente, dalla frazione RC-M/18,
si è subito ottenuto il composto 12.
O O OH OH HO OH
Figura 2.12 Struttura del composto 11, kaempferolo.
Il composto 11 (Figura 2.12) si presenta come un solido amorfo di colore giallo e di formula molecolare C15H10O6, determinata con l’ausilio di
un’analisi ESI-MS, registrata in modalità negativa. Il picco quasi molecolare è a m/z 285 [M-H]-. Tramite i dati riportati in letteratura, in
accordo ai risultati dell’esperimento monodimensionale 1H-NMR, il
composto 11 è stato caratterizzato come kaempferolo, un flavonolo [Harborne, 1994].
I dati dello spettro 1H-NMR del kaempferolo sono riportati in Tabella 2.4. Il composto 12 (Figura 2.13) si presenta come un solido cristallino di colore giallo e di formula molecolare C15H10O7, ottenuta tramite analisi
ESI-MS in modalità negativa, con picco quasi molecolare registrato a m/z 301 [M-H]-. L’esperimento monodimensionale 1H-NMR, insieme ai dati
riportati in letteratura, ha permesso di caratterizzare il composto 12 come quercetina, un flavonolo [Harborne, 1994].
O O HO OH OH OH OH
Figura 2.13 Struttura del composto 12, quercetina.
I dati dello spettro 1H-NMR della quercetina sono riportati in Tabella 2.4.
Kaempferolo e quercetina sono due flavonoli molto diffusi all’interno del regno vegetale. Nello specifico, la via biosintetica della quercetina è risultata molto attiva in R. polystachya, in quanto, dei composti caratterizzati e isolati appartenenti alla famiglia dei flavonoidi in questo lavoro di tesi, abbiamo ben 5 flavonoli glicosidati della quercetina (composti 9, 18, 19, 20 e 21) più lo stesso aglicone semplice (composto 12).
luteolina (10) kaempferolo (11) quercetina (12)
posizione δH δH δH 3 6.54 s - - 6 6.20 d (2.1) 6.19 d (2.0) 6.18 d (2.1) 8 6.43 d (2.1) 6.40 d (2.0) 6.40 d (2.1) 2’ 7.38 d (2.1) 8.08 d (8.9) 7.51 d (2.1) 3’ - 6.93 d (8.9) - 5’ 6.90 d (8.9) 6.93 d (8.9) 6.86 d (8.5) 6’ 7.41 dd (2.1, 8.9) 8.08 d (8.9) 7.66 dd (2.1, 8.5)
Composti 9 e 17
Una parte dell’estratto cloroformio-metanolico (9.723 g) è stata sottoposta a cromatografia su colonna Sephadex LH-20. Dall’analisi tramite RP-HPLC della frazione RC-M/12, eluendo con una miscela di
metanolo-acqua (55:45), è stato isolato il composto 9. Lo stesso composto è stato ottenuto anche dalla frazione RB/7, sottoposta a
RP-HPLC, utilizzando come fase mobile una miscela di metanolo-acqua (40:60). La frazione RB/7 era stata precedentemente ricavata dalla
cromatografia su colonna Sephadex LH-20 di una parte dell’estratto n-butanolico (10.08 g) ottenuto dalla ripartizione dell’estratto metanolico. Il composto 17 è stato purificato dalla frazione RB/11, tramite RP-HPLC,
eluendo con una miscela di metanolo-acqua (40:60).
O HO OH O O O OH HO HOH3C OH OH
Figura 2.14 Struttura del composto 9, quercitrina.
Il composto 9 (Figura 2.14) si presenta come un solido amorfo di colore giallo intenso e di formula molecolare C21H20O11, determinata tramite
analisi ESI-MS in modalità negativa. Il picco quasi molecolare è stato registrato a m/z 447 [M-H]-; inoltre un altro picco notevole è presente a m/z 301 [M-H-146]-, questo picco corrisponde all’aglicone e equivale alla
Con l’ausilio dei dati riportati in letteratura e dei risultati dell’esperimento monodimensionale 1H-NMR, il composto 9 è stato caratterizzato come
quercitrina, o quercetina-3-O-α-L-ramnopiranoside, un flavonolo glico-sidato già isolato in numerose specie vegetali [Harborne, 1994].
I dati dello spettro 1H-NMR della quercitrina sono riportati in Tabella 2.5.
O HO OH O O O OH HO HOH3C OH OH OH
Figura 2.15 Struttura del composto 17, miricitrina.
Il composto 17 (Figura 2.15) si presenta come un solido amorfo di colore arancio-rosso e di formula molecolare C21H20O12, ottenuta tramite analisi
ESI-MS in modalità negativa. Il picco quasi molecolare è stato registrato a m/z 463 [M-H]-, altri picchi importanti sono a m/z 926 [2M-H]-,
equivalente al dimero quasi molecolare, e a m/z 316 [M-H-146]-,
corrispondente all’aglicone.
Lo studio dello spettro monodimensionale 1H-NMR e dei dati presenti in letteratura ha permesso di identificare il composto 17 come miricitrina o miricetina-3-O-α-L-ramnopiranoside, un flavonolo glicosidato [Fossent et
quercitrina (9) miricitrina (17) posizione δH δH 6 6.18 d (1.9) 6.20 d (1.8) 8 6.40 d (1.9) 6.37 d (1.8) 2’ 7.32 d (2.0) 6.95 s 5’ 6.88 d (8.3) - 6’ 7.20 dd (2.0, 8.3) 6.95 s 1’’ 5.35 d (1.5) 5.32 d (1.6) 2’’ 4.23 dd (1.5, 3.0) 4.22 dd (1.6, 3.1) 3’’ 3.78 dd (3.0, 9.5) 3.81 dd (3.1, 9.3) 4’’ 3.50 t (9.5) 3.51 t (9.3) 5’’ 3.45 m 3.43 m 6’’ 0.93 d (6.0) 0.97 d (5.9)
Tabella 2.5 Dati NMR (250 MHz in CD3OD) dei composti 9 e 17. I valori di chemical shift
sono indicati in ppm e la loro costante di accoppiamento in Hz è riportata fra parentesi.
Composti 18 e 19
Una parte della frazione n-butanolica dell’estratto metanolico (10.08 g) è stata sottoposta a cromatografia su colonna Sephadex LH-20. Dallo studio della frazione RB/11 per mezzo di RP-HPLC, eluendo con una miscela di
metanolo-acqua (40:60), sono stati ottenuti i composti 18 e 19.
O HO OH O O OH OH O OH HO OH
Il composto 18 (Figura 2.16) si presenta come un solido amorfo di colore giallo e di formula molecolare C20H18O11, ottenuta tramite analisi ESI-MS
in modalità positiva e negativa. In modalità negativa è stato registrato il picco quasi molecolare a m/z 433 [M-H]-, il picco corrispondente al dimero
quasi molecolare a m/z 866 [2M-H]-, e il picco equivalente alla perdita di un pentoso a m/z 301 [M-H-132]-. In modalità positiva sono stati ottenuti
invece il picco equivalente al composto sodiato a m/z 457 [M+Na]+, il
picco del dimero sodiato a m/z 891 [2M+Na]+ e infine quello dell’aglicone
sodiato a m/z 325 [M+Na-132]+. Confrontando i dati presenti in
letteratura con i risultati dell’esperimento monodimensionale 1H-NMR è stato possibile caratterizzare il composto 18 come quercetina-3-O-α-L-arabinopiranoside, un flavonolo glicosidato [Vvedenskaya et al., 2004]. I dati dello spettro 1H-NMR della quercetina-3-O-α-L-arabinopiranoside
sono riportati in Tabella 2.6.
O HO OH O O OH OH H O H OH H OH H CH2OH
Figura 2.17 Struttura del composto 19, quercetina-3-O-α-L-arabinofuranoside. Il composto 19 (Figura 2.17) si presenta come un solido amorfo di colore giallo e di formula molecolare C20H18O11, determinata grazie ad analisi
registrati più importanti sono stati il picco quasi molecolare a m/z 433 [M-H]-, quello del dimero quasi molecolare a m/z 866 [2M-H]- e quello
dell’aglicone a m/z 301 [M-H-132]-. Dall’analisi degli spettri 1H-NMR e 13
C-NMR e dai risultati dell’esperimento bidimensionale HSQC, con l’ausilio dei dati presenti in letteratura, è stato possibile caratterizzare il composto 19 come quercetina-3-O-α-L-arabinofuranoside, un flavonolo glicosidato che
quercetina-3-O-α-L-arabinopiranoside (18) quercetina-3-O-α-L- arabinofuranoside (19) posizione δH δH δC 2 - - 158.5 3 - - 135.6 4 - - 179.4 5 - - 162.9 6 6.20 d (1.9) 6.21 d (1.7) 99.7 7 - - 166.0 8 6.40 d (1.9) 6.40 d (1.7) 94.5 9 - - 159.3 10 - - 105.6 1’ - - 123.1 2’ 7.57 d (2.0) 7.53 d (2.0) 116.7 3’ - - 145.8 4’ - - 149.8 5’ 6.88 d (8.2) 6.90 d (8.3) 116.3 6’ 7.75 dd (2.0, 8.2) 7.50 dd (2.0, 8.3) 122.7 1’’ 5.16 d (7.2) 5.47 br s 109.4 2’’ 3.90 dd (7.2, 8.5) 4.33 br d (2.0) 83.0 3’’ 3.66 dd (3.0, 8.5) 3.92 br d (4.0) 78.4 4’’ 3.81 m 3.87 m 87.8 5’’ 3.47 dd (3.5, 12.0) 3.86 dd (2.0, 12.0) 3.52 m 62.0
Tabella 2.6 Dati NMR (250 MHz in CD3OD) dei composti 18 e 19. I valori di chemical
shift sono indicati in ppm e la loro costante di accoppiamento in Hz è riportata fra parentesi.
differisce dal composto 18 solo perché l’aldopentoso arabinosio è in conformazione furanosica. La quercetina-3-O-α-L-arabinoside è quindi presente nelle foglie di R. polystachya sia in conformazione piranosica sia in conformazione furanosica: in letteratura questo è stato già riscontrato nella specie Vaccinium macrocarpon Ait. (Ericaceae) [Vvedenskaya et al., 2004]. I dati degli spettri 1H-NMR e 13C-NMR della
quercetina-3-O-α-L-arabinofuranoside sono riportati in Tabella 2.6. Composti 20 e 21
Una parte della frazione n-butanolica dell’estratto metanolico (10.08 g) è stata sottoposta a cromatografia su colonna Sephadex LH-20. Dallo studio della frazione RB/13 per mezzo di RP-HPLC, eluendo con una miscela di
metanolo-acqua (50:50), sono stati ottenuti i composti 20 e 21.
O HO OH O O O OH O HOH3C OH OH O HO HO HO
amorfo di colore giallo e di formula molecolare C28H24O15, ottenuta tramite
analisi ESI-MS in modalità positiva e negativa. I picchi principali registrati in modalità positiva sono stati quelli del composto sodiato a m/z 623 [M+Na]+ e quello del dimero sodiato a m/z 1123 [2M+Na]+ mentre in
modalità negativa i picchi più importanti sono stati il picco quasi molecolare a m/z 599 [M-H]-, il picco del dimero quasi molecolare a m/z
457 [2M-H]- e quello dell’aglicone a m/z 301 [M-H-152-146]-. Gli spettri
monodimensionali 1H-NMR, 13C-NMR e 1D-TOCSY, insieme agli
esperimenti bidimensionali HSQC e HMBC, hanno permesso, con il confronto dei dati riportati in letteratura, la caratterizzazione del composto 20 come quercetina-3-O-(3’’-galloil)-α-L-ramnopiranoside, più semplice-mente noto anche come 3’’-O-galloilquercitrina, un estere gallico della quercitrina [Moharram et al., 2006]. I dati degli spettri 1H-NMR e 13C-NMR
della 3’’-O-galloilquercitrina sono riportati in Tabella 2.7.
O HO OH O O O O HO HOH3C OH OH O HO HO HO
Il composto 21 (Figura 2.18) si presenta come un solido amorfo di colore giallo e formula molecolare C28H24O15, determinata tramite analisi ESI-MS
in modalità positiva e negativa. Il picco quasi molecolare è stato registrato in modalità negativa a m/z 599 [M-H]-, insieme al picco del dimero quasi
molecolare, a m/z 1199 [2M-H]-, e al picco dell’aglicone, a m/z 301 [M-H-152-146]-. In modalità positiva si è registrato invece il picco del composto
sodiato a m/z 623 [M+Na]+ e quello del dimero sodiato a m/z 1123
[2M+Na]+. Con l’ausilio degli esperimenti monodimensionali 1H-NMR, 13
C-NMR e 1D-TOCSY e degli spettri bidimensionali HMBC e HSQC, e confrontando i nostri risultati con i dati presenti in letteratura, è stato possibile caratterizzare il composto 21 come quercetina-3-O-(2’’-galloil)-α-L-ramnopiranoside, o, più semplicemente, 2’’-O-galloilquercitrina, un estere gallico della quercitrina [Peng et al., 2003]. I dati degli spettri 1
Spettro 2.6 HSQC del composto 21.
3’’-O-galloilquercitrina (20) 2’’-O-galloilquercitrina (21) posizione δH δC δH δC 2 - 156.5 - 158.5 3 - 134.5 - 135.6 4 - 178.4 - 179.4 5 - 161.2 - 162.9 6 6.21 d (2.1) 99.8 6.21 d (2.1) 100.2 7 - 164.5 - 164.3 8 6.39 d (2.1) 94.5 6.39 d (2.1) 95.0 9 - 156.0 - 156.1 10 - 104.1 - 104.2 1’ - 121.3 - 121.1 2’ 7.39 d (2.0) 116.5 7.38 d (2.2) 117.0 3’ - 145.4 - 145.3 4’ - 148.7 - 148.8 5’ 6.95 d (8.1) 116.4 6.96 d (8.1) 116.8 6’ 7.41 dd (2.0, 8.1) 122.8 7.37 dd (2.2, 8.1) 123.0 1’’ 5.39 d (1.5) 103.3 5.52 d (1.7) 100.7 2’’ 4.48 dd (1.5, 3.0) 69.8 5.67 dd (1.7, 2.9) 73.6 3’’ 5.23 dd (3.0, 9.5) 75.2 4.03 dd (2.9, 9.2) 70.9 4’’ 3.64 t (9.5) 70.6 3.49 t (9.2) 73.9 5’’ 3.59 m 72.1 3.48 m 72.5 6’’ 0.98 d (6.0) 17.6 1.02 d (5.7) 18.1 1’’’ - 118.5 - 118.5 2’’’/6’’’ 7.18 s 110.3 7.09 s 110.5 3’’’/5’’’ - 145.6 - 145.3 4’’’ - 139.0 - 139.1 COO - 165.4 - 165.4
Tabella 2.7 Dati NMR (250 MHz in CD3OD) dei composti 20 e 21. I valori di chemical
shift sono indicati in ppm e la loro costante di accoppiamento in Hz è riportata fra parentesi.
Spettro 2.8 ESI-MS in modalità negativa del composto 21.
Miscela 1
Una parte dell’estratto cloroformio-metanolico (9.723 g) è stata sottoposta a cromatografia su colonna Sephadex LH-20. Dall’analisi della frazione RC-M/13, sottoposta a RP-HPLC usando come fase mobile una
miscela di metanolo-acqua (45:55), è stata ottenuta la miscela 1. Inizialmente la miscela è stata ritenuta un composto puro di natura fenolica appartenente alla classe dei flavonoidi poiché, studiata tramite TLC, aveva mostrato una singola macchia di color giallo intenso al reattivo specifico per i flavonoidi, ovvero il reattivo NTS/PEG.
L’analisi ulteriore degli spettri 1H-NMR e 13C-NMR ha rivelato l’effettiva
presenza della quercetina come aglicone, sebbene sia stato chiaro che non si trattava di un composto puro bensì, data la molteplicità dei segnali riportati per la porzione zuccherina, di una miscela di glicosidi della quercetina, non meglio caratterizzati.
Diidroflavonoli
I diidroflavonoli sono un gruppo di flavonoidi in cui è presente un gruppo carbonilico in posizione 4 e un gruppo ossidrilico in posizione 3. Manca il doppio legame in posizione 2-3, e le posizioni 2 e 3 sono centri chirali. Composti 7 e 15
Una parte della frazione n-butanolica dell’estratto metanolico (10.08 g) è stata sottoposta a cromatografia su colonna Sephadex LH-20. Dallo studio della frazione RB/7 per mezzo di RP-HPLC, eluendo con una miscela di
metanolo-acqua (40:60), sono stati ottenuti i composti 7 e 15. Il composto 7 è stato inoltre purificato anche dalla frazione RB/5, tramite
RP-HPLC con una miscela di metanolo-acqua (40:60) come fase mobile e dalla frazione RC-M/10, sempre per mezzo di RP-HPLC ed eluendo con una
miscela di metanolo-acqua (45:55). La frazione RC-M/10 era stata ottenuta
dalla cromatografia su colonna Sephadex LH-20 di una parte dell’estratto cloroformio-metanolico (9.723 g). O O HO OH OH O OH O H HO OH
Figura 2.19 Struttura del composto 7, (2R,
3R)-diidrokaempferolo-3-O-α-L-arabinopiranoside.
Il composto 7 (Figura 2.19) si presenta come un solido amorfo di colore arancione e di formula molecolare C20H20O10, determinata tramite analisi
ESI-MS, in modalità negativa e positiva. I picchi principali sono stati registrati a m/z 419 [M-H]- (picco quasi molecolare), 839 [2M-H]- (picco
del dimero quasi molecolare), 443 [M+Na]+ (picco del composto sodiato) e
311 [M+Na-132]+ (picco dell’aglicone sodiato).
La struttura è stata stabilita per mezzo del confronto con i dati riportati in letteratura, l’analisi degli spettri monodimensionali 1H-NMR, 13C-NMR e
1D-TOCSY e del bidimensionale HSQC, arrivando alla caratterizzazione del composto 7 come (2R, 3R)-diidrokaempferolo-3-O-α-L-arabinopiranoside, un diidroflavonolo glicosidato [Dagne et al., 1993].
I dati degli spettri 1H-NMR e 13C-NMR del composto sono riportati in
Tabella 2.8.
Il composto 15 (Figura 2.20) si presenta come un solido amorfo di colore arancione e di formula molecolare C20H20O10, stabilita tramite analisi
ESI-MS, in modalità negativa e positiva. Il picco quasi molecolare è stato registrato in modalità negativa a m/z 419 [M-H]-, insieme al picco del
dimero quasi molecolare, a m/z 839 [2M-H]-, mentre il picco del composto
sodiato e quello dell’aglicone sodiato sono stati registrati in modalità positiva, rispettivamente a m/z 443 [M+Na]+ e a m/z 311 [M+Na-132]+.
O O HO OH OH O OH O H HO OH
Figura 2.20 Struttura del composto 15, (2R,
3S)-diidrokaempferolo-3-O-α-L-arabinopiranoside.
Dallo studio degli spettri monodimensionali 1H-NMR e 13C-NMR e
diidroflavonolo glicosidato, stereoisomero del composto 7 [Dagne et al., 1993].
I dati degli spettri 1H-NMR e 13C-NMR del (2R,
3S)-diidro-kaempferolo-3-O-α-L-arabinopiranoside sono riportati in Tabella 2.8.
(2R, 3R)-diidrokaempfe- rolo-3-O-α-L-arabino-piranoside (7) (2R, 3S)-diidrokaempfe- rolo-3-O-α-L-arabino-piranoside (15) posizione δH δC δH δC 2 5.20 d (10.9) 83.6 5.51 d (3.0) 81.6 3 4.85 d (10.9) 76.3 4.55 d (3.0) 76.3 4 - 179.1 - 179.3 5 - 161.7 - 162.5 6 5.92 d (2.0) 96.8 5.94 d (1.9) 96.4 7 - 165.0 - 165.3 8 5.93 d (2.0) 94.8 5.91 d (1.9) 97.3 9 - 158.1 - 158.0 10 - 105.1 - 104.9 1’ - 122.8 - 122.5 2’/6’ 7.37 d (8.0) 130.3 7.39 d (8.0) 130.0 3’/5’ 6.83 d (8.0) 116.3 6.77 d (8.0) 115.8 4’ - 160.7 - 161.3 1’’ 3.78 d (7.2) 101.8 4.56 d (7.2) 102.4 2’’ 3.53 dd (7.2, 8.5) 73.2 3.55 dd (7.2, 8.5) 71.7 3’’ 3.78 dd (3.0, 8.5) 67.1 3.53 dd (3.0, 8.5) 73.3 4’’ 3.56 m 71.2 3.77 m 68.2 5’’ 3.37 dd (3.5, 12.0) 3.89 dd (2.0, 12.0) 63.7 3.41 dd (3.3, 12.0) 3.83 dd (2.1, 12.0) 65.9
Tabella 2.8 Dati NMR (250 MHz in CD3OD) dei composti 7 e 15. I valori di chemical shift
Spettro 2.12 1D-TOCSY del composto 7.
Spettro 2.14 ESI-MS in modalità negativa del composto 7.
Composti 8 e 14
Una porzione dell’estratto cloroformio-metanolico (9.723 g) è stata sottoposta a cromatografia su colonna Sephadex LH-20. Dall’analisi della frazione RC-M/12, tramite RP-HPLC ed eluendo con una miscela di
metanolo-acqua (55:45) si è isolato il composto 8. Una parte della frazione n-butanolica dell’estratto metanolico (10.08 g) è stata sottoposta a cromatografia su colonna Sephadex LH-20. Dallo studio della frazione RB/7 per mezzo di RP-HPLC, eluendo con una miscela di metanolo-acqua
(40:60), è stato separato il composto 14.
O O HO OH OH O H O OH H OH H OH H CH2OH
Figura 2.21 Struttura del composto 8, (2R, 3R)-taxifolina-3-O-α-L-arabinofuranoside. Il composto 8 (Figura 2.21) si presenta come un solido amorfo di colore arancione e di formula molecolare C20H20O11, ottenuta per mezzo di analisi
ESI-MS, in modalità negativa. Il picco quasi molecolare è stato registrato a m/z 435 [M-H]-, altri picchi notevoli sono stati quello del dimero quasi
molecolare, a m/z 871 [2M-H]- e quello dell’aglicone, a m/z 303
[M-H-132]-. Tramite i dati riportati in letteratura, insieme agli spettri
mono-dimensionali 1H-NMR e 13C-NMR e all’esperimento bidimensionale HSQC, è
stato possibile caratterizzare il composto 8 come (2R, 3R)-taxifolina-3-O-α-L-arabinofuranoside, un diidroflavonolo glicosidato già precedentemente isolato dalle radici di Fragaria x ananassa Duch.(Rosaceae) [Kanji et al., 1995].
I dati degli spettri 1H-NMR e 13C-NMR del composto 8 sono riportati in Tabella 2.9. O O HO OH OH O OH O OH OH HO
Figura 2.22 Struttura del composto 14, (2R, 3R)-taxifolina-3-O-α-L-arabinopiranoside. Il composto 14 (Figura 2.22) si presenta come un solido amorfo di colore arancione e di formula molecolare C20H20O11, ottenuta tramite analisi
ESI-MS, in modalità negativa. Il picco quasi molecolare è stato registrato a m/z 435 [M-H]-, il picco del dimero quasi molecolare a m/z 871 [2M-H]- e quello dell’aglicone a m/z 303 [M-H-132]-. Dagli spettri monodimensionali 1H-NMR e 13C-NMR e dall’esperimento bidimensionale HSQC, insieme ai
dati riportati in letteratura, è stato possibile caratterizzare il composto 14 come (2R, 3R)-taxifolina-3-O-α-L-arabinopiranoside, un diidroflavonolo glicosidato che differisce dal composto 8 solamente per la conformazione della porzione zuccherina. Questo derivato fenolico è stato già isolato nella specie Rhododendron ferrugineum L. (Ericaceae) [Chosson et al., 1998]. I dati degli spettri 1H-NMR e 13C-NMR sono riportati in Tabella 2.9.
(2R, 3R)-taxifolina-3-O-α-L-arabinofuranoside (8) (2R, 3R)-taxifolina-3-O-α-L-arabinopiranoside (14) posizione δH δC δH δC 2 5.06 d (12.0) 83.9 5.15 d (10.9) 84.1 3 4.85 d (12.0) 76.0 4.90 d (10.9) 76.3 4 - 198.2 - 196.1 5 - 165.5 - 165.4 6 5.92 d (1.9) 97.7 5.90 d (2.1) 96.3 7 - 168.8 - 168.9 8 5.90 d (1.9) 96.9 5.93 d (2.1) 96.2 9 - 157.0 - 164.3 10 - 105.4 - 105.2 1’ - 129.6 - 128.8 2’ 7.00 d (1.7) 115.8 6.96 d (1.8) 115.4 3’ - 146.5 - 146.5 4’ - 147.5 - 147.4 5’ 6.84 d (8.0) 116.2 6.82 d (8.1) 116.0 6’ 6.88 dd (1.7, 8.0) 120.9 6.84 dd (1.8, 8.1) 120.6 1’’ 4.18 d (1.6) 107.8 3.85 d (3.9) 101.1 2’’ 3.88 dd (1.6, 3.1) 81.1 3.56 dd (3.9, 6.0) 73.0 3’’ 3.78 dd (3.1, 9.3) 79.3 3.80 dd (3.3, 6.0) 66.6 4’’ 4.24 t (9.3) 88.8 3.58 m 71.1 5’’ 3.62 m 63.2 3.44 dd (7.4, 11.7) 3.89 dd (3.6, 11.7) 63.2
Tabella 2.9 Dati NMR (250 MHz in CD3OD) dei composti 8 e 14. I valori di chemical shift
Catechine
Le catechine sono una categoria di flavonoidi con un gruppo ossidrilico in posizione 3 e senza gruppo carbonilico in posizione 4. Le posizioni 2 e 3 sono centri chirali, in quanto manca il doppio legame in posizione 2-3. Composti 13, 16 e 22
Una parte della frazione n-butanolica dell’estratto metanolico (10.08 g) è stata sottoposta a cromatografia su colonna Sephadex LH-20. Il composto 13 è stato separato dalle frazioni RB/6 e RB/7, entrambe analizzate
tramite RP-HPLC usando una miscela di metanolo-acqua (40:60) come fase mobile. Il composto 16 è stato ottenuto studiando la frazione RB/11,
tramite RP-HPLC eluendo con una miscela di metanolo-acqua (40:60), mentre il composto 22 è stato purificato dalla frazione RB/15, mediante
RP-HPLC eluendo con una miscela di metanolo-acqua (50:50).
O OH OH OH HO O O H3C HO HO OH
Figura 2.23 Struttura del composto 13, catechina-3-O-α-L-ramnopiranoside. Il composto 13 (Figura 2.23) si presenta come un solido amorfo di colore
modalità negativa, insieme al picco del dimero quasi molecolare a m/z 871 [2M-H]-. Grazie all’analisi degli spettri monodimensionali 1H-NMR e 13
C-NMR e dell’esperimento bidimensionale HSQC, e confrontando i risultati con quanto riportato in letteratura, è stato possibile identificare il composto 13 come catechina-3-O-α-L-ramnopiranoside, già isolata in precedenza da foglie e corteccia della specie Quercus miyagii Koidz (Fagaceae) [Ishimaru et al., 1987].
I dati degli spettri 1H-NMR e 13C-NMR della
catechina-3-O-α-L-ramno-piranoside sono riportati in Tabella 2.10.
O OH OH OH HO OH
Figura 2.24 Struttura del composto 16, catechina.
Il composto 16 (Figura 2.24), già isolato in moltissime specie vegetali, si presenta come un solido cristallino di colore rosa e di formula molecolare C15H13O6, determinata tramite analisi ESI-MS in modalità positiva e
negativa. Il picco quasi molecolare è stato registrato a m/z 291 [M+H]+ in modalità positiva e a m/z 289 [M-H]- in modalità negativa. Il composto 16
è stato caratterizzato, grazie all’analisi dello spettro 1H-NMR e ai dati
riportati in letteratura, come catechina [Davis et al., 1996].
I dati dello spettro 1H-NMR della catechina sono riportati in Tabella 2.10.
Il composto 22 (Figura 2.25) si presenta come un solido amorfo di colore giallo e di formula molecolare C22H18O10, determinata con l’ausilio di
analisi ESI-MS, in modalità positiva e negativa. Il picco quasi molecolare è stato registrato, in modalità negativa, a m/z 441 [M-H]-, insieme al picco
del dimero quasi molecolare a m/z 883 [2M-H]- e al picco corrispondente
alla perdita di una molecola di acido gallico a m/z 289 [M-H-152]-. In
modalità positiva è stato registrato invece il picco del dimero sodiato, a m/z 907 [2M+Na]+.
Per mezzo degli spettri monodimensionali 1H-NMR e 13C-NMR e ai dati presenti in letteratura è stato possibile caratterizzare il composto 22 come epicatechina-3-O-gallato, un estere gallico dell’epicatechina che, insieme alla catechina stessa, fa parte dei polifenoli presenti nel tè verde (Camellia sinensis (L.) Kuntze, Theaceae) [Davis et al., 1996].
O OH OH OH HO O O OH OH OH
Figura 2.25 Struttura del composto 22, epicatechina-3-O-gallato.
I dati degli spettri 1H-NMR e 13C-NMR dell’epicatechina-3-O-gallato sono riportati in Tabella 2.10.
Tabella 2.10 Dati NMR (250 MHz in CD3OD) dei composti 13, 16 e 22. I valori di
chemical shift sono indicati in ppm e la loro costante di accoppiamento in Hz è riportata fra parentesi. catechina (16) catechina-3-O-α-L-ramnopiranoside (13) epicatechina-3-O-gallato (22) posizione δH δH δC δH δC 2 4.55 d (8.1) 4.62 d (8.0) 80.9 5.03 d (1.4) 78.6 3 3.93 3.93 m 75.6 5.53 m 69.9 4 2.52 dd (8.4, 16.1) 2.83 dd (5.0, 16.1) 2.56 dd (8.0, 16.0) 2.93 dd (4.0, 16.0) 27.8 2.96 dd (2.0, 17.0) 3.05 dd (4.5, 17.0) 26.6 5 - - 157.0 - 157.5 6 5.93 d (1.8) 5.94 d (2.0) 96.2 5.96 d (1.5) 96.5 7 - - 157.6 - 157.8 8 5.86 d (1.8) 5.86 d (2.0) 95.3 5.96 d (1.5) 95.8 9 - - 156.5 - 156.1 10 - - 100.2 - 104.2 1’ - - 131.6 - 131.4 2’ 6.84 d (1.9) 6.84 d (2.0) 114.9 6.93 d (2.2) 115.1 3’ - - 145.6 - 145.9 4’ - - 145.7 - 145.9 5’ 6.79 d (8.1) 6.74 d (8.1) 115.9 6.71 d (8.0) 116.0 6’ 6.73 dd (1.9, 8.1) 6.75 dd (2.0, 8.1) 119.6 6.82 dd (2.2, 8.0) 119.3 1’’ - 4.29 d (1.3) 101.8 - 121.4 2’’ - 3.49 dd (1.3, 3.0) 71.7 6.95 s 110.2 3’’ - 3.52 dd (3.0, 9.4) 71.9 - 146.3 4’’ - 3.58 t (9.4) 72.1 - 138.8 5’’ - 3.66 m 69.6 - 146.3 6’’ - 1.23 d (6.0) 17.7 6.95 s 110.2 COO - - - - 167.5
ALTRI COMPOSTI Composto 2
Una parte dell’estratto cloroformico (9.6 g) è stata sottoposta a cromatografia flash su gel di silice. Il composto 2 è stato isolato dalla frazione RC/11 tramite RP-HPLC ed eluendo con una miscela di
metanolo-acqua (85:15).
Il composto 2 (Figura 2.26) si presenta come un solido cristallino di colore bianco e di formula molecolare C16H32O2, determinata in seguito ad analisi
ESI-MS in modalità negativa. Il picco quasi molecolare è stato registrato a m/z 255 [M-H]-, mentre il picco relativo al dimero del composto è stato
registrato a m/z 511 [2M-H]-. Tramite gli spettri monodimensionali 1
H-NMR e 13C-NMR e l’esperimento bidimensionale HSQC si è potuta studiare
la struttura del composto in esame. Ciò ha permesso la caratterizzazione del composto 2 come acido palmitico, un metabolita primario, apparte-nente alla classe degli acidi grassi saturi a catena lineare.
I dati degli spettri 1H-NMR e 13C-NMR dell’acido palmitico sono riportati nel
capitolo 3.
OH O