Capitolo 3
DOLORE NEGLI ANIMALI DOMESTICI E IN
MEDICINA VETERINARIA
Il dolore si è da sempre manifestato in ogni forma di vita da quando essa è presente sul nostro pianeta. Il dolore è al contempo un sintomo e una patologia. Il termine “dolore” è uno tra i concetti più difficili da definire. Nonostante la scienza abbia chiarito innumerevoli aspetti della sua complicata fisiopatologia, il dolore rappresenta ancora oggi un capitolo non completamente compreso della patologia del paziente. Basti pensare che tradizionalmente, fino a pochi anni fa, il dolore veniva considerato, a torto, come parte integrante del protocollo terapeutico e, in un certo senso, utile per poter limitare le “esuberanze” del paziente animale. Una sorta di contenimento fisiologico, che permetteva di promuovere l'immobilità e garantire la guarigione (funzione protettiva del dolore). La cruciale differenza è insita nel “limite” oltre il quale l'alterato funzionamento di tale dispositivo di salvaguardia trasforma il dolore da sintomo della malattia in malattia stessa (dolore che persiste al di là del danno) (Viganò, 2011).
L'attenzione veterinaria per il dolore è oggi intesa in una prospettiva terapeutica, forse per questo essa si è sviluppata relativamente correlata alla pratica anestesiologica.
Un fondamentale momento nell’importanza del dolore in medicina veterinaria deve essere considerato il primo tentativo di affermare la “sofferenza” animale stabilendo criteri obiettivi per il riconoscimento e la valutazione del dolore (Sanford et al., 1986). Un secondo tentativo può essere considerato la trattazione, nel 1987, di un intero numero sulla principale rivista degli American Veterinary Practitioners “sul riconoscimento e il controllo del dolore e dello stress animale” ove, già nel titolo era sottolineato come non fosse facile un discrimine tra i due termini (AA VV, 1987). Un terzo momento corrisponde alla pubblicazione nel 1992 di un intero libro sul dolore animale (Short &Van Poznak, 1992). L'attenzione generale però, era prevalentemente rivolta alle modalità di terapia del dolore, solo negli ultimi anni appariranno diversi testi o manuali sulla terapia del dolore e sull'analgesia veterinaria, sia in Nord
America che in Europa, dove viene trattata anche la neurofisiologia del dolore, prendono come principale riferimento, le acquisizioni tratte dalla medicina umana. D'altra parte, la stragrande maggioranza delle conoscenze sul dolore applicate in Medicina Umana deriva da modelli sperimentali sugli animali; pertanto sostenere che gli animali non possano percepire dolore, equivale ad affermare che tutti gli studi fatti, relativamente alla farmacologia e alla farmacodinamica degli analgesici, sono basati su un principio errato.
3.1 DEFINIZIONE DEL DOLORE IN MEDICINA VETERINARIA
“Dolore umano” non equivale a “ Dolore Animale”, almeno clinicamente, metodi e definizioni della medicina umana possono risultare utili nella comprensione del dolore negli animali (Molony & Kent, 1997). Anche se in genere accettato che la sensibilità dolorifica possa avere le stesse finalità nell'uomo come negli animali, ciò che differisce è il substrato neurale su cui è applicata. Alcune definizioni in medicina umana sembrano utili come punto di partenza. Il dolore, secondo la definizione dell'I.A.S.P. (International Association for the Study of Pain, 2000) è “un’esperienza sensoriale ed emotiva spiacevole associata ad un danno tissutale reale o potenziale, oppure ad un'esperienza descrivibile come tale danno”. E' evidente che l'espressione “descrivibile” attraverso il linguaggio parlato finisce per penalizzare non solo gli animali, ma anche esseri umani (adulti o neonati) incapaci di esprimersi verbalmente, ma non per questo esclusi dall'esperienza dolorosa. D'altra parte una definizione (umana) del dolore animale non è di semplice attuazione e va incontro a più di un adattamento, come il seguente di Molony e Kent, per cui “il dolore animale è un’esperienza sensitiva avversiva che rappresenta la coscienza da parte dell'animale di un danno o della minaccia (anche senza danno) all'integrità dei suoi tessuti”. Ciò cambia la fisiologia e il comportamento dell'animale volto a ridurre o evitare il danno, a ridurre la probabilità della sua ricorrenza e a promuovere il suo sollievo. Ciò nondimeno, mentre può essere non essenziale argomentare se un animale sia auto-cosciente o “soffra” in un modo umano, è sicuramente un obiettivo medico “veterinario” cogliere la sottigliezza dell'espressività animale negli atteggiamenti comportamentali in risposta al dolore. Secondo queste definizioni, il dolore implica il coinvolgimento della coscienza, pertanto, il soggetto anestetizzato non può percepire
il dolore nel senso stretto del termine, ma è in grado di manifestare le sequele fisiologiche dell'attivazione del sistema di percezione dello stimolo nocivo, anche se quest'ultimo non raggiungerà il livello corticale. In corso di anestesia non è corretto parlare di dolore, ma è meglio ricorrere al termine nocicezione.
3.2 FISIOLOGIA DEL DOLORE, NOCICEZIONE
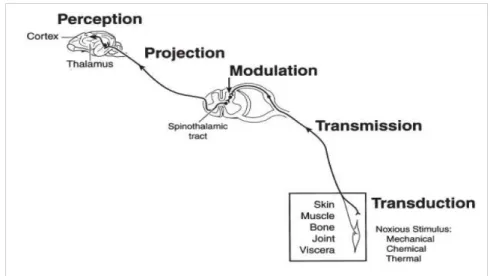
Dolore e nocicezione non sono la stessa cosa. La nocicezione rappresenta la recezione di un segnale proveniente dall'attivazione di nocicettori, recettori deputati alla rilevazione di stimoli tissutali dannosi. Il dolore implica che tali stimoli nocivi siano stati percepiti a livello corticale. Il sistema fisiologico che trasforma le stimolazioni algogene in sensazioni dolorose comprende generalmente quattro processi fondamentali:
• trasduzione dello stimolo algogeno mediante neurotrasmettitori in una serie di fenomeni elettrochimici che portano all'originarsi dell'impulso elettrico. Tale processo avviene a livello dei nocicettori e può essere provocato da stimoli di natura diversa (meccanici, chimici o termici);
• trasmissione, ossia la propagazione dell'impulso elettrico dalla sede nervosa periferica primaria (nocicettore) al sistema nervoso periferico (midollo spinale e vie ascendenti a livello talamico) e poi a quello centrale a livello della corteccia somatosensoriale;
• modulazione, ossia il complicato processo che coinvolge sostanze endogene (serotonina, noradrenalina, oppioidi ecc.), le quali influenzano la trasmissione dell'impulso alterandone il segnale percepito. Questo fenomeno è alla base dell'analgesia fornita dalle endorfine e, in modo opposto, dell'iperalgesia centrale;
• percezione o integrazione, ossia il processo finale attraverso il quale l'individuo percepisce in modo coscio il dolore e reagisce di conseguenza in base alla sua indole o alle sue esperienze passate (Viganò, 2011).
Figura 3.1.: Rappresentazione schematica della trasmissione segnale dolorifico
3.3 TRASDUZIONE
La trasduzione rappresenta la fase di attivazione dei nocicettori, per cui uno stimolo nocicettivo viene convertito in un impulso nervoso.
I nocicettori sono recettori sensoriali con un'elevata soglia di attivazione e sono principalmente sensibili al trauma tissutale o a stimoli non nocivi che potrebbero danneggiare i tessuti in caso di esposizione prolungata. Questi recettori sono costituiti dalle terminazioni libere delle fibre nervose afferenti primarie che sono distribuite in tutta la periferia del corpo.
Uno stimolo nocivo (quello che, se prolungato, provoca un danno che induce risposte umorali e cellulari infiammatorie) attiva i nocicettori mielinici di tipo A-δ e quelli amielinici di tipo C.
I nocicettori A-δ sono unimodali, sensibili a stimoli meccanici e trasducono sensazioni puntorie a velocità di 5-25 m/sec. I nocicettori C sono polimodali, conducono ad una velocità inferiore a 2 m/sec e trasportano impulsi generati dal danno tissutale; essendo polimodali, essi rispondono a insulti termici, chimici, meccanici.
Oltre alla nocicezione diretta, il trauma chirurgico produce una risposta infiammatoria neuroumorale che causa la liberazione di prodotti intracellulari (potassio, bradichinina, prostaglandine) da parte delle cellule infiammatorie e di quelle danneggiate. La bradichinina attiva la fosfolipasi presente in tutte le membrane cellulari determinando la sintesi di prostaglandine e leucotrieni, che innalzano la sensibilità dei nocicettori nella sede della lesione. Di conseguenza, vi è
una risposta maggiore allo stimolo doloroso nella sede del trauma (iperalgesia primaria). Un riflesso assonale invia impulsi verso il midollo spinale, ma anche verso le altre branche periferiche dei nocicettori. Questo causa il rilascio di un neuropeptide (sostanza P), che induce vasodilatazione e degranulazione dei mastociti. Dopo degranulazione dei mastocici vengono rilasciate sia istamina che serotonina. Queste sostanze proinfiammatorie sensibilizzano i nocicettori A-δ e C adiacenti (iperalgesia secondaria). Molti nocicettori (“nocicettori dormienti”) normalmente non possono essere attivati e diventano eccitabili solo in certe condizioni patologiche, come l'infiammazione.
3.4 TRASMISSIONE
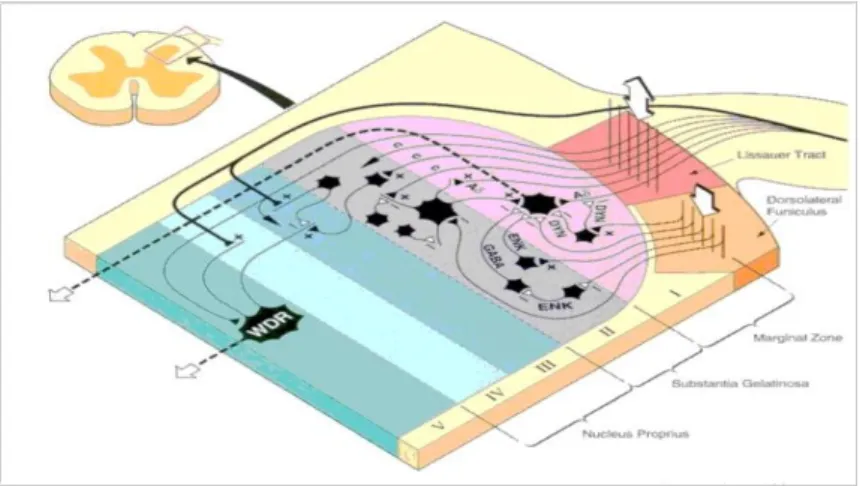
In questa fase l'informazione viene trasmessa alle strutture del SNC deputate all'elaborazione della sensazione del dolore. Gli impulsi nervosi sensoriali tradotti a livello periferico raggiungono il corno dorsale del midollo spinale attraverso gli assoni A-δ di tipo mielinico, responsabili della sensazione di dolore acuto e immediato, e fibre amieliniche di tipo C polimodale, responsabili della sensazione di dolore localizzata, continua e poco profonda. I gangli della radice dorsale (Dorsal Root Ganglia, DRG) contengono i corpi cellulari dei nocicettori A-δ e C. Dopo essere entrati nel midollo spinale, i nocicettori ascendono o discendono per diversi segmenti del tratto di Lissauer prima di entrare in sinapsi con i neuroni di secondo ordine nelle lamina I, II (sostanza gelatinosa) e V del corno dorsale. Il principale trasmettitore usato dai nocicettori che entrano in sinapsi nel corno dorsale è il glutammato e i recettori maggiormente coinvolti nella sensazione di dolore acuto sono i recettori AMPA (Acido-alfa-amino-3-idrossi-5-metil-isossazolo-4-propionico). Le due principali classi di neuroni di secondo ordine sono i neuroni nocicettivi specifici (NS) e quelli ad “ampio range dinamico” (Wide Dynamic Range,WDR). I neuroni NS rispondono solamente a un tipo specifico di stimolo nocivo. I loro campi recettivi sono piccoli e sono osservati soprattutto nella lamina I. I neuroni WDR sono neuroni nocicettivi non specifici. Essi rispondono a un'ampia gamma di stimoli, dal tatto lieve agli stimoli nocivi. Essi hanno un ambito di risposta più ampio e si trovano in tutte le lamine ma sopratutto nella lamina V. Entrambi i neuroni di secondo ordine presentano il soma nel corno dorsale del midollo spinale e assone che proietta lo
stimolo fino al talamo (Shorten et al., 2006).
Figura 3.2: Rappresentazione schematica delle corna dorsali midollo spinale e dei neuroni
della I, II e V lamina.
Vi sono due principali sistemi ascendenti: • la via neo-spino-talamica,
• la via paleo-spinoreticolo-diencefalica.
La via neo-spino-talamica decorre nei quadranti ventro-laterali del midollo e termina nel nucleo dorso laterale del talamo: da qui altri neuroni si proiettano alla corteccia sensitiva. Questa via contiene neuroni che non si interrompono e che conducono informazioni ben discriminate e localizzate. La via paleo-spino-reticolo-diencefalica è una via formata da molti neuroni che conduce afferenze con scarse capacità di localizzazione e di codificazione ma con molte sinapsi nelle strutture implicate nei fenomeni di attivazione e di risposta somatica e vegetativa al dolore. Di essa fanno parte le vie spino-ipotalamica e spino-reticolare che contribuiscono alla responsività neuro-vegetativa al dolore ma sopratutto portano le informazioni nocicettive alla sostanza grigia periacqueduttale, così da attivare il sistema discendente di controllo del dolore (Novelli, et al.,1999).
3.5 MODULAZIONE
Rappresenta l'attività neurologica di controllo dei neuroni di trasmissione dello stimolo nocicettivo.
Anatomicamente i siti di modulazione del dolore sono periferici e centrali (spinali e sovraspinali). Le connessioni ascendenti attraverso cui le informazioni sensitive
raggiungono i centri superiori non sono semplici relais: è infatti noto che sono soggette alla modulazione a opera di connessioni intraspinali e di vie discendenti provenienti dal tronco encefalico e dalla corteccia cerebrale. L'inibizione presinaptica influenza molte fibre afferenti primarie. A livello del midollo sono stati descritti due sistemi di modulazione del dolore:
1. Il sistema delle vie inibitorie discendenti 2. Il sistema del “Gate Control”
I meccanismi inibitori centrali sono attivati per modulare il dolore a livello spinale attraverso le vie discendenti tramite neurotrasmettitori (serotonina, endorfina...) rilasciate dagli interneuroni spinali e sovraspinali durante l'evento nocivo. Questi neurotrasmettirori si legano ai recettori per gli oppiacei pre e post sinaptici inibendo il rilascio di neurotrasmettitori e la trasmissione dello stimolo algogeno aumentando la stabilità delle membrane post sinaptiche. La teoria del controllo a cancello (Melzack & Wall, 1965) propone un meccanismo per la modulazione del flusso di informazioni in entrata lungo le vie afferenti nocicettive (Standring, 2008). La teoria del controllo a cancello fu formulata quando ancora mancavano molte conoscenze sui mediatori e sul sistema degli oppioidi; tuttavia rimane univocamente accettato che la trasmissione degli impulsi nervosi dalle fibre afferenti alle cellule T dei gangli del midollo spinale, è modulata da un meccanismo di controllo d'ingresso (cancello) influenzato dall'attività delle fibre di grande e piccolo diametro. L'attività delle grosse fibre tende ad inibire la trasmissione (chiude il cancello) mentre l'attività delle fibre piccole ne facilita la trasmissione (apre il cancello).
Dall'altra parte, la persistenza dello stimolo dolorifico facilita la sommazione temporale dei segnali in entrata dalla periferia (wind up) determinando una riduzione della soglia di eccitabilità e amplificando la risposta e lo spettro di azione. Sembra che le cellule continuamente stimolate, producano una maggiore quantità di glutammato e di sostanza P, che stimolano i recettori AMPA e della neurochinina-I. Questo porta all'attivazione dei recettori dell'NMDA (N-metil-D-aspartato) normalmente non funzionanati, che reagiscono al glutammato provocando una risposta aumentata. Se la stimolazione persiste in modo cronico, i campi recettoriali dei neuroni WDR si allargano e anche gli stimoli non nocivi sono in grado di attivarli. Tale fenomeno è chiamato iperalgesia secondaria o centrale ed è responsabile della diminuzione della soglia per gli stimoli dolorifici nelle aree
adiacenti a quella danneggiata, fino a determinare allodinia, che rappresenta la percezione del dolore in risposta a uno stimolo normalmente non doloroso (Viganò, 2011).
3.6 PERCEZIONE
Rappresenta la fase di sperimentazione della sensazione soggettiva ed emotiva del dolore, fase terminale. La combinazione di tre livelli psicologici:
• Discriminazione sensoriale: che fornisce informazioni sull'insorgenza della stimolazione dolorosa (localizzazione, intensità, tipo, durata dello stimolo) e che coinvolge vie laterali spino-talamiche e talamo.
• Dimensione emozionale: che interferisce con le condizioni di benessere e provoca risposte a carico del sistema nervoso autonomo, realizza la sgradevolezza del dolore e la correla a paura ed ansia e che coinvolge le vie mediali che instaurano sinapsi nella formazione reticolare e nel sistema limbico.
• Dimensione cognitiva: che risente delle precedenti esperienze e dei processi di condizionamento e che coinvolge l'attività corticale (apprendimento).
3.7 METODI PER LA VALUTAZIONE DEL DOLORE
Allo stato attuale non esiste un sistema universalmente riconosciuto per valutare il dolore negli animali. Diverse strategie sono state investigate sia in via sperimentale che nella pratica clinica, nel tentativo di individuare misure oggettive in grado di valutare il dolore acuto e cronico nei cani e nei gatti. Queste includono l'osservazione e la registrazione di risposte fisiologiche (frequenza cardiaca e respiratoria, perfusione sanguigna, perfusione capillare, ventilazione polmonare, gas ematici, dilatazione pupillare, ecc.), metaboliche (metabolismo glucidico, lipidico, proteico, bilancio idrico, ecc.), neuroendocrine (cortisolo, β-endorfine, catecolamine, glucagone, ADH, ecc.) e locomotorie al dolore (Fernandez et al., 2007). Tali misure però non rappresentano, da sole, degli stretti indicatori di stati algici, in quanto risultano influenzate da molti altri fattori oltre il dolore (Taylor & Robertson, 2004). Metodi in grado di quantificare la risposta sensoria (Quantitative Sensory Testing – QST), che sono stati usati per identificare la soglia nocicettiva meccanica e termica in seguito ad interventi chirurgici, sebbene siano risultati validi sopratutto per
l'efficacia degli analgesici non è stato stabilito come possano fornire uno strumento sensibile per misurare il dolore nei cani e gatti (Fernandez et al., 2007). Un approccio alternativo/complementare per la valutazione del dolore in tali specie è l'impiego di scale del dolore. Per misurare esclusivamente l'intensità del dolore provato dagli animali sono state testate semplici scale unidimensionali. Tali scale monoparametriche sono state adattate da quelle impiegate in medicina umana e includono la scala visuale analogica (VAS), la scala descrittiva semplice (SDS) e la scala descrittiva numerica (NRS). Le prime due quantificano il dolore prendendo come punti di riferimento l'assenza del dolore, la presenza del dolore estremo e un numero variabile di livelli intermedi. La terza è una scala che descrive dettagliatamente le caratteristiche del paziente in base all'intensità del dolore (es. Mathews Pain Scoring System). Sfortunatamente, sebbene generalmente facili da usare, queste scale risultano poco affidabili quando applicate in campo veterinario, in quanto l'osservatore, sulla base di una valutazione puramente soggettiva, a stabilire il livello di dolore provato dall'animale ed attribuirgli un punteggio. Nel tentativo di superare le carenze delle semplici scale descrittive, sono state sviluppate scale interattive multiparametriche dove vengono valutati gli effetti di interazioni verbali e fisiche tra l'animale e l'osservatore e l'ambiente circostante, comprendenti anche quelli conseguiti ad una lieve palpazione dell'area dolente o del sito chirurgico, eventualmente in associazione ad una valutazione delle modificazioni fisiologiche in atto. Tali interazioni con il paziente hanno lo scopo di aumentare la capacità dell'osservatore di apprezzare gli effetti sia comportamentali che sensoriali del dolore provato dall'animale. In medicina Umana, scale composite come il “McGill Pain Questionaire” utilizzano proprio questo approccio. Recentemente, diverse scale composite approntate sul modello McGill Pain Questionaire sono state sviluppate tentandone l'applicazione in medicina veterinaria. Tali scale (tra cui la University of Melbourne Pain Scale, la Colorado State University Scale, la 4A Vet Scale e il Glasgow Composite Paine Tool) includono la possibilità di valutare la possibilità di valutare non solo l'intensità dello stato algico, ma anche le risposte fisiologiche e comportamentali al dolore (Bufalari et al., 2007; Dobromylskyj et al., 2000; Fernandez et al., 2007;Hellyer, 2002; Hellyer, 2007; Mathews, 2000). Le scale multiparametriche posso essere impiegate solo in condizioni di dolore acuto conseguente a traumi o ad interventi chirurgici, e alcuni indici comportamentali
introdotti in alcune di queste scale (in particolare Glasgow, che allo stato attuale appare, tra quelle menzionate la più affidabile e per questo l'unica attualmente validata) sono stati definiti facendo riferimento specificatamente alla specie canina.