CAPITOLO 2
2.Acido Adipico
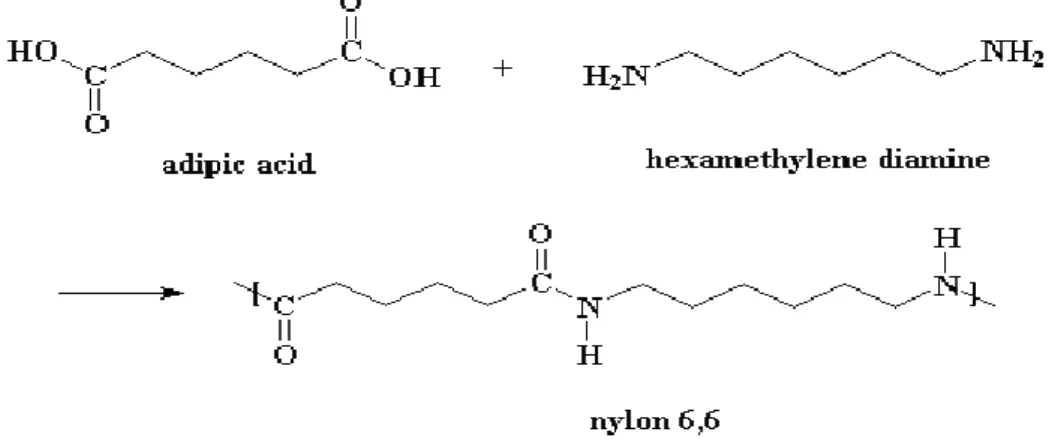
L’acido adipico (figura 1), o acido esandioico, a temperatura e pressione ambiente, è un composto cristallino, bianco e inodore; presenta il punto di fusione a 152°C, risulta molto solubile in solventi polari ed è praticamente insolubile in solventi apolari. Le sue molteplici applicazioni come intermedio chimico, di cui la più importante è nella produzione del nylon 6,6, lo rendono uno dei più importanti acidi dicarbossilici alifatici, non per niente la sua produzione mondiale è pari a circa 2,8 106 tonnellate all’anno[1].
Figura 1: acido Adipico.
2.1 Applicazioni e produzione
L’acido adipico è utilizzato come intermedio per molti scopi dall’industria chimica; il suo utilizzo principale è quello come monomero nella sintesi del nylon 6,6 (figura 2).
Sebbene l’acido adipico sia utilizzato prevalentemente nella produzione delle poliammidi, in misura minore è impiegato anche come intermedio per la produzione di poliesteri insaturi, resine poliuretaniche, plastificanti e come additivo alimentare, sostituendo completamente quelli tradizionali, quali l’acido citrico e l’acido tartarico[2].
Conseguentemente a tali applicazioni e all’aumento dell’impiego del nylon 6,6 nella produzione di fibre e materie plastiche, la richiesta di acido adipico è in continua crescita, intorno al 3% annuale e nel 2010 la crescita è stimata addirittura intorno al 5-6%[2].
2.2 I processi industriali
Ad oggi l’acido adipico è sintetizzato, a livello industriale, per il 95% della produzione totale a partire da cicloesano, oppure da fenolo per il restante 5%; in entrambi i casi il processo di sintesi avviene in 2 stadi:
• il primo stadio comprende la trasformazione del substrato di partenza per ottenere cicloesanolo o una miscela di cicloesanolo-cicloesanone, chiamata KA oil;
• nel secondo stadio il cicloesanolo o la miscela KA oil vengono ossidati ad acido adipico con acido nitrico[3].
Gli attuali processi industriali si differenziano, dunque, per il primo stadio di reazione, mentre il secondo stadio, il più impattante a livello ambientale, è lo stesso per tutti i tipi di processo.
2.2.1 Miscela KA oil
La miscela di cicloesanolo e cicloesanone, prodotta nel primo stadio di reazione, può essere ottenuta attraverso 3 diverse sintesi[2]:
• l’ossidazione del cicloesano con aria,
• l’idrogenazione catalitica di fenolo a cicloesanolo,
• l’idratazione di cicloesene.
2.2.1.1 Ossidazione del cicloesano con aria
L’ossidazione del cicloesano è stata sviluppata per la prima volta nel 1940 dalla DuPont, ed attualmente il 98 % della produzione totale di acido adipico negli USA ed il 94 % di quello europeo utilizza come materia prima di partenza cicloesano che a sua volta può essere ottenuto dalla idrogenazione del benzene oppure, in piccola parte, dalla frazione naphta[4]. Il processo ossidativo può essere condotto attraverso 2 differenti vie di sintesi:
1. nel processo tradizionale l’ossidazione viene condotta in presenza di sali organici di Co o Mn;
2. nel processo Halcon, IFP e Stamicarbon Tecnology viene invece utilizzato acido metaborico anidro.
Nel processo tradizionale,(1), il cicloesano, in fase liquida, viene ossidato per via radicalica in presenza di catalizzatori omogenei di cobalto e manganese, in un intervallo di temperatura compreso tra 150°-180° C e una pressione di 10 atm. La reazione comprende 2 stadi:
• l’ossidazione del cicloesano a cicloesilperossido
C
6H
12+ O
2→ C
6H
11OOH;
• la deperossidazione di tale intermedio, in presenza del medesimo catalizzatore, a cicloesanone e cicloesanolo
3 C
6H
11OOH → 2 C
6H
11OH + C
6H
10O + O
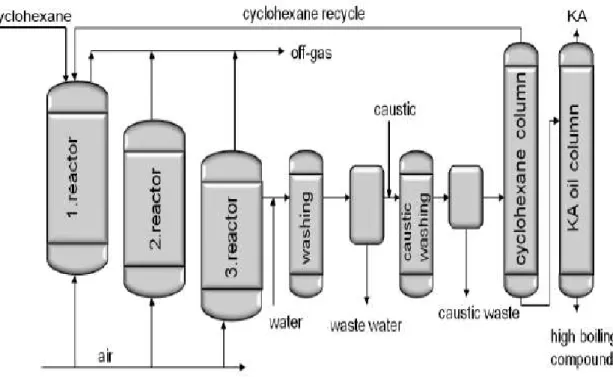
2.Il primo stadio di questa reazione, che porta alla formazione dell’idroperossido, limita la velocità dell’intero processo e in genere viene condotto in reattori passivati, in assenza di complessi di metalli di transizione al fine di evitare la decomposizione del prodotto stesso. Quest’ultima viene invece condotta in un secondo reattore, dove sono ottimizzate la quantità di catalizzatore e le condizioni di reazione in modo tale da ottenere il rapporto cicloesanolo-cicloesanone desiderato. La reattività dei prodotti finali e dell’intermedio di reazione, maggiore di quella del substrato di partenza, impone la necessità di limitare la conversione del cicloesano tra il 5 e il 7 %, riciclando quello non convertito, al fine di evitare il rischio di reazioni consecutive. Pur con questo accorgimento la selettività del processo è compresa tra il 75 e l’80 %, i sottoprodotti più comuni sono acidi carbossilici e cicloesilidroperossido[2][5]. La figura 4 illustra un flow sheet semplificato della sintesi della miscela KA oil:
il cicloesano è alimentato al primo dei tre reattori in serie, nei quali avviene la reazione di ossidazione, mentre l’aria è alimentata a tutti i reattori, ottenendo in questo modo un controllo ed una sicurezza maggiore sulla reazione. Una volta uscita dal reattore di ossidazione, la miscela di reazione viene lavata con acqua per il recupero del catalizzatore e in seguito viene trattata con una soluzione caustica, (con concentrazione tra il 5 e il 7 % in peso), per ridurre le
impurezze acide che si formano come sottoprodotto; dopo il lavaggio, la miscela viene inviata in una prima colonna di rettifica, dove viene recuperato di testa e riciclato il più bassobollente cicloesano non reagito, infine nell’ ultima colonna di rettifica dove avviene il recupero della miscela KA oil.
Figura 4: flow-sheet semplificato di un impianto per la sintesi della miscela KA oil.
Nel 1950 fu messo a punto dalla Halcon un secondo processo per la sintesi della miscela Keton-alcool,(2), che prevede l’impiego di acido metaborico anidro nel primo dei 4 reattori dove avviene l’ossidazione, senza bisogno di altri catalizzatori. La reazione avviene con la formazione di un intermedio perossiborato del cicloesano che viene trasformato nel sale metaborico del cicloesano, un prodotto stabile, rispetto a quelli del processo tradizionale, con minor tendenza a dare prodotti di successiva ossidazione. In seguito il cicloesanometaborato viene idrolizzato a cicloesanolo ed acido borico, quest’ultimo a sua volta viene disidratato a acido metaborico e riciclato al reattore di ossidazione.
18 C
6H
12+ 9 O
2+ H
3B
3O
6→ 6 B(OC
6H
11)
3+ 12 H
2O
B(OC
6H
11)
3+ 3 H
2O → 3 C
6H
11OH + H
3BO
3Sebbene per questo tipo di processo i costi di investimento per l’impianto siano maggiori rispetto a quello precedentemente descritto (a causa del processo di disidratazione, recupero e riciclo dell’acido borico), essi vengono però compensati da una maggiore conversione del cicloesano, compresa tra il 10-15 % e da una selettività in miscela KA oil che risulta essere del 90 %, con un rapporto molare alcool\chetone pari a 10.
2.2.1.2 idrogenazione del fenolo
Figura 5:schema della reazione di idrogenazione del fenolo.
La reazione di idrogenazione del fenolo (figura 5) per ottenere cicloesanolo presenta, rispetto al processo classico di ossidazione del cicloesano, diversi vantaggi: necessita di apparecchiature meno complesse, permette di avere una maggiore selettività nella molecola desiderata e, conseguentemente, la purezza del prodotto ottenuto è molto elevata. Inoltre giocando sul catalizzatore, è possibile ottenere la miscela KA oil con il rapporto molare ottimale tra chetone e alcool[2] , tale possibilità è molto importante poiché, aumentando la quantità di chetone presente in miscela, è possibile diminuire il consumo di idrogeno ed acido nitrico nel successivo stadio di ossidazione della stessa ad acido adipico.
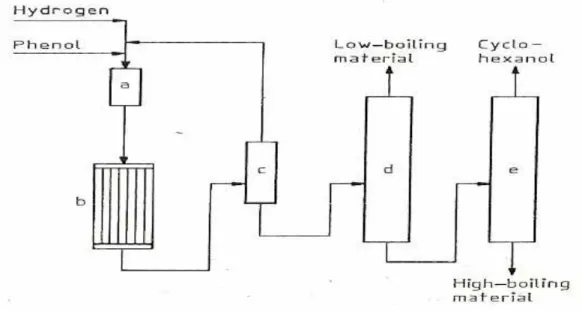
L’idrogenazione del fenolo, per ottenere cicloesanolo, viene condotta in fase gas, utilizzando catalizzatori di nichel supportati su allumina, i quali possono contenere anche rame, cobalto o manganese, alla temperatura di 150°C impiegando una pressione di idrogeno di 3 bar, (Processo Allied e Monsanto), con una resa in cicloesanolo del 95 %. Tale reazione può essere fermata alla produzione di cicloesanone, sia in fase gas che in fase liquida. Il processo è condotto, più comunemente, in fase gas, in presenza di un’ampia gamma di catalizzatori a base di metalli nobili come il palladio, il platino, l’iridio, il rutenio e l’osmio; le condizioni di reazione sono analoghe a quelle utilizzate per l’ idrogenazione completa del fenolo a cicloesanolo: infatti la temperatura di processo è compresa tra i 140 ed i 170°C e si lavora a pressione atmosferica di idrogeno, raggiungendo una conversione di fenolo del 95 %.
In figura 6 è rappresentato il flow sheet dell’impianto per l’idrogenazione del fenolo in fase gas: il substrato di partenza è alimentato, insieme all’idrogeno ad un evaporatore (a), quindi la miscela dei due gas arriva al reattore multitubolare (b). La miscela dei prodotti ottenuti viene
poi inviata ad un condensatore (c) e di seguito ad una colonna di distillazione (d) dove vengono allontanati di testa i prodotti bassobollenti, mentre nell’ultima colonna dell’impianto viene recuperato il cicloesanolo ottenuto come prodotto di testa.
Figura 6:flow sheet dell'impianto di idrogenazione del fenolo.
2.2.1.3Idratazione diretta del cicloesene
Figura 7: schema della reazione di idratazione del cicloesene.
L’idratazione diretta del cicloesene (figura 7), condotta in presenza di diversi catalizzatori rappresenta una via di sintesi alternativa per la produzione di cicloesanolo. Il cicloesene è un ottimo precursore per la sintesi di fine chemicals ad alto valore aggiunto a causa dell’elevata reattività del doppio legame. Tale processo presenta però delle problematiche che limitano lo sviluppo su larga scala[6]:
• l’idrogenazione del benzene a cicloesene è termodinamicamente sfavorita rispetto alla completa idrogenazione a cicloesano, che quindi è favorita, e diventa difficile ottenere il prodotto intermedio con buone selettività;
• la miscela finale ottenuta, composta da benzene, cicloesano e cicloesene, è di difficile separazione a causa dei punti di ebollizione molto vicini.
Tali problematiche sono state superate dall’industria Asahi, che ha messo a punto una tecnologia “ad hoc” per tale processo, utilizzata in almeno 5 impianti, di cui custodisce gelosamente il know-how.
2.3 Ossidazione della miscela KA oil
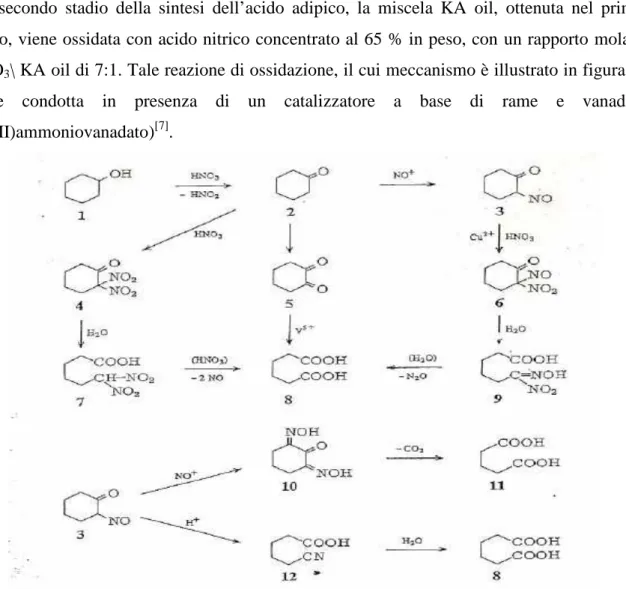
Nel secondo stadio della sintesi dell’acido adipico, la miscela KA oil, ottenuta nel primo stadio, viene ossidata con acido nitrico concentrato al 65 % in peso, con un rapporto molare HNO3\ KA oil di 7:1. Tale reazione di ossidazione, il cui meccanismo è illustrato in figura 8,
viene condotta in presenza di un catalizzatore a base di rame e vanadio, (Cu(II)ammoniovanadato)[7].
Figura 8: meccanismo di reazione di ossidazione della miscela KA oil.
Fin dal 1956, poco dopo la brevettazione da parte della Du pont del processo con catalizzatori di rame, sono stati molti gli studi che hanno indagato e proposto il meccanismo della reazione, ciononostante ad oggi sull’argomento sono ancora in corso modifiche e revisioni
[8][9]
. Come si può osservare in figura 8 il primo step della reazione è caratterizzato dall’ossidazione del cicloesanolo (1) a cicloesanone (2), accompagnato dalla formazione di acido nitroso, il chetone a sua volta può reagire in diversi modi per dare acido adipico (8):
• la maggior parte del cicloesanone viene nitrosilato a 2-nitrosocicloesanone (3), il quale a sua volta reagisce con l’acido nitrico per dare 2-nitro-2-nitrosocicloesanone (6), la rottura idrolitica di questo intermedio porta alla formazione dell’acido 6-immino-6-idrossiimminoesanoico (9) che successivamente si decompone per dare acido adipico e ossidi di azoto.
• Il cicloesanone può anche essere ossidato a cicloesandione (5), questo intermedio viene poi ossidato ad acido adipico in presenza di catalizzatori di vanadio.
Anche l’intermedio 2-nitrosocicloesanone può subire altre 2 differenti vie di reazione, oltre a quella appena descritta:
• via nitrosazione, si forma l’intermedio (10), che tramite decarbossilazione dà acido glutarico (11)
• via riarrangiamento di tipo Beckmann, il nitrosochetone forma l’acido 5-cianopentanoico (12), che successivamente si idrolizza ad acido adipico (8).
Una volta terminato il processo, sono state consumate 2 moli di agente ossidante per ogni mole di cicloesanone: la necessità di utilizzare un eccesso di acido nitrico rappresenta, come vedremo in seguito, una delle maggiori problematiche di impatto negli attuali processi di produzione di acido adipico.
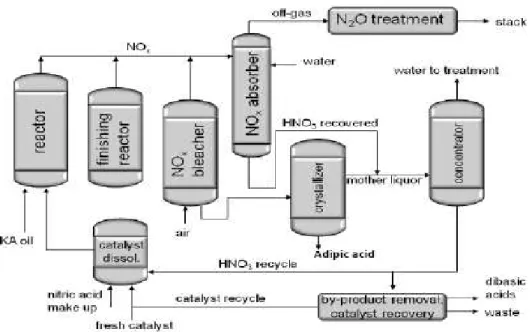
2.3.1 Il processo industriale
Il processo industriale per l’ossidazione della miscela KA oil è condotto in 2 reattori in serie: il primo operante a 60-80°C, mentre il secondo a temperatura più elevata, tra i 90-100°C; impiegando una pressione tra 1 e 4 atmosfere. La resa molare ottenuta a conversione totale di KA oil è del 95 %, i principali sottoprodotti sono l’acido glutarico, (selettività del 3 %) e l’acido succinico, (selettività del 2 %). In figura 9 è illustrato un flow sheet semplificato per il secondo stadio del processo per la sintesi dell’acido adipico.
Figura 9: flow-sheet per il processo di ossidazione della miscela KA oil.
Il flusso di acido nitrico in entrata al reattore, costituito da due correnti, una di riciclo ed una di alimentazione fresca, contiene anche il catalizzatore di Cu\V. La reazione è molto esotermica e necessita di un controllo continuo per tenere la temperatura sufficientemente bassa. La miscela di reazione, una volta uscita dal reattore, viene inviata ad una colonna dove si allontanano gli NOx, attraverso uno stripping con aria, e quindi il flusso contenente gli
ossidi di azoto inviato ad un’altra colonna dove sono trattati con acqua e recuperati con acido nitrico; la frazione di ossidi di azoto non recuperabile è invece inviata al trattamento per l’abbattimento prima di poter essere immessa in atmosfera. La soluzione acquosa, in uscita dalla colonna di stripping, viene inviata al cristallizzatore dove si recupera l’acido adipico che in seguito viene filtrato e centrifugato. Le acque madri recuperate dalla filtrazione, insieme all’acido nitrico in uscita dalla colonna di assorbimento, sono inviate ad un concentratore dal quale in testa sono recuperate le acque da trattare e in coda si ottiene l’acido nitrico; quest’ultimo prima di essere inviato al flusso di riciclo viene trattato per recuperare, per scambio ionico, il catalizzatore e separarlo dai sottoprodotti.
2.4 Problematiche degli attuali processi industriali
Dal momento che la richiesta dell’ acido adipico risulta essere crescente e che quindi la sua produzione, già ingente, aumenta di anno in anno, non si possono sottovalutare le problematiche connesse con gli attuali processi industriali, anzi è necessario ed utile individuarle ed effettuare studi di ricerca per limitarle o, meglio ancora, evitarle.
2.4.1 Impatto ambientale
Sicuramente la problematica maggiore connessa con la produzione dell’ acido adipico è collegata alla formazione di enormi quantità di protossido di azoto (0.3 tonnellate per ogni tonnellata di AA prodotto)[10], un gas difficile da smaltire che è sicuramente una delle maggiori cause del consumo di ozono e dell’effetto serra. Per molti anni l’industria dell’acido adipico è stata la maggior responsabile della produzione di N2O, fino al 2000, quando le
restrizioni delle normative hanno imposto alle aziende produttrici l’installazione di tecnologie atte alla rimozione ed all’abbattimento del protossido di azoto[11].
Gli altri sottoprodotti derivanti dall’utilizzo dell’acido nitrico come agente ossidante sono il monossido ed il biossido di azoto, che vengono recuperati, tramite assorbimento con acqua, in una colonna multistrato e riutilizzati all’interno del processo:
2 NO + O
2→ 2 NO
23 NO
2+ H
2O → 2 HNO
3+ NO
Nonostante la scarsa solubilità degli NOx, utilizzando condizioni di pressione e temperatura
ottimali, si può ottenere il loro recupero totale; purtroppo il protossido di azoto non può essere recuperato così semplicemente e la sua coproduzione rappresenta il vero problema ambientale nel processo industriale di sintesi dell’acido adipico: infatti il suo tempo di vita è stimato intorno ai 150 anni e si calcola che costituisca il 6 % dei fattori che contribuiscono al consumo dell’ozono[12].
2.4.1.1 Metodi per l’abbattimento di N2O
Come è stato scritto precedentemente, in seguito alle restrizioni effettuate dalle normative che regolano l’emissione di agenti inquinanti in atmosfera, è stato necessario sviluppare tecnologie sempre più avanzate per il trattamento del protossido di azoto; i metodi attualmente in uso, a livello industriale, ad oggi sono 3:
2) la decomposizione termica,
3) la conversione del protossido a monossido di azoto, che può essere recuperato[6]. Il primo metodo, il più semplice, consiste in una reazione fortemente esotermica (∆H= -19,6 Kcal\mol), che non richiede l’utilizzo di altri reagenti e le reazioni in gioco sono le seguenti:
N
2O + * ↔ N
2O*
N
2O* → N
2+ O*
2O* → O
2+ *
N
2O + O* → N
2+ O
2+ *
dove
*
è il sito attivo del catalizzatore.Il processo di decomposizione (1), può essere catalizzato da diverse classi di sistemi quali i metalli nobili, ossidi metallici, puri o in miscela, sistemi supportati di metalli o ossidi metallici e zeoliti[13][14]. Nonostante il processo sia apparentemente molto semplice, la sua esotermicità è causa di problematiche importanti che determinano alti costi di gestione, connessi con la rapida sinterizzazione del catalizzatore, la necessità di utilizzare materiali speciali e il controllo restrittivo della temperatura necessario per poter rispettare le concentrazioni di NOx in uscita ammesse dalla legge; infatti, maggiore è la temperatura più
alto è il rischio che si formino ossidi di azoto.
La decomposizione termica (2) che rappresenta il secondo metodo, può avvenire sia effettuando la combustione di N2O in condizioni ossidanti sia in atmosfera riducente.
Nel primo caso si formano NO e NO2, che subiscono poi il processo di assorbimento in acqua
per dare acido nitrico da riciclare. La combustione in ambiente riducente, invece, viene effettuata in condizioni substechiometriche per minimizzare la formazione degli ossidi di azoto, in presenza di eccesso di metano: si produce singas (CO e H2) il cui valore aggiunto
rappresenta la driving force per la riduzione degli NOx:
4 N
2O + CH
4→ CO
2+ 2 H
2O + 4 N
24 NO + CH
4→ CO
2+ 2 H
2+ 2 N
22 O
2+ CH
4→ CO
2+ 2 H
2O
H
2O + CO
2+ 2 CH
4→ 3 CO + 5 H
2N
2O → 1\2 O
2+ N
2Il terzo metodo, (3), risulta essere un’alternativa interessante anche nell’ottica della “green chemistry”, infatti prevede il recupero del protossido di azoto puro per riutilizzarlo, come
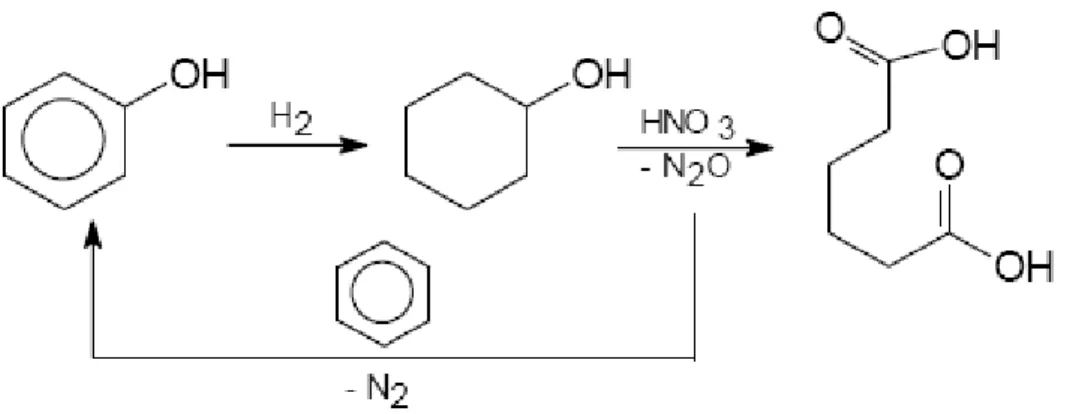
forte agente ossidante, all’interno di vari processi. Un impiego molto interessante, proposto da Solutia e Boreskov Institute of Catalysis, è il riutilizzo dell’N2O per l’ossidazione del benzene
a fenolo, che viene poi a sua volta idrogenato a cicloesanolo, integrandolo così il protossido nel processo di produzione dell’acido adpico[15]. La reazione, rappresentata in figura 10, è catalizzata da zeoliti ZSMC- Fe3+. Nonostante gli ottimi risultati ottenuti (la conversione del fenolo è infatti maggiore del 95 %) lo studio si è interrotto a livello di impianto pilota perchè sono stati riscontrati dei limiti di applicazione, come la disattivazione del catalizzatore e la bassa efficienza rispetto a N2O prodotto, che determinano una scarsa economicità del
processo non bilanciabile con la produzione dell’acido adipico.
Figura 10: schema della reazione per la reintegrazione dell’N2O.
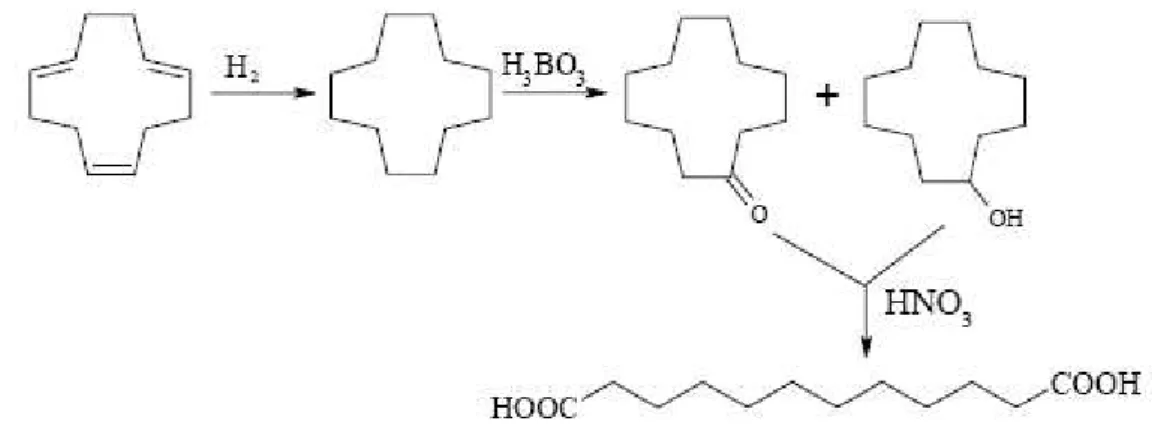
L’azienda Basf, invece, ha brevettato nel 2005 un processo che prevede la riutilizzazione del N2O per la sintesi del ciclododecadienone, materia prima per la sintesi del Nylon 12[16]; tale
processo è stato messo in funzione dal 2009. La reazione in gioco, illustrata in figura 11, è l’ossidazione del ciclododecatriene a ciclododecanone per mezzo del protossido d’azoto; tale processo risulta essere anche meno inquinante di quello classico per la produzione del ciclododecanone, rappresentato invece in figura 12, che coinvolge ancora una volta l’impiego di acido nitrico come agente ossidante.
Figura 12: processo classico per la produzione di ciclododecanone.
2.4.2 Problematiche di sicurezza
Sebbene la problematica maggiore del processo di produzione dell’acido adipico si riscontri nel forte impatto ambientale appena descritto, esistono anche rischi di sicurezza di tipo processuale legati al primo stadio di sintesi. Il processo, infatti, può essere pericoloso sia a causa della possibilità di formazione di miscele gassose infiammabili, sia per la formazione di perossidi organici che rendono difficile la gestione della reazione. Infine è necessario notare che le conversioni molto basse di cicloesano sono causa di costi di purificazione e riciclo molto elevati.
2.5 Processi alternativi descritti in letteratura
Nonostante il notevole sviluppo delle tecniche di abbattimento degli agenti inquinanti, sviluppatesi a causa dell’industria dell’acido adipico, la continua emanazione di norme più restrittive costringe a non sottovalutare la problematica ambientale legata alla produzione di acido adipico. Negli ultimi anni i tentativi di proporre i metodi sostitutivi del processo classico sono stati numerosi anche se non sempre i risultati ottenuti sono stati soddisfacenti: il più delle volte a causa delle rese ottenute estremamente basse o della formazione di miscele di prodotti troppo complesse per poter isolare con alte rese il prodotto desiderato. Per queste ragioni lo studio in questo campo di applicazione della chimica è fervido e molti sono i gruppi di ricerca che tentano di mettere a punto sistemi innovativi e potenzialmente applicabili a
livello industriale. La letteratura scientifica è ricca di brevetti ed articoli accademici che riguardano processi alternativi per la produzione dell’acido adipico a basso impatto ambientale, tutti uniti dall’obiettivo comune di utilizzare agenti ossidanti diversi dall’acido nitrico. Ad oggi, i processi più studiati sono:
1) l’ossidazione diretta di cicloesano ad acido adipico con aria 2) l’ossidazione del cicloesanone con ossigeno molecolare 3) l’ossidazione del cicloesanone con perossido di idrogeno 4) l’ossidazione del cicloesene con aria
5) l’ossidazione del cicloesene con perossido di idrogeno 6) l’ossidazione dell’n-esano con aria
7) l’ossidazione del cicloesandiolo con ossigeno molecolare.
8) la sintesi a due stadi di acido adipico a partire da cicloesene, via 1,2-cicloesandiolo.
2.5.1 Ossidazione diretta del cicloesano con aria
Uno degli intenti principali di chi fa ricerca sulla sintesi dell’acido adipico è di trasformare il processo tradizionale a doppio stadio in uno a singolo stadio; in questo modo una resa inferiore in acido adipico potrebbe essere compensata dai minori costi necessari per la manutenzione dell’impianto ed inoltre sarebbe superata anche la problematica ambientale, poiché, in alternativa all’acido nitrico, viene usata aria come agente ossidante. In particolare, gli sforzi della ricerca, nell’ambito della reazione di ossidazione diretta di cicloesano con aria, sono concentrati sullo studio di sistemi catalitici ad alta selettività che permettano una buona conversione per passaggio del substrato di partenza.
In passato, la Asahi Chemical Industry ha svolto un’ampia attività di ricerca su questo potenziale processo; la sintesi, che veniva condotta in acido acetico in presenza di acetati di Co3+ come catalizzatori, permetteva di ottenere una conversione per passaggio del 50-60 % ed una selettività ad acido adipico tra il 70 e il 75 %, che recentemente è stata migliorata ed ha raggiunto valori dell’88 %[17]. Nonostante questi risultati fossero incoraggianti, i vantaggi ottenuti dalla sostituzione dell’acido nitrico con aria e dall’eliminazione di uno stadio di reazione non sono stati sufficienti a compensare i costi elevati derivanti dall’utilizzo
dell’acido acetico come solvente: è necessario, infatti, un work-up molto complesso per separare e purificare il prodotto ed inoltre tale solvente non è così eco-compatibile e necessita l’utilizzo di apparecchiature in acciai speciali a causa della sua corrosività.
2.5.2 Ossidazione di cicloesanone con O
2Anche per questo processo il punto focale su cui si concentrano gli studi è la ricerca di catalizzatori opportuni: in questo caso devono essere sistemi in grado di agire come catalizzatori di ossido-riduzione in presenza di ossigeno molecolare, ai quali devono essere associate, inoltre, un’alta selettività e la facilità di recupero e riattivazione, oltre ovviamente ai requisiti fondamentali che ogni catalizzatore deve avere (basso costo, facilità di sintesi, reperibilità commerciale, non tossicità e basso impatto ambientale). Sistemi catalitici che soddisfino il più possibile tutti questi requisiti sono stati individuati negli eteropoliacidi, la cui attività è però fortemente dipendente dal solvente: per questo i migliori risultati sono stati ottenuti utilizzando acido acetico, al quale sono connesse tutte le problematiche descritte nel paragrafo precedente. I risultati migliori sono stati ottenuti conducendo la reazione per 7 ore a 70°C, a pressione atmosferica con eteropoliacidi, ottenendo così rese in acido adipico maggiori del 50 % con una conversione molare di cicloesanone del 99 %, mentre i maggiori sottoprodotti sono risultati essere l’acido glutarico, con selettività del 19 %, e l’acido succinico, con selettività pari circa al 3 %[18].
L’ossidazione del cicloesanone con O2, in fase liquida, è stata studiata anche da Shimizu che
in un primo tempo ha investigato la reazione con catalizzatori a base di acetato di manganese, poi ha ottimizzato il sistema catalitico combinandolo con acetato di cobalto; ottenendo in tal modo selettività ad acido adipico intorno al 77 %, con conversione del substrato del 100 %, conducendo la sintesi in una miscela di acqua e acido acetico, per 5 ore a 70°C e pressione atmosferica di ossigeno[19].
2.5.3 Ossidazione del cicloesanone con H
2O
2Utilizzare il perossido di idrogeno per ossidare il cicloesanone ad acido adipico renderebbe il processo industriale molto pulito, sia perché tale agente ossidante è molto eco-compatibile, sia perché permette l’adozione di condizioni operative blande, tuttavia il processo è penalizzato dagli eccessivi costi di realizzazione.
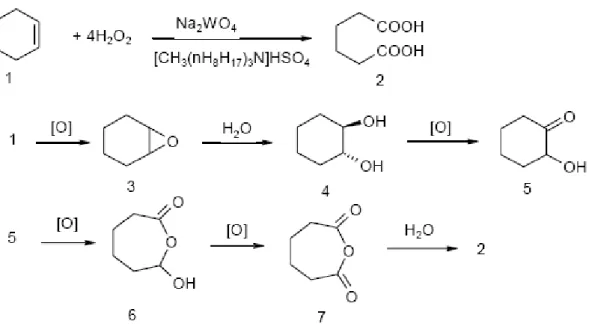
I catalizzatori più studiati, per questo tipo di processo, sono sistemi omogenei del tipo Na2WO4, i quali, utilizzati in presenza di leganti acidi e H2O2 al 30 %, permettono di ottenere
rese in acido adipico dell’82 %. La reazione avviene senza l’utilizzo di solventi organici e agenti trasferitori di fase ed il meccanismo proposto è riportato in figura 13[20].
Figura 13: meccanismo di ossidazione del cicloesanone.
2.5.4 Ossidazione del cicloesene con aria
Le potenzialità di questa reazione, per poterla usare a livello industriale, sono state investigate in presenza di catalizzatori a base di poliossometallati, pochè tali sistemi sono ritenuti i più opportuni per reazioni di ossidazione con ossigeno a basse conversioni.
La reazione viene condotta a una temperatura di 38°C, per 24 ore in presenza di poliossoanioni supportati su metalli come pre-catalizzatori. Nonostante il lungo tempo di reazione, relativamente ad un utilizzo industriale, le rese sono molto basse, inferiori al 25 %, le selettività nei vari prodotti sono molto basse e variano con il tipo di catalizzatore e di solvente impiegato[21].
2.5.5 Ossidazione del cicloesene con H
2O
2Un’altra valida alternativa al processo classico di produzione dell’acido adipico, che aggirerebbe anche la problematica ambientale, è la reazione di ossidazione del cicloesene con perossido di idrogeno. I catalizzatori messi a punto, da vari gruppi di ricerca, per questa reazione sono sia omogenei (acido tungstico), sia eterogenei a base di titanio incorporato in matrici porose.
La reazione, condotta in catalisi omogenea, non necessita dell’utilizzo di solventi organici né di trasferitori di fase: l’acido tungstico si trova disciolto in una soluzione di H2O2 al 30 %
insieme ad acidi organici, i quali, coordinandosi al tungsteno, formano un complesso organometallico che può trasferirsi nella fase organica del cicloesene. L’acido ossalico è il miglior acido organico per ottenere elevate conversioni del substrato di partenza (100 %), ed ottime rese in acido adipico (96,6 %), i sottoprodotti di questa reazione sono il cicloesandiolo, il cicloesanone, l’acido valerico e il ciclopentanone. La sintesi viene condotta, in un primo stadio, per 3-4 ore a 72°C, per permettere la formazione del complesso catalitico, successivamente la temperatura è portata a 94°C e la reazione, lasciata decorrere per ulteriori 20 ore, permette la completa ossidazione del substrato[22]. Questa sintesi è stata studiata anche in presenza di trasferitori di fase, PTC (phase-trnsfer catalyst), che generalmente sono molecole formate da lunghe catene alifatiche, compatibili con fasi organiche, legate ad un anione che permette l’interazione con i solventi polari; in questo caso le rese di acido adipico, a conversione totale di cicloesene, sono del 93 %, la reazione necessita di minor tempo per essere portata a completezza, 8 ore, e la temperatura è inferiore, 75-80°C. In figura 14 si riporta il meccanismo di reazione.
Figura 14: meccanismo di reazione di ossidazione di cicloesene con H2O2.
Come si evince dal meccanismo riportato, la sintesi procede passando per tre tipi di diverse ossidazioni:
2) l’ossidazione dell’alcool
3) l’ossidazione di tipo Bayer-Villiger
Una volta che l’acido adipico si è formato viene recuperato per cristallizzazione dalla soluzione acquosa[23].
In catalisi eterogenea, invece, la reazione viene condotta in presenza di titanio incorporato in matrici micro o mesoporose, con il vantaggio di avere un tempo di vita del catalizzatore più lungo rispetto a quello omogeneo; tale vantaggio è però controbilanciato da una resa minore in acido adipico (80 %), da un tempo di reazione più prolungato, che si aggira intorno alle 72 ore e dalla necessità di una temperatura di esercizio superiore, pari a 100°C[24].
2.5.6 Ossidazione di n-esano con aria
L’ossidazione dell’n-esano ad acido adipico è stata descritta recentemente da Thomas, la reazione è condotta con catalizzatori microporosi a base di MeAlPO (Me: CoII, FeII, MnII), le conversioni ottenute sono molto basse, circa del 10 % di substrato, ma la selettività è molto elevata[25]. Giocando sulle dimensioni dei pori del catalizzatore, quindi sulla diffusione molecolare, si ottengono selettività ad acido adipico diverse: infatti, solo i prodotti di reazione con le giuste dimensioni possono diffondere all’esterno della matrice del catalizzatore, mentre quelli con dimensioni maggiori rimangono intrappolati all’interno e la loro diffusione è ritardata.
I limiti di tale processo sono al momento rappresentati dalla la rapida disattivazione del catalizzatore, dalle basse rese ed anche, ovviamente, dall’elevata tossicità del prodotto di partenza.
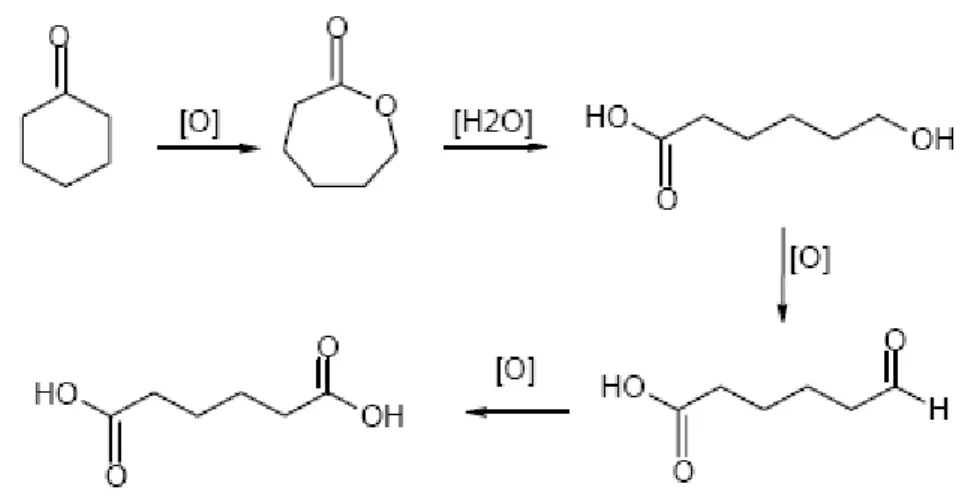
2.5.7 Ossidazione dell’1,2-cicloesandiolo con O
2L’ossidazione dell’1,2-cicloesandiolo è stata sviluppata sia in catalisi omogenea che eterogenea. Essendo una reazione che ha come agente ossidante l’ossigeno molecolare, i migliori sistemi omogenei individuati sono, ancora una volta, gli eteropoliacidi: la reazione è condotta in etanolo a 75°C per 24 ore e passa per l’intermedio etiladipato con una selettività del 90 %, ad una conversione del 62 %[26].
Per la catalisi eterogenea sono invece utilizzati le titanio-silicaliti, che generalmente sono molto usati nelle reazioni con perossido di idrogeno per la loro elevata attività e selettività. In questo caso le rese di acido adipico ottenute sono pari al 39 % ad una conversione di
cicloesandiolo del 50 %, la selettività ad acido adipico è del 78 % e i principali sottoprodotti sono l’acido glutarico e il succinico[27].
2.5.8 Sintesi a 2 stadi di acido adipico da cicloesene, via 1,2-cicloesandiolo
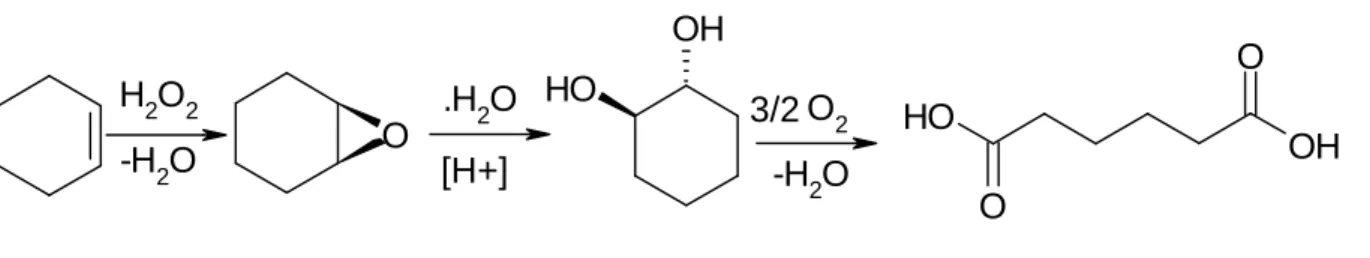
Il gruppo di ricerca dell’Università di Bologna, del Professor Cavani, da alcuni anni si interessa di trovare vie alternative eco-compatibili per la produzione di acido adipico ed i loro studi sono concentrati su una sintesi a due stadi:
• il primo stadio consiste nella sintesi dell’1,2-cicloesandiolo a partire da cicloesene ossidandolo con acqua ossigenata, in presenza di H2WO4 come catalizzatore: tale
processo è oggetto di un brevetto[27]
• il secondo stadio consiste invece nell’ossidazione del 1,2-cicloesandiolo con ossigeno molecolare, in presenza di catalizzatori eterogenei di Ru supportati su allumina, vantaggiosi sia dal punto di vista economico sia da quello pratico del recupero e della purificazione del prodotto. Elemento questo di estrema importanza se paragonato al processo con eteropolicomposti dove la catalisi omogenea implica un work-up molto complesso.
In figura 15 viene mostrato il meccanismo della reazione:
O H OH O2 HO O OH O O -H2O H2O2 -H2O .H2O [H+] 3/2
Figura 15: meccanismo di reazione per la sintesi di acido adipico a 2 stadi a partire da cicloesene.
In scala di laboratorio, la reazione di ossidazione è condotta in un reattore continuo per 3 ore a 90°C, con una pressione di ossigeno pari a 3 bar, lavorando in acqua a pH≈13, per aggiunta di NaOH. Sebbene la reazione sia in fase di studio, i risultati sono incoraggianti, le conversioni ottenute sono del 16 % e le selettività maggiori del 50 %, i sottoprodotti sono l’acido glutarico e il succinico. Modificando i sistemi catalitici con bismuto, le selettività sono state migliorate fino a raggiungere il 70 %.
Il mio lavoro di tesi si inserisce in questo studio proponendo, in alternativa al primo stadio, la sintesi dell’ 1,2-cicloesandiolo attraverso l’idrogenazione del catecolo (1,2-diidrossibenzene), utilizzando acqua come solvente e condizioni di esercizio il meno drastiche possibili.
I potenziali vantaggi derivanti da questo tipo di reazione sono molteplici:
• la sostituzione del cicloesene, che deriva da benzene, con un substrato estraibile da biomasse, come viene spiegato nel prossimo capitolo
• l’utilizzo di H2, al posto del perossido di idrogeno, un reagente meno costoso e con
minori costi di gestione dal punto di vista della sicurezza, soprattutto se si opera in condizioni di reazione relativamente blande
• la possibilità di usare lo stesso tipo di catalizzatore, sia nel primo che nel secondo stadio, al fine di poter arrivare verso un processo di tipo “one-pot”, diminuendo significativamente i costi di realizzazione e gestione di impianto.
Bibliografia
[1] ULLMANN’S Encyclopedia of Industrial Chemistry, Wiley VCH 2nd Edition (2002). [2] Castellan A., Bart J.C.J e S. Cavallaro, Catal. Today, 9 (1991) 237.
[3] http:// www.chemplan.com/chemplan_demo/sample_reports/Adipic_Acids.pdf. [4] Cavani F. et al, Sustainable Industrial Processes, Wiley VCH 1st edition (2009.) [5] Shuchardt U., Cardoso D., Appl. Catal. A, 211 (2000) 1.
[6] Parmon V.N., Panov G.I., Uriarte A. et al, Catal. Today, 100 (1,2) (2005) 115. [7] Castellan A., Bart J.C.J. et al, Catal Today 9 (1991) 255.
[8] Van Asselt W. J., Van Krebelen D.W., Chem. Eng. Science, 18 (1963) 429. [9] Van Asselt W. J., Van Krebelen D.W., Chem. Eng. Science, 18 (1963) 471. [10] Thiemens M.H., Trogler W.C., Science, 251 (1991) 93.
[11] IPPC, Good Practice Guidance and Uncertaunity Managementin National Green House, Gas Inventories.
[12] IPPC Fourth Assessment Report: Climate chnge 2007, 7th chapter. [13] Kapteijin F., Rodriguez-Mirasol J. et al, Appl. Catalysis B, 9 (1996) 25.
[14] Shimizu A., Tanaka K. et al, Chemosphere-Global Change Science, 2 (2000) 425. [15] Mc Ghee W.D., U.S. Patent 5,808,167 (1998) (assegnato a Solutia).
[16] Tell J., Röβler B. et al, WO Patent Appl 2005/030689 (assegnato a BASF). [17] Shimizu A. et al, Bull. Chem. Soc. Jpn, 76 (2003) 10.
[18] Bregeault J. M., Atlamsami, J. Org. Chem., 58 (1993) 5663. [19] Shimizu A. et al, Bull. Chem. Soc. Jpn, 76 (2003) 651.
[20] Zhang S., Jiang H., Gong H. and Sun Z., Petroleum Sci. and Tech., 21 (2003) 275. [21] Weiner H., Trovatelli A., Finke R.G., J. Mol. Catal. A: chem, 191 (2003) 217.
[22] Deng Y. et al, Green Chem ,1 (1999) 275. [23] Noyori R. et al, Science, 281 (1998) 1977.
[24] Lapisardi G. et al, Microporous Mesoporous Materials, 78 (2005) 289.
[25] Thomas J.M., Raja R., Sankar G. and Bell R., Acc. Chem. Res., 34 (2001) 191.
[26] Loloudi M., Michailidis A., Laussac J.P., Bau R. and Hadjiliadis, C.R. Acad. Sci. Paris, 309b (1989) 463.
[27] Alini S., Accoranti P., Babini P., Cavani F., Raabova K., It. Pat. Appl. MI2009A001842 (2009), assegnato a Radici Chimica.